Слайд 2
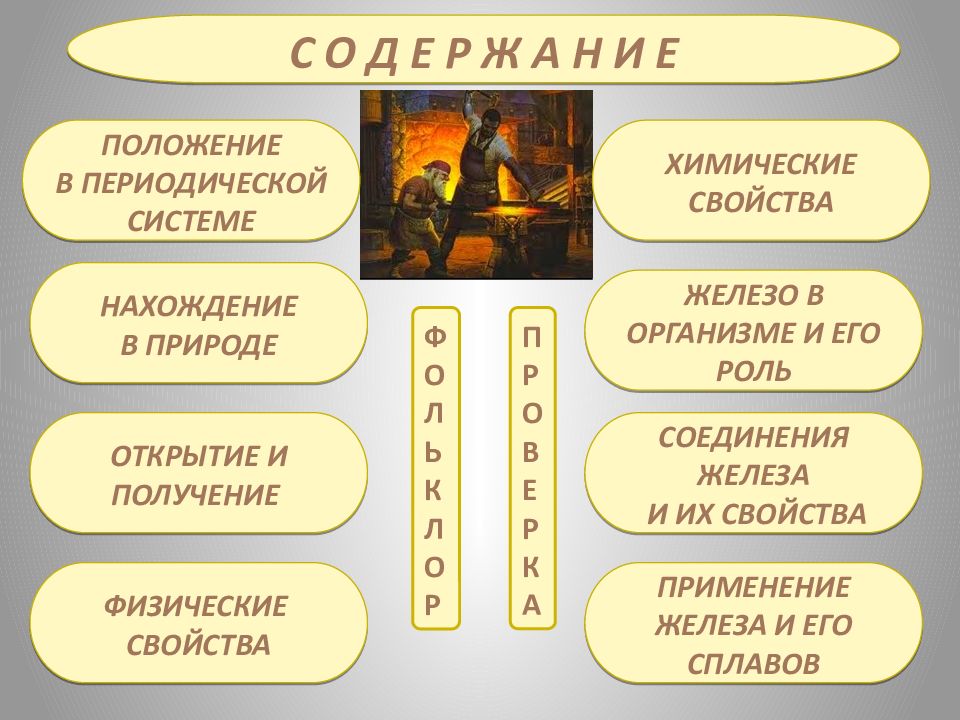
С О Д Е Р Ж А Н И Е Положение В периодической системе НАХОЖДЕНИЕ В ПРИРОДЕ ОТКРЫТИЕ И ПОЛУЧЕНИЕ ХИМИЧЕСКИЕ СВОЙСТВА ЖЕЛЕЗО В ОРГАНИЗМЕ И ЕГО РОЛЬ СОЕДИНЕНИЯ ЖЕЛЕЗА И ИХ СВОЙСТВА ПРИМЕНЕНИЕ ЖЕЛЕЗА И ЕГО СПЛАВОВ ФИЗИЧЕСКИЕ СВОЙСТВА П Р О В Е Р К А ф о л ь к л о р
Слайд 3
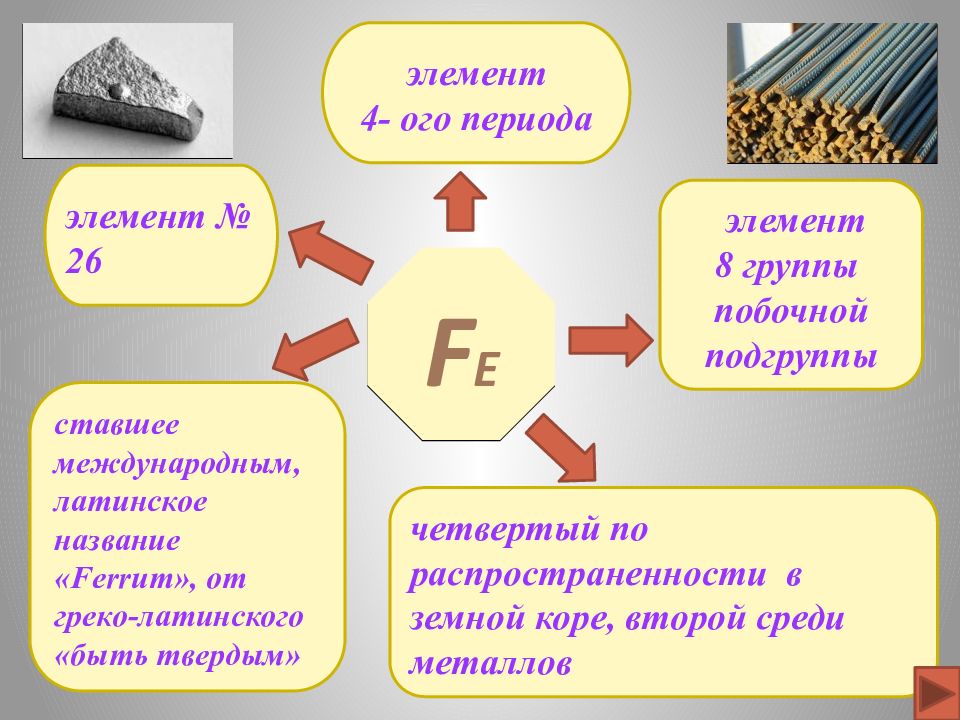
F е элемент № 26 элемент 4- ого периода четвертый по распространенности в земной коре, второй среди металлов элемент 8 группы побочной подгруппы ставшее международным, латинское название « Ferrum », от греко-латинского «быть твердым»
Слайд 4
Электронное строение атома железа Fe + 26 2е 8е 14е 2е 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 возможные степени окисления +2 и +3
Слайд 5
Нахождение в природе В земной коре на долю железа приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. Оно бывает в виде различных соединений: оксидов, гидроксидов и солей. В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Слайд 6
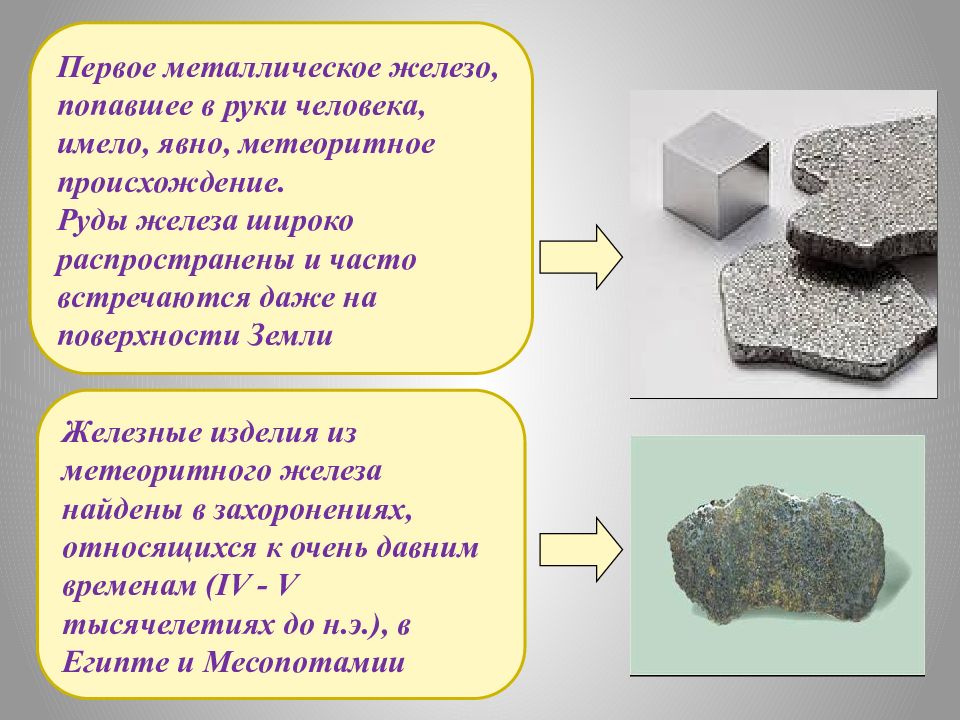
Первое металлическое железо, попавшее в руки человека, имело, явно, метеоритное происхождение. Руды железа широко распространены и часто встречаются даже на поверхности Земли Железные изделия из метеоритного железа найдены в захоронениях, относящихся к очень давним временам (IV - V тысячелетиях до н.э.), в Египте и Месопотамии
Слайд 7
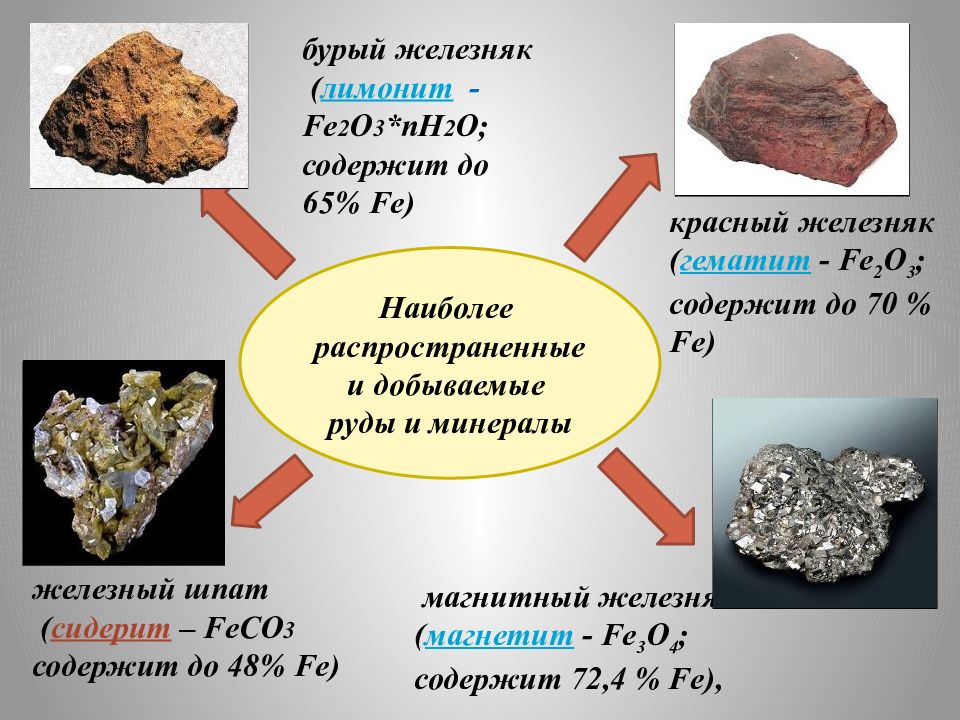
Наиболее распространенные и добываемые руды и минералы магнитный железняк ( магнетит - Fe 3 O 4 ; содержит 72,4 % Fe), бурый железняк ( лимонит - Fe 2 О 3 *пН 2 О; содержит до 65% Fe ) красный железняк ( гематит - Fe 2 O 3 ; содержит до 70 % Fe) железный шпат ( сидерит – FeCO 3 содержит до 48 % Fe )
Слайд 8
Люди впервые овладели железом в 4-3 тысячелетиях до н. э., подбирая упавшие с неба камни — железные метеориты, и превращая их в украшения, орудия труда и охоты. Их и сейчас находят у жителей Северной и Южной Америки, Гренландии и Ближнего Востока, а также при археологических раскопках на всех континентах. Самый древний способ получения железа основывается на его восстановлении из оксидных руд. В 19 веке были разработаны современные способы: мартеновские печи, электросталеплавильные процессы и другие методы… История получения железа
Слайд 9
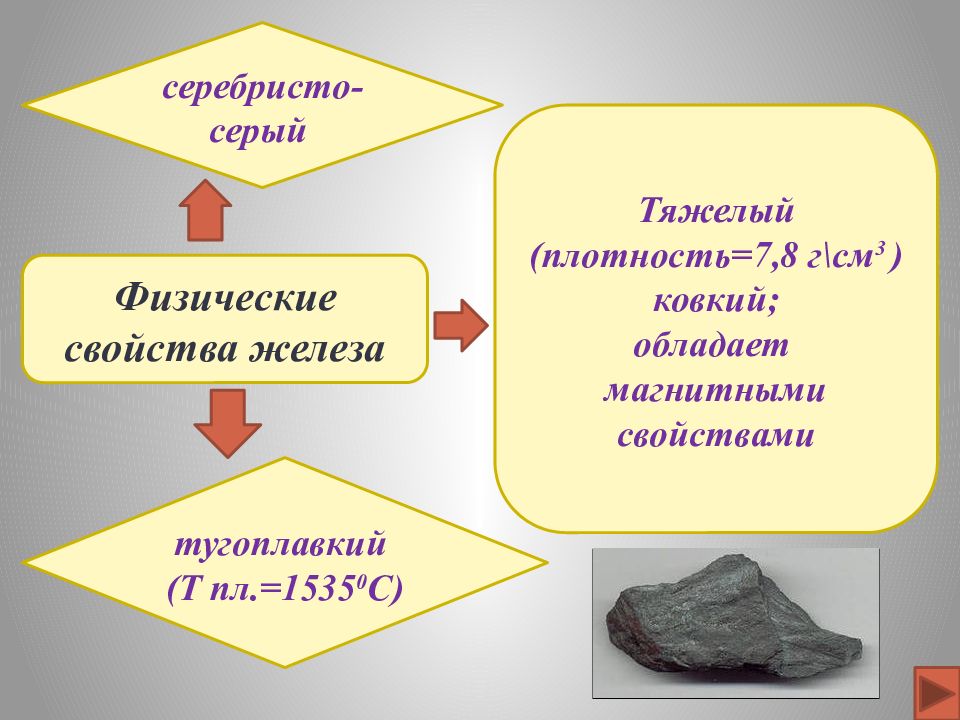
Физические свойства железа серебристо-серый тугоплавкий (Т пл.=1535 0 C ) Тяжелый (плотность=7,8 г\см 3 ) ковкий; обладает магнитными свойствами
Слайд 10
Химические свойства Реакции с простыми веществами Железо сгорает в чистом кислороде при нагревании:4 Fe +3O 2 =2Fe 2 O 3 Реагирует с порошком серы при нагревании: Fe +S = FeS Реагирует с галогенами при нагревании:2 Fe + 3CL 2 =2FeCL 3
Слайд 11
Химические свойства Реакции со сложными веществами С кислотами: А) с соляной кислотой 2 HCL + Fe = FeCL 2 + H 2 Б) с серной кислотой H 2 SO 4 + Fe = FeSO 4 + H 2 С солями: Fe + CuSO 4 = Cu + FeSO 4 С водой ( при высокой температуре): 3 Fe + 4H 2 O=Fe 3 O 4 +4H 2 (железная окалина)
Слайд 12
Железо разрушается под действием окружающей среды, т.е. подвергается коррозии – «ржавлению». При этом на поверхности образуется «ржавчина». 4Fe + 2 Н 2 О + ЗО 2 = 2( Fe 2 O 3 • Н 2 О)
Слайд 14
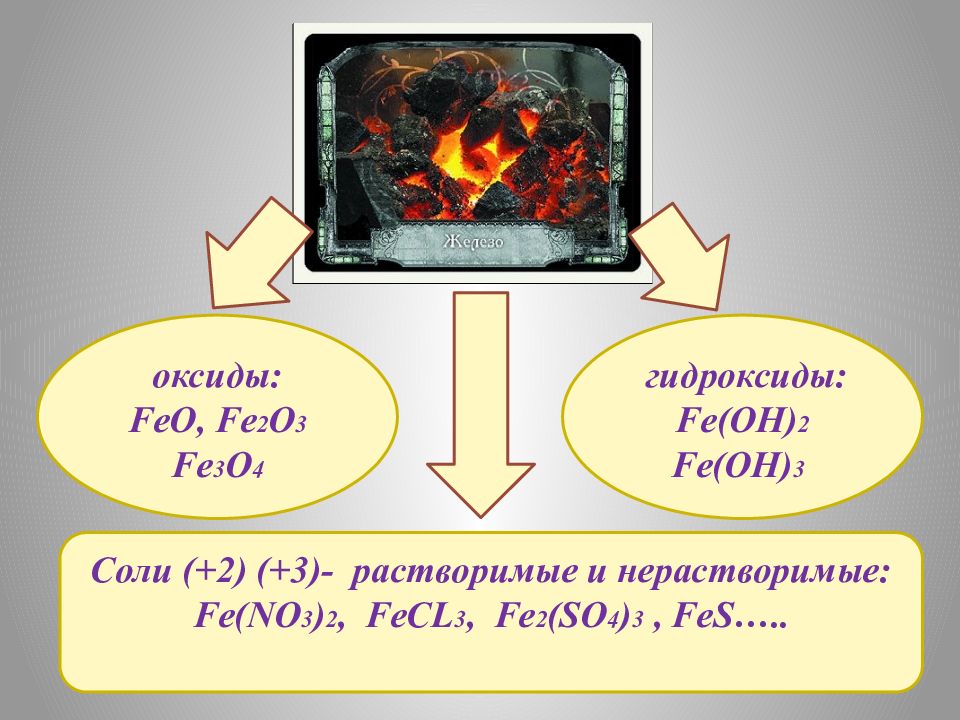
Соли (+2) (+3) - растворимые и нерастворимые: Fe(NO 3 ) 2, FeCL 3, Fe 2 (SO 4 ) 3, FeS ….. оксиды: FeO, Fe 2 O 3 Fe 3 O 4 гидроксиды : Fe(OH) 2 Fe(OH) 3
Слайд 15
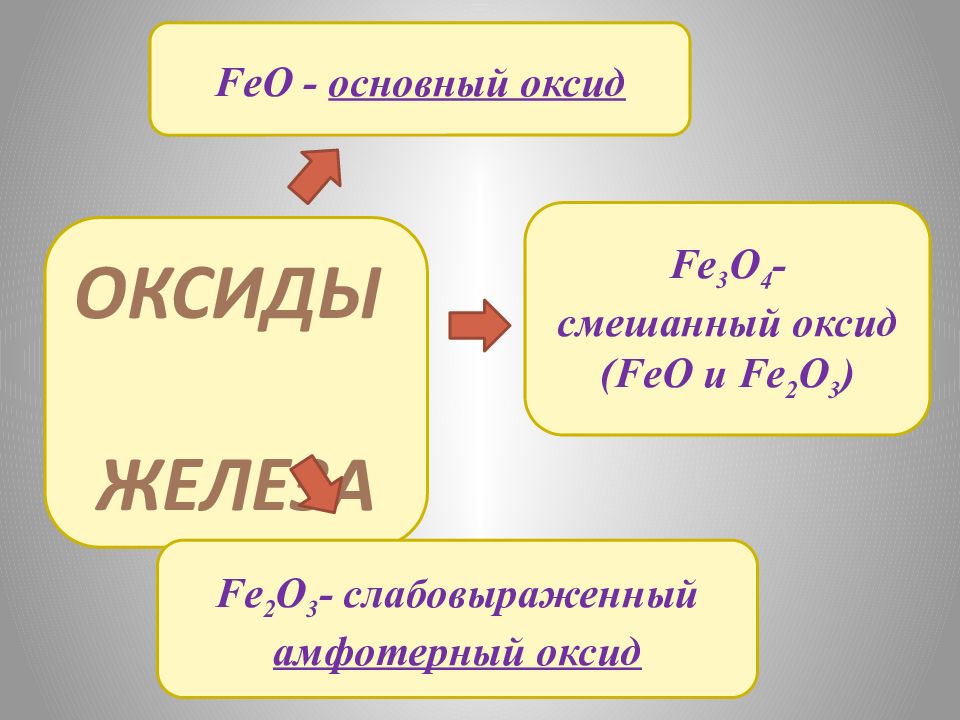
ОКСИДЫ ЖЕЛЕЗА FeO - основный оксид Fe 2 O 3 - слабовыраженный амфотерный оксид Fe 3 O 4 - смешанный оксид ( FeO и Fe 2 O 3 )
Слайд 16
Химические свойства FeO с кислотами: FeO + 2HCL=FeCL 2 + H 2 O 2) с более активными металлами: 3FeO + 2Al = 3Fe + Al 2 O 3 Химические свойства Fe 2 O 3 1) с кислотами: Fe 2 O 3 + 3H 2 SO 4 =Fe 2 (SO 4 ) 3 + 3H 2 O 2) с более активными металлами Fe 2 O 3 + 3Mg=3MgO +2Fe Химические свойства Fe 3 O 4 1) с кислотами Fe 3 O 4 + 8HCL=FeCL 2 +2FeCL 3 + 4H 2 O 2) также с более активными металлами Fe 3 O 4 +4 Zn=4 ZnO +3Fe
Слайд 17
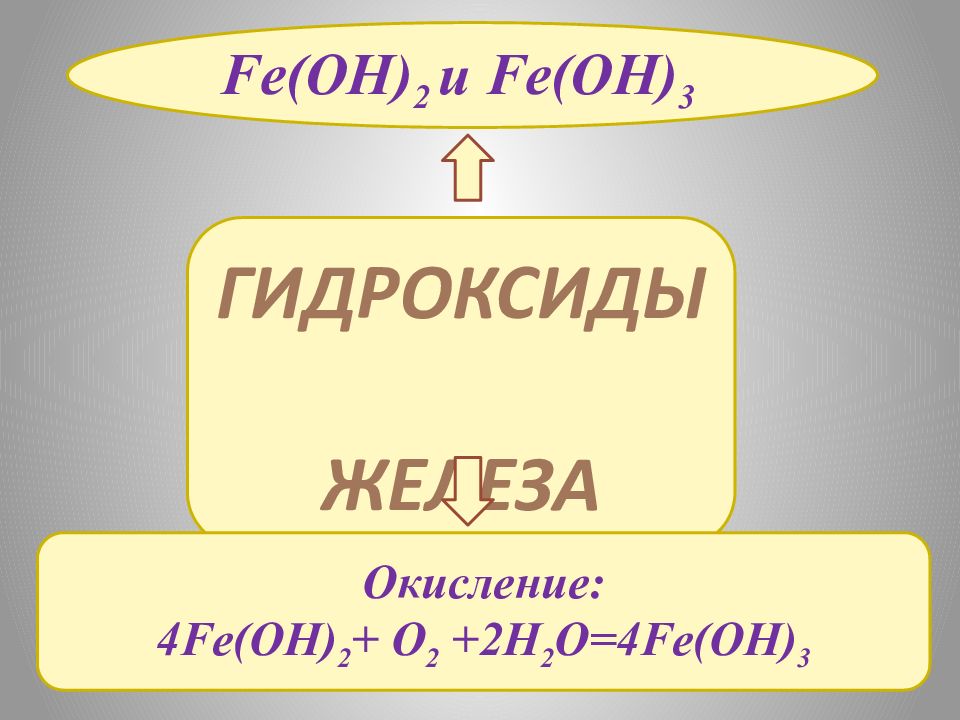
ГИДРОКСИДЫ ЖЕЛЕЗА Fe(OH) 2 и Fe(OH) 3 Окисление: 4Fe(OH) 2 + O 2 +2H 2 O=4Fe(OH) 3
Слайд 18
Fe(OH) 2 и Fe(OH) 3 Fe(OH) 3 реагирует с конц. щелочами Fe(OH) 3 + 3NaOH=Na 3 (Fe(OH) 6 ) 1) Реагируют с кислотами: Fe(OH) 2 + 2HNO 3 = Fe(NO 3 ) 2 + 2H 2 O Fe(OH) 3 + 3HCL=FeCl 3 +3H 2 O 2) Разлагаются при нагревании: 2Fe(OH) 3 = Fe 2 O 3 +3H 2 O Fe(OH) 2 = FeO + H 2 O
Слайд 19
Соли железа Реагируют с щелочами: FeCL 2 + 2NaOH= Fe(OH) 2 + 2 NaCL Реагируют с более активными металлами: FeCL 2 + Mg= MgCL 2 + Fe Реагируют с другими солями: Fe 2 (SO 4 ) 3 + 3BaCL 2 =3BaSO 4 + 2FeCL 3 Реагируют с кислотами: FeS + 2HCl=FeCL 2 + H 2 S
Слайд 20
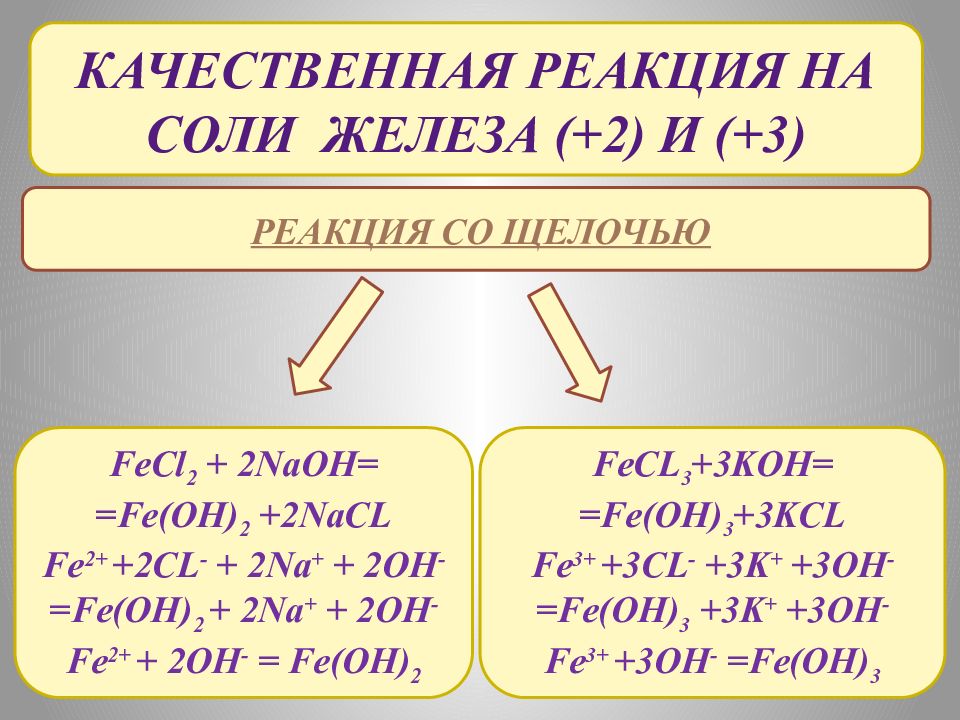
КАЧЕСТВЕННАЯ РЕАКЦИЯ НА Соли железа (+2) и (+3) Реакция со щелочью FeCl 2 + 2NaOH= = Fe(OH) 2 +2NaCL Fe 2+ +2CL - + 2Na + + 2OH - =Fe(OH) 2 + 2Na + + 2OH - Fe 2+ + 2OH - = Fe(OH) 2 FeCL 3 +3KOH= = Fe(OH) 3 +3KCL Fe 3+ +3CL - +3K + +3OH - =Fe(OH) 3 +3K + +3OH - Fe 3+ +3OH - =Fe(OH) 3
Слайд 21
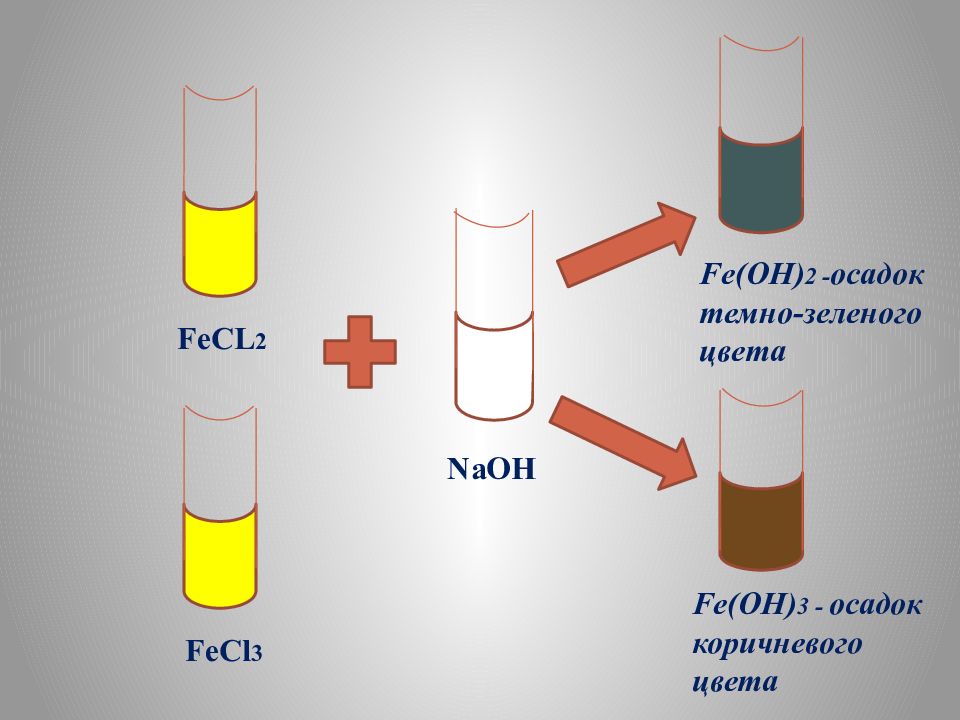
FeCL 2 FeCl 3 NaOH Fe(OH) 2 - осадок темно-зеленого цвета Fe(OH) 3 - осадок коричневого цвета
Слайд 22
Железо в организме Железо в виде ионов присутствует в организмах всех растений и животных и, конечно же, человека, но в растениях и животных в малых количествах (в среднем 0,02%). Основная биологическая функция железа – участие в транспорте кислорода ко всем органам и окислительных процессах. В организме человека с массой тела прниблизительно70 кг содержится 4,2 г железа, а в 1 л крови – 450 мг. При недостатке железа в организме развивается железистая анемия. Перенос железа в организме осуществляет важнейший белок –гемоглобин, в котором находится больше половины всего железа организма.
Слайд 23
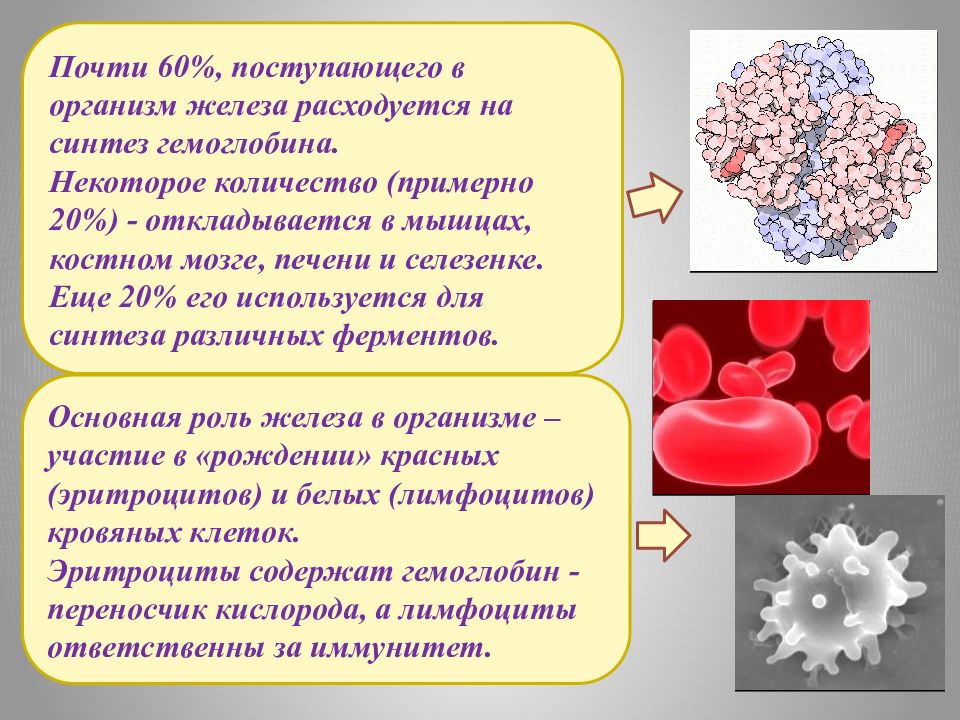
Основная роль железа в организме – участие в «рождении» красных (эритроцитов) и белых (лимфоцитов) кровяных клеток. Эритроциты содержат гемоглобин - переносчик кислорода, а лимфоциты ответственны за иммунитет. Почти 60%, поступающего в организм железа расходуется на синтез гемоглобина. Некоторое количество (примерно 20%) - откладывается в мышцах, костном мозге, печени и селезенке. Еще 20% его используется для синтеза различных ферментов.
Слайд 24
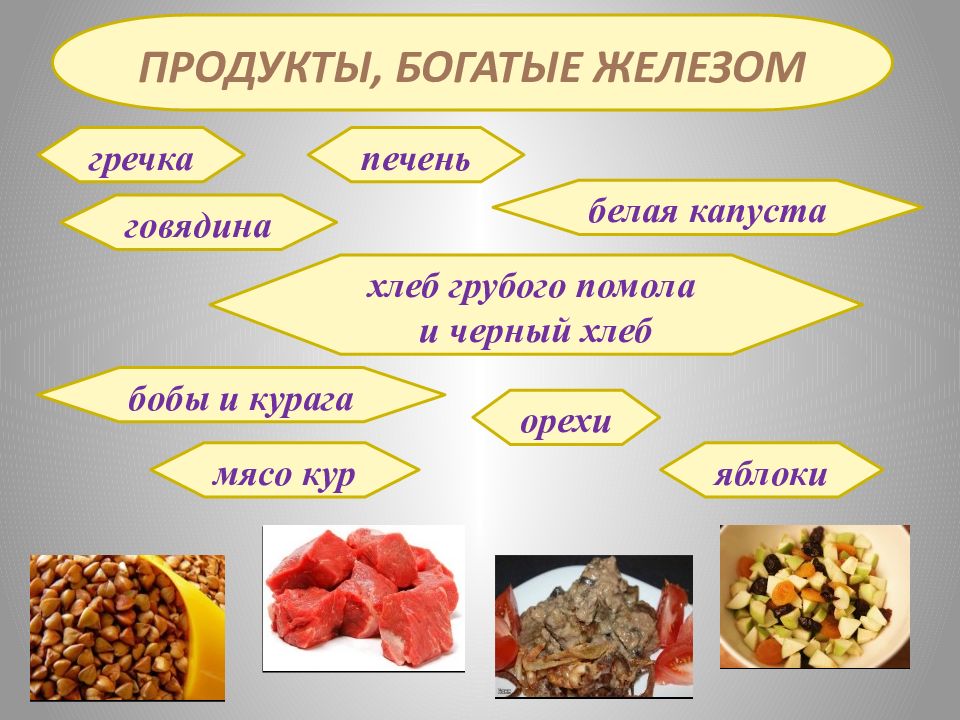
гречка говядина печень белая капуста хлеб грубого помола и черный хлеб бобы и курага орехи мясо кур яблоки Продукты, богатые Железом
Слайд 25
При анемии, для приготовления пищи, рекомендуется использовать чугунную посуду. Как показали эксперименты, приготовление и кипячение соуса на протяжении 20 минут в такой посуде, способствует увеличению количества железа в 9 раз. Людям с пониженным гемоглобином необходимо чаще бывать на свежем воздухе. Будьте внимательны к своему здоровью: наличие достаточного количества гемоглобина – это наша жизнь!!! При анемии (недостатке гемоглобина) увеличьте в своем рационе количество нежирного говяжьего мяса и печени, красной икры, а также яичных желтков. Э Т О В А Ж Н О И П О Л Е З Н О З Н А Т Ь!!!
Слайд 27
Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении сердечников электромагнитов, как катализатор химических процессов, для некоторых других целей. Находят широкое применение и многие соединения железа. Так, сульфат железа (III) используют при водоподготовке, оксиды и цианид железа служат пигментами при изготовлении красителей и так далее. Но сплавы железа — чугун и сталь — составляют основу современной техники
Слайд 28
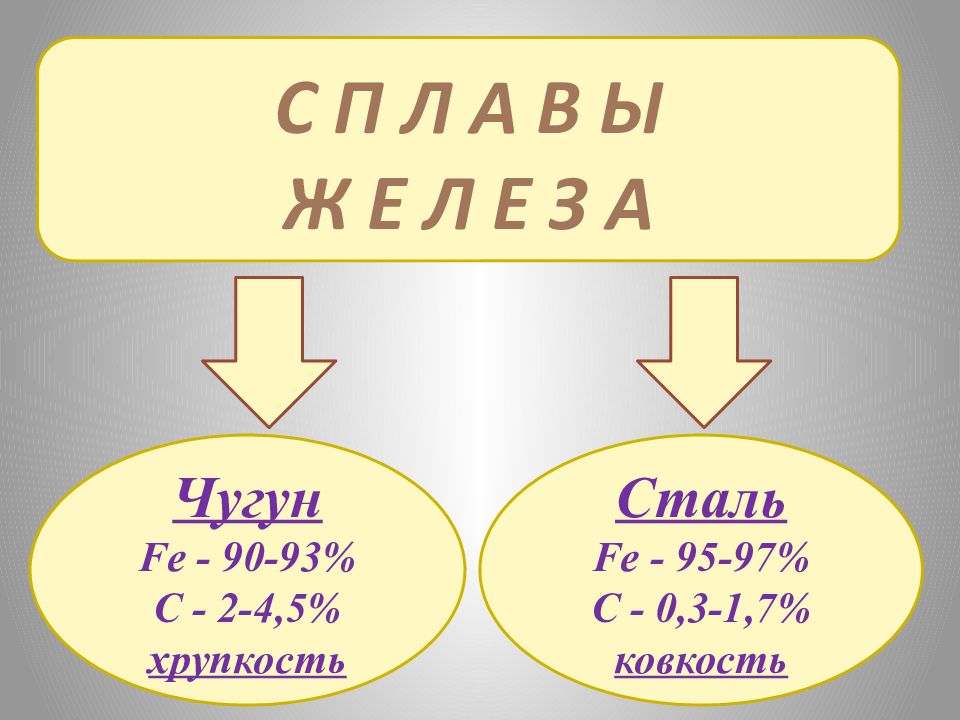
С П Л А В Ы Ж Е Л Е З А Чугун Fe - 90-93% C - 2-4,5% хрупкость Сталь Fe - 95-97% C - 0,3-1,7% ковкость
Слайд 29
Железо сегодня Гидроэлектро- станции и опоры линий электропередач Трубопроводы для воды, нефти и газа Автомобили, Тракторы, Подводные лодки, Бытовые приборы, Другие предметы
Слайд 31
«Ржавое железо не блестит» (никчемность и бездеятельность человека портит!!!) Очень часто употребляемая пословица: «Куй железо, пока горячо» (делай все вовремя!!!, не пропусти момент!!!) «Без разума сила все равно, что железо гнило» (главное в человеке - разумные и осмысленные поступки!!!) В народном фольклоре метких изречений о важности и значении железа в человеческом обиходе встречается много
Слайд 32
Есть у железа страшный враг – «ржавчина». К чему она приводит, как с ней бороться и как важно не попасть в ее «сети» - и об этом говорит народная мудрость: «Человека губит горе, железо портит влага» (турецкая) «Сердца ржавеют, как ржавеет железо» (арабская) «Ржавчина не железе, а неправда в человеке не утаится» «Хорошее железо не ржавеет» (русские)
Слайд 35
1. Белок крови, переНосящий по организму кислород 2. Тип реакции, в которую вступают гидроксиды железа при нагревании 3. Минерал – Красный железняк 5. Особое свойство железа, отличающее его от многих других металлов 4. Латинское название железа 6. Ковкий сплав железа
Слайд 36
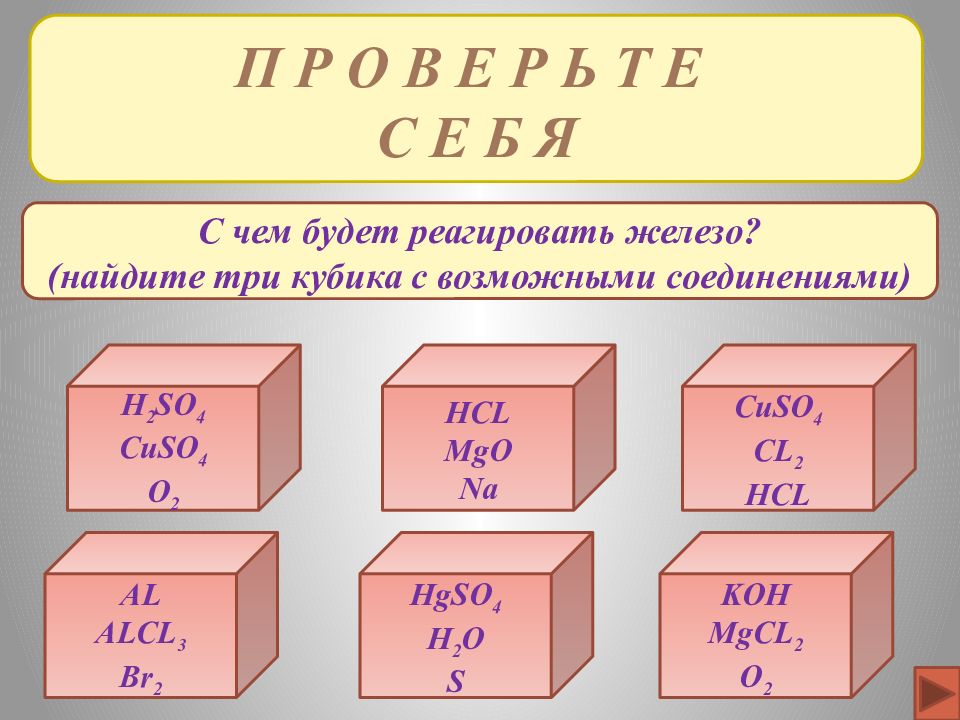
П Р О В Е Р Ь Т Е С Е Б Я H 2 SO 4 CuSO 4 O 2 HCL MgO Na KOH MgCL 2 O 2 AL ALCL 3 Br 2 HgSO 4 H 2 O S CuSO 4 CL 2 HCL С чем будет реагировать железо? (найдите три кубика с возможными соединениями)
Слайд 37
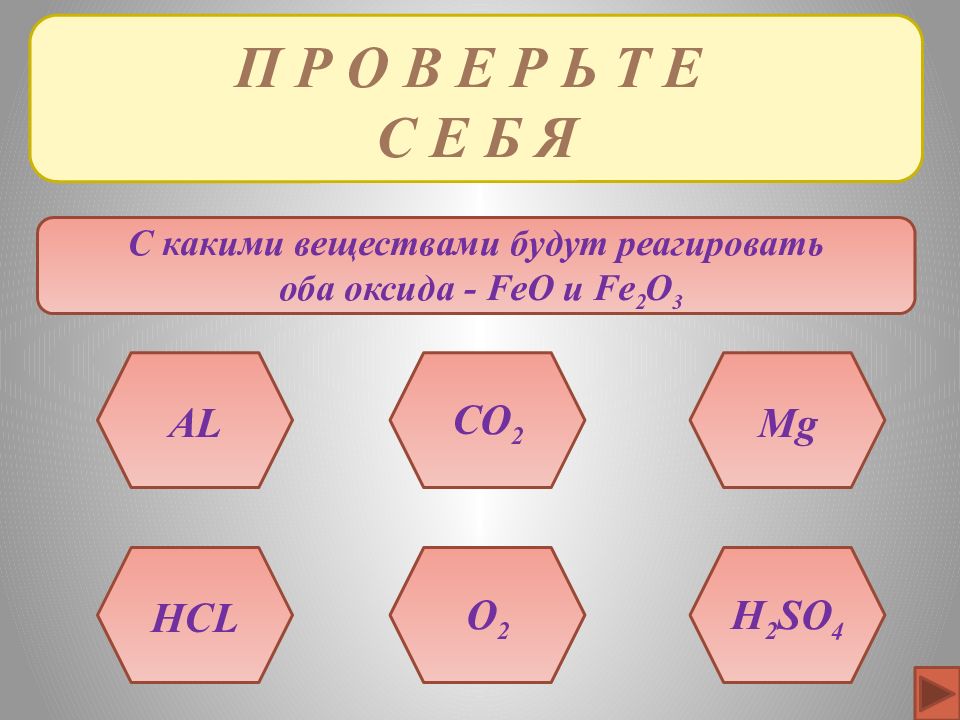
П Р О В Е Р Ь Т Е С Е Б Я С какими веществами будут реагировать оба оксида - FeO и Fe 2 O 3 H 2 SO 4 HCL O 2 AL Mg CO 2
Слайд 38
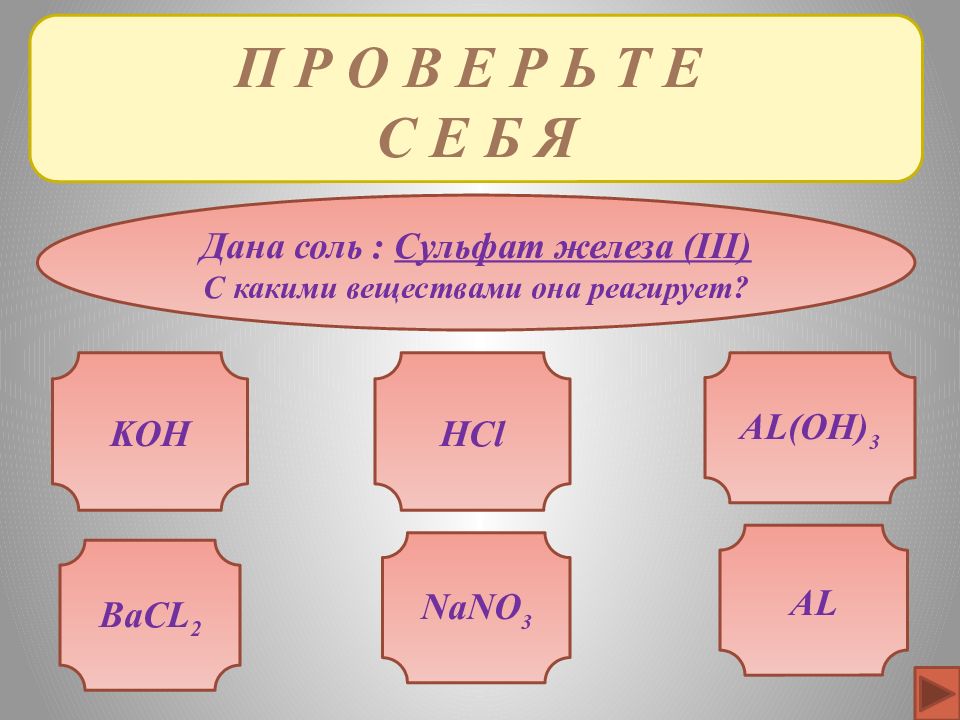
П Р О В Е Р Ь Т Е С Е Б Я Дана соль : Сульфат железа ( III) С какими веществами она реагирует? KOH AL(OH) 3 BaCL 2 AL NaNO 3 HCl
Последний слайд презентации: ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЯ
Учебник для общеобразовательных учреждений, 9 класс, Г.Е. Рудзитис,Ф.Г. Фельдман ССЫЛКИ НА ИСТОЧНИКИ ИНФОРМАЦИИ И ИЗОБРАЖЕНИЙ: http://im0-tub-ru.yandex.net/i?id=151351830-48-72&n=21 http://im5-tub-ru.yandex.net/i?id=132804891-18-72&n=21 http://im0-tub-ru.yandex.net/i?id=389614815-46-72&n=21 http://im3-tub-ru.yandex.net/i?id=152691363-60-72&n=21 http://im5-tub-ru.yandex.net/i?id=375112224-26-72&n=21 http://im0-tub-ru.yandex.net/i?id=148759345-57-72&n=21 http://im3-tub-ru.yandex.net/i?id=97587139-26-72&n=21 http://im8-tub-ru.yandex.net/i?id=26227792-59-72&n=21 http://www.ukzdor.ru/ferrum.html http://im4-tub-ru.yandex.net/i?id=64602315-02-72&n=21 http://im8-tub-ru.yandex.net/i?id=72487700-14-72&n=21 http://img0.liveinternet.ru/images/attach/c/7/94/310/94310832_nygooset06.jpg http://termist.com/bibliot/popular/mezenin/mezenin_046.htm http://cdn.elec.ru/_fitbox/200x200/offers/orig/8796471298.jpg