Первый слайд презентации: ЗАНИМАТЕЛЬНАЯ ХИМИЯ
ТЕМА : МНОГООБРАЗИЕ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ. СОЛИ. Центр дополнительного образования «Дом научной коллаборации им. П.К. Анохина» при ФГБОУ ВО «ПИМУ» Минздрава России
Слайд 3
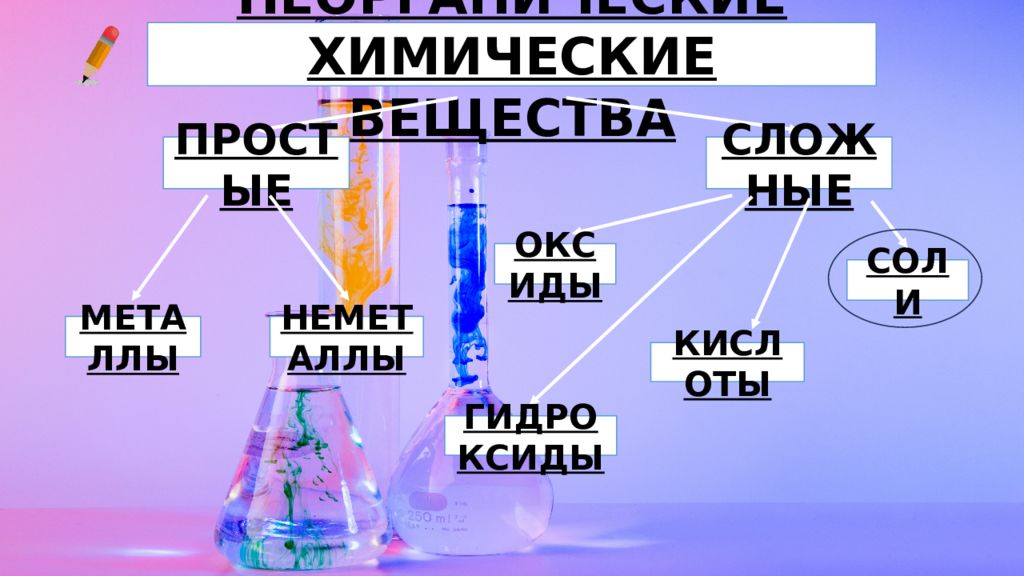
НЕОРГАНИЧЕСКИЕ ХИМИЧЕСКИЕ ВЕЩЕСТВА ПРОСТЫЕ МЕТАЛЛЫ СЛОЖНЫЕ НЕМЕТАЛЛЫ ОКСИДЫ ГИДРОКСИДЫ КИСЛОТЫ СОЛИ
Слайд 4: ХИМИЧЕСКИЕ ВЕЩЕСТВА: КИСЛОТЫ
КИСЛОТЫ – ЭТО СЛОЖНЫЕ ХИМИЧЕСКИЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ ОДНОГО ИЛИ НЕСКОЛЬКИХ АТОМОВ ВОДОРОДА, СПОСОБНЫХ ЗАМЕЩАТЬСЯ АТОМАМИ МЕТАЛЛА, И КИСЛОТНЫХ ОСТАТКОВ.
Слайд 5: ХИМИЧЕСКИЕ ВЕЩЕСТВА: СОЛИ
СОЛИ – ЭТО СЛОЖНЫЕ ХИМИЧЕСКИЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ КАТИОНА (МЕТАЛЛА) И АНИОНА (КИСЛОТНОГО ОСТАТКА). ХИМИЧЕСКИЕ ВЕЩЕСТВА: СОЛИ
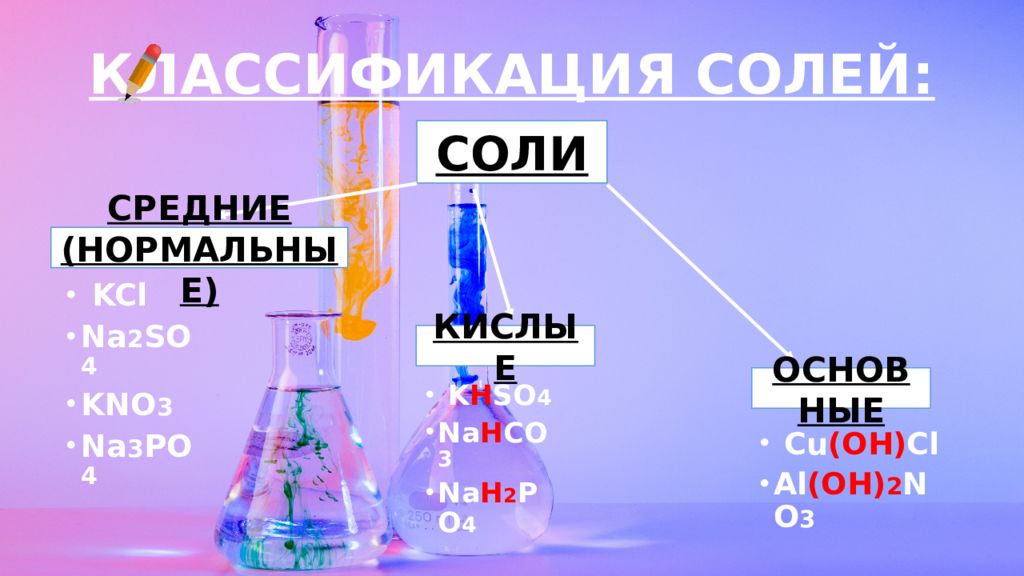
Слайд 6: КЛАССИФИКАЦИЯ СОЛЕЙ:
СОЛИ СРЕДНИЕ (НОРМАЛЬНЫЕ) КИСЛЫЕ ОСНОВНЫЕ KCl Na 2 SO 4 KNO 3 Na 3 PO 4 K H SO 4 Na H CO 3 Na H 2 PO 4 Cu (OH) Cl Al (OH) 2 NO 3
Слайд 7
СРЕДНИЕ (НОРМАЛЬНЫЕ) СОЛИ КИСЛЫЕ СОЛИ ОСНОВНЫЕ СОЛИ Это соли, в которых атомы водорода в кислоте полностью замещены атомами металлов: NaOH + H 2 CO 3 → NaHCO 3 + H 2 O 2 NaOH + H 2 SO 4 → Na 2 SO 4 + 2H 2 O Это продукт неполного замещения атомов водорода атомами металлов в кислоте: Это продукт неполного замещения гидроксогрупп основания кислотным остатком: Al(OH) 3 + HNO 3 → Al(OH) 2 NO 3 + H 2 O
Слайд 8: ТИПЫ СОЛЕЙ:
СОЛИ ДВОЙНЫЕ (СМЕШАННЫЕ) Fe (NH 4 ) 2 (SO 4 ) 2 КОМПЛЕКСНЫЕ Соли, в которых содержится один анион и два разных катиона: Na 2 [Zn(OH) 4 ] Соли, в состав которых входит комплексный ион:
Слайд 9
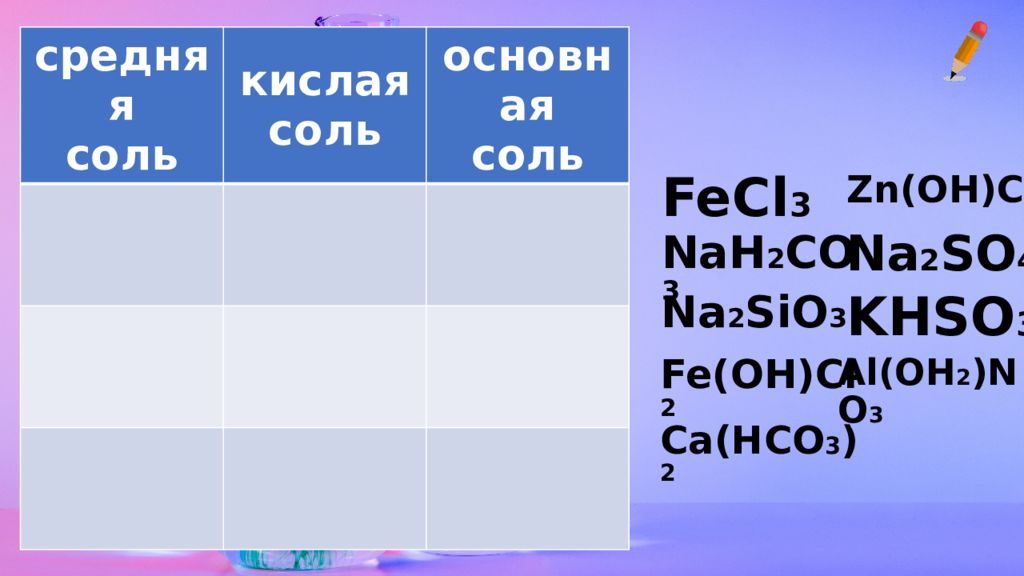
средняя соль кислая соль основная соль FeCl 3 NaH 2 CO 3 Na 2 SiO 3 Fe(OH)Cl 2 Ca(HCO 3 ) 2 Zn(OH)Cl Na 2 SO 4 KHSO 3 Al(OH 2 )NO 3
Слайд 10: КАК ДАТЬ НАЗВАНИЯ СОЛЯМ?
O 2- – оксид (пример: CuO – оксид меди); OH - – гидроксид (прим.: NaOH – гидроксид натрия); F - – фторид (прим.: NaF – фторид натрия); Cl - – хлорид (прим.: CrCl 3 – хлорид хрома); Br - – бромид (прим.: KBr – бромид калия); I - – йодид (прим.: KI – йодид калия); SO 3 2- – сульфит (прим.: Na 2 SO 3 – сульфит натрия); SO 4 2- – сульфат (прим.: Na 2 SO 4 – сульфат натрия); NO 2 - – нитрит (прим.: Ba(NO 2 ) 2 – нитрит бария); NO 3 - – нитрат (прим.: Mn(NO 3 ) 2 - нитрат марганца); КАК ДАТЬ НАЗВАНИЯ СОЛЯМ? В ЗАВИСИМОСТИ ОТ КИСЛОТНОГО ОСТАТКА: PO 4 3- – фосфат (прим.: Na 3 PO 4 – фосфат натрия); CO 3 2- – карбонат (прим.: Na 2 CO 3 – карбонат натрия).
Слайд 11: ПОПРОБУЕМ ВМЕСТЕ!
Ba 2+ Cl 2 - хлорид бария Pb 2+ (NO 3 ) 2 - нитрат свинца Ca 2+ CO 3 2- карбонат кальция Fe 2+ SO 4 2- сульфат железа Mg 3 2+ (PO 4 ) 2 3- фосфат магния
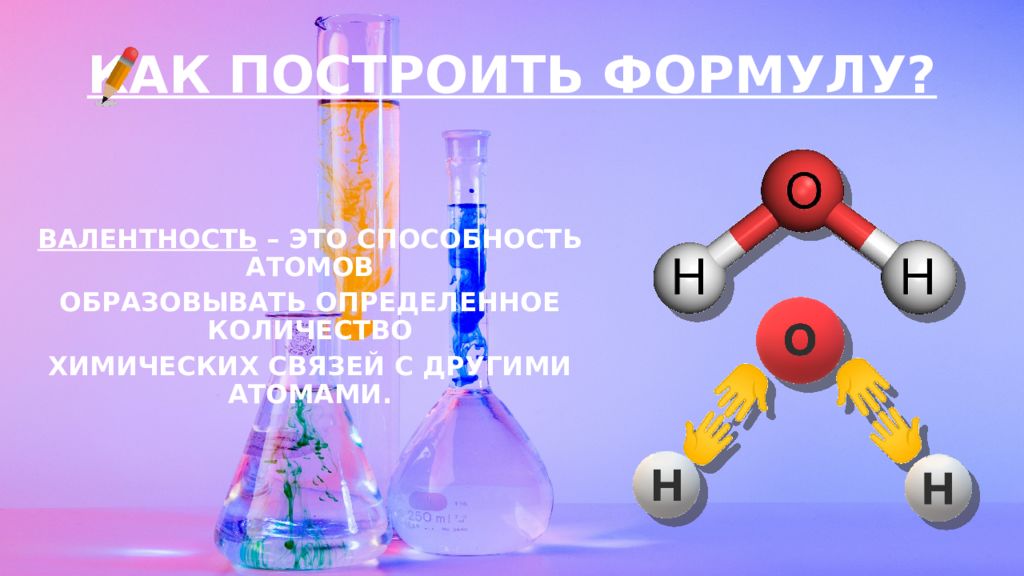
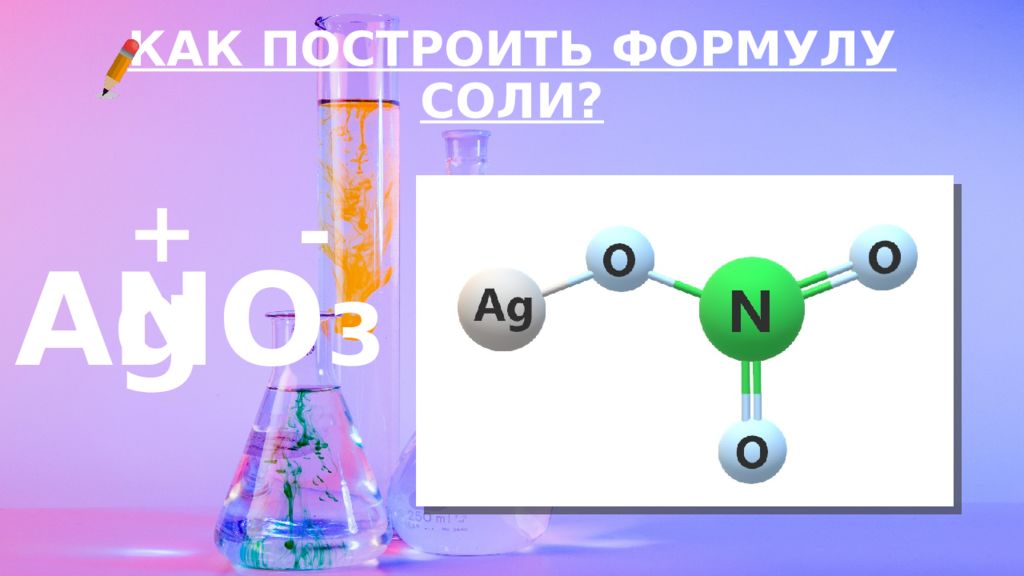
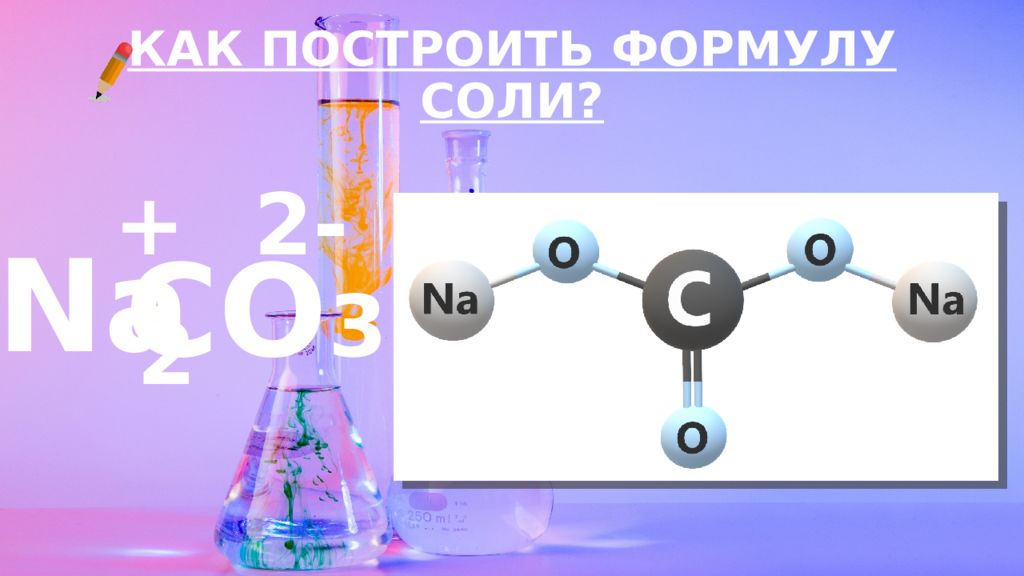
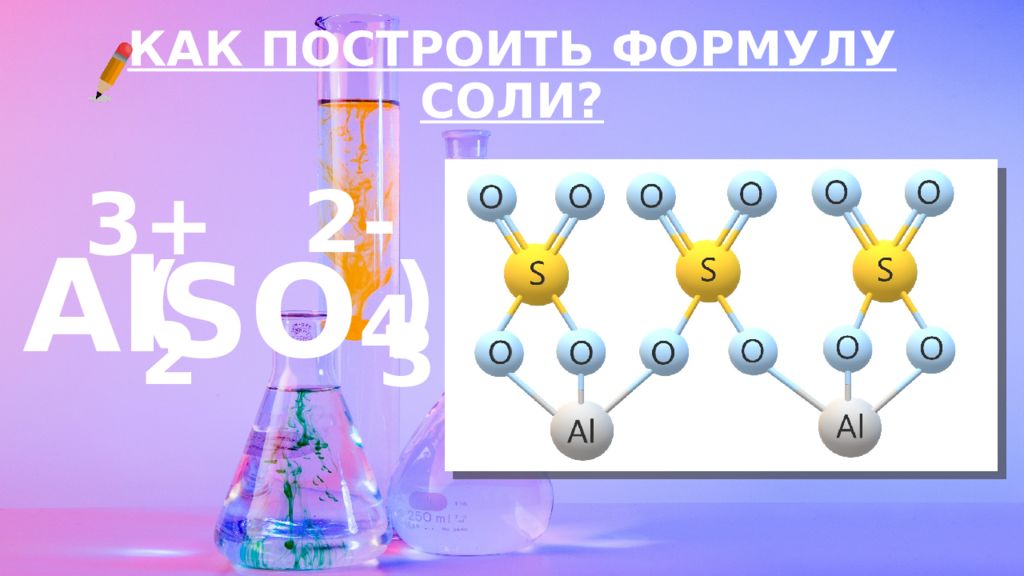
Слайд 12: КАК ПОСТРОИТЬ ФОРМУЛУ?
ВАЛЕНТНОСТЬ – ЭТО СПОСОБНОСТЬ АТОМОВ ОБРАЗОВЫВАТЬ ОПРЕДЕЛЕННОЕ КОЛИЧЕСТВО ХИМИЧЕСКИХ СВЯЗЕЙ С ДРУГИМИ АТОМАМИ. КАК ПОСТРОИТЬ ФОРМУЛУ?
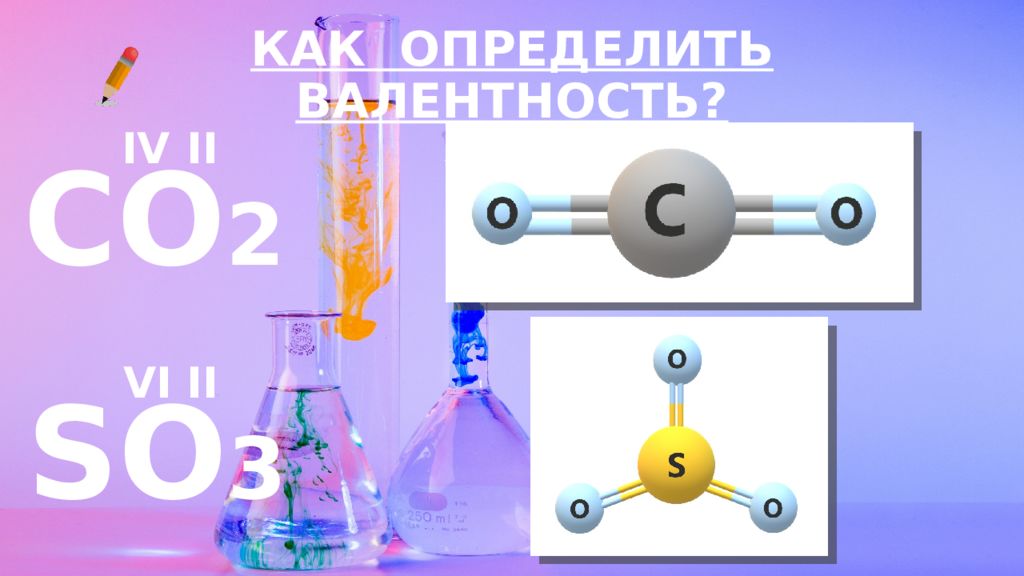
Слайд 13: КАК ОПРЕДЕЛИТЬ ВАЛЕНТНОСТЬ?
CO 2 КАК ОПРЕДЕЛИТЬ ВАЛЕНТНОСТЬ? II IV SO 3 II VI
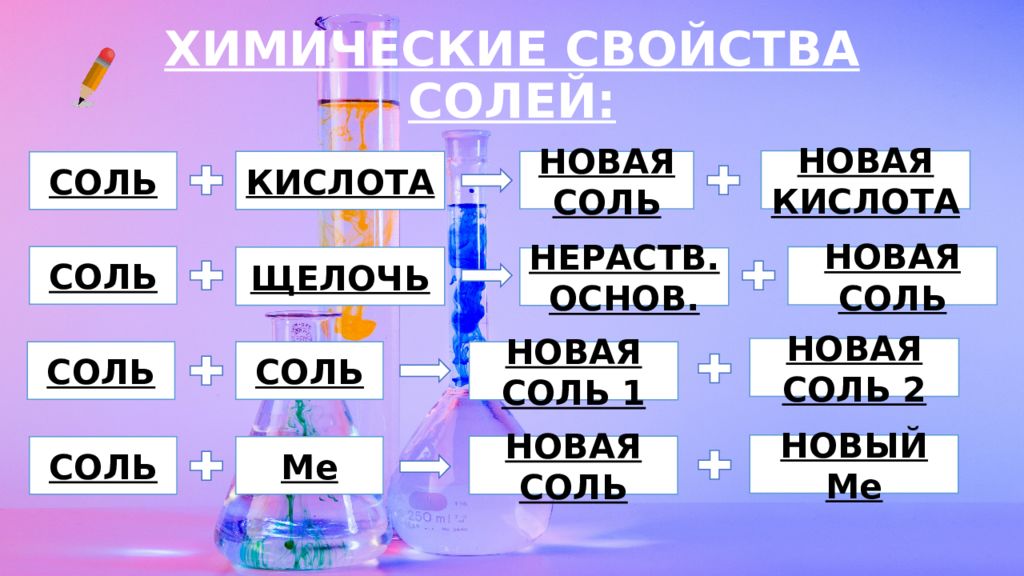
Слайд 18: ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ:
СОЛЬ КИСЛОТА НОВАЯ СОЛЬ НОВАЯ КИСЛОТА СОЛЬ ЩЕЛОЧЬ НЕРАСТВ. ОСНОВ. НОВАЯ СОЛЬ СОЛЬ СОЛЬ НОВАЯ СОЛЬ 1 НОВАЯ СОЛЬ 2 СОЛЬ Me НОВАЯ СОЛЬ НОВЫЙ Me
Слайд 19: ДОМАШНЕЕ ЗАДАНИЕ
1. Составить формулы для следующих солей и расставить заряды: хлорид калия; сульфат меди; нитрат магния; фосфат кальция. 2. Дать названия следующим веществам: CuCl 2 ; Ca(OH) 2 ; Ba ( NO 3 ) 2 ; MgSO 4 ; Zn 3 (PO 4 ) 2. 2. Составить структурные формулы следующих веществ и определить валентность каждого элемента: KCl ; NaNO 3 ; Na 2 CO 3 ; K 2 SO 4. ДОМАШНЕЕ ЗАДАНИЕ
Слайд 21
ЧТО ДЕЛАЛИ? ЧТО НАБЛЮДАЛИ? ВЫВОД 1. AgNO 3 + HCl 5. AgNO 3 + NaCl 6. BaCl 2 + Na 2 SO 4 7. CuSO 4 + Fe AgCl↓ + HNO 3 Соль реагирует с кислотой 2. BaCl 2 + H 2 SO 4 BaSO 4 ↓ + 2HCl Соль реагирует с кислотой 3. 2CuSO 4 + 2NaOH Cu(OH) 2 ↓ + Na 2 SO 4 Соль реагирует со щелочью 4. FeCl 3 + 3NaOH Fe(OH) 3 ↓ + 3NaCl AgCl↓ + NaNO 3 Соль реагирует со щелочью Соль реагирует с солью BaSO 4 ↓ + 2NaCl Соль реагирует с солью FeSO 4 + Cu↓ Соль реагирует с Me до H 2 8. FeCl 3 + Cu Соль не р. с Me после H 2