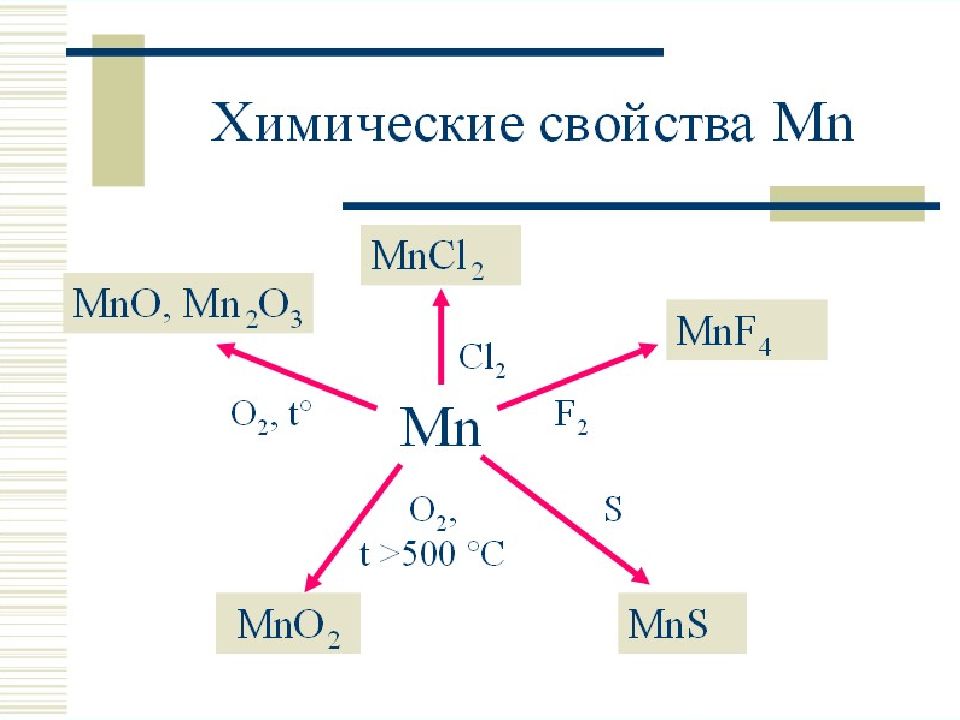
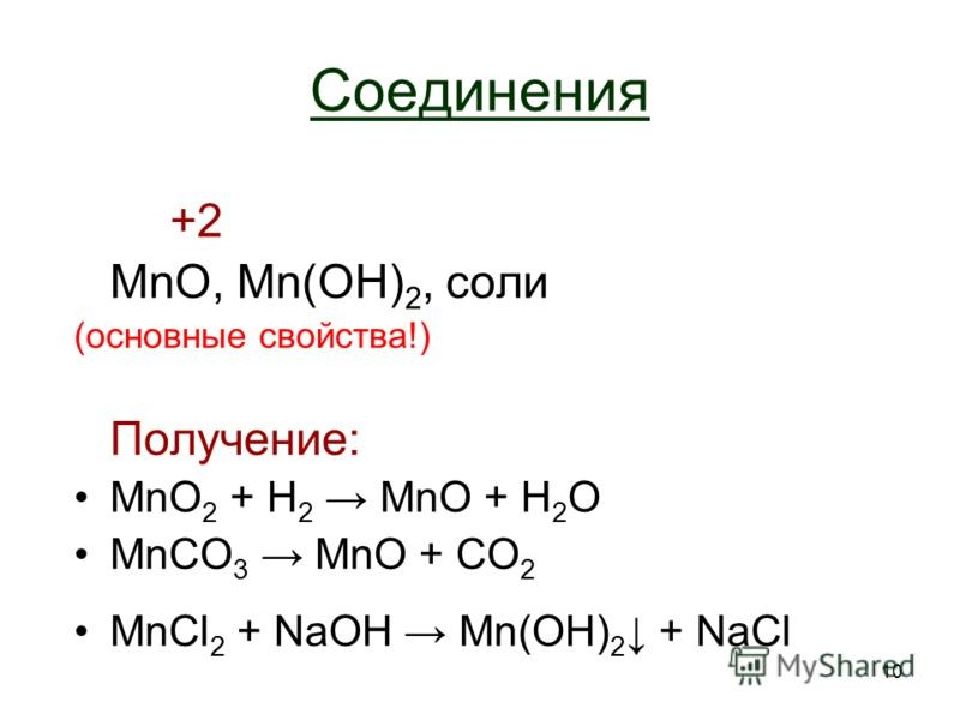
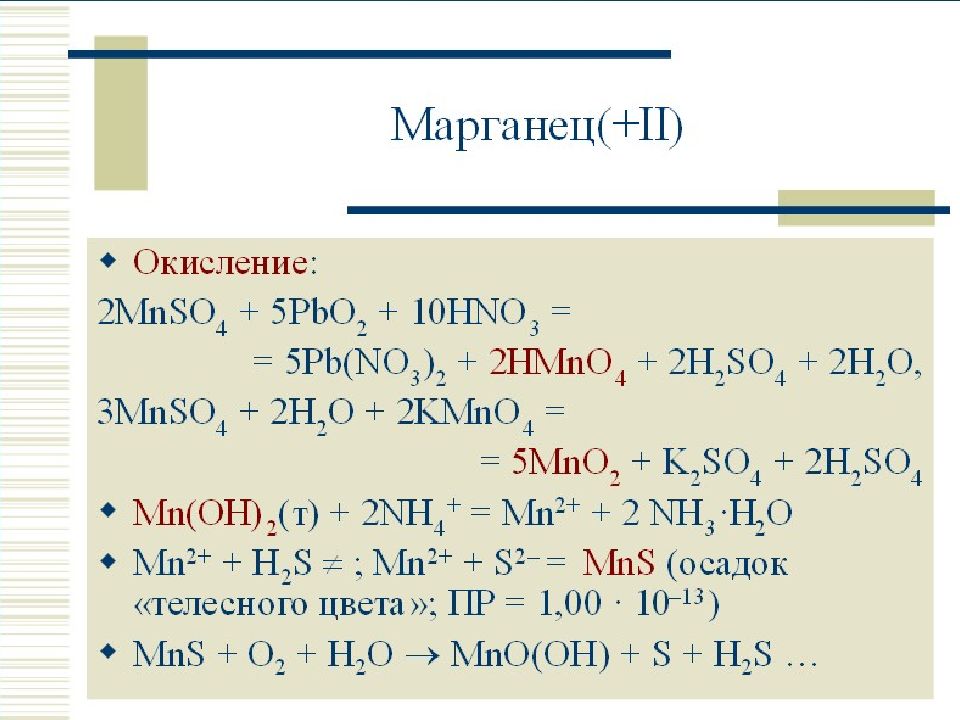
Слайд 35: Восстановление перманганата калия
Слайд 55: Образование ржавчины
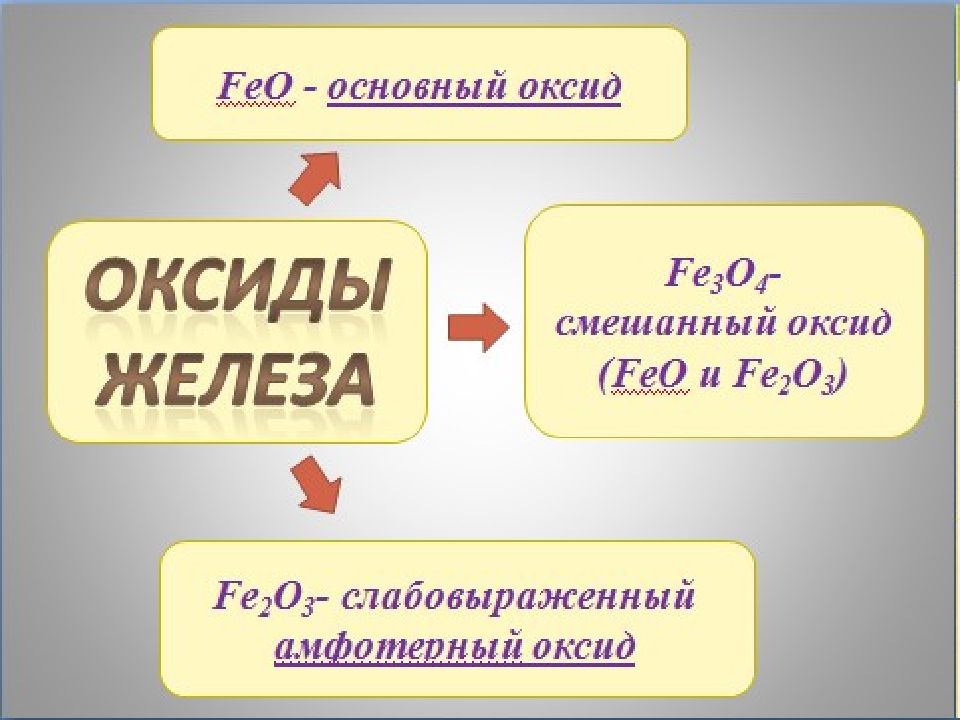
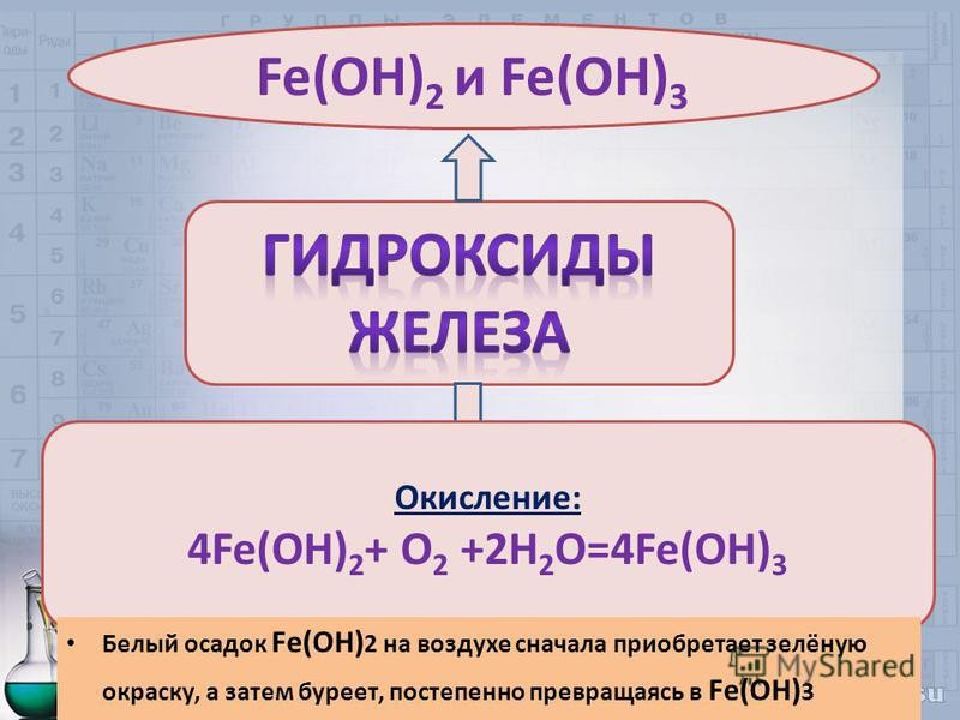
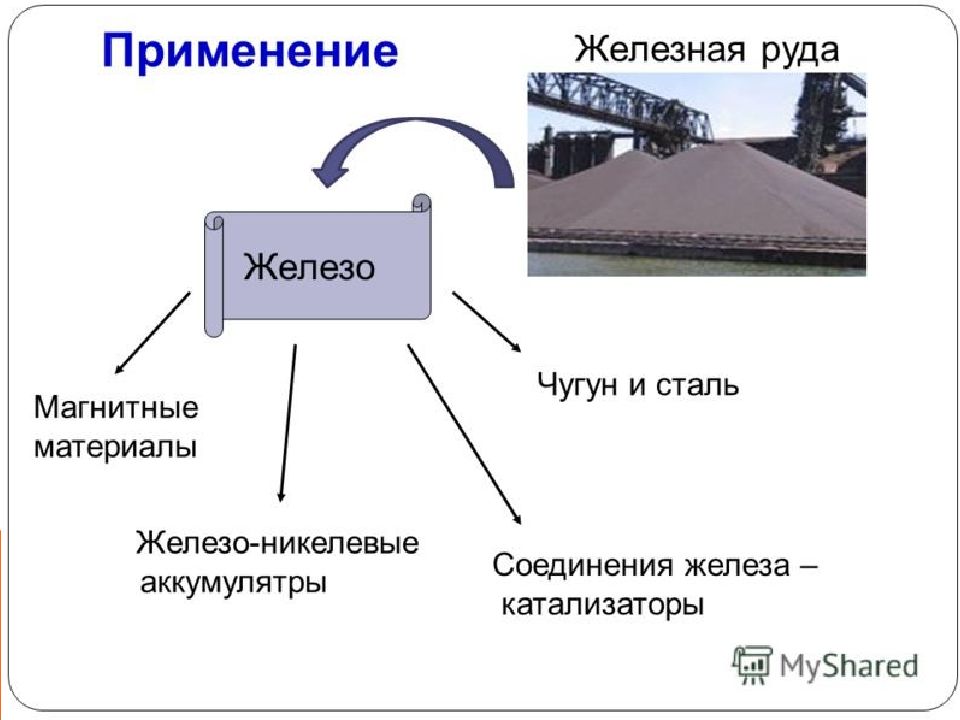
Во влажном воздухе железо подвергается коррозии: 4Fe + 6H 2 O + 3O 2 = 4 Fe(OH) 3 Гидроксид железа (III) термодинамически неустойчив, он со временем теряет часть воды, переходя в FeO (OH) ("болотная руда"): Fe (OH) 3 = FeO (OH) + H 2 O 2FeO(OH) = Fe 2 O 3 + H 2 O Что касается ржавчины, то это СМЕСЬ, состоящая главным образом из Fe (OH) 3, FeOOH и частично из оксида Fe 2 O 3.
Слайд 70: Соль мора
FeSO 4 ·( NH 4 ) 2 SO 4 ·6H 2 O Применяется в научно-исследовательских работах и химических лабораториях как удобная форма железа(II ): для установки титра перманганата калия, при объемных определениях хрома и ванадия, этилового спирта и эфира. В растворах ион Fe 2+ даже слабыми окислителями легко окисляется до Fe 3 +. Соль мора
Слайд 88: Тривиальные названия
MnO 2 - пиролюзит Марганцовка – водный раствор KMnO 4
Слайд 89: Тривиальные названия
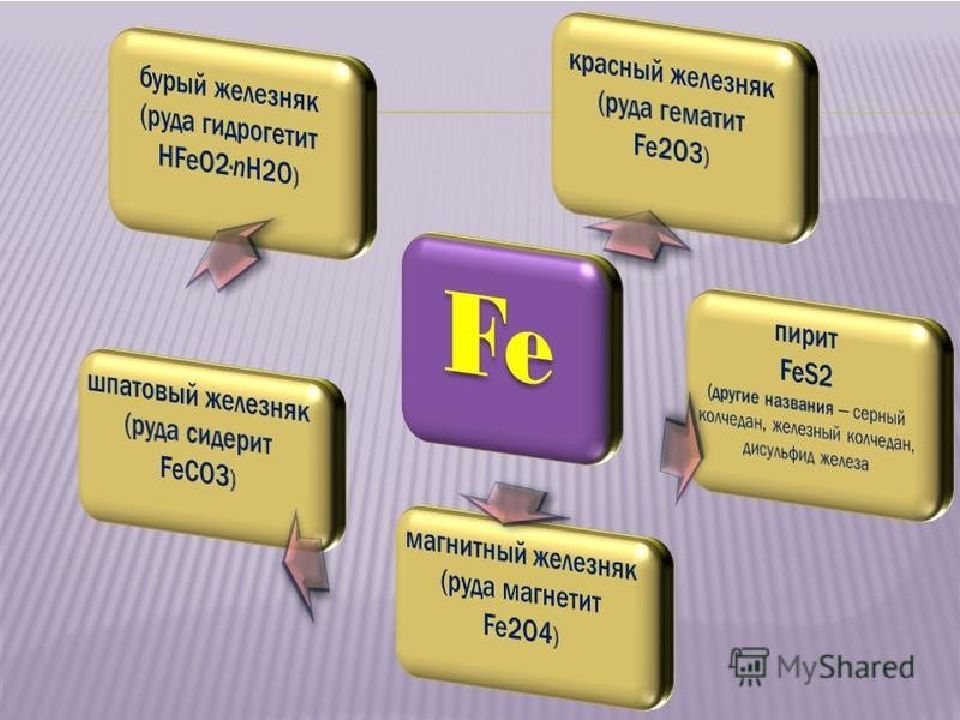
Fe3O4 – магнитный железняк FeS2 – железный колчедан, серный колчедан, пирит CuFeS2 – медный колчедан, халькопирит FeSO4 ▪ 7H2O – железный купорос ( NH4)2Fe(SO4)2 ▪ 6H2O – соль Мора Железные квасцы – Me[Fe(SO4)2] ▪ 12H2O, где Ме – ионы щелочных металлов или катион аммония NH4+ K 3 [Fe(CN)6 ] – красная кровяная соль K4[Fe(CN)6] – желтая кровяная соль Fe4[Fe(CN)6] 3 – берлинская лазурь