Первый слайд презентации
1 Количественное определение лекарственных средств титриметрическим методом. НАО «Медицинский университет Астана» Кафедра фармацевтических дисциплин
Слайд 2
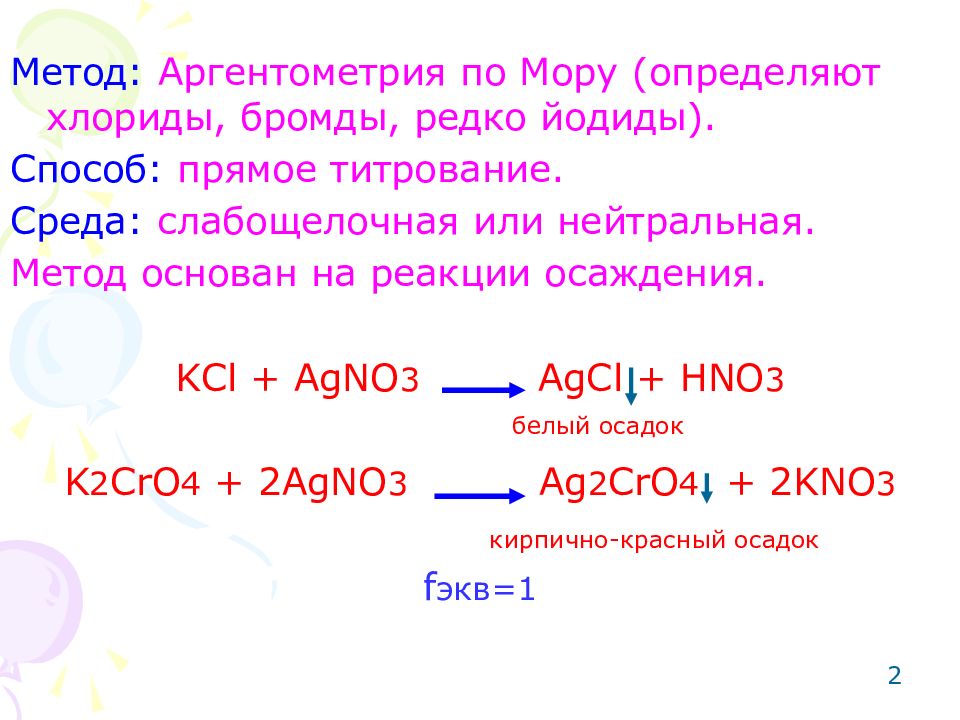
2 Метод: Аргентометрия по Мору (определяют хлориды, бромды, редко йодиды). Способ: прямое титрование. Среда: слабощелочная или нейтральная. Метод основан на реакции осаждения. KCl + AgNO 3 AgCl + HNO 3 K 2 CrO 4 + 2AgNO 3 Ag 2 CrO 4 + 2KNO 3 f экв =1 кирпично-красный осадок белый осадок
Слайд 3
3 Сущность: точную навеску препарата растворяют в воде и титруют титрованным раствором азотнокислого серебра в точке эквивалентности избыточная капля титранта взаимодействует с индикатором-хроматом калия и образуется красный осадок хромата калия. Особенность: В сильно-щелочной среде образуется гидроксид серебра, который разлагается до оксида серебра ( I ), имеющего черный цвет. В кислой среде хромат калия переходит в бихромат калия, который не образует красного осадка с избытком азотнокислого серебра и мы не можем зафиксировать точку эквивалентности.
Слайд 4
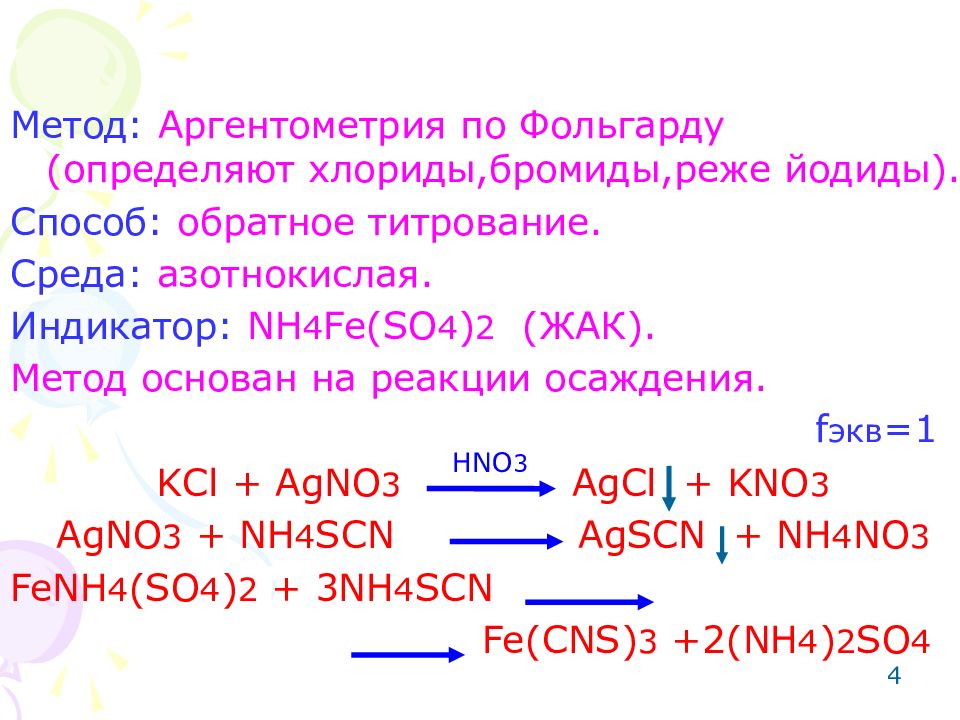
4 Метод: Аргентометрия по Фольгарду (определяют хлориды,бромиды,реже йодиды). Способ: обратное титрование. Среда: азотнокислая. Индикатор: NH 4 Fe(SO 4 ) 2 ( ЖАК). Метод основан на реакции осаждения. KCl + AgNO 3 AgCl + KNO 3 AgNO 3 + NH 4 SCN AgSCN + NH 4 NO 3 FeNH 4 (SO 4 ) 2 + 3NH 4 SCN Fe(CNS) 3 +2(NH 4 ) 2 SO 4 HNO 3 f экв =1
Слайд 5
5 Сущность: Особенность: В сильно-щелочной среде образуется гидроксид серебра, который разлагается до оксида серебра ( I ), имеющего черный цвет. А так же подвергаются гидролизу индикатор с образованием гидроксида железа (III) - рыжий осадок.
Слайд 6
6 Метод: Аргентометрия по Фаянсу. (чаще определяют йодиды). Способ: прямое титрование. Среда: уксусно-кислая для полной диссоциации индикатора, чтобы он лучше адсорбировался в виде аниона на положительно заряженном осадке в точке эквивалентности). Индикаторы адсорбционные: эозинат натрия или бромфеноловый синий.
Слайд 7
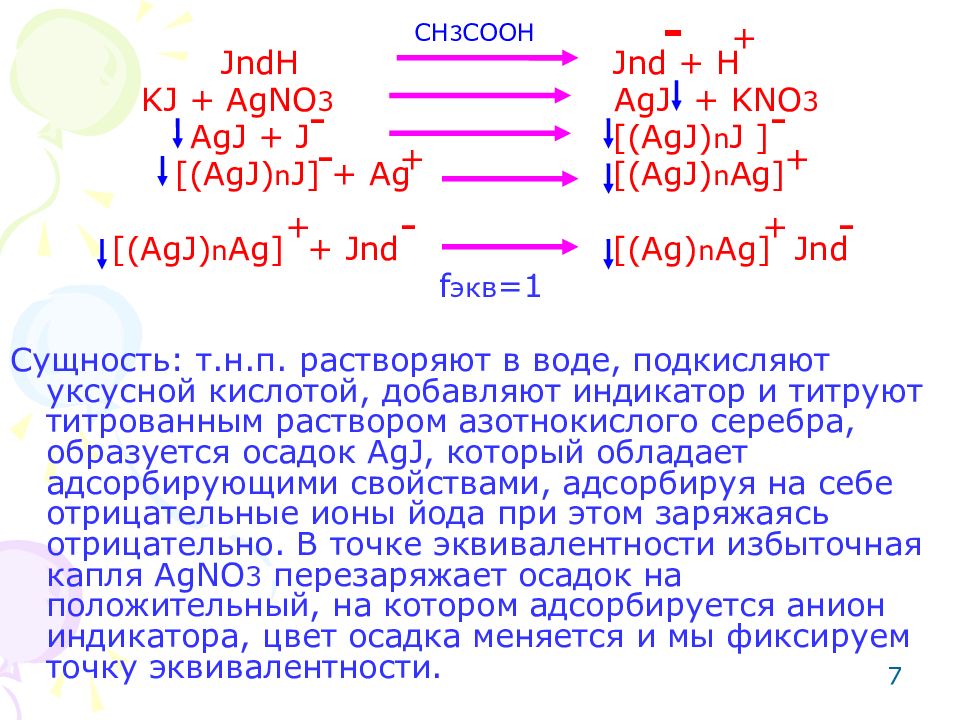
7 JndH Jnd + H KJ + AgNO 3 AgJ + KNO 3 AgJ + J [(AgJ) n J ] [(AgJ) n J] + Ag [(AgJ) n Ag] [(AgJ) n Ag] + Jnd [(Ag) n Ag] Jnd f экв =1 Сущность: т.н.п. растворяют в воде, подкисляют уксусной кислотой, добавляют индикатор и титруют титрованным раствором азотнокислого серебра, образуется осадок AgJ, который обладает адсорбирующими свойствами, адсорбируя на себе отрицательные ионы йода при этом заряжаясь отрицательно. В точке эквивалентности избыточная капля AgNO 3 перезаряжает осадок на положительный, на котором адсорбируется анион индикатора, цвет осадка меняется и мы фиксируем точку эквивалентности. - + - - - - + + + - + С H 3 COOH
Слайд 8
8 Метод: Меркуриметрия. Способ: прямое тирование. Среда: азотнокислая. Титрант: раствор нитрата ртути (II). Индикатор: дифенилкарбазон или нитропруссид натрия. Особенность: для хлоридов метод основан на реакции образования трудно диссоциируемого соединения сулемы ; для бромидов и йодидов метод основан на реакции осаждения.
Слайд 9
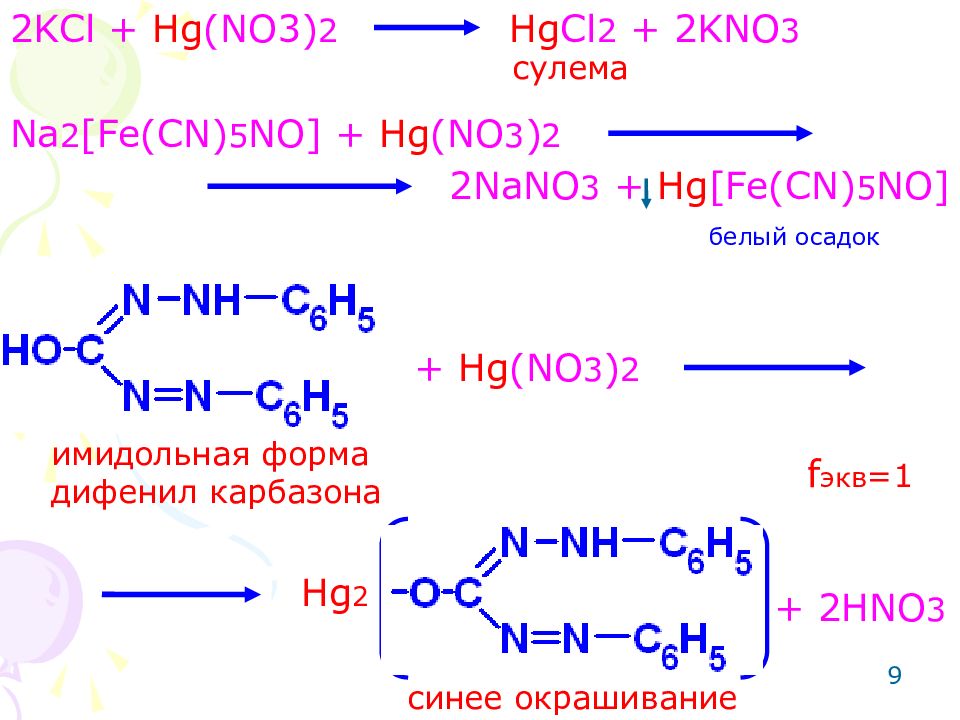
9 2 KCl + Hg (NO3) 2 Hg Cl 2 + 2KNO 3 Na 2 [Fe(CN) 5 NO] + Hg (NO 3 ) 2 2NaNO 3 + Hg [Fe(CN) 5 NO] сулема имидольная форма дифенил карбазона + Hg (NO 3 ) 2 Hg 2 + 2HNO 3 синее окрашивание f экв =1 белый осадок
Слайд 10
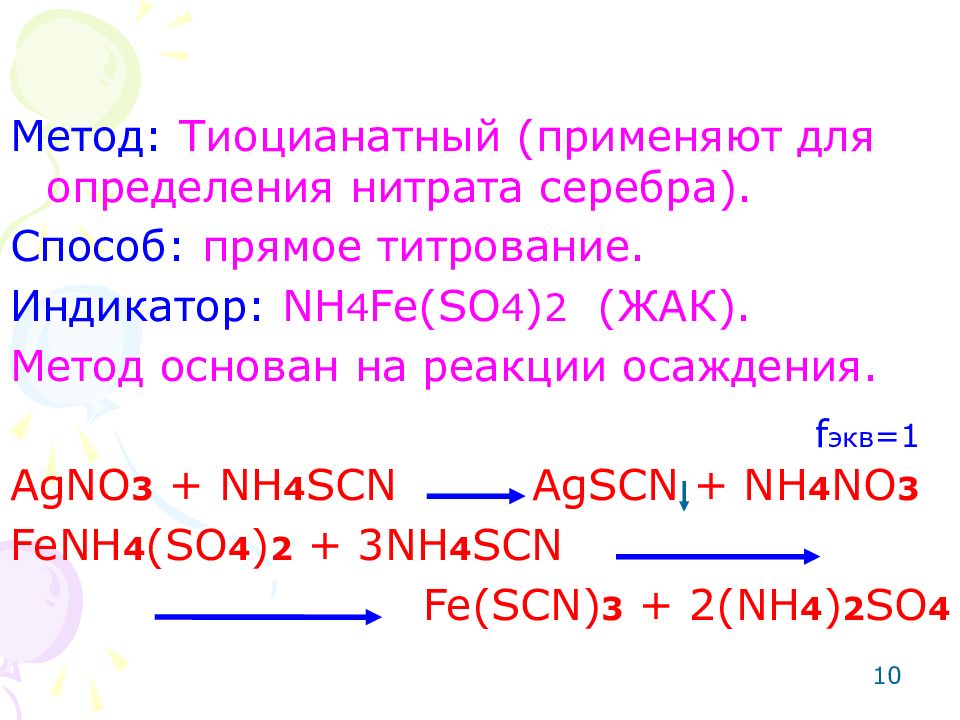
10 Метод: Тиоцианатный (применяют для определения нитрата серебра). Способ: прямое титрование. Индикатор: NH 4 Fe(SO 4 ) 2 ( ЖАК). Метод основан на реакции осаждения. AgNO 3 + NH 4 SCN AgSCN + NH 4 NO 3 FeNH 4 (SO 4 ) 2 + 3NH 4 SCN Fe(SCN) 3 + 2(NH 4 ) 2 SO 4 f экв =1
Слайд 11
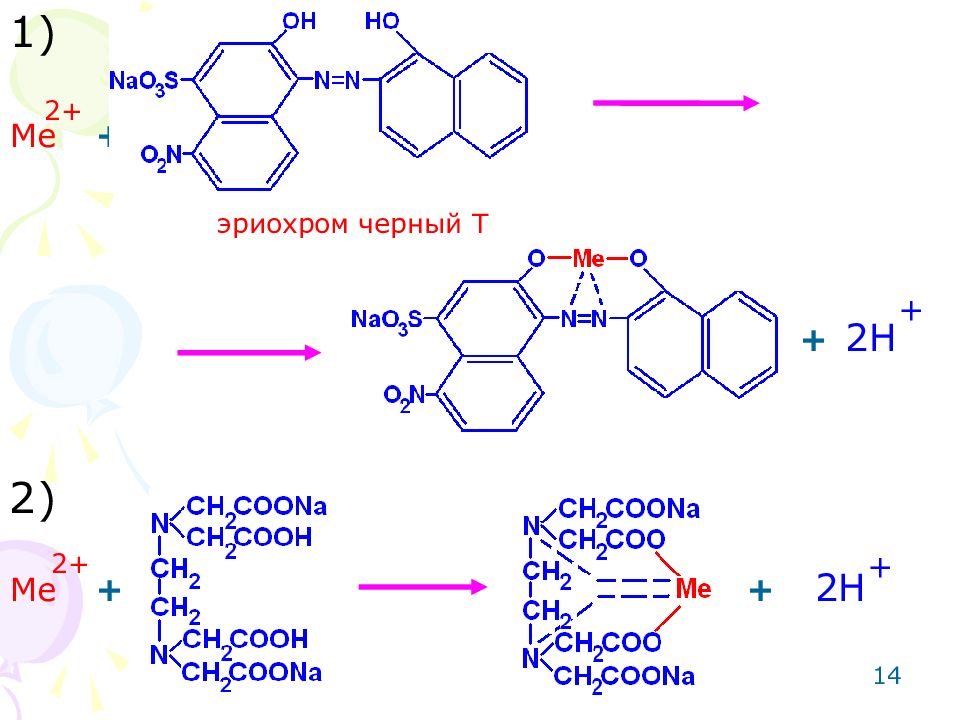
11 Препараты, образованные катионами металлов со степенями окисления +2 и +3, определяют количественно Методом комплексонометрическим, способом прямого и обратного титрования. Метод основан на реакции комплексообразования. Среда для 2-х зарядных катионов металлов – аммиачный буферный раствор, для 3-х зарядных – азотнокислая. Индикатор для 2-х зарядных катионов металлов – эриохром черный Т, для 3-х зарядных – мурексид, пирокатехиновый фиолетовый.
Слайд 12
12 В комплексонометрии применяются металл-индикаторы. Требования к индикаторам: Обратимое взаимодействие металла с индикатором. Связь Ме- Jnd должна быть менее прочной, чем связь Ме-Трилон Б.
Слайд 13
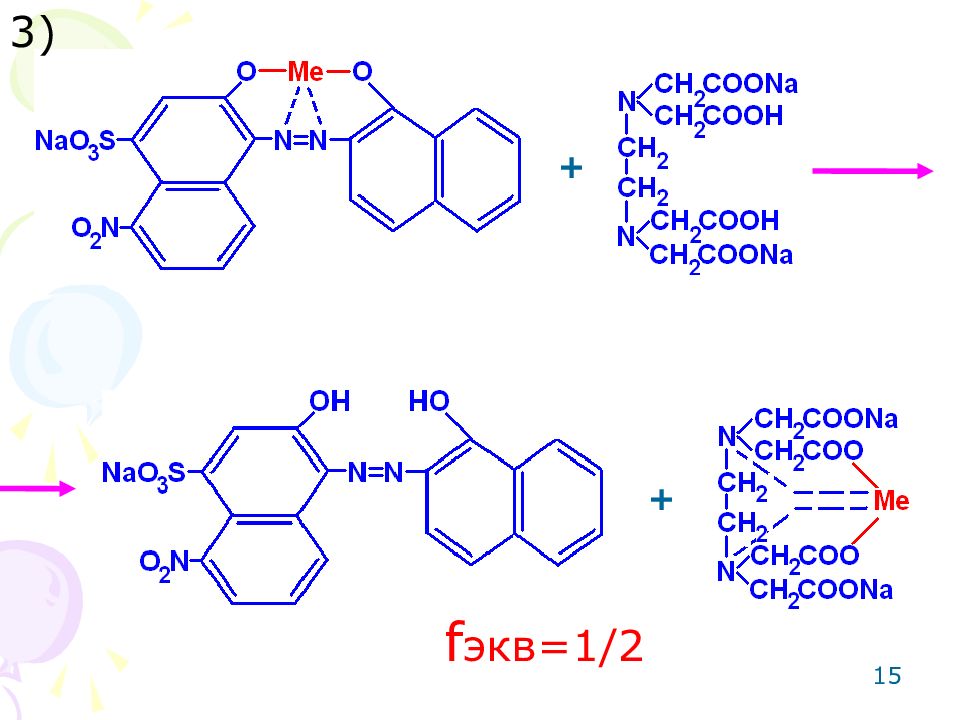
13 Метод: комплексонометрический для 2-х зарядных катионов металлов ( Zn,Ca,Mg ). Способ: прямое титрование. Среда: аммиачный буферный раствор. Титрант: раствор трилона Б (динатриевая соль этилендиаминотетрауксусной кислоты). Индикатор: эриохром черный Т. Метод основан на реакции комплексообразования.
Слайд 16
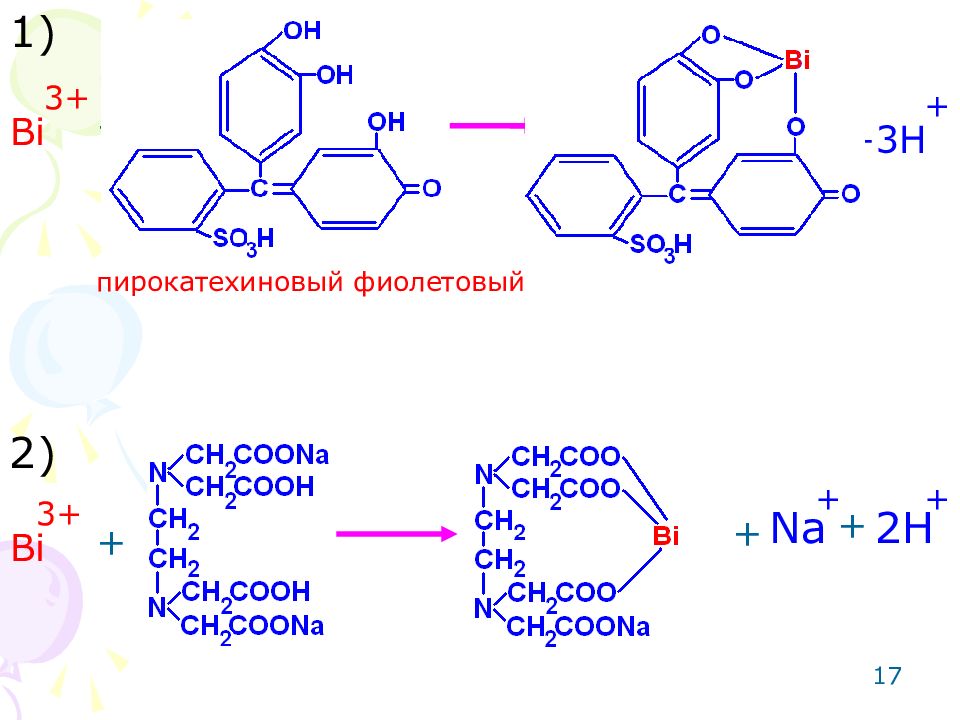
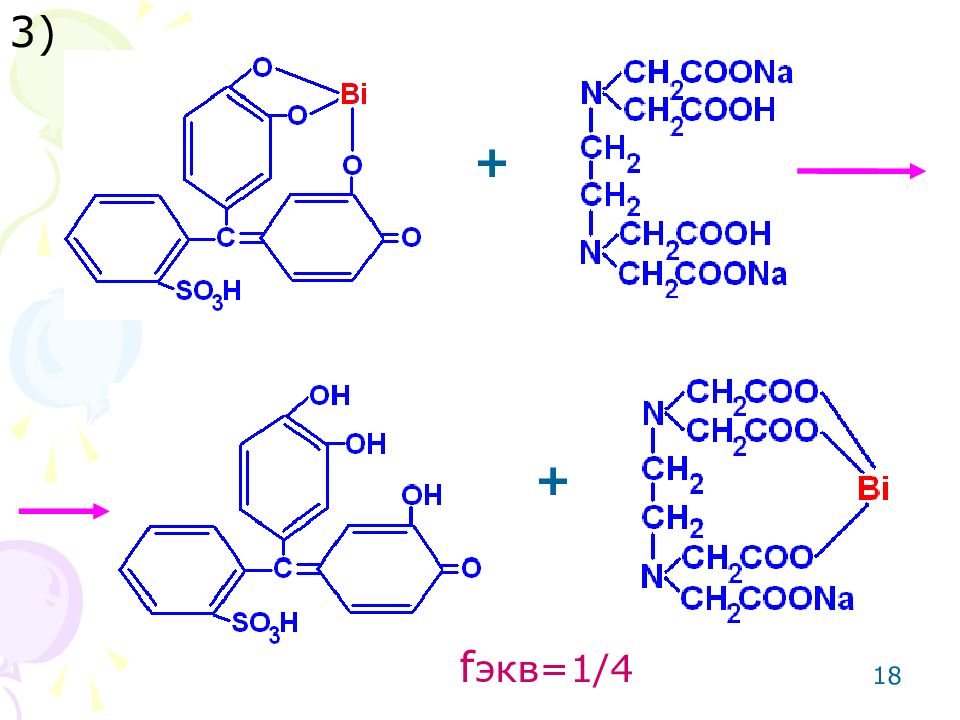
16 Метод: комплексонометрический для 3-х зарядных катионов металлов ( Bi ). Способ: прямое титрование. Среда: азотнокислая. Титрант: раствор трилона Б (динатриевая соль этилендиаминотетрауксусной кислоты). Индикатор: пирокатехиновый фиолетовый. Метод основан на реакции комплексообразования. +3
Слайд 17
17 Bi 3 + +3H + + + + + + + Bi 3 + Na 2H 1) 2) пирокатехиновый фиолетовый
Слайд 19
19 Метод: комплексонометрический. Способ: обратное титрование (для определения FeSO 4 и CuSO 4 ). Индикатор: эриохром черный Т Обратное титрование применяется в следующих случаях: Когда катион металла в буферном растворе образует нерастворимое соединение гидроксида металла ( Fe(OH) 2 и Cu(OH) 2 ). Когда отсутствует подходящий индикатор. Когда реакция комплексообразования идет медленно.
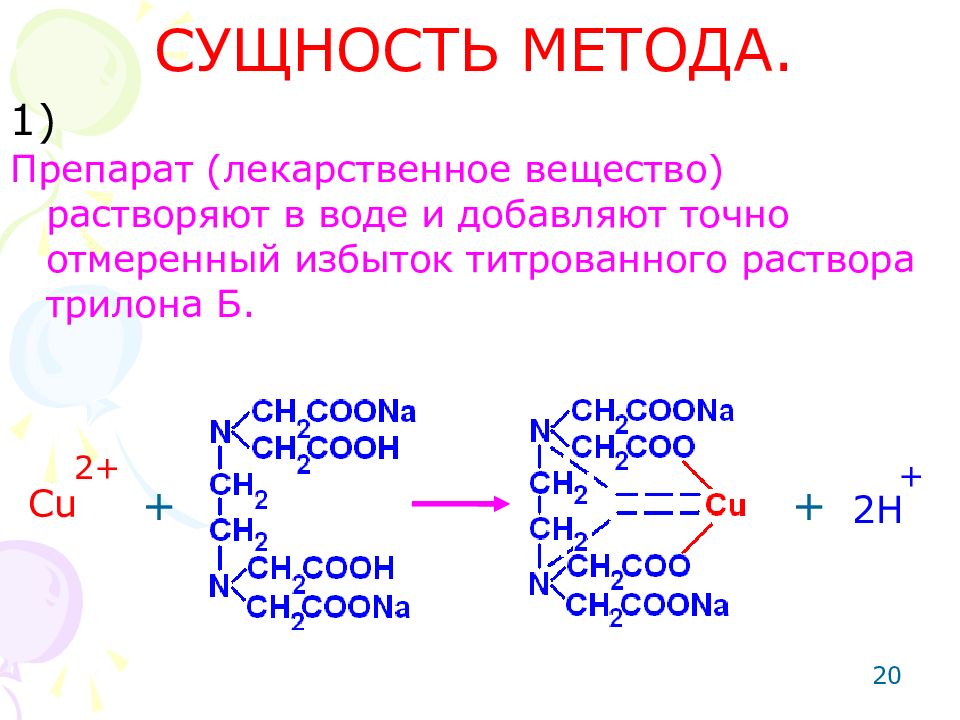
Слайд 20: СУЩНОСТЬ МЕТОДА
20 СУЩНОСТЬ МЕТОДА. Препарат (лекарственное вещество) растворяют в воде и добавляют точно отмеренный избыток титрованного раствора трилона Б. Cu 2 + + + + 2H 1)
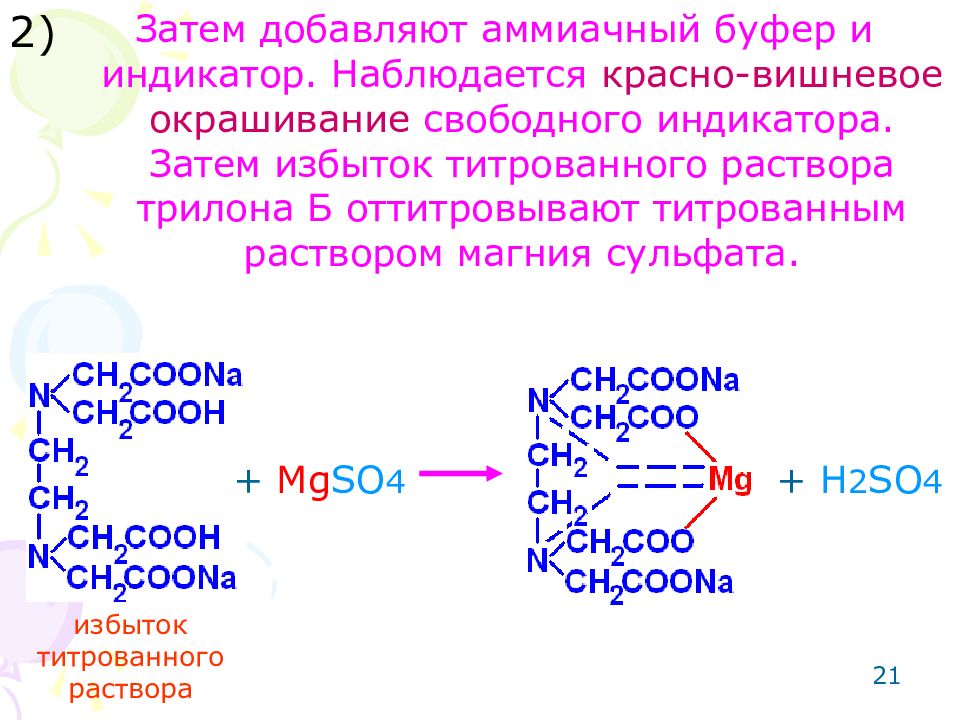
Слайд 21
21 Затем добавляют аммиачный буфер и индикатор. Наблюдается красно-вишневое окрашивание свободного индикатора. Затем избыток титрованного раствора трилона Б оттитровывают титрованным раствором магния сульфата. 2) + Mg SO 4 + H 2 SO 4 избыток титрованного раствора
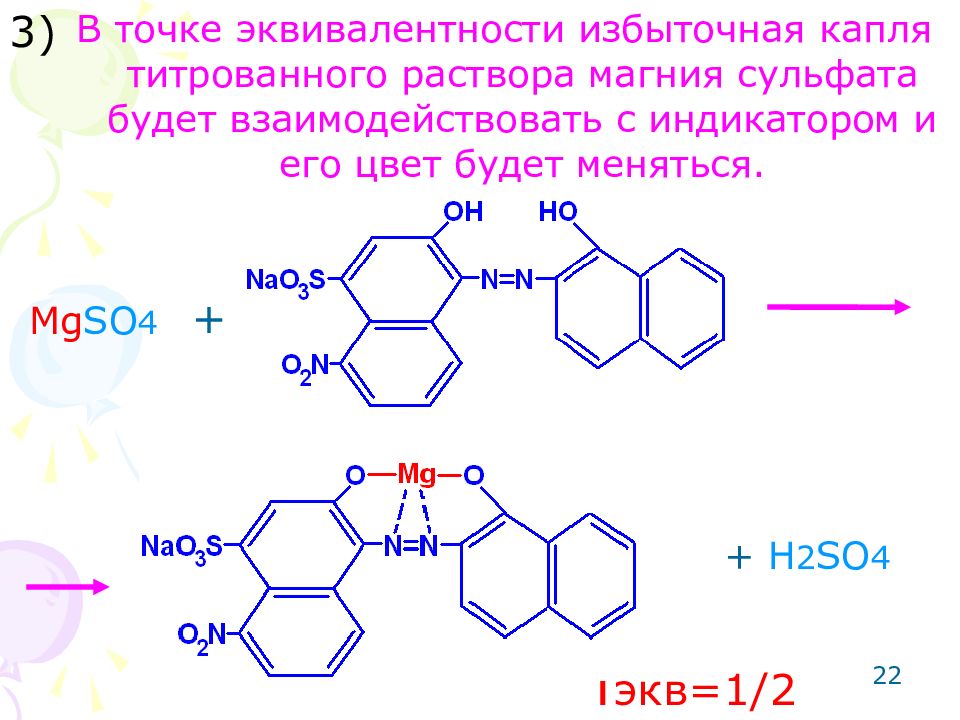
Слайд 22
22 В точке эквивалентности избыточная капля титрованного раствора магния сульфата будет взаимодействовать с индикатором и его цвет будет меняться. 3) Mg SO 4 + + H 2 SO 4 f экв =1/2
Слайд 23
23 ОПРЕДЕЛЕНИЕ ГЛЮКОЗЫ И ФОРМАЛЬДЕГИДА Метод: йодометрический. Способ: обратное титрование. Среда: щелочная (т.к. альдегидная группа окисляется йодом только в щелочной среде). Метод основан на реакции окисления-восстановления.
Слайд 24
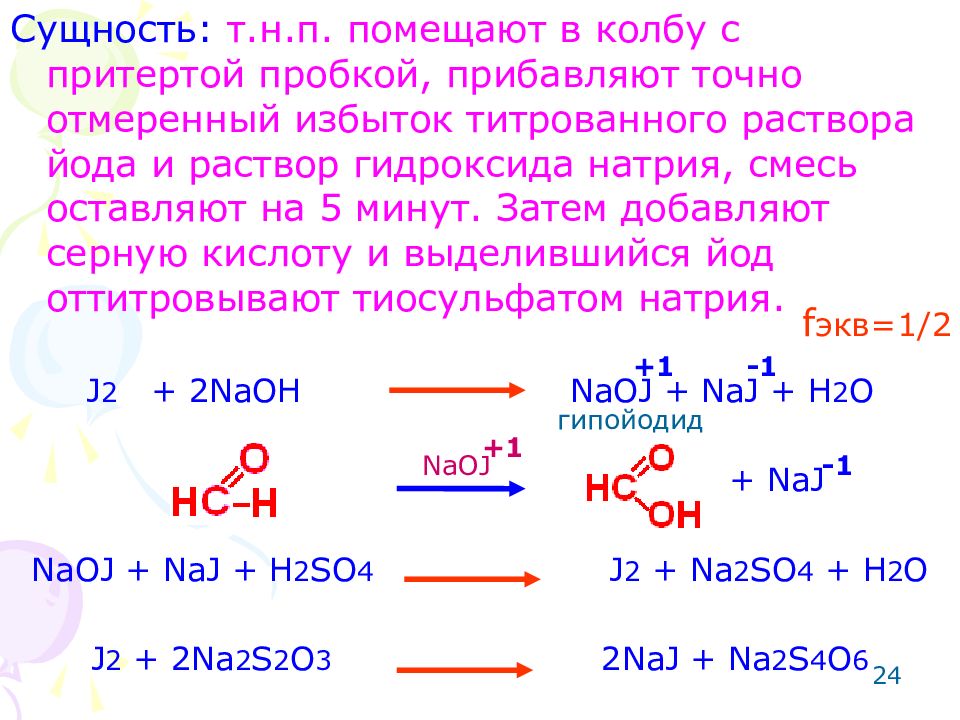
24 Сущность: т.н.п. помещают в колбу с притертой пробкой, прибавляют точно отмеренный избыток титрованного раствора йода и раствор гидроксида натрия, смесь оставляют на 5 минут. Затем добавляют серную кислоту и выделившийся йод оттитровывают тиосульфатом натрия. J 2 + 2NaOH NaOJ + NaJ + H 2 O + NaJ NaOJ + NaJ + H 2 SO 4 J 2 + Na 2 SO 4 + H 2 O J 2 + 2Na 2 S 2 O 3 2NaJ + Na 2 S 4 O 6 NaOJ гипойодид +1 +1 -1 -1 f экв=1/2
Слайд 25
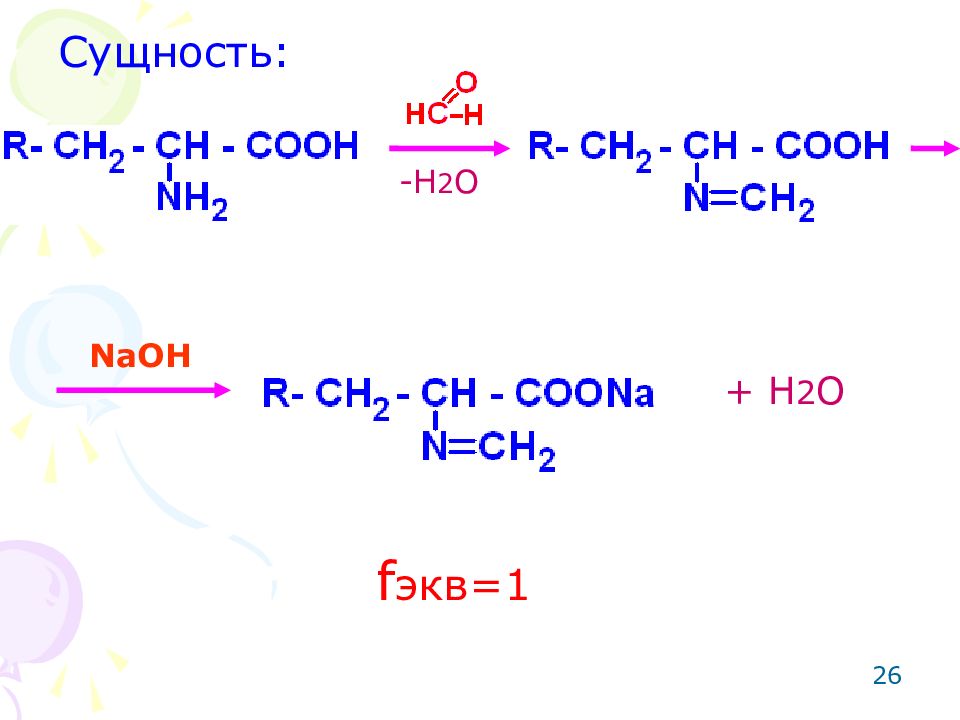
25 ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТ Метод: алкалиметрический по Сиренсу с блокировкой первичной алифатической аминогруппы формальдегидом с целью усиления кислотных свойств. Способ: прямое титрование.
Слайд 27
27 ОПРЕДЕЛЕНИЕ ФЕНОЛОВ Метод: броматометрический. Способ: обратное титрование. Метод основан на реакции электрофильного замещения.
Слайд 28
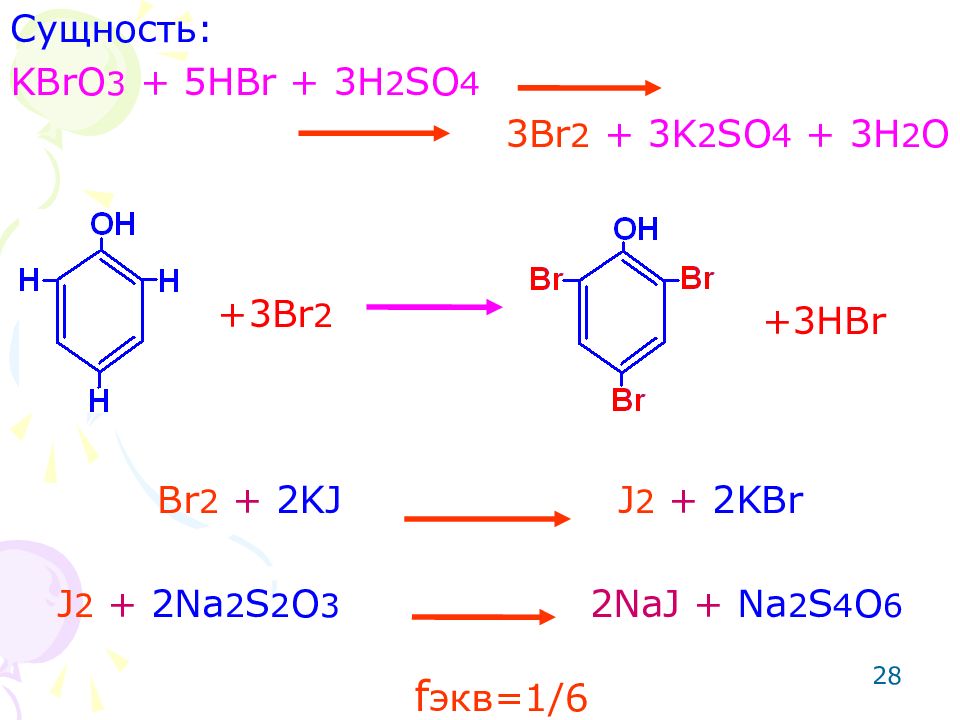
28 Сущность: KBrO 3 + 5HBr + 3H 2 SO 4 3Br 2 + 3K 2 SO 4 + 3H 2 O Br 2 + 2KJ J 2 + 2KBr J 2 + 2Na 2 S 2 O 3 2NaJ + Na 2 S 4 O 6 +3 Br 2 +3HBr f экв=1/ 6
Слайд 29
29 ОПРЕДЕЛЕНИЕ ФЕНОЛОВ Метод: броматометрический. Способ: прямое титрование. Индикатор: метиловый красный. Метод основан на реакции электрофильного замещения.
Слайд 30
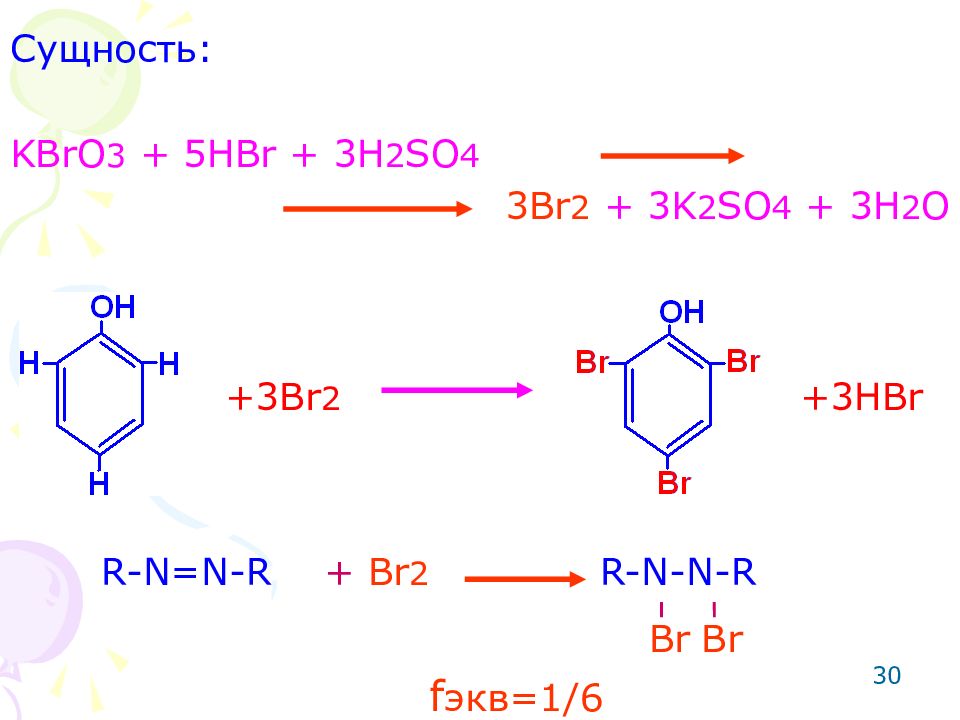
30 Сущность: KBrO 3 + 5HBr + 3H 2 SO 4 3Br 2 + 3K 2 SO 4 + 3H 2 O R-N=N-R + Br 2 R-N-N-R +3 Br 2 +3HBr Br Br f экв=1/ 6
Слайд 31
31 ОПРЕДЕЛЕНИЕ ФЕНОЛОВ Метод: йодометрический. Способ: обратное титрование. Метод основан на реакции электрофильного замещения
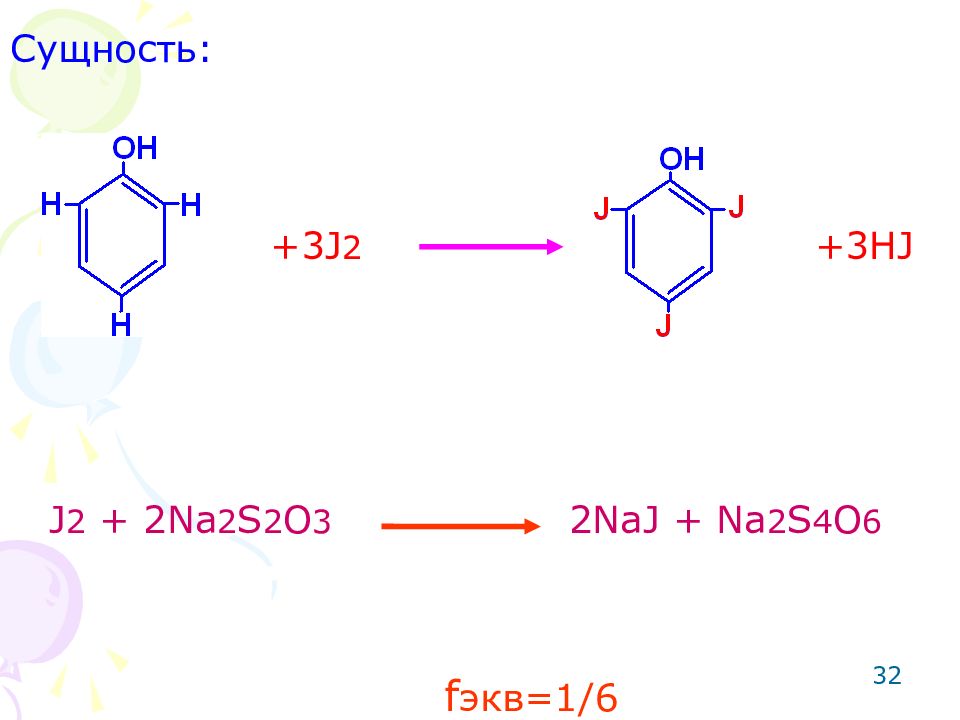
Слайд 32
32 Сущность: J 2 + 2Na 2 S 2 O 3 2NaJ + Na 2 S 4 O 6 +3J 2 +3HJ f экв=1/ 6
Слайд 33
33 ОПРЕДЕЛЕНИЕ ФЕНОЛОВ Метод: хлорйодометрический. Способ: обратное титрование. Метод основан на реакции электрофильного замещения.
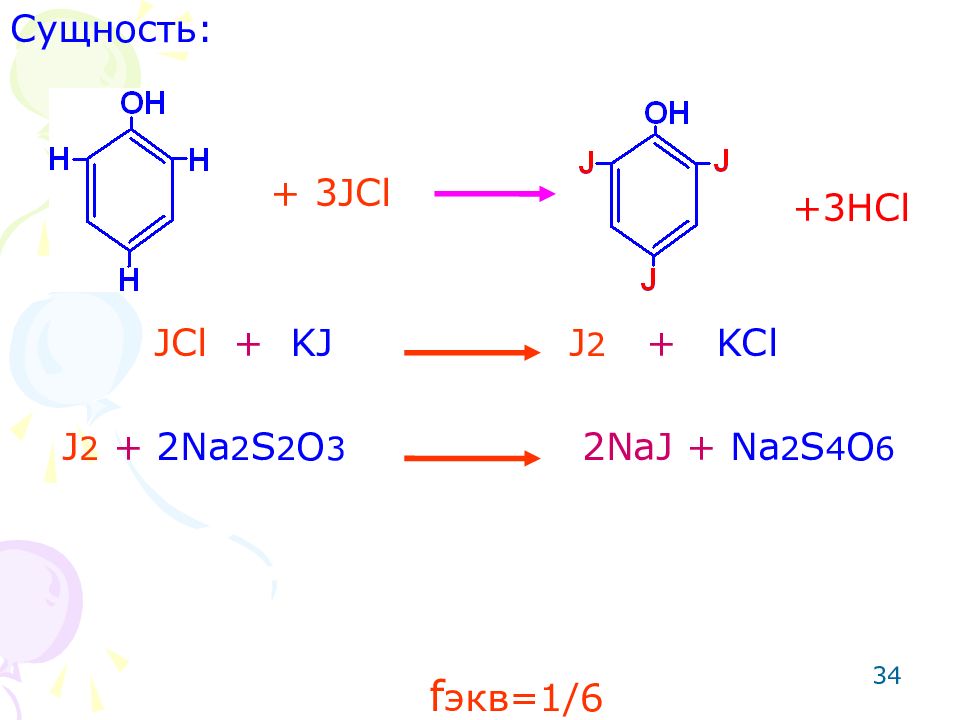
Слайд 34
34 Сущность: JCl + KJ J 2 + KCl J 2 + 2Na 2 S 2 O 3 2NaJ + Na 2 S 4 O 6 + 3 JCl +3HCl f экв=1/ 6
Слайд 35
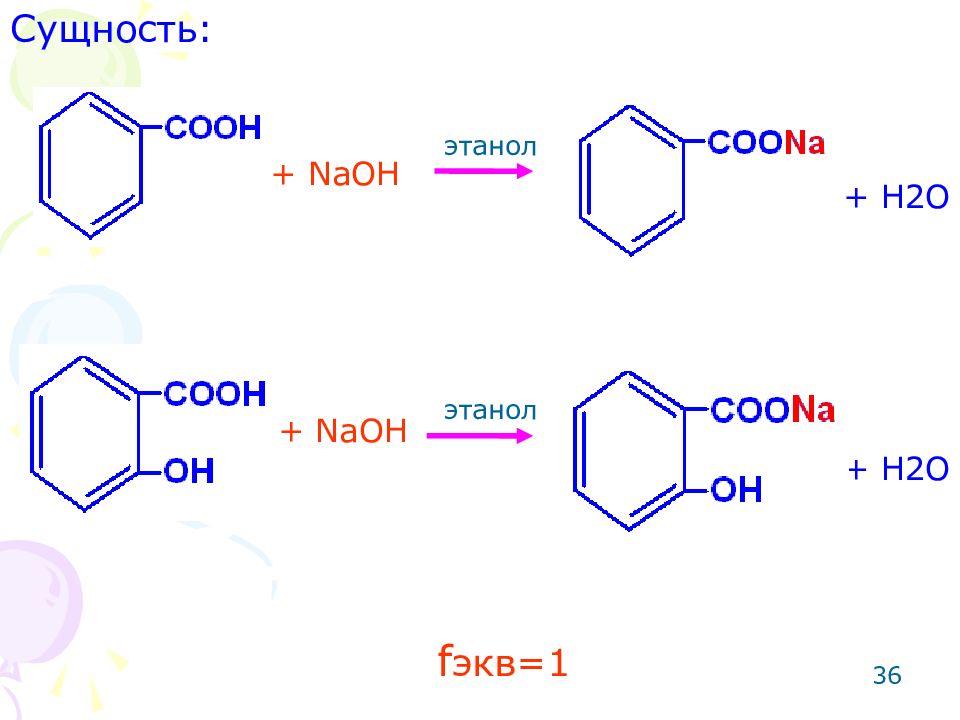
35 ОПРЕДЕЛЕНИЕ БЕНЗОЙНОЙ И САЛИЦИЛОВОЙ КИСЛОТ Метод: алкалиметрический. Способ: прямое титрование. Среда: этанол (для лучшего растворения навески препарата и подавления гидролиза соли, образованной сильным основанием и слабой кислотой). Метод основан на реакции нейтрализации. Примечание: если не добавить этанол, результаты будут занижены.
Слайд 37
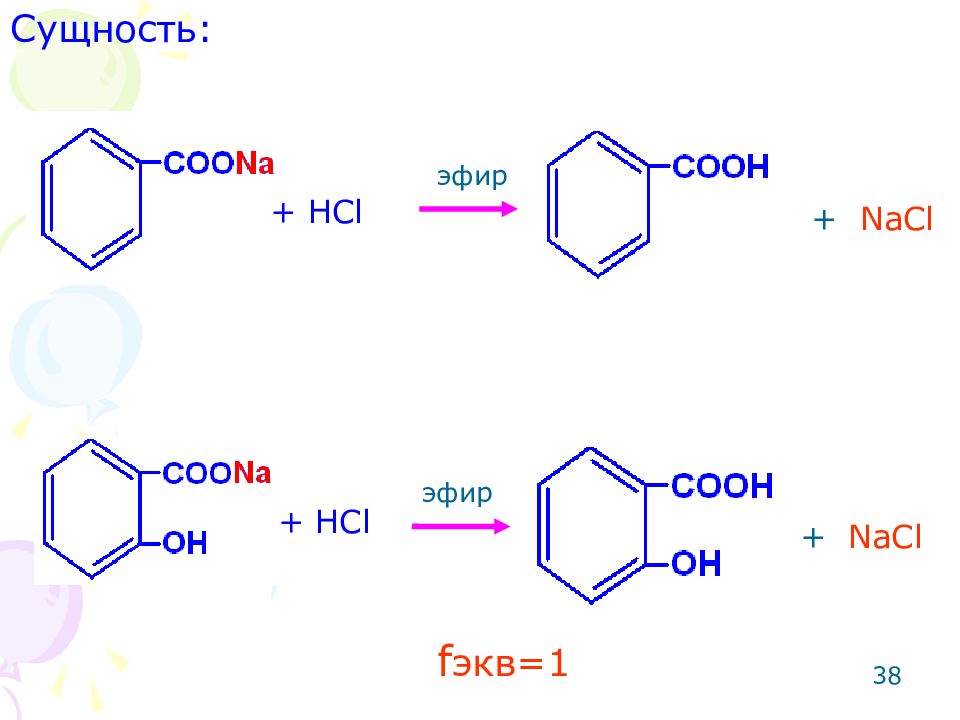
37 ОПРЕДЕЛЕНИЕ СОЛЕЙ БЕНЗОЙНОЙ И САЛИЦИЛОВОЙ КИСЛОТ Метод: ацидиметрический. Способ: прямое титрование. Среда: эфир (для извлечения из сферы реакции бензойной и салициловой кислот). Примечание: если не добавить эфир, результаты будут занижены, т.к в процессе титрования выделяется кислота и индикатор сменит окраску раньше, до точки эквивалентности.
Слайд 39
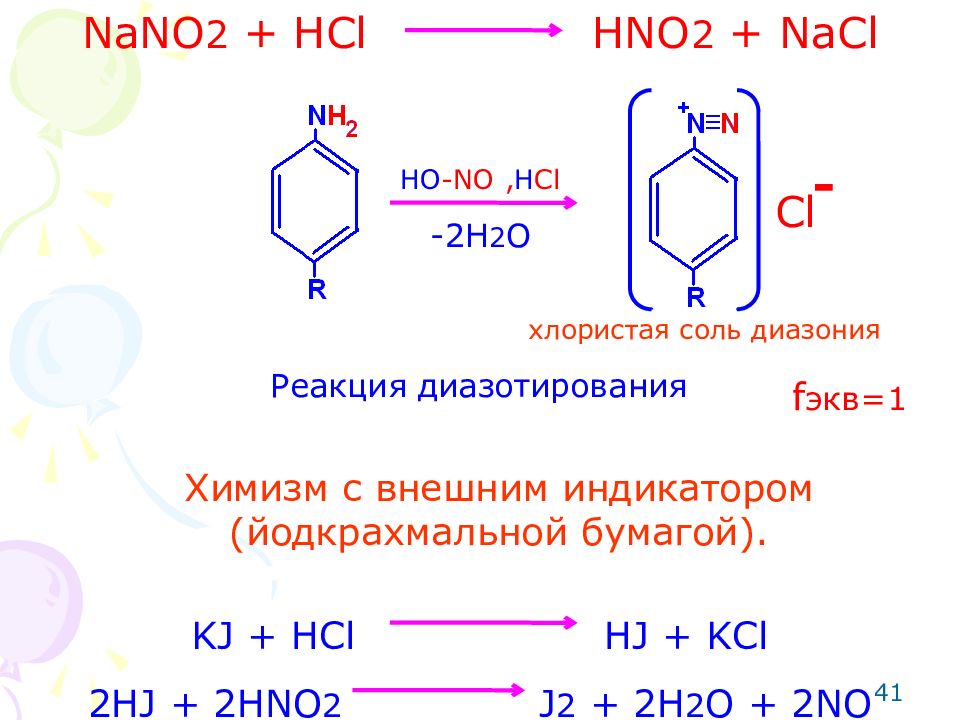
Метод: нитритометрия (по первичной ароматической аминогруппе- для бензокаина, прокаина, прокаинамида, метоклопрамида, сульфаниламидных препаратов ). Способ: прямое титрование. Индикаторы: внутренние – нейтральный красный, тропеолин ОО с метиленовым синим; внешний – йодкрахмальная бумага, пропитанная иодидом калия и крахмалом. Метод основан на реакции диазотирования. Диазотирующим агентом является азотистая кислота. Титрованным раствором служит нитрит натрия. 39
Слайд 40
Особенности: добавляют катализатор (калия бромид), т.к. реакция идет медленно. Реакцию проводят на холоду, т.к. при температуре 18-20 С азотистая кислота разрушается. Титрование сначала ведут медленно, со скоростью 1 мл в минуту, перед точкой эквивалентности (за 0.5 мл) переходят на скорость 0.05 мл в минуту. 40 0
Слайд 41
NaNO 2 + HCl HNO 2 + NaCl 41 HO -NO , H Cl Cl - - 2 H 2 O хлористая соль диазония Реакция диазотирования KJ + HCl HJ + KCl 2HJ + 2HNO 2 J 2 + 2H 2 O + 2NO f экв=1 Химизм с внешним индикатором (йодкрахмальной бумагой).
Слайд 42
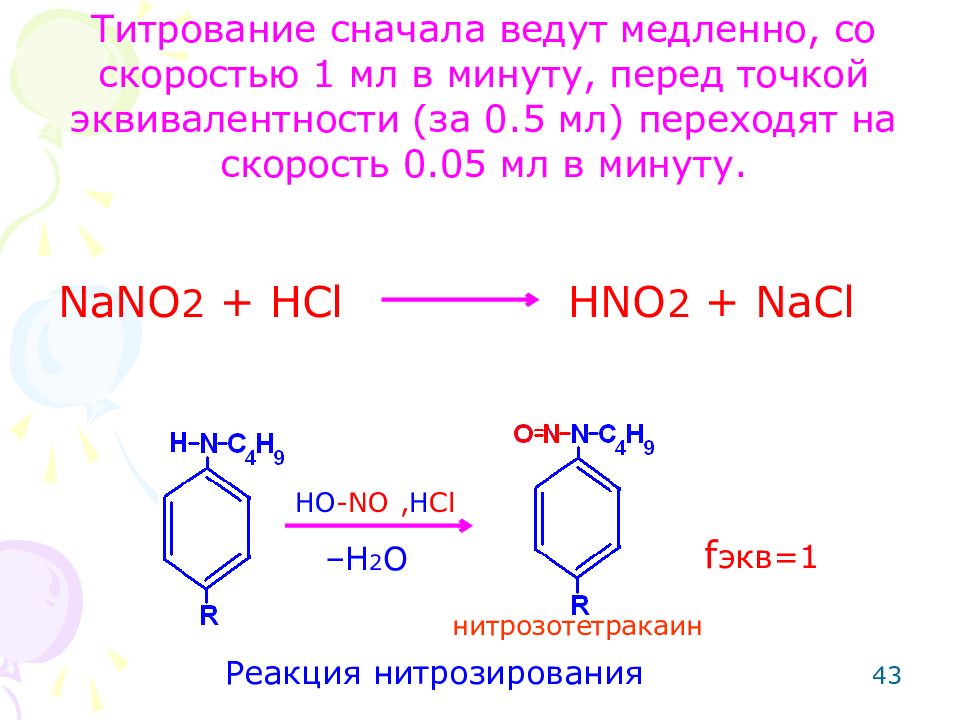
Метод: нитритометрия (по вторичной ароматической аминогруппы – для тетракаина гидрохлорида). Способ: прямое тирование. Метод основан на реакции нитрозирования. Особенности: добавляют катализатор (калия бромид), т.к. реакция идет медленно. Реакцию проводят на холоду, т.к. при температуре 18-20 С азотистая кислота разрушается. Нитрозирующим агентом является азотистая кислота. 0 42
Слайд 43
NaNO 2 + HCl HNO 2 + NaCl Реакция нитрозирования –H 2 O HO -NO , H Cl нитрозотетракаин f экв=1 Титрование сначала ведут медленно, со скоростью 1 мл в минуту, перед точкой эквивалентности (за 0.5 мл) переходят на скорость 0.05 мл в минуту. 43
Слайд 44
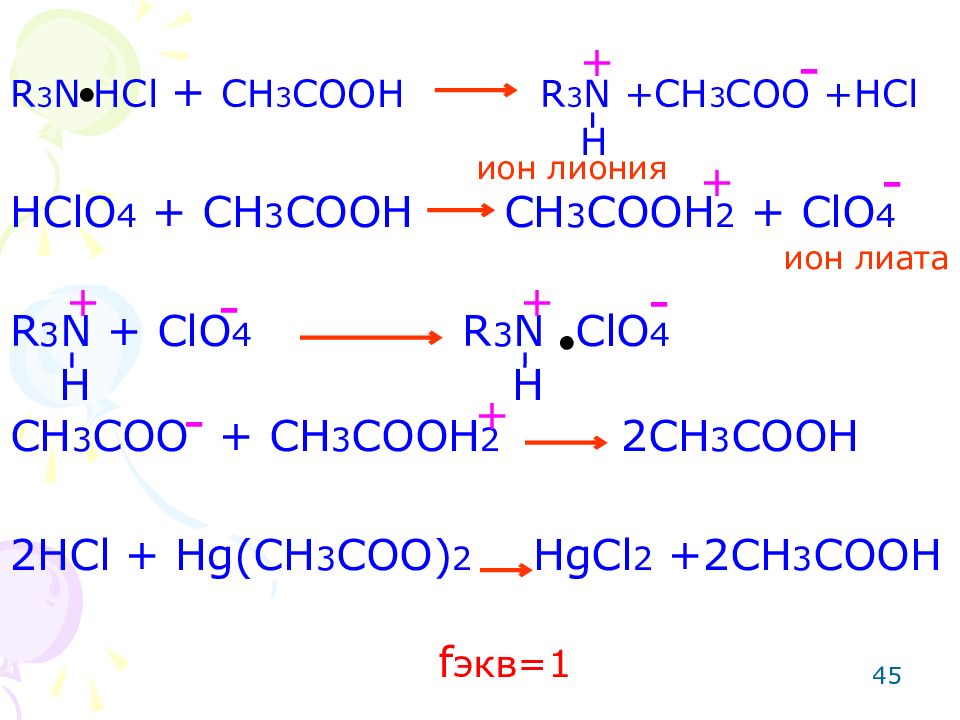
ОПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ СО СЛАБО-ОСНОВНЫМИ СВОЙСТВАМИ Метод: неводное титрование. Способ: прямое титрование. Титрант: хлорная кислота. Среда: протогенный растворитель, усиливающий слабые основные свойства (ледяная уксусная кислота, уксусный ангидрид). Метод основан на реакции кислотно-основного взаимодействия. 44
Слайд 45
R 3 N HCl + CH 3 COOH R 3 N + CH 3 COO +HCl HClO 4 + CH 3 COOH CH 3 COOH 2 + ClO 4 R 3 N + ClO 4 R 3 N ClO 4 CH 3 COO + CH 3 COOH 2 2CH 3 COOH 2HCl + Hg(CH 3 COO) 2 HgCl 2 +2CH 3 COOH 45 ● ● + - H ион лиония ион лиата + - H + - - + f экв=1 H + -
Слайд 46
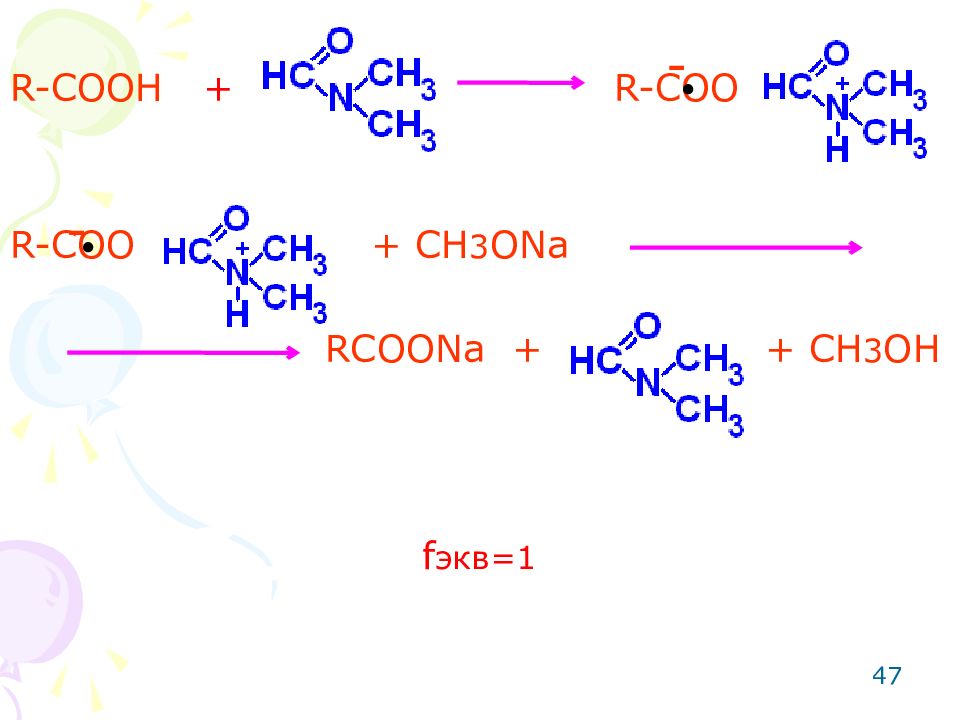
ОПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ СО СЛАБО-КИСЛОТНЫМИ СВОЙСТВАМИ Метод: неводное титрование. Способ: прямое титрование. Титрант: метилат натрия. Среда: протофильный растворитель, усиливающий слабые кислотные свойства (диметилформамид). Метод основан на реакции кислотно-основного взаимодействия. Этим методом можно определить фуросемид, фталазол, кислоту мефенаминовую. 46