Слайд 2
В основе строения ЛВ данной группы лежит ядро фурана – пятичленного цикла с атомом кислорода Подобно бензолу фуран обладает ароматическим характером и п/э вступает в р. замещения. Наибольшее значение для медицины представляют 5-нитрозамещенные фурана. Наличие нитрогоуппы придает антибактериаль-ные свойства. Если в положение 3 ввести еще нитрогруппу, то активность снижается. 2
Слайд 3
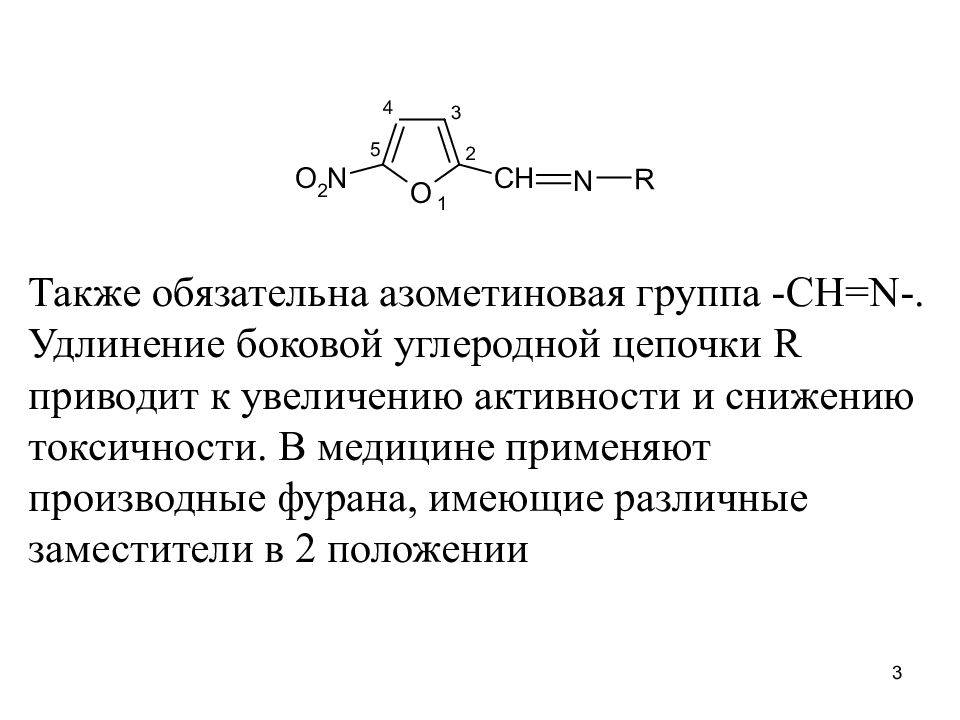
Также обязательна азометиновая группа -CH=N-. Удлинение боковой углеродной цепочки R приводит к увеличению активности и снижению токсичности. В медицине применяют производные фурана, имеющие различные заместители в 2 положении 3
Слайд 5
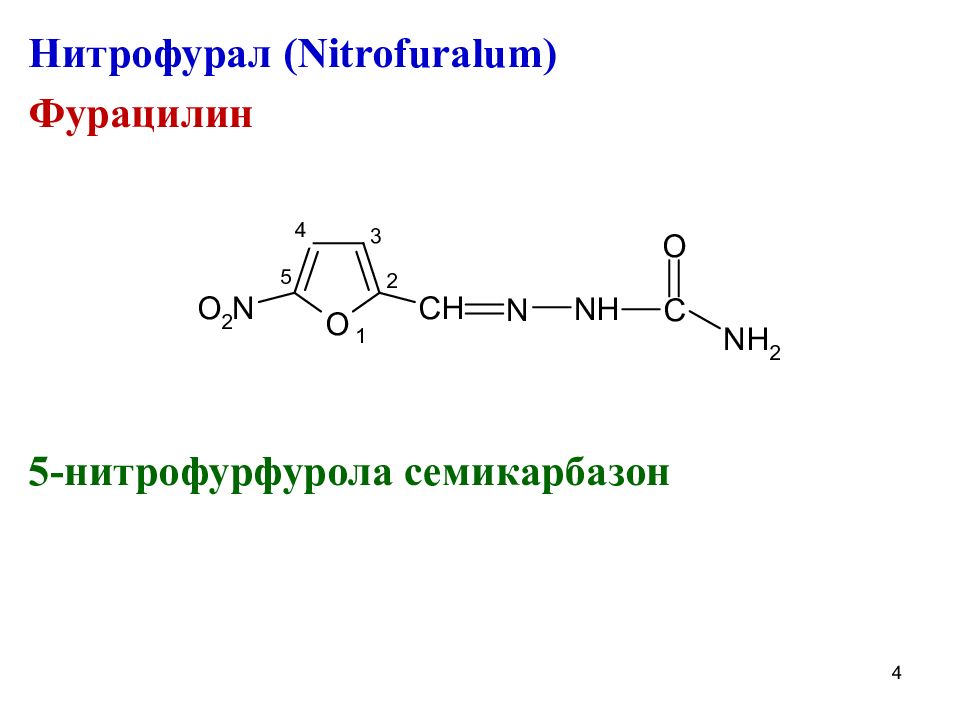
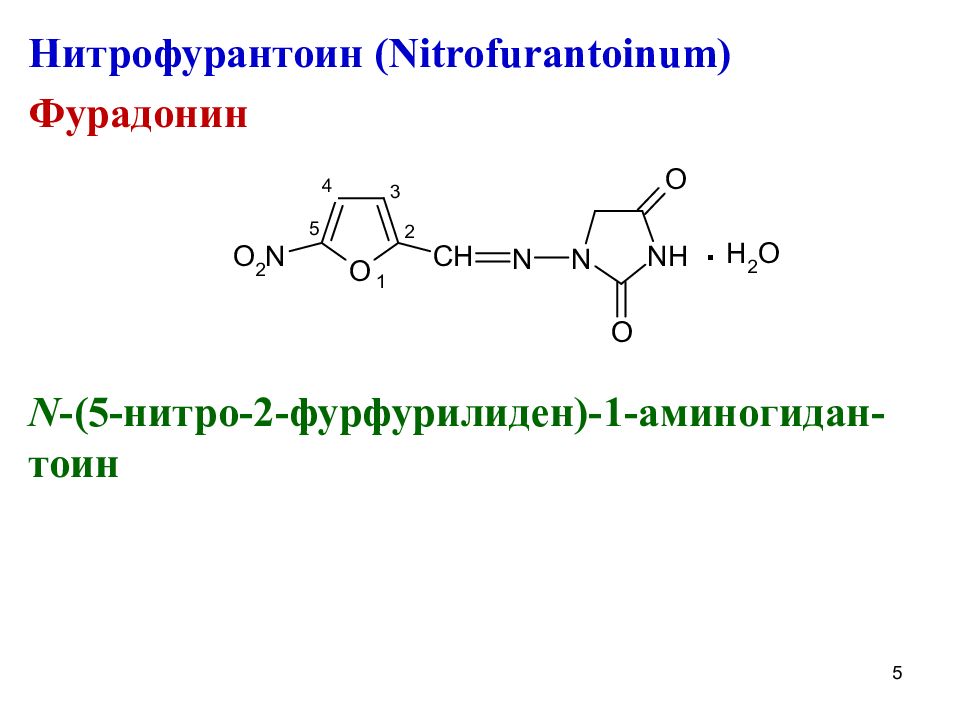
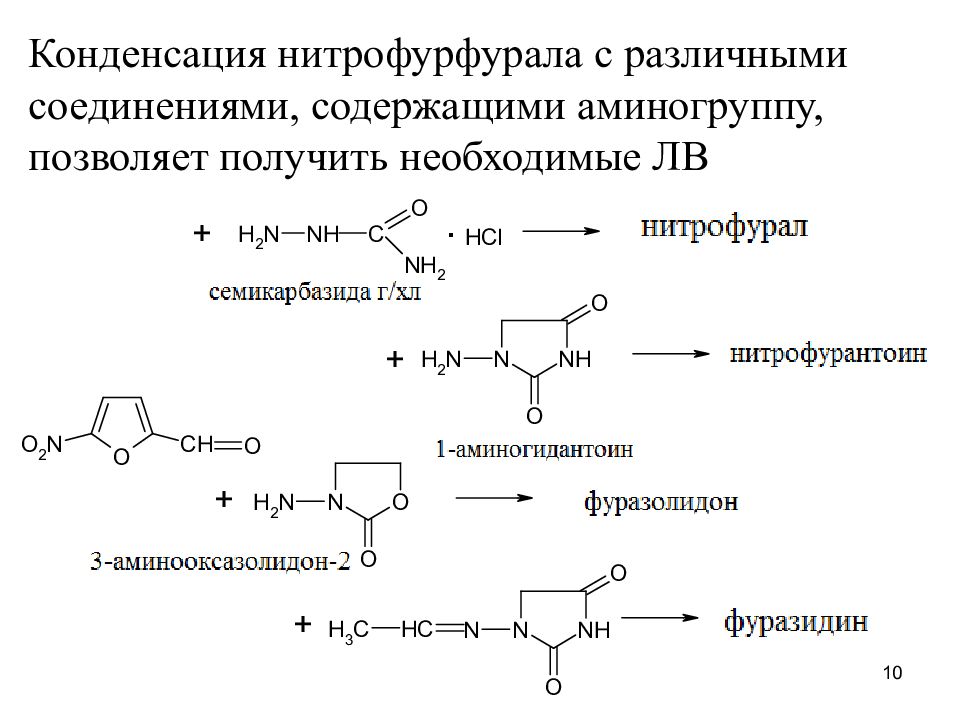
Нитрофурантоин ( Nitrofurantoinum) Фурадонин N -(5- нитро-2-фурфурилиден)-1-аминогидан-тоин 5
Слайд 6
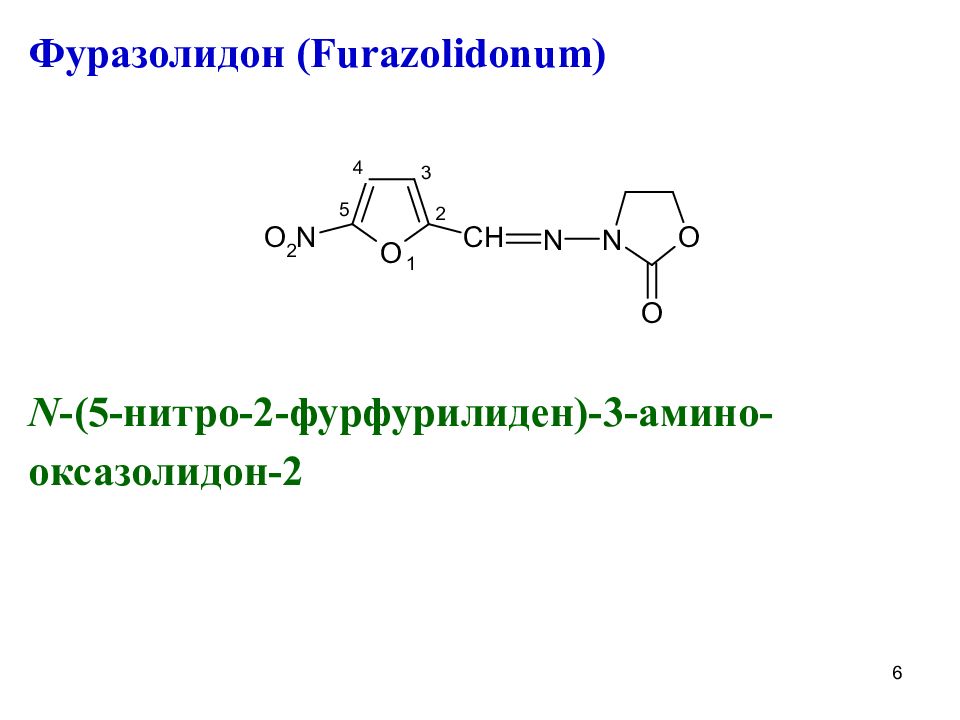
Фуразолидон ( Furazolidon u m) N -(5- нитро-2-фурфурилиден)-3-амино- оксазолидон-2 6
Слайд 7
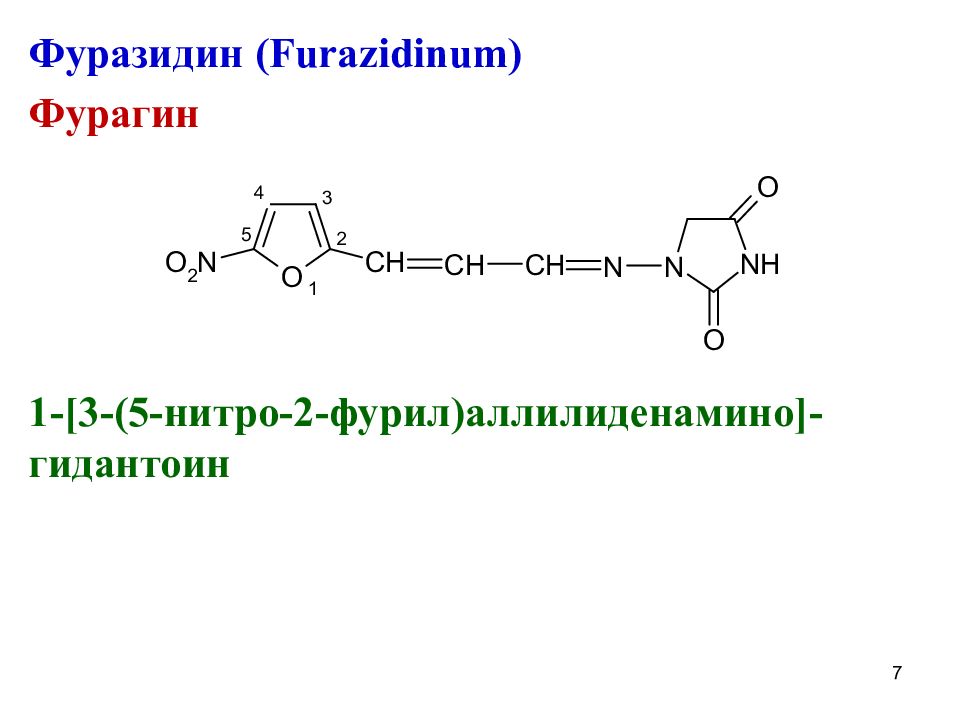
Фуразидин ( Furazidinum) Фурагин 1 -[3 - (5- нитро-2-фурил)аллилиденамино ] -гидантоин 7
Слайд 8
Это желтые с зеленоватым (нитрофурал, нитрофрантоин, фуразолидон) или оранжевым оттенком (фуразидин) кристаллические вещества, без запаха, горького вкуса, о.м.р. воде и спирте. Ввиду наличия нитро и амидной групп нитрофурал имеет в растворах кислую реакцию и лучше других растворяется в щелочах Фуразидин растворимый содержит 10% калиевой соли фуразидина и 90% NaCl 8
Слайд 9
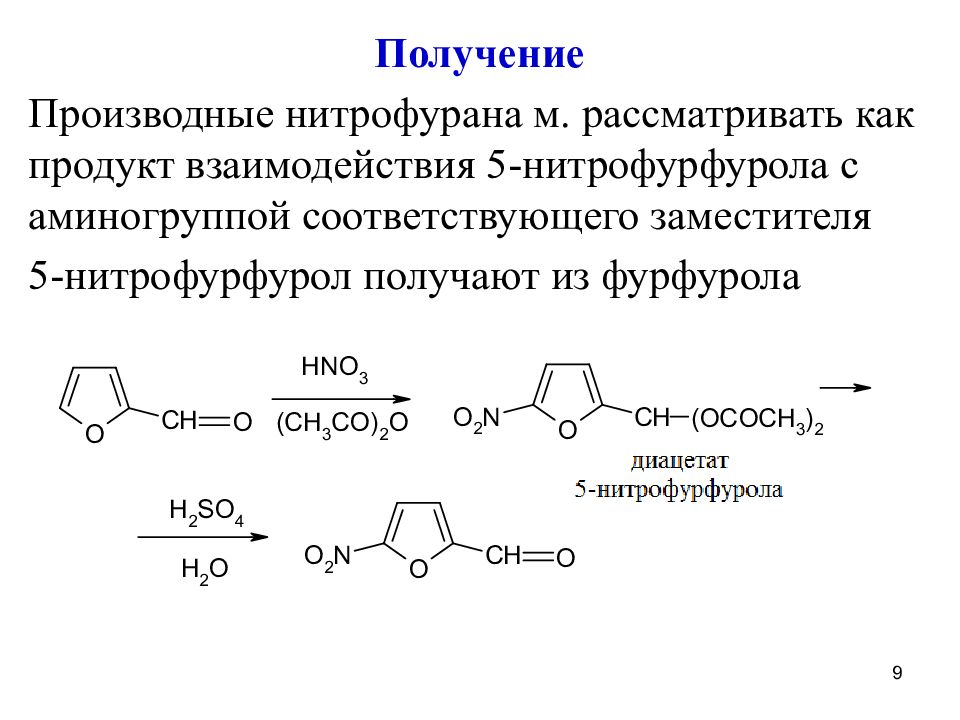
Получение Производные нитрофурана м. рассматривать как продукт взаимодействия 5-нитрофурфурола с аминогруппой соответствующего заместителя 5-нитрофурфурол получают из фурфурола 9
Слайд 10
Конденсация нитрофурфурала с различными соединениями, содержащими аминогруппу, позволяет получить необходимые ЛВ 10
Слайд 13
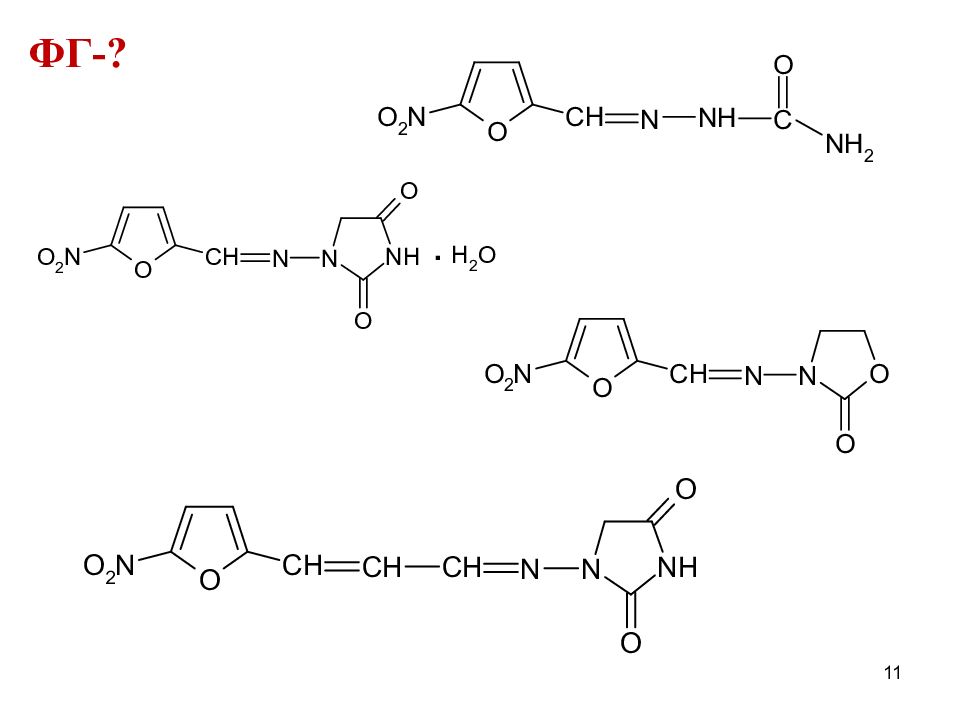
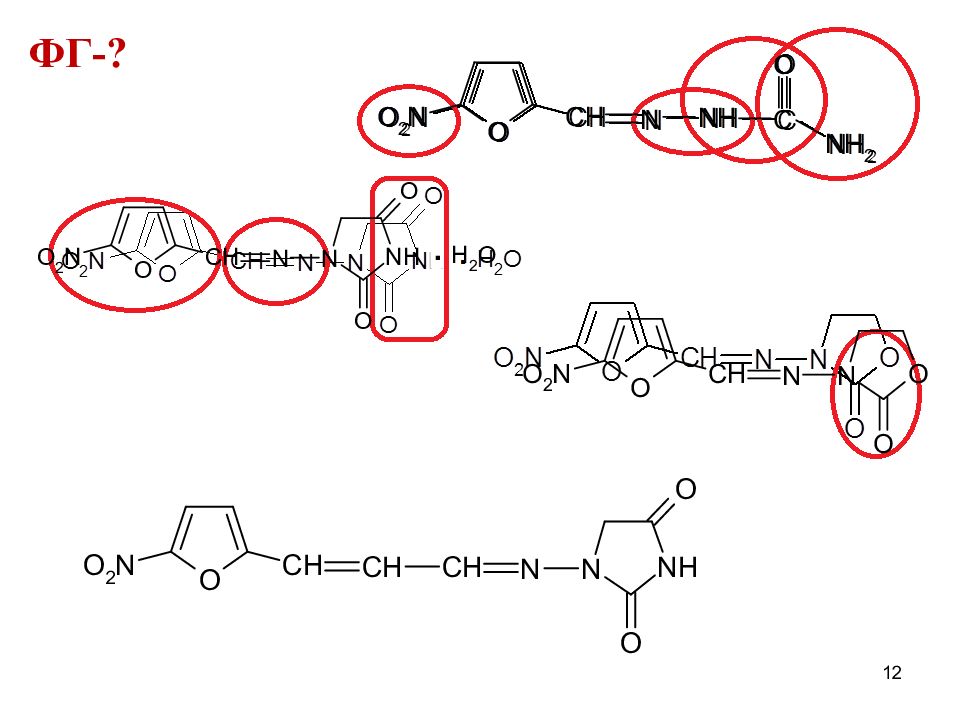
ФГ ядро нитофурана нитрогруппа азометиновая группа -CH=N- амидные группы (замещ-я и незамещ-я) гидразиновая связь = N-NH- имидная группа -С O-NH-CO- у нитрофуран- тоина и фуразидина сложноэфирная группа в лактамном кольце фуразолидона 13
Слайд 14
Качественный анализ 1. Определяют Т плавления (нитрофурантоин и фуразолидон плавятся с разложением) 2. СПФ в УФ- и видимой области спектра ( NO 2 - гр., двойные связи – наличие сопряженных связей в структуре данных ЛВ обуславливает их окраску) 3. ИК-спектроскопия 14
Слайд 15
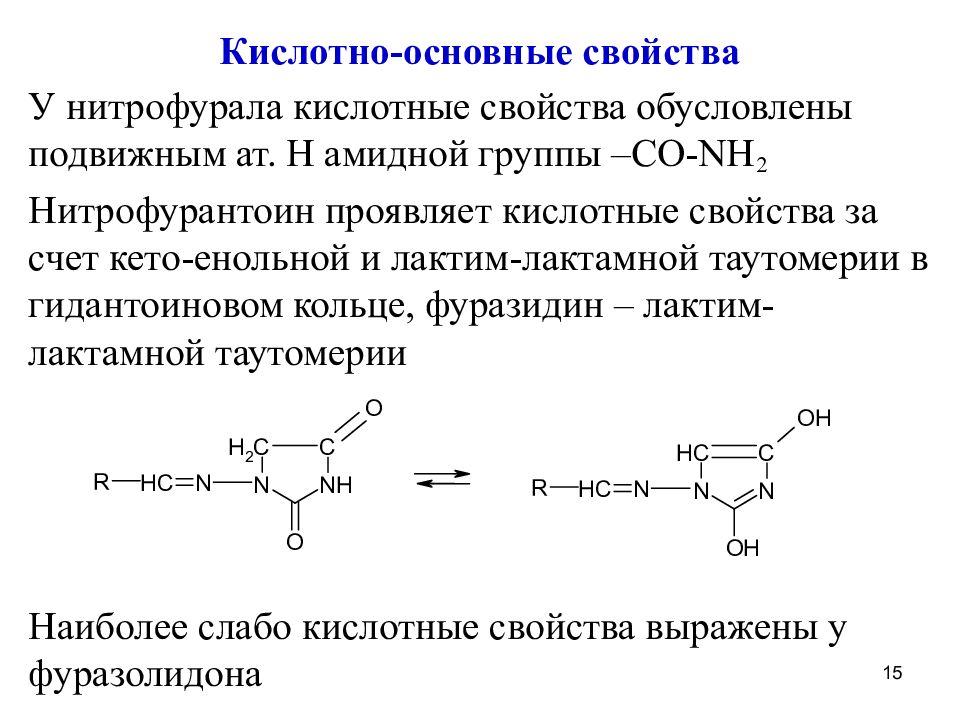
Кислотно-основные свойства У нитрофурала кислотные свойства обусловлены подвижным ат. H амидной группы – CO-NH 2 Нитрофурантоин проявляет кислотные свойства за счет кето- енольной и лактим-лактамной таутомерии в гидантоиновом кольце, фуразидин – лактим-лактамной таутомерии Наиболее слабо кислотные свойства выражены у фуразолидона 15
Слайд 16
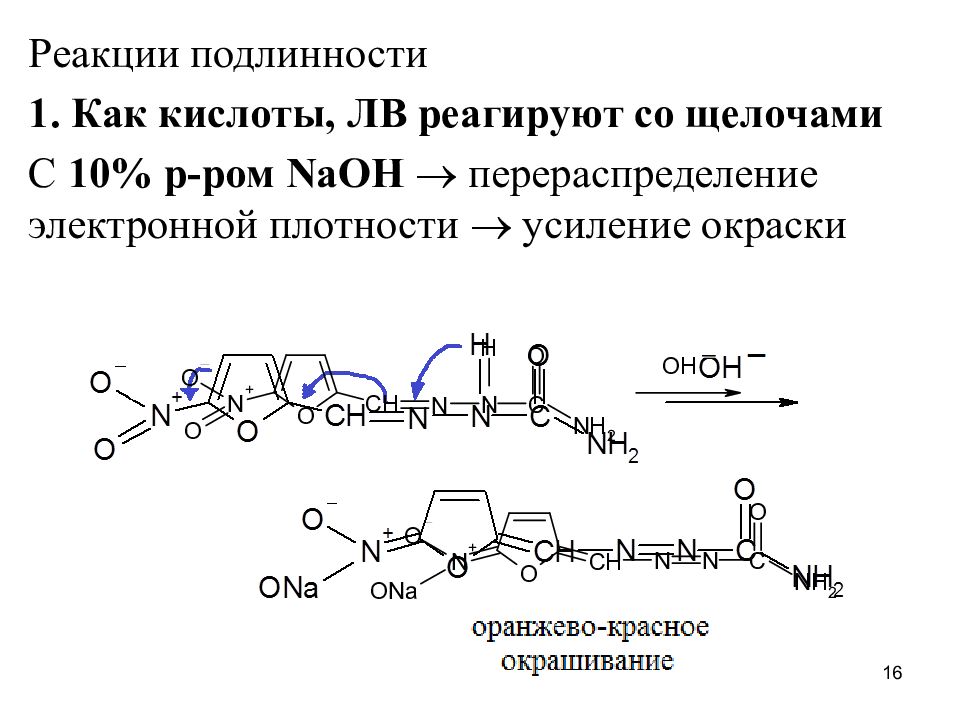
Реакции подлинности 1. Как кислоты, ЛВ реагируют со щелочами С 10% р-ром NaOH перераспределение электронной плотности усиление окраски 16
Слайд 17
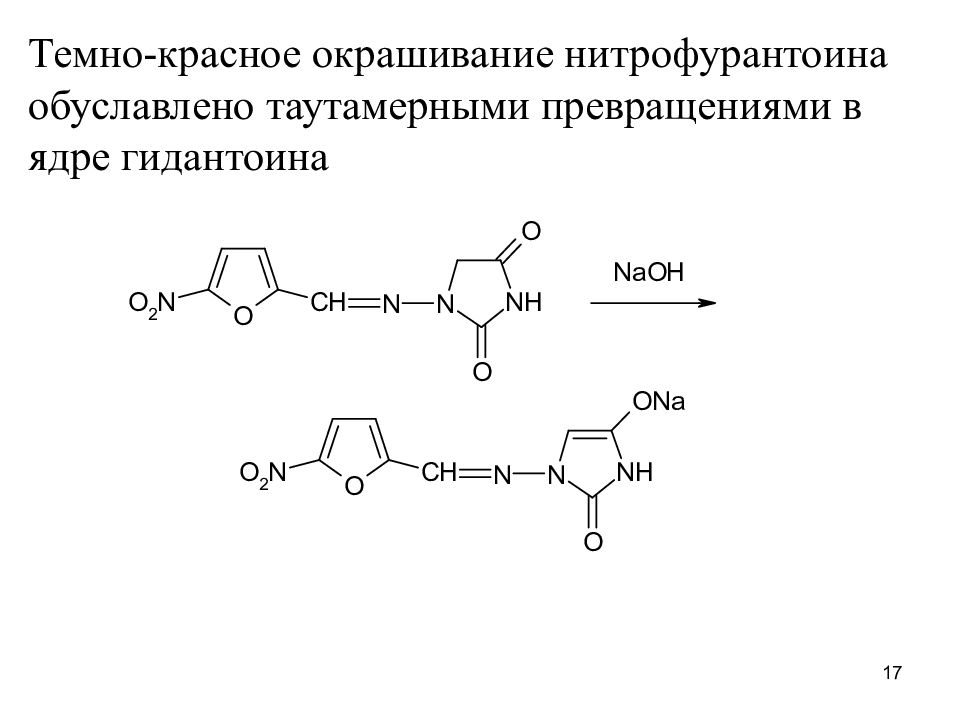
Темно-красное окрашивание нитрофурантоина обуславлено таутамерными превращениями в ядре гидантоина 17
Слайд 18
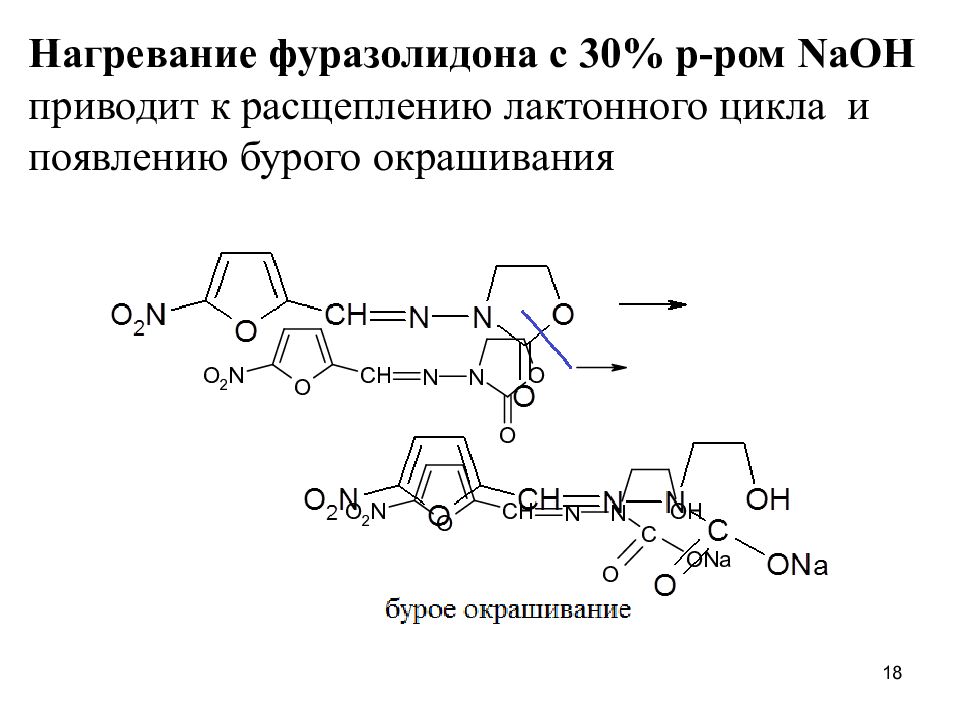
Нагревание фуразолидона с 30% р-ром NaOH приводит к расщеплению лактонного цикла и появлению бурого окрашивания 18
Слайд 19
2. За счет кислотных свойств все пр-ные фурана растворяются в протофильных растворителях (пиридин, ДМФА), образуя окрашенные анионы, которые с катионами щелочных металлов образуют соли различной окраски Нитрофурантоин + ДМФА + сп. р-р KOH коричнево-желтое окрашивание Фуразолидон + ДМФА + сп. р-р KOH фиолетовое окрашивание 19
Слайд 20
Отличить производные нитрофурана друг от друга можно по окраске со спиртовым раствором KOH в сочетании с ацетоном нитрофурал темно-красное окрашивание нитрофурантоин зеленовато-желтое, переходящее в бурое, затем в бурый осадок фуразолидон постепенно появляющееся красное окрашивание, переходящее в бурое фуразидин красное окрашивание, затем красный осадок 20
Слайд 21
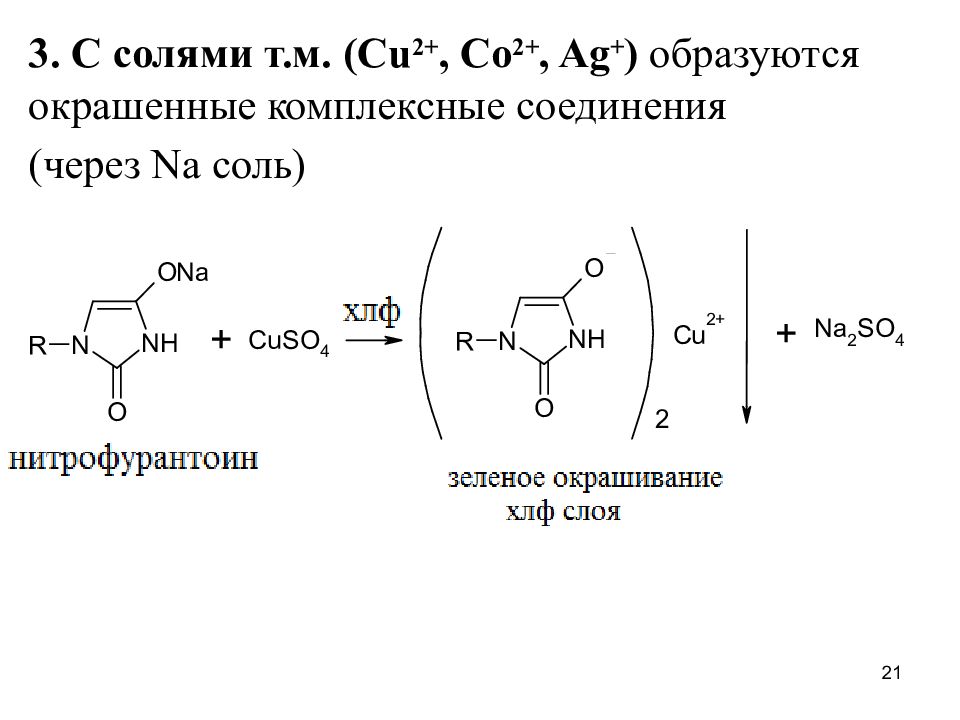
3. С солями т.м. ( Cu 2+, Co 2+, Ag + ) образуются окрашенные комплексные соединения (через Na соль) 21
Слайд 22
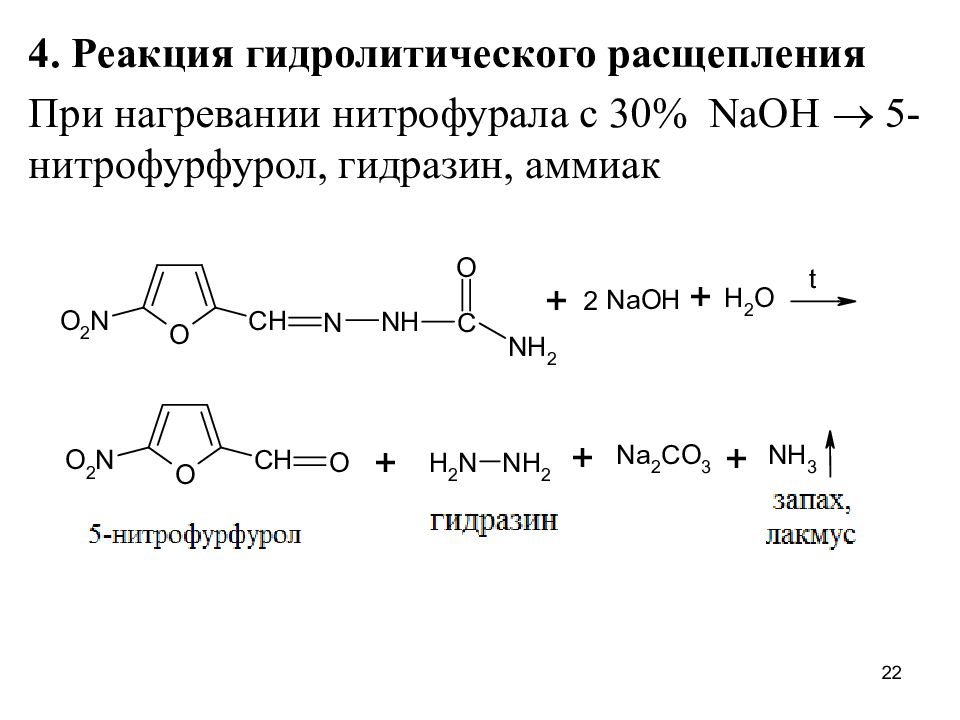
4. Реакция гидролитического расщепления При нагревании нитрофурала с 30% NaOH 5-нитрофурфурол, гидразин, аммиак 22
Слайд 23
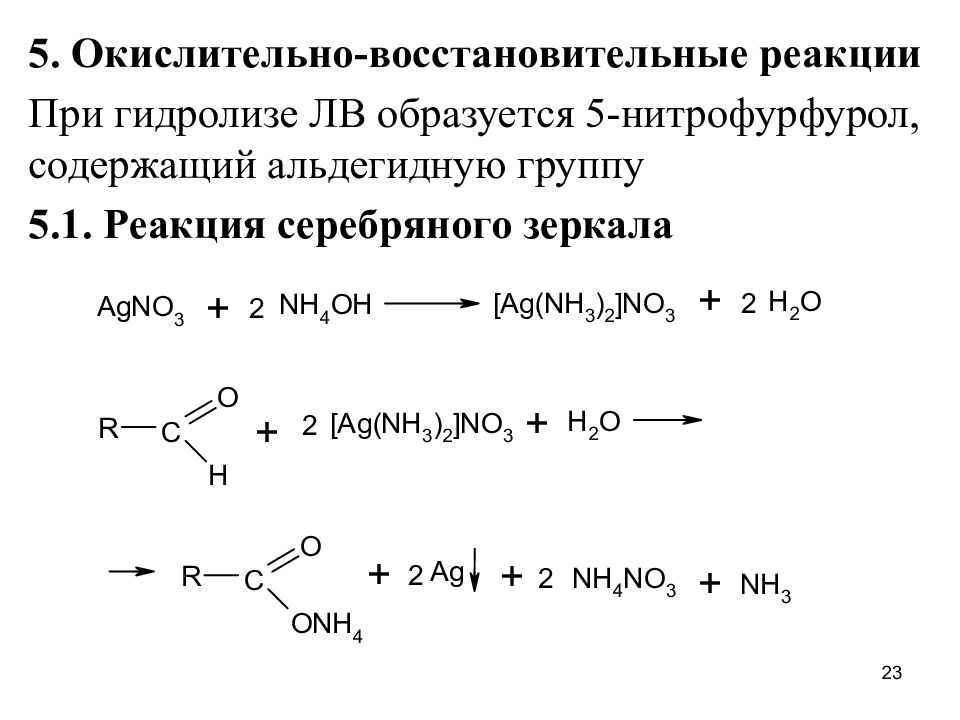
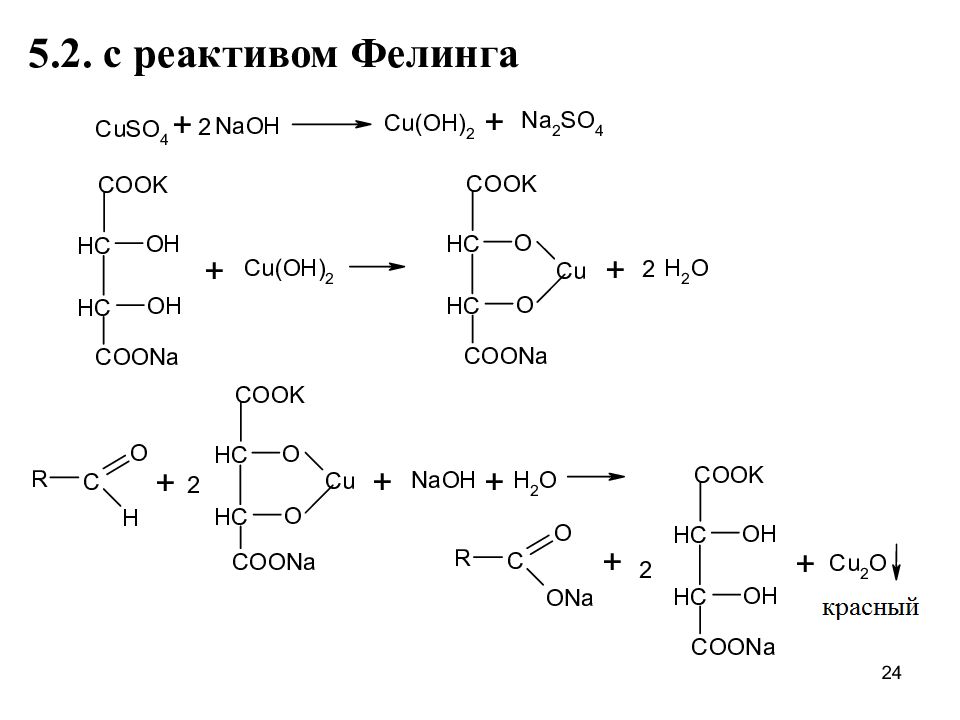
5. Окислительно-восстановительные реакции При гидролизе ЛВ образуется 5-нитрофурфурол, содержащий альдегидную группу 5.1. Реакция серебряного зеркала 23
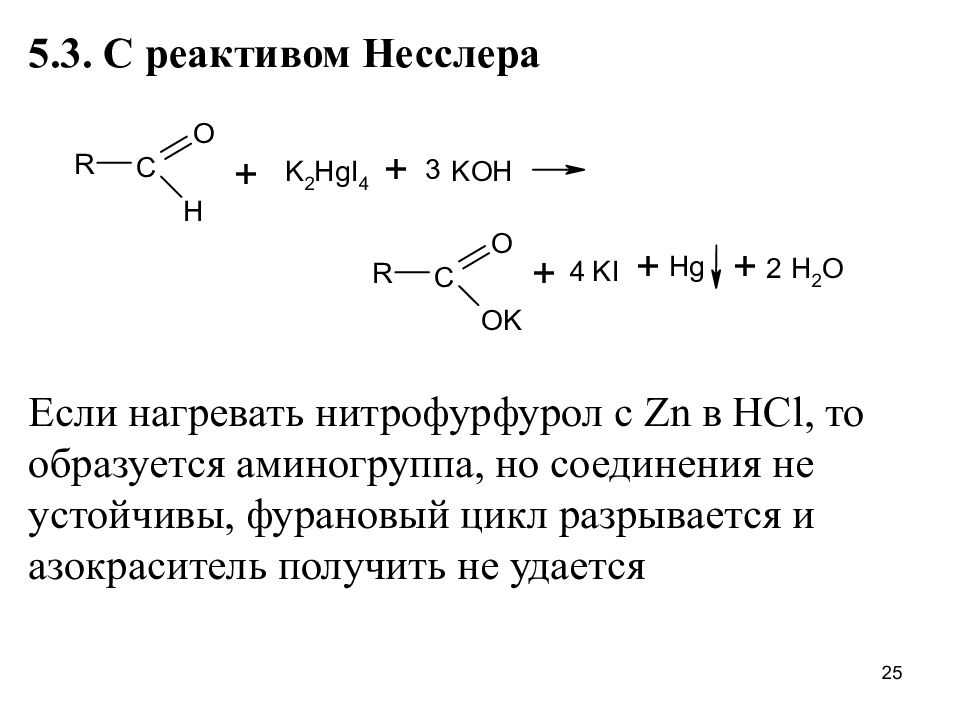
Слайд 25
5.3. С реактивом Несслера Если нагревать нитрофурфурол с Zn в HCl, то образуется аминогруппа, но соединения не устойчивы, фурановый цикл разрывается и азокраситель получить не удается 25
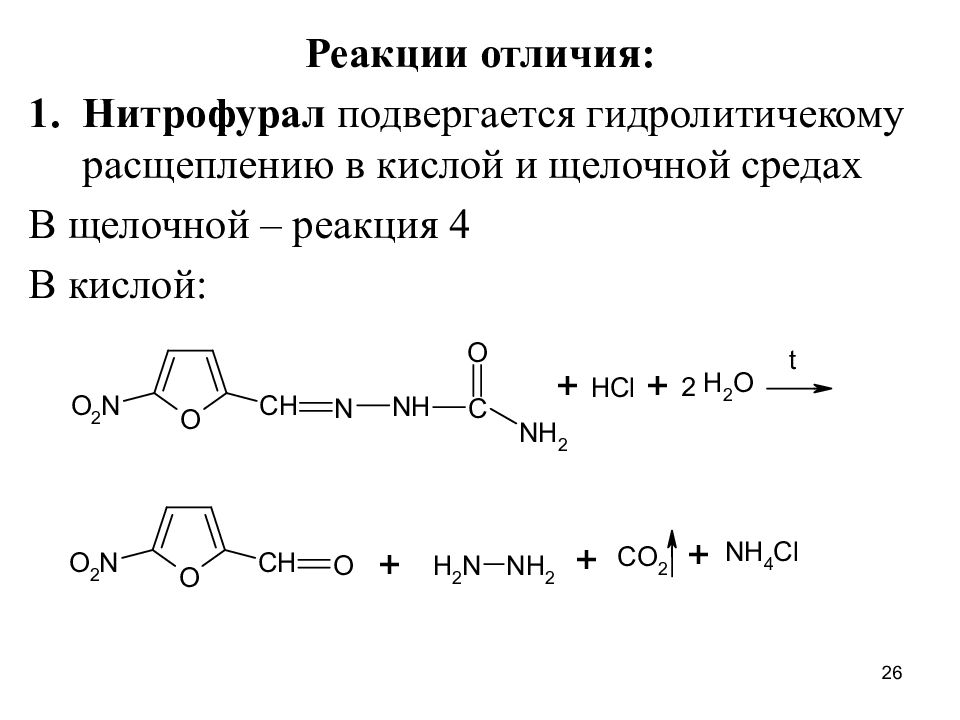
Слайд 26
Реакции отличия: Нитрофурал подвергается гидролитичекому расщеплению в кислой и щелочной средах В щелочной – реакция 4 В кислой: 26
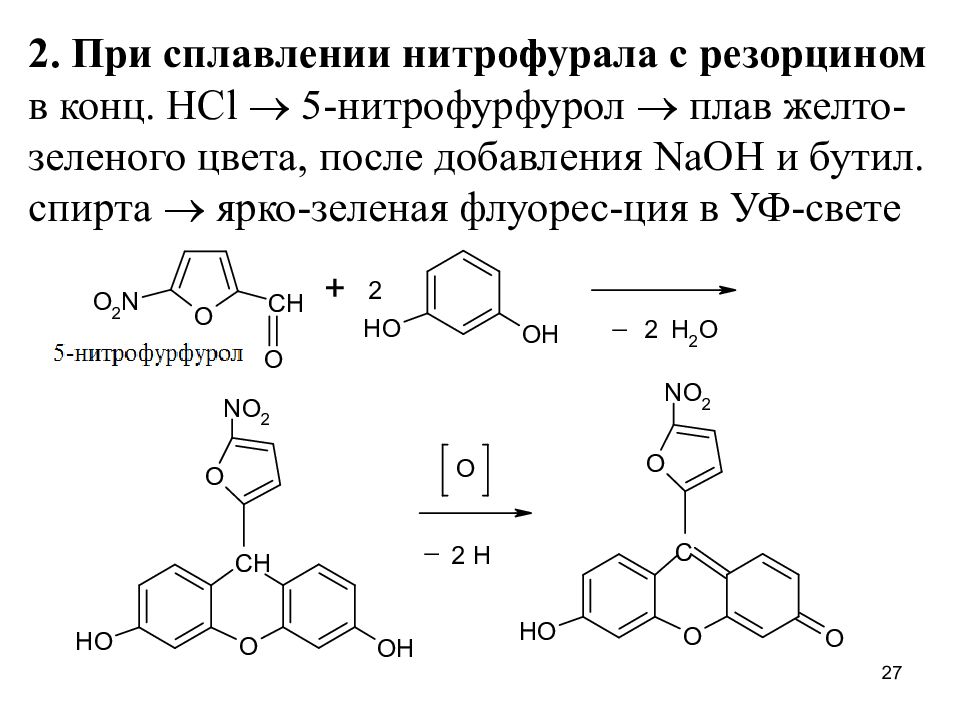
Слайд 27
2. При сплавлении нитрофурала с резорцином в конц. HCl 5-нитрофурфурол плав желто-зеленого цвета, после добавления NaOH и бутил. спирта ярко-зеленая флуорес-ция в УФ-свете 27
Слайд 28
Примеси В ЛВ устанавливают содержание посторонних примесей – ТСХ (доп) В фуразидине определяют отсутствие легкообугливающихся (при 250 о С) примесей 28
Слайд 29
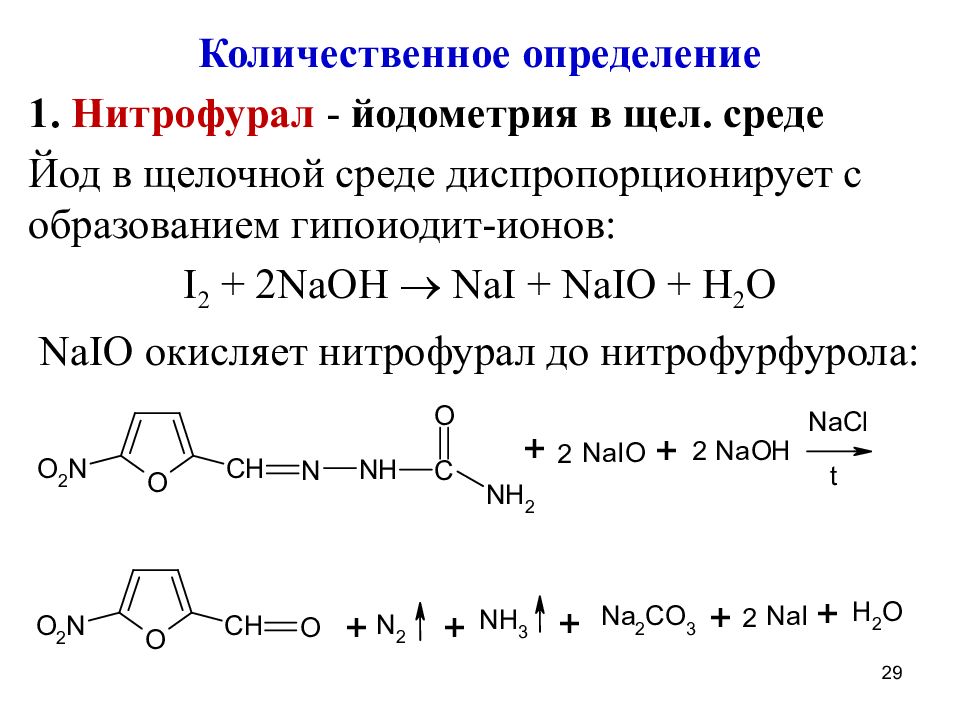
Количественное определение 1. Нитрофурал - йодометрия в щел. среде Йод в щелочной среде диспропорционирует с образованием гипоиодит-ионов: I 2 + 2NaOH NaI + NaIO + H 2 O NaIO окисляет нитрофурал до нитрофурфурола: 29
Слайд 30
Растворимость нитрофурала в воде улучшают добавлением NaCl и нагреванием Далее р-р подкисляют и выделившийся йод титруют тиосульфатом натрия NaI + NaIO + H 2 SO 4 I 2 + Na 2 SO 4 + H 2 O I 2 + Na 2 S 2 O 3 2NaI + Na 2 S 4 O 6 Ind – крахмал, || к.о. f экв (нитрофурала) = ? 30
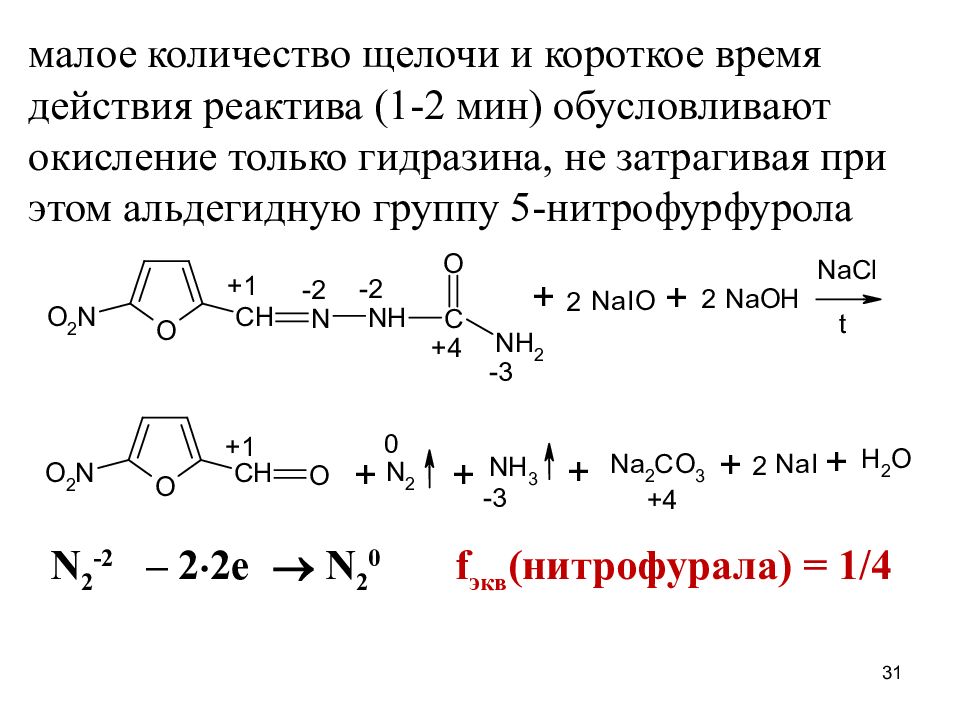
Слайд 31
малое количество щелочи и короткое время действия реактива (1-2 мин) обусловливают окисление только гидразина, не затрагивая при этом альдегидную группу 5-нитрофурфурола N 2 -2 – 2 2e N 2 0 f экв (нитрофурала) = 1/4 31
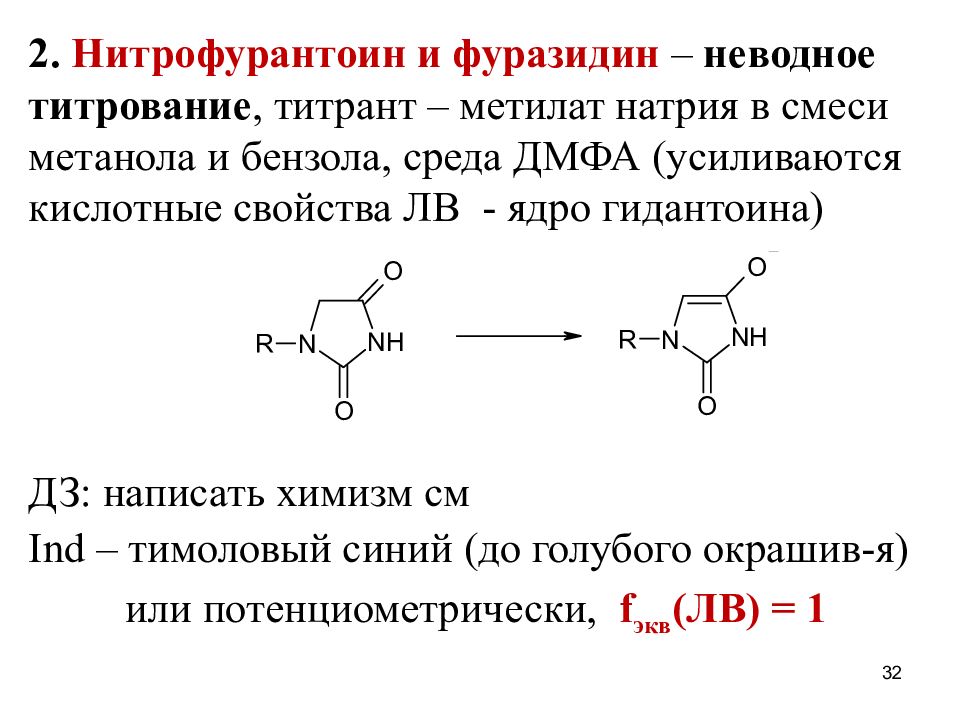
Слайд 32
2. Нитрофурантоин и фуразидин – неводное титрование, титрант – метилат натрия в смеси метанола и бензола, среда ДМФА (усиливаются кислотные свойства ЛВ - ядро гидантоина) ДЗ: написать химизм см Ind – тимоловый синий (до голубого окрашив-я) или потенциометрически, f экв (ЛВ) = 1 32
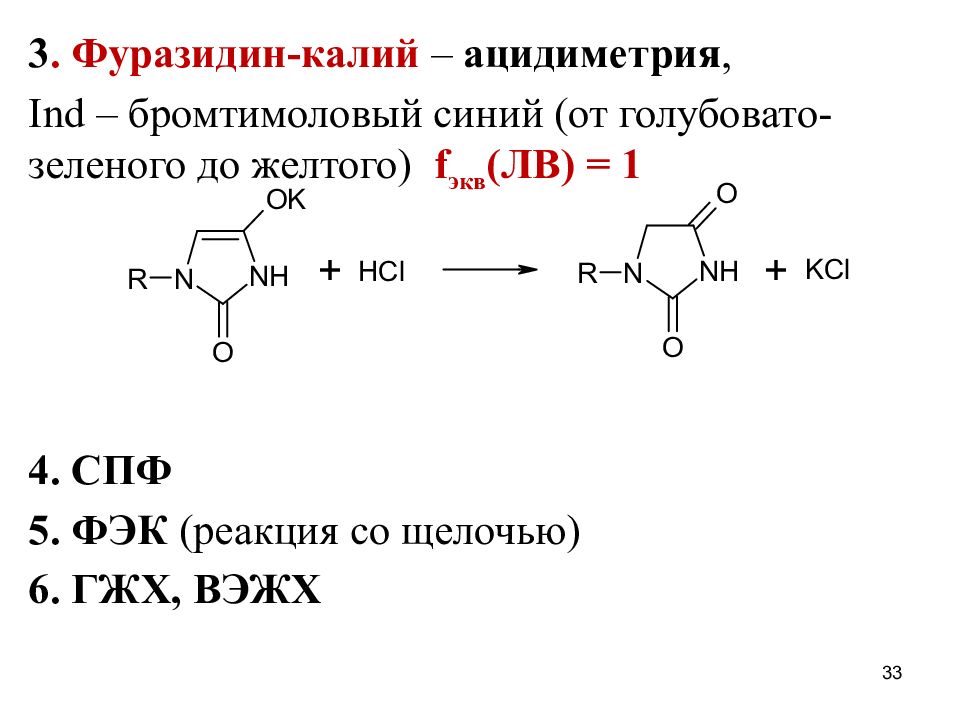
Слайд 33
3. Фуразидин-калий – ацидиметрия, Ind – бромтимоловый синий (от голубовато-зеленого до желтого) f экв (ЛВ) = 1 4. СПФ 5. ФЭК (реакция со щелочью) 6. ГЖХ, ВЭЖХ 33
Слайд 34
Хранение Список, в ХУТ в банках темного стекла, в прохладном месте Под действием света происходит необратимое разрушение фуранового цикла (фотодеструкция), Под действием влаги легко гидролизуются Применение Антибактериальные средства Фуразолидон – антибактериальное и антипротозойное средство 34
Слайд 35
ЛФ: нитрофурал – таблетки, мазь Нитрофурантоин, фуразолидон и фуразидин – таблетки Фуразидин растворимый – таблетки, капсулы, смесь для приготовления р-ра местного применения 35
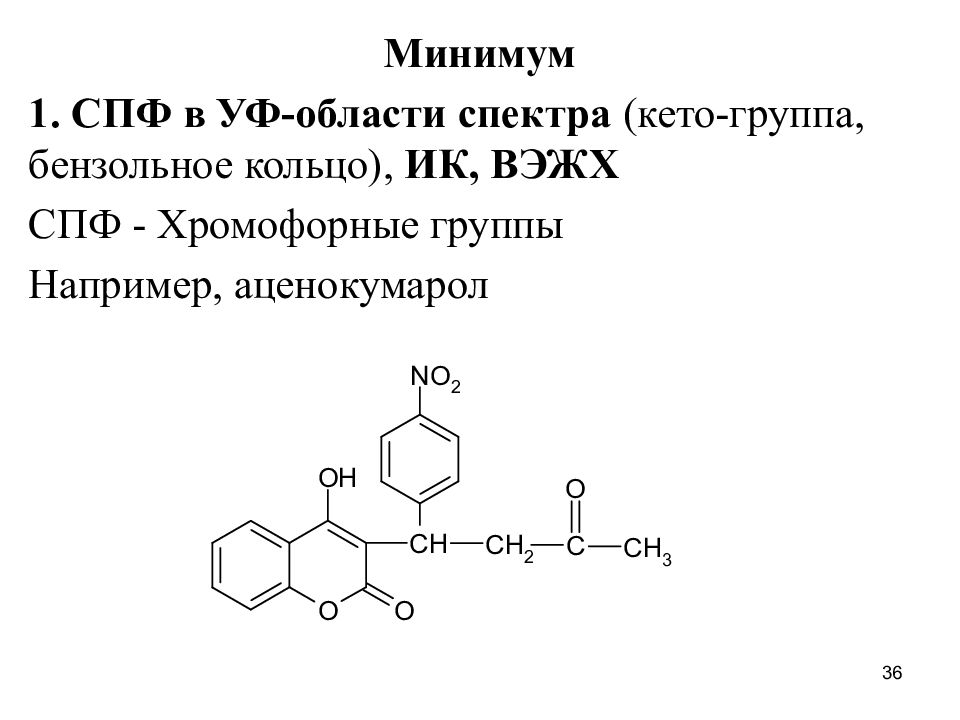
Слайд 36
Минимум 1. СПФ в УФ-области спектра (кето-группа, бензольное кольцо), ИК, ВЭЖХ СПФ - Хромофорные группы Например, аценокумарол 36
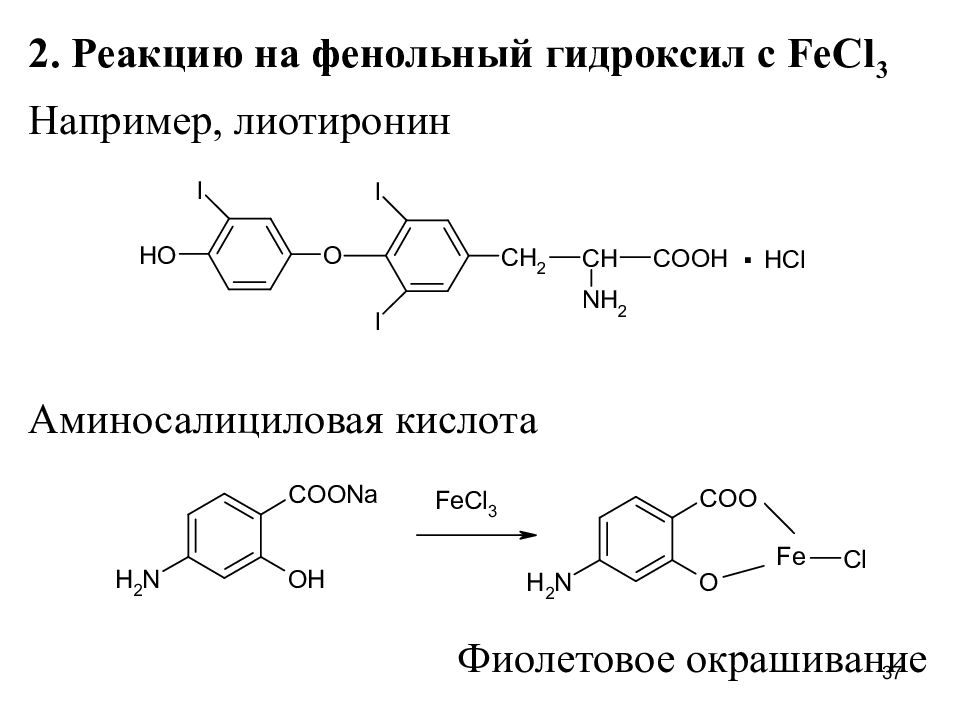
Слайд 37
2. Реакцию на фенольный гидроксил с F e Cl 3 Например, лиотиронин Аминосалициловая кислота Фиолетовое окрашивание 37
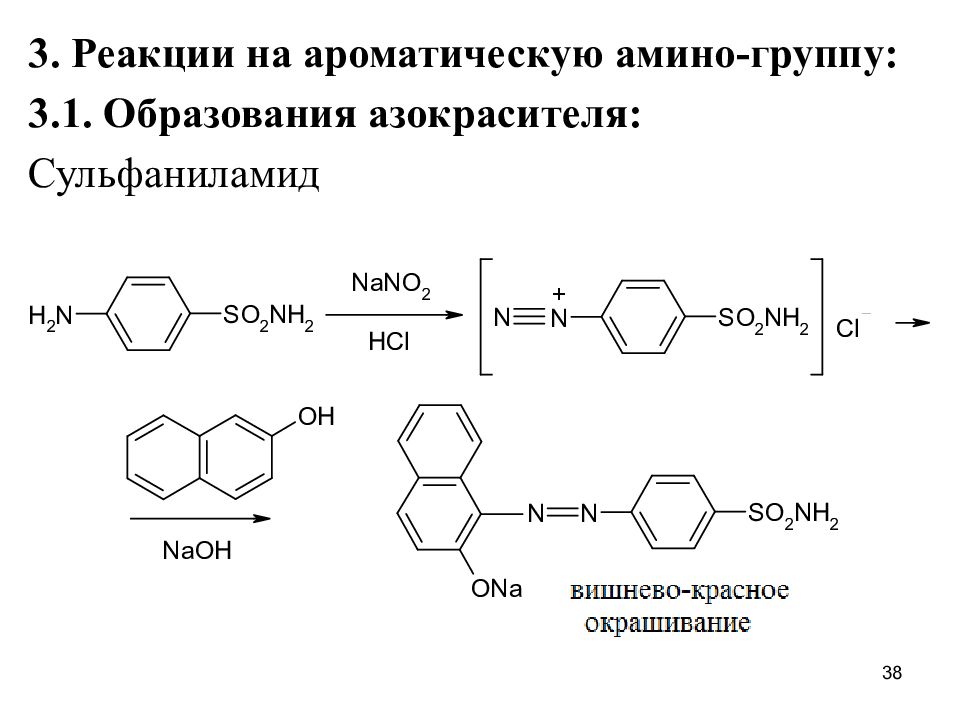
Слайд 38
3. Реакции на ароматическую амино-группу: 3.1. Образования азокрасителя: Сульфаниламид 38
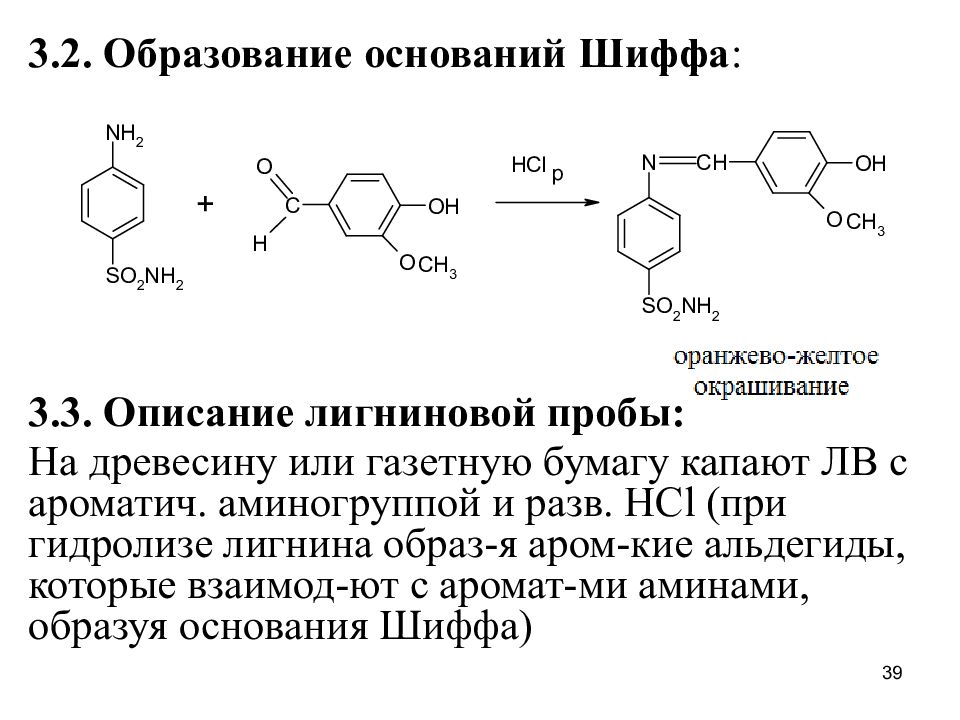
Слайд 39
3.2. Образование оснований Шиффа : 3.3. Описание лигниновой пробы: На древесину или газетную бумагу капают ЛВ с ароматич. аминогруппой и разв. HCl ( при гидролизе лигнина образ-я аром-кие альдегиды, которые взаимод-ют с аромат-ми аминами, образуя основания Шиффа) 39
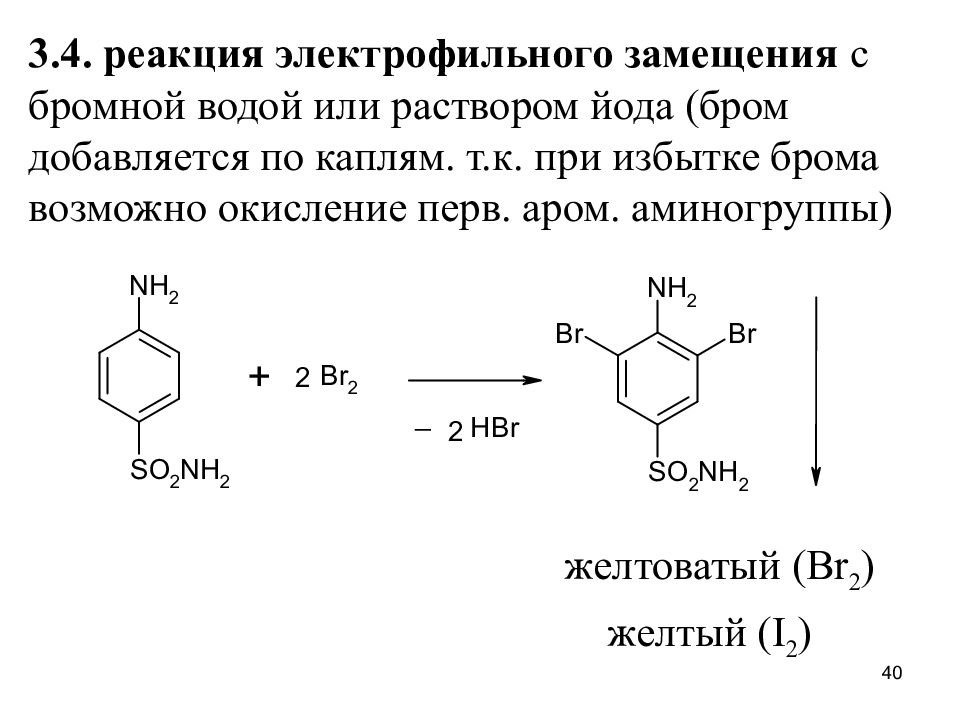
Слайд 40
3.4. реакция электрофильного замещения с бромной водой или раствором йода (бром добавляется по каплям. т.к. при избытке брома возможно окисление перв. аром. аминогруппы) желтоватый ( Br 2 ) желтый ( I 2 ) 40
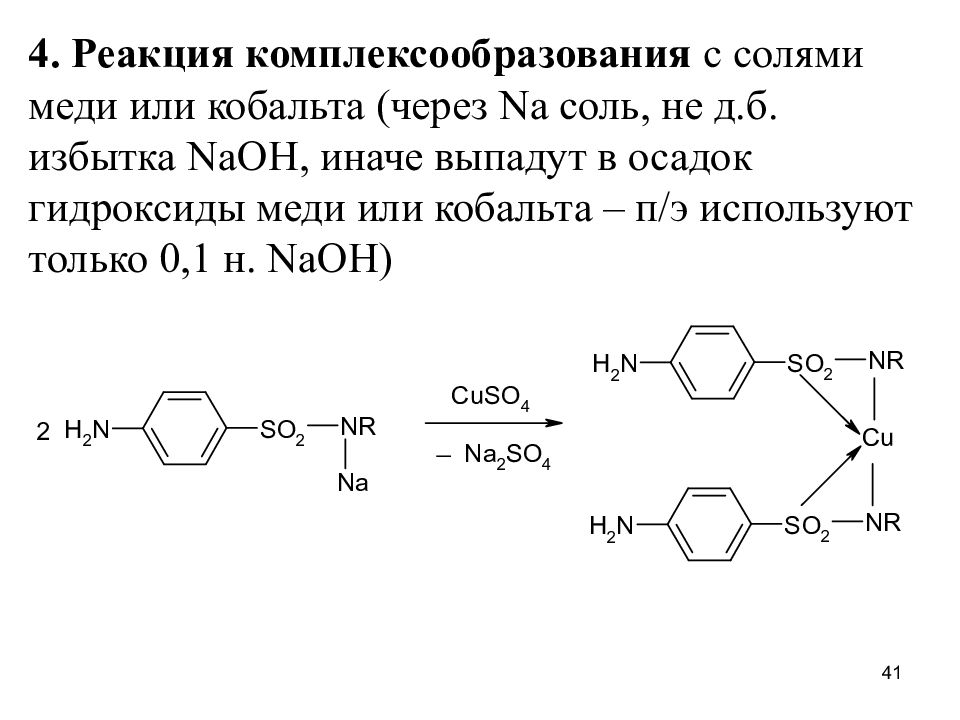
Слайд 41
4. Реакция комплексообразования с солями меди или кобальта (через Na соль, не д.б. избытка NaOH, иначе выпадут в осадок гидроксиды меди или кобальта – п/э используют только 0,1 н. NaOH) 41
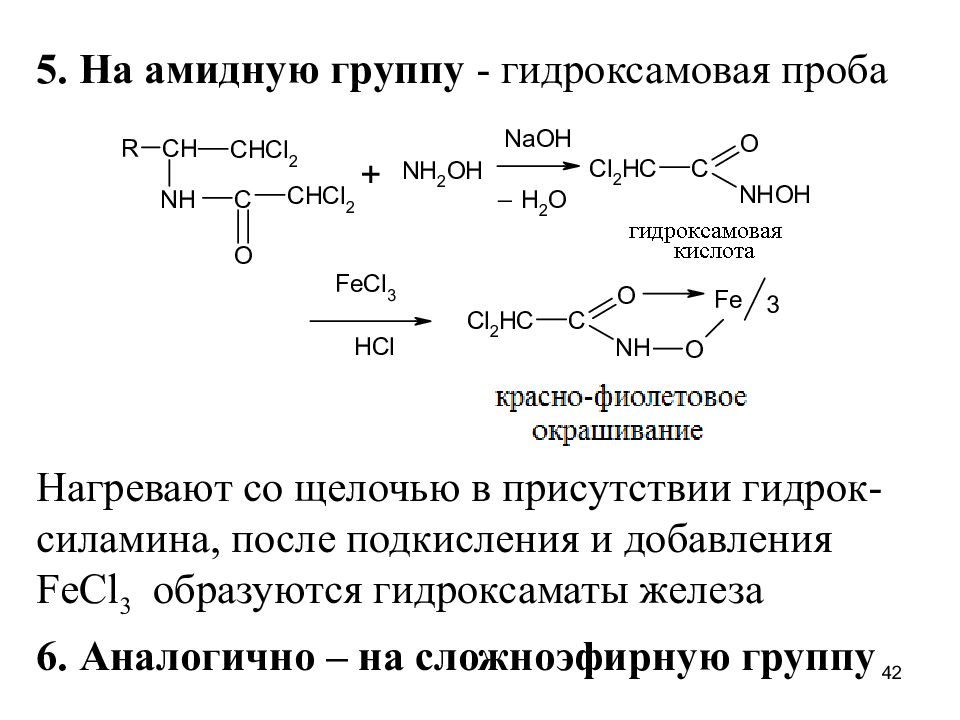
Слайд 42
5. На амидную группу - гидроксамовая проба Нагревают со щелочью в присутствии гидрок-силамина, после подкисления и добавления FeCl 3 образуются гидроксаматы железа 6. Аналогично – на сложноэфирную группу 42
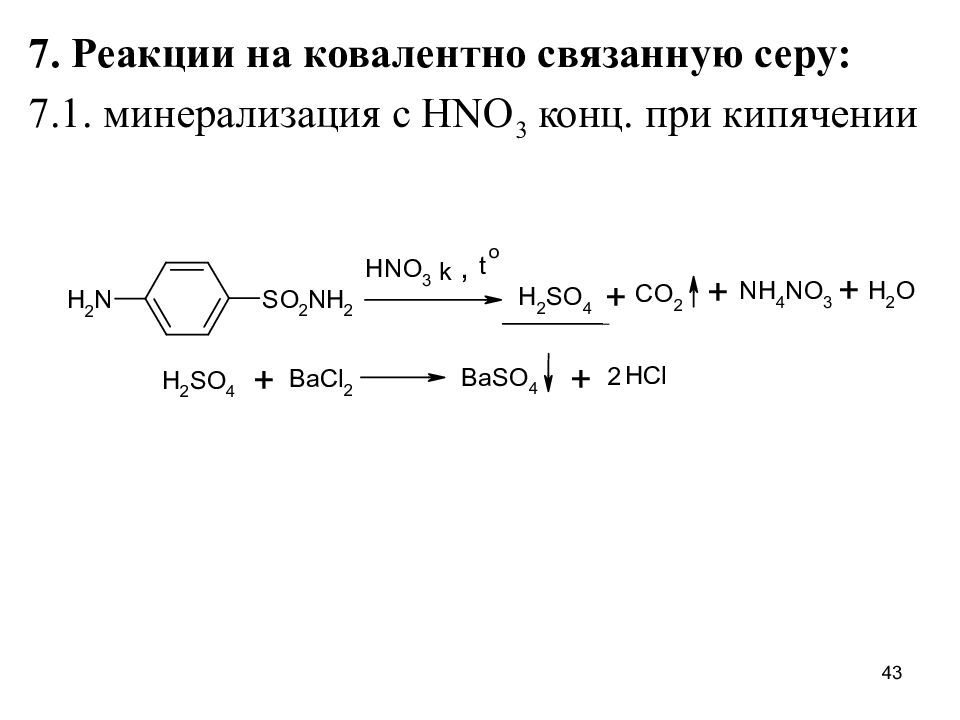
Слайд 43
7. Реакции на ковалентно связанную серу: 7.1. минерализация с HNO 3 конц. при кипячении 43
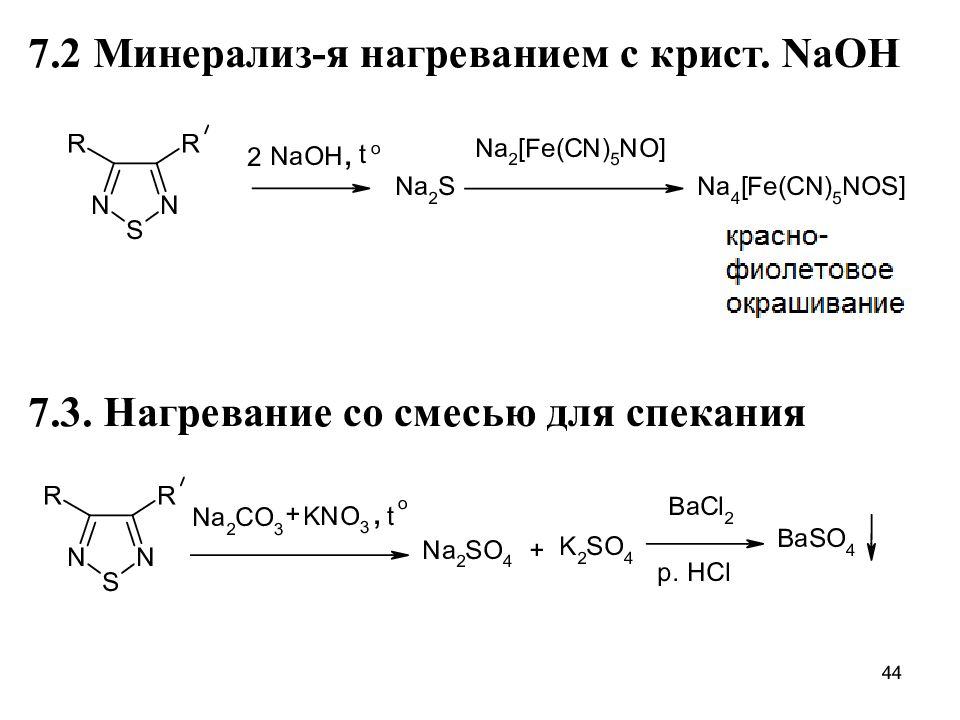
Слайд 44
7.2 Минерализ-я нагреванием с крист. NaOH 7.3. Нагревание со смесью для спекания 44
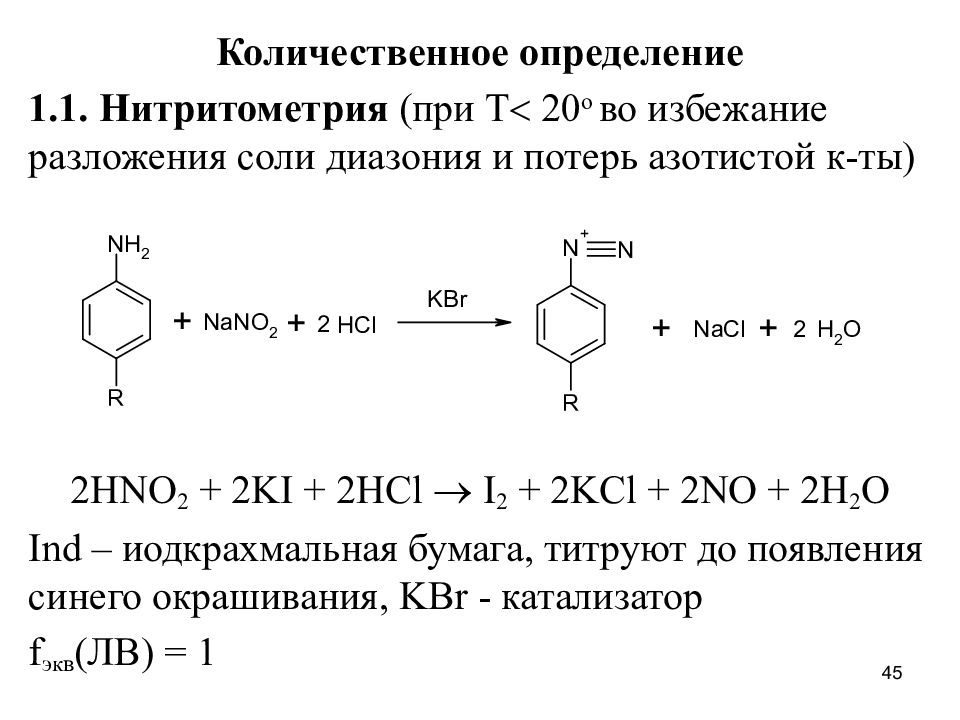
Слайд 45
Количественное определение 1.1. Нитритометрия (при Т 20 о во избежание разложения соли диазония и потерь азотистой к-ты) 2HNO 2 + 2KI + 2HCl I 2 + 2KCl + 2NO + 2H 2 O Ind – иодкрахмальная бумага, титруют до появления синего окрашивания, KBr - катализатор f экв (ЛВ) = 1 45
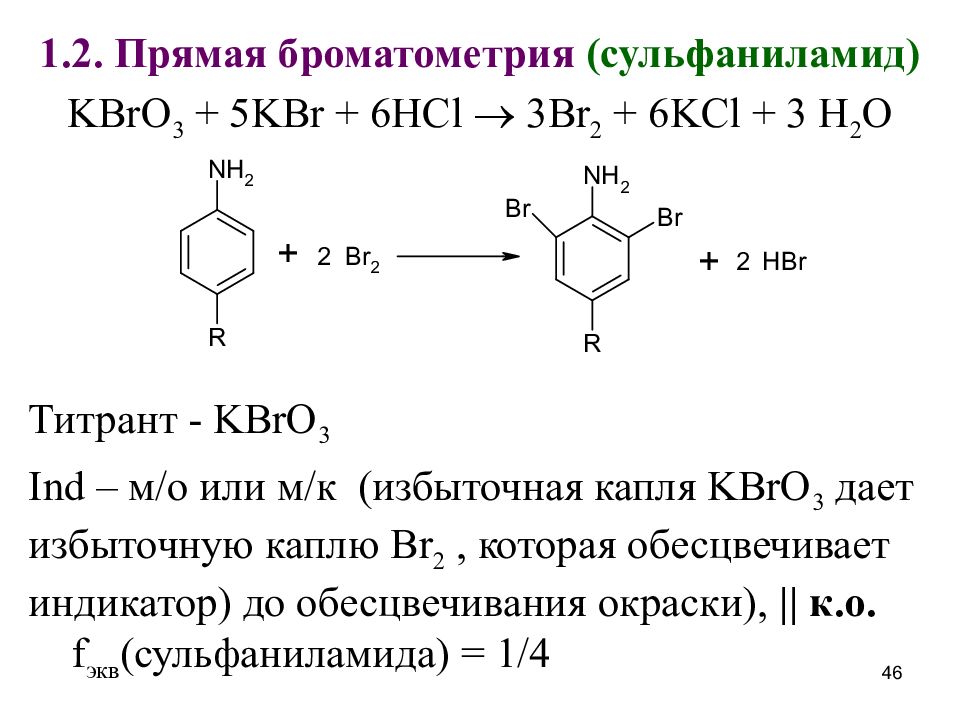
Слайд 46
1.2. Прямая броматометрия (сульфаниламид) KBrO 3 + 5KBr + 6HCl 3Br 2 + 6KCl + 3 H 2 O Титрант - KBrO 3 Ind – м/о или м/к (избыточная капля KBrO 3 дает избыточную каплю Br 2, которая обесцвечивает индикатор) до обесцвечивания окраски), || к.о. f экв (сульфаниламида) = 1/4 46
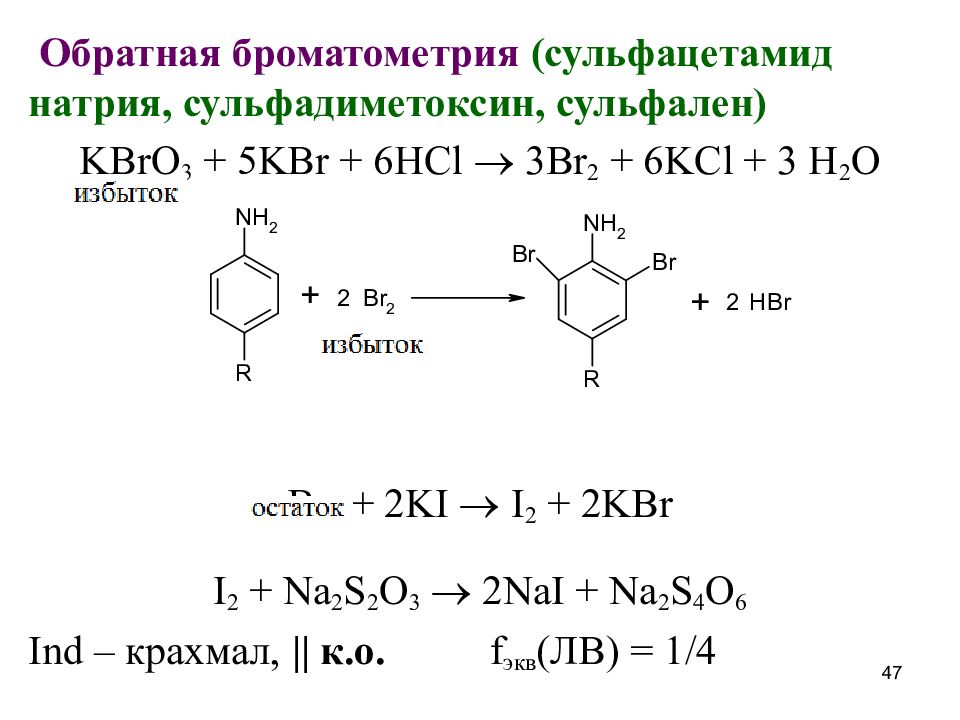
Слайд 47
О братная броматометрия ( сульфацетамид натрия, сульфадиметоксин, сульфален ) KBrO 3 + 5KBr + 6HCl 3Br 2 + 6KCl + 3 H 2 O Br 2 + 2KI I 2 + 2KBr I 2 + Na 2 S 2 O 3 2NaI + Na 2 S 4 O 6 Ind – крахмал, || к.о. f экв (ЛВ) = 1/4 47
Слайд 48
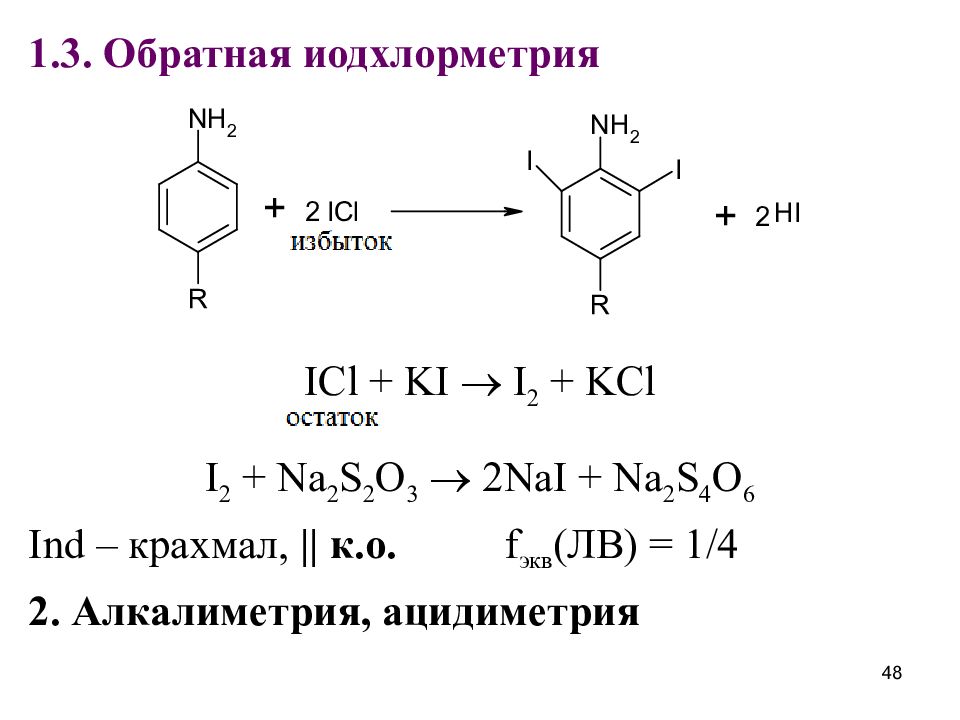
1.3. Обратная иодхлорметрия ICl + KI I 2 + KCl I 2 + Na 2 S 2 O 3 2NaI + Na 2 S 4 O 6 Ind – крахмал, || к.о. f экв (ЛВ) = 1/4 2. Алкалиметрия, ацидиметрия 48