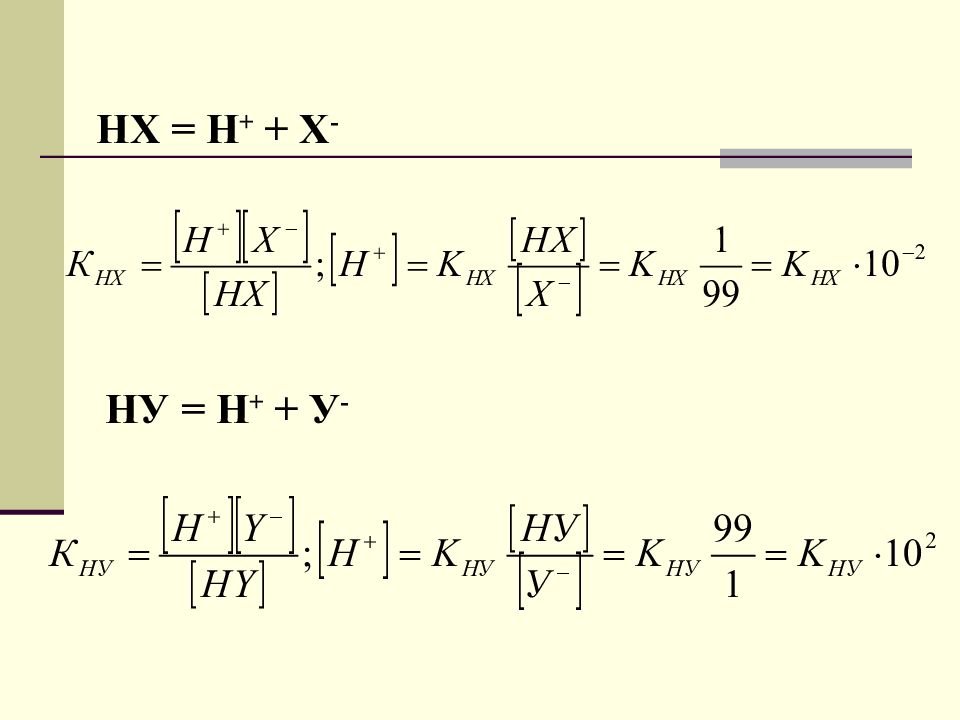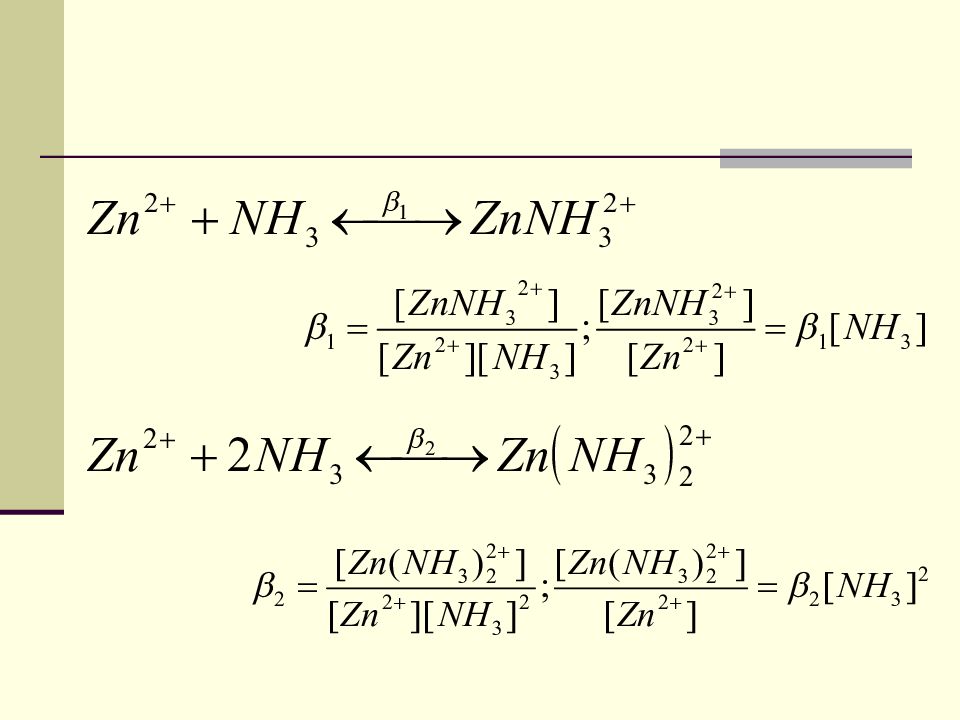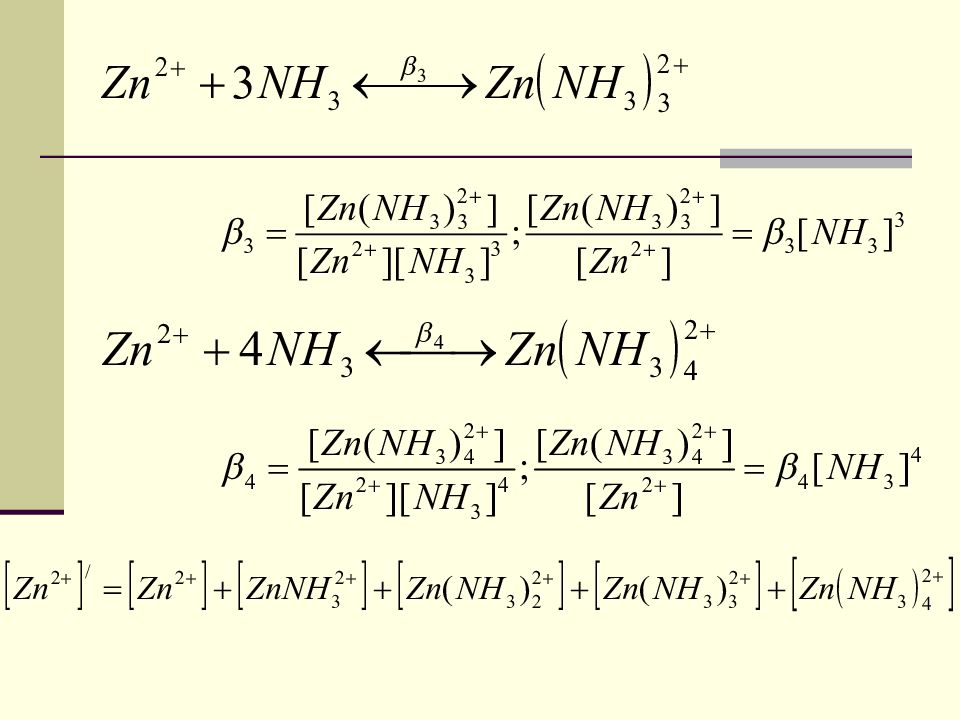Первый слайд презентации: Аналитическая химия (количественный анализ) курс лекций
Волков А.В., Филимонов Д.А., Березина Н.М., Базанов М.И. ГОУ ВПО «ИГХТУ» Кафедра аналитической химии ПЛ097/П
Слайд 2: Список литературы:
Васильев, В.П. Аналитическая химия. Кн. 1. - М.: Дрофа, 2003. Лабораторные работы по химическим методам анализа.: метод. указания / Кочергина Л.А., Ю.А. Жуков; Иван. хим.-технол. ин-т. Иваново, 1991. /библ. № 370 /. Аналитическая химия: лабораторный практикум / В.П. Васильев, Р.П. Морозова, Л.А. Кочергина. - М.: Дрофа, 2004. Аналитическая химия: сборник вопросов, упражнений и задач / В.П. Васильев, Л.А. Кочергина, Т.Д. Орлова - М.: Дрофа, 2003.
Слайд 3
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия, 1985. Раздаточный материал к лекционному курсу по аналитической химии (количественный анализ).: метод. указания / М.И. Базанов и др.; Иван. гос. хим.-технол. ун-т. Иваново, 2004. /библ. № 933 /. Расчеты в количественном анализе.: метод. указания / М.И. Базанов, Л.А.Кочергина, Т.Д. Орлова; Иван. гос. хим.-технол. ун-т. Иваново, 2005. / библ. № 949 /. Задания для экспресс-опроса студентов при изучении курса «Аналитической химии».: метод. указания / Л.А.Кочергина и др.; Иван. гос. хим.-технол. ун-т. Иваново, 2005. / библ. № 958 /.
Слайд 4
Аналитическая химия - наука о методах определения химического состава вещества и его структуры. Предметом аналитической химии является разработка методов анализа и их практическое выполнение, а также широкое исследование теоретических основ аналитических методов. 4
Слайд 5
1. Качественный анализ. 2. Количественный анализ. P = f ( c ) Р – аналитический сигнал (измеряемое свойство). а) Р – V (объем) – титриметрический анализ. б) Р – m (массы) – гравиметрический анализ. Аналитическая химия 5
Слайд 6
Титриметрический анализ основан на точном измерении объема стандартного раствора пошедшего на реакцию с определяемым веществом. Стандартным раствором называют раствор, концентрация которого известна с высокой точностью (±0,1%). Титрование – процесс постепенного прибавления титранта (стандартный раствор) к определяемому веществу для определения точки эквивалентности. Точка эквивалентности – момент титрования, когда количество титранта химически эквивалентно количеству анализируемого вещества.
Слайд 7
Эквивалент – реальная или условная частица, соответствующая одному протону или другому одноразрядному иону в данной реакции. Фактор эквивалентности показывает, какая доля реальной или условной частицы соответствует одному протону или другому однозарядному иону в данной реакции. М экв = f экв ∙ М(А) Na 2 CO 3 + HCl = NaHCO 3 + NaCl Na 2 CO 3 + 2HCl = H 2 CO 3 + 2NaCl f экв (Na 2 CO 3 ) = 1 f экв (Na 2 CO 3 ) = ½ М экв = 1 ∙ М (Na 2 CO 3 ) = 10 5,99 М экв = ½ ∙ М (Na 2 CO 3 ) = 5 2,99
8
Слайд 9
Способы выражения концентрации Молярная (моль / л) с (HCl) = 0,1 М с (H 2 SO 4 ) = 1 M 2. Молярная концентрация эквивалента (нормальность) (моль·экв/л) с ( f A) с( HCl ) = 0,1 н с( 1/5 KMnO 4 ) = 0,1 н с( 1/2 H 2 SO 4 ) = 1 н
Слайд 10
3. Титр (г/мл) Т(HCl) = 0.005026 4. Титр по определяемому веществу (г/мл) Т(А/В)(условный титр) – сколько грамм вещества В соответствует 1мл титранта А. Т(HCl/CaO) = 0.002914
Реакция должна протекать с большой скоростью. Константа равновесия должна быть велика, т.е. реакция должна протекать полностью. Должны отсутствовать побочные реакции. Возможность фиксирования точки эквивалентности (т.э.). 11
Слайд 12: Приемы титриметрического анализа
прямое титрование; обратное титрование (титрование по остатку); титрование по замещению (титрование заместителя). 12
Слайд 13: 1. В методах прямого титрования определяемое вещество непосредственно реагирует с титрантом. Типичным примером прямого титрования является титрование щелочи кислотой
n(NaOH) = n(HCl) c(NaOH) ∙ V(NaOH) = c(HCl) ∙ V(HCl) 13
Слайд 14
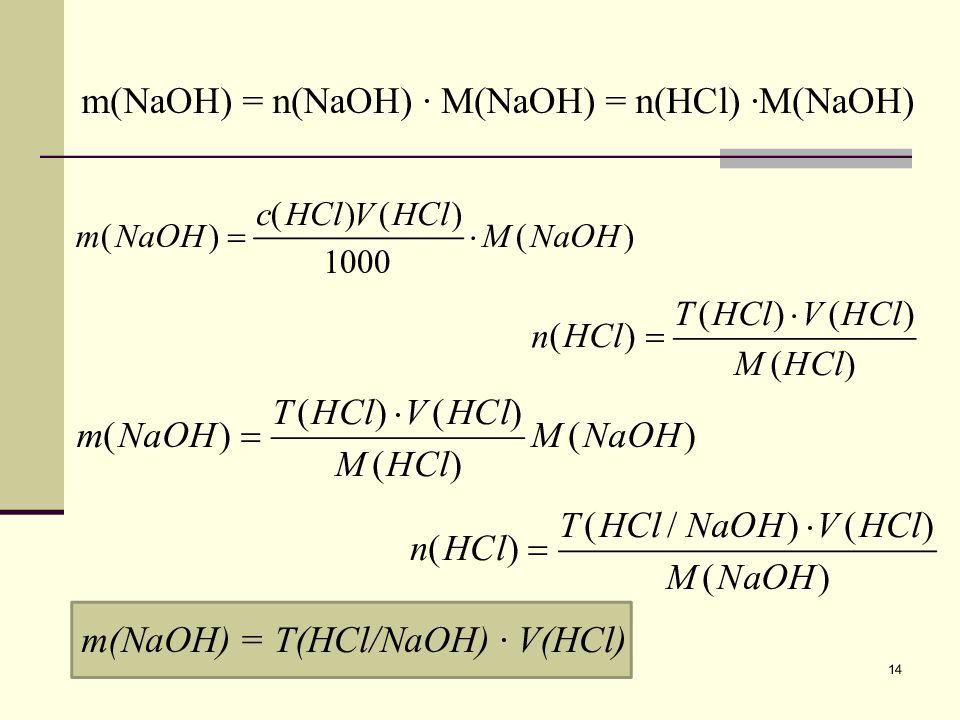
m(NaOH) = Т (HCl/NaOH) ∙ V(HCl) m(NaOH) = n(NaOH) ∙ M(NaOH) = n(HCl) ∙M(NaOH) 14
Слайд 15
2. В методах обратного титрования используется два титрованных рабочих раствора — основной и вспомогательный. Пример 1. CaCO 3 + 2 HCl (изб – №1) = CaCl 2 + H 2 O + CO 2 + ( HCl ост ) HCl ост + NaOH №2 = NaCl + H 2 O n (1/2CaCO 3 ) = n (HCl) – n (NaOH) 15
Слайд 16
Пример 2. Определение солей аммония и азота в органических соединениях по Кьельдалю а) Н 2 SO 4 изб. + 2 NH 3 = ( NH 4 ) 2 SO 4 + ( Н 2 SO 4 ост ) Н 2 SO 4 ост + 2NaOH = Na 2 SO 4 + 2 H 2 O n (NH 4 + ) = n ( 1/2 Н 2 SO 4 ) – n (NaOH) 16
Слайд 17
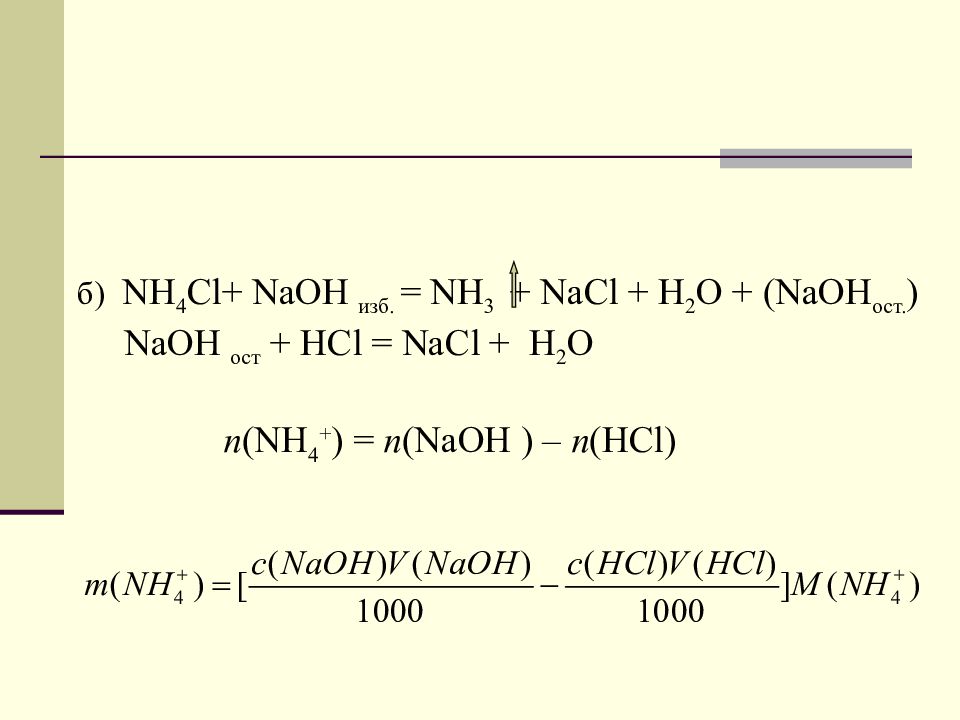
б) NH 4 С l + NaOH изб. = NH 3 + NaCl + H 2 O + ( NaOH ост. ) NaOH ост + HCl = NaCl + H 2 O n (NH 4 + ) = n (NaOH ) – n (HCl)
Слайд 18
3. T итрование заместителя или титрование по замещению В этом методе к определяемому веществу добавляют специальный реагент, вступающий с ним в реакцию. Один из продуктов взаимодействия о ттитровывается рабочим раствором.
Слайд 19
П ример ы : При иодометрическом определении меди к анализируемому раствору добавляется заведомый избыток KI и происходит реакци я: 2С u 2+ + 4 I - = 2 CuI + I 2 Выделившийся иод оттитровывают тиосульфатом: I 2 + 2S 2 O 4 2- = 2I - + S 4 O 6 2- 2) Определение NH 4 + 4NH 4 + + 6CH 2 O = 6(CH 2 )N 4 ↓ + 4H + + 6H 2 O Образовавшуюся кислоту оттитровывают щелочью.
Слайд 20
3) Определение Ca : С aC 2 O 4 + H 2 SO 4 = С aSO 4 + H 2 C 2 O 4 5H 2 C 2 O 4 + 2MnO 4 - + 6H + =10CO 2 + 2Mn 2+ + 8H 2 O n(½CaC 2 O 4 ) = n(½H 2 C 2 O 4 ) = n(1/5KMnO 4 ) 20
Слайд 21
Методы титриметрического анализа: I. Кислотно-основное титрование Н + +ОН - = Н 2 О II. Комплексометрическое титрование Hg 2+ + 2Cl - = HgCl 2 (меркуриметрия) M 2+ + H 2 ЭДТА 2- = МЭДТА 2- + 2Н + (комплексонометрия) III. Осадительное титрование А g + + Cl - = AgCl (аргентометрия) Hg 2 2+ + 2 Cl - = Hg 2 Cl 2 (меркурометрия) IV. Окислительно-восстановительное титрование (редоксиметрия) 5 Fe 2+ + MnO 4 - + 8H + = 5 Fe 3+ + Mn 2+ + 4H 2 O 21
Слайд 22
I. Кислотно-основное титрование Н + +ОН - = Н 2 О Титранты: Сильные кислоты - HCl, HNO 3, Н 2 SO 4 Сильные основания - NaOH, KOH Определяемые вещества: кислоты, основания, соли. В процессе титрования происходит изменение рН p Н = - lg a H + = - lg ( H + ] ∙ H + ); p Н - lg H + ]. Крив ая титрования - это графическая зависимость рН раствора от объема добавленного титранта (рН = f ( V титранта )).
Слайд 23
Расчет кривой титрования сильного основания сильной кислотой 100мл 0,1М NaOH + V мл 0,1М HCl ; V общ = const (100 мл) NaOH + HCl = NaCl + H 2 O 1 ) V ( HCl ) = 0 мл, ОН - = Na ОН = 0,1 моль/л рОН = - lg 0,1 = 1; рН = 14-1= 13 2 ) V ( HCl ) = 50,0 мл, рОН = - lg 0,05 = 1,3; рН = 12,7 3 ) V ( HCl ) = 90,0 мл, рОН = - lg 0,01 = 2; рН = 12 23
Слайд 24
4) V(HCI)=99,0 мл; pOH=3; рН = 11 5) V ( HCl ) = 99,9 мл; рОН = 4; рН = 10 6) V ( HCl ) = 100,0 мл – т.э.; ОН - = Н + = 10 -7 моль/л; рН = 7 7) V ( HCl ) = 100,1 мл; рН = 4
Слайд 25
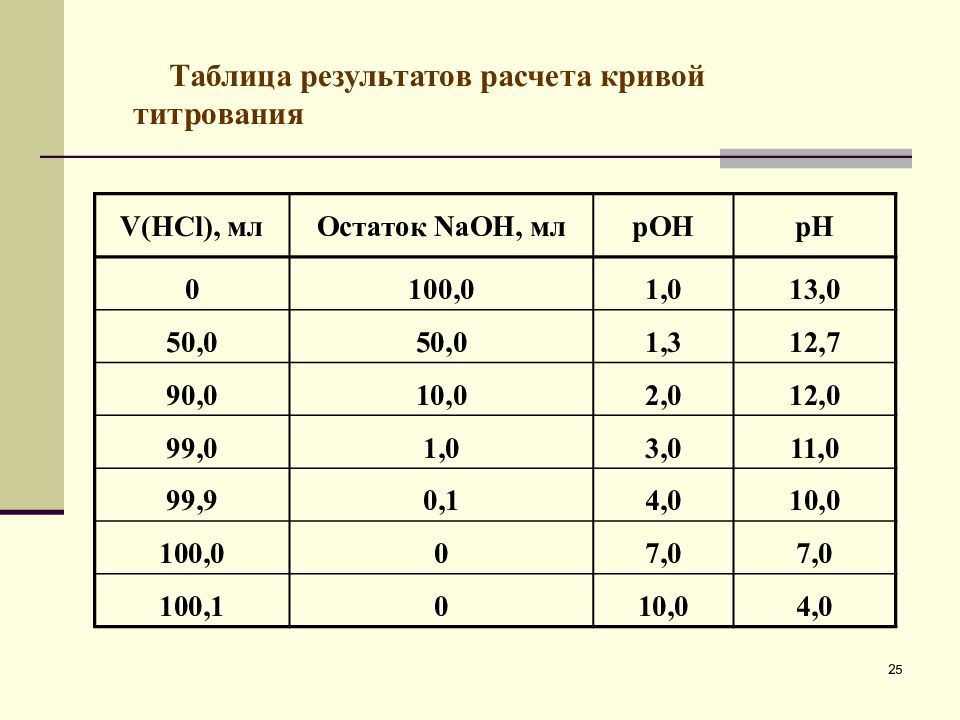
V( HCl ), мл Остаток Na ОН, мл рОН рН 0 10 0,0 1,0 13,0 50,0 50,0 1,3 12,7 90,0 10,0 2,0 12,0 99,0 1,0 3,0 11,0 99,9 0,1 4,0 10,0 100,0 0 7,0 7,0 100,1 0 10,0 4,0 Таблица результатов расчета кривой титрования 25
Слайд 27
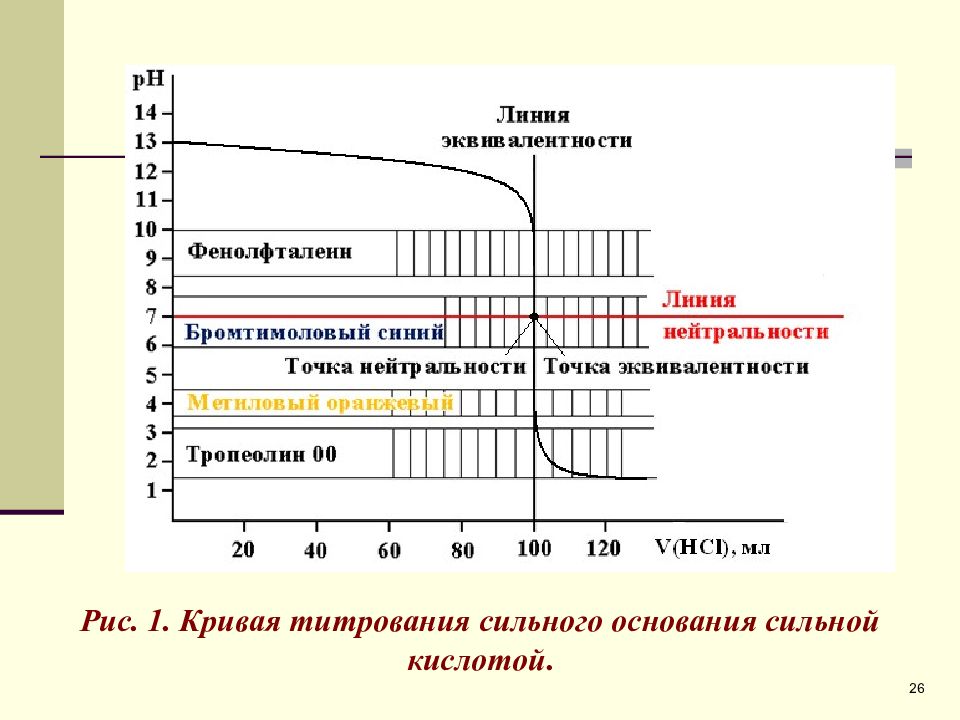
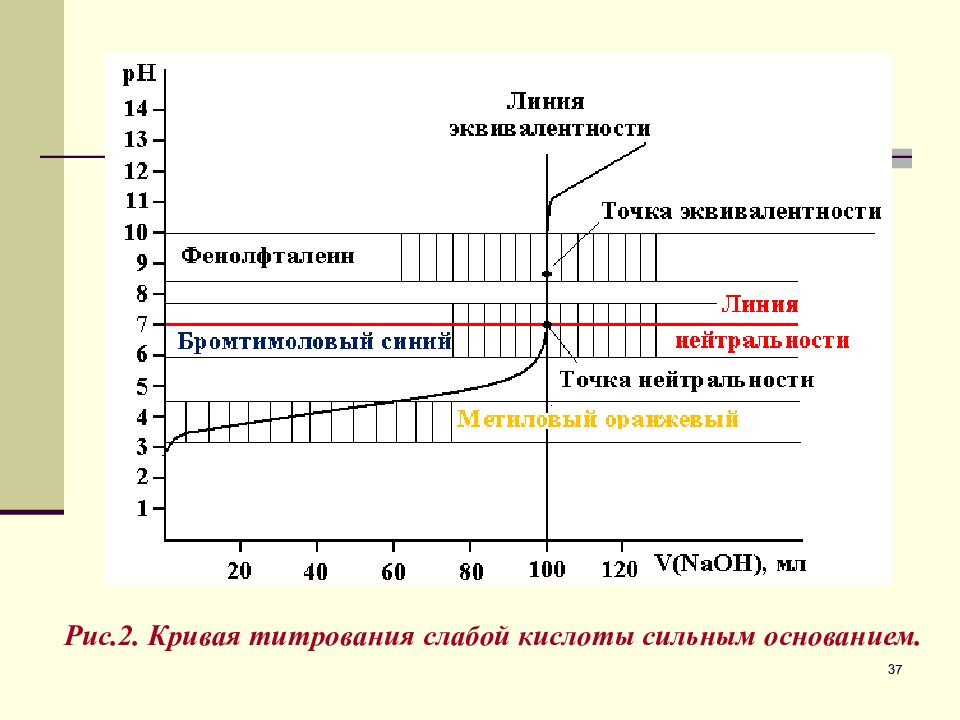
Пересечение линии эквивалентности (Л.Э.) с линией нейтральности (Л.Н.) дает точку нейтральности (Т.Н.). В данном случае, при титровании сильного основания сильной кислотой Т.Н. и Т.Э. совпадают. Резкое изменение рН вблизи Т.Э. называется скачком титрования (С.Т.). Точка на кривой титрования, когда раствор недотитрован на 0,1% называется началом С.Т., когда раствор перетитрован на 0,1% - конец С.Т.
Слайд 28
Факторы, влияющие на величину скачка титрования а) Концентрация с ( Na ОН) = с (НС l ) = 1M V ( HCl ) = 99,9 мл; рОН = 3; рН = 11 V ( HCl ) = 100,1 мл; рН = 3 Скачок титрования : 11 – 3 = 8 единиц рН. С увеличением концентрации величина скачка титрования увеличивается. 28
Слайд 29
б) Температура t = 25 0 C K w = 10 -14 t = 60 0 C K w = 10 -13 V ( HCl ) = 99,9 мл, ОН - = 10 -3 моль/л; рОН = 3; рН = 10 V ( HCl ) = 100,1 мл, Н + = 10 -3 моль/л; рН = 3 При 60 0 C Δ рН =10 - 3 = 7 С ростом температуры, величина скачка титрования уменьшается. 29
Слайд 30
Расчет кривой титрования слабой кислоты сильным основанием 100мл 0,1М СН 3 СООН + V мл 0,1М NaOH ; V общ = const (100 мл) 1) V NaOH = 0 мл СН 3 СООН + Н 2 О =СН 3 СОО - +Н 3 О + СН 3 СООН =СН 3 СОО - +Н + C a -x х х 30 К а = 1,74 ∙ 10 -5 т.к. х << С a, С a -x ~ C a х = [ H + ] = 1,32 ∙10 -3 моль/л; рН = 2,89 рОН = 11,11
Слайд 31
0 < V ( NaOH ) < 100 мл – буферная область СН 3 СООН = СН 3 СОО - + Н + 2) V NaOH = 9,0 мл Образовалось: СН 3 СОО - = С s = Остаток: СН 3 СООН = С a =. рН = 3,7 5 C s + x C a -x 31 x
Слайд 32
3) V NaOH = 50,0 мл Образовалось: СН 3 СОО - = С S = 0,05 моль/л, Остаток: СН 3 СООН = С А = 0,05 моль/л рН = 4,76 4) V NaOH = 90,0 мл Образовалось: СН 3 СОО - = С S = 0,09 моль/л, Остаток: СН 3 СООН = С А = 0,01 моль/л рН = 5,71 32 рОН = 9,24 рОН = 8,29
Слайд 33
5 ) V NaOH = 99,9 мл Образовалось: СН 3 СОО - = С S = 0,0999 моль/л, Остаток: СН 3 СООН = С А = 0,0001 моль/л рН = 7,76 33 рОН = 6,24
Слайд 34
6 ) V NaOH = 100 мл – эквивалентное количество Образовалось: СН 3 СОО - = С S = 0,1 моль/л, Остаток: СН 3 СООН = С А = 0 моль/л СН 3 СОО - + Н 2 O = СН 3 СООН + ОН - Н + = 10 -14 / (7,6 ∙ 10 -6 ) = 1,32 ∙ 10 -9 моль/л рН = 8,88 рОН = 5,12 34
Слайд 35
7 ) V NaOH = 100,1 мл (избыток 0,1 мл) O Н - = 0,1 ∙ 0,1/100 = 1,0 ∙ 10 -4 моль/л рОН = 4; рН = 10 35
Слайд 36
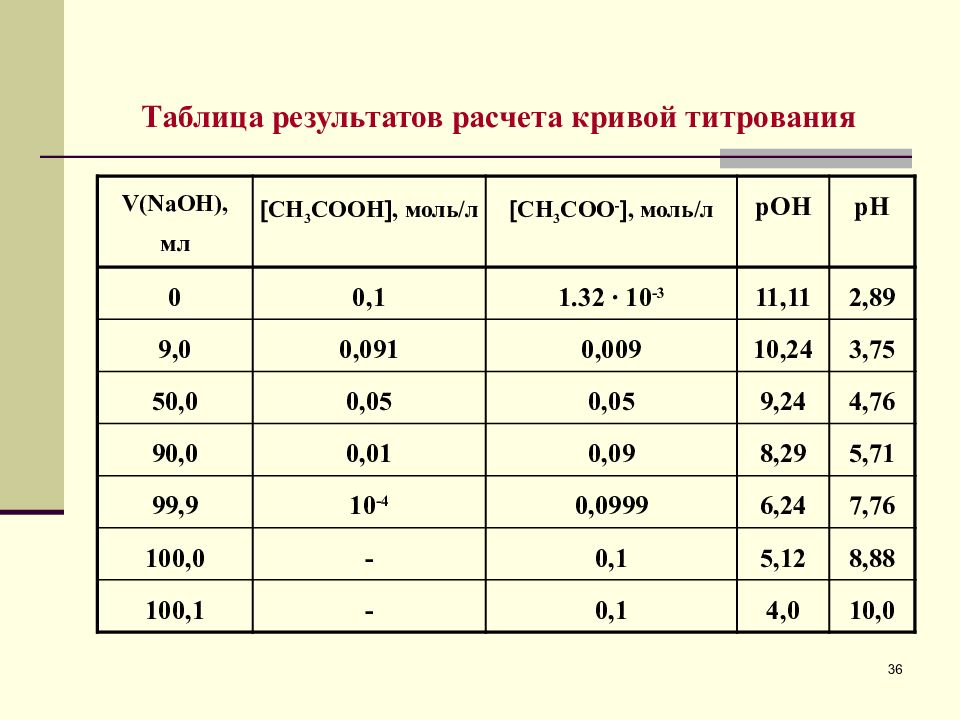
Таблица результатов расчета кривой титрования V ( Na ОН), мл СН 3 СООН , моль/л СН 3 СОО - , моль/л рОН рН 0 0, 1 1.32 ∙ 10 -3 11, 11 2, 89 9,0 0, 091 0, 009 10, 24 3, 75 50,0 0, 05 0, 05 9, 24 4, 76 9 0,0 0, 0 1 0, 09 8, 2 9 5, 7 1 99, 9 10 -4 0, 0999 6, 24 7, 76 100,0 - 0, 1 5, 12 8, 88 100, 1 - 0, 1 4, 0 10, 0 36
Слайд 38
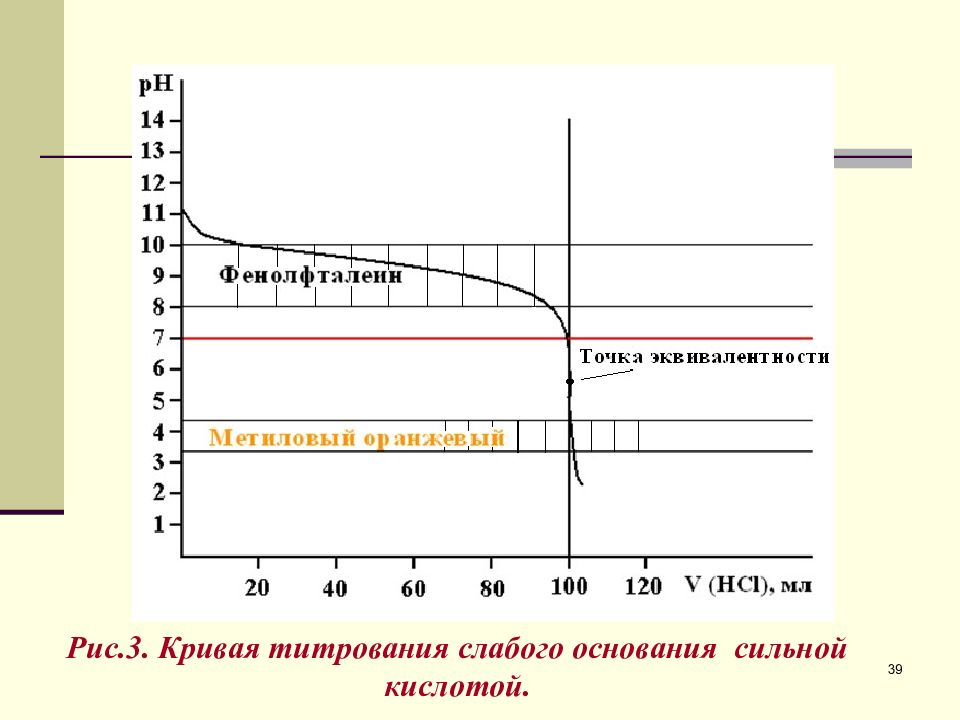
Кривая титрования слабого основания сильной кислотой 0,1М NH 3 + 0,1М Н Cl, К b = 1, 76 ∙ 10 -5 ; К а = 5, 68 ∙ 10 -10 ; рН = 14 – рК b + lg ( [ NH 3 ] / [ NH + 4 ] ) V (Н Cl ), мл остаток NН 3 , моль/л рОН рН 0 100,0 2,9 11,1 50,0 50,0 4,7 9,3 99,0 1,0 6,7 7,3 99,9 0,1 7,7 6,3 100,0 0 8,9 5,1 100,1 0 10,0 4.0 Точка эквивалентности находится в кислой области. 38
Слайд 40
Факторы, влияющие на величину скачка титрования : Концентрация реагирующих веществ; 2.Температура ( t °); 3. Природа реагирующих веществ ( K дисс ). 40
Слайд 41
Титрование смеси двух кислот 1. Титрование смеси двух сильн ых кислот. Оттитровать отдельно одну сильную кислоту в присутствии другой сильной кислоты невозможно. Можно определить только общую кислотность (щелочность). 2. Титрование смеси сильной и слабой кислот (оснований). Оттитровать сильную кислоту в присутствии слабой с погрешностью в 1 % можно, если K a слабой кислоты ≤ 10 -5. HCl + CH 3 COOH ; K а = 1,7 4 ∙ 10 -5 HCl + C 6 H 5 COOH ; K а = 6,6 ∙ 10 -5 41
Слайд 42
3. Титрование смеси двух слабых кислот НХ; H У титрант – щелочь. Предположим, что одну слабую кислоту в присутствии другой слабой кислоты можно оттитровать с точностью в 1%. НХ – оттитрована на 99% HУ – оттитрована на 1% 42
Слайд 44
K нх ∙ 10 -2 = K ну ∙ 10 2 ; Т.о. Оттитровать одну слабую кислоту в присутствии другой слабой кислоты с точностью в 1% можно, если отношение величин K a этих кислот отличается больше, чем на четыре порядка. 44
Слайд 46
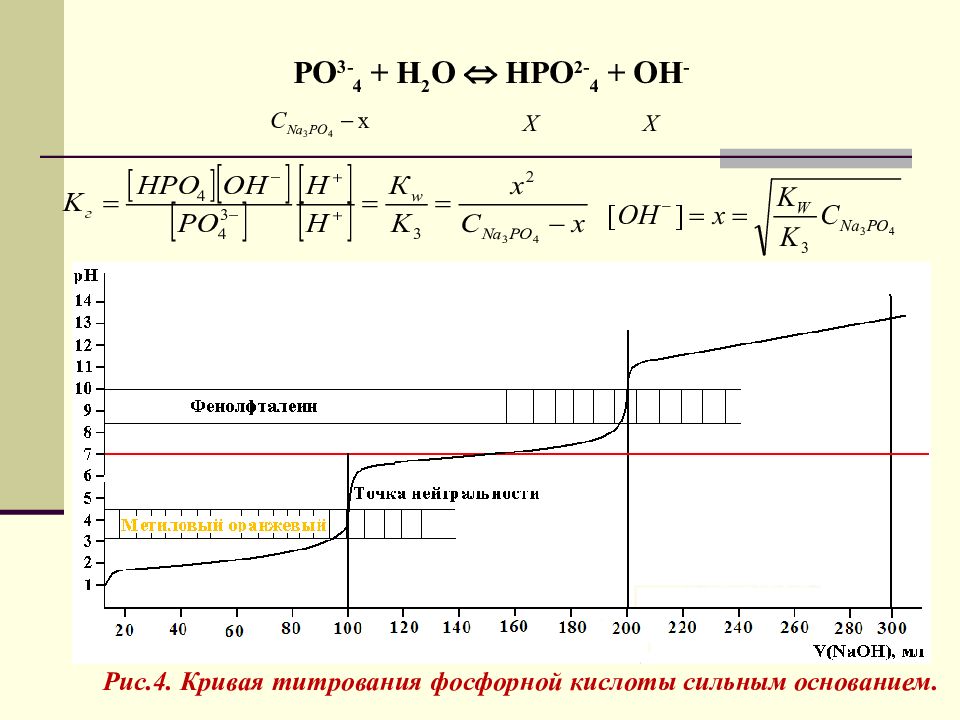
Титрование многоосновных кислот 100 мл 0,1 м Н 3 РО 4 + V мл 0,1 м NaOH Н 3 РО 4 Н + + Н 2 РО - 4 К 1 = 7,58 ∙ 10 -3 рК 1 = 2,12 Н 2 РО - 4 Н + + НРО 2- 4 К 2 = 6,16 ∙ 10 -8 рК 2 = 7,21 НРО 2- 4 Н + + РО 3- 4 К 3 = 4,26 ∙ 10 -13 рК 3 = 12,38 V NaOH = 100 мл - I т. э. V NaOH = 200мл - II т.э V NaOH = 300мл III т.э В области третьей точки эквивалентности скачка не наблюдается, т.к. К 3 очень мала.
Слайд 47
РО 3- 4 + Н 2 О НРО 2- 4 + ОН - Рис.4. Кривая титрования фосфорной кислоты сильным основанием.
Слайд 48
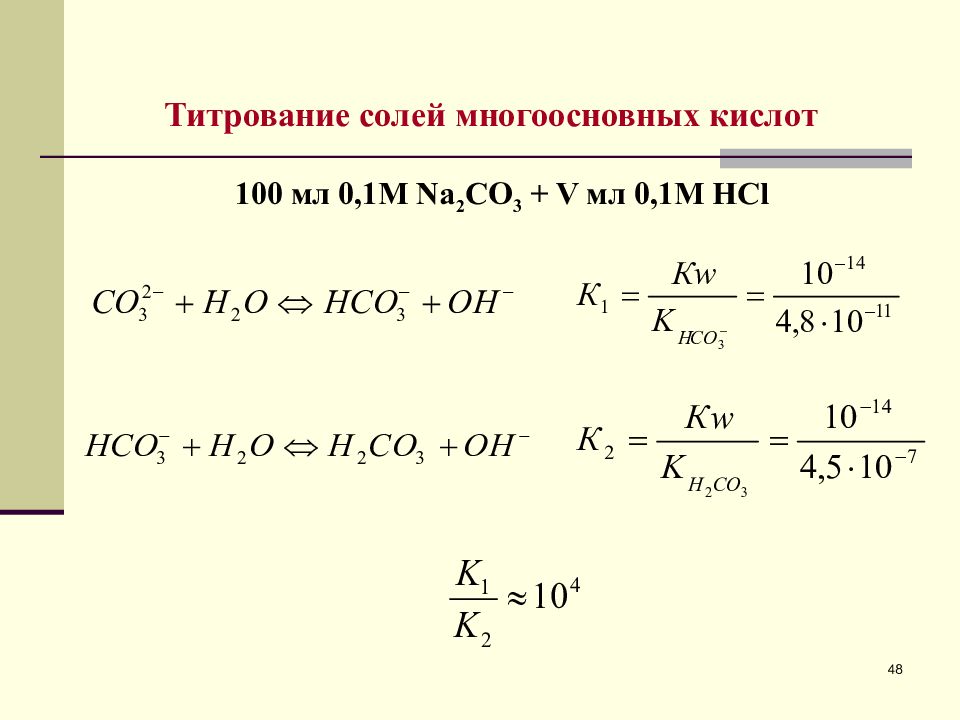
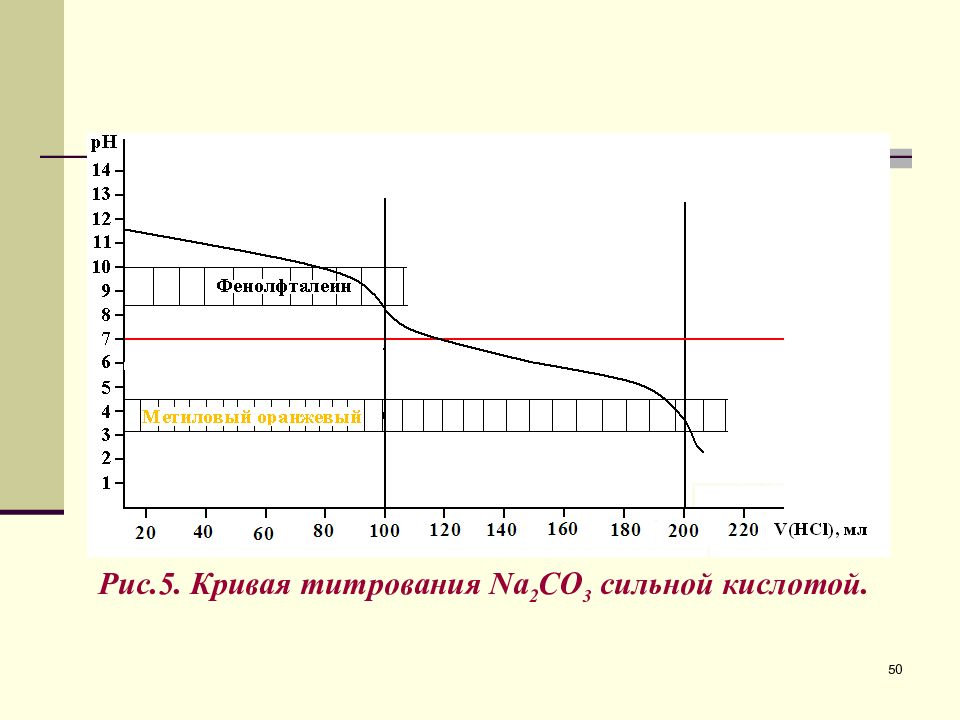
Титрование солей многоосновных кислот 100 мл 0, 1 М Na 2 CO 3 + V мл 0, 1 М HCl 48
Слайд 49
2) 0 V ( HCl ) 100 мл – 1 я буферная область. 3) V ( HCl )=100 мл – 1 я точка эквивалентности. 49
Слайд 51
Индикаторы кислотно-основного титрования Кислотно-основные индикаторы – это органические соединения сложной структуры, которые изменяют свою окраску в зависимости от рН раствора.
Слайд 52
Hind H + + Ind - кр желт Интервал pH, при котором индикатор изменяет свою окраску, называется интервалом перехода индикатора. Ионная теория
Слайд 53
Хромофорная теория В соответствии с этой теорией изменение цвета индикатора связано с существенным изменением его молекулярной структуры. Окраска соединений связана с наличием хромофорных групп: - NO 2 -, - N = N - т. д., и ауксохромных групп, которые в присутствии хромофорных также влияют на окраску. Структурные изменения в растворах метилового оранжевого при изменении рН можно представить схемой: В воде, нейтральном и щелочном растворе метиловый оранжевый имеет желтую окраску (форма Ind - ), при подкислении структура молекулы изменяется и индикатор приобретает красную окраску (форма HInd ).
Слайд 54
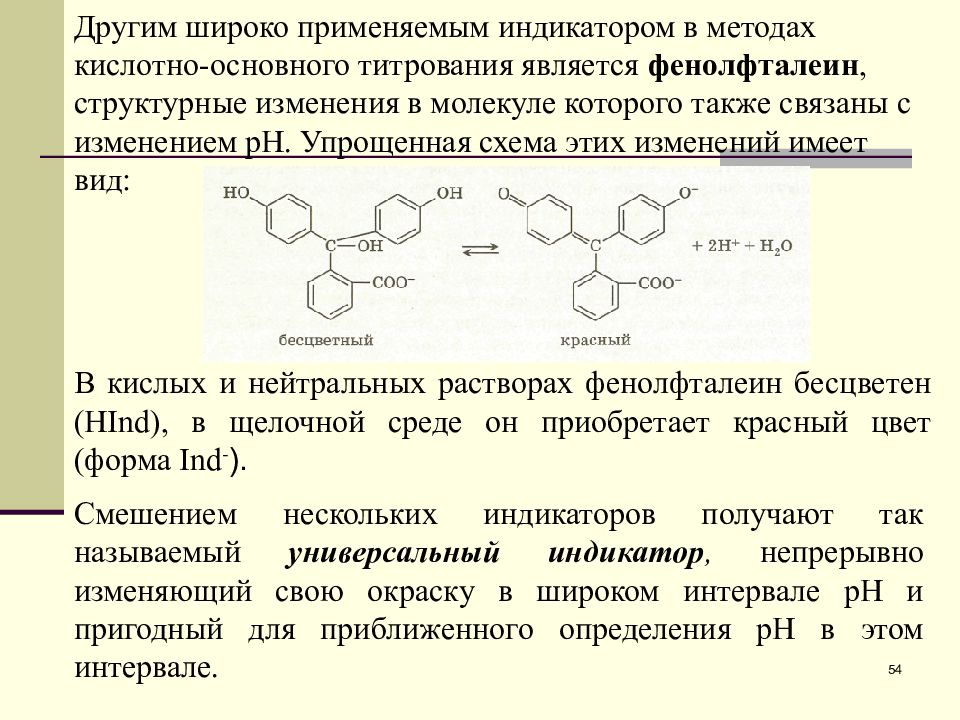
Другим широко применяемым индикатором в методах кислотно-основного титрования является фенолфталеин, структурные изменения в молекуле которого также связаны с изменением рН. Упрощенная схема этих изменений имеет вид : В кислых и нейтральных растворах фенолфталеин бесцветен ( HInd ), в щелочной среде он приобретает красный цвет (форма Ind - ). Смешением нескольких индикаторов получают так называемый универсальный индикатор, непрерывно изменяющий свою окраску в широком интервале рН и пригодный для приближенного определения рН в этом интервале. 54
Слайд 55
Условия выбора индикатора 1. По кривой титрования. 2. По показателю титрования. Показатель титрования – это то значение рН, при котором заканчивают титрование с данным индикатором.Показатель титрова6ния должен находиться в пределах скачка титрования рТ рН в т.э. 3. По индикаторной ошибке. 55
Слайд 56
Индикаторные ошибки титрования Тип ошибки Причина ошибки Водородная Н + -ошибка, Н + Избыток ионов Н + вследствие недотитрования сильной кислоты или перетитрования основания (сильного или слабого) сильной кислотой. Гидроксильная ОН - - ошибка, ОН - Избыток ионов ОН - вследствие недотитрования сильного основания или перетитрования кислоты (сильной или слабой) сильным основанием. V 1 – объем анализируемого раствора, взятый для титрования; V 2 – объем раствора в конце титрования; Сн – нормальная концентрация анализируемого раствора; рК – показатель константы диссоциации слабого электролита; рТ – показатель титрования индикатора.
Слайд 57
Кислотная НА – ошибка, НА Избыток молекул НА слабой кислоты при её недотитровании Щелочная МОН-ошибка, МОН Избыток молекул слабого основания МОН при его недотитровании Индикаторные ошибки титрования V 1 – объем анализируемого раствора, взятый для титрования; V 2 – объем раствора в конце титрования; Сн – нормальная концентрация анализируемого раствора; рК – показатель константы диссоциации слабого электролита; рТ – показатель титрования индикатора.
Слайд 58
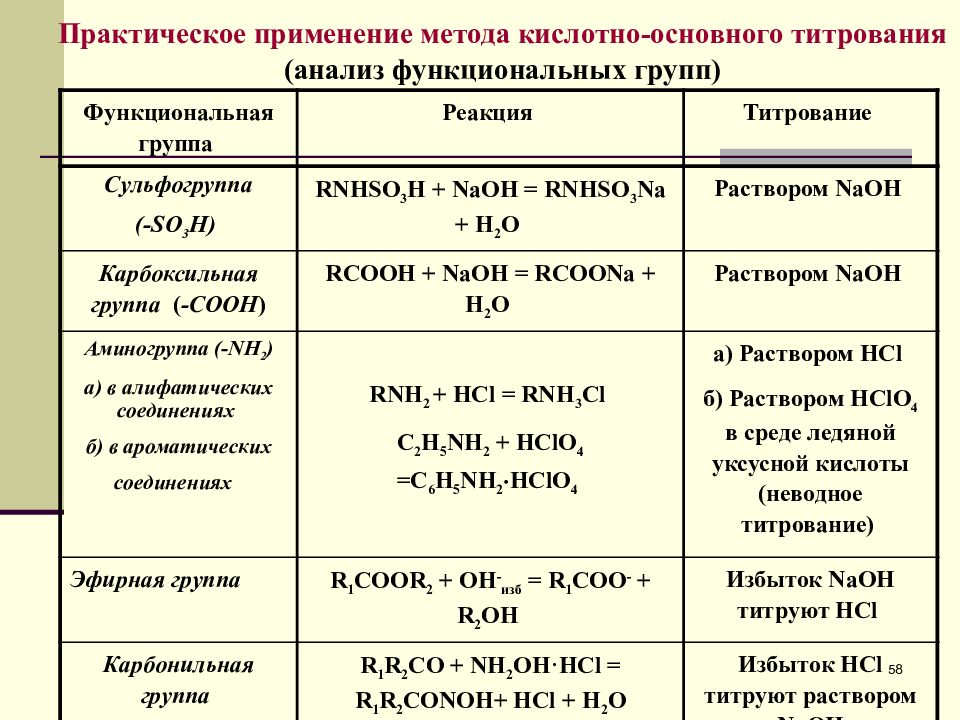
58 Практическое применение метода кислотно-основного титрования (анализ функциональных групп) Функциональная группа Реакция Титрование Сульфогруппа (- SO 3 H ) RNHSO 3 H + NaOH = RNHSO 3 Na + H 2 O Раствором NaOH Карбоксильная группа ( - COOH ) RCOOH + NaOH = RCOONa + H 2 O Раствором NaOH Аминогруппа (- NH 2 ) а) в алифатических соединениях б) в ароматических соединениях RNH 2 + HCl = RNH 3 Cl С 2 H 5 NH 2 + HClO 4 =С 6 H 5 NH 2 HClO 4 а) Раствором HCl б) Раствором HClO 4 в среде ледяной уксусной кислоты (неводное титрование) Эфирная группа R 1 COOR 2 + OH - изб = R 1 COO - + R 2 OH Избыток NaOH титруют НС l Карбонильная группа R 1 R 2 CO + NH 2 OH·HCl = R 1 R 2 CONOH+ HCl + H 2 O Избыток HCl титруют раствором NaOH
Слайд 59
II. Комплексометрическое титрование Меркуриметрия Титрант – Hg(NO 3 ) 2 Определяемые вещества – Cl -, Br -, SCN -, CN - Индикаторы – нитропруссид натрия, дифенилкарбазид, дифенилкарбазон Hg 2+ + 2 Г - Hg Г 2 59 - константа устойчивости Hg Г 2
Слайд 60
60 Простейшим комплексоном является иминодиуксусная кислота: Для целей количественного анализа наиболее часто в качестве титранта используется двухзамещенная натриевая соль этилендиаминтетраксусной кислоты – комплексон III (трилон Б, ЭДТА) : 2. Комплексонометрия (хелатометрия) Основными титрантами являются комплексоны. Комплексонами называют группу аминополикарбоновых кислот.
Слайд 61
Метод комплексонометрии основан на образовании прочных комплексных соединений ионов металлов с комплексоном III (комплексонатов металлов) в соотношении M : L = 1 :1 по схеме: M 2+ + H 2 Edta 2- = MEdta 2- + 2H + M 3 + + H 2 Edta 2- = MEdta - + 2H +
Слайд 62
Условия комплексонометрического титрования 1. pH 3 титровать нельзя, т.к. образуются менее прочные кислые комплексы. 2. pH 10 титровать нельзя. М(ОН) 2 3. Оптимальное значение pH = 810 в среде аммонийного буфера ( NH 3 + NH 4 Cl ) M 2+ + H 2 Y 2- = MY 2- + 2 H + ; H 2 Y 2- - комплексон; MY 2- - комплексонат. 4. Аммиак кроме части буферного раствора является также дополнительным лигандом. M(NH 3 ) 4 2+ + H 2 Y 2- = MY 2- + 2NH 4 + + 2NH 3 5. Маскировка мешающих ионов металлов с помощью солей органических кислот. 62
Слайд 63
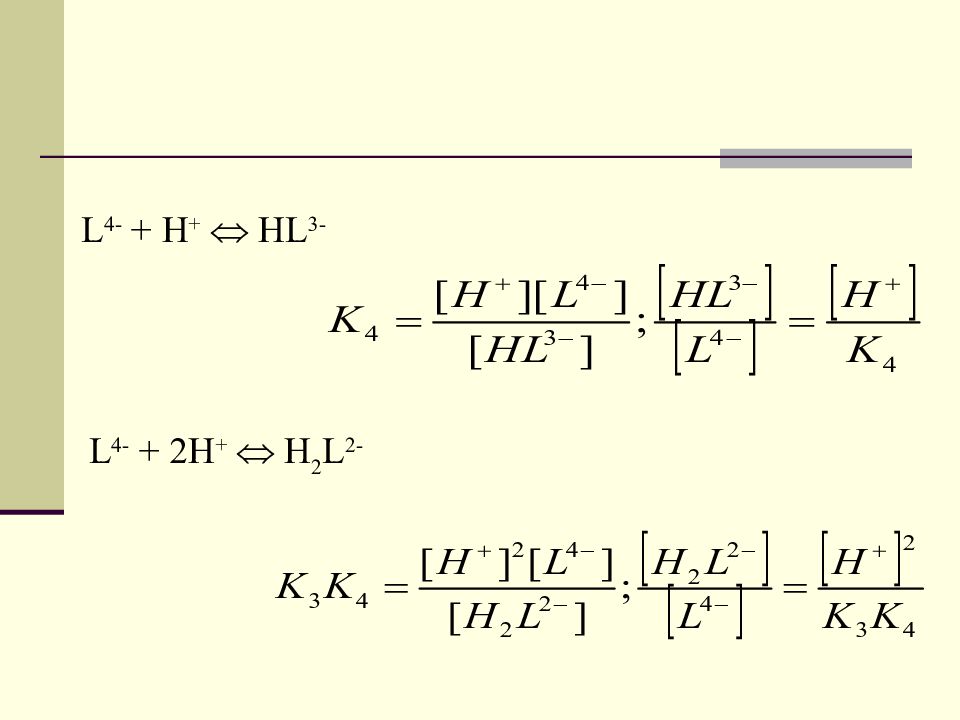
Условная константа устойчивости Zn 2+ + L 4- ZnL 2- При наличии дополнительных лигандов и ионов Н + возможно наличие конкурирующих равновесий. Zn 2+ / и L 4- / - условные концентрации. - истинная константа устойчивости. - условная константа устойчивости 63
Слайд 70
Расчет скачка титрования 100 мл 0,01М Са 2+ + V мл 0,01М трилона Б. Са 2+ + Y 4- =CaY 2- ; 1) V тр. Б = 99, 9 мл рСа 2+ = 5 2) V тр.Б = 100 мл – т.э. Са Y 2- =Ca 2+ + Y 4- 0,01-х х х х = 5 10 -7 моль/л; рСа = 6,3 70 10 -5 -х х 0,00999-х
Слайд 71
3) V тр.Б = 100,1 мл Са Y 2- =Ca 2+ + Y 4- 0,01-х х х+10 -5 х = 2,5 10 -8 моль/л; рСа = 7,7 Кривую титрования строят в координатах рСа – V титранта. 71
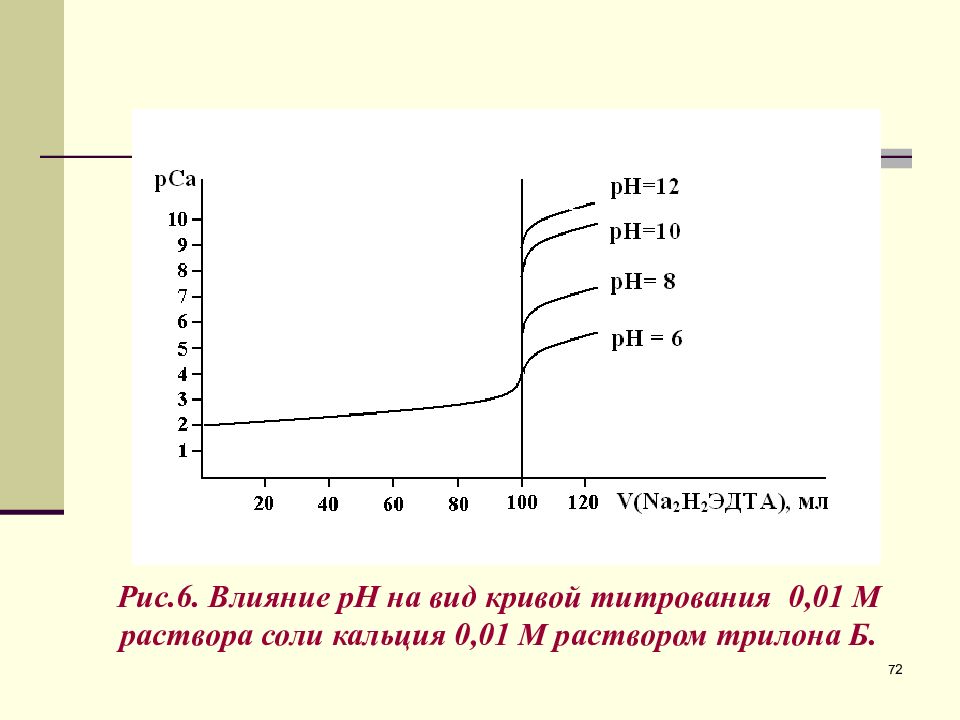
Слайд 72
72 Рис.6. Влияние рН на вид кривой титрования 0,01 М раствора соли кальция 0,01 М раствором трилона Б.
Слайд 73
Металлохромные индикаторы Применяются в методе комплексонометрии, представляют собой слабые органические кислоты, которые образуют окрашенные комплексы с металлами, устойчивость которых ниже, чем устойчивость соответствующих комплексонатов (мурексид, эриохром черный Т, ксиленовый оранжевый и др.). Эриохром черный Т (Н 3 Ind ): рН 6 рН = 8 10 рН 11 красн голуб оранж Zn 2+ + NH 3 + HInd 2- = ZnInd - (кр-фиол) + NH 4 + ZnInd - + NH 3 + H 2 Y 2- = ZnY 2- + NH 4 + + HInd 2- ( голуб ) При выборе индикатора необходимо учитывать правило : 73
Слайд 74
Применение метода комплексонометрии 1. Прямое титрование Zn 2+ ; Ca 2+ ; Ni 2+ ; Co 2+ ; Cd 2+ ; Mg 2+ и др. с аммонийным буфером и эриохромом черным Т. Fe 3+ ; Zr 4+ - в кислой среде с ксиленовым оранжевым. Прямое титрование использовать нельзя, если: а) возможно образование гидроксидов металлов. б) реакция комплексообразования протекает медленно. в) нет подходящего металлохромного индикатора. г) возможно блокирование индикатора. 74
Слайд 75
2. Косвенное титрование а) обратное титрование M 2+ + H 2 Y 2- ( изб.) = MY 2- + 2H + + (H 2 Y 2- ( ост.) ) H 2 Y 2- ( ост.) + Zn 2+ =ZnY 2- + 2H + n(M 2+ ) = n(H 2 Y 2- ) – n(Zn 2+ ) Определяют: Hg 2+, Al 3+ ; Cr 3+ и др. б) т итрование по замещению M 2+ + MgY 2- = MY 2- + Mg 2+ Mg 2+ + H 2 Y 2- = MgY 2- + 2H + n(M 2+ ) = n(Mg 2+ ) = n(H 2 Y 2- ) Определяют: Hg 2+, Th 4 + ; Cu 2 + и др.
Слайд 76
3. Косвенное определение анионов SO 4 2- + Ba 2+ ( изб.) = BaSO 4 + (Ba 2+ ( ост.) ) Ba 2+ (ост.) + H 2 Y 2- = BaY 2- + 2H + n(SO 4 2- ) = n(Ba 2+ ) – n(H 2 Y 2- ) Определяют : SO 4 2-, PO 4 3- и др.
Слайд 77: III. Осадительное титрование
Требования к реакциям осаждения: 1. Малая растворимость осадка. 2. Высокая скорость образования осадков. 3. Явление адсорбции и окклюзии должно быть минимальным. 4. Возможность фиксирования точки эквивалентности. 77
Слайд 78
Аргентометрия Титрант – AgNO 3. Ag + + X - = AgX ПР AgX = [Ag + ][X - ] ; Определяемые ионы - X = Cl -, Br -, I -, SCN -. 1. Безиндикаторные методы. Метод равного помутнения (Гей-Люссака). 2. Метод Мора (индикатор K 2 CrO 4 ). Ag + + Cl - = AgCl Индикаторная реакция: CrO 4 2- + 2 Ag + = Ag 2 CrO 4 кирпично-красный Условия: рН 6,5 10 осадок рН 6,5 CrO 4 2- + Н + = Н CrO 4 - рН 10 Ag 2 O (черный осадок) 78
Слайд 79
3. Метод Фольгарда (тиоционатометрия) Индикатор - Обратное титрование (рабочие растворы- AgNO 3, К SCN или NH 4 SCN ): Cl - + Ag + (изб) AgCl + Ag + (ост) Ag + (ост) + SCN - AgSCN Индикаторная реакция: Fe 3+ + nSCN - (изб) = n (Cl - )= n ( Ag + ) - n (SCN - ) 79
Слайд 80
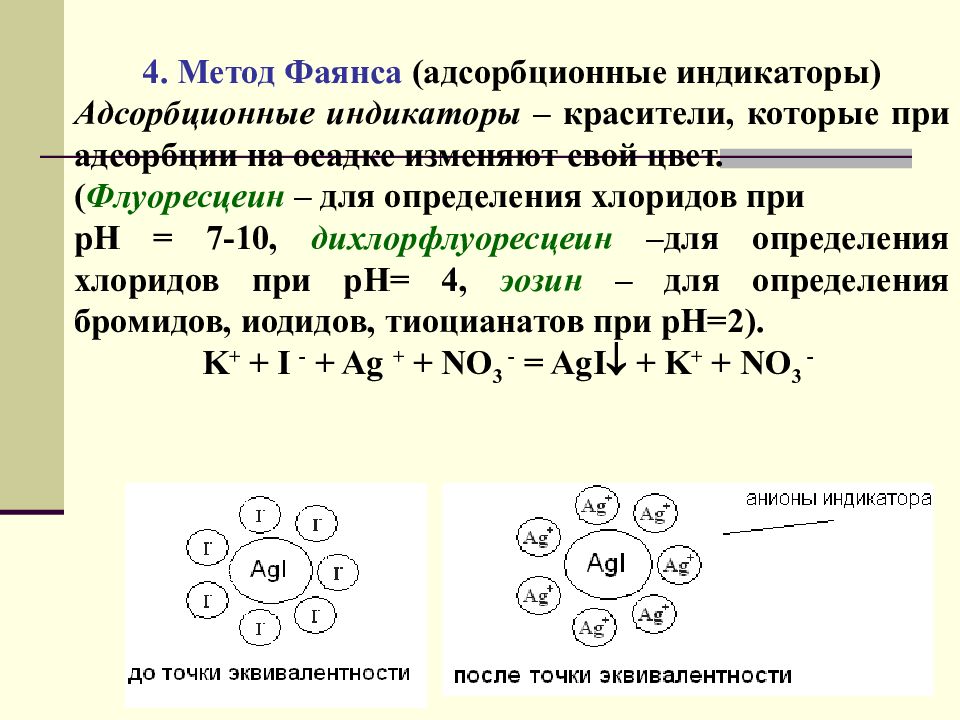
4. Метод Фаянса (адсорбционные индикаторы) Адсорбционные индикаторы – красители, которые при адсорбции на осадке изменяют свой цвет. ( Флуоресцеин – для определения хлоридов при рН = 7-10, дихлорфлуоресцеин –для определения хлоридов при рН= 4, эозин – для определения бромидов, иодидов, тиоцианатов при рН=2). K + + I - + Ag + + NO 3 - = AgI + K + + NO 3 - 80
Слайд 81
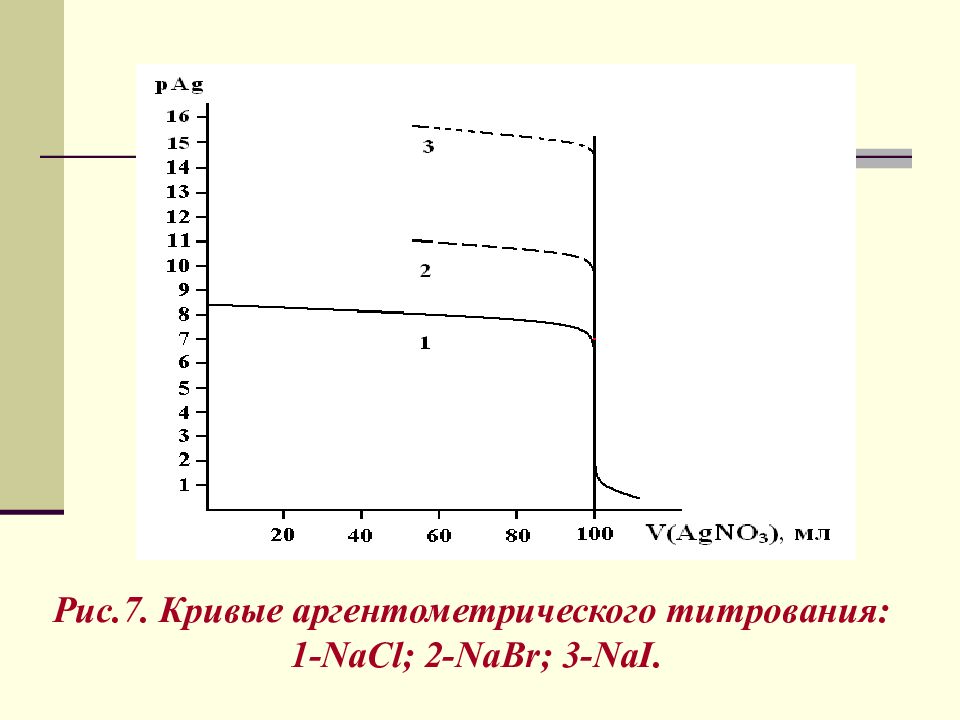
Рис. 7. Кривые аргентометрического титрования: 1- NaCl ; 2- NaBr ; 3- NaI.
Слайд 82
Факторы, влияющие на величину скачка титрования в методах осаждения 1. Концентрация реагентов. 2. Температура. 3. Произведение растворимости (ПР). 4. Ионная сила раствора ( I). 82
Слайд 83
Меркурометрия Рабочий раствор – Hg 2 ( NO 3 ) 2 FeSCN 2+ - кроваво - красный, Hg 2 (SCN) 2 – белый. 2. Индикатор дифенилкарбазон – адсорбционный индикатор, который окрашивает суспензию Hg 2 Cl 2 в сине-фиолетовый цвет. Hg 2 2+ + 2 X - = Hg 2 X 2 ; X= Cl -, Br -, SCN - ; ПР= [Hg 2 2+ ][X - ] 2 1. Ин д икатор – FeSCN 2+ 2FeSCN 2+ + Hg 2 2 + = Hg 2 (SCN) 2 + 2Fe 3+ ; 83
Слайд 84
IV. Окислительно-восстановительное титрование Фактор эквивалентности – доля условной или реальной частицы, которая соответствует 1 электрону в окислительно-восстановительной реакции. f экв ( Fe 2+ ) = 1 В реакциях окисления-восстановления существует 2 редокс-пары. Окислительно-восстановительная система характеризуется окислительно-восстановительным потенциалом. 84
Слайд 86
Величина Е зависит от следующих факторов: t ; Концентрация; Величина рН; От реакций протекающих совместно:
Слайд 87
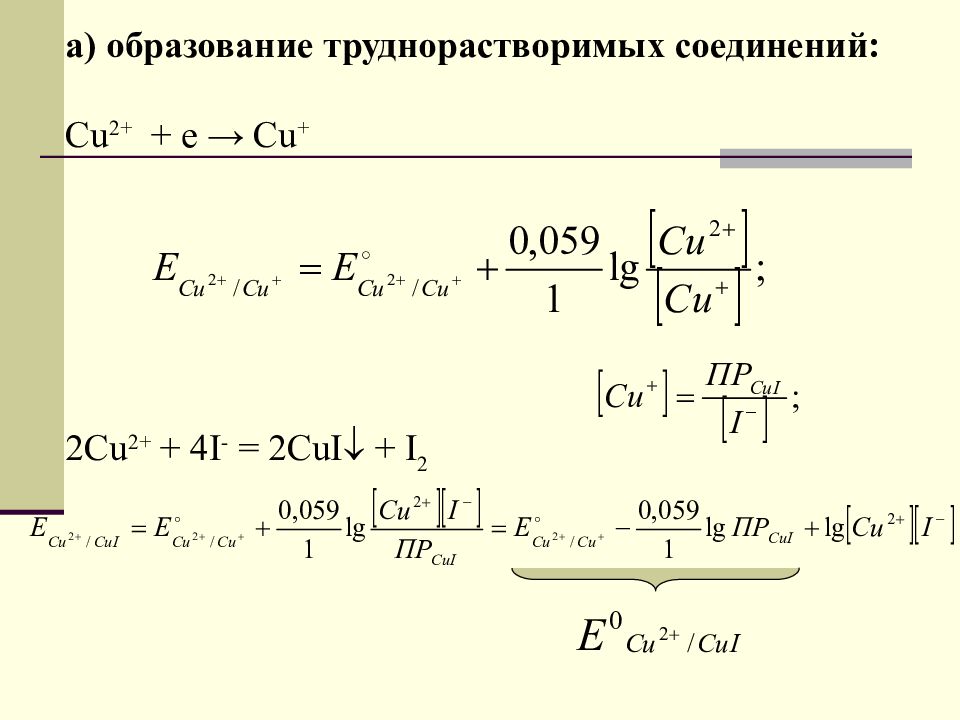
а) образование труднорастворимых соединений: Cu 2+ + e → Cu + 2Cu 2+ + 4I - = 2CuI + I 2
Слайд 89
Константа равновесия окислительно-восстановительных реакций 89 К р – константа равновесия реакции; E ox 0 - стандартный потенциал пары окислителя; E red 0 - стандартный потенциал пары восстановителя; m – наименьшее общее кратное из числа принятых и отданных электронов.
Слайд 90
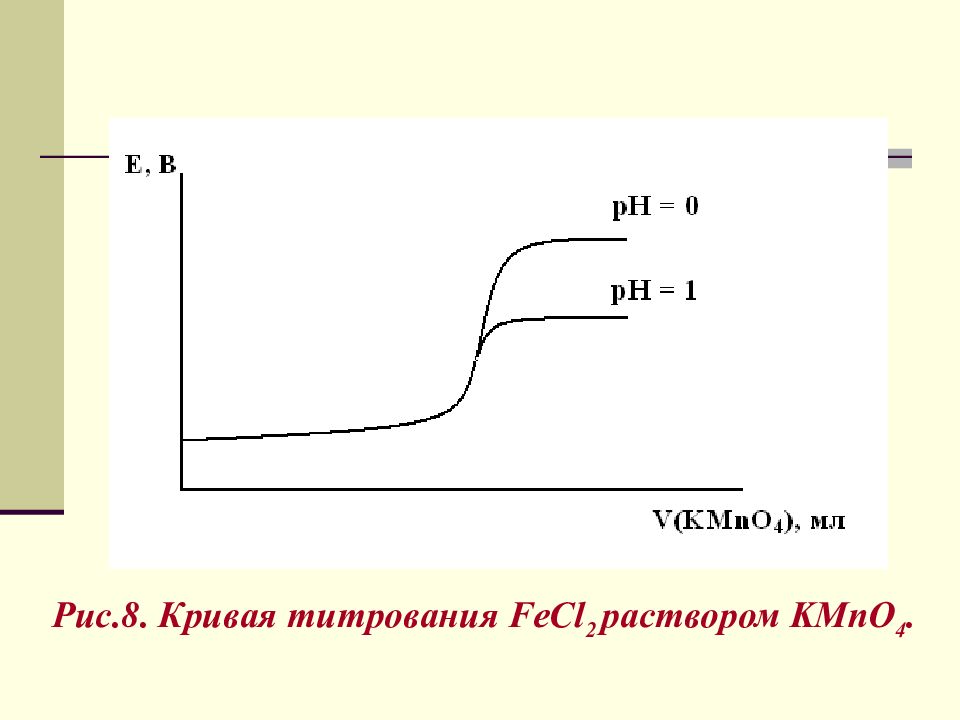
Расчет скачка титрования 100 мл 0,1 М FeCl 2 + V мл 0,1 н KMnO 4 ; Н + = 1 моль/л, рН=0 и [H + ]=0,1 моль / л, рН=1 0,1 н К MnO 4 = 0,02 М К MnO 4
Слайд 92
2 ) V ( KMnO 4 ) = 100 мл - точка эквивалентности, а) Н + = 1 моль/л, рН =0 а, в – число принятых и отданных электронов. б) Н + = 0,1 моль/л, рН=1 К р = 10 62,7 = 5 10 62
Слайд 94
3) V ( KMnO 4 ) = 100,1 мл а) Н + = 1 моль/л б) Н + = 0,1моль / л Величина скачка титрования зависит от рН. Кривую титрования строят в координатах Е – V титранта. 94
Слайд 96
Методы окислительно-восстановительного титрования Перманганатометрия KMnO 4 (безиндикаторный) ; Иодометрия I 2, Na 2 S 2 O 3 (индикатор - крахмал) ; Хроматометрия K 2 Cr 2 O 7 (индикатор - дифениламин) ; Броматометрия KBrO 3 (индикаторы - метиловый оранжевый, метиловый красный). 96
Слайд 97
Гравиметрический анализ Гравиметрический метод анализа основан на измерении массы вещества, полученного в результате химической реакции. а) Метод отгонки. Состоит в переводе одного из компонентов в летучее соединение и его последующем удалении б) Метод осаждения. Состоит в выделении определяемого вещества в осадок в виде малорастворимого соединения. 97
Слайд 98
Соединение, в виде которого определяемый компонент осаждают из анализируемого раствора, называют формой осаждения, которая должна отвечать требованиям : 1. Полнота осаждения. 2. Легкая фильтруемость. 3. Чистота осадка. 98
Слайд 99
Соединение, в виде которого определяемое вещество взвешивают, называют гравиметрической формой. Требования к гравиметрической форме: 1. Состав гравиметрической формы должен соответствовать химической формуле. 2. Гравиметрическая форма должна иметь большую молекулярную массу для определения меньшего количества вещества с большей точностью. 3. Гравиметрическая форма должна быть устойчива и не должна взаимодействовать с окружающей средой.
Слайд 100
Условия аналитического осаждения кристаллических осадков Размер частиц кристаллического осадка связан с величиной относительного пересыщения (О.П.) раствора в процессе осаждения, которая определяется по формуле: Чем меньше величина О.П., тем больше размер кристаллов.
Слайд 101
Основной причиной, вызывающей загрязнение осадков, является соосаждение – выпадение в осадок вместе с определяемым веществом примесей, для которых в условиях осаждения произведение растворимости не достигнуто. Соосаждение примесей на поверхности осадка называют адсорбцией. Соосаждение, при котором примеси или маточный раствор захватываются внутрь кристалла, называют окклюзией.
Слайд 102
Кристаллические осадки осаждают медленно из горячих, разбавленных растворов разбавленным раствором осадителя при интенсивном перемешивании в присутствии солей аммония. Аморфные осадки осаждают быстро из горячих, концентрированных растворов в присутствии солей аммония с последующим разбавлением. Горячие растворы сразу фильтруют.
Последний слайд презентации: Аналитическая химия (количественный анализ) курс лекций
Определение сульфата гравиметрическая форма и форма осаждения F – фактор перерасчета Погрешность метода не более 0,5%, масса определяемого вещества 0,01 1,00 гр., при процентном отношении не менее 0,1%. 103