Первый слайд презентации: Алкины (ацетиленовые углеводороды)
Слайд 2: Алкины (ацетиленовые углеводороды)
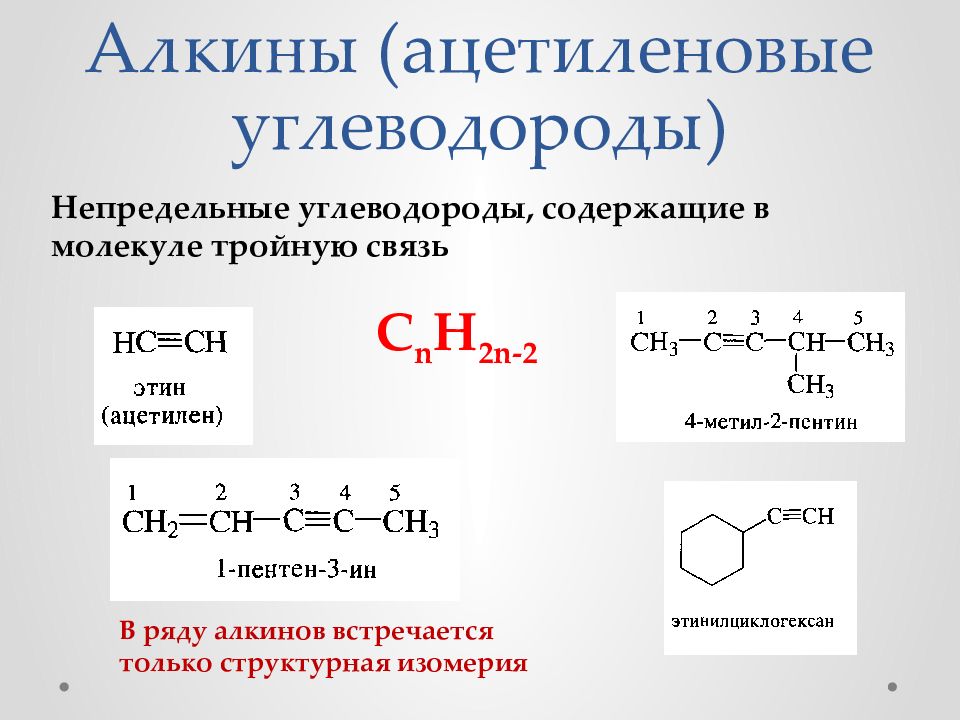
Непредельные углеводороды, содержащие в молекуле тройную связь С n H 2 n -2 В ряду алкинов встречается только структурная изомерия
Слайд 3: Электронное строение алкинов
Слайд 4: Физические свойства
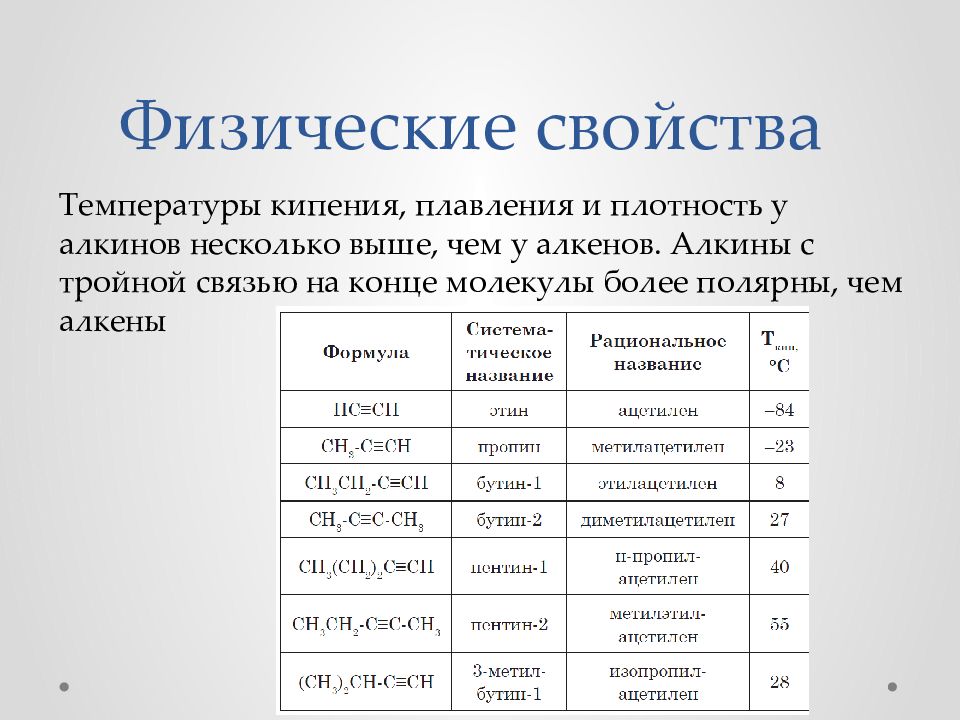
Температуры кипения, плавления и плотность у алкинов несколько выше, чем у алкенов. Алкины с тройной связью на конце молекулы более полярны, чем алкены
Слайд 6: Способы получения
1. Синтез из элементов (М. Бертло ) Историческое значение имеет синтез ацетилена из элементов, проведенный французским химиком М. Бертло (1863) при пропускании водорода над раскаленными электрической дугой графитовыми электродами
Слайд 8: Способы получения
3. Карбидный метод Синтез ацетилена из карбида кальция обработкой его водой (Ф. Велер, 1862) удобен как лабораторный Метод (в конце XIX века внедрен как промышленный способ)
Слайд 9: Способы получения
4. Дегидрогалогенирование вицинальных и геми - нальных дигалогеналканов Реакции проводят действием сильного основания : спиртового раствора щелочи или амида натрия в жидком аммиаке (реакция элиминирования)
Слайд 10: Способы получения
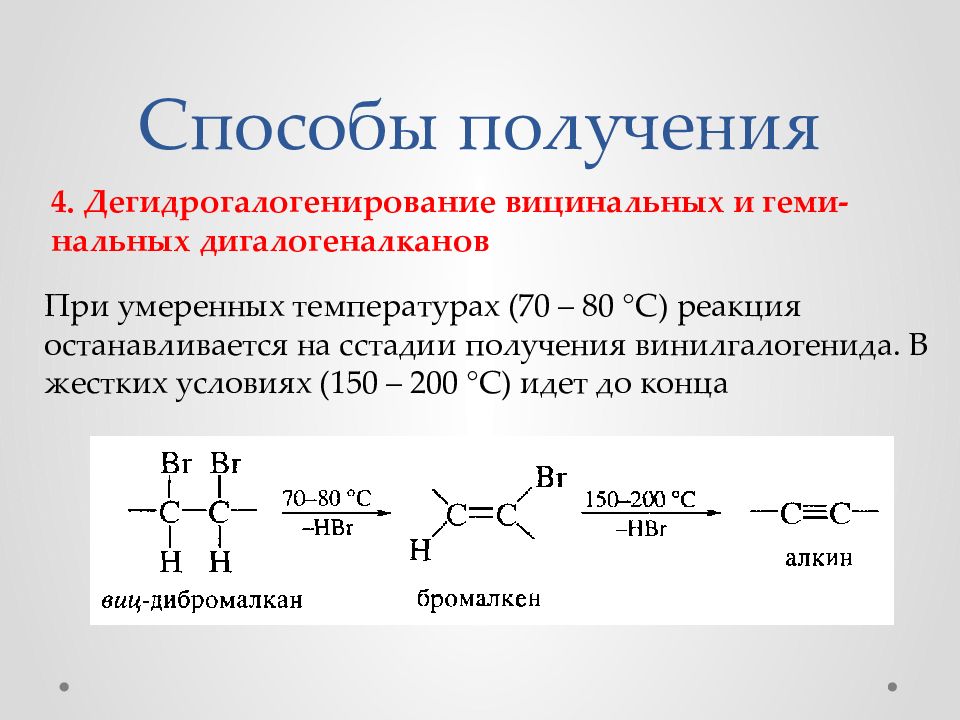
4. Дегидрогалогенирование вицинальных и геми - нальных дигалогеналканов При умеренных температурах (70 – 80 °С) реакция останавливается на сстадии получения винилгалогенида. В жестких условиях (150 – 200 °С) идет до конца
Слайд 11: Способы получения
5. Получение их тетрагалогенидов Из тетрагалогенидов алкины получают нагреванием с цинковой пылью Реакция имеет ограниченное применение, так как тетрагалогениды синтезируют обычно из алкинов
Слайд 12: Способы получения
6. Получение гомологов ацетилена с помощью ацетиленидов При обработке ацетилена металлическим натрием или амидом натрия образуется ацетиленид натрия, который алкилируют действием алкилгалогенидов с образованием гомологов ацетилена
Слайд 13: Способы получения
6. Получение гомологов ацетилена с помощью ацетиленидов Подобные превращения можно осуществлять также с по- мощью металлорганических соединений, например, с эти- нилмагнийгалогенидами ( Иоцич )
Слайд 15: Общая характеристика
Присоединение Замещение Полимеризация Окисление Конденсация Наиболее характерные реакции:
Слайд 16: Реакции электрофильного присоединения
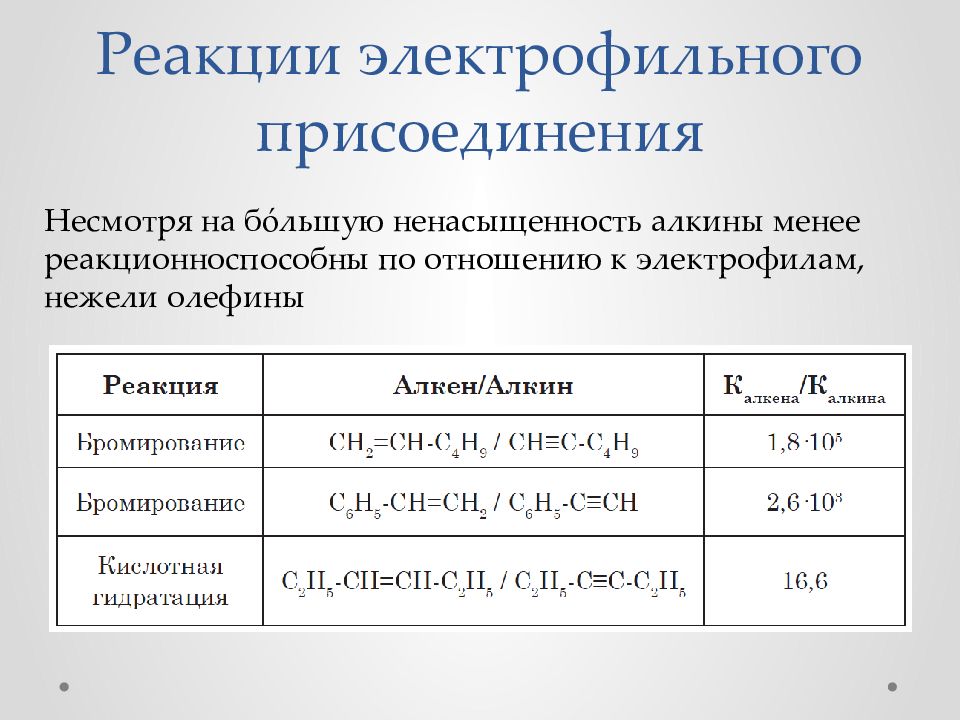
Несмотря на бóльшую ненасыщенность алкины менее реакционноспособны по отношению к электрофилам, нежели олефины
Слайд 17: Реакции электрофильного присоединения
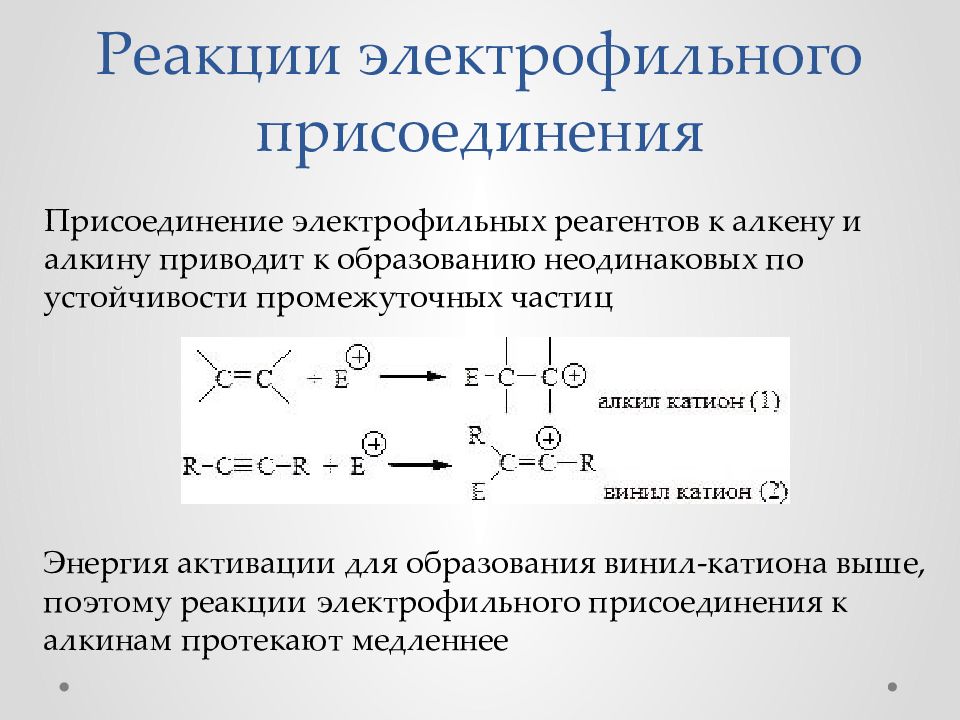
Присоединение электрофильных реагентов к алкену и алкину приводит к образованию неодинаковых по устойчивости промежуточных частиц Энергия активации для образования винил-катиона выше, поэтому реакции электрофильного присоединения к алкинам протекают медленнее
Слайд 18: Реакции электрофильного присоединения
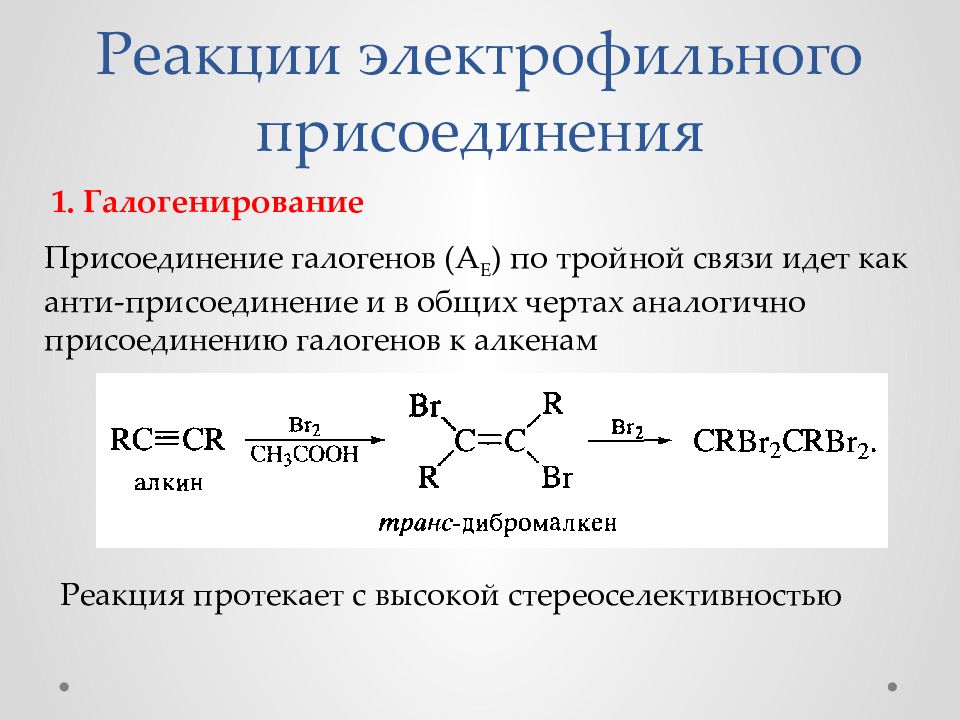
Присоединение галогенов ( A E ) по тройной связи идет как анти-присоединение и в общих чертах аналогично присоединению галогенов к алкенам 1. Галогенирование Реакция протекает с высокой стереоселективностью
Слайд 19: Механизм галогенирования
Стадия 1 – образование π -комплекса Стадия 2 – перегруппировка π -комплекса в мостиковый бромирениевый катион
Слайд 20: Механизм галогенирования
Стадия 3 – присоединение аниона брома к бромирениевому катиону
Слайд 21: Реакции электрофильного присоединения
1. Галогенирование При наличии сопряженной двойной и тройной связи галогенирование идет по тройной связи
Слайд 22: Реакции электрофильного присоединения
2. Гидрогалогенирование Галогеноводороды присоединяются к ацетиленовым углеводородам в две стадии по правилу М арковникова
Слайд 23: Механизм гидрогалогенирования
Стадия 1 – образование π -комплекса Стадия 2 – образование карбокатиона ( скоростьлимитирующая стадия)
Слайд 24: Механизм гидрогалогенирования
Стадия 3 – стабилизация карбокатиона взаимлжействием с бромид-ионом Гидробромирование алкинов менее стереоселективно по сравнению с гидробромированием алкенов и сопровождается образованием продуктов цис - и транс-строения
Слайд 25: Реакции электрофильного присоединения
3. Гидратация (реакция Кучерова ) Алкины присоединяют воду в присутствии серной кислоты и солей ртути ( II) Промежуточным продуктом образуется ненасыщенный спирт ( енол ), который быстро перегруппировывается в карбонильное соединение ( правило Эльтекова-Эрленмейера, 1887 )
Слайд 26: Реакции электрофильного присоединения
3. Гидратация (реакция Кучерова ) К гомологам ацетилена вода присоединяется по правилу Марковникова
Слайд 27: Реакции электрофильного присоединения
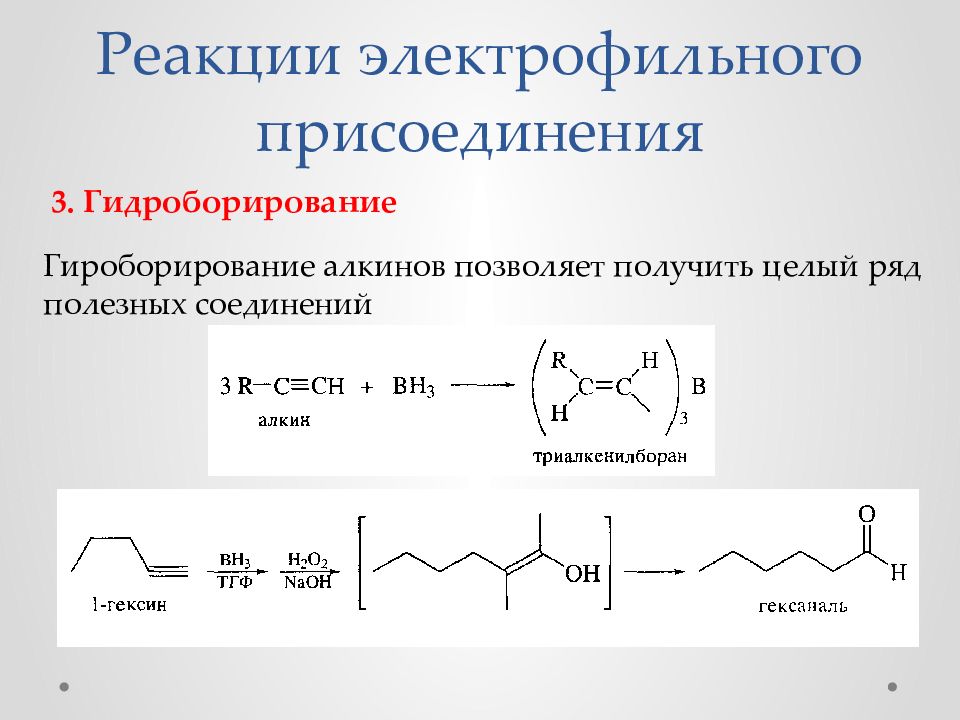
3. Гидроборирование Гироборирование алкинов позволяет получить целый ряд полезных соединений
Слайд 28: Реакции нуклеофильного присоединения ( A N )
4. Присоединение спиртов (реакция Фаворского) Спирты присоединяются к ацетилену в присутствии твер-дой щелочи, при нагревании и под давлением в несколько атмосфер с образованием простых виниловых эфиров
Слайд 29: Механизм реакции
Стадия 1 – образование сильного нуклеофила Стадия 2 – присоединение сильного нуклеофила к алкину с образованием карбоаниона
Слайд 30: Механизм реакции
Стадия 3 – стабилизация карбоаниона путем отрыва протона от молекулы спирта и регенерация алкоксид -иона
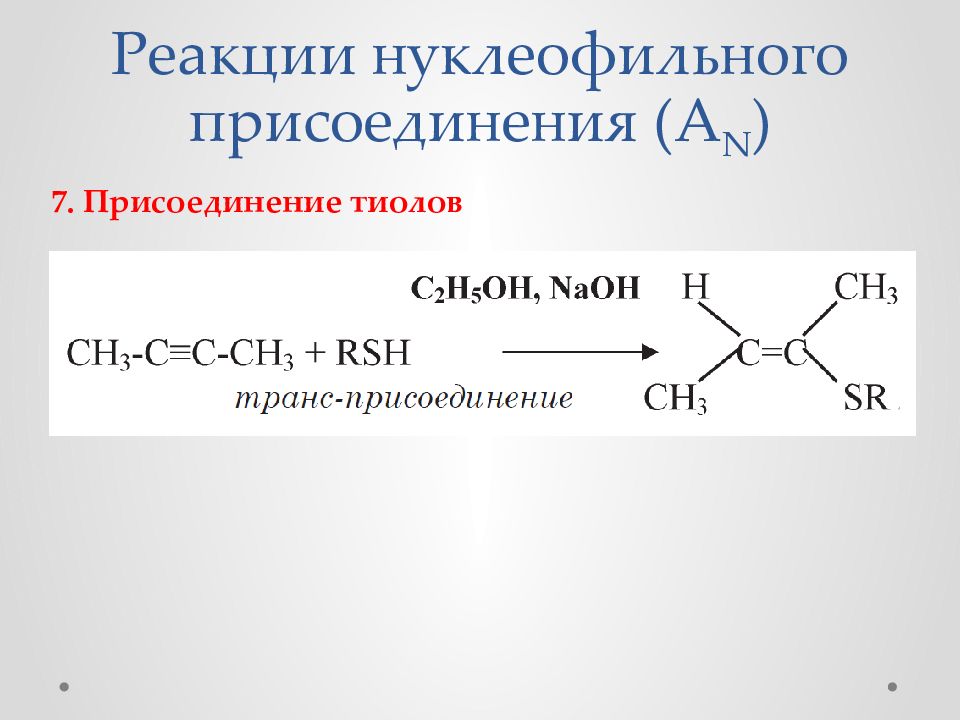
Слайд 31: Реакции нуклеофильного присоединения ( A N )
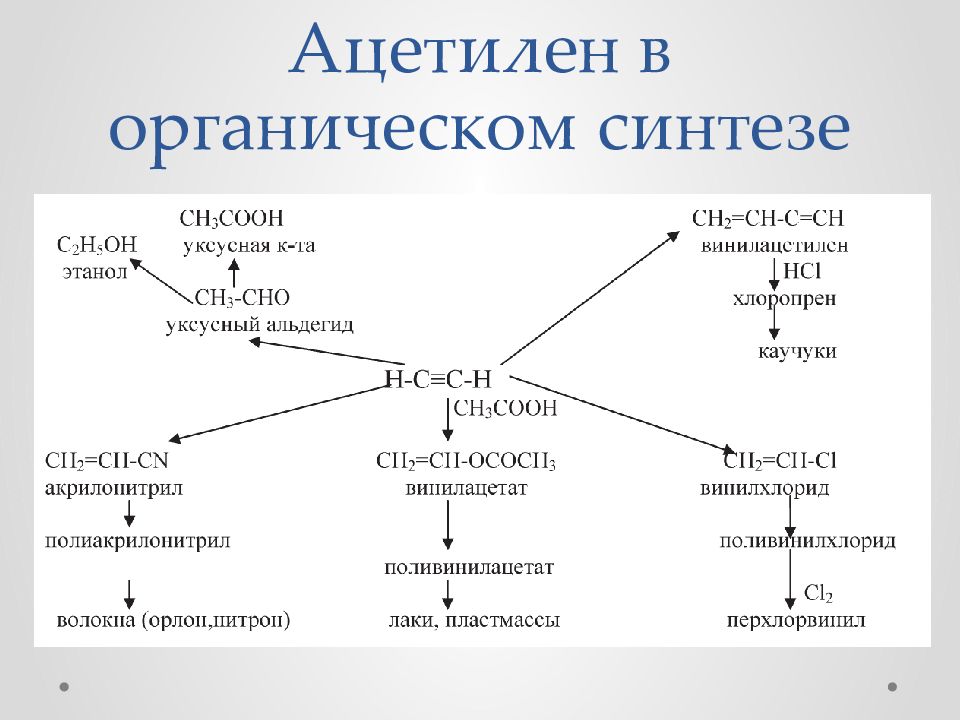
5. Присоединение синильной кислоты 6. Присоединение уксусной кислоты Акрилонитрил применяют для производства синтетического волокна – нитрона, винилацетат - поливинилацетата
Слайд 33: Реакции присоединения
8. Гидрирование Алкины, подобно алкенам, устойчивы к действию водорода в момент выделения и гидрируются действием молекулярного водорода в присутствии катализаторов гидрирования
Слайд 34: Гидрирование ( син -присоединение)
Гидрирование можно остановить на стадии образования алкена, если использовать Рd на карбонате кальция, дезактивированный ацетатом свинца ( катализатор Линдлара ). Реакция на этом катализаторе стереоселективна : водород присоединяется главным образом в цис - положение
Слайд 35: Гидрирование ( син -присоединение)
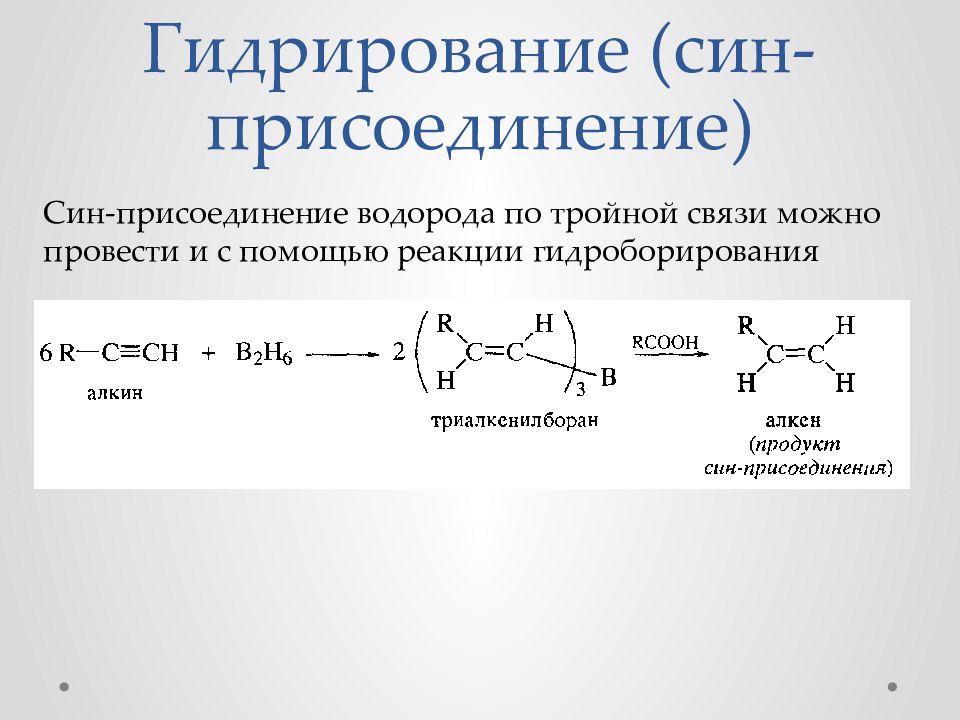
Син -присоединение водорода по тройной связи можно провести и с помощью реакции гидроборирования
Слайд 36: Гидрирование (анти-присоединение)
Избирательное и стереоселективное восстановление алкинов до алкенов возможно также алюмогидридом лития или раствором натрия в жидком аммиаке с образованием продуктов транс- гидрирования
Слайд 37: Реакции окисления
8. Окисление с полным разрывом связи Ацетиленовые углеводороды обесцвечивают щелочной раствор перманганата калия на холоду, но медленнее, нежели алкены (качественная реакция)
Слайд 38: Реакции окисления
9. Окисление с неполным разрывом связи При осторожном окислении, например, действием перманганата калия в нейтральной среде (или диоксида селена SeO 2 в серной кислоте), алкины могут образовывать α- дикетоны
Слайд 39: Реакции окисления
10. Озонирование Ацетилен может взаимодействовать с озоном при низкой температуре. Расщепление озонида приводит в востанови - тельной среде к образованию глиоксаля
Слайд 40: Реакции окисления
11. Горение На воздухе ацетилен горит сильно коптящим пламенем: в результате неполного окисления, кроме углекислого газа, образуется углерод
Слайд 41: Реакции олигомеризации
12. Получение винилацетилена Ацетилен вступает в реакцию ступенчатой полимери-зации в присутствии одновалентной меди в кислой среде ( Ньюленд )
Слайд 42: Реакции олигомеризации
13. Циклолигомеризация При температурах выше 400°С в присутствии активиро - ванного угля ацетилен и его гомологи подвергаются циклоолигомеризации и превращаются в бензол и его замещенные ( Зелинский, Казанский)
Слайд 43: Реакции олигомеризации
13. Циклолигомеризация Монозамещенные алкины при этом дают два триалкил - замещенных бензола (1,2,4- и 1,3,5-изомеры). Дизамещенныеалкины приводят к гексаалкилбензолам
Слайд 44: Реакции олигомеризации
13. Циклолигомеризация Монозамещенные алкины при этом дают два триалкил - замещенных бензола (1,2,4- и 1,3,5-изомеры). Дизамещенныеалкины приводят к гексаалкилбензолам
Слайд 45: Реакции олигомеризации
13. Циклолигомеризация Ацетилен в присутствии никелевых катализаторов спосо - бен подвергаться тетрамеризации с образованием циклооктатетраена ( В. Реппе, 1943 )
Слайд 46: Реакции полимеризации
14. Полимеризация Алкины способны к полимеризации с образованием сопряженных полиенов
Слайд 47: Реакции изомеризации
15. Изомеризация алкинов (А.Е. Фаворский, 1888) При нагревании в присутствии сильных оснований алки - ны обнаруживают перемещение тройной связи, протекающее через промежуточное образование алленовых углеводородов
Слайд 48: Реакция конденсации
16. Реакция А.Е. Фаворского Изопрен можно получать из ацетона и ацетилена по реакции конденсации
Слайд 49: Кислотные свойства алкинов
Ацетилен и гомологи с тройной связью на конце молекулы способны взаимодействовать со щелочными металлами, их амидами, гидридами, а также с некоторыми солями тяжелых металлов с замещением водорода при тройной связи на металл и образованием солей – ацетиленидов
Слайд 50: Кислотные свойства алкинов
При пропускании над металлическим натрием при 150 °С образуется натрийацетиленид 17. Взаимодействие со щелочными металлами При нагревании натрийацетиленида до 220 °С получают динатрийацетиленид
Слайд 52: Кислотные свойства алкинов
18. Взаимодействие с металлорганическими соединениями
Слайд 53: Кислотные свойства алкинов
19. Качественная реакция Взаимодействие алкинов, имеющих концевую тройную связь, с аммиачным раствором гидроксида серебра или хлорида одновалентной меди сопровождается образованием характерных осадков серо-желтого и красно-бурого цвета