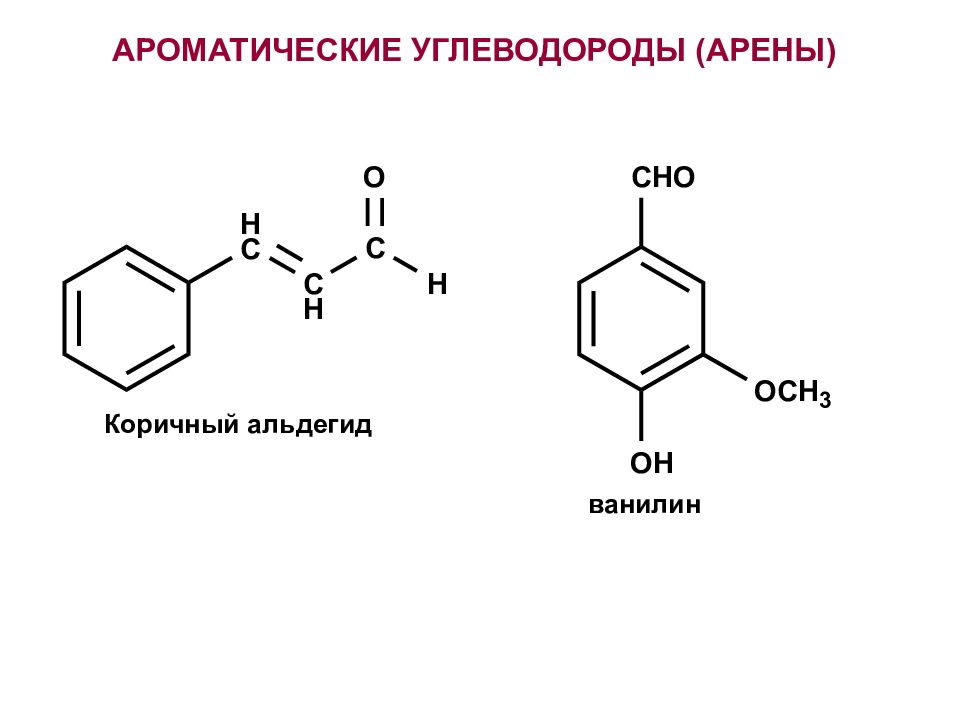
Первый слайд презентации: Ароматические углеводороды(арены). Бензол. Строение бензола
Слайд 2: Майкл Фарадей (1791-1867 )
Английский физик и химик, о дин из основателей количественной электрохимии. 1823 г. - впервые получил жидкий хлор, сероводород, оксид углерода ( IV), аммиак, оксид азота ( IV) 1825 г.- открыл бензол из светильного газа («карбюрированный водород»)
Слайд 3: Кекуле Фридрих Август (1829-1896)
Немецкий химик- органик Его исследования сосредоточены в области теоретической органической химии и органического синтеза. Высказал мысль о валентности как о целом числе единиц сродства, которым обладает атом. Углерод считал четырехвалентным.
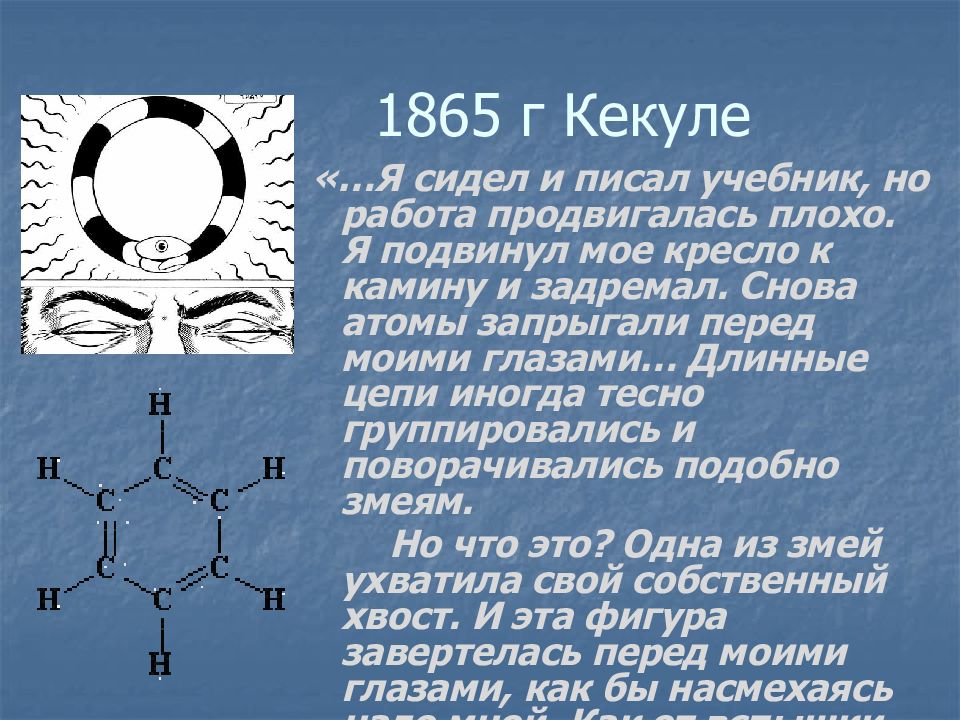
Слайд 4: 1865 г Кекуле
«…Я сидел и писал учебник, но работа продвигалась плохо. Я подвинул мое кресло к камину и задремал. Снова атомы запрыгали перед моими глазами… Длинные цепи иногда тесно группировались и поворачивались подобно змеям. Но что это? Одна из змей ухватила свой собственный хвост. И эта фигура завертелась перед моими глазами, как бы насмехаясь надо мной. Как от вспышки молнии, я пробудился. Остаток ночи я провел, обдумывая следствие из гипотезы …»
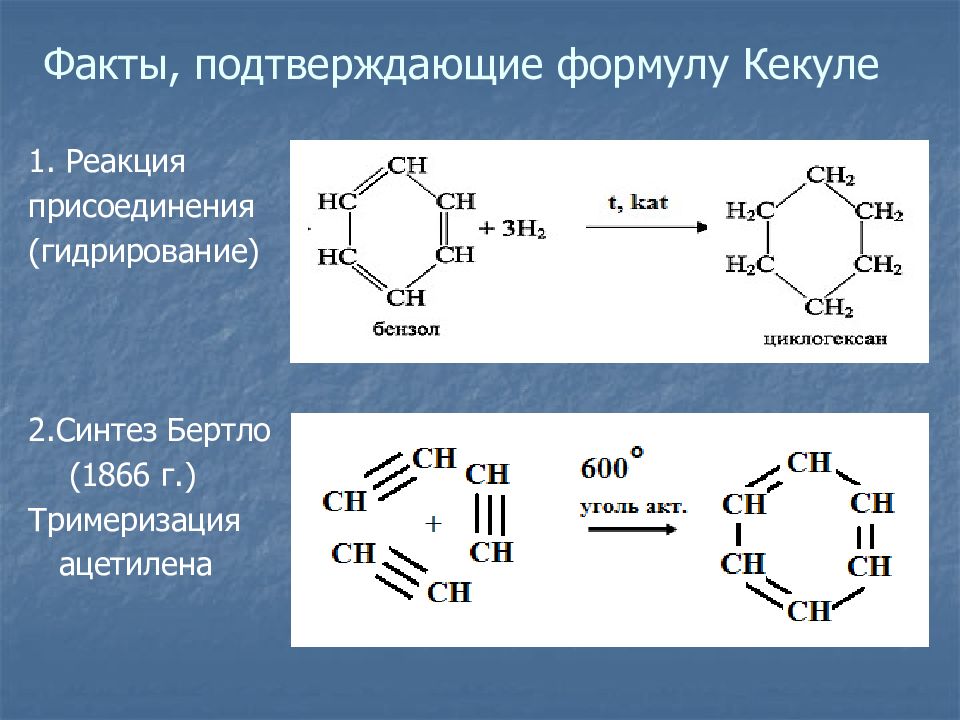
Слайд 5: Факты, подтверждающие формулу Кекуле
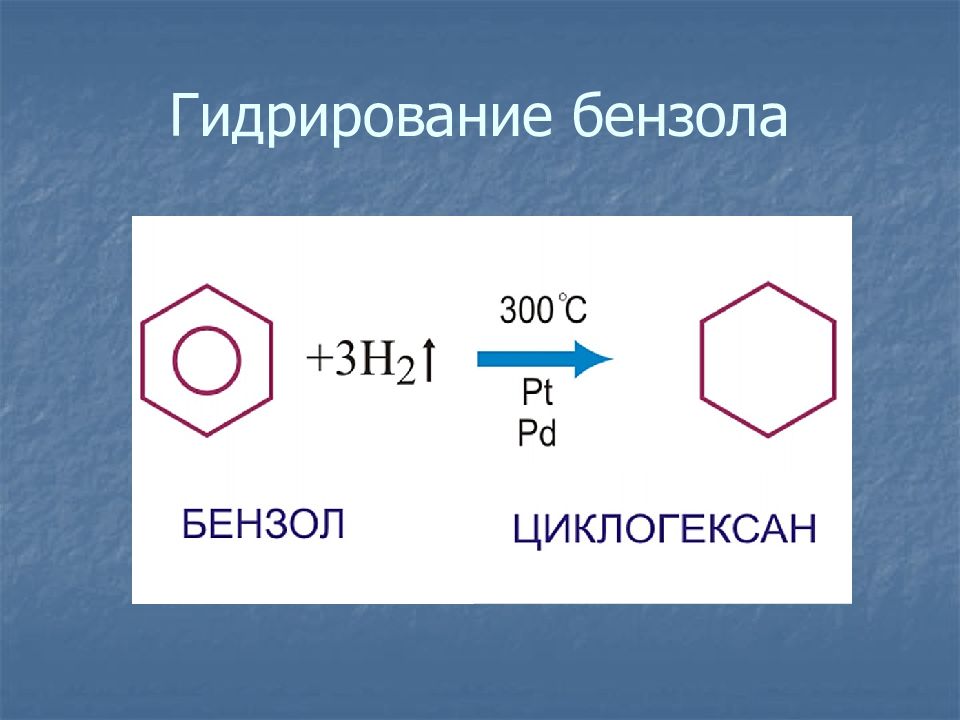
1. Реакция присоединения (гидрирование) 2.Синтез Бертло ( 1866 г.) Тримеризация ацетилена
Слайд 6: Факты, опровергающие формулу Кекуле
Бензол не обесцвечивает бромную воду и раствор KMnO4
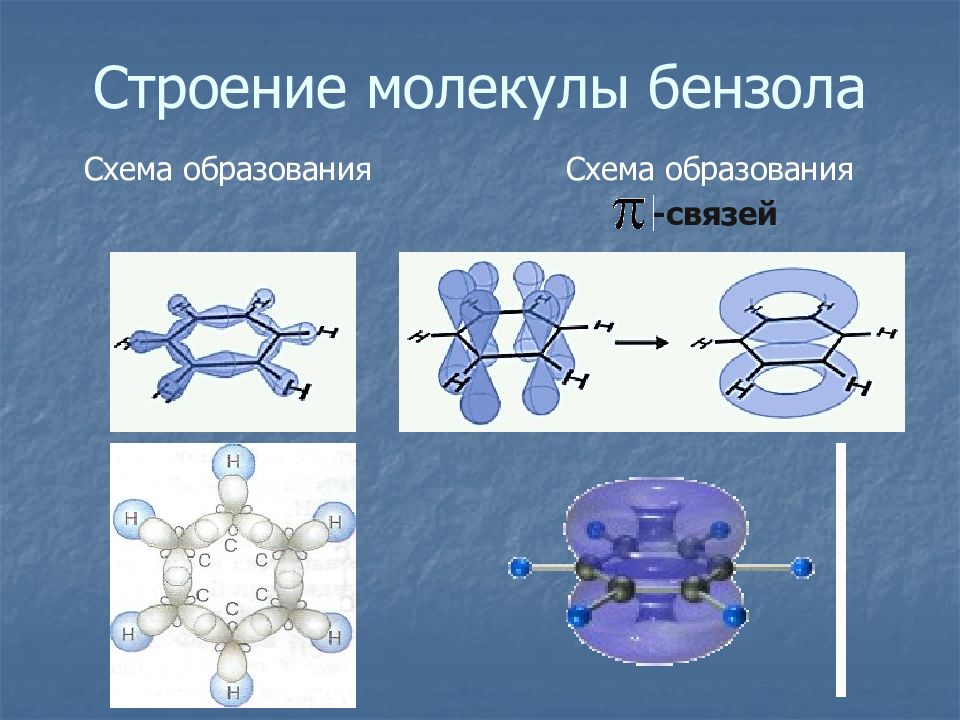
Слайд 7: Строение молекулы бензола
Слайд 8: Строение молекулы бензола
Схема образования σ -связей Схема образования -связей
Слайд 10: Арены или ароматические углеводороды
Соединения углерода с водородом, в молекулах которых имеется бензольное кольцо или ядро Общая форула :
Слайд 11: Обобщение сведений о строении и свойствах алканов, алкенов, алкинов, аренов
Признаки сравнения алканы алкены алкины арены Общая формула C n H 2n+2 C n H 2n C n H 2n-2 C n H 2n-6 Тип гибридизации SP 3 SP 2 SP SP 2 Угол форма 109,28 тетраэдр 120 плоское 180 линейное 120 плоское Длина связи 0,154 нм 0,134 нм 0,12 нм 0,14 нм Реакции замещения характерны Не характерны Не характерны характерны Реакции присоединения Не характерны характерны характерны С трудом Обесцв. р- ром Перманганата калия Не характерны характерны характерны Не характерны
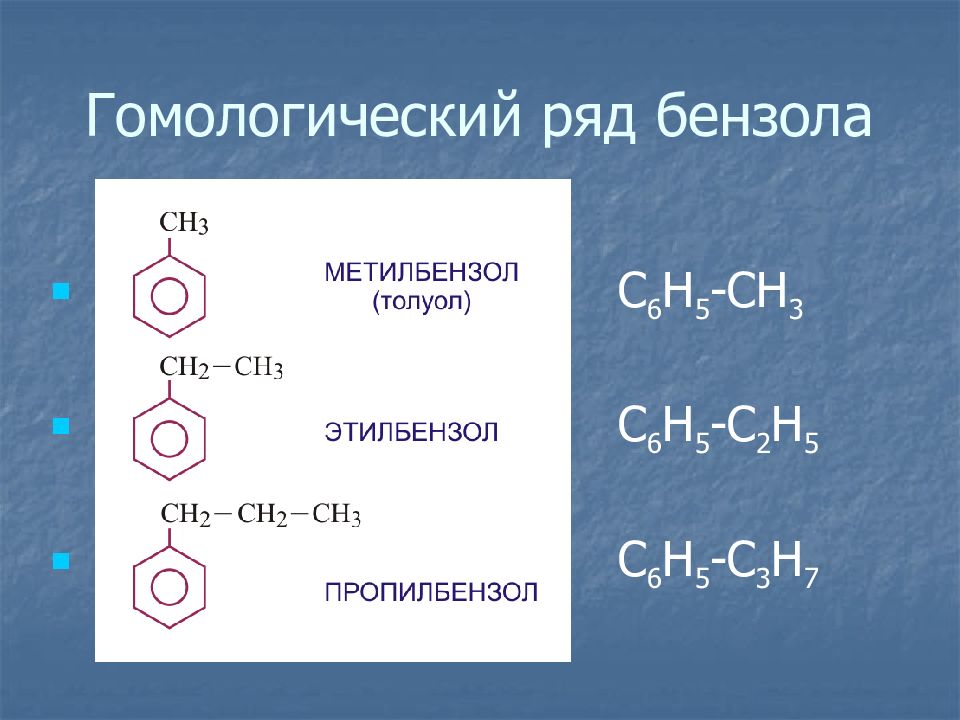
Слайд 12: Гомологический ряд бензола
С 6 Н 5 -СН 3 С 6 Н 5 -С 2 Н 5 С 6 Н 5 -С 3 Н 7 Гомологический ряд бензола
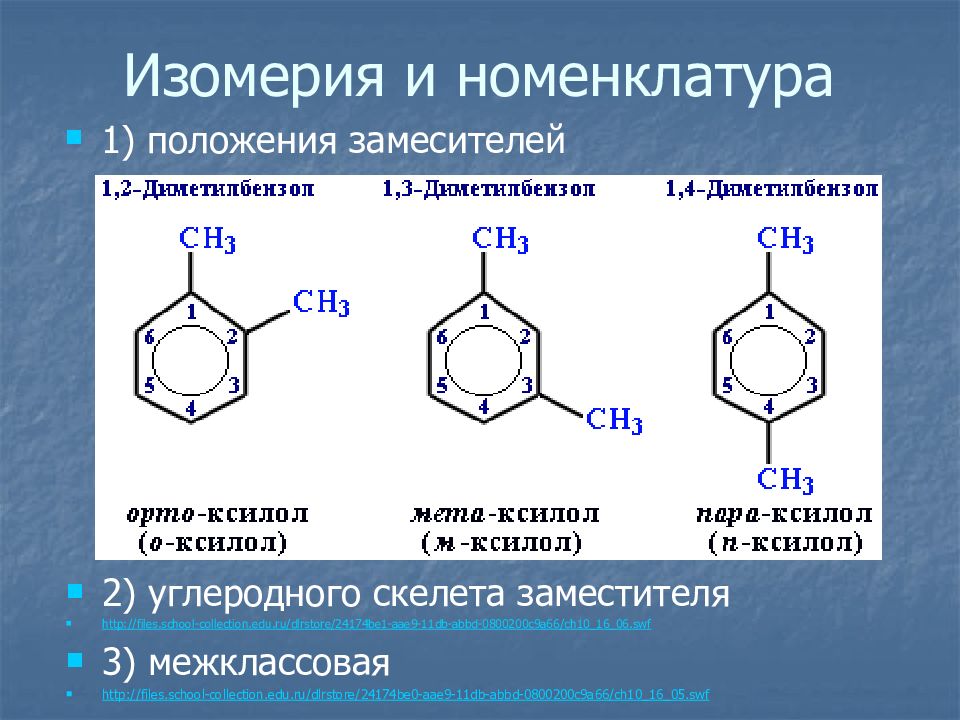
Слайд 13: Изомерия и номенклатура
1) положения замесителей 2) углеродного скелета заместителя http://files.school-collection.edu.ru/dlrstore/24174be1-aae9-11db-abbd-0800200c9a66/ch10_16_06.swf 3) межклассовая http://files.school-collection.edu.ru/dlrstore/24174be0-aae9-11db-abbd-0800200c9a66/ch10_16_05.swf
Слайд 14
Закрепление 1)Какова общая формула гомологического ряда аренов ? 2)В каком состоянии гибридизации находятся атомы углерода в молекуле бензола? 3)Чему равен валентный угол в молекуле бензола? 4)Имеет ли молекула бензола кратные связи? 5)Что такое ароматическая связь? 6)Каково современное изображение молекулы бензола?
Слайд 17: Физические свойства
Бесцветная, летучая жидкость Температура кипения +80 ° С Температура плавления +5 ° С Плотность 0,86 г/см3 Характерный запах! Не растворяется в воде, но р астворяется в спирте, эфире Бензол и его пары ядовиты!
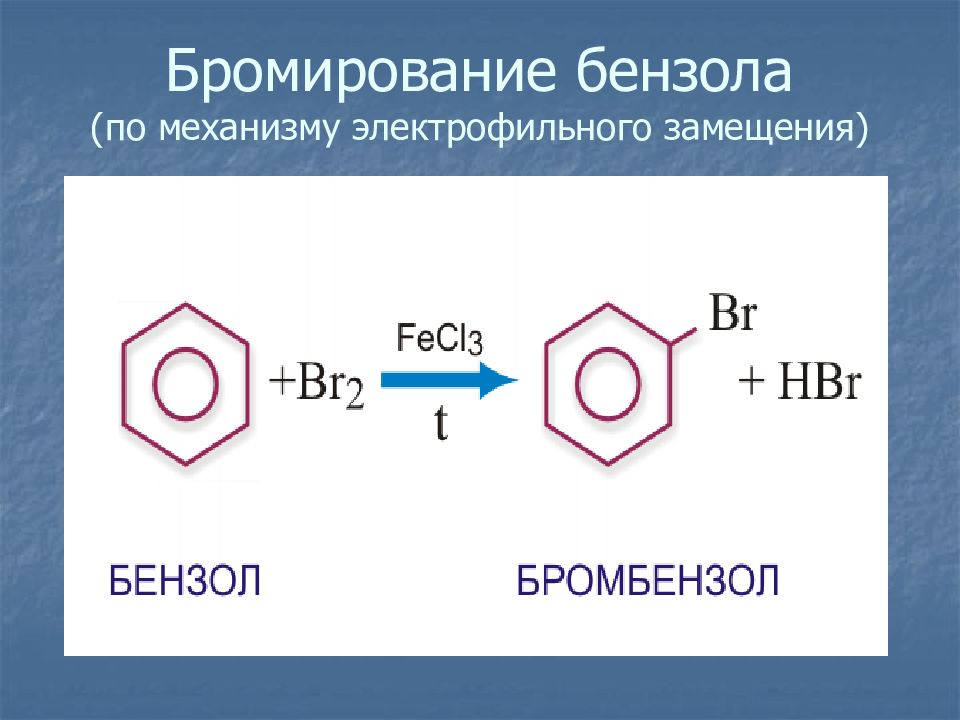
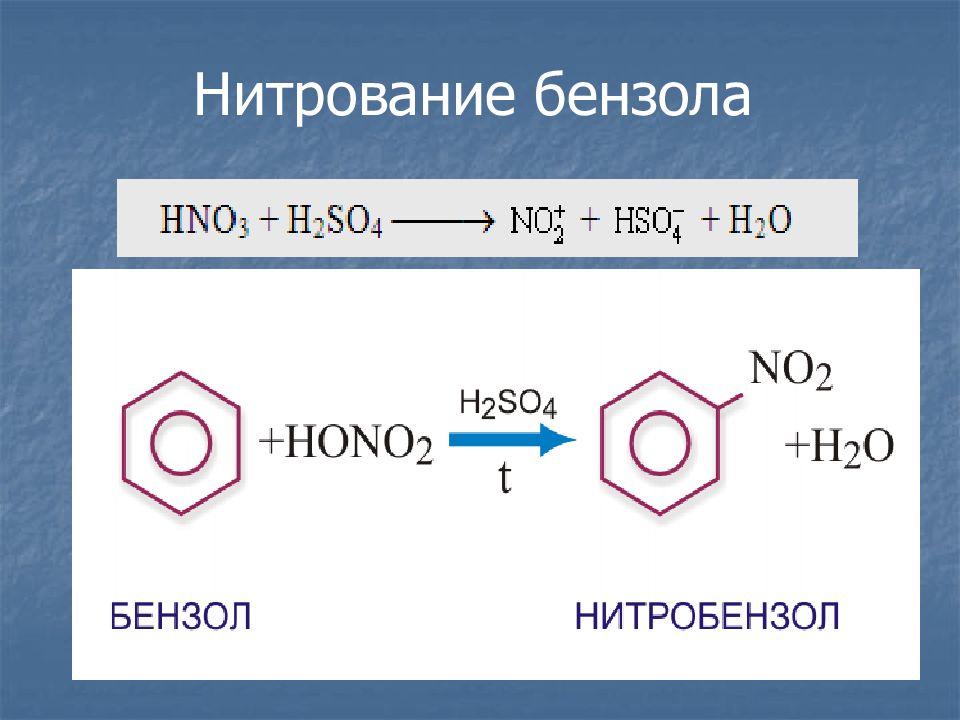
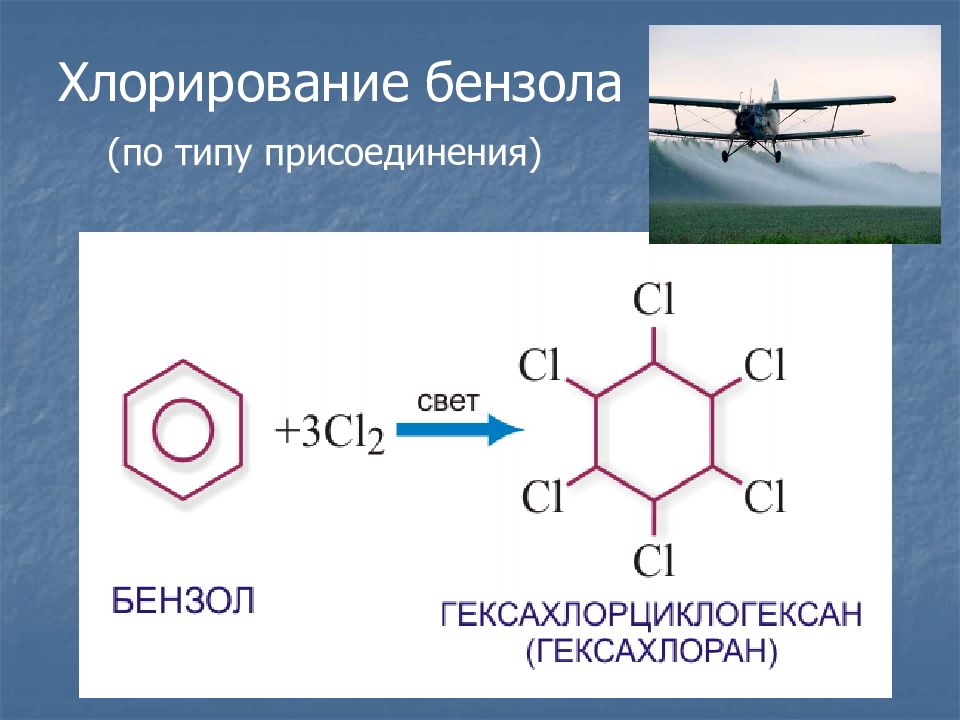
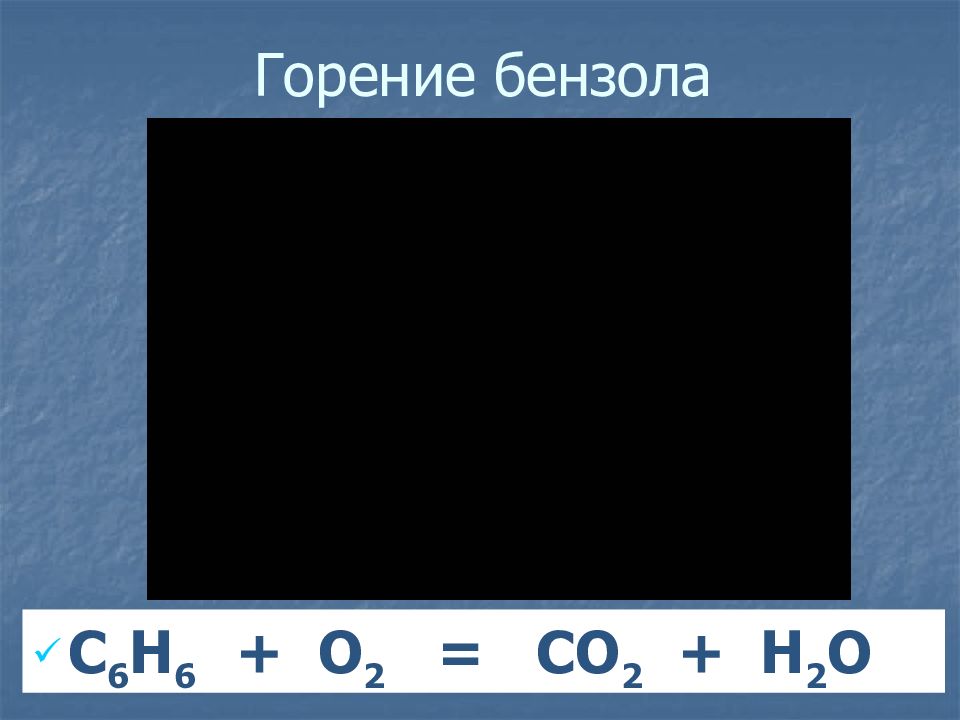
Слайд 18: Химические свойства
Разорвать р-электронное облако в молекуле бензола сложно. Для того чтобы бензол вступил в химические реакции, необходимы жесткие условия : повышенная температура, свет, а во многих случаях – катализатор.
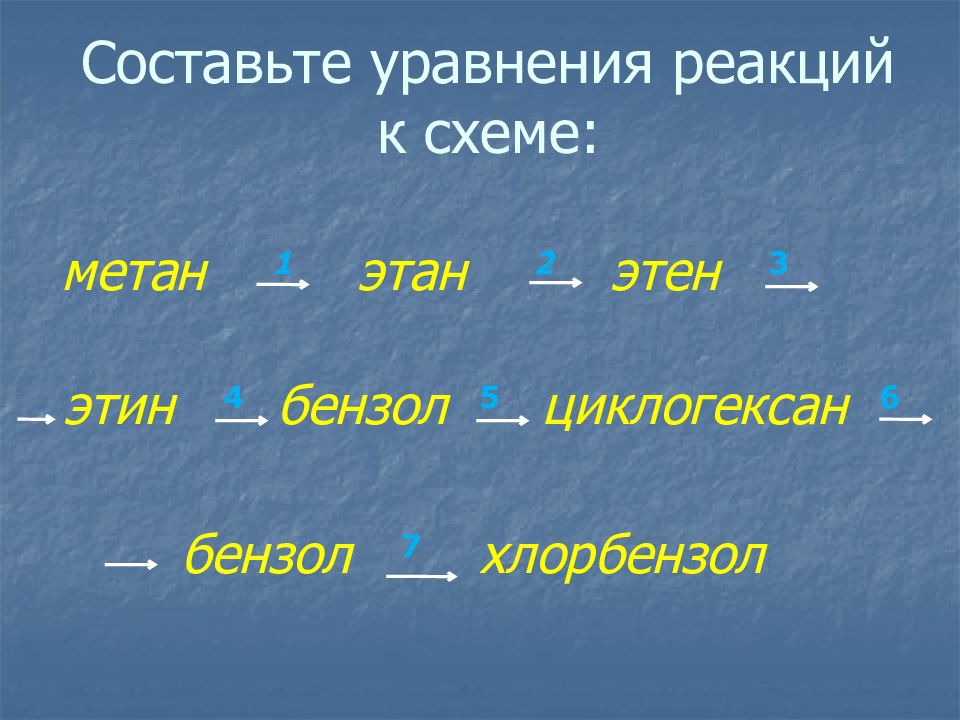
Слайд 27: Составьте уравнения реакций к схеме:
метан 1 этан 2 этен 3 этин 4 бензол 5 циклогексан 6 бензол 7 хлорбензол