Первый слайд презентации: Окислительно-восстановительные реакции (ОВР) ОВР с участием органических веществ Окисление углеводородов
Слайд 2: Горение органических веществ
Реакция горения приводит к полному окислению органических веществ, в результате чего образуются СО 2 и Н 2 О При сгорании азотсодержащих веществ выделяется также N 2 Горение хлорпроизводных углеводородов сопровождается выделением H С l
Слайд 3: Алканы
При обычных условиях устойчивы к действию окислителей (растворы KMnO 4, K 2 Cr 2 O 7 ). В результате контролируемого каталитического окисления кислородом можно получить спирты, альдегиды, кетоны, карбоновые кислоты :
Слайд 4: Алкены
В зависимости от природы окислителя и условий реакции образуются различные продукты: двухатомные спирты, эпоксиды, альдегиды, кетоны, карбоновые кислоты При окислении водным раствор o м KMnO 4 при комнатной температуре происходит разрыв π-связи и образуются двухатомные спирты : Обесцвечивание раствора перманганата калия - качественная реакция на кратную связь
Слайд 5: Алкены
В результате каталитического окисления алкенов кислородом воздуха получают эпоксиды : Озон легко окисляет алкены, расщепляя молекулу по месту двойной связи с образованием альдегидов и кетонов в зависимости от строения алкена (используется для определения строения алкена ):
Слайд 6: Алкины
Алкины легко окисляются перманганатом калия и бихроматом калия по месту кратной связи При действии на алкины водным раствором KMnO 4 происходит его обесцвечивание (качественная реакция на кратную связь) При взаимодействии ацетилена с водным раствором перманганата калия образуется соль щавелевой кислоты (оксалат калия):
Слайд 7: Алкины
Окисление перманганатам калия в кислой среде при нагревании сопровождается разрывом углеродной цепи по месту тройной связи и приводит к образованию кислот : Окисление алкинов, содержащих тройную связь у крайнего атома углерода, сопровождается в этих условиях образованием карбоновой кислоты и СО 2 :
Слайд 8: Циклоалканы
При действии сильных окислителей ( KMnO 4, K 2 Cr 2 O 7 и др.) циклоалканы образуют двухосновные карбоновые кислоты с тем же числом атомов углерода: Адипиновая кислота используется для производства полиамидных волокон – капрона и найлона
Слайд 9: Арены
Бензол Устойчив к окислителям при комнатной температуре Не реагирует с водными растворами перманганата калия, бихромата калия и других окислителей Можно окислить озоном с образованием диальдегида :
Слайд 10: Арены
Гомологи бензола Окисляются относительно легко. Окислению подвергается боковая цепь, у толуола – метильная группа. Мягкие окислители ( MnO 2 ) окисляют метильную группу до альдегидной группы : Более сильные окислители – KMnO 4 в кислой среде или хромовая смесь при нагревании окисляют метильную группу до карбоксильной : В нейтральной или слабощелочной среде образуется не сама бензойная кислота, а ее соль - бензоат калия :
Слайд 11: Арены
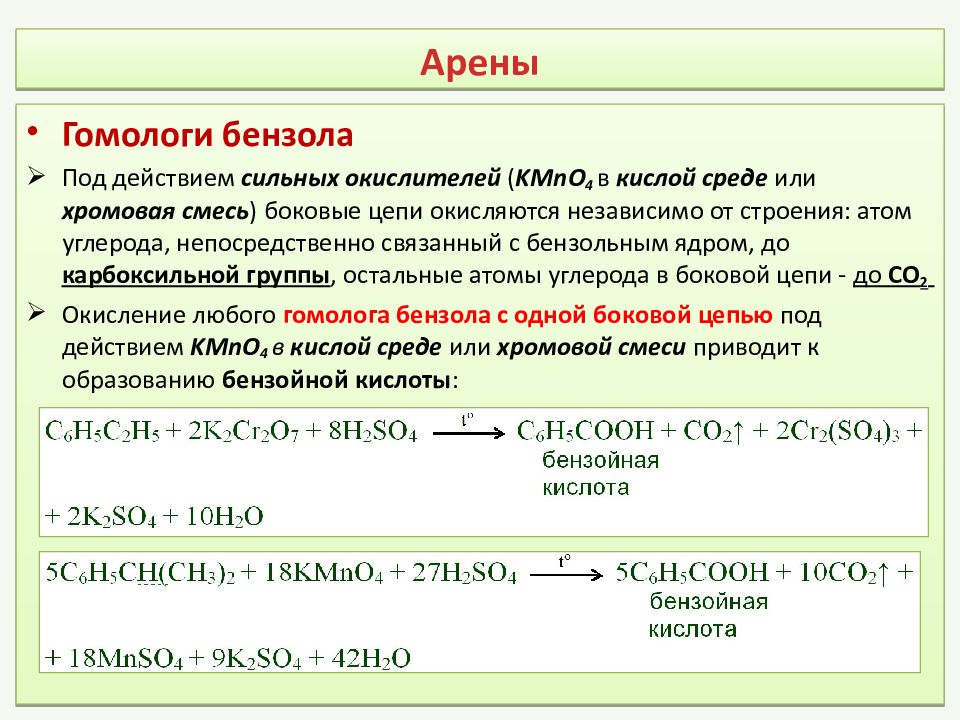
Гомологи бензола Под действием сильных окислителей ( KMnO 4 в кислой среде или хромовая смесь ) боковые цепи окисляются независимо от строения: атом углерода, непосредственно связанный с бензольным ядром, до карбоксильной группы, остальные атомы углерода в боковой цепи - до СО 2 Окисление любого гомолога бензола с одной боковой цепью под действием KMnO 4 в кислой среде или хромовой смеси приводит к образованию бензойной кислоты :
Слайд 12: Арены
Гомологи бензола, содержащие несколько боковых цепей, при окислении образуют соответствующие многоосновные ароматические кислоты: