Первый слайд презентации: Биологиялық жүйелердің термодинамикасы
Орындаған : Калжегитова М. Кадырхан ш. Керім е. Тексерген : Тулеуханов С. Биологиялық жүйелердің термодинамикасы ӘЛ-ФАРАБИ атындағы ҚАЗАҚ ҰЛТТЫҚ УНИВЕРСИТЕТІ Биология және биотехнология факультеті Алматы - 2020
Слайд 2: Жоспар
Кіріспе бөлім Негізгі бөлім Термодинамиканың I және II заңдары. Термодинамика заңдарының биологиялық жүйелер үшін қолданылу мүмкіндіктері. Энтропия және негэнтропия. Қайтымсыз процестер термодинамикасы. Организм және клетка «химиялық машина» ретінде. Гесс заңы. Қорытынды бөлім Пайдаланған әдебиеттер тізімі
Слайд 3: Кіріспе бөлім
Барлық нақты үдерістер тепе- тең емес болғандықтан, энтропияның үдемелілігіне қатысты алғанда олар қайтымсыз. Бұл екінші алғышарт термодинамикалық үдерістердің басым бағытын – « уақыт жебесін » енгізгендігін білдіреді. Классикалық физика үшін Лаплас детерминизміне қарама-қарсы, жансыз ж ə не биологиялық табиғаттағы осы қайтымсыз эволюцияның м ə ні туралы ə лі күнге дейін жалғасын тауып келе жатқан пікірталас тудырған мүлдем жаңа түсінік болды. Тепе- теңдік термодинамикасы статикалық физикада өзінің толық теориялық негізіне ие болды Термодинамика теориясының негізінде екі алғышарт бар. Біріншісі қуаттың сақталу ж ə не өзгеру заңы. Екіншісі кез келген тепе- тең емес үдерістер барабара үдей түсетін ( қалыпты жағдай ) термодинамикалық атқаратын қызметі бар екендігін көрсетті. Тепе- тең үдерістерде энтропия өзгермейді. Термодинамиканың физиканың бір саласы ретінде пайда болғанына 200 жылға жуықтады. Бастапқыда оның классикалық атауы тепе- теңдік термодинамикасы деп саналды. Тепе- теңдік термодинамикасы тепе- тең күй-қалыптар мен тепе- тең ( квазистатикалық ) үдерістерге сипаттама берді.
Слайд 4: Термодинамиканың I және II заңдары
Слайд 5: Термодинамиканың бірінші заңы
Слайд 7: Т ермодинамиканың екінші заңы
Тірі организмдерде жүріп отыратын барлық процестер қайтымсыз болғандықтан энтропия үнемі өсіп отырады. Бұл кезде энергияның бір бөлігі энергиясы аз метаболизмнің соңғы өнімдері түрінде сыртқа шығарылып отырады. Организм, ашық жүйе болып есептеледі, сырттан энергияны қабылдайды және оны энергияға бай қосылыс (АТФ) түрінде жинақтайды. Бұл жағдайда жүйенің энтропиясы төмендейді. Қорға жиналған энергия пайдалы жұмыс жасау үшін жұмсалады.
Слайд 8: Термодинамиканың екінші заңы
Термодинамиканың екінші заңының жалпы анықтамасы : Оқшауланған жүйеде өздігінен жүретін процесс егер процесс қайтымсыз болса, бос энергияның азаюына алып келеді, ал егер қайтымды болған жағдайда бос энергияның мөлшері тұрақты немесе өте аз (минимум) көрсеткішінде болады. G 0. Термодинамиканың екінші бастамасы бойынша энергияның әр түрі жылуға айналады да, ал кері бағытта жылудың энергияға айналуы толық болмайды.
Слайд 9: Термодинамиканың бірінші заңының биожүйелер үшін тұжырымдамасы
Ал, термодинамиканың бірінші және екінші бастамаларын біріктірсек, онда мынаны аламыз : Тірі организмдерде жасалатын жұмыстың барлығы АТФ энергиясы есебінен атқарылады. АТФ – әмбебаб энергия көзі : АТФ + Н 2 О АДФ + Н 3 РО 4 + 7,0 – 8,5 ккал
Слайд 10: Термодинамика заңдарының биологиялық жүйелер үшін қолданылу мүмкіндіктері
Термодинамиканың бірінші бастамасы өлі табиғатқа да, тірі табиғатқа да қолданыла беретін болса, термодинамиканың екінші бастамасының тірі табиғатқа бірден қолдануға болмайды. Оның себебі тірі ағза жабық жүйе емес ашық жүйеге жатады. Max Rubner (1854-1932 ) Термодинамиканың бірінші заңын тірі жүйелер үшін қолдану мүмкіндігі туралы алғаш рет неміс физиологы, әрі гигиенист Макс Рубнер айтты.
Слайд 11
Термодинамиканың екінші заңына сәйкес жүйенің күйі оның ерекше функциясы – энтропиямен S сипатталады. Энтропия берілген жағдайда қандай процестер жүруі мүмкін және ол жүрген жағдайда қай шекке дейін жүруі мүмкін екендігін анықтайды. Энтропия қайтымсыз процестердегі энергияны жоғалтуды сипаттайды. Энтропияның өзгерісі S жүйенің сіңірген жалпы жылу мөлшерінің жүйе температурасына қатынасымен анықталады. Q / T : S Q/T мұндағы, Q – жүйенің сіңірген жылуы, Т – температура. Оқшауланған жүйе үшін Q = 0 болғандықтан теңдеу мынадай түрге өзгереді : S 0
Слайд 12
Яғни, қайтымды процестер кезінде энтропияның өзгерісі S = 0, Ал қайтымсыз процестерде энтропия оң мәнге ие : S > 0 Оқшауланған жүйедегі энтропия тепе- теңдік ( қайтымды ) жағдайда S өзгеріссіз қалады және тепе- теңсіздік ( қайтымсыз ) жағдайда өседі. Энтропия – оқшауланған жүйедегі энергия айналымы бағытын анықтаушы критерий болып есептеледі.
Слайд 13: Энтропия және негэнтропия
Энтропия ұғымын термодинамикаға 1865 ж. Р.Клаузиус енгізген. Кез келген А және В күйлеріндегі жүйе энтропиясы мәндерінің айырымы мына формула арқылы анықталады :, мұндағы dQ – жүйеге күйі шексіз аз квазистатик. болып өзгергенде берілетін жылу мөлшері, Т – жүйенің абс. темп-расы; интрегал екі күйді өзара жалғастыратын кез келген қайтымды жолмен алынады. Изотерм. процесс жағдайында : dS =Q/ Т. Ал кез келген қайтымды жолмен алынатын тұйық процесс үшін :. Соңғы теңдік энтропияның dS = dQ / Т түріндегі толық дифференциал болатындығының қажетті және жеткілікті шарты, ал энтропия – күй функциясы. Энтропияның абс. мәні термодинамиканың үшінші бастамасы бойынша анықталады және ол бойынша абс. нөл темп-рада кез келген жүйенің энтропиясы нөлге айналады. Р.Клаузиус Энтропия (гр. бұрылыс, айналу ) – тұйық термодинамикалық жүйедегі өздігінен жүретін процестің өту бағытын сипаттайтын күй функциясы. Энтропияның күй функциясы екендігі термодинамиканың екінші бастамасында тұжырымдалады.
Слайд 14: Энтропия және негэнтропия
Негэнтропия - бұл энтропия тұжырымдамасына қосу арқылы қалыптасқан және оның қарама-қарсылығын білдіретін философиялық және физикалық термин. Ең жалпы мағынада бұл энтропия мағынасында керісінше болып табылады және жүйеде тәртіпті және жүйені ұйымдастыруды немесе жүйеде қол жетімді энергияның сапасын білдіреді.Бұл термин кейде физика және математика ( ақпараттық теория, математикалық статистика) математикалық жағынан энтропияның мәніне қарсы келетін сандарды белгілеу үшін қолданылады. « Теріс энтропия» тұжырымдамасы 1943 жылы австриялық физик Эрвин Шредингердің « Өмір дегеніміз не?» Атты танымал кітабында ұсынылған. Онда Нильса Бора- ның физикалық және философиялық заңдарды терең байланыстырғаны туралы идеясын жалғастыруға тырысты, оған сәйкес Нильса Бора жасаған біртұтастық принципі адамның білімін әлем бірлігін түсіну үшін біріктіруі мүмкін еді. Шредингер өз жұмысында былай деп жазады : « Біріншіден, осы терминдің ( физикалық ) мағынасын анықтау кезінде талқылауды « еркін энергия» терминімен бастағанын атап өткім келеді. Бұл осы тұрғыда неғұрлым нақты тұжырым. Бірақ бұл таза техникалық термин екі тіл арасындағы айырмашылықты түсінуге тырысатын орташа оқырман үшін жалпыға ортақ энергия концепциясына лингвистикалық тұрғыдан жақын келеді.» Эрвин Шредингер
Слайд 15
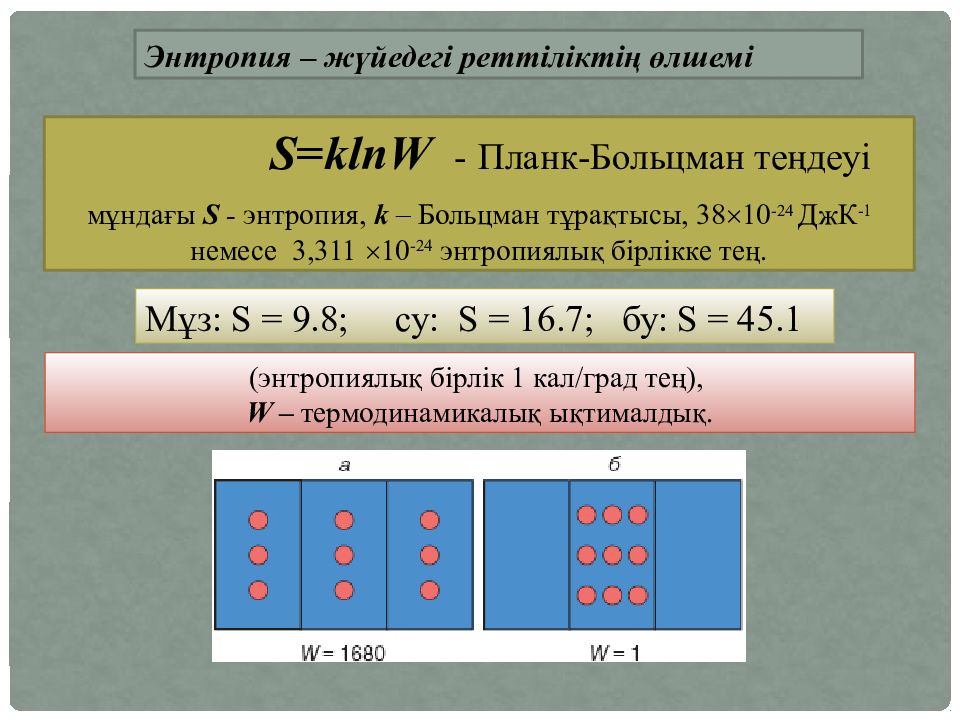
Энтропия – жүйедегі реттіліктің өлшемі S = klnW - Планк-Больцман теңдеуі мұндағы S - энтропия, k – Больцман тұрақтысы, 38 10 -24 ДжК -1 немесе 3,31 1 10 -24 энтропиялық бірлікке тең. ( энтропиялық бірлік 1 кал/град тең ), W – термодинамикалық ықтималдық. Мұз : S = 9.8 ; су: S = 16.7 ; бу : S = 45.1
Слайд 16: Қайтымсыз процестер термодинамикасы
Тепе- теңсіз күй арқылы өтетін кез-келген термодинамикалық процесс қайтымсыз термодинамикалық процесс деп аталады. Қайтымсыз процестердің тура және кері бағыттарда өтуі нәтижесінде термодинамикалық жүйе сырттан энергия жұмсалмайынша бастапқы күйіне қайта оралмайды. Мысал ретінде тік орналасқан поршенді цилиндрдегі газды қарастырайық. Шексіз баяу өтетін, сығылудың қайтымды процесін жасау үшін, поршенге шексіз аз мөлшердегі жүкті арттыру қажет. Егер жұмысшы дене ақырғы жылдамдықтармен процесті аяқтаса, онда мұндай процесс қайтымсыз болады. Поршеньнің ақырғы жылдамдығы кезінде, поршень маңындағы газ қысымды болады. Қалған көлемдегі газға қарағанда көп, жәнеде оның қысымы бүкіл көлем бойынша теңесуі үшін біршама уақыт талап етіледі. Газдың кеңеюі кезінде осы құбылысты керісінше тәртіпте байқаймыз. Тікелей поршень маңайындағы газдың қысымы қалған газдағыға қарағанда кем болады және газ біртіндеп кеңейіп цилиндрдің барлық көлемін алуы үшін біраз уақыт қажет болады. Осылай, ақырғы жылдамдықты кеңею және сығылу процестері қайтымсыз термодинамикалық процестер болып табылады.
Слайд 17
17 Қайтымды термодинами калық процес тер идеал процестер болады. Оларда кеңею кезінде газ максимал жұмысты жасайды, ол мына теңдеумен анықталады: мұндағы р- сыртқы орта қысымына тең, жұмысшы дененің қысымы. Ал сығылу кезінде, жұмысшы дене бастапқы күйге оралады, қайтымды процесте минимал жұмыс жұмсалады. Қайтымсыз процестер кезінде газ жұмысы теңдеумен анықталады мұндағы р- сыртқы ортаның қысымы. Газдың кеңеюі кезінде барлық уақытта газдың сығылуы кезінде керісінше Тек қана қайтымды процестер күй диаграммаларында графикалық түрде көрсетіле алады, өйткені бұл диаграммаларда әрбір нүкте дененің тепе-теңдікті күйін көрсетеді. Қайтымсыз процестердің графикалық бейнеленуі тіпті мүмкін емес, немесе параметрлерін орташаландырылған мәндермен алмастыра отырып, жуықтап көрсетуге болады.
Слайд 18: Организм және клетка « химиялық машина» ретінде
Организм және клетка қоршаған ортаның және клетканың арасында, сонымен қатар клетканың ішінде заттарды тасмалдаудың және химиялық реакциялардың нәтижесінде жұмыс істейтін химиялық машина. Осыған сәйкес биологиялық жүйені физикалық тұрғыдан түсіндіруде термодинамикаға негізделеді. Термодинамика физиканың бір бөлімі ретінде энергия мен жұмыстың арасындағы қатысты карастырады. Термодинамиканы кейде жылудың жалпы теориясы деп те атайды.Термодинамикалық дене немесе жүйе деп белгілі бір көлемге ие болатын затты айтады. Стационарлы күйде энергия және зат қоршаған ортамен алмасады ( ашық жүйе ) немесе тек энергиямен алмасатын ( жабық жүйе ) жүйелер болуы мүмкін. Қоршаған ортамен энергия не заттармен алмаспаған термодинамикалық жүйені жекеленген ( тұйық, изолированный) деп атайды. Жекеленген жүйе уақыт өткен соң термодинамикалық тепе- теңдік күйге келеді. Мұндай күйдегі, стационарлық күйдегі сияқты жүйенің параметрлері уақыт өткен соң өзгеріссіз қалады. Термодинамикалық жүйе деп клетканы, организмді және т. б. айтуға болады. Шынын айтқанда организм жылу машинасы ретіндеемес, химиялық машина ретінде жұмыс істейді.
Слайд 19: Гесс заңы
Химиялық айналымдар кезінде термодинамиканың бірінші заңынан шығатын салдар : Гесс заңы. Көптеген сатыдан өткен химиялық реакцияның жылу эффектісі реакцияның жүріп өткен жолына байланысты болмайды, ол тек қана химиялық жүйенің бастапқы күйдегі энергиясы мен соңғы күйдегі энергиясының айырмасына байланысты болады.
Слайд 20: Гесс заңының биологиядағы орны
Гесс заңы тағамның энергетикалық құндылығын ( калориялылығын ) анықтау үшін ветеринария мен медицинада қолданылады. Тағамның энергетикалық құндылығын анықтауда калориметриялық бомбада тамақты өрттейді. Сонда бөлініп шыққан жылу мөлшерін тіркеп алады. Ал егер тамақты адам жесе, онда тамақ организмде биохимиялық реакцияға түсіп, жылу бөлініп шығарады. Гесс заңы бойынша осы екі жылу бір-біріне тең болуға тиіс. Бұған глюкозаның тотығуы биохимиялық реакциясы мысал бола алады.