Первый слайд презентации: Дисциплина Химия. Общая химия
Флеровская О.Н. преподаватель высшей категории
Слайд 2: Дисциплина Химия. Общая химия
Тема. Атом. Ядро и электронная оболочка. Изотопы Строение электронных оболочек атома. Понятие об орбиталях.
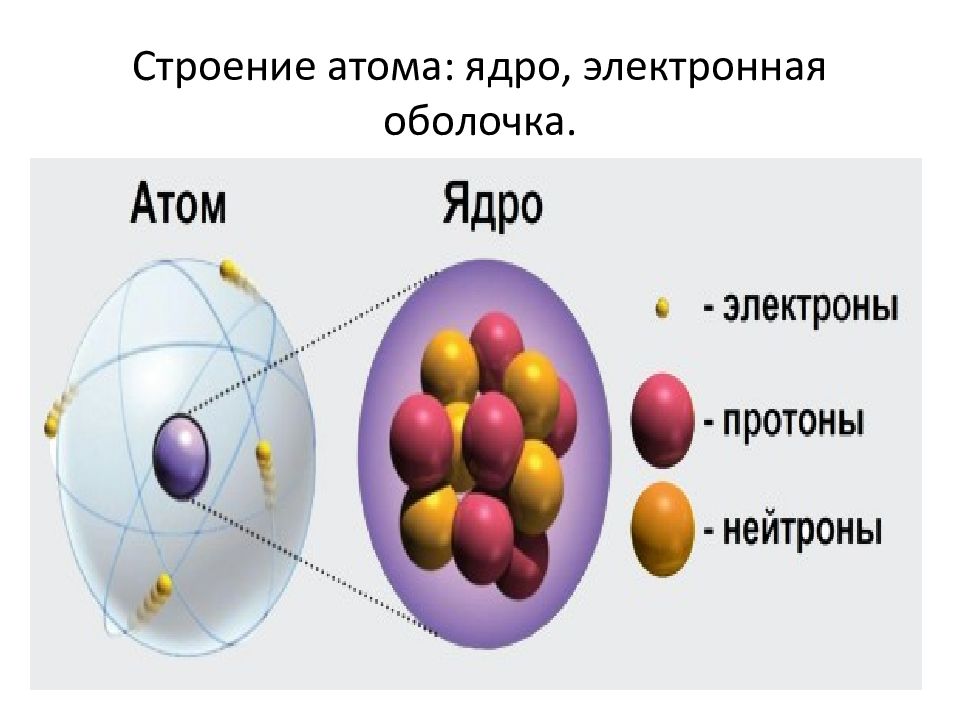
В результате экспериментов, посвященных изучению строения атома, было установлено, что атом состоит из положительно заряженного ядра и электронной оболочки. Ядро образовано протонами и нейтронами.
Слайд 5: Строение атома: ядро, электронная оболочка
Протон — это частица, имеющая положительный заряд (+). Нейтрон — это нейтральная частица, заряд ее равен 0.
Слайд 6: Строение атома: ядро, электронная оболочка
Электронная оболочка образована электронами, заряд у которых отрицательный. Число электронов равно числу протонов, поэтому заряд атома в целом равен 0 (т. е. атом электронейтральная частица). Число протонов, а следовательно, заряд ядра и число электронов численно равны порядковому номеру химического элемента.
Слайд 7: Строение атома: ядро, электронная оболочка
Практически вся масса атома сосредоточена в ядре. Это связано с тем, что масса электрона настолько меньше массы протона или нейтрона, что ею пренебрегают (не учитывают). Электроны двигаются вокруг ядра атома, не беспорядочно, а в зависимости от энергии, которой они обладают, образуя так называемый электронный слой.
Слайд 8: Строение атома: ядро, электронная оболочка
На каждом электронном слое может располагаться определенное число электронов: на первом — не больше двух, на втором — не больше восьми, на третьем — не больше восемнадцати.
Слайд 9: Строение атома: ядро, электронная оболочка
Число электронных слоев определяется по номеру периода, в котором расположен химический элемент. Число электронов на последнем (внешнем) слое определяется по номеру группы рассматриваемого элемента.
Слайд 10: видео : Электронная конфигурация атома ( теор.)
https://101student.ru/himiya/ehlektronnaya-formula-ehlementa.html
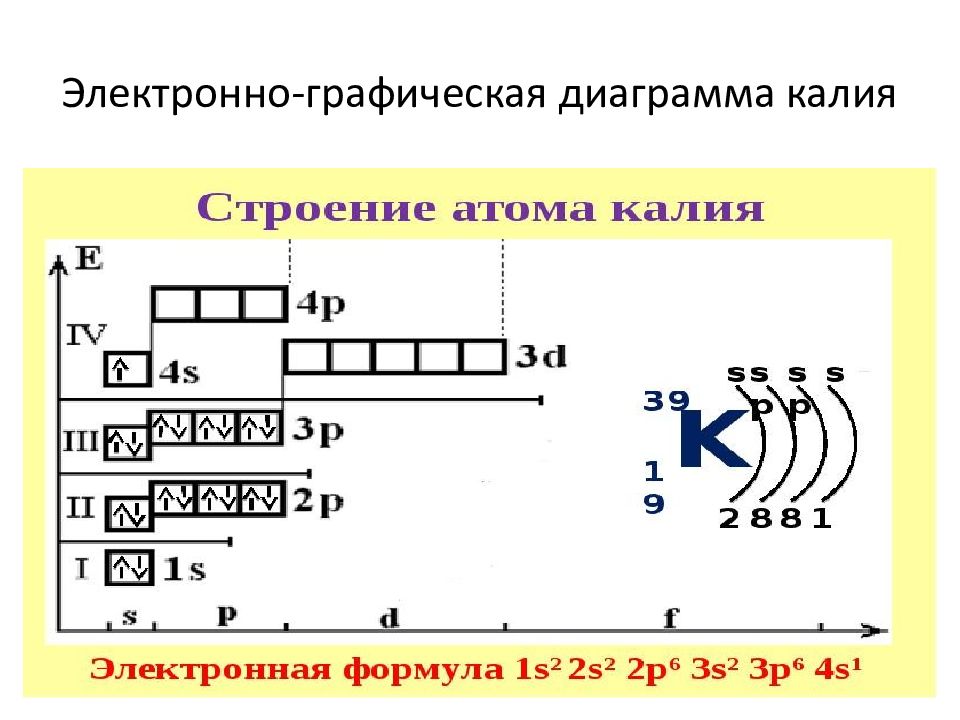
Слайд 13: Порядок заполнения орбиталей
Порядок заполнения орбиталей : 1 s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Слайд 14: Практическая работа Электронная конфигурация атомов и ионов
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число неспаренных электронов 1. Cs 2. C 3. O 4. Cr 5. N Запишите номера выбранных элементов
Слайд 15: Практическая работа Электронная конфигурация атомов и ионов
2. Определите, у атомов каких из указанных в ряду элементов валентные электроны находятся как на S-, так и на d- подуровнях 1. C 2. Fe 3. Sn 4. Pb 5. Cr Запишите номера выбранных элементов.
Слайд 16: Практическая работа Электронная конфигурация атомов и ионов
3. Определите атомы каких из указанных в ряду элементов в основном состоянии содержат три неспаренных электрона. 1. Ca 2. P 3. N 4. O 5. Ti Запишите номера выбранных элементов.
Слайд 17: Практическая работа Электронная конфигурация атомов и ионов
4. Определите атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных s- электронов. 1. Be 2. H 3. O 4. Cu 5. N Запишите номера выбранных элементов.
Слайд 18: Практическая работа Электронная конфигурация атомов и ионов
5. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют электронную формулу внешнего энергетического уровня ns1 1. Li 2. P 3. B 4. Cu 5. N Запишите номера выбранных элементов.
Слайд 19: Практическая работа Электронная конфигурация атомов и ионов
6. Определите, атомы каких из указанных в ряду элементов имеют семь валентных электронов 1. P 2. Na 3. Cl 4. Mn 5. S Запишите номера выбранных элементов.
Слайд 20: Практическая работа Электронная конфигурация атомов и ионов
7. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют сходную конфигурацию внешнего энергетического уровня. 1. P 2. S 3. Ba 4. Ti 5. F Запишите номера выбранных элементов.
Слайд 21: Практическая работа Электронная конфигурация атомов и ионов
8. Определите, катионы каких из указанных в ряду элементов имеют электронную формулу, совпадающую с электронной формулой атома неона. 1. Al 2. Li 3. Mg 4. C 5. N Запишите номера выбранных элементов.