Первый слайд презентации: Электронное строение атома и периодический закон
Свойства элементов определяются количеством электронов и их пространственным расположением относительно ядра в атоме.
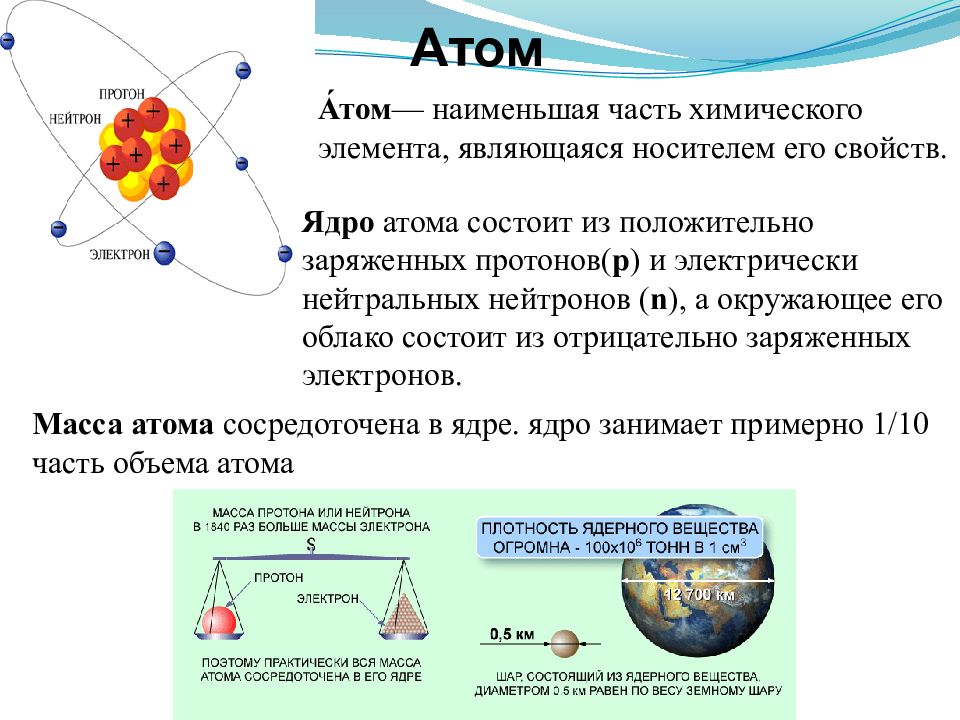
Слайд 3: Атом
А́том — наименьшая часть химического элемента, являющаяся носителем его свойств. Масса атома сосредоточена в ядре. ядро занимает примерно 1/10 часть объема атома Ядро атома состоит из положительно заряженных протонов ( p ) и электрически нейтральных нейтронов ( n ), а окружающее его облако состоит из отрицательно заряженных электронов.
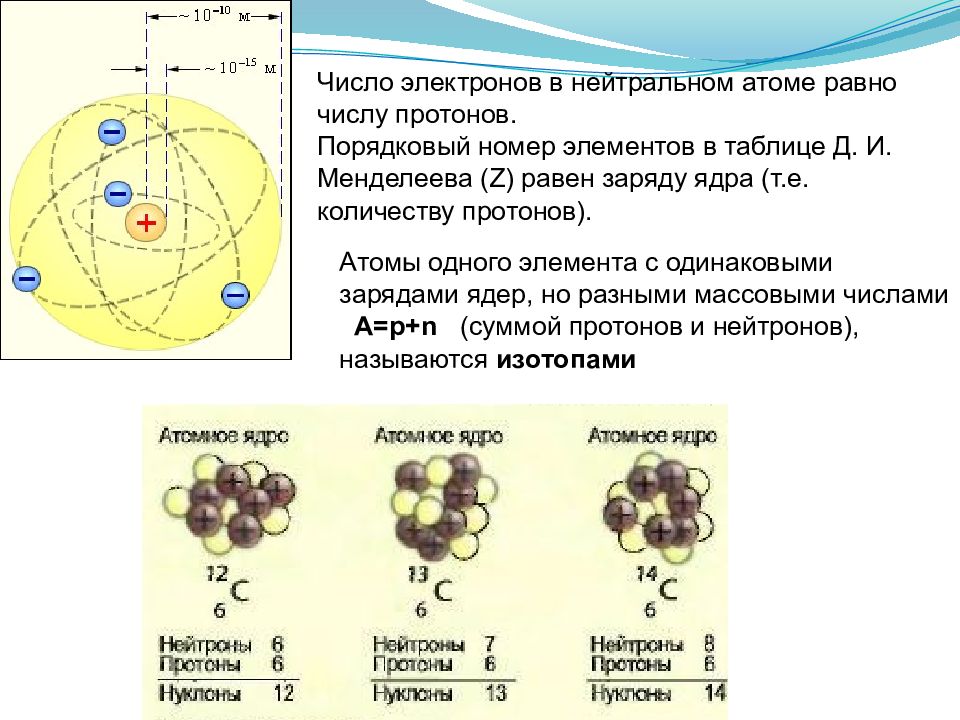
Слайд 4
Число электронов в нейтральном атоме равно числу протонов. Порядковый номер элементов в таблице Д. И. Менделеева ( Z ) равен заряду ядра (т.е. количеству протонов). Атомы одного элемента с одинаковыми зарядами ядер, но разными массовыми числами A= p+n (суммой протонов и нейтронов ), называются изотопами Изотопы аргона: Ar, Ar, Ar. Изотопы калия: K, K, K.
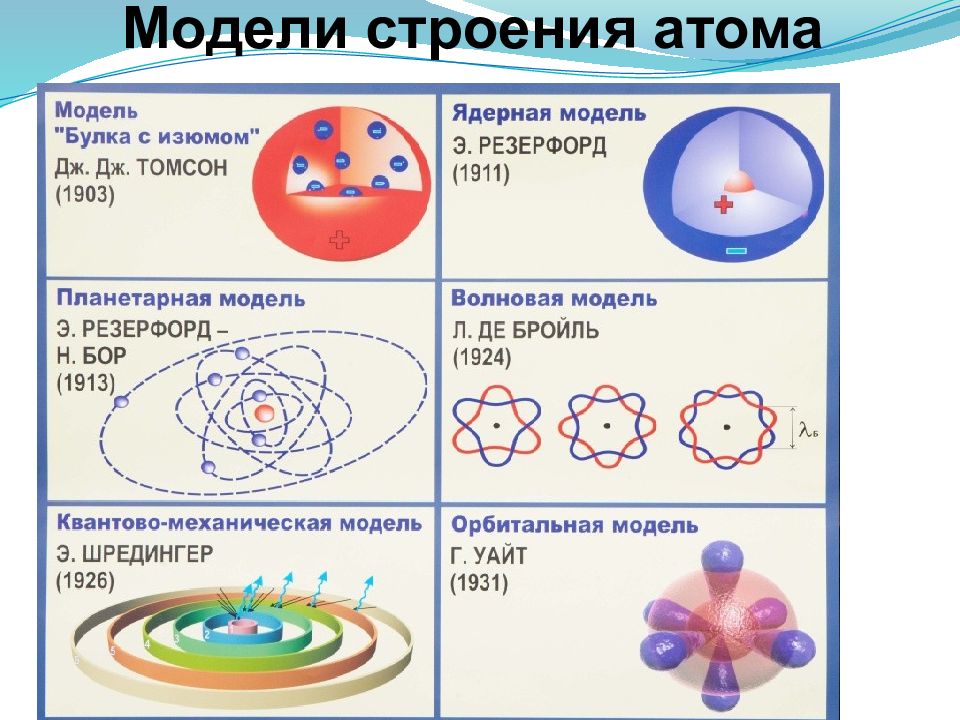
Слайд 5: Модели строения атома
Слайд 6: Квантово-механическая модель атома
Двойственная природа электрона: e Уравнение Шредингера
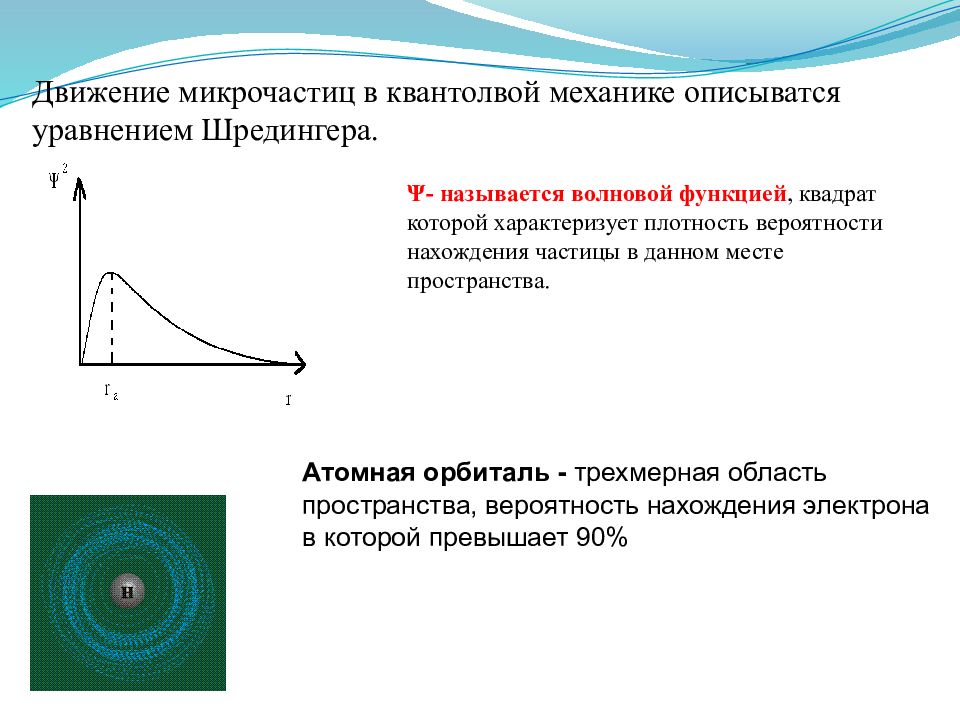
Слайд 7
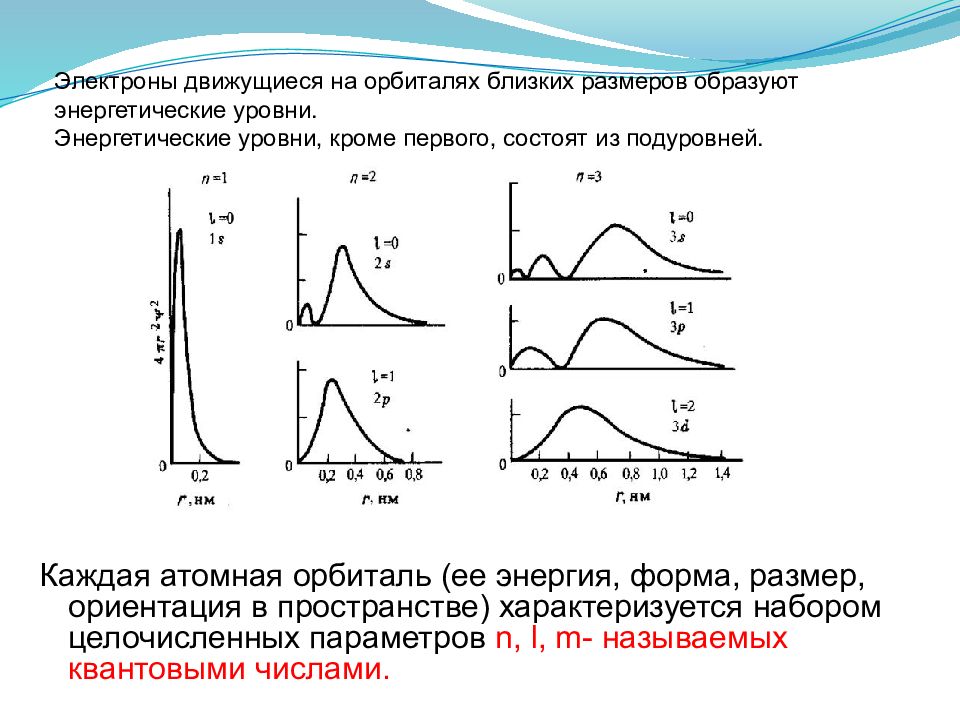
Движение микрочастиц в квантолвой механике описыватся уравнением Шредингера. Атомная орбиталь - трехмерная область пространства, вероятность нахождения электрона в которой превышает 90 % Ψ- называется волновой функцией, квадрат которой характеризует плотность вероятности нахождения частицы в данном месте пространства.
Слайд 8
Каждая атомная орбиталь (ее энергия, форма, размер, ориентация в пространстве) характеризуется набором целочисленных параметров n, l, m- называемых квантовыми числами. Электроны движущиеся на орбиталях близких размеров образуют энергетические уровни. Энергетические уровни, кроме первого, состоят из подуровней.
Слайд 9: Квантовые числа
Главное квантовое число n Орбитальное квантовое число l Магнитное квантовое число m Спиновое квантовое число s
Слайд 10: Главное квантовое число
Главное квантовое число может принимать положительные целочисленные значения: n =1, 2, 3,..7..,∞ Главное квантовое число характеризует : * удаленность уровня от ядра *уровень энергии электрона в атоме *количество подуровней на данном уровне.
Слайд 11: Орбитальное квантовое число
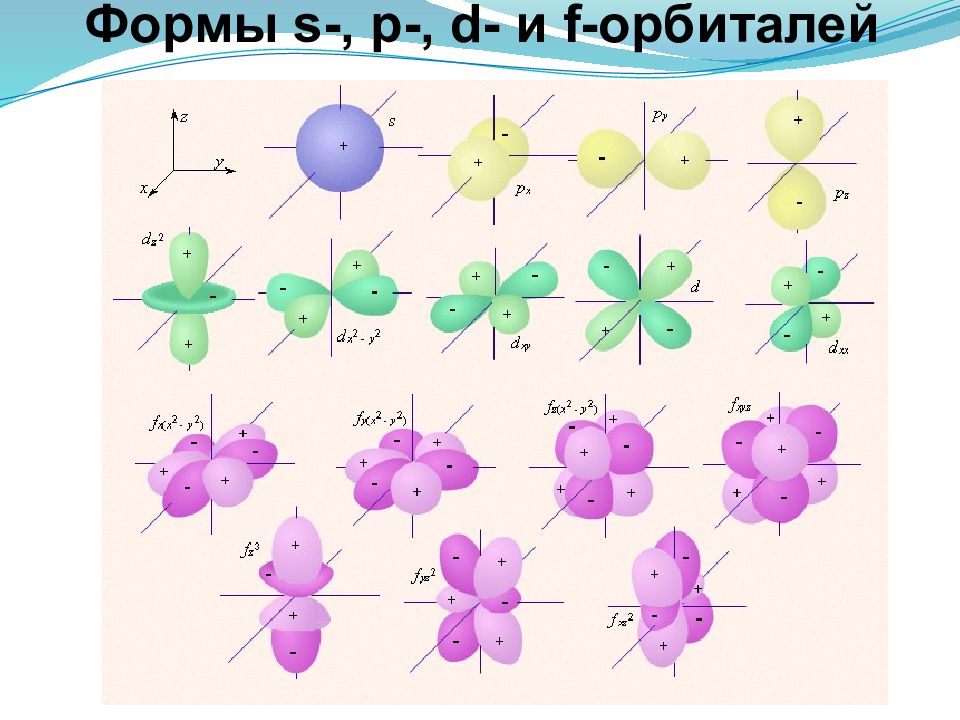
Орбитальное квантовое число, принимает целочисленные значения l=0,1…(n-1) Орбитальное квантовое число характеризует тип энергетического подуровня и форму атомной орбитали. l 0 1 2 3 Тип подуровня S p d f Форма атомной орбитали -
Слайд 12
Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например, n l Обозначение подуровня 1 0 (одно значение) 1 s 2 0 ;1 (два) 2 s 2р 3 0 ;1;2 (три) 3 s 3р 3 d Т.о., энергетический подуровень – это совокупность электронных состояний, характеризующихся определенным набором квантовых чисел n и l.
Слайд 13: Магнитное квантовое число
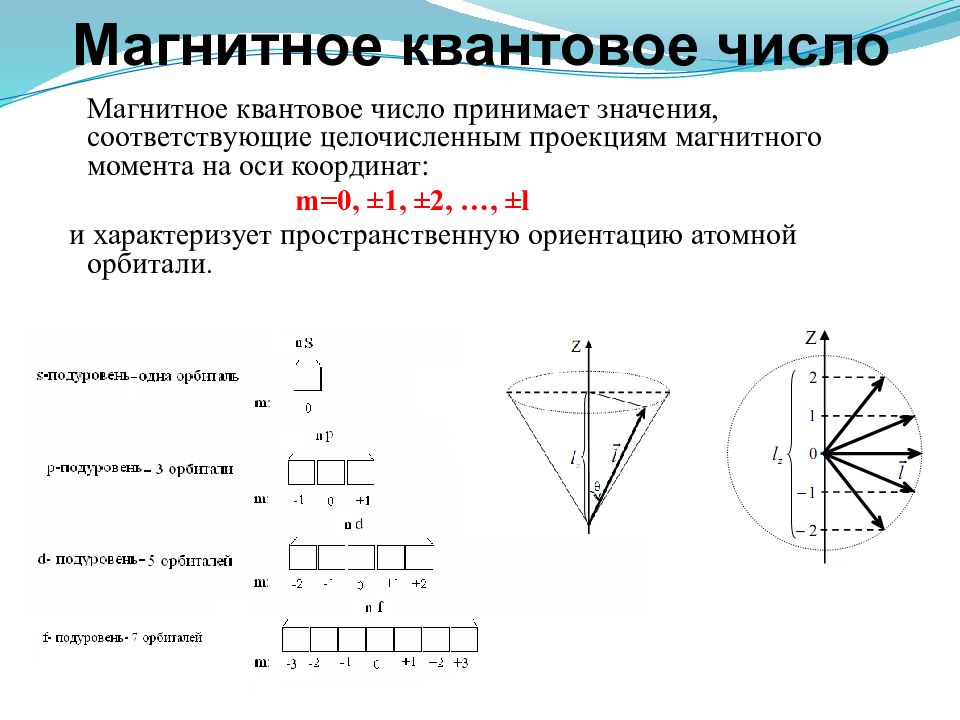
Магнитное квантовое число принимает значения, соответствующие целочисленным проекциям магнитного момента на оси координат: m=0, ±1, ±2, …, ±l и характеризует пространственную ориентацию атомной орбитали.
Слайд 14
Оно принимает все целочисленные значения от – l до + l. Например, при l =0 m l = 0; при l =1 m l = -1; 0 ; +1; при l =2 m l = -2; -1; 0 ; +1; +2 ; Любому значению l соответствует (2 l +1) возможных расположений электронного облака данного типа в пространстве. Все орбитали, принадлежащие одному подуровню данного энергетического уровня, имеют одинаковую энергию в отсутствии магнитного поля (вырожденные).
Слайд 16: Спиновое число
Спиновое число -«СПИН» - определяется собственным моментом вращения электрона в двух противоположных направлениях. S= ± 1/2 обозначение Графическое обозначение Направление вращения +1/2 ↑ по часовой стрелке -1/2 ↓ против часовой стрелки
Слайд 17: Общая таблица по квантовым числам
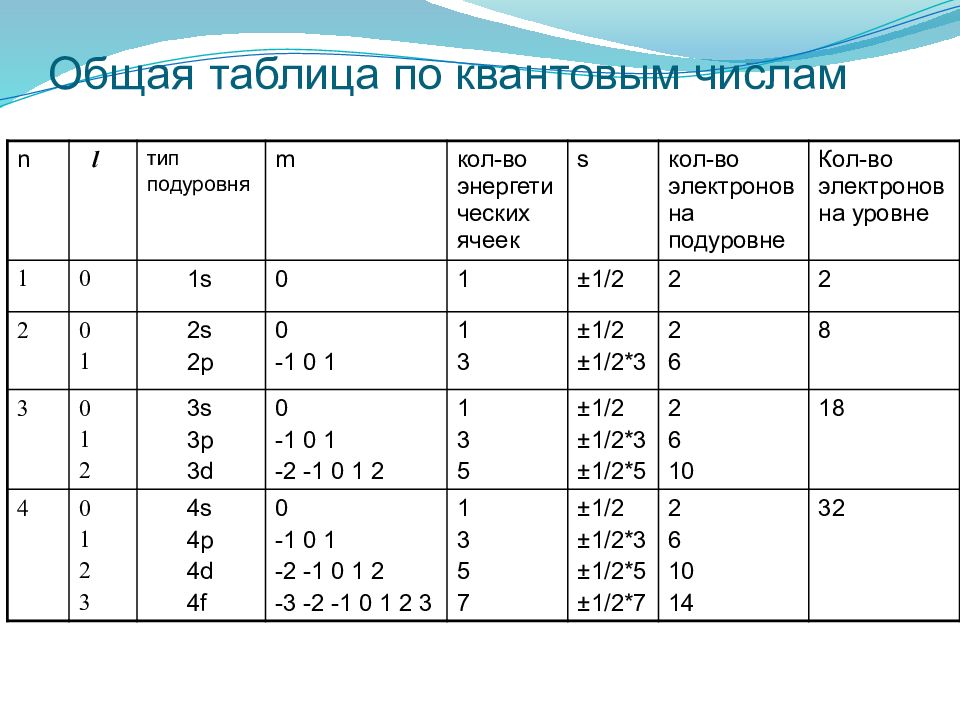
n l тип подуровня m кол-во энергетических ячеек s кол-во электронов на подуровне Кол-во электронов на уровне 1 0 1s 0 1 ± 1/2 2 2 2 0 1 2s 2p 0 -1 0 1 1 3 ± 1/2 ± 1/2*3 2 6 8 3 0 1 2 3s 3p 3d 0 -1 0 1 -2 -1 0 1 2 1 3 5 ± 1/2 ± 1/2*3 ± 1/2*5 2 6 10 18 4 0 1 2 3 4s 4p 4d 4f 0 -1 0 1 -2 -1 0 1 2 -3 -2 -1 0 1 2 3 1 3 5 7 ± 1/2 ± 1/2*3 ± 1/2*5 ± 1/2*7 2 6 10 14 32
Слайд 18: Энергетический уровень
Совокупность всех орбиталей с одинаковым значением главного квантового числа, т.е. орбиталей с близкими значениями энергий.
Слайд 19: При составлении электронных конфигураций многоэлектронных атомов учитывают :
принцип минимальной энергии правило Клечковского принцип Паули правило Хунда
Слайд 20: Последовательность заполнения электронных подуровней
1. Принцип минимума энергии Наиболее устойчивое состояние электрона в атоме соответствует наименьшему возможному значению его энергии. В результате возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке: n S < (n-1)d ≤ (n-2)f ≤ (n-3)g < np 2. Правило Клечковского Заполнение электронных оболочек в атомах элемента происходит в порядке возрастания суммы ( n + l ). При равенстве этой суммы вначале заполняется подуровень с меньшим значением n.
Слайд 21
Применим правило Клечковского … 3s 3p 3d 4s 4p … (3+0) (3+1) (3+2) (4+0) (4+1) 3 4 5 4 5 Последовательность заполнения этих подуровней : … 3s 3p 4s 3d 4p … Увеличение Е
Слайд 22
1 s < 2 s < 2 p < 3 s < 3 p < 3 d ≈4 s < 4 p < 4 d ≈5 s < 5 p < 6 s ≈ 4 f ≈ 5 d < 6 p < 7 s ≈ 5 f ≈ 6 d < 7 p.
Слайд 23
3. Запрет Паули В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. 4. Правило Хунда Минимальной энергией обладает конфигурация с максимальным суммарным спином. Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа : х=2п 2
Слайд 24
При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда: в пределах энергетического подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. Например, 2 p 2 1 2 1 2 1 2 1 = + ч ш ц з и ж - + 2 p 2 1 2 1 2 1 2 1 = + ч ш ц з и ж - + 2 p 2 3 2 1 2 1 2 1 = + + 2 p 2 1 2 1 2 1 2 1 = ч ш ц з и ж - + + 2 p 2 1 2 1 2 1 2 1 - = ч ш ц з и ж - + + ч ш ц з и ж - m ax суммарныйспин
Слайд 25: Составление электронных формул
1. полная электронная формула показывает распределение электронов атома по его уровням и подуровням. Независимо от последовательности формирования подуровня в электронной формуле он записывается на своем энергетическом уровне. 2. сокращенная электронная формула показывает распределение валентных электронов на формирующихся атомных орбиталях.
Слайд 26
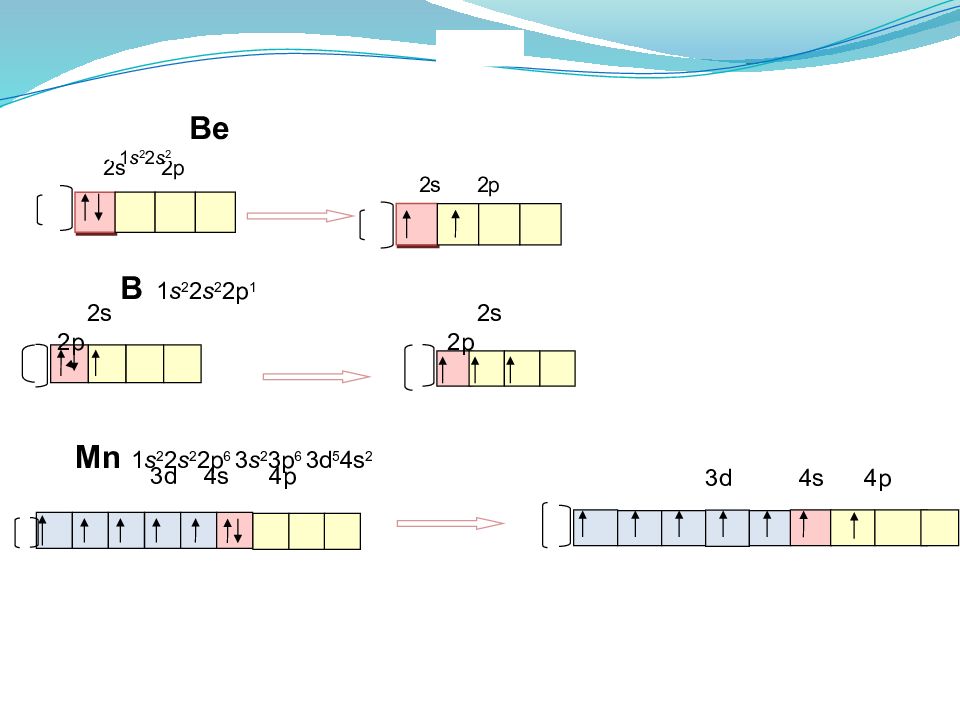
3. электронная формула в виде энергетических ячеек. Составляется только для сокращенной электронной формулы. Показывает распределение валентных электронов и позволяет прогнозировать возможные валентности атома. Нормальным (невозбужденным) состоянием атома называется структура, соответствующая квантово-химическим законам формирования атомных орбиталей. Возбужденным состоянием атома называется структура, в которой электроны переходят на энергетические подуровни с более высокой энергией в пределах внешнего уровня.
Слайд 27: Валентность - способность атома к образованию химических связей
Валентность определяется числом неспаренных электронов на внешних орбиталях в атоме.
Слайд 28
2s 2p 2s 2p Ве 1 s 2 2 s 2 В 1 s 2 2 s 2 2p 1 Mn 1 s 2 2 s 2 2p 6 3 s 2 3p 6 3d 5 4s 2 2s 2p 2s 2p 3d 4s 4p 3d 4s 4p
Слайд 29: Периодический закон
Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра (порядковый номер). Периодический закон был открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). Периодические изменения свойств химических элементов обусловлены повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра. Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Слайд 30: Атомный радиус
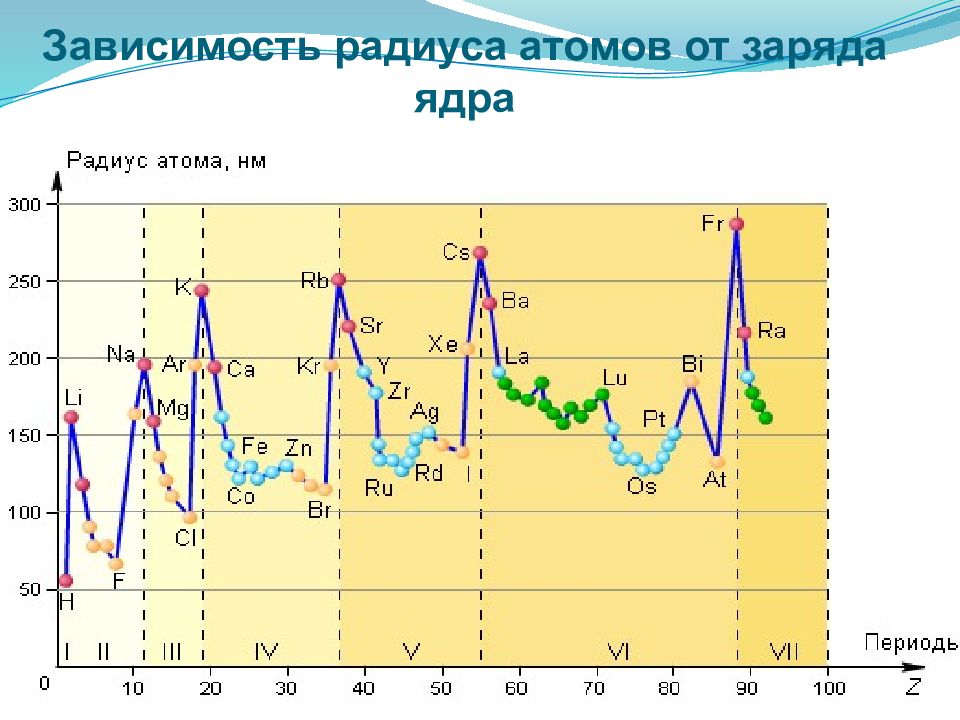
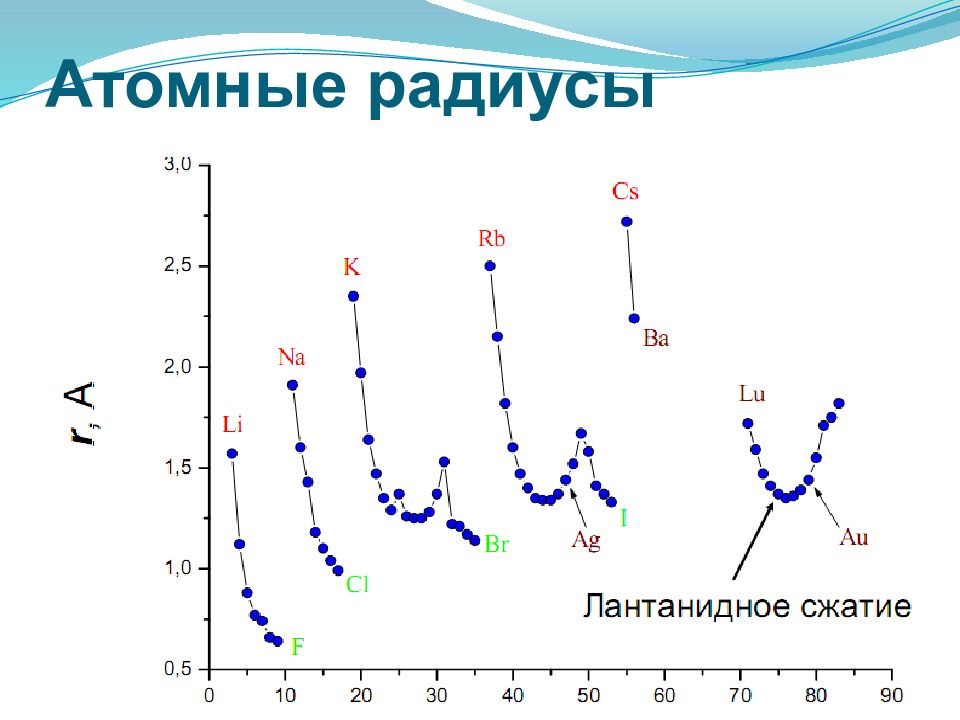
Орбитальный атомный радиус- это условная величина, которая равна расстоянию между ядром и самой дальней из стабильных орбиталей в в электронной оболочке этого атома. В периоде с увеличением порядкового номера атомный радиус уменьшается за счёт более сильного взаимодействия между ядром и внешними электронами. В группе с увеличением порядкового номера атомный радиус растет, так как увеличивается число уровней.
Слайд 31
уменьшение увеличение при этом в главных подгруппах такое увеличение происходит в большей степени, чем в побочных подгруппах.
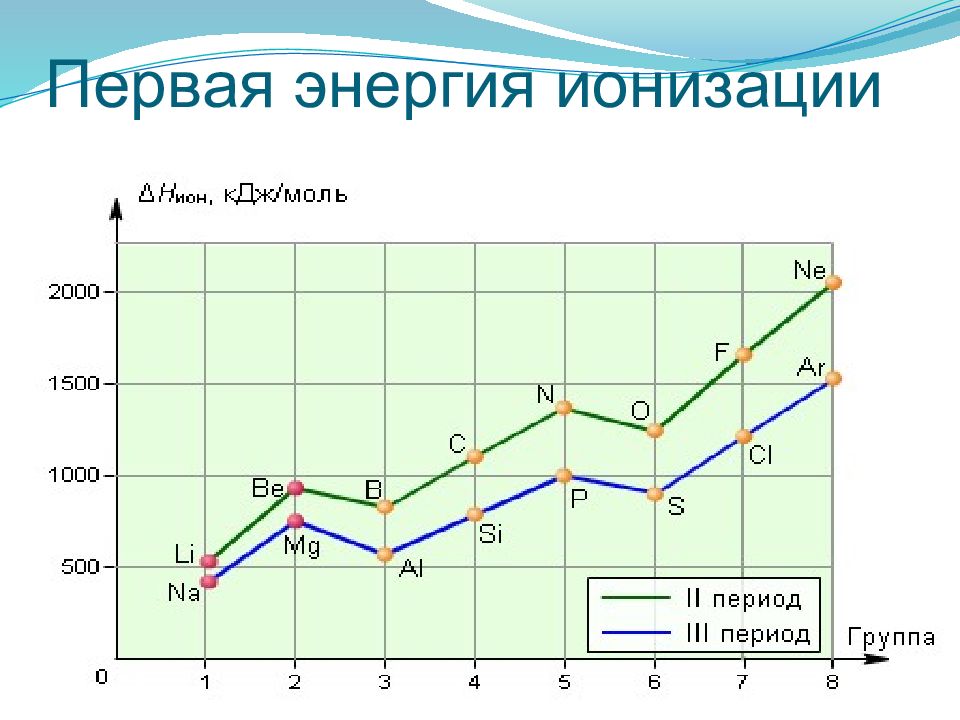
Слайд 34: Энергия ионизации
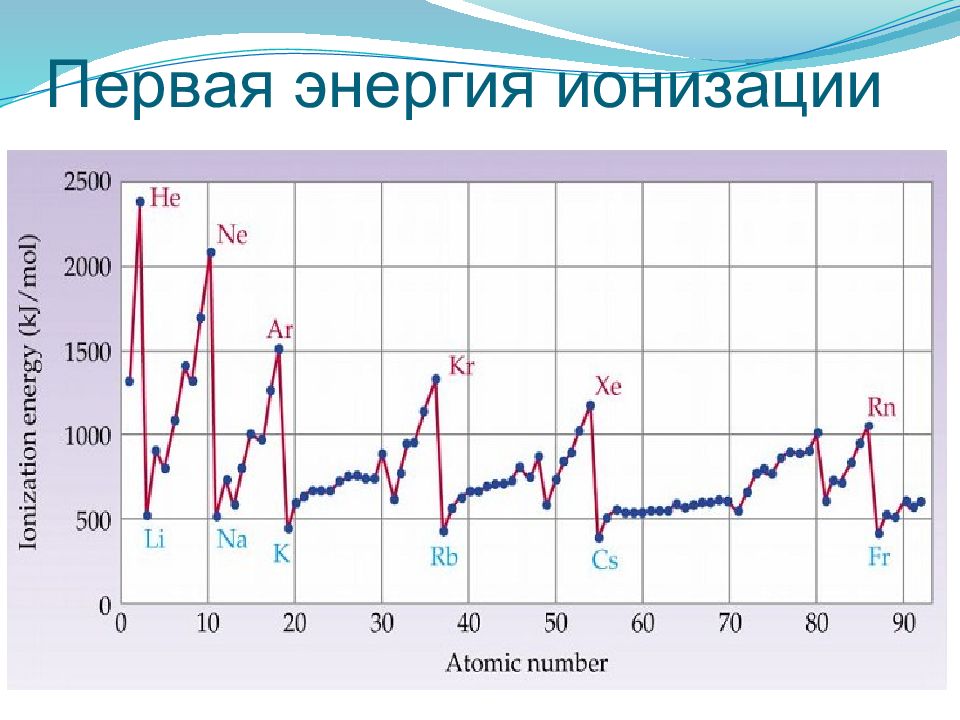
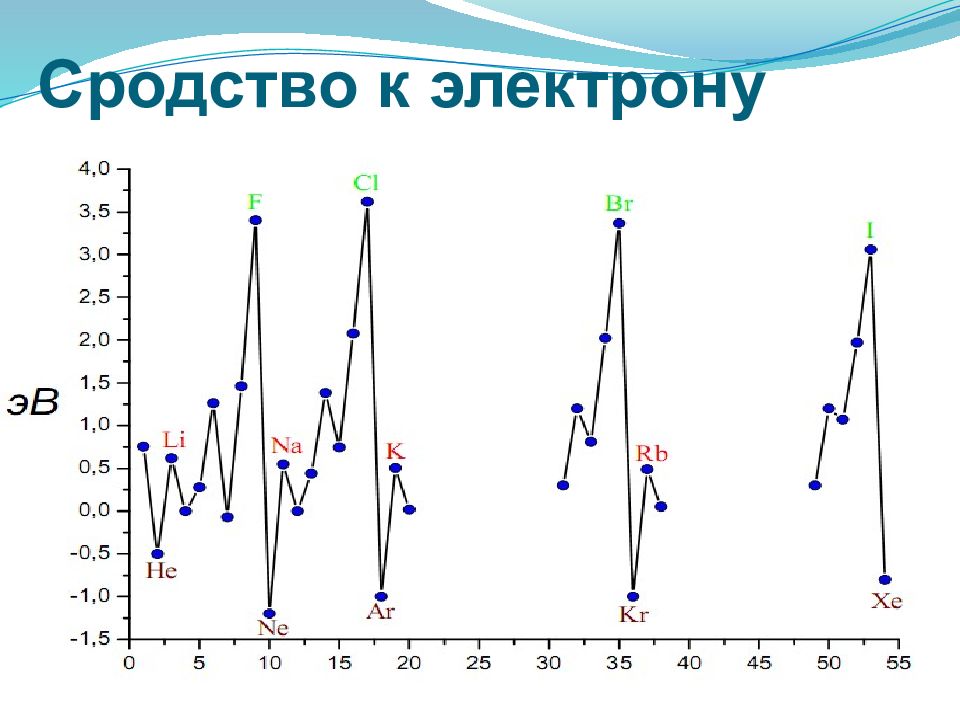
Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. При отрыве электрона от атома образуется соответствующий катион. Энергия, которая выделяется при присоединении к атому одного электрона, называется энергией сродства к электрону Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра.
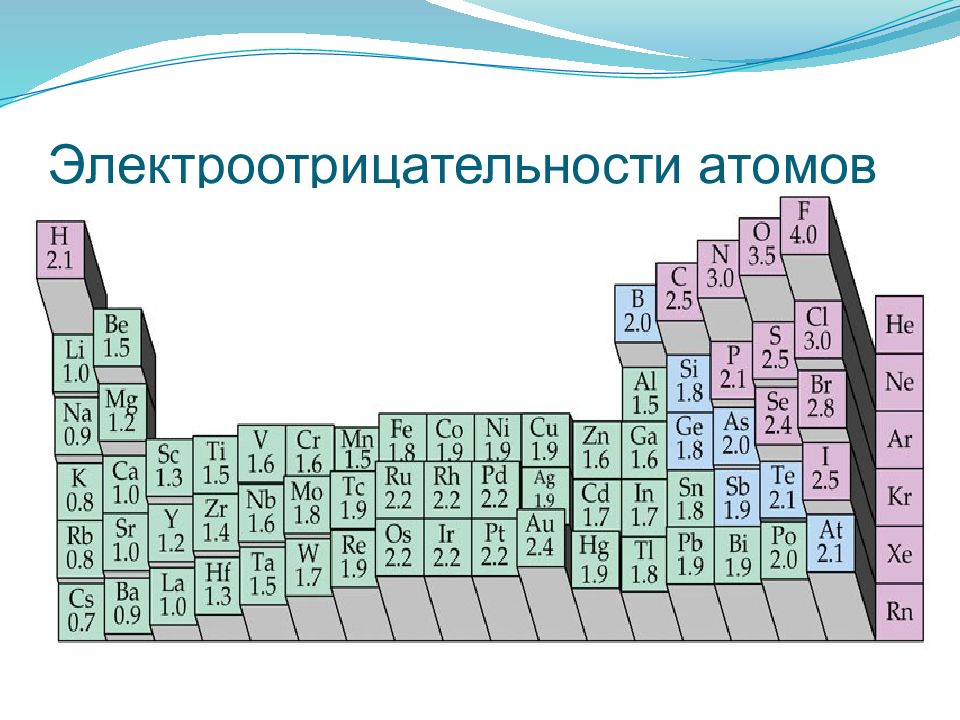
Слайд 38: Электроотрицательность
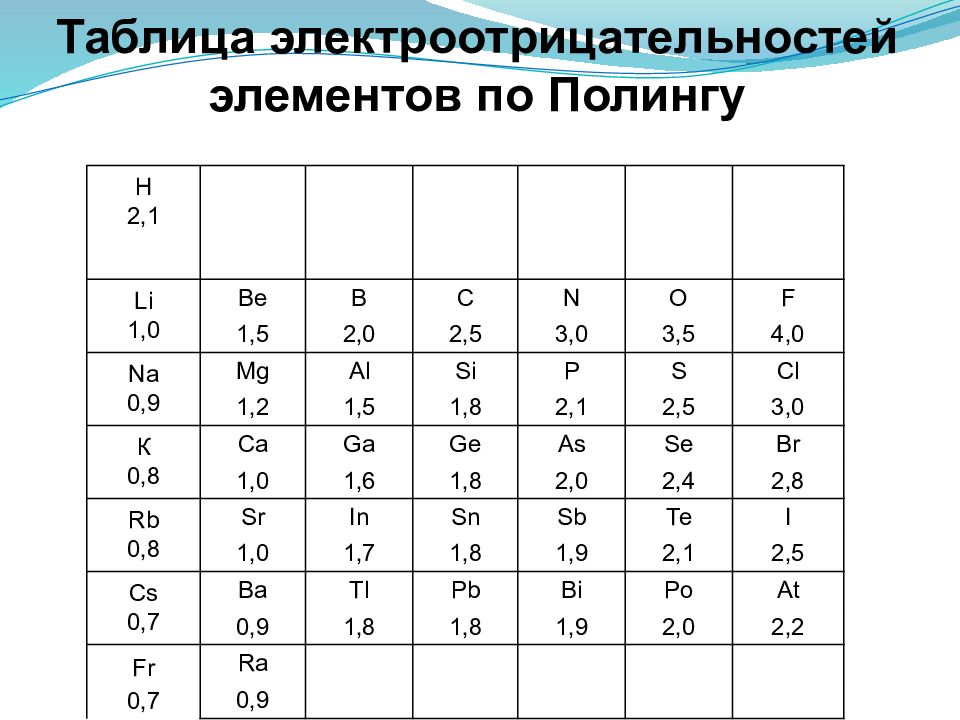
Электроотрицательность - способность атома в соединении притягивать к себе электроные пары. Может быть определена формуле: ЭО=1/2(ЭИ+СЭ), где ЭИ и СЭ –энергия ионизации и сродства. На практике пользуются относительной электроотрицательностью. с увеличением номера элемента электроотрицательность в периоде растет, а в группе — уменьшается. ЭО <2 Металлические свойства ЭО≈2 Переходные свойства ЭО >2 Неметаллические свойства
Слайд 39: Таблица электроотрицательностей элементов по Полингу
H 2,1 Li 1,0 Be В С N О F 1,5 2,0 2,5 3,0 3,5 4,0 Na 0,9 Mg Al Si P S Cl 1,2 1,5 1,8 2,1 2,5 3,0 К 0,8 Ca Ga Ge As Se Br 1,0 1,6 1,8 2,0 2,4 2,8 Rb 0,8 Sr In Sn Sb Те I 1,0 1,7 1,8 1,9 2,1 2,5 Cs 0,7 Ba Tl Pb Bi Po At 0,9 1,8 1,8 1,9 2,0 2,2 Fr 0,7 Ra 0,9