Первый слайд презентации
1 Вячеслав Владимирович Хорунжий моб. тел. 8-911-297-2598 e-mail: 1135329@mail.ru
Слайд 5
5 Педиатрия Лечебное дело Стоматология Медицинская биофизика Медико-профилактическое дело Сестринское дело (бакалавриат) Клиническая психология Дефектология (бакалавриат)
Слайд 6
6 ПОДГОТОВИТЕЛЬНЫЕ КУРСЫ ПО ХИМИИ 4 цикла по 7 занятий – всего 28 занятий Начало курсов – 5 октября Окончание курсов – 19 апреля 1 цикл: 5 октября - 16 ноября 2 цикл: 23 ноября – 11 января (4 января занятий не будет!!) 11 января - репетиционный ЕГЭ по общей химии 3 цикл: 18 января- 1 марта 4 цикл: 8 марта - 19 апреля Курсы проводятся 1 раз в неделю (по четвергам, с 18.00, аудитория №1 – 6-этажный кирпичный корпус) Продолжительность каждого занятия –3 академических часа - 3∙45 мин. = 2 часа 15 минут (с 15-минутным перерывом) (4 января занятий не будет!!) 27 занятие – 12 апреля- РЕПЕТИЦИОННЫЙ ЕГЭ 28 занятие (последнее) – 19 апреля – обсуждение результатов репетиционного ЕГЭ
Слайд 9
9 Ключ к успеху: Юноши!!!! Готовимся НАКАНУНЕ!!!! к каждому занятию На занятия приходим с конспектом лекции, написанным дома!!!!!!
Слайд 10
10 Ключ к успеху: Девушки!!!! Готовимся НАКАНУНЕ!!!! К каждому занятию!! На занятия приходим с конспектом лекции, написанным дома!!!!!!
Слайд 12
12 «В увольнительном документе ему написали, что он устраняется с производства вследствие роста слабосильности в нем и задумчивости среди общего темпа труда»
Слайд 13
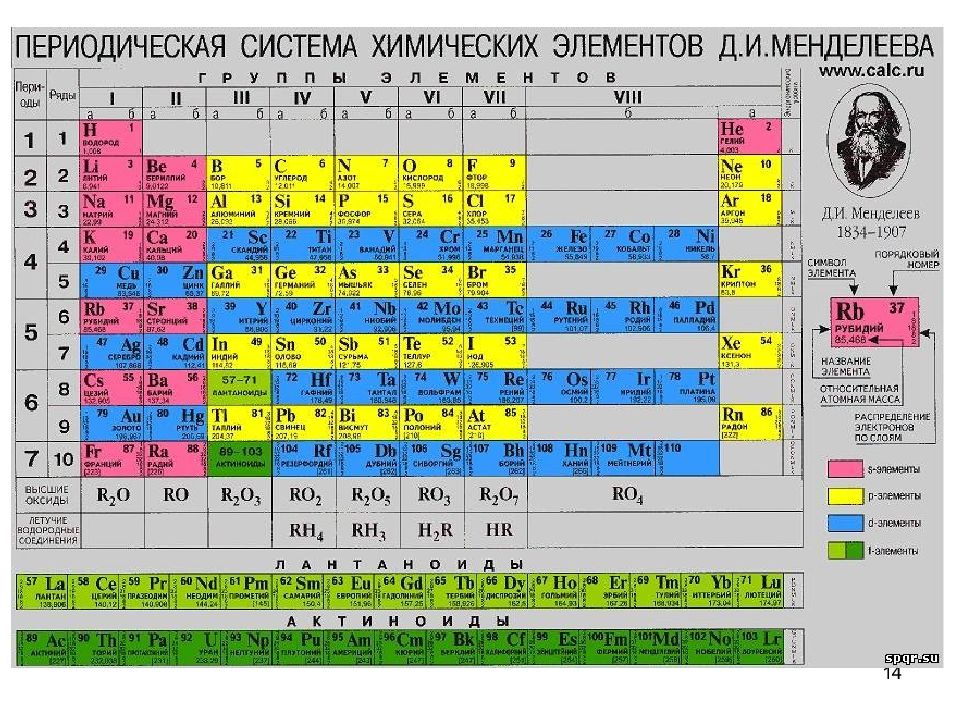
13 Лекция 1-1 "Строение атома. Квантовые числа. Электронные конфигурации. Нормальное и возбужденное состояние атомов"
Слайд 15
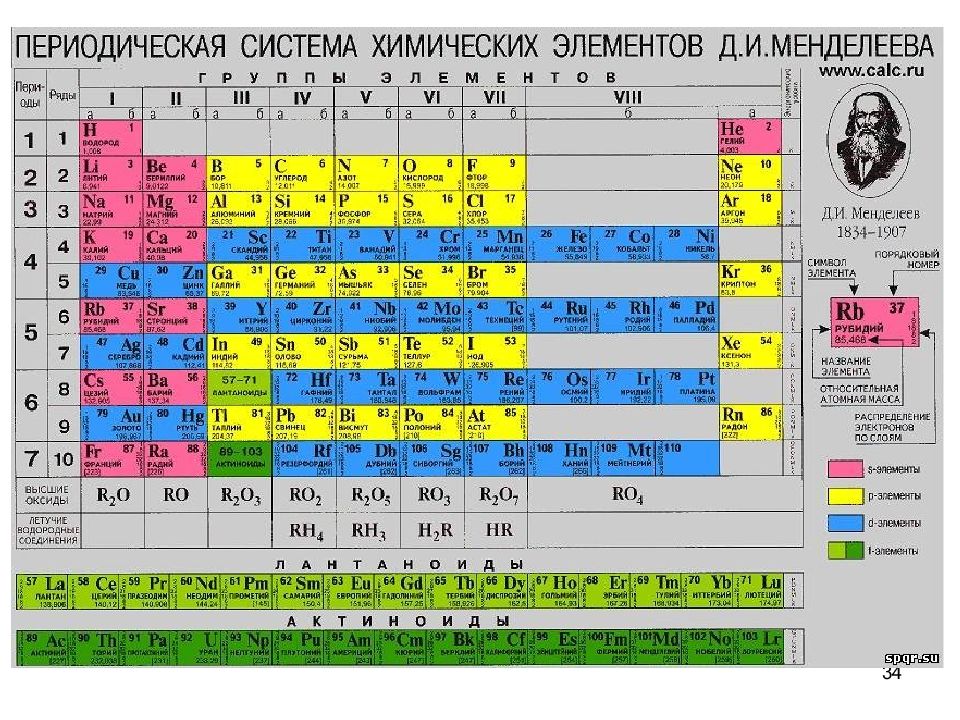
15 РУТЕНИЙ В 1844 в Казанском университете К. К. Клаус выделил из уральской самородной платины 6 г неизвестного ранее металла. Он определил его атомную массу, исследовал химические свойства и дал название. От латинского названия России Ruthenia 101 Ru 44
Слайд 17
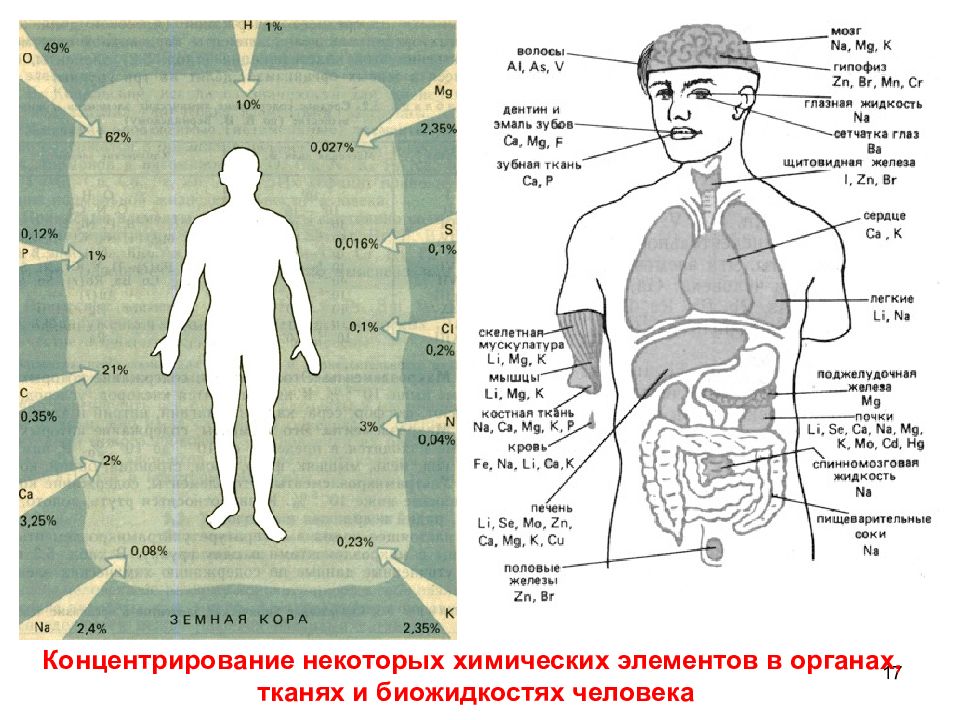
17 Концентрирование некоторых химических элементов в органах, тканях и биожидкостях человека
Слайд 20
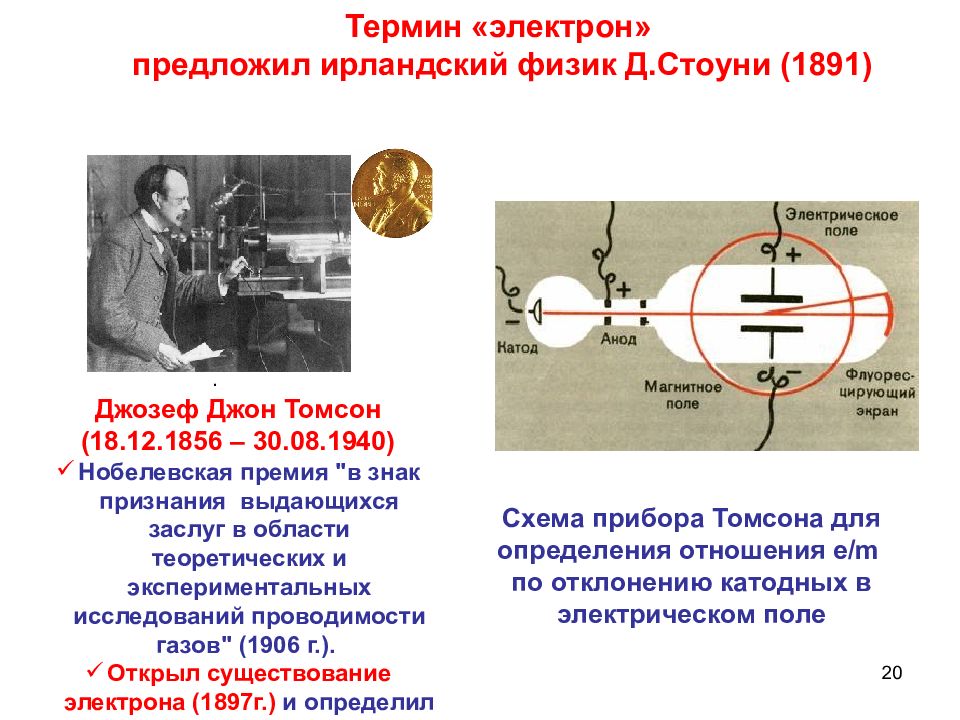
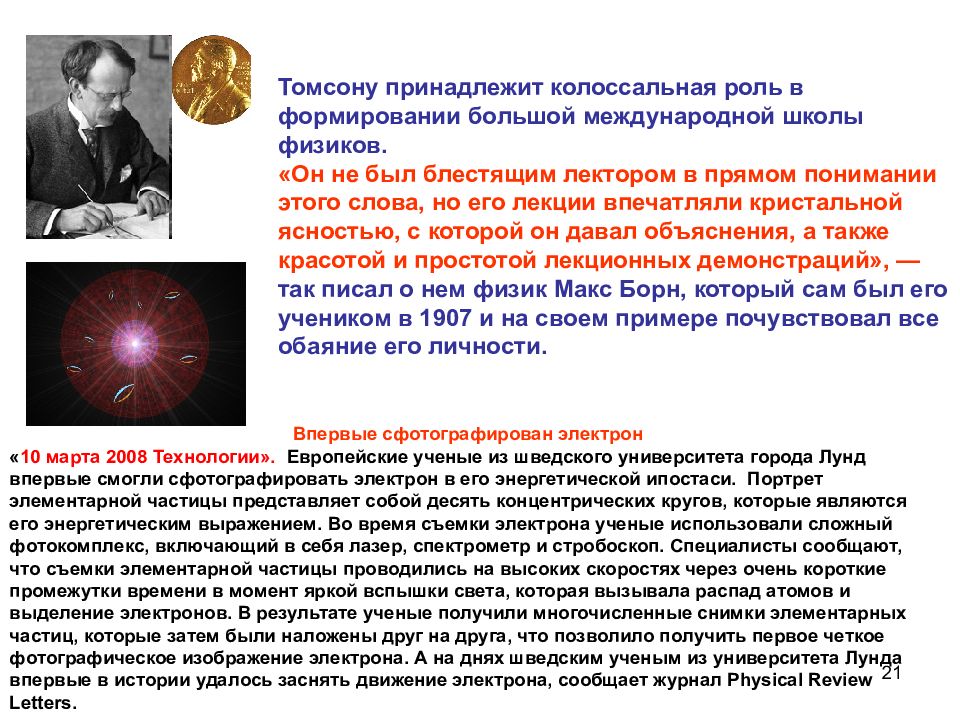
20 . Схема прибора Томсона для определения отношения e/m по отклонению катодных в электрическом поле Термин «электрон» предложил ирландский физик Д.Стоуни (1891) Джозеф Джон Томсон ( 18.12.1856 – 30.08.1940 ) Нобелевская премия "в знак признания выдающихся заслуг в области теоретических и экспериментальных исследований проводимости газов" (1906 г. ). Открыл существование электрона (1897г.) и определил отношение его заряда к массе
Слайд 21
21 Впервые сфотографирован электрон « 10 марта 2008 Технологии». Европейские ученые из шведского университета города Лунд впервые смогли сфотографировать электрон в его энергетической ипостаси. Портрет элементарной частицы представляет собой десять концентрических кругов, которые являются его энергетическим выражением. Во время съемки электрона ученые использовали сложный фотокомплекс, включающий в себя лазер, спектрометр и стробоскоп. Специалисты сообщают, что съемки элементарной частицы проводились на высоких скоростях через очень короткие промежутки времени в момент яркой вспышки света, которая вызывала распад атомов и выделение электронов. В результате ученые получили многочисленные снимки элементарных частиц, которые затем были наложены друг на друга, что позволило получить первое четкое фотографическое изображение электрона. А на днях шведским ученым из университета Лунда впервые в истории удалось заснять движение электрона, сообщает журнал Physical Review Letters. Томсону принадлежит колоссальная роль в формировании большой международной школы физиков. «Он не был блестящим лектором в прямом понимании этого слова, но его лекции впечатляли кристальной ясностью, с которой он давал объяснения, а также красотой и простотой лекционных демонстраций», — так писал о нем физик Макс Борн, который сам был его учеником в 1907 и на своем примере почувствовал все обаяние его личности.
Слайд 22
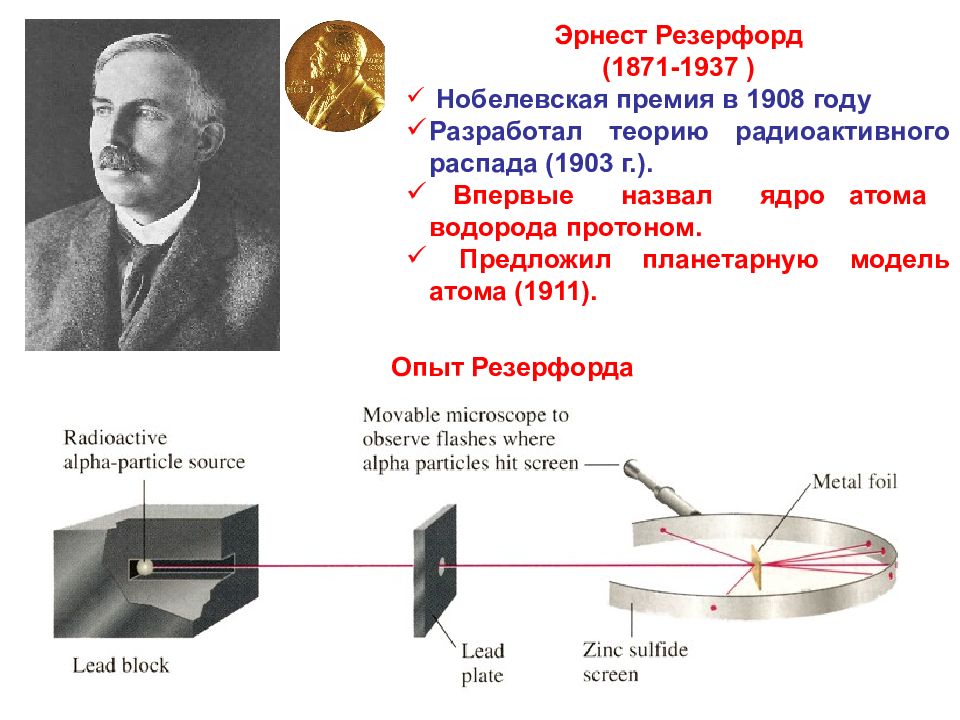
22 Эрнест Резерфорд (1871-1937 ) Нобелевская премия в 1908 году Разработал теорию радиоактивного распада (1903 г.). Впервые назвал ядро атома водорода протоном. Предложил планетарную модель атома (1911). Опыт Резерфорда
Слайд 23
23 Малликен Роберт Сандерсон (7.06.1896-31.10.1986) Нобелевская премия "за фундаментальную работу по химическим связям и структуре молекул" (1966 г.). Один из создателей метода молекулярных орбиталей (МО) Впервые применил ЭВМ для расчета π – электронных систем. Точно определил (1912 г.) заряд электрона. z е = 1, 6 · 10 -19 Кл m e = 9,1·10 - 31 кг m прот. = 1.67 ·10 - 27 кг Опыт Малликена с капельками масла
Слайд 24
24 В своей Нобелевской лекции Милликен, ссылаясь на опыт работы, высказал убеждение, что "наука шагает вперед на двух ногах - на теории и эксперименте. Иногда вперед выдвигается одна нога, иногда другая, но неуклонный прогресс достигается лишь тогда, когда шагают обе". Малликена описывают как непритязательного, добродушного человека. Он обладал широкими познаниями в ботанике, с удовольствием водил машину, любил восточные ковры, увлекался искусством.
Слайд 25
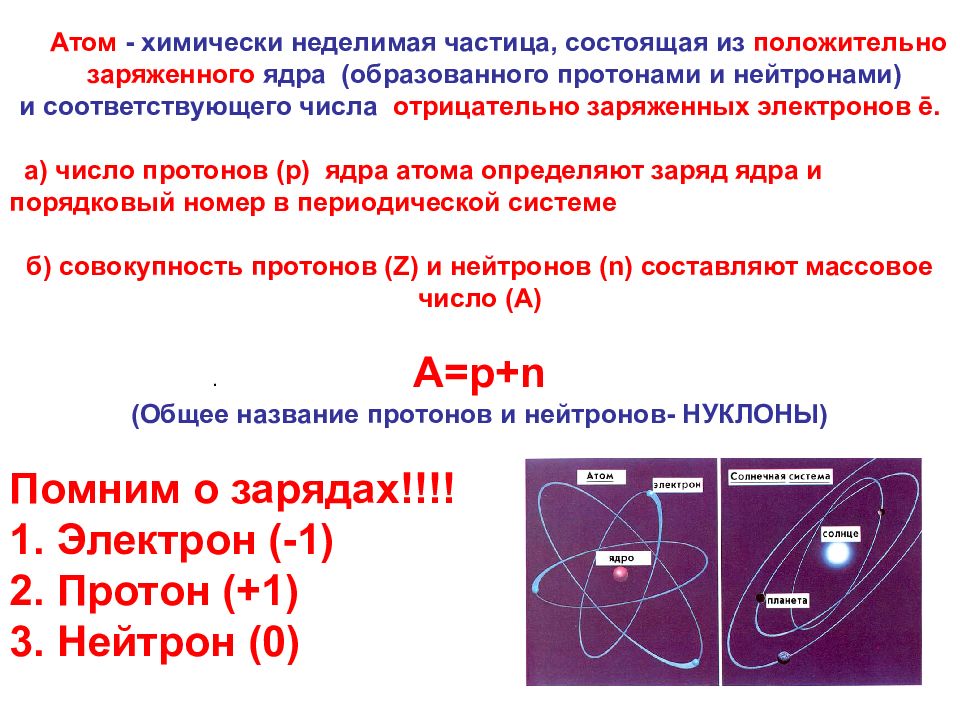
25 . Атом - химически неделимая частица, состоящая из положительно заряженного ядра (образованного протонами и нейтронами) и соответствующего числа отрицательно заряженных электронов ē. а) число протонов ( p) ядра атома определяют заряд ядра и порядковый номер в периодической системе б) совокупность протонов ( Z) и нейтронов (n) составляют массовое число (A) A=p+n (Общее название протонов и нейтронов- НУКЛОНЫ) Помним о зарядах!!!! 1. Электрон (-1) 2. Протон (+1) 3. Нейтрон (0)
26 Тест №1 Ядро (несколько вариантов ответов)
Слайд 27: 1.Укажите суммарный относительный заряд смеси, состоящей из 5 протонов, 6 нейтронов и 2 электронов:
27 1.Укажите суммарный относительный заряд смеси, состоящей из 5 протонов, 6 нейтронов и 2 электронов: 1) +1 2) +2 3) +3 4) +4
28 2.Смесь, состоящая из 6 протонов и 3 нейтронов имеет приблизительно такую же массу, как и средняя масса атома элемента: 1) цезия; 2) бериллия; 3) натрия; 4) фтора.
Слайд 29: 3.Масса атома определяется массой:
29 3.Масса атома определяется массой: 1) ядра; 2) протонов и электронов; 3) протонов и нейтронов; 4) нейтронов и электронов.
Слайд 30: 4. Заряд ядра определяется числом:
30 4. Заряд ядра определяется числом: 1) нейтронов; 2) электронов; 3) протонов и электронов; 4) протонов.
Слайд 31: 5. Атомы, входящие в состав формулы Э 3 N 2 содержат 182 протона. Укажите химический знак элемента Э:
31 5. Атомы, входящие в состав формулы Э 3 N 2 содержат 182 протона. Укажите химический знак элемента Э: 1) М g 2) Ва; 3) Са; 4) Sr.
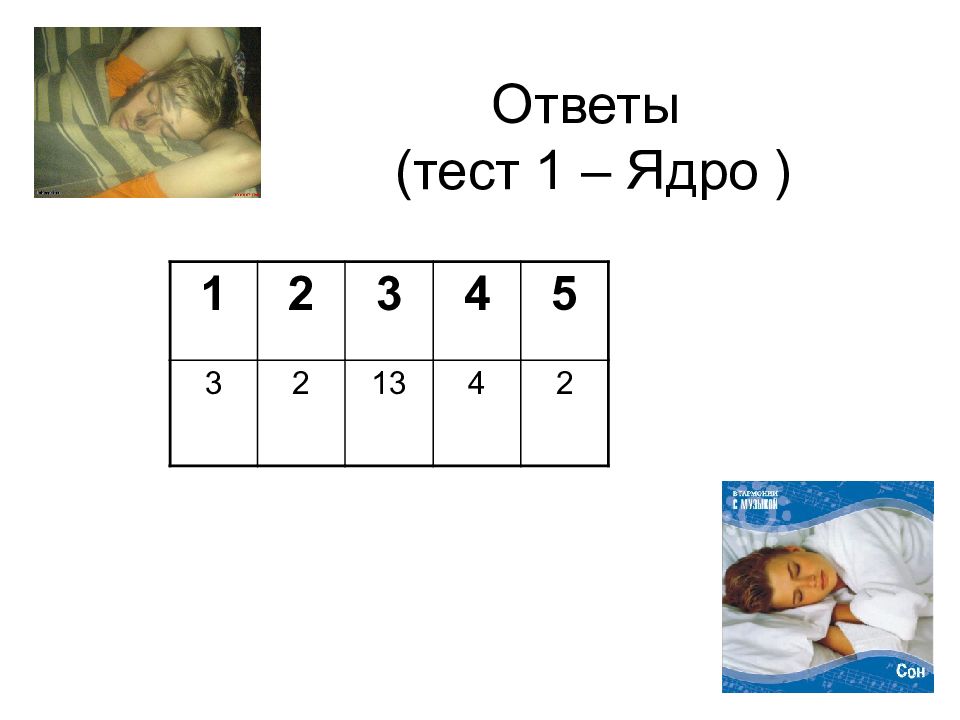
Слайд 32: Ответы (тест 1 – Ядро )
32 Ответы (тест 1 – Ядро ) 1 2 3 4 5 3 2 13 4 2
Слайд 35
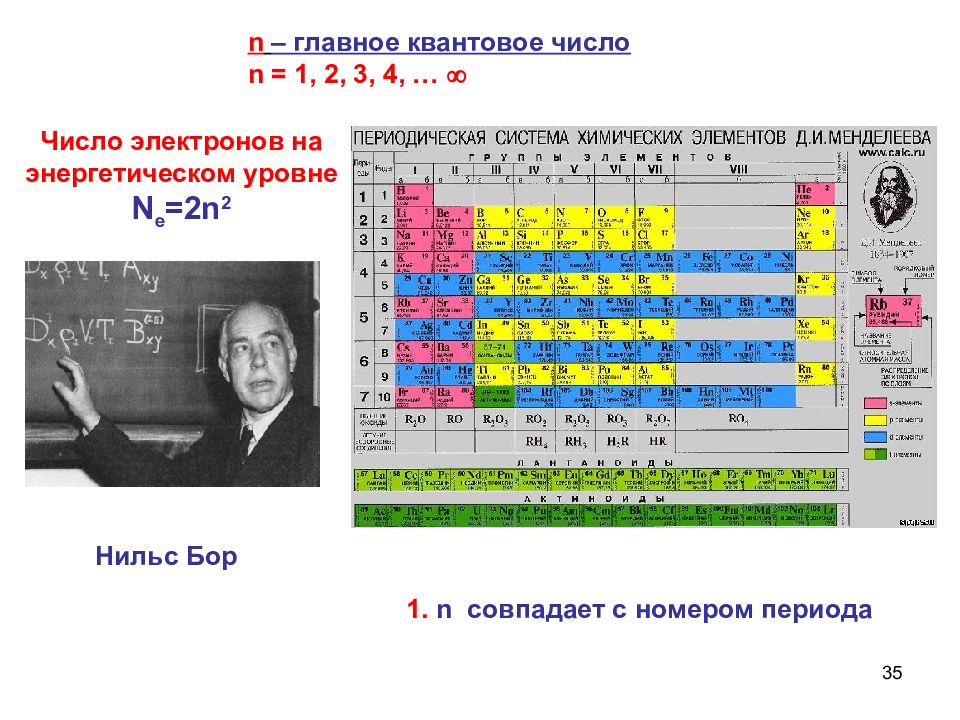
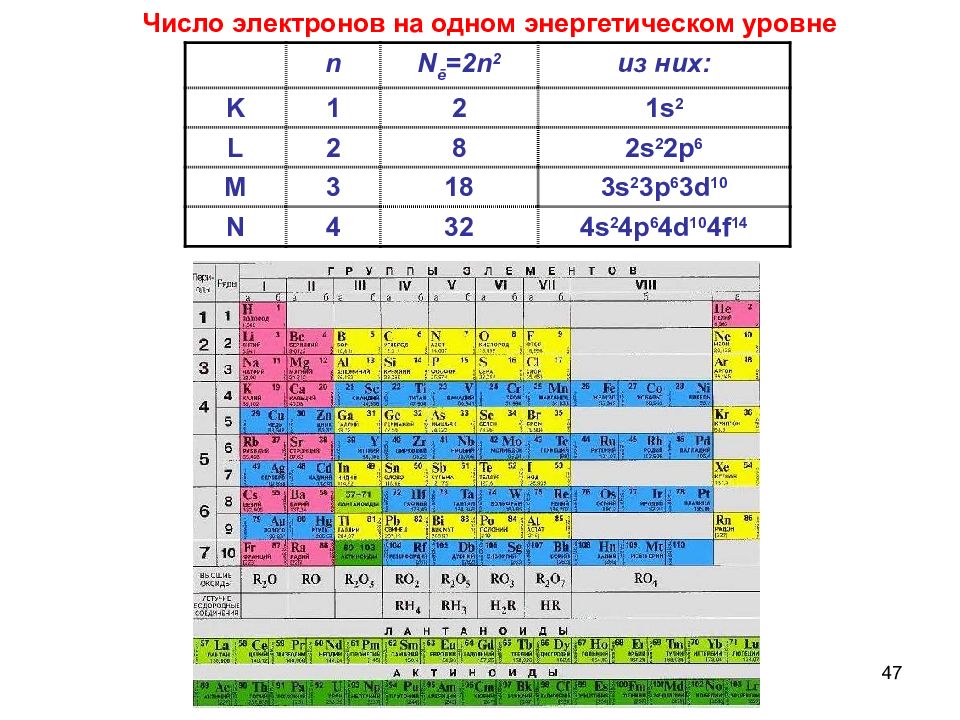
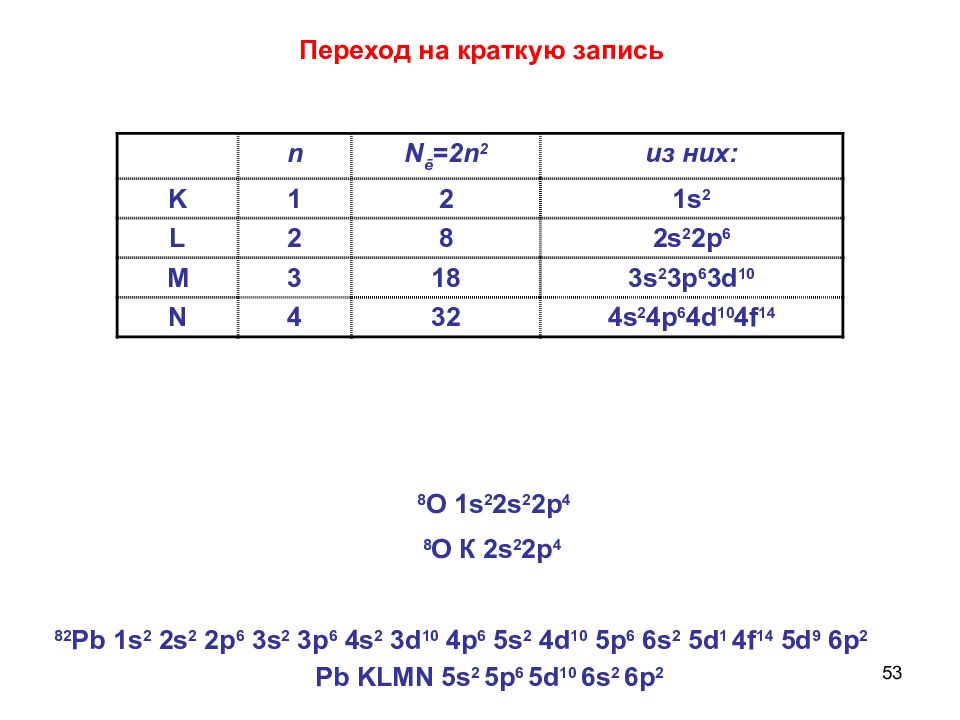
35 n – главное квантовое число n = 1, 2, 3, 4, … 1. n совпадает с номером периода Нильс Бор Число электронов на энергетическом уровне N e =2n 2
Слайд 36
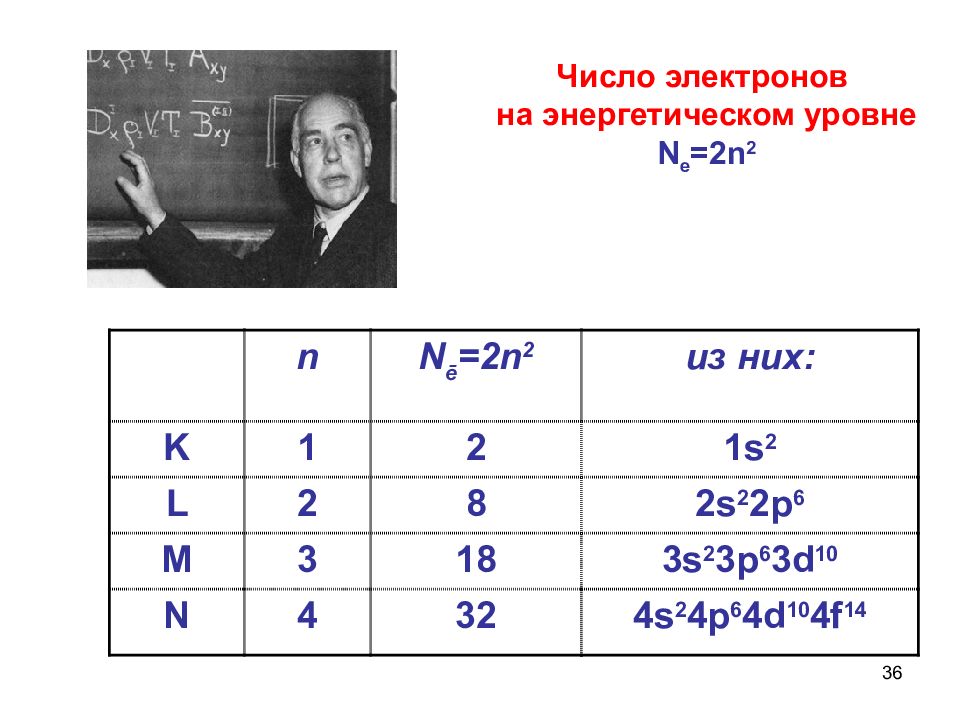
36 n N ē =2n 2 из них : K 1 2 1s 2 L 2 8 2s 2 2p 6 M 3 18 3s 2 3p 6 3d 10 N 4 32 4s 2 4p 6 4d 10 4f 14 Число электронов на энергетическом уровне N e =2n 2
Слайд 37
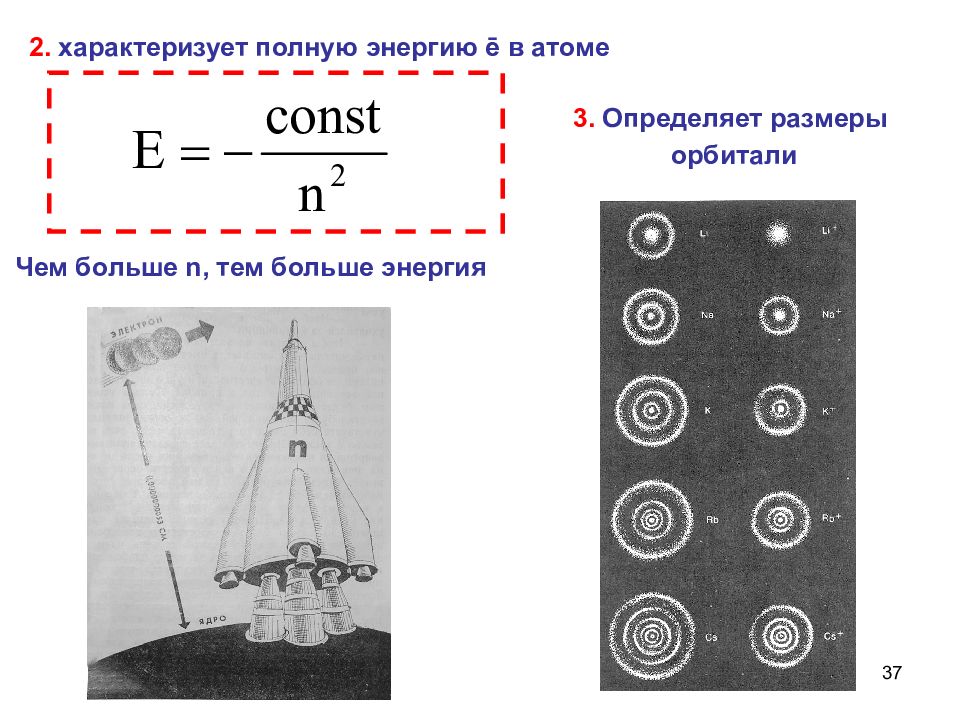
37 2. характеризует полную энергию ē в атоме 3. Определяет размеры орбитали Чем больше n, тем больше энергия
Слайд 38
38 Зоммерфельд Арнольд Иоганн Вильгельм (5.12.1868 – 26.06.1951) Разработал квантовую теорию эллиптических орбит. Ввел орбитальное квантовое число. Совместно с Дебаем установил (1916 г.), что для характеристики движения электрона в атоме при действии магнитного поля требуется третье, «внутреннее квантовое число». Вывел уравнение зависимости энергии атома от главного и орбитального квантовых чисел. L – орбитальное квантовое число V e ≈ 2000 м/сек
Слайд 39
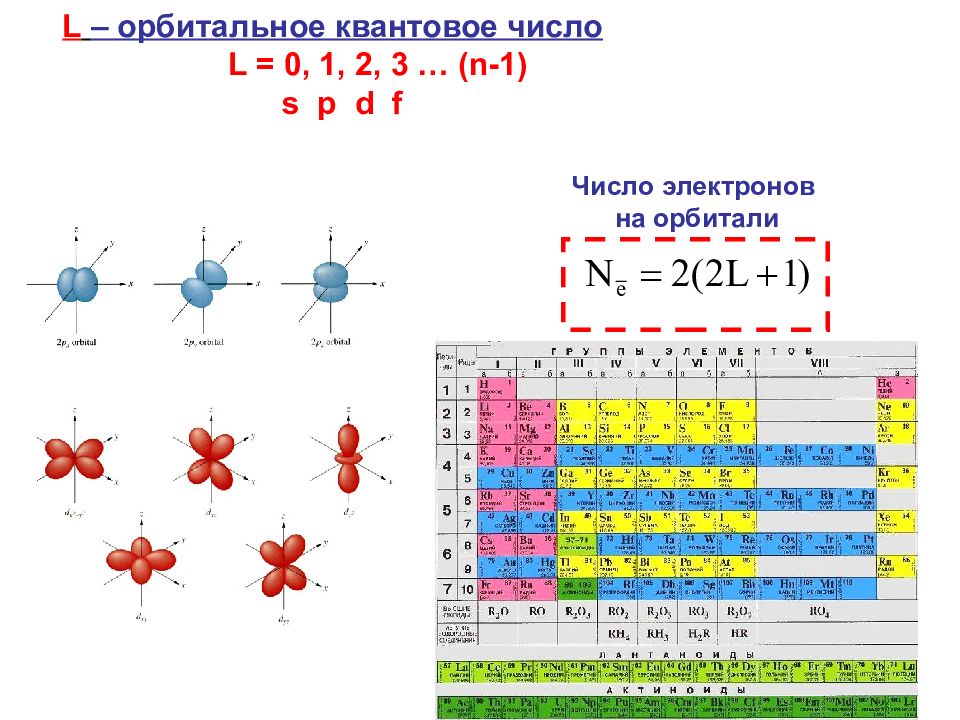
39 характеризует: Форму электронного облака L – орбитальное квантовое число L = 0, 1, 2, 3 … ( n-1) s p d f
Слайд 41
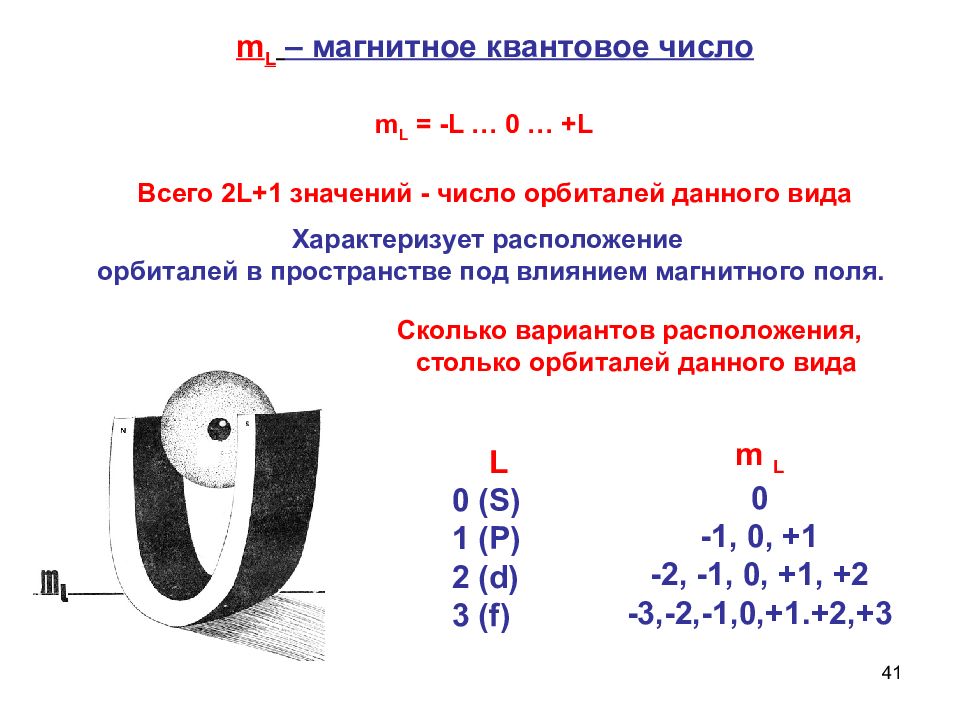
41 L 0 ( S ) 1 (Р) 2 ( d ) 3 ( f ) m L 0 -1, 0, +1 -2, -1, 0, +1, +2 -3,-2,-1,0,+1.+2,+3 Сколько вариантов расположения, столько орбиталей данного вида Характеризует расположение орбиталей в пространстве под влиянием магнитного поля. m L – магнитное квантовое число m L = - L … 0 … + L Всего 2 L +1 значений - число орбиталей данного вида
Слайд 42
42 Варианты расположения s, p, d – орбиталей при наложении магнитного поля L 0 ( S ) 1 (Р) 2 ( d ) 3 ( f ) m L 0 -1, 0, +1 -2, -1, 0, +1, +2 -3,-2,-1,0,+1.+2,+3 Число электронов на орбитали
Слайд 43
43 Число электронов на орбитали L – орбитальное квантовое число L = 0, 1, 2, 3 … ( n-1) s p d f
Слайд 44
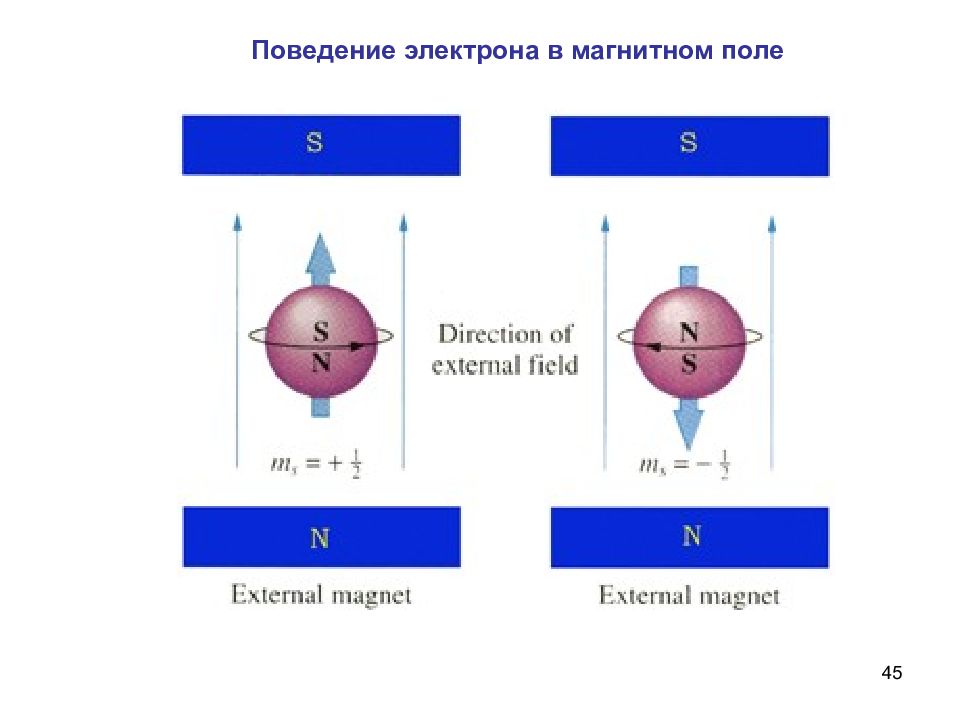
44 s – спиновое квантовое число Спин, бывший ранее гипотезой, подтверждался уравнением Дирака. Нобелевская премия совместно со Шредингером в 1933 году. s = ±½ Поль Дирак (8.08.1902 – 20.10.1984) 1. Характеризует вращение электрона вокруг собственной оси по часовой стрелке ↑ и против ↓
Слайд 46
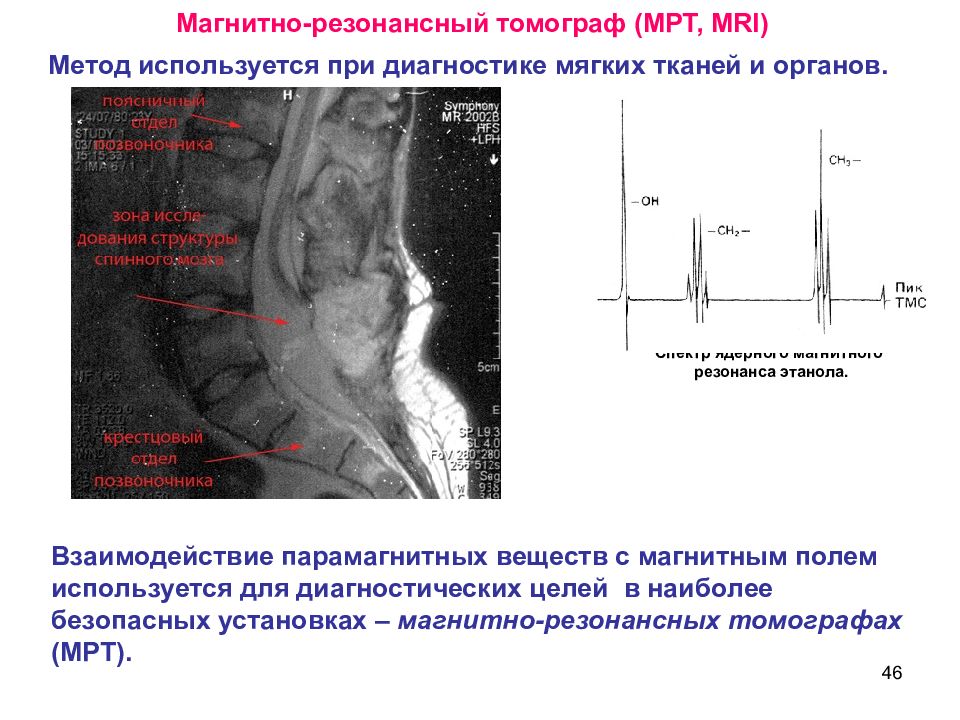
46 Взаимодействие парамагнитных веществ с магнитным полем используется для диагностических целей в наиболее безопасных установках – магнитно-резонансных томографах (МРТ). Метод используется при диагностике мягких тканей и органов. Магнитно-резонансный томограф (МРТ, MRI ) Спектр ядерного магнитного резонанса этанола.
Слайд 47
47 n N ē =2n 2 из них : K 1 2 1s 2 L 2 8 2s 2 2p 6 M 3 18 3s 2 3p 6 3d 10 N 4 32 4s 2 4p 6 4d 10 4f 14 Число электронов на одном энергетическом уровне
Слайд 48
48 Принцип Паули В атоме не может быть двух ē (электронов) с одинаковым набором четырёх квантовых чисел. Нобелевская премия (1945 г.) "за открытие принципа запрета, который называют также принципом запрета Паули". Вольфганг Паули (25.04.1890 – 15.12.1958)
Слайд 49
49 Иллюстрация принципа Паули: все электроны разные – отличаются хотя бы одним значением квантового числа
Слайд 50
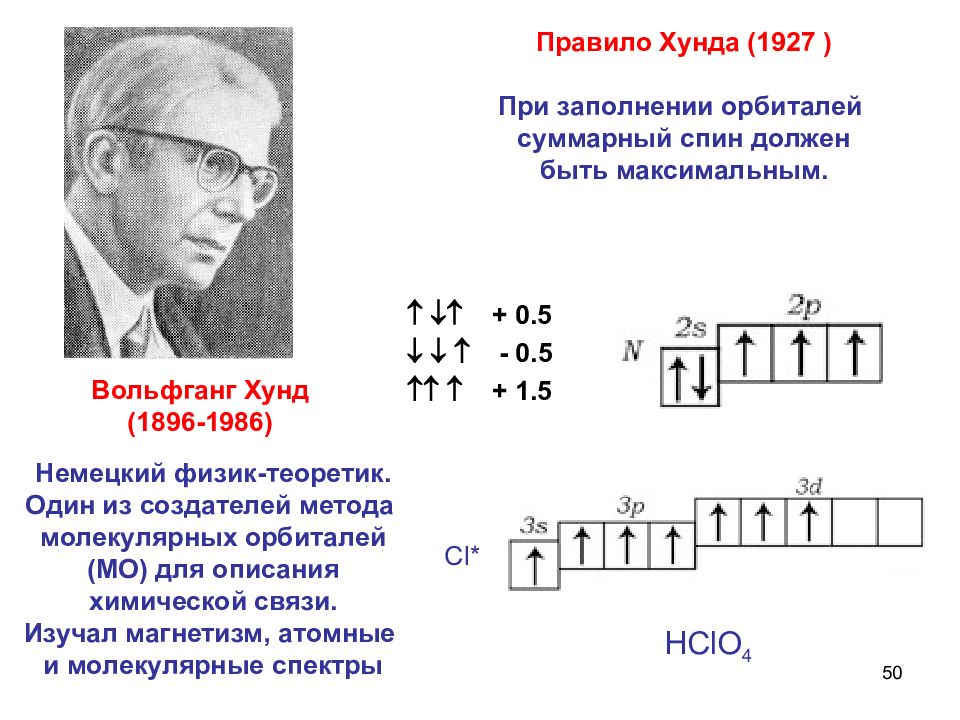
50 Правило Хунда (1927 ) При заполнении орбиталей суммарный спин должен быть максимальным. + 0.5 - 0.5 + 1.5 НС l О 4 С l * Немецкий физик-теоретик. Один из создателей метода молекулярных орбиталей (МО) для описания химической связи. Изучал магнетизм, атомные и молекулярные спектры Вольфганг Хунд (1896-1986)
Слайд 51
51 Электронные конфигурации атомов s, p n d n - 1 f n - 2 g n - 3 h n - 4 s и p электроны заполняют энергетический уровень, совпадающий с номером периода ; d электроны заполняют ( n -1) энергетический уровень по сравнению с периодом; f электроны заполняют ( n -2) энергетический уровень по сравнению с периодом.
Слайд 52
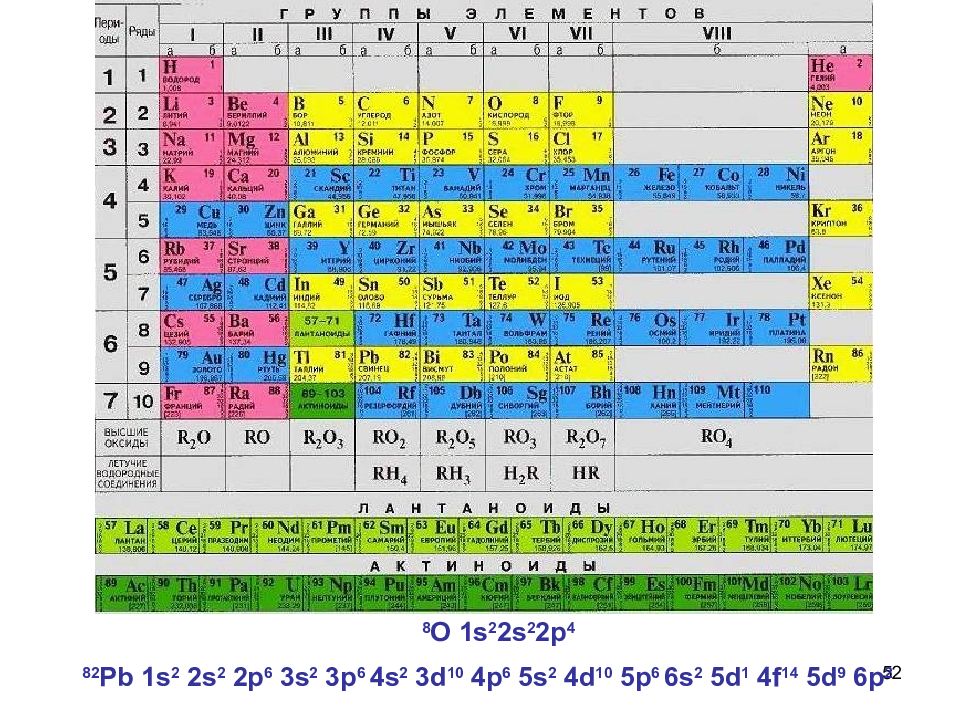
52 8 О 1 s 2 2s 2 2p 4 82 Pb 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 1 4f 14 5d 9 6p 2
Слайд 53
53 n N ē =2n 2 из них : K 1 2 1s 2 L 2 8 2s 2 2p 6 M 3 18 3s 2 3p 6 3d 10 N 4 32 4s 2 4p 6 4d 10 4f 14 Переход на краткую запись Pb KLMN 5s 2 5p 6 5d 10 6s 2 6p 2 8 O 1s 2 2s 2 2p 4 8 O К 2s 2 2p 4 82 Pb 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 1 4f 14 5d 9 6p 2
Слайд 54
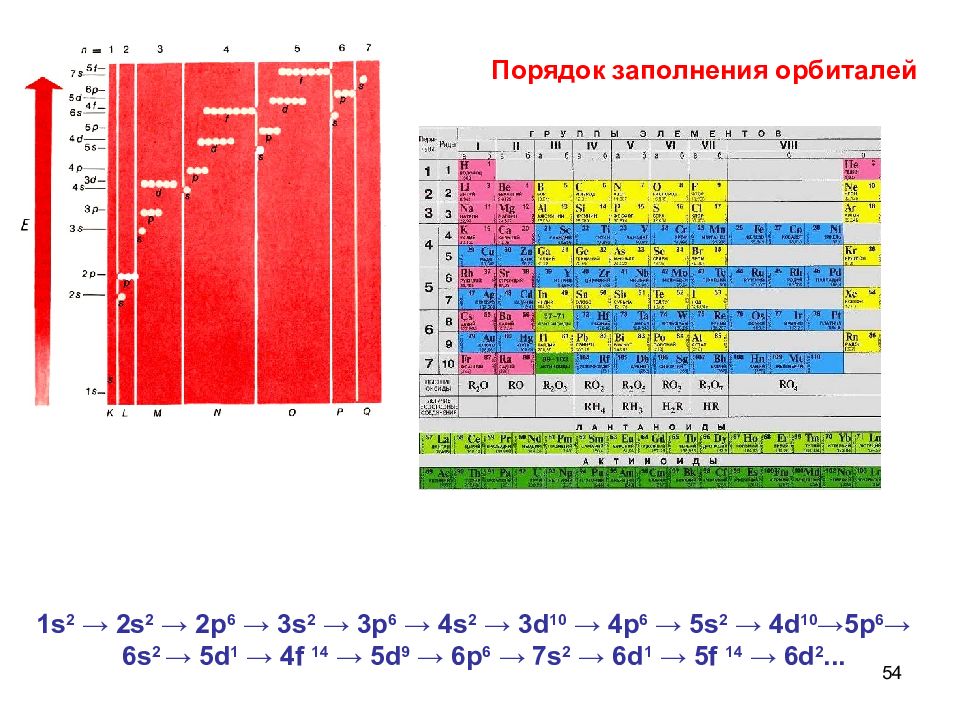
54 1 s 2 → 2s 2 → 2p 6 → 3s 2 → 3p 6 → 4s 2 → 3d 10 → 4p 6 → 5s 2 → 4d 10 → 5p 6 → 6s 2 → 5d 1 → 4f 14 → 5d 9 → 6p 6 → 7s 2 → 6d 1 → 5f 14 → 6d 2... Порядок заполнения орбиталей
Слайд 55
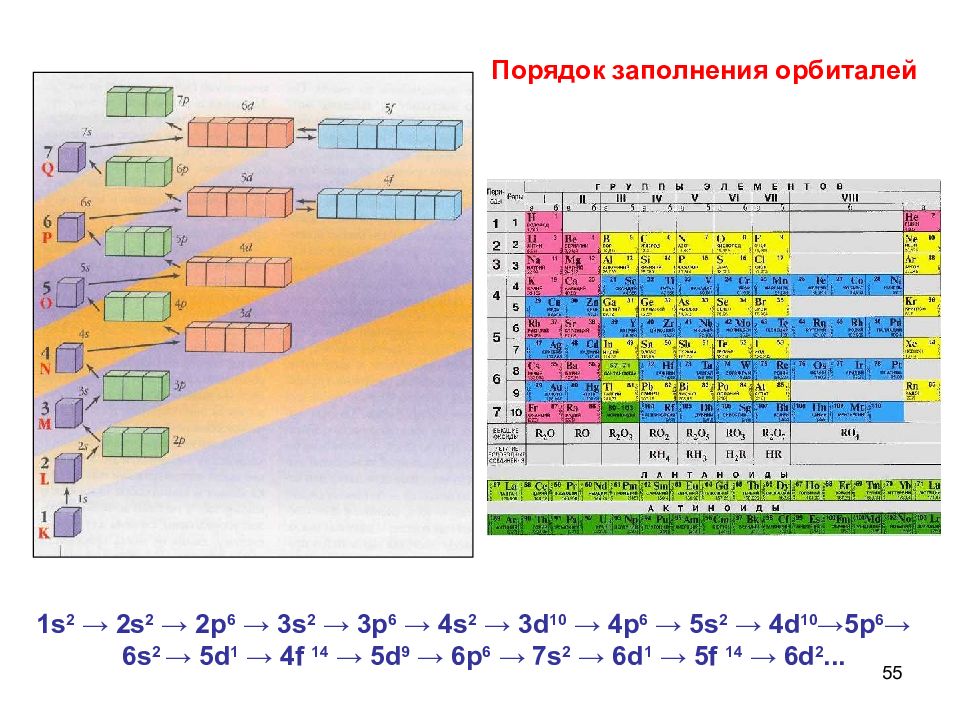
55 1 s 2 → 2s 2 → 2p 6 → 3s 2 → 3p 6 → 4s 2 → 3d 10 → 4p 6 → 5s 2 → 4d 10 → 5p 6 → 6s 2 → 5d 1 → 4f 14 → 5d 9 → 6p 6 → 7s 2 → 6d 1 → 5f 14 → 6d 2... Порядок заполнения орбиталей
Слайд 56
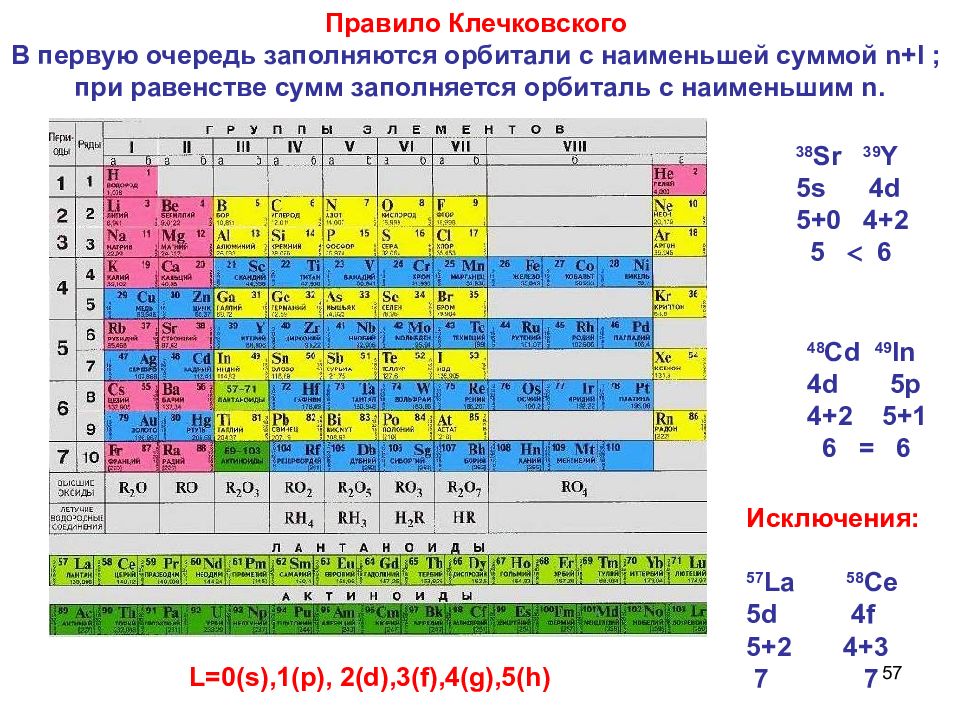
56 Клечковский Всеволод Маврикиевич (28.11.1900 -2.05.1972) Правило Клечковского Советский агрохимик. Впервые организовал широкие экспериментальные исследования питания растений с применением радиоактивных изотопов. Ввел правила формирования электронных конфигураций атомов по мере роста заряда ядра.
Слайд 57
57 Правило Клечковского В первую очередь заполняются орбитали с наименьшей суммой n+l ; при равенстве сумм заполняется орбиталь с наименьшим n. Исключения: 57 La 58 C е 5 d 4 f 5+2 4+3 7 7 48 Cd 49 In 4d 5p 4+2 5+1 6 = 6 38 Sr 39 Y 5s 4d 5+0 4+2 5 6 L=0(s),1(p), 2(d),3(f),4(g),5(h)
Слайд 58
58 Проскок электрона Для 4-го и 9-го по счету d -элементов (кроме 74 W) наблюдается проскок s– электрона на d -орбиталь, при этом d- орбиталь заполняется наполовину или полностью, что энергетически выгоднее. Для 4-го по счету d -элемента происходит также увеличение суммарного спина.
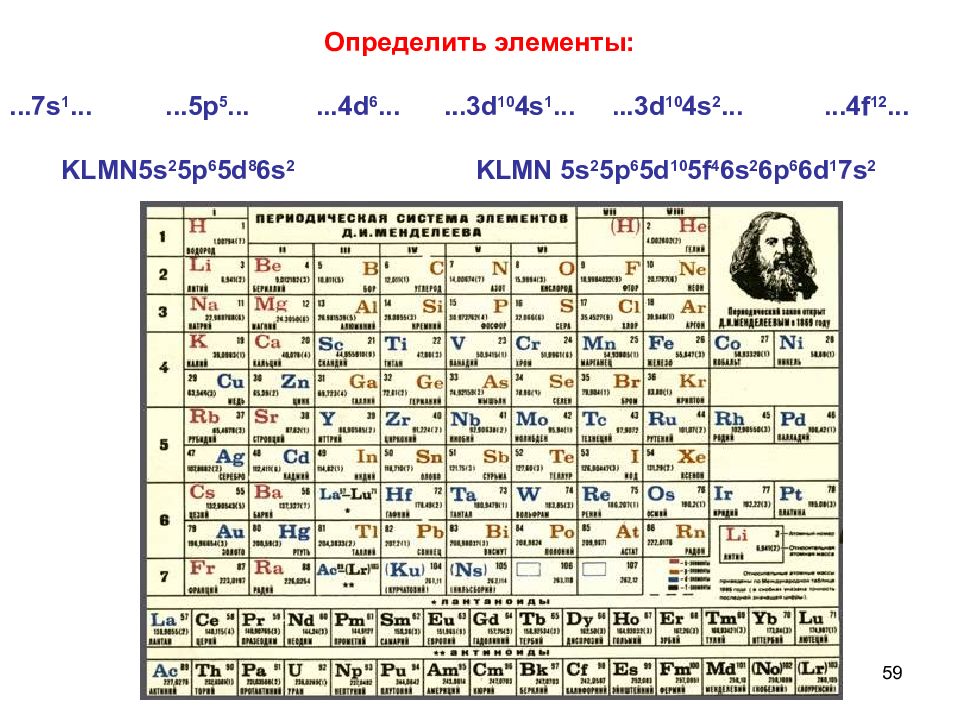
Слайд 59
59 Определить элементы: ...7s 1......5p 5......4d 6......3d 10 4s 1......3d 10 4s 2......4f 12... KLMN5s 2 5p 6 5d 8 6s 2 KLMN 5s 2 5p 6 5d 10 5f 4 6s 2 6p 6 6d 1 7s 2
Слайд 60
60 Поиск элементов s, p n d n + 1 f n + 2 g n + 3 h n + 4 s и p элементы ищем в периоде, совпадающем с номером энергетического уровня; d элементы – в ( n +1) периоде; f -элементы - в ( n +2) периоде и т.д.
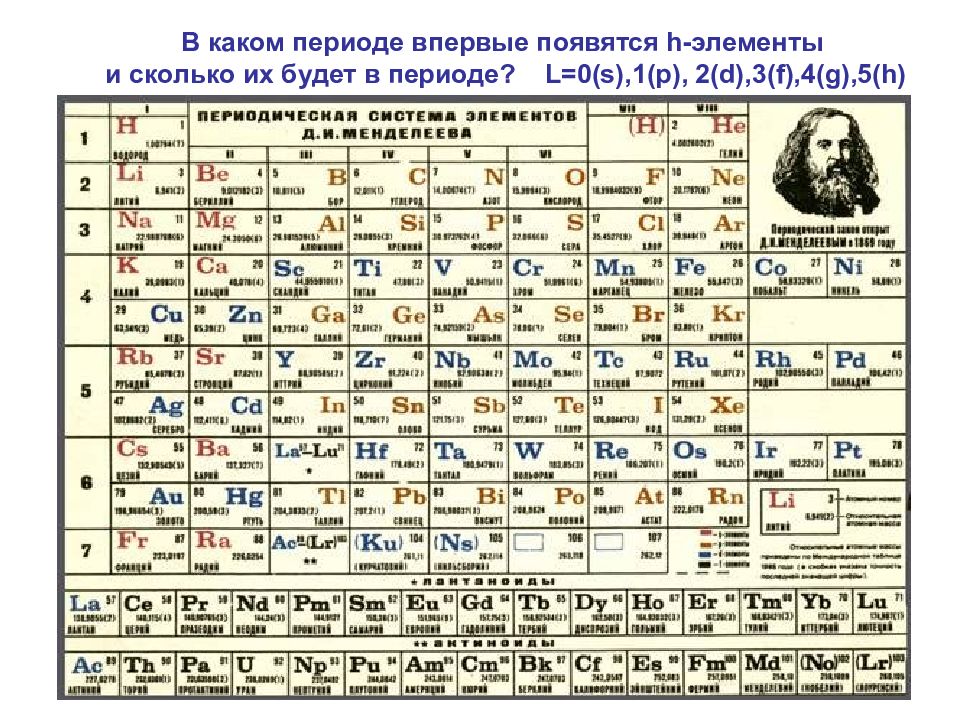
Слайд 61
61 В каком периоде впервые появятся h -элементы и сколько их будет в периоде? L=0(s),1(p), 2(d),3(f),4(g),5(h)
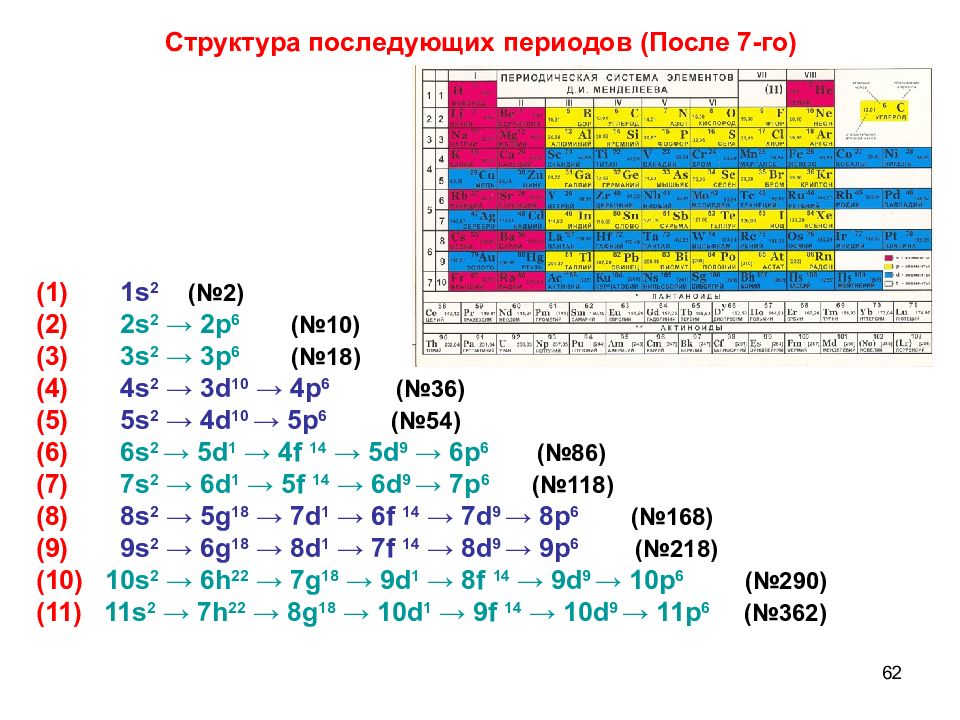
Слайд 62
62 (1) 1 s 2 (№2) (2) 2s 2 → 2p 6 (№10) (3) 3s 2 → 3p 6 (№18) (4) 4s 2 → 3d 10 → 4p 6 (№36) (5) 5s 2 → 4d 10 → 5p 6 (№54) (6) 6s 2 → 5d 1 → 4f 14 → 5d 9 → 6p 6 (№86) (7) 7s 2 → 6d 1 → 5f 14 → 6d 9 → 7 p 6 (№118) (8) 8 s 2 → 5 g 18 → 7d 1 → 6f 14 → 7d 9 → 8p 6 (№168) (9) 9s 2 → 6g 18 → 8d 1 → 7f 14 → 8d 9 → 9p 6 (№218) (10) 10s 2 → 6h 22 → 7g 18 → 9d 1 → 8f 14 → 9d 9 → 10p 6 (№290) (11) 11s 2 → 7h 22 → 8g 18 → 10d 1 → 9f 14 → 10d 9 → 11p 6 (№362) Структура последующих периодов (После 7-го)
Слайд 63
63 Электронные конфигурации ионов: 16 S 0 KL 3 s 2 3 p 4 S 2 - KL 3s 2 3p 6 S 4 + KL 3s 2 3p 0 S 6+ KL 3 s 0 3 p 0
Слайд 64
64 Электронные конфигурации ионов: 16 S 0 KL 3 s 2 3 p 4 S 2 - KL 3s 2 3p 6 S 4 + KL 3s 2 3p 0 S 6+ KL 3 s 0 3 p 0
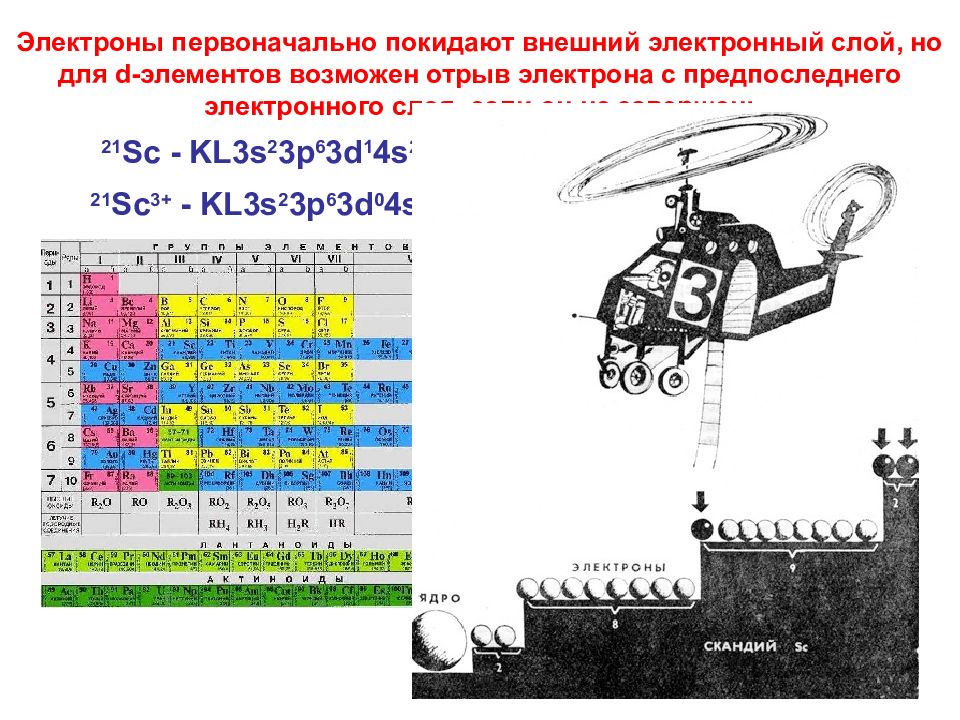
Слайд 65
65 Электроны первоначально покидают внешний электронный слой, но для d -элементов возможен отрыв электрона с предпоследнего электронного слоя, если он не завершен: 21 Sc - KL3s 2 3p 6 3d 1 4s 2 21 Sc 3+ - KL3s 2 3p 6 3d 0 4s 0
Слайд 66
66 Нормальное и возбужденное состояние атомов: K2S 2 2 p 2 K2S 1 2 p 3 Атомы в возбужденном состоянии называются атомными радикалами!
Слайд 67
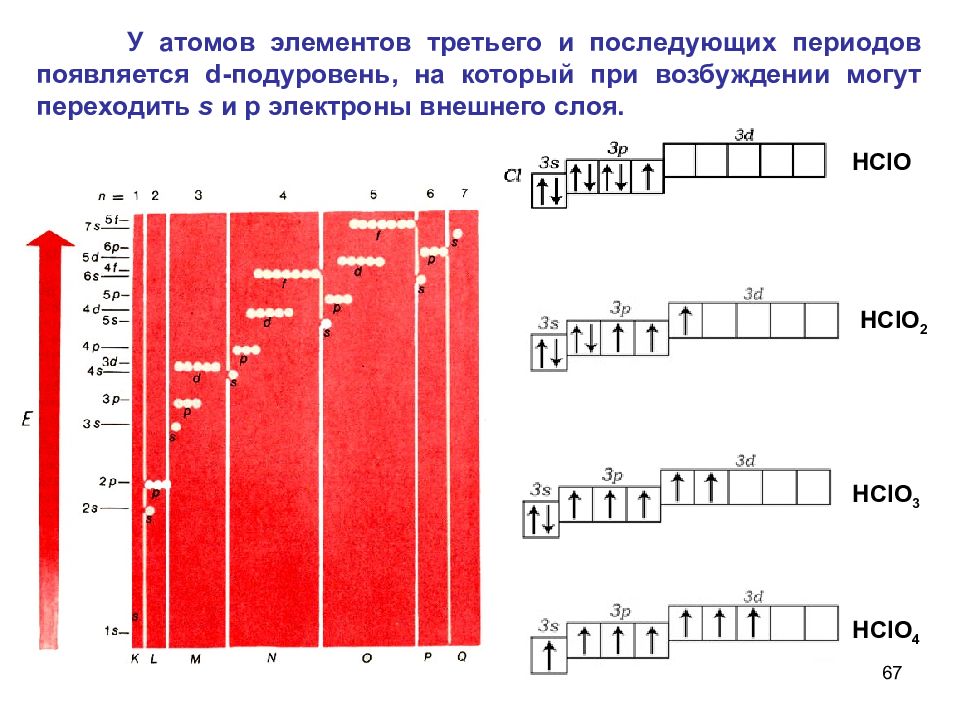
67 У атомов элементов третьего и последующих периодов появляется d -подуровень, на который при возбуждении могут переходить s и р электроны внешнего слоя. Н ClO 2 НС l О 3 НС l О 4 Н ClO
Слайд 68: Тест №2 Электронные конфигурации. (один вариант ответа)
68 Тест №2 Электронные конфигурации. (один вариант ответа)
Слайд 69: 1.Укажите электронную конфигурацию атома элемента с протонным числом 15:
69 1.Укажите электронную конфигурацию атома элемента с протонным числом 15: 1) 1s 2 2s 2 2p 6 3s 2 2) 1s 2 2s 2 2p 6 3s 2 3p 1 3) 1s 2 2s 2 2p 6 3s 2 3p 2 4) 1s 2 2s 2 2p 6 3s 2 3p 3
Слайд 70: 2. Какова сокращенная электронная конфигурация атома элемента с порядковым номером 20?
70 2. Какова сокращенная электронная конфигурация атома элемента с порядковым номером 20? 1) [ А r] 4s 1 2) [N е ] 3s 1 3) [ А r] 4s 2 4) [N е ] 3s 2
Слайд 71: 3. Укажите сокращенную электронную конфигурацию основного состояния атома марганца:
71 3. Укажите сокращенную электронную конфигурацию основного состояния атома марганца: 1 ) [Ar] 3d 3 4s 2 ; 2) [Ar] 3d 5 4s 1 ; 3) [Ar] 3d 5 4s 2. 4) [Ar] 3d 6 4s 1.
Слайд 72: 4. Число неспаренных электронов в атоме фосфора в основном состоянии равно:
72 4. Число неспаренных электронов в атоме фосфора в основном состоянии равно: 1) 5 2) 4 3) 3 4) 2
Слайд 73: 5. Наибольшее число вакантных (незаполненных) орбиталей на внешнем электронном слое в основном состоянии имеет атом:
73 5. Наибольшее число вакантных (незаполненных) орбиталей на внешнем электронном слое в основном состоянии имеет атом: 1) Na ; 2) А l ; 3) Р; 4) С l.
Слайд 74: 6.Укажите число незаполненных З d -орбиталей в основном состоянии атома V:
74 6.Укажите число незаполненных З d -орбиталей в основном состоянии атома V: 1) 4 2) 3 3) 2 4) 1
Слайд 75: 7.Число неспаренных электронов в основном состоянии атома С r равно:
75 7.Число неспаренных электронов в основном состоянии атома С r равно: 1) 6 2) 5 3) 4 4) 3
Слайд 76: 8.Укажите суммарное число s -электронов в основном состоянии атома С u :
76 8.Укажите суммарное число s -электронов в основном состоянии атома С u : 1) 8 2) 6 3) 7 4) 5
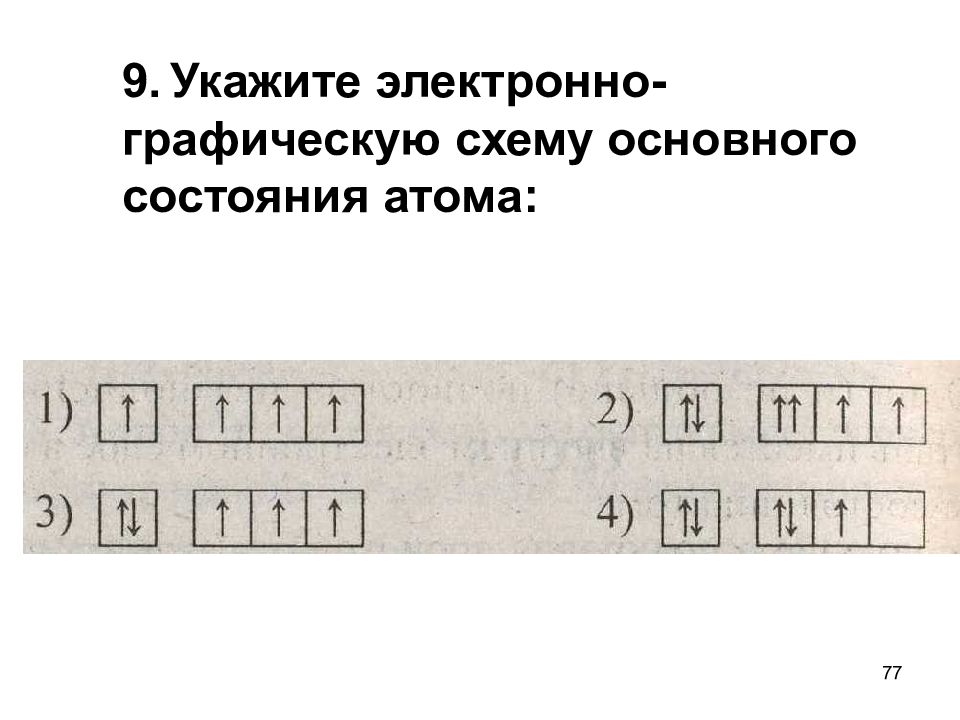
Слайд 77: 9. Укажите электронно-графическую схему основного состояния атома:
77 9. Укажите электронно-графическую схему основного состояния атома:
Слайд 78
78 10. Энергетический З d -подуровень заполнен наполовину в основном состоянии атома: 1) V 2) Cr 3) F е 4) Zn
Слайд 79: 11. Число энергетических слоев и число электронов во внешнем энергетическом слое атома мышьяка равны соответственно
79 11. Число энергетических слоев и число электронов во внешнем энергетическом слое атома мышьяка равны соответственно 1) 4, 6 2) 2, 5 3) 3, 7 4) 4, 5
Слайд 80: 12. Химические элементы, в атомах которых одинаковое число энергетических слоев расположены в ряду:
80 12. Химические элементы, в атомах которых одинаковое число энергетических слоев расположены в ряду: 1) K, Na, Li 2) Ca, Mg, Al 3) Al, Si, P 4) S, Cr, Se
Слайд 81: 13. К s -элементам относится:
81 13. К s -элементам относится: 1) Al 2) Be 3) C 4) B
Слайд 82
82 14. Электронная конфигурация 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 соответствует иону : Li + 2) К + 3) Cs + 4) Na +
Слайд 83
83 15. Число электронов в атоме аргона равно числу электронов в ионе: S 2- 2) А I 3+ 3) Na + 4) F -
Слайд 84
84 16. На третьем энергетическом уровне имеется по 8 электронов у каждой из частиц: Na + и А r 2) S 2- и А r 3) F - и Ne 4) Mg 2+ и S -
Слайд 85
85 17. Число энергетических уровней и число внешних электронов атома хлора равны соответственно: 4, 6 2, 5 3, 7 4, 5
Слайд 86
86 18. В атомах щелочных металлов одинаковое число: 1 ) электронных энергетических уровней 2) электронов на втором энергетическом уровне 3) валентных электронов 4) протонов и нейтронов
Слайд 87
87 19. Инертный газ, имеющий такую же электронную конфигурацию, что и ион Sc 3 + 1) He 2) Ne 3) Xe 4) Ar
Слайд 88
88 20. Число неспаренных электронов в атоме мышьяка в невозбужденном состоянии 1) 5 2) 3 3) 2 4) 4
Слайд 89
89 21. Восьмиэлектронную внешнюю оболочку имеет ион: 1) Р 3+ 2) S 2- 3) Cl 5+ 4) Fe 2+
Слайд 90
90 2 2. Число энергетических уровней и число внешних электронов алюминия равны соответственно: 1) 2 и1 2) 2 и 3 3) 3 и 3 4) 3 и 2
Слайд 91
91 23. Электронная конфигурация 1 s 2 2s 2 2p 6 3s 2 3p 6 соответствует иону: 1 ) N 3- 2) Cl - 3) S 4 + 4) Na +
Слайд 92
92 24. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел: 1) 2,8,8,2 2) 2,8,18,1 3) 2,8,8.1 4) 2,8,18,2
Слайд 93
93 25. Число электронов в атоме криптона равно числу электронов в ионе: 1 ) S е 2- 2) AI 3 + 3) Na + 4) F -
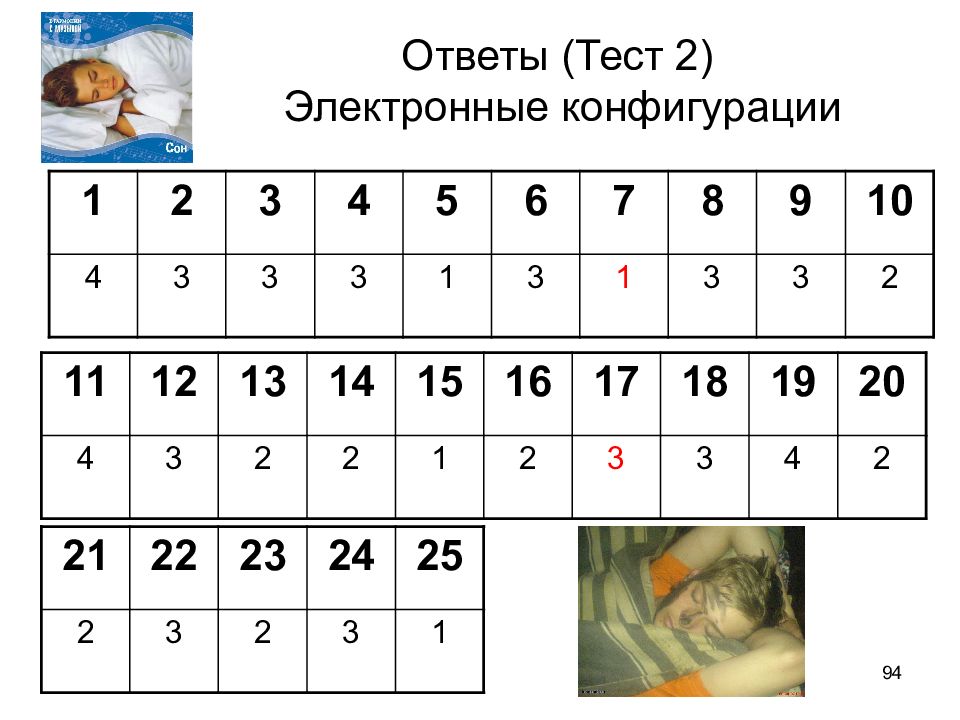
Слайд 94: Ответы (Тест 2) Электронные конфигурации
94 Ответы (Тест 2) Электронные конфигурации 1 2 3 4 5 6 7 8 9 10 4 3 3 3 1 3 1 3 3 2 11 12 13 14 15 16 17 18 19 20 4 3 2 2 1 2 3 3 4 2 21 22 23 24 25 2 3 2 3 1