Первый слайд презентации
Органическая и физическая химия РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ им. Н.И.ПИРОГОВА 1 Лекция 1 Строение органических соединений Кислотно-основные свойства органических соединений Курс лекций для студентов медико-биологического факультета, направление «Биофизика» Лекции читает ст.преподаватель Гузеева Татьяна Владимировна
Слайд 2
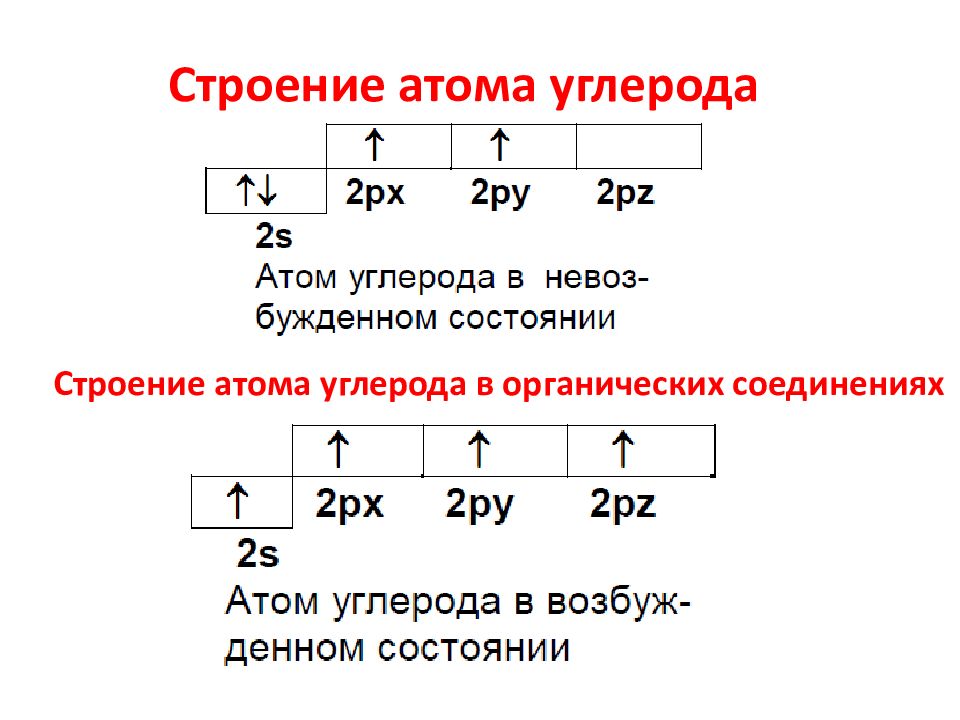
Строение атома углерода Строение атома углерода в органических соединениях
Слайд 3
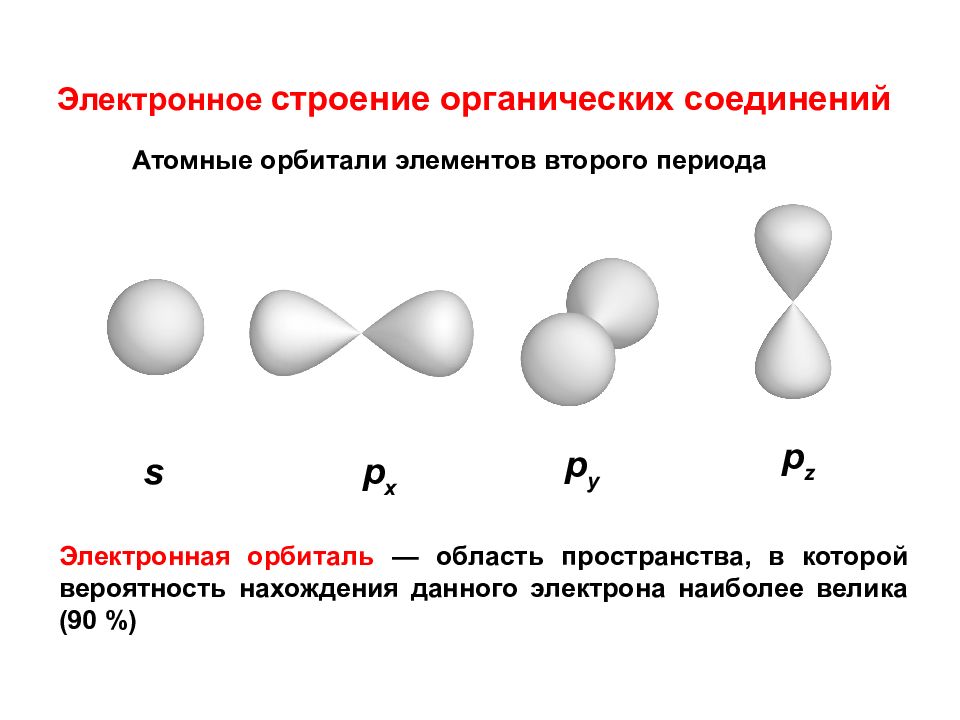
Электронное строение органических соединений Электронная орбиталь — область пространства, в которой вероятность нахождения данного электрона наиболее велика (90 %) Атомные орбитали элементов второго периода s p x p y p z
Слайд 4
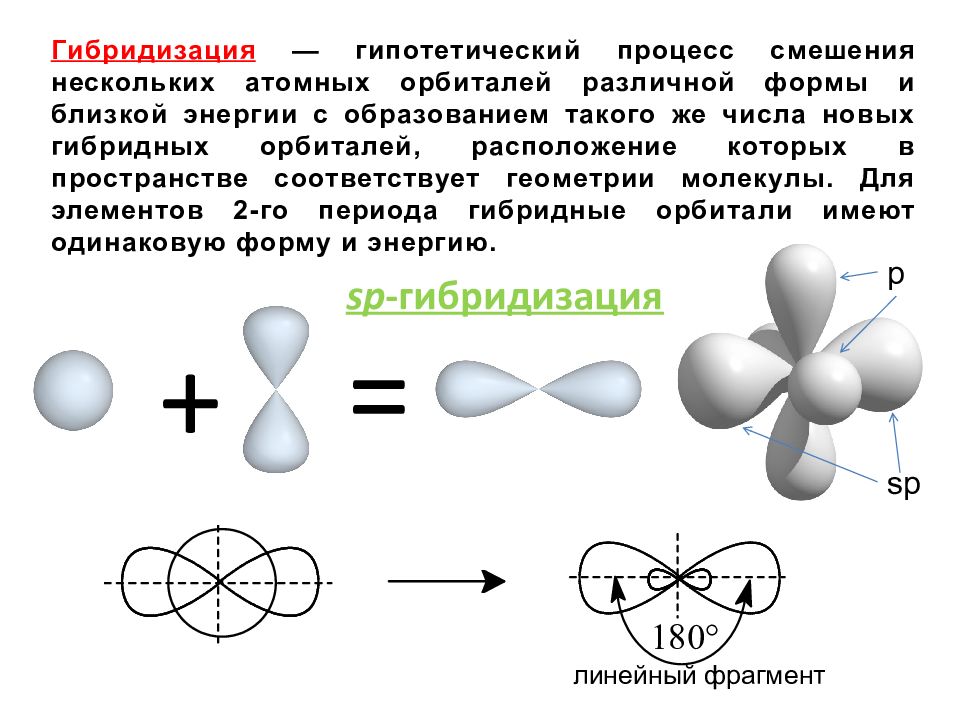
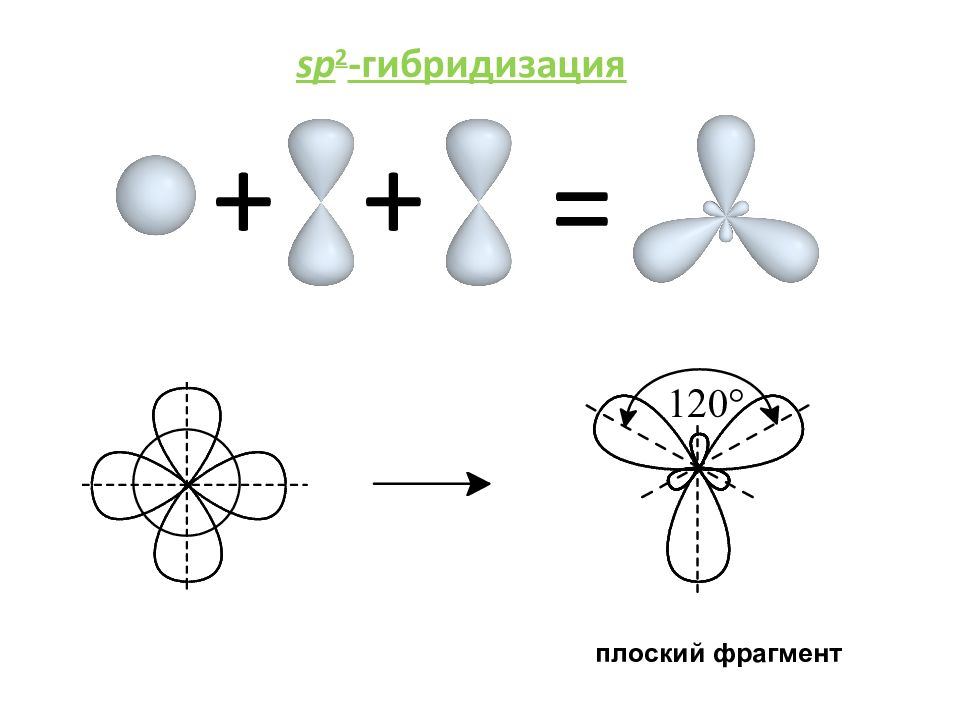
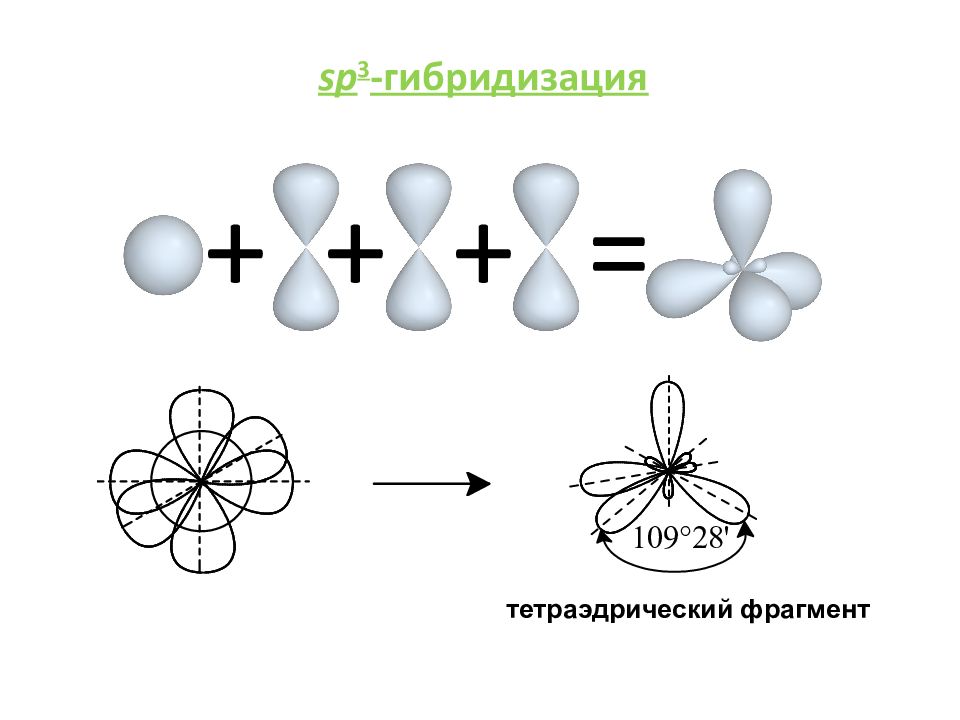
= + sp -гибридизация Гибридизация — гипотетический процесс смешения нескольких атомных орбиталей различной формы и близкой энергии с образованием такого же числа новых гибридных орбиталей, расположение которых в пространстве соответствует геометрии молекулы. Для элементов 2-го периода гибридные орбитали имеют одинаковую форму и энергию. sp p линейный фрагмент
Слайд 7
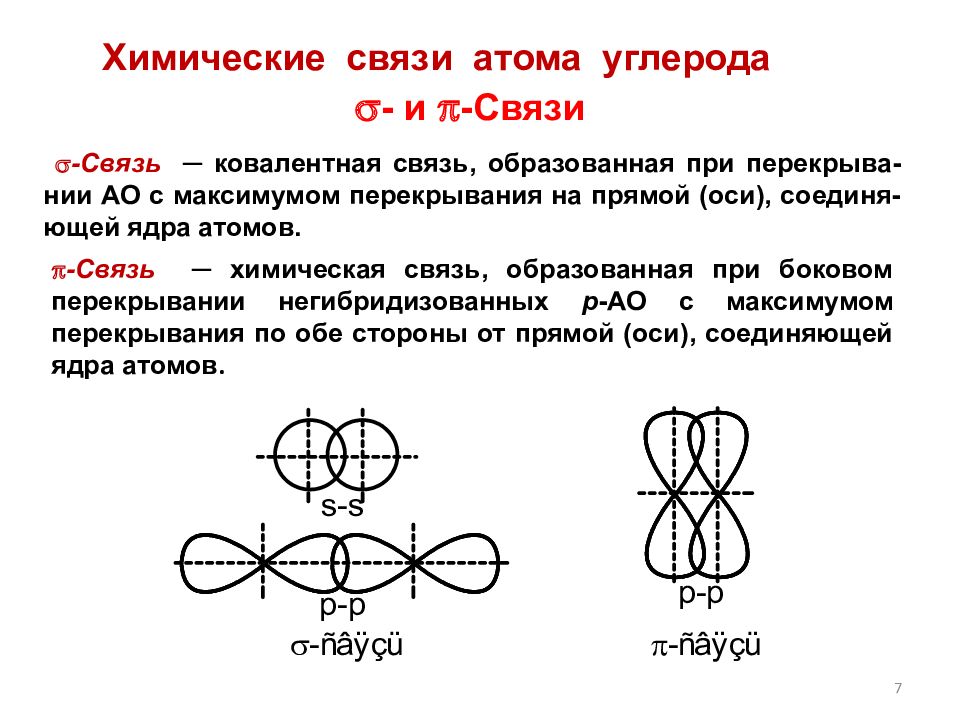
7 - Связь ─ химическая связь, образованная при боковом перекрывании негибридизованных р -АО с максимумом перекрывания по обе стороны от прямой (оси), соединяющей ядра атомов. - Связь ─ ковалентная связь, образованная при перекрыва-нии АО с максимумом перекрывания на прямой (оси), соединя-ющей ядра атомов. - и -Связи Химические связи атома углерода
Слайд 8
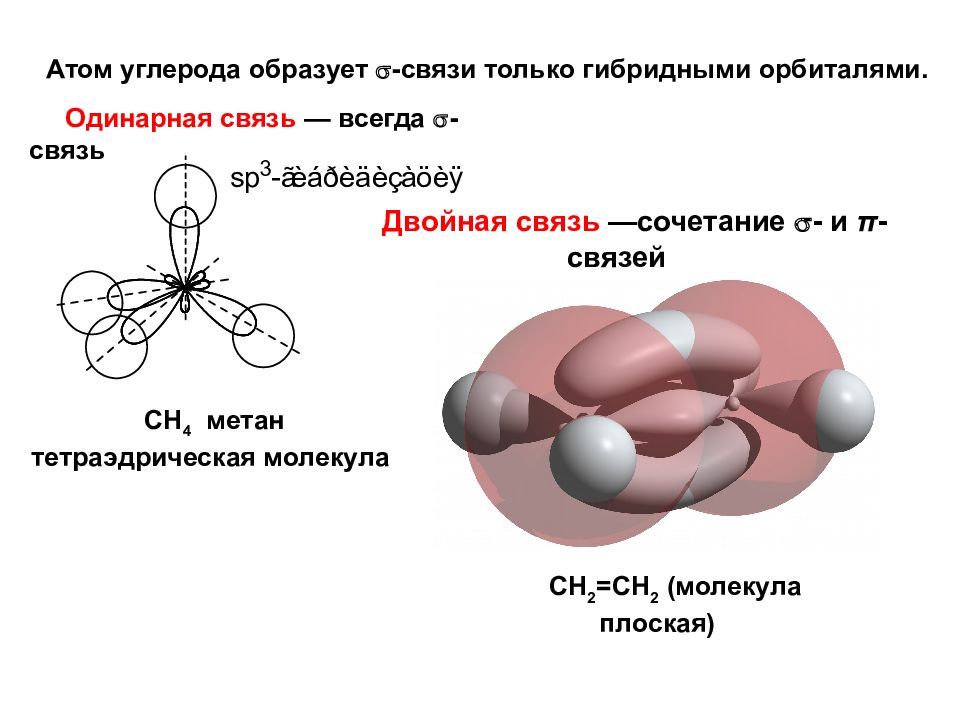
Атом углерода образует -связи только гибридными орбиталями. СН 4 метан тетраэдрическая молекула Одинарная связь — всегда -связь Двойная связь —сочетание - и π -связей СН 2 =СН 2 (молекула плоская)
Слайд 9
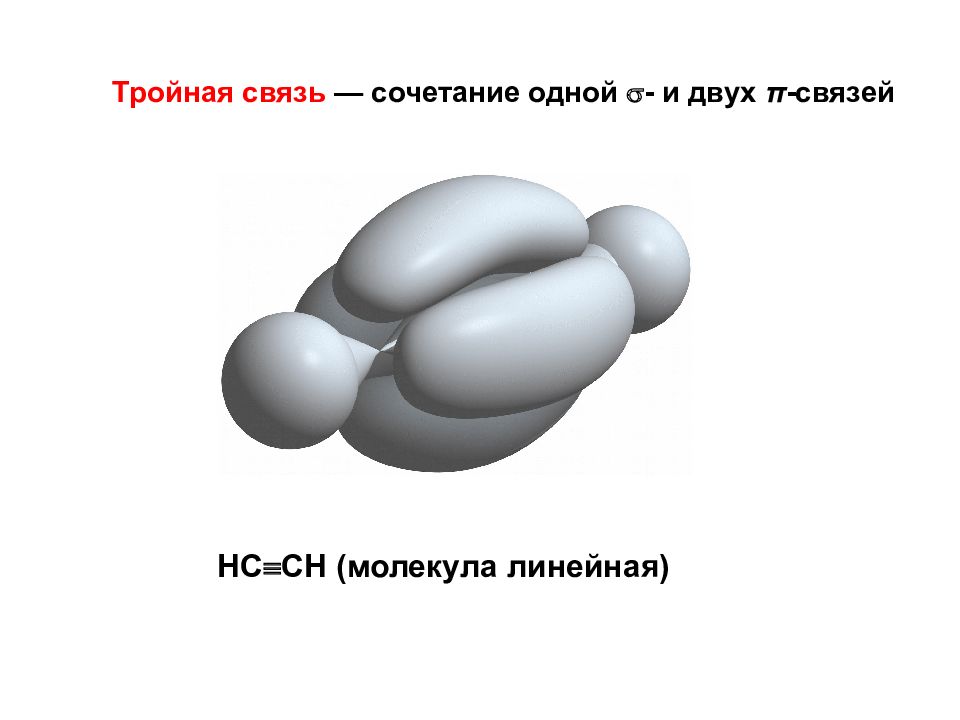
Тройная связь — сочетание одной - и двух π -связей НС СН (молекула линейная)
Слайд 10
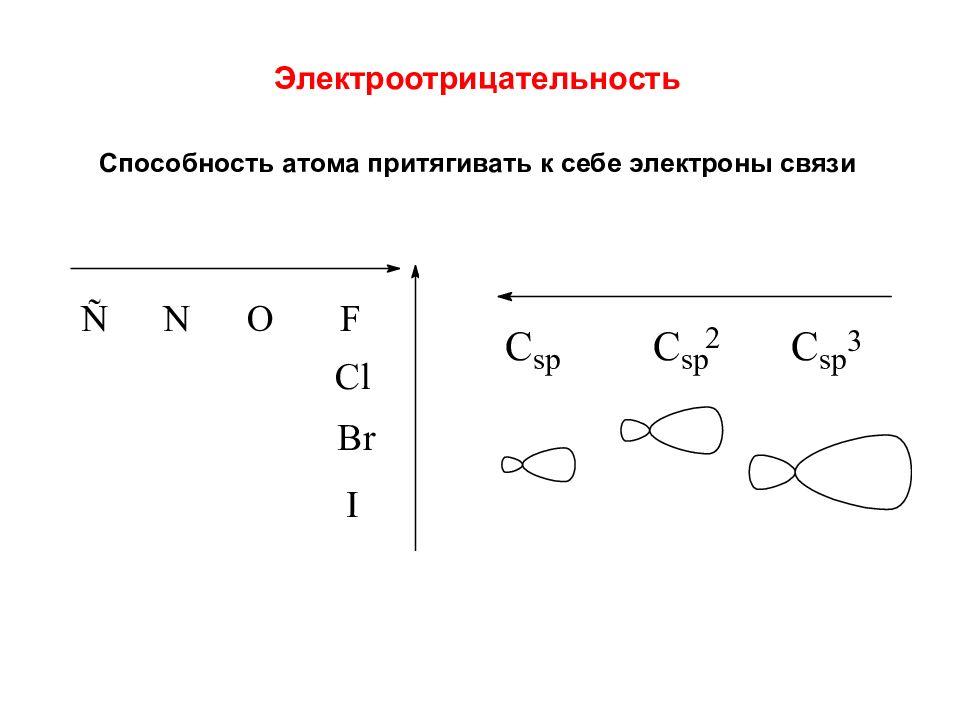
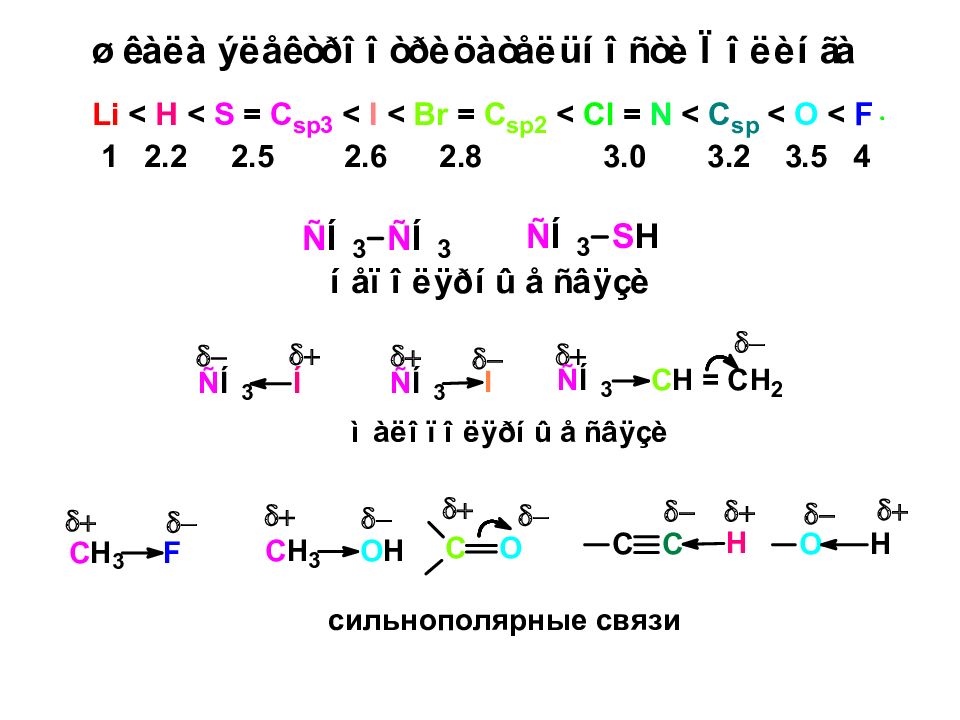
Электроотрицательность Способность атома притягивать к себе электроны связи
Слайд 12
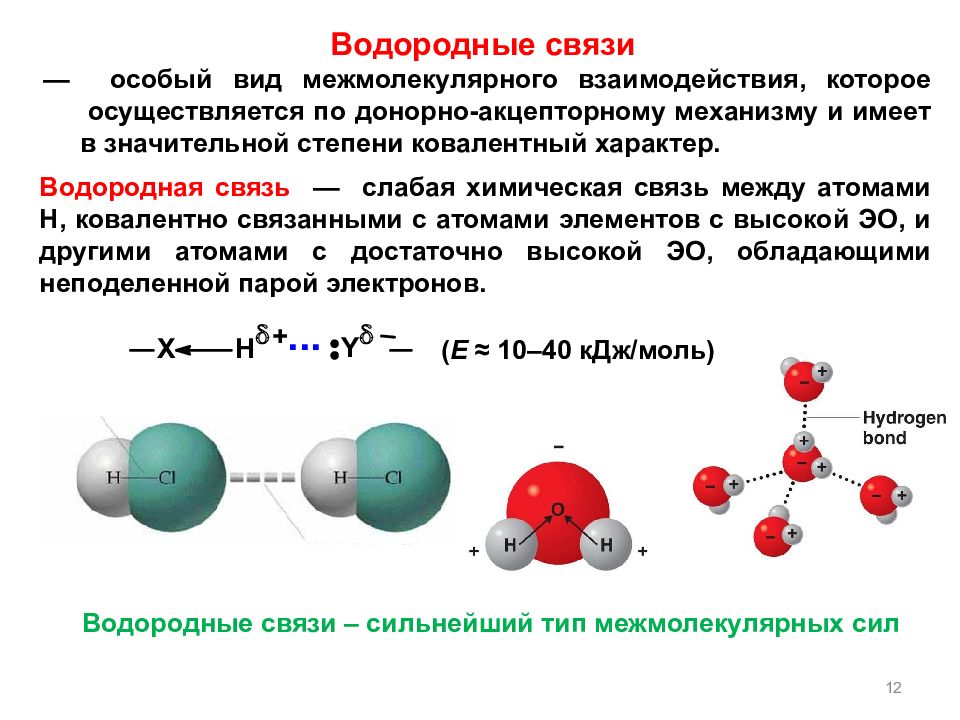
— особый вид межмолекулярного взаимодействия, которое осуществляется по донорно-акцепторному механизму и имеет в значительной степени ковалентный характер. 12 Водородная связь — слабая химическая связь между атомами Н, ковалентно связанными с атомами элементов с высокой ЭО, и другими атомами с достаточно высокой ЭО, обладающими неподеленной парой электронов. Водородные связи – сильнейший тип межмолекулярных сил ( Е ≈ 10 ‒ 40 кДж / моль) Водородные связи
Слайд 13
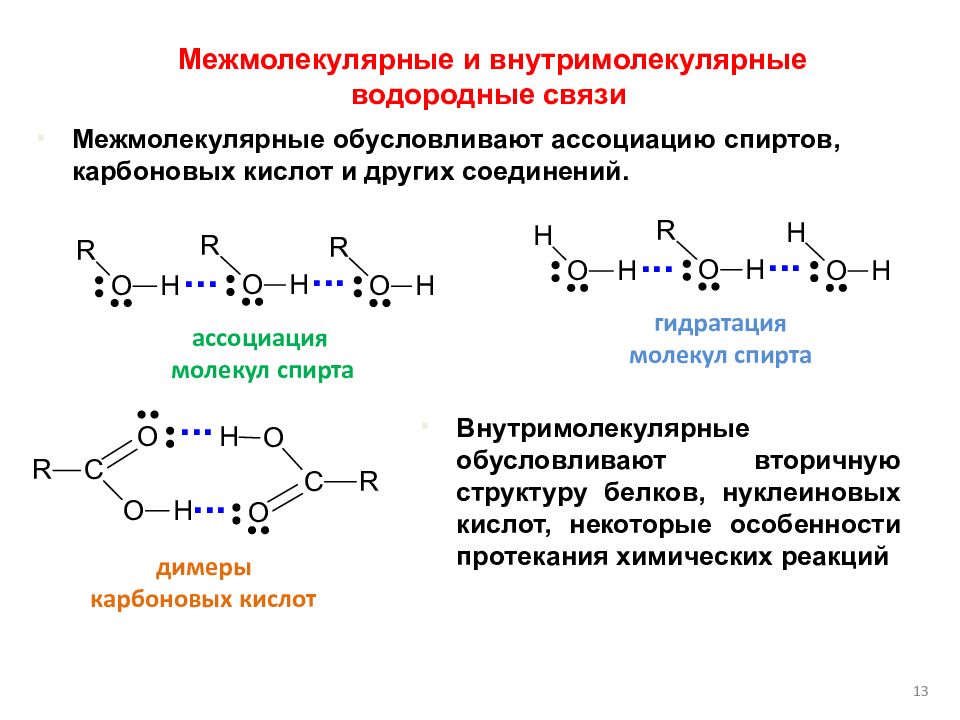
13 ассоциация молекул спирта гидратация молекул спирта димеры карбоновых кислот Межмолекулярные обусловливают ассоциацию спиртов, карбоновых кислот и других соединений. Межмолекулярные и внутримолекулярные водородные связи Внутримолекулярные обусловливают вторичную структуру белков, нуклеиновых кислот, некоторые особенности протекания химических реакций
Слайд 14
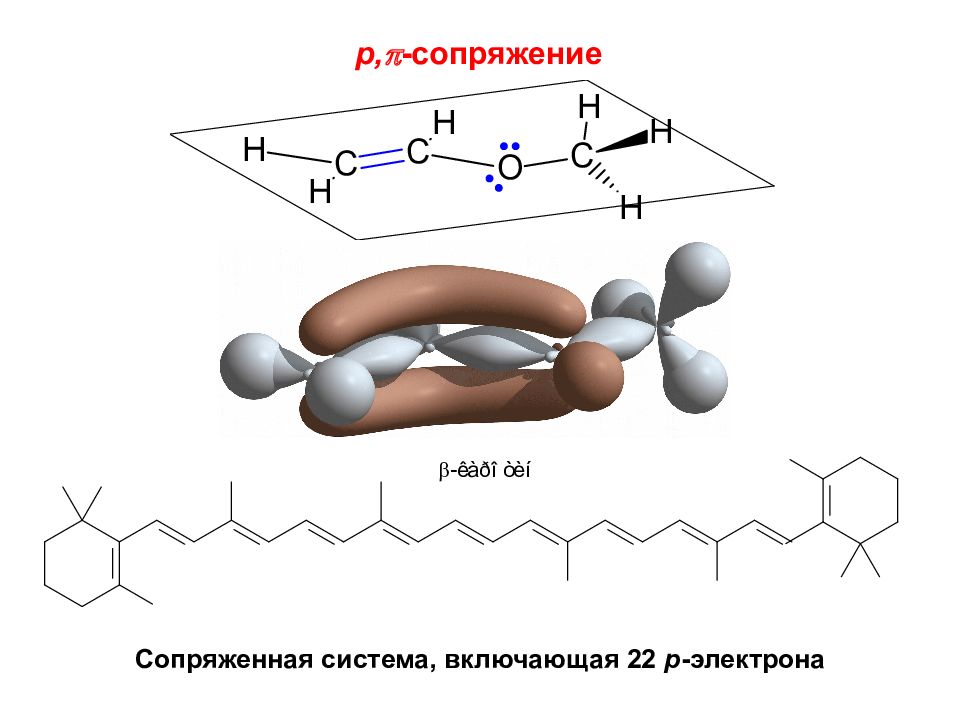
Делокализованные химические связи Делокализация электронной плотности ведет к более равномерному распределению электронной плотности в молекуле, что понижает ее энергию и повышает стабильность Делокализованная связь — ковалентная связь, электронная плотность которой рассредоточена между несколькими ( более чем двумя) атомами. Ее молекулярные орбитали охватывают более двух атомов.
Слайд 15
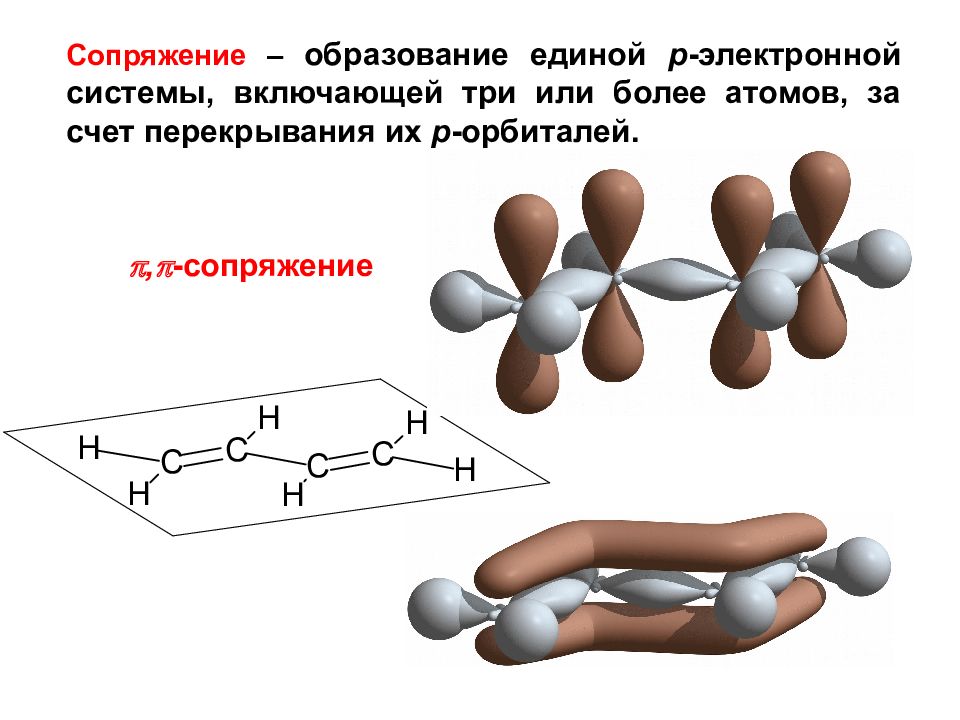
Сопряжение – образование единой р -электронной системы, включающей три или более атомов, за счет перекрывания их p -орбиталей. , -сопряжение
Слайд 17
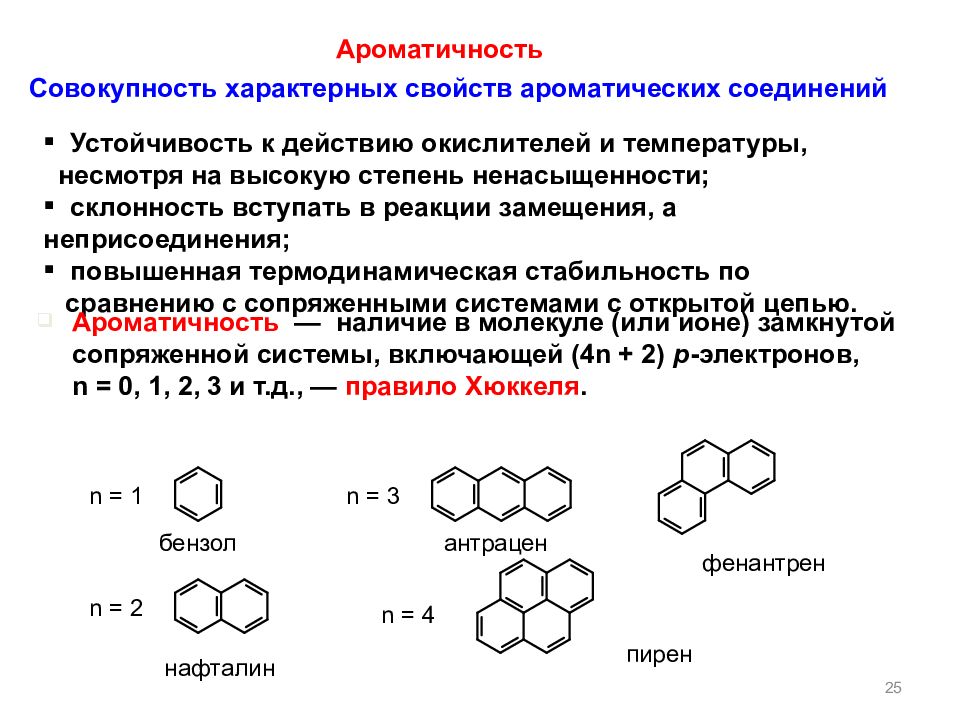
2 5 Совокупность характерных свойств ароматических соединений Устойчивость к действию окислителей и температуры, несмотря на высокую степень ненасыщенности; склонность вступать в реакции замещения, а неприсоединения ; повышенная термодинамическая стабильность по сравнению с сопряженными системами с открытой цепью. Ароматичность — наличие в молекуле (или ионе) замкнутой сопряженной системы, включающей (4 n + 2 ) p - электронов, n = 0, 1, 2, 3 и т.д., — правило Хюккеля. Ароматичность n = 1 n = 2 n = 3 n = 4 бензол нафталин антрацен фенантрен пирен
Слайд 18
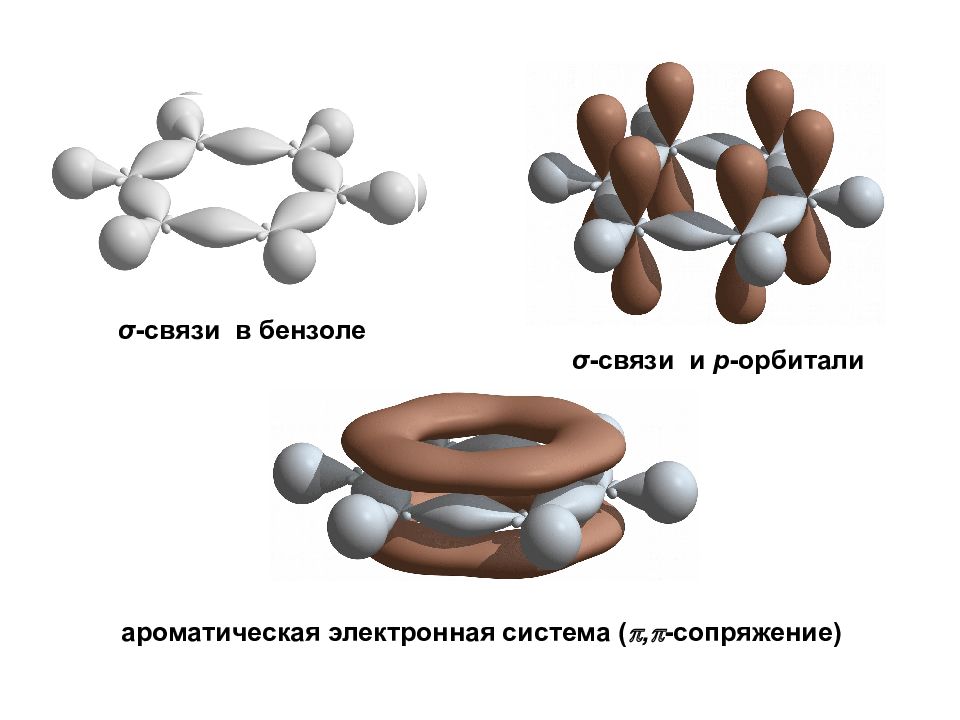
σ -связи в бензоле σ -связи и р -орбитали ароматическая электронная система ( , - сопряжение)
Слайд 19
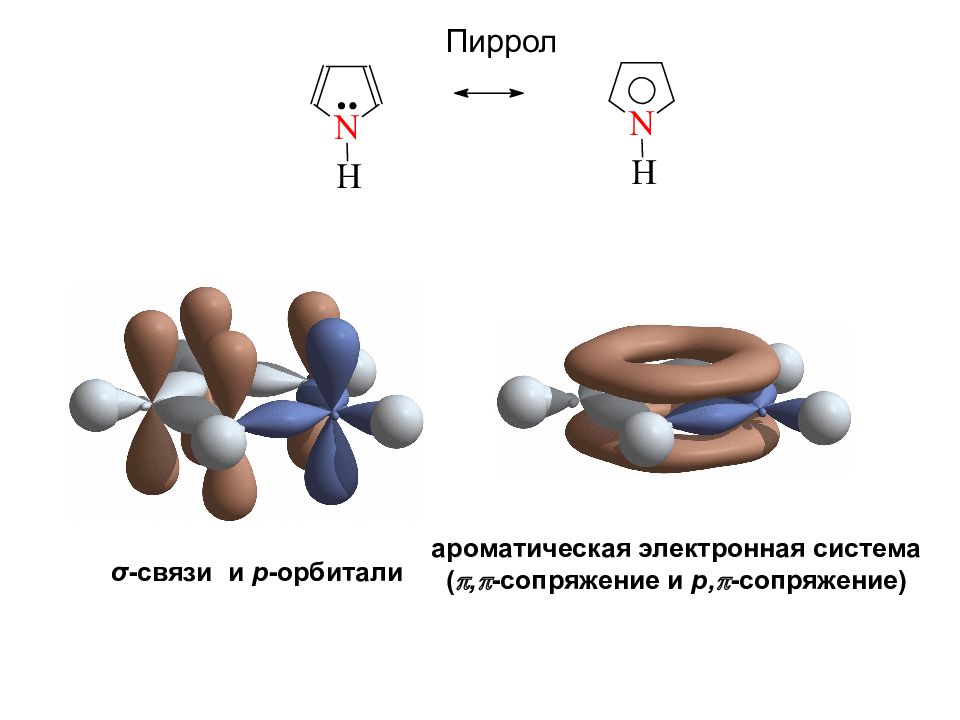
Пиррол σ -связи и р -орбитали ароматическая электронная система ( , - сопряжение и p, - cопряжение )
Слайд 20
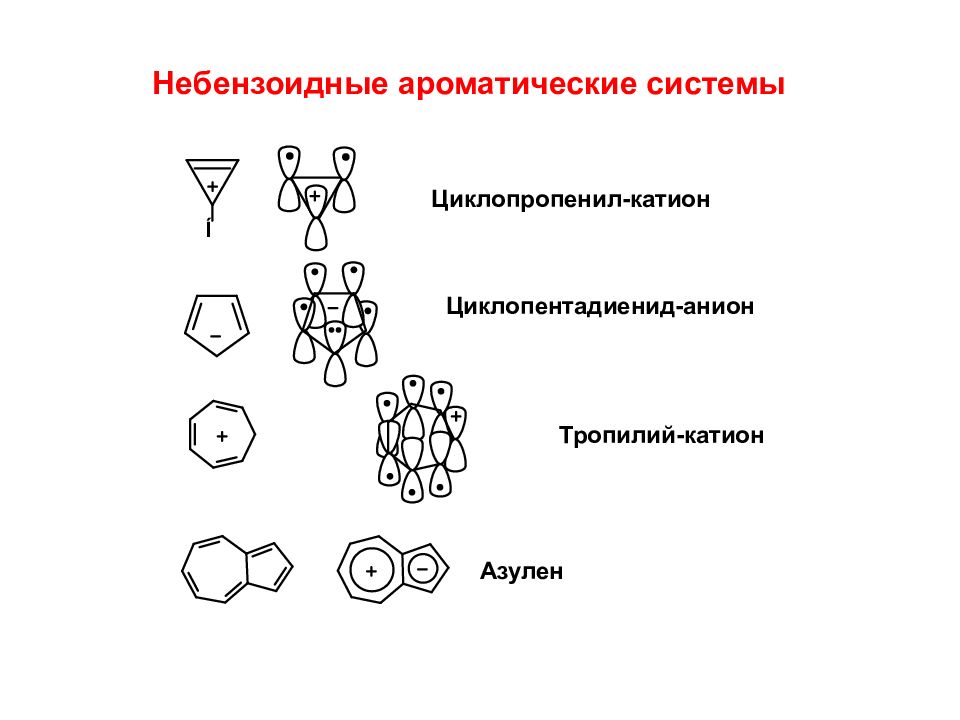
Небензоидные ароматические системы Циклопропенил -катион Циклопентадиенид -анион Тропилий -катион Азулен
Слайд 25
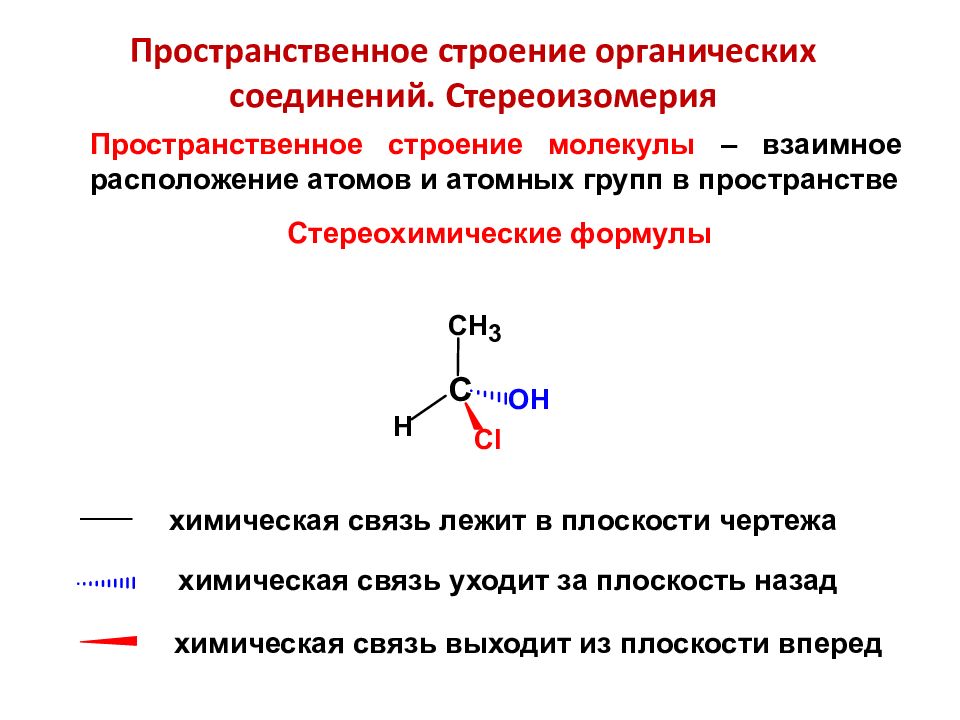
Пространственное строение органических соединений. Стереоизомерия Стереохимические формулы Пространственное строение молекулы – взаимное расположение атомов и атомных групп в пространстве химическая связь лежит в плоскости чертежа химическая связь уходит за плоскость назад химическая связь выходит из плоскости вперед
Слайд 26
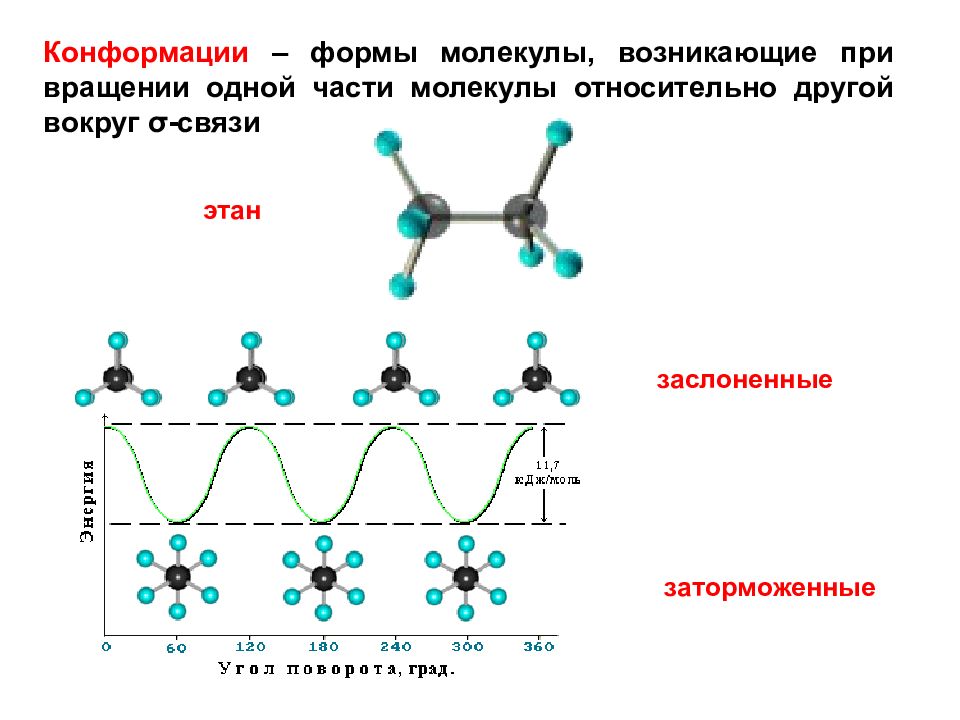
Конформации – формы молекулы, возникающие при вращении одной части молекулы относительно другой вокруг σ -связи этан заслоненные заторможенные
Слайд 27
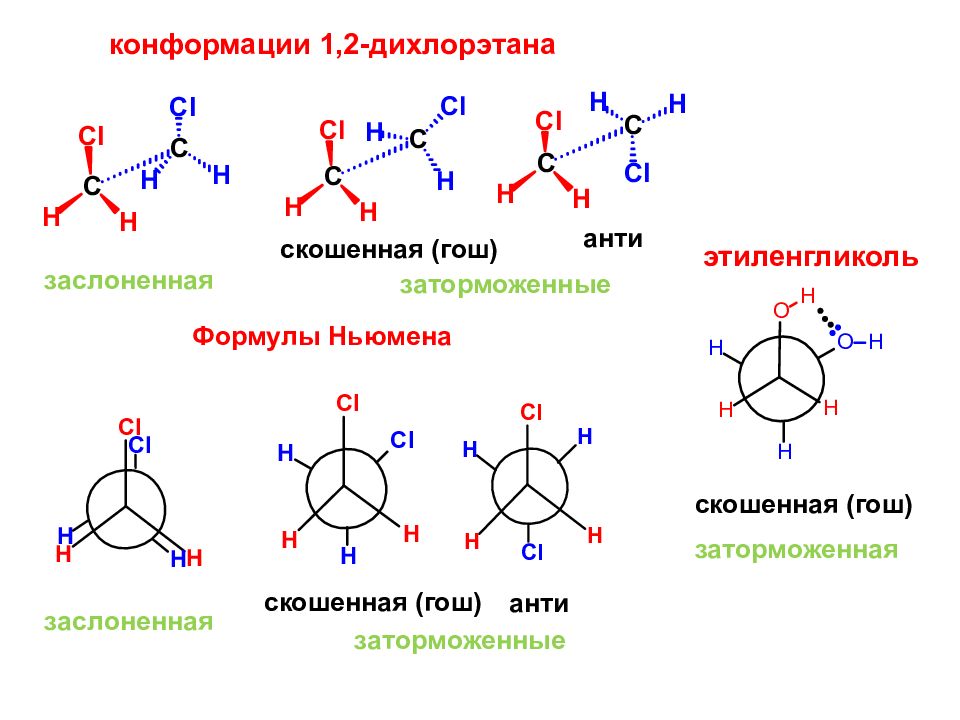
конформации 1,2-дихлорэтана заслоненная заторможенные скошенная ( гош ) анти Формулы Ньюмена заслоненная заторможенные скошенная ( гош ) анти скошенная ( гош ) заторможенная этиленгликоль
Слайд 28
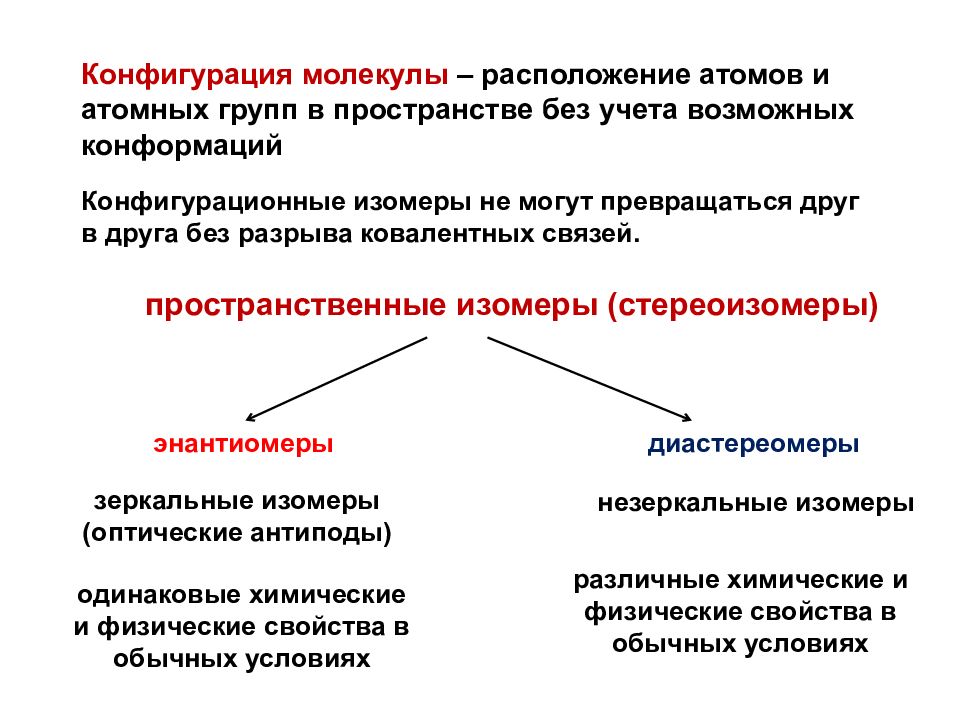
Конфигурация молекулы – расположение атомов и атомных групп в пространстве без учета возможных конформаций пространственные изомеры (стереоизомеры) энантиомеры диастереомеры зеркальные изомеры (оптические антиподы) незеркальные изомеры одинаковые химические и физические свойства в обычных условиях различные химические и физические свойства в обычных условиях Конфигурационные изомеры не могут превращаться друг в друга без разрыва ковалентных связей.
Слайд 30
Хиральность – свойство объекта не совпадать со своим зеркальным отражением Асимметрический атом углерода – атом углерода, связанный с четырьмя различными заместителями
Слайд 31
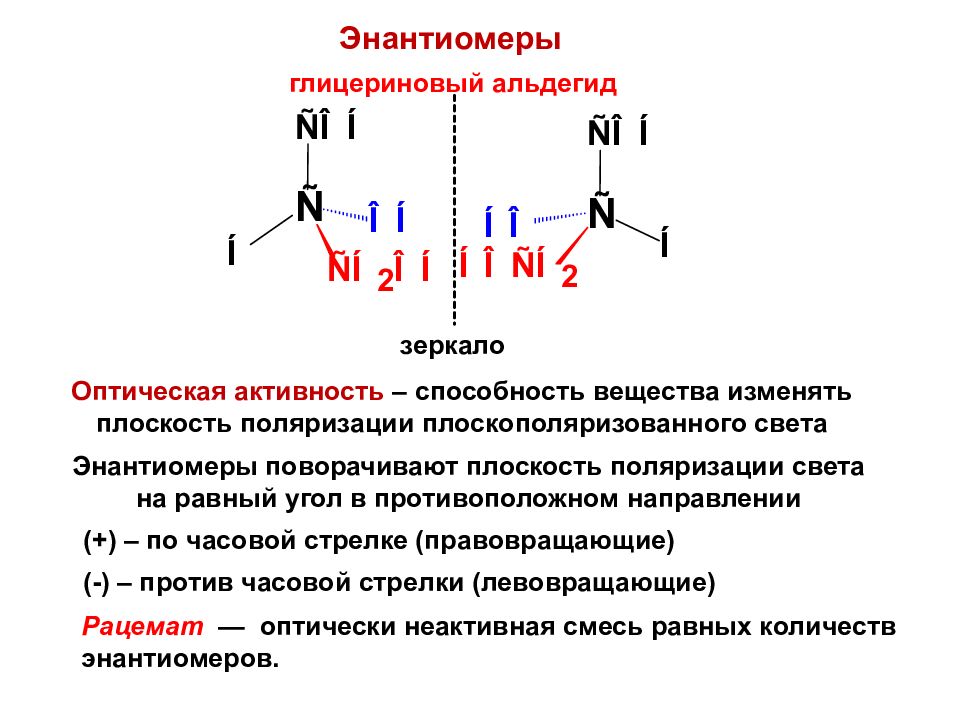
Энантиомеры глицериновый альдегид зеркало Оптическая активность – способность вещества изменять плоскость поляризации плоскополяризованного света Энантиомеры поворачивают плоскость поляризации света на равный угол в противоположном направлении (+) – по часовой стрелке (правовращающие) (-) – против часовой стрелки (левовращающие) Рацемат — оптически неактивная смесь равных количеств энантиомеров.
Слайд 32
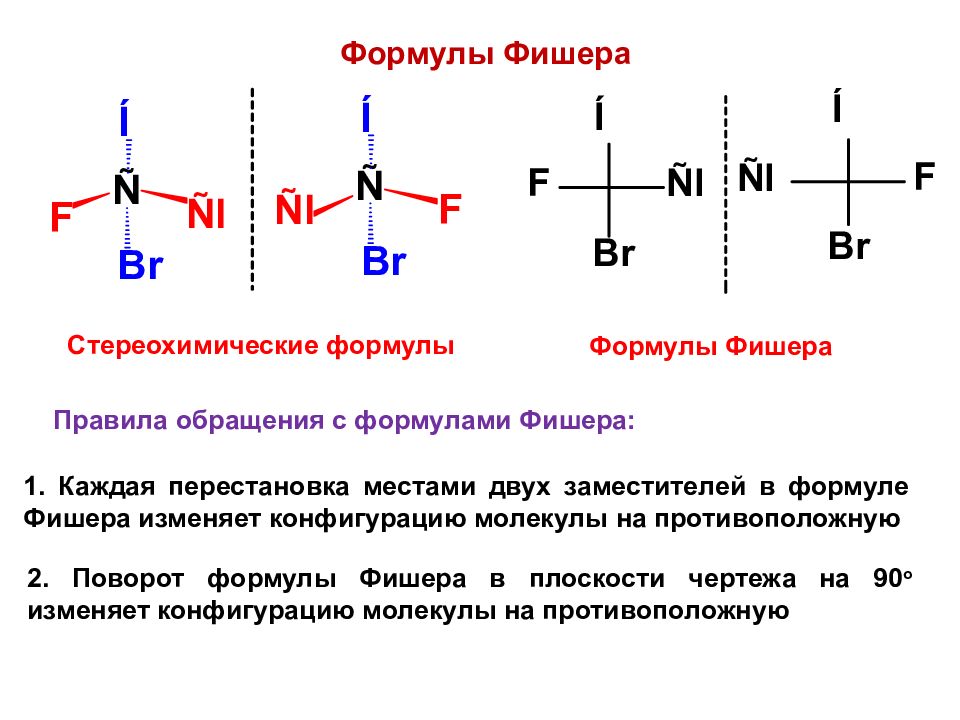
Формулы Фишера Стереохимические формулы Формулы Фишера Правила обращения с формулами Фишера: 1. Каждая перестановка местами двух заместителей в формуле Фишера изменяет конфигурацию молекулы на противоположную 2. Поворот формулы Фишера в плоскости чертежа на 90 о изменяет конфигурацию молекулы на противоположную
Слайд 33
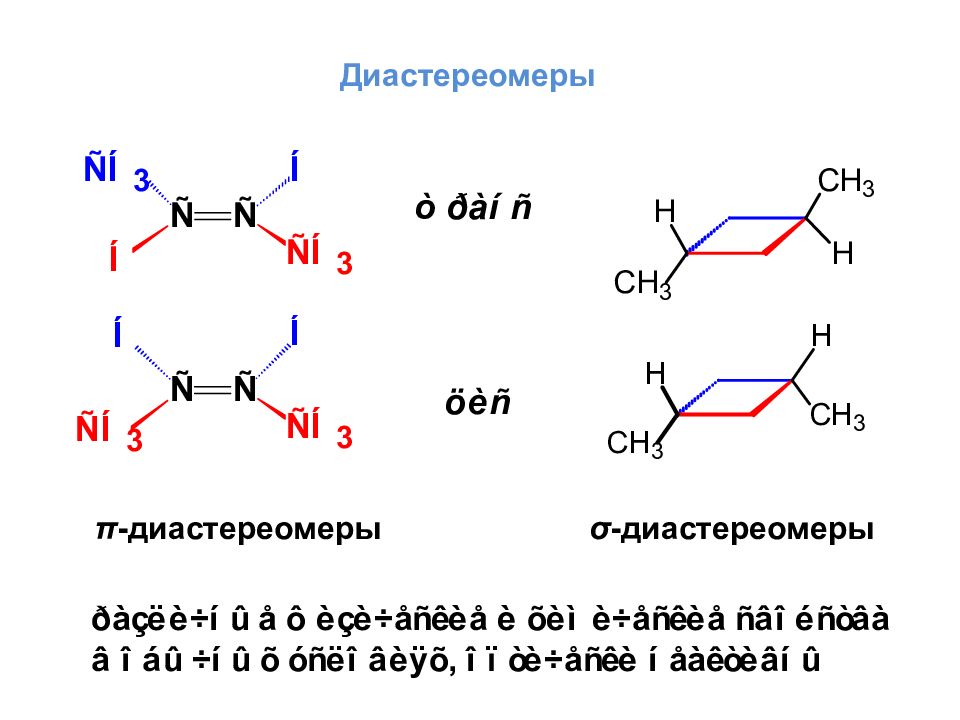
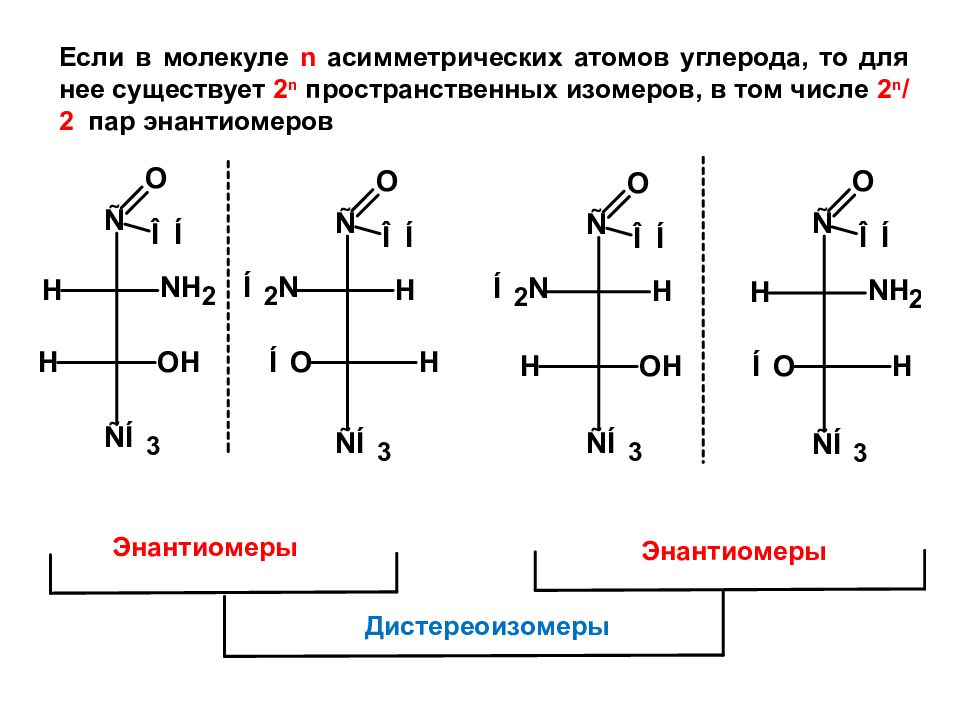
Если в молекуле n асимметрических атомов углерода, то для нее существует 2 n пространственных изомеров, в том числе 2 n /2 пар энантиомеров Энантиомеры Энантиомеры Дистереоизомеры
Слайд 34
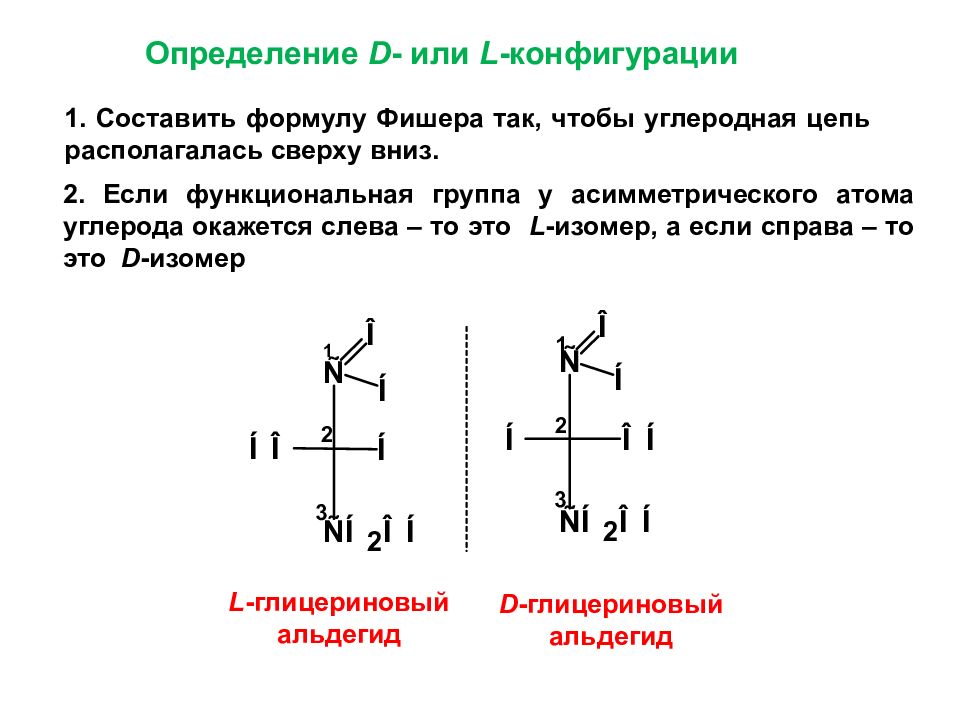
Определение D - или L -конфигурации 1. Составить формулу Фишера так, чтобы углеродная цепь располагалась сверху вниз. 2. Если функциональная группа у асимметрического атома углерода окажется слева – то это L -изомер, а если справа – то это D -изомер L - глицериновый альдегид D - глицериновый альдегид
Слайд 35
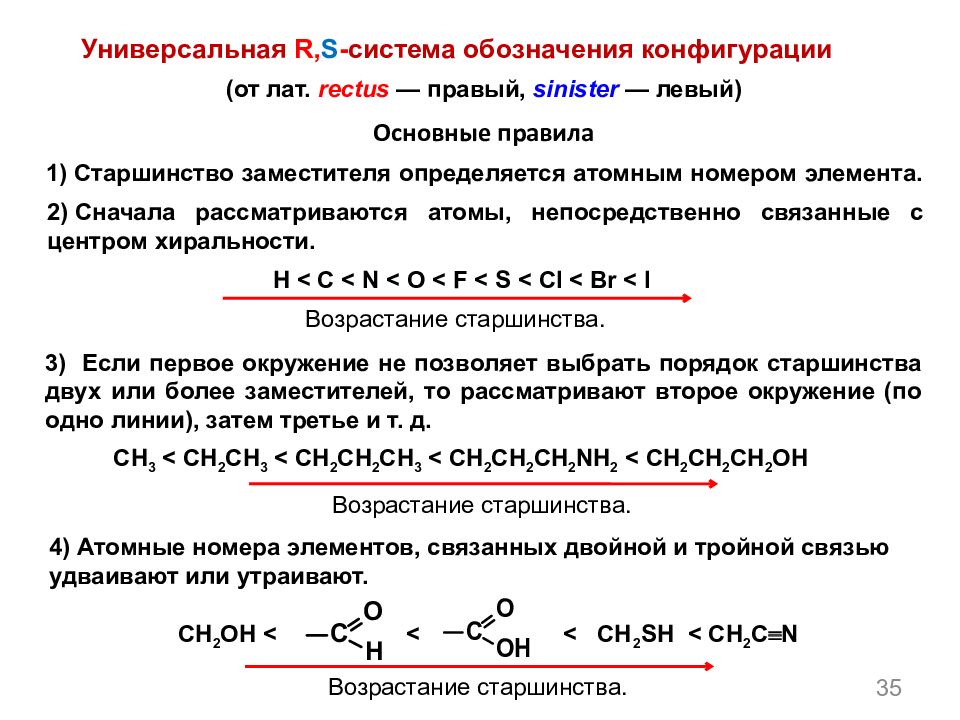
35 1) Старшинство заместителя определяется атомным номером элемента. Основные правила (от лат. rectus — правый, sinister — левый) Универсальная R, S - система обозначения конфигурации 2) Сначала рассматриваются атомы, непосредственно связанные с центром хиральности. 3) Если первое окружение не позволяет выбрать порядок старшинства двух или более заместителей, то рассматривают второе окружение (по одно линии), затем третье и т. д. 4) Атомные номера элементов, связанных двойной и тройной связью удваивают или утраивают. H < C < N < O < F < S < Cl < Br < I Возрастание старшинства. CH 3 < CH 2 CH 3 < CH 2 CH 2 CH 3 < CH 2 CH 2 CH 2 NH 2 < CH 2 CH 2 CH 2 OH Возрастание старшинства. CH 2 OH < < < CH 2 SH < CH 2 C N Возрастание старшинства.
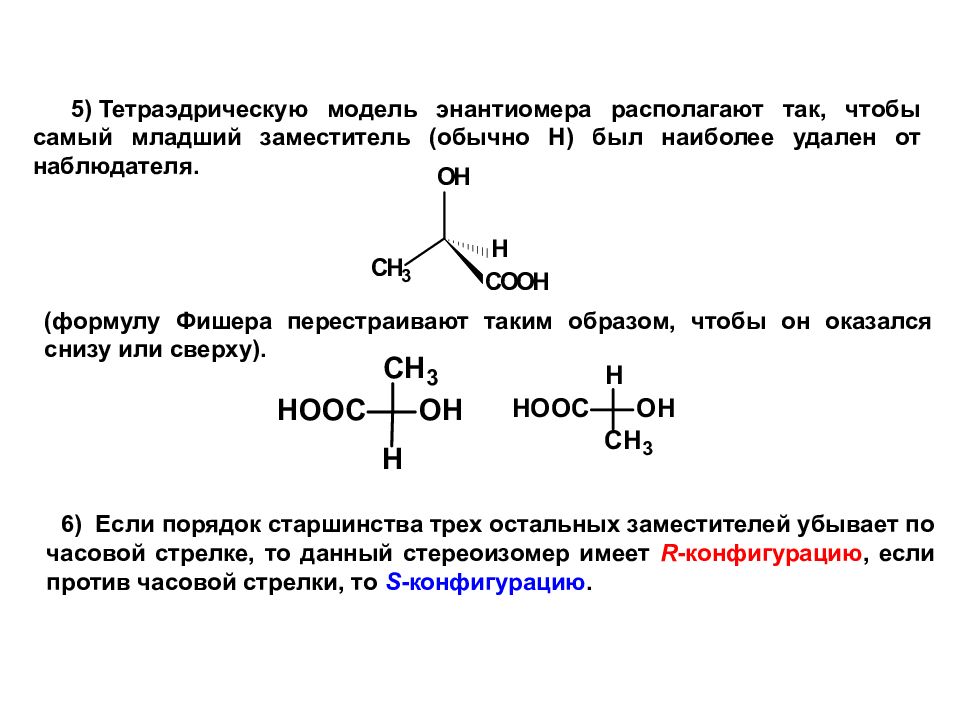
Слайд 36
5 ) Тетраэдрическую модель энантиомера располагают так, чтобы самый младший заместитель (обычно Н) был наиболее удален от наблюдателя. (формулу Фишера перестраивают таким образом, чтобы он оказался снизу или сверху). 6) Если порядок старшинства трех остальных заместителей убывает по часовой стрелке, то данный стереоизомер имеет R -конфигурацию, если против часовой стрелки, то S -конфигурацию.
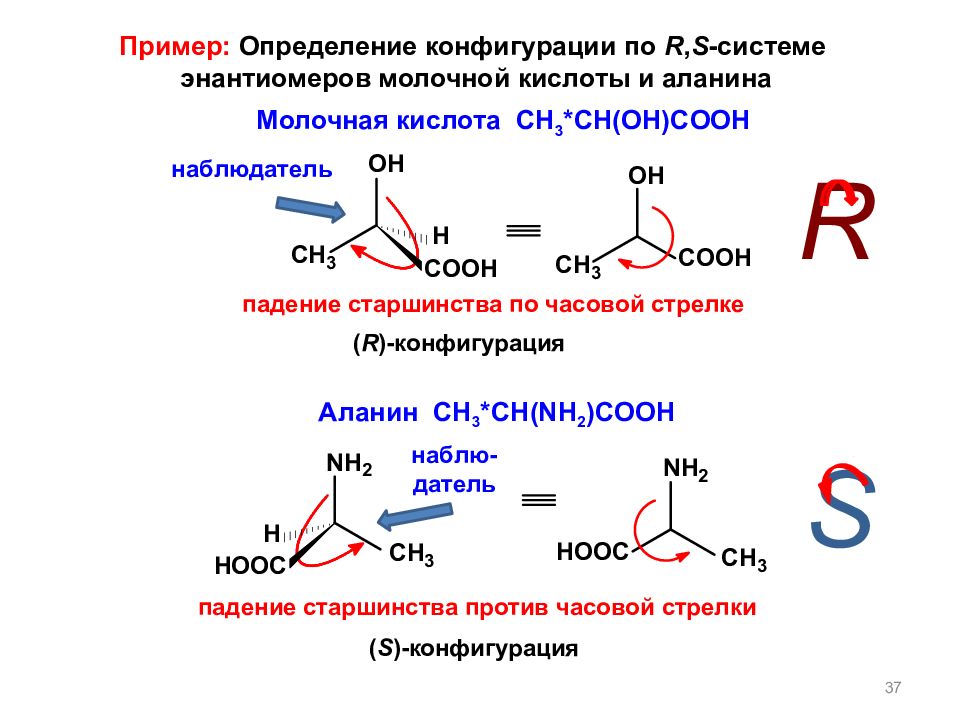
Слайд 37
37 ( R )- конфигурация Молочная кислота С H 3 *CH(OH)COOH Аланин С H 3 *CH(NH 2 )COOH ( S )- конфигурация наблюдатель н аблю - датель R S Пример: Определение конфигурации по R, S - системе энантиомеров молочной кислоты и аланина падение старшинства по часовой стрелке падение старшинства против часовой стрелки
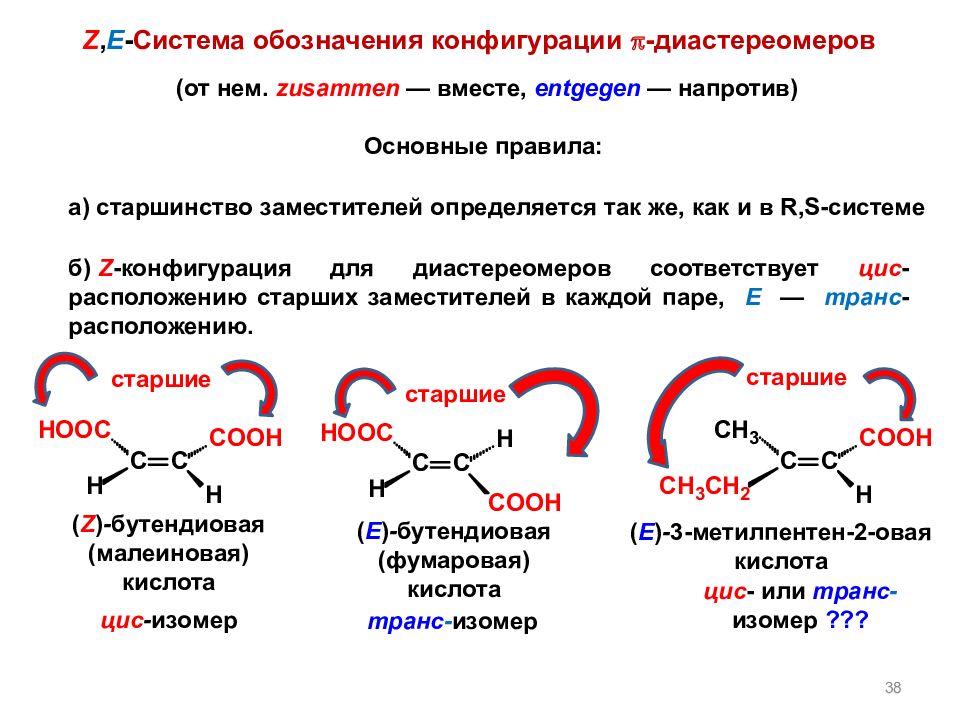
Слайд 38
38 (от нем. zusammen — вместе, entgegen — напротив) а ) старшинство заместителей определяется так же, как и в R,S -системе б ) Z -конфигурация для диастереомеров соответствует цис -расположению старших заместителей в каждой паре, E — транс -расположению. цис - или транс - изомер ??? старшие старшие старшие ( E ) - 3-метилпентен-2-овая кислота транс - изомер ( E ) - бутендиовая (фумаровая) кислота ( Z ) - бутендиовая (малеиновая) кислота цис - изомер Z, E - Система обозначения конфигурации - диастереомеров Основные правила:
Слайд 41
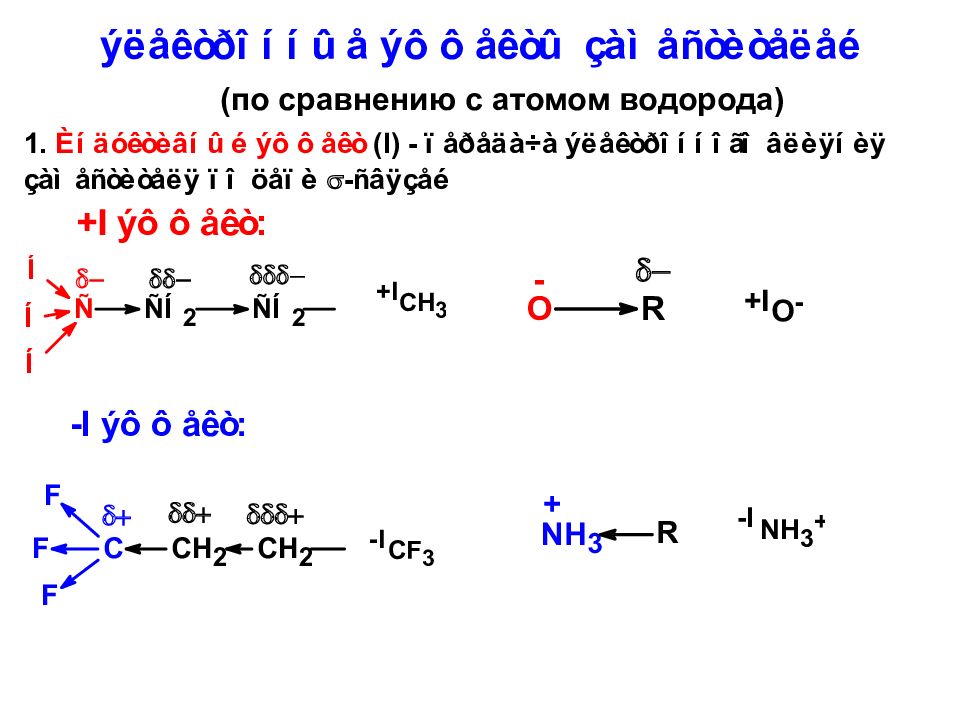
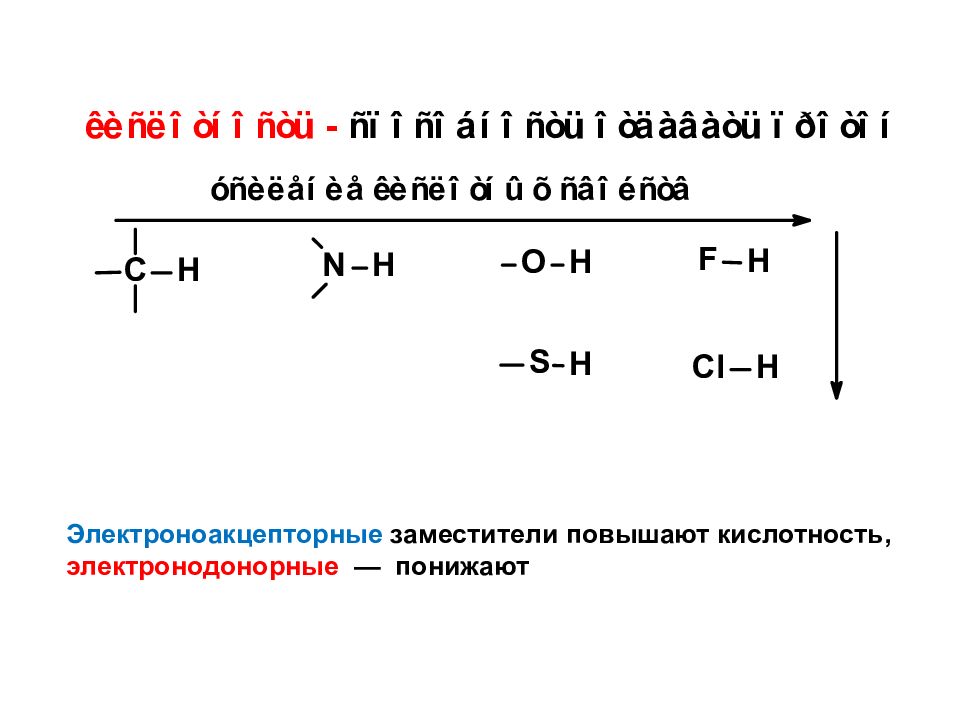
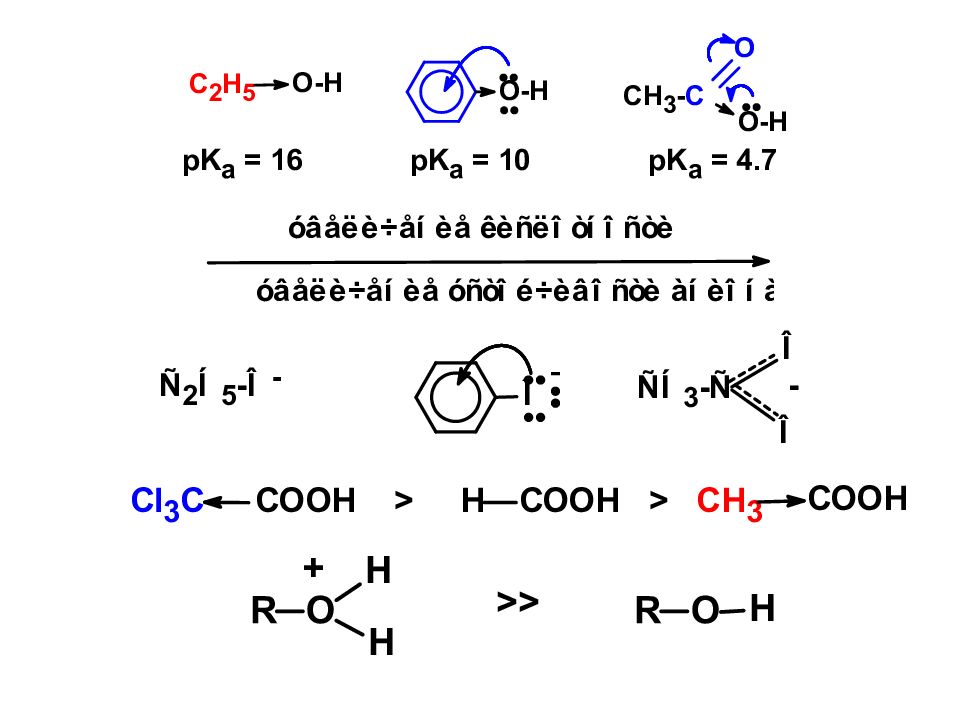
Электроноакцепторные заместители повышают кислотность, электронодонорные — понижают
Слайд 43
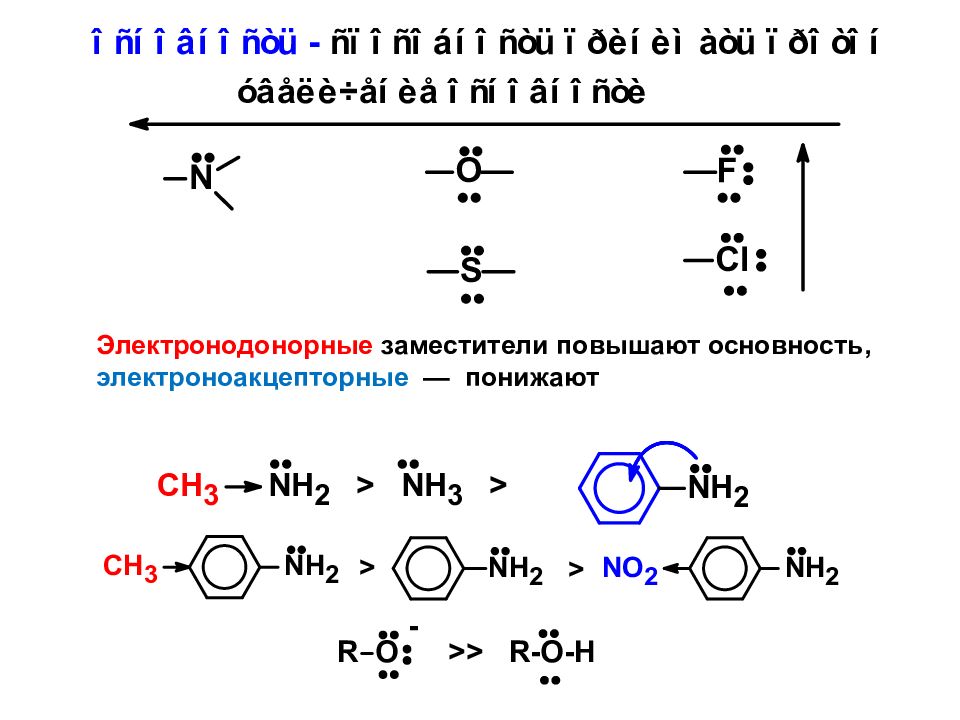
Электронодонорные заместители повышают основность, электроноакцепторные — понижают
Последний слайд презентации: Органическая и физическая химия РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
(перенос пары электронов) 40 Взаимодействие n - оснований Льюиса с кислотами Льюиса Кислоты n- Комплексы n - Основания Кислоты Льюиса — акцепторы пары электронов ─ частицы с вакантной орбиталью, способные дополнить свою электронную оболочку парой электронов : H +, Ag +, BF 3, AlCl 3, SO 3, R 3 C +. Основания Льюиса — доноры пары электронов ─ тождественны основаниям Брёнстеда ; пара электронов может быть неподеленной парой (n- основания) или принадлежать - связи ( - основания). Кислоты и основания по Льюису