Первый слайд презентации: ДВС синдром. ТЭЛА
Слайд 2: Определение
Синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром, коагулопатия потребления, дефибринация, тромбогемор-рагический синдром, внутрисосудистое микросвертывание и др.) называется динамический патологический процесс дезорганизации системы гемостаза, приводящий при спонтанном своем течении к тяжелому повреждению и гибели органов и тканей организма в результате либо необратимого тромбообразования и блокады микроциркуляторного русла, либо смертельного кровотечения.
Слайд 3
ДВС-синдром - (диссеминированное внутрисосудистое свёртывание, коагулопатия потребления, тромбогеморрагический синдром) — нарушенная свёртываемость крови по причине массивного освобождения из тканей тромбопластических веществ.
Слайд 4: Определение
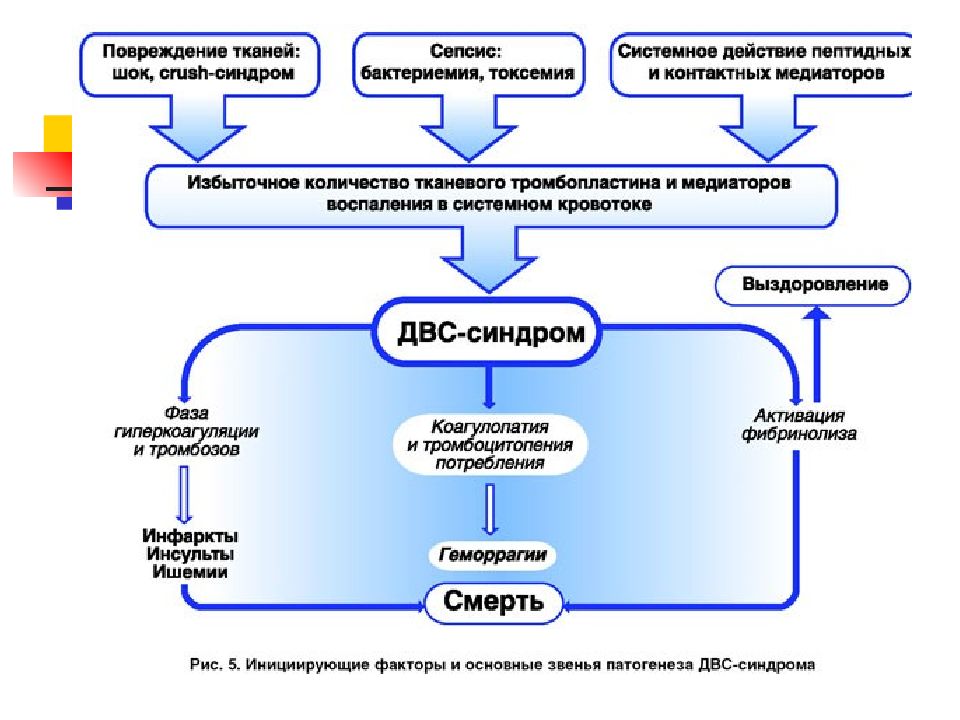
ДВС - синдром неспецифичен и универсален, поскольку возникает при самых разнообразных заболеваниях. В основе лежит интенсивная или длительная активация коагуляционного потенциала крови, которая приводит к истощению и срыву противосвертывающих механизмов, в первую очередь антитромбина III и протеина С. Вследствие этого происходит свертывание крови преимущественно в зоне микроциркуляции, активирование фибринолиза, системы моно- нуклеарных фагоцитов, калликреин-кининовой системы, изменением гемодинамики, рН крови.
Слайд 5: Причины ДВС-синдрома
ДВС-синдром складывается из признаков основной формы патологии, вызвавшей его развитие, а также из клинических и лабораторных проявлений самого синдрома. Первичная ранняя диагностика основана на выявлении тех воздействий и видов патологии, при которых развитие ДВС-синдрома неизбежно либо высоковероятно. К ним в первую очередь относятся все виды шока. Выраженность ДВС-синдрома обычно соответствует тяжести и длительности шокового состояния, глубине характерных для него циркуляторных расстройств.
Слайд 6: Причины ДВС-синдрома
Вторая частая причина возникновения ДВС-синдрома (около 50% всех случаев) — гнойно-септические процессы, бактериемии, септицемии. Об этих разновидностях ДВС-синдрома следует думать при развитии у больных тромбогеморрагий на фоне повышенной температуры тела, ознобов, потливости, признаков поражений органов инфекционного генеза (особенно с абсцедированием), в том числе и тяжелых форм кишечной токсикоинфекции (понос, рвота, дегидратация и др.) в сочетании с лейкоцитозом или лейкопенией со сдвигом лейкоцитарной формулы влево, токсигенной зернистостью лейкоцитов и нарушениями свертываемости крови.
Слайд 7: Причины ДВС-синдрома
К ДВС ведут все острые гемолитические анемии, в том числе обусловленные трансфузиями несовместимой по группам АВО или резус фактору крови, инфицированной крови и гемопрепаратов с истекшим сроком хранения. К развитию ДВС-синдрома ведут и анафилактические реакции на гемопрепараты, кровезаменители и лекарственные средства.
Слайд 8: Причины ДВС-синдрома
К развитию ДВС-синдрома ведут и чрезмерно массивные (по 5 л и более) трансфузии совместимой консервированной крови (так называемый синдром массивных трансфузий). ДВС-синдром развивается также при всех острых отравлениях, вызывающих шок, гемолиз и внутрисосудистое свертывание крови, в том числе при отравлениях ядами змей, содержащими коагулирующие кровь ферменты — токсины гадюковых и щитомордников.
Слайд 9: Причины ДВС-синдрома
В акушерской практике острый ДВС-синдром может возникнуть при предлежании и ранней отслойки плаценты, при раннем отхождении околоплодных вод, амниотической эмболии, внутриутробной гибели плода. ДВС-синдромом нередко осложняются деструктивные процессы в органах (инфаркт миокарда, мозговой инсульт, острая дистрофия печени, геморрагический и деструктивный панкреатит), ожоги кожи и химические ожоги пищевода и желудка.
Слайд 11: Действия тромбина и их результат:
• образование фибрина — снижение активности факторов I, II; • агрегация тромбоцитов — снижение количества тромбоцитов; • активация факторов V, VIII — снижение концентрации факторов V, VIII; • активация фактора ХIII — снижение концентрации фактора XIII; • активация системы протеина С/протеина S — снижение их концентрации; • активация фибринолитической системы.
Слайд 12: Действия плазмина и их результат:
• деградация фибрина — значительное повышение продуктов деградации фибрина; • деградация фибриногена — снижение концентрации фактора I; • протеолиз фактов V и VIII — снижение их содержания; • протеолиз фактора Виллебрандта, XIII, XI — снижение их содержания; • протеолиз фактора XIII — снижение его концентрации; • изменения в гликопротеидах тромбоцитарной мембраны.
Слайд 13
Образование тромбина на ранних стадиях ДВС способствует появлению больших растворимых комплексов фибрин- фибриноген и образованию фибриновых микротромбов, вызывающих обструкцию микроциркуляторного русла и ПОН. При замедленном течении крови через разветвления мелких сосудов происходит её «расслоение» на плазму и эритроциты, заполняющие разные капилляры. Без плазмы эритроциты теряют способность к передвижению и скапливаются в виде медленно циркулирующих, а затем нециркулирующих образований. Затем происходит их стаз, агрегация, лизис и высвобождение кровяного тромбопластина. Поступление в кровоток тромбопластина запускает процесс внутрисосудистого свёртывания крови. Выпадающие при этом нити фибрина опутывают глыбки эритроцитов, образуя «сладжи» — комочки, оседающие в капиллярах и ещё больше нарушающие однородность структуры крови.
Слайд 14: Клиническая картина ДВС синдрома
Основные клинические проявления ДВС-синдрома — тромбозы, приводящие к нарушению микроциркуляции и возникновению ПОН и геморрагического синдрома. ДВС-синдром характеризуется стадийностью развития. Стадии (фазы) ДВС-синдрома: • I стадия — гиперкоагуляция; • II стадия — коагулопатия потребления; • III стадия — гипокоагуляция.
Слайд 15
В течении ДВС-синдрома выделяют несколько фаз : Фаза гиперкоагуляции и гиперагрегации тромбоцитов Переходная фаза – наблюдается тенденция к гипокоагуляции по одним тестам и гиперкоагуляция по другим Фаза гипокоагуляции и активация фибрнолиза (геморрагическая фаза) Восстановительная фаза (при неблагоприятном течении – фаза тяжелых осложнений и летального исхода)
Слайд 16: Фазы ДВС-синдрома
: I фаза — гиперкоагуляция. Потеря факторов свертывающей системы в процессе обильного кровотечения приводит к удлинению времени образования сгустка и его ретракции, удлинению времени капиллярного кровотечения. Лабораторные показатели: уменьшение времени свертывания крови, тромбинового времени, положительный этаноловый тест.
Слайд 17
II фаза — гипокоагуляция. При геморрагическом шоке в фазе спазма венул и артериол (клинические проявления: дегидратация, бледные и холодные кожные покровы, признаки острой почечной недостаточности) в капиллярах развивается расслоение плазмы и форменных элементов — “ сладж ”-феномен. Агрегация форменных элементов, обволакивание их фибрином сопровождаются потреблением факторов свертывания крови и активацией фибринолиза. Лабораторные показатели: умеренная тромбоцитопения (до 120 × 109/л), тромбиновое время 60 с и больше, резко положительный этаноловый тест.
Слайд 18
III фаза — потребления с активацией местного фибринолиза. Афибриногенемия в сочетании с выраженной активацией фибринолиза. При этой фазе рыхлые сгустки крови в месте кровотечения быстро (в течение 15-20 мин) лизируются на 50 %. Лабораторные показатели: увеличение времени свертывания крови, тромбинового времени, уменьшение тромбоцитов до 100 × 109/л, быстрый лизис сгустка.
Слайд 19
IV фаза — генерализованный фибринолиз. Капиллярная кровь не свертывается, отмечаются паренхиматозное кровотечение, петехиальные высыпания на коже и внутренних органах, гематурия, выпот в синовиальные полости и терминальные изменения в органах и системах.
Слайд 20: Клиническая картина ДВС синдрома
ДВС-синдром классифицируется не только по стадийности (фазности) развития, но и по скорости развития геморрагических проявлений. Различают следующие формы ДВС-синдрома: молниеносная, острая, подострая и хроническая.
Слайд 21: Клиническая картина ДВС синдрома
Молниеносная форма чаще всего встречается при такой патологии, как ТЭЛА, эмболия ОВ, тромбоз брыжеечной артерии. Острая форма развивается при шоке любого происхождения, массивной кровопотере и стремительных травматичных родах, эмболии ОВ, эклампсии, разрыве матки. Подострая форма непродолжительная (несколько часов или минут). Она либо переходит в хроническую, либо реализуется в острую форму. Для подострой формы ДВС-синдрома характерно наличие высокой АГ (180/120 мм рт.ст. и выше), олигурии или анурии, геморрагий (петехии), неврологических проявлений (головная боль, нарушение зрения, боли в эпигастральной области) и болей в правом подреберье в результате напряжения капсулы печени.
Слайд 22: Нарушение микроциркуляции в органах с их дисфункцией и дистрофией
Чрезвычайно часто таким органом являются легкие, в сосуды которых из венозной системы заносится огромное количество микросгустков фибрина, агрегатов клеток крови и продуктов протеолиза. В результате развивается острая легочно-циркуляторная недостаточность - одышка, цианоз, снижение насыщения крови кислородом, а затем повышение углекислого газа в артериальной крови; появляются интерстициальный отек, инфаркты легкого часто с развитием респираторного дистресс-синдрома.
Слайд 23: Острая почечная недостаточность
Второе место по частоте органное поражение при ДВС-синдроме. Она проявляется в виде снижения количества выделяемой мочи вплоть до полной анурии (отсутствия мочеотделения), выделением с мочой белка, эритроцитов. При этом нарушается водно-электролитный баланс, а также кислотно-основное равновесие в организме, в сыворотке крови отмечается нарастание уровня креатинина, а впоследствии -остаточного азота и мочевины. В целом данный синдром не отличается от других видов острой почечной недостаточности.
Слайд 24: Главные клинические проявления ДВС синдрома
• тромботические явления; • геморрагический синдром; • микроциркуляторные нарушения; • ПОН; • анемия; • нестабильная гемодинамика; • шок и формирование шоковых органов.
Слайд 25: Диагностика ДВС синдрома
Лабораторные исследования Стадия гиперкоагуляции: • время свёртывания крови ↓; • АЧТВ ↓; • Ht ↑ (40 и ≥); • фибриноген ↑; • время рекальцификации плазмы ↑ (более 45”); • тромбиновое время ↑ (более 10”); • АЧТВ ↓ (менее 45”); • ±продукты деградации фибрина (более 10 мг%); • ±растворимые комплексы мономеров фибрина; • ± тесты: этаноловый, протаминсульфатный.
Слайд 26: Диагностика ДВС синдрома
Лабораторные исследования Стадия коагулопатии потребления: • тромбоциты↓; • фибриноген ↓; • антитромбин III ↓; • гипопротеинемия, гипоальбуминемия; • продукты деградации фибрина ↑; • АЧТВ ↑ (≥65”); • время рекальцификации плазмы ↑; • протромбиновое и тромбиновое время ↑; • время свёртывания крови, время кровотечения и Ht могут оставаться либо укороченными, либо в пределах верхней или нижней границы нормы.
Слайд 27: Диагностика ДВС синдрома
Лабораторные исследования Стадия гипокоагуляции: • время кровотечения↑, время свертывания крови ↑; • ↑фибринолитической активности и протеолиза; • фибриноген ↓; • Hb ↓, Ht ↓; • эритроциты ↓; • плазменные факторы IV, VIII, I, II, V, XIII ↓; • активность антитромбина III ↓; • плазминоген ↓; • повышенная кровоточивость, отсутствие сгустков или быстрое их растворение.
Слайд 28: Диагностика
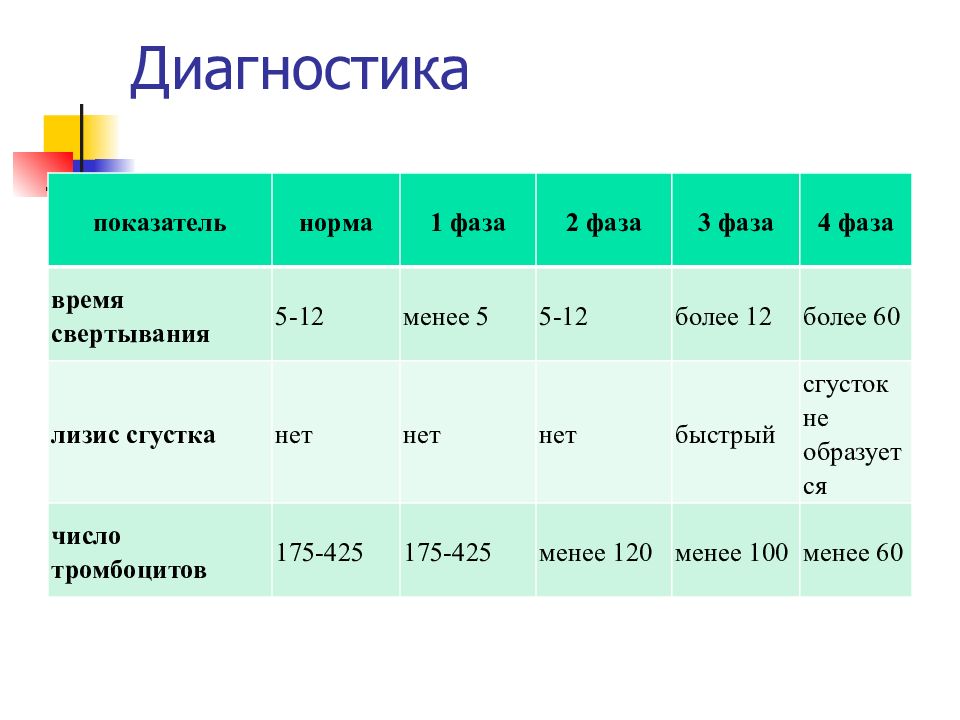
показатель норма 1 фаза 2 фаза 3 фаза 4 фаза время свертывания 5-12 менее 5 5-12 более 12 более 60 лизис сгустка нет нет нет быстрый сгусток не образуется число тромбоцитов 175-425 175-425 менее 120 менее 100 менее 60
Слайд 29: Лечение ДВС-синдрома:
Летальность при острых формах составляет 30%. В первую очередь при лечении синдрома диссеминированного внутрисосудистого свертывания ведется интенсивная борьба с патологическими процессами, вызывающими и усугубляющими ДВС-синдром.
Слайд 30: Лечение ДВС-синдрома:
Динамический контроль за содержанием тромбоцитов в крови приобретает при ДВС-синдроме, в том числе и в процессе его лечения гепарином, исключительно важное значение. Гепарин часто неэффективен из-за позднего его назначения в период, когда образование фибрина и агрегация тромбоцитов с их отложением в микроциркуляторном русле в основном уже завершились, а также вследствие значительного дефицита антитромбина III и высокого содержания в крови белков острой фазы, блокирующих гепарин, либо из-за образования аномальных форм тромбина.
Слайд 31: Лечение ДВС-синдрома:
При гепаринотерапии следует придерживаться следующих основных правил. Нужно применять гепарин возможно раньше – в фазе гиперкоагуляции в дозах 20 000-40 000 ЕД/сут, а во второй (переходной) фазе - в дозах, не превышающих 20 000 ЕД/сут. В эти периоды гепарин используется для «прикрытия» базисной терапии свежезамороженной плазмой. В стадии гипокоагуляции и кровотечений гепарин используют лишь в малых дозах для «прикрытия» трансфузионной терапии (по 2500 ЕД перед переливаниями крови и плазмы). В несколько больших дозах его можно применять в сочетании с контрикалом и другими антипротеазами.
Слайд 32: Лечение ДВС-синдрома:
Если ДВС-синдром вызван сильными кровотечениями, в лечение включают антиферменты (контрикал, гордокс). При развитии третьей стадии синдрома диссеминированного внутрисосудистого свертывания, при присоединении к данному патологическому состоянию обильных кровотечений, несвертываемости крови, выраженной гипокоагуляции, а также если клиническая картина осложняется кровотечениями из язв желудочно-кишечного тракта (кровавая рвота, дегтеобразный стул), сильными маточными кровотечениями, гепарин категорически противопоказан.
Слайд 33: Лечение ДВС-синдрома:
Трансфузионная терапия составляет основу лечения синдрома диссеминированного внутрисосудистого свертывания, что обеспечивает коррекцию нарушений гемостаза; возмещение объема жидкости в циркуляции и восстановление центрального венозного давления, нарушенных вследствие шока и (или) кровопотери; замещение клеток крови -эритроцитов и тромбоцитов. Некоторые из вышеуказанных целей достигаются массивными переливаниями плазмы, содержащей все компоненты системы свертывания крови и других плазменных ферментных систем и обладающей антипротеазной активностью, в том числе и большим количеством антитромбина III.
Слайд 35: Тромбоэмболия легочной артерии (ТЭЛА)
внезапная закупорка ветвей или ствола легочной артерии тромбом (эмболом), образовавшимся в правом желудочке или предсердии сердца, венозном русле большого круга кровообращения и принесенным с током крови. В результате ТЭЛА прекращается кровоток по легочной артерии. Развитие ТЭЛА происходит часто стремительно и может привести к гибели больного. От ТЭЛА умирает 0,1% населения земного шара ежегодно. Среди причин смерти населения от сердечно-сосудистой заболеваний ТЭЛА стоит на третьем месте.
Слайд 36: Причины развития ТЭЛА
Наиболее частыми причинами развития ТЭЛА служат: тромбоз глубоких вен (ТГВ) голени (в 70 – 90% случаев), часто сопровождающийся тромбофлебитом. Может иметь место тромбоз одновременно глубоких и поверхностных вен голени тромбоз нижней полой вены и ее притоков сердечно-сосудистые заболевания, предрасполагающие к появлению тромбов и эмболий в легочной артерии (ИБС, активная фаза ревматизма с наличием митрального стеноза и мерцательной аритмии, гипертоническая болезнь, инфекционный эндокардит, кардиомиопатии и неревматические миокардиты )
Слайд 37: Причины развития ТЭЛА
септический генерализованный процесс онкологические заболевания (чаще рак поджелудочной железы, желудка, легких ) тромбофилия (повышенное внутрисосудистое тромбообразование при нарушении системы регуляции гемостаза) антифосфолипидный синдром — образование антител к фосфолипидам тромбоцитов, клеток эндотелия и нервной ткани (аутоиммунные реакции); проявляется повышенной склонностью к тромбозам различных локализаций.
Слайд 38: Факторы риска тромбозов вен и ТЭЛА - это:
длительное состояние обездвиженности (постельный режим, частые и продолжительные авиаперелеты, поездки, парез конечностей), прием большого количества диуретиков (массовая потеря воды приводит к дегидратации, повышению гематокрита и вязкости крови); злокачественные новообразования
Слайд 39: Факторы риска тромбозов вен и ТЭЛА - это:
длительный прием некоторых лекарственных препаратов (оральные контрацептивы, заместительная гормональная терапия) повышает свертываемость крови; варикозная болезнь (при варикозном расширении вен нижних конечностей создаются условия для застоя венозной крови и образования тромбов); нарушения обмена веществ, гемостаза (гиперлипидпротеинемия, ожирение, сахарный диабет, тромбофилия); хирургические операции и внутрисосудистые инвазивные процедуры (например, центральный катетер в крупной вене);
Слайд 40: Классификация ТЭЛА по объему поражения легочных артерий ( ESC, 2000)
Объем поражения Признаки Массивная ТЭЛА (обструкция > 50% сосудистого русла легких) Явления шока или гипотонии – относительное снижение артериального давления на 40 мм рт. ст. в течение 15 минут и более, не связанное с развитие аритмии, гиповолемии, сепсиса. Кроме того, характерны одышка, диффузный цианоз, возможны обмороки. Субмассивная ТЭЛА (обструкция < 50% сосудистого русла легких) Явления правожелудочковой недостаточности, подтвержденные Эхо КГ. Артериальной гипотензии нет. Немассивная ТЭЛА Гемодинамика стабильна, признаков правожелудочковой недостаточности клинически и при Эхо КГ нет.
Слайд 41: Классификация ТЭЛА по варианту течения
Вариант течения Признаки Молниеносное (14%), острое (12,8%) Внезапное начало, боль за грудиной, одышка падение АД, признаки острого легочного сердца. Подострое (31,4%) Прогрессирующая дыхательная и правожелудочковая недостаточность, признаки инфарктной пневмонии, кровохарканье. Рецидивирующее (41,8%) Повторные эпизоды одышки, обмороки, признаки пневмонии.
Слайд 42: Сроки развития
Что касается сроков развития заболевания, молниеносная форма развивается в течение нескольких минут и часов. Острой ТЭЛА считается на протяжении 3 суток, подострой – в течение 30 суток с момента эпизода эмболии. Хроническая посттромбоэмболическая легочная гипертензия развивается по прошествии 1 месяца от эмболического поражения легочных артерий.
Слайд 43: Диагностика ТЭЛА
В диагностике ТЭЛА главная задача – установить местонахождение тромбов в легочных сосудах, оценить степень поражения и выраженность нарушений гемодинамики, выявить источник тромбоэмболии для предупреждения рецидивов. Сложность диагностики ТЭЛА диктует необходимость нахождения таких пациентов в специально оборудованных сосудистых отделениях, владеющих максимально широкими возможностями для проведения специальных исследований и лечения.
Слайд 44: Всем пациентам с подозрением на ТЭЛА проводят следующие обследования:
тщательный сбор анамнеза, оценку факторов риска ТГВ/ТЭЛА и клинической симптоматики общий и биохимический анализы крови, мочи, исследование газового состава крови, коагулограмму и исследование Д-димера в плазме крови (метод диагностики венозных тромбов) ЭКГ в динамике (для исключения инфаркта миокарда, перикардита, сердечной недостаточности) рентгенографию легких (для исключения пневмоторакса, первичной пневмонии, опухолей, переломов ребер, плеврита)
Слайд 45: Всем пациентам с подозрением на ТЭЛА проводят следующие обследования:
эхокардиографию (для выявления повышенного давления в легочной артерии, перегрузок правых отделов сердца, тромбов в полостях сердца) сцинтиграфию легких (нарушение перфузии крови через легочную ткань говорит об уменьшении или отсутствии кровотока вследствие ТЭЛА) ангиопульмонографию (для точного определения локализации и размеров тромба) УЗДГ вен нижних конечностей, контрастную флебографию (для выявления источника тромбоэмболии)
Слайд 46: Лечение ТЭЛА
Приблизительно 10% пациентов погибает в первые часы и сутки после эпизода массивной ТЭЛА, в течение года умирает порядка 25% и в течение 3 лет – уже 35% больных. Успех лечения острой массивной ТЭЛА зависит от решения таких задач, как: устранение угрозы гибели больного от острой сердечно-легочной недостаточности; нормализация (улучшение) перфузии легких и предотвращение тяжелой хронической постэмболической легочной гипертензии; профилактика рецидива тромбоэмболии легочной артерии.
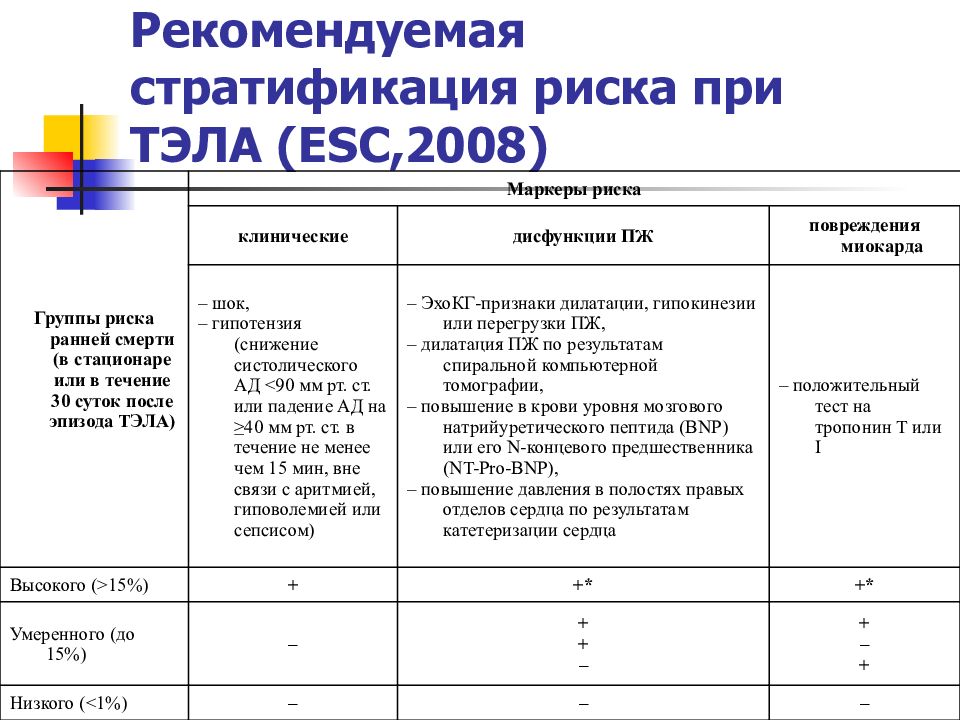
Слайд 47: Рекомендуемая стратификация риска при ТЭЛА (ESC,2008)
Группы риска ранней смерти (в стационаре или в течение 30 суток после эпизода ТЭЛА) Маркеры риска клинические дисфункции ПЖ повреждения миокарда – шок, – гипотензия (снижение систолического АД <90 мм рт. ст. или падение АД на ≥40 мм рт. ст. в течение не менее чем 15 мин, вне связи с аритмией, гиповолемией или сепсисом) – ЭхоКГ-признаки дилатации, гипокинезии или перегрузки ПЖ, – дилатация ПЖ по результатам спиральной компьютерной томографии, – повышение в крови уровня мозгового натрийуретического пептида (BNP) или его N-концевого предшественника (NT-Pro-BNP), – повышение давления в полостях правых отделов сердца по результатам катетеризации сердца – положительный тест на тропонин Т или I Высокого (>15%) + +* +* Умеренного (до 15%) – + + – + – + Низкого (<1%) – – –
Слайд 48: Лечение ТЭЛА
Согласно рекомендациям ESC стратегия лечения существенно зависит от степени риска ранней смерти и включает: антикоагулянтную терапию нефракционированным гепарином; вазопрессивные препараты для устранения системной гипотензии и профилактики дальнейшего прогрессирования правожелудочковой недостаточности; у пациентов с низким сердечным выбросом и нормальным АД могут быть использованы добутамин и допамин; оксигенотерапию ; тромболитическую терапию (ТЛТ) у пациентов высокого риска, сопровождающейся кардиогенным шоком и/или артериальной гипотензией; хирургическую эмболэктомию или чрескожную катетерную эмболэктомию или фрагментацию тромбоэмбола если тромболизис абсолютно противопоказан или оказался неэффективным.
Слайд 49: Схемы применения
Начинают с внутривенного болюсного введения нефракционированного гепарина в дозе 80 ЕД/кг, затем переходят на постоянную внутривенную инфузию со скоростью 18 ЕД/кг/ч. В дальнейшем дозу НФГ подбирают с учетом АЧТВ, которое должно быстро увеличиться – в 1,5-2,5 раза по сравнению с контролем – и поддерживаться на этом уровне.
Слайд 50: Также используются различные схемы подкожного введения антикоагулятнов:
Далтепарин Подкожно 100 МЕ/кг 2 раза в сутки. Подкожно 200 МЕ/кг (максимально 18 000 ME ) 1 раз в сутки. Надропарин Подкожно 86 МЕ/кг 2 раза в сутки. Подкожно 172 МЕ/кг (максимально 17 100 ME ) 1 раз в сутки. Эноксапарин Подкожно 100 ME (1 мг)/кг 2 раза в сутки. Подкожно 150 ME (1,5 мг)/кг 1 раз в сутки. Фондапаринукс Подкожно 5 мг 1 раз в сутки при массе тела 50 кг; 7,5 мг 1 раз в сутки при массе тела 50-100 кг; 10 мг 1 раз в сутки при массе тела более 100 кг.
Слайд 51: Тромболитическая терапия
Тромболитическая терапия приводит к быстрому восстановлению кровотока в пораженном сосуде и оказывает благоприятное влияние на показатели гемодинамики. Применение тромболитических препаратов хорошо зарекомендовало себя при лечении острого эпизода легочной тромбоэмболии, когда с момента появления первых симптомов до начала терапии прошло менее 2 недель. В настоящее время в клинической практике при лечении ТЭЛА используют две группы тромболитических препаратов : I – не обладающие сродством к фибрину (стрептокиназа, урокиназа, анизоилированный плазминоген–стрептокиназный активаторный комплекс), создающие системный фибринолиз; II – обладающие сродством к фибрину тромба (тканевой активатор плазминогена, альтеплаза, проурокиназа), которые «работают» только на тромбе, за счет наличия Sh радикала, афинного к фибрину.
Слайд 52: Оперативное лечение
Рентгено-эндоваскулярные методы. Эндоваскулярная механическая дезобструкция легочной артерии применяется как самостоятельный метод, так и в дополнение к тромболитической терапии. Помимо гемодинамической разгрузки правых отделов сердца при массивной ТЭЛА, фрагментация эмбола может существенно повысить эффективность тромболизиса вследствие увеличения суммарной площади поверхности получающихся фрагментов.
Слайд 53: Оперативное лечение
Продолжают совершенствоваться методы фрагментации и дисперсии тромбов с помощью обычных сердечных катетеров или специально разработанных ротационных или других устройств. Предложено несколько концепций подобных эндоваскулярных вмешательств, включая: фрагментацию и катетерную аспирацию эмбола с помощью стандартного диагностического или баллонного катетера; ротационную дезобструкцию легочной артерии с помощью модернизированного катетера pigtail, предложенного Schmitz-Rode.
Слайд 54: Простая фрагментация тромбоэмбола
возможна только при «мягком» тромбоэмболе и в значительном проценте случаев приводит к окклюзии дистального легочного артериального русла. Неадекватное восстановление проходимости легочных артерий, в свою очередь, ведет к относительно быстрому развитию посттромбоэмболической легочной гипертензии. Кроме того, катетеры следует использовать только при поражении основных артерий, так как фрагментация тромба в менее крупных ветвях обычно не приносит пользы и может сопровождаться повреждением стенки сосуда и ее перфорацией.
Слайд 55: При ротационной дезобструкции
после селективной катетеризации легочной артерии, проводник проводится сквозь эмбол. Затем катетер Schmitz-Rode перемещается по проводнику от дистальной части эмбола к проксимальной с одновременным вращением вокруг своей оси. Вращение катетера осуществляется вручную, со скоростью 1-3 оборота в секунду. Предшествующая и контрольная ангиопульмонография также выполняются с помощью этого катетера, к тому же, он позволяет одновременно с фрагментацией проводить локальный тромболизис. Для этого в дистальной части катетера имеются 6 стандартных отверстий для введения контрастного препарата и/или тромболитика. Эффективность процедуры составляет порядка 70%. При этом, каких либо серьезных осложнений, связанных с процедурой отмечено не было.
Последний слайд презентации: ДВС синдром. ТЭЛА: Хирургические методы лечения
В тех случаях, когда выполнение тромболитической терапии или эндоваскулярной дезобструкции легочной артерий неэффективно или невозможно, при острой массивной ТЭЛА высокого риска ранней смерти возможно выполнение «открытой» тромбэмболэктомии.