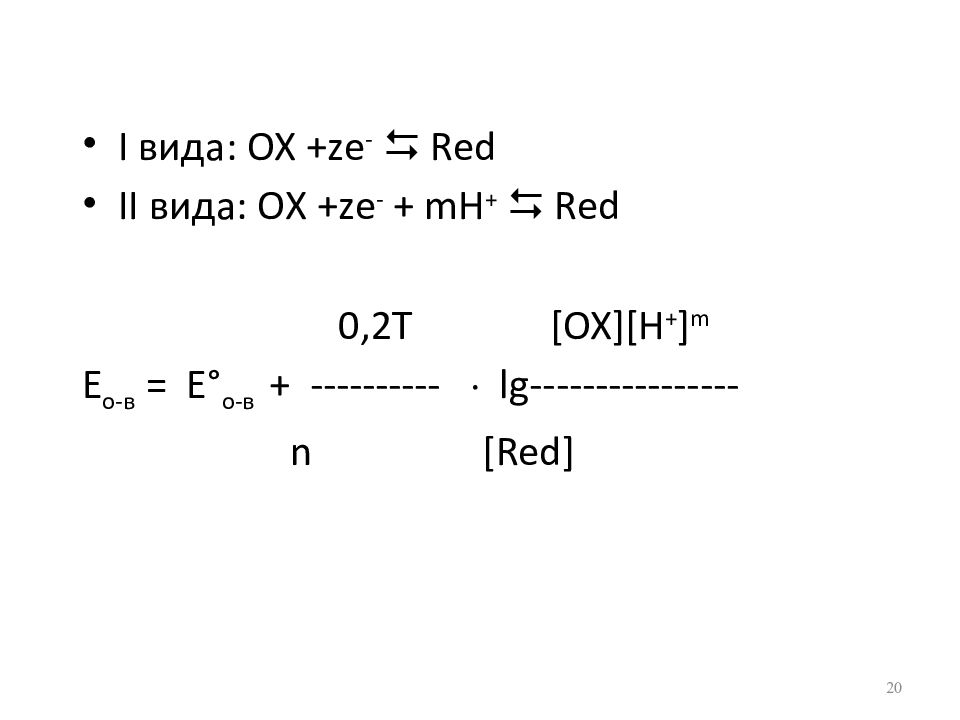Слайд 2: План лекции
Процессы на границе металл / вода, металл / раствор Электродный потенциал Уравнение Нернста Водородный электрод Классификация электродов Уравнение Нернста-Петерса О-В системы в живых организмах 2
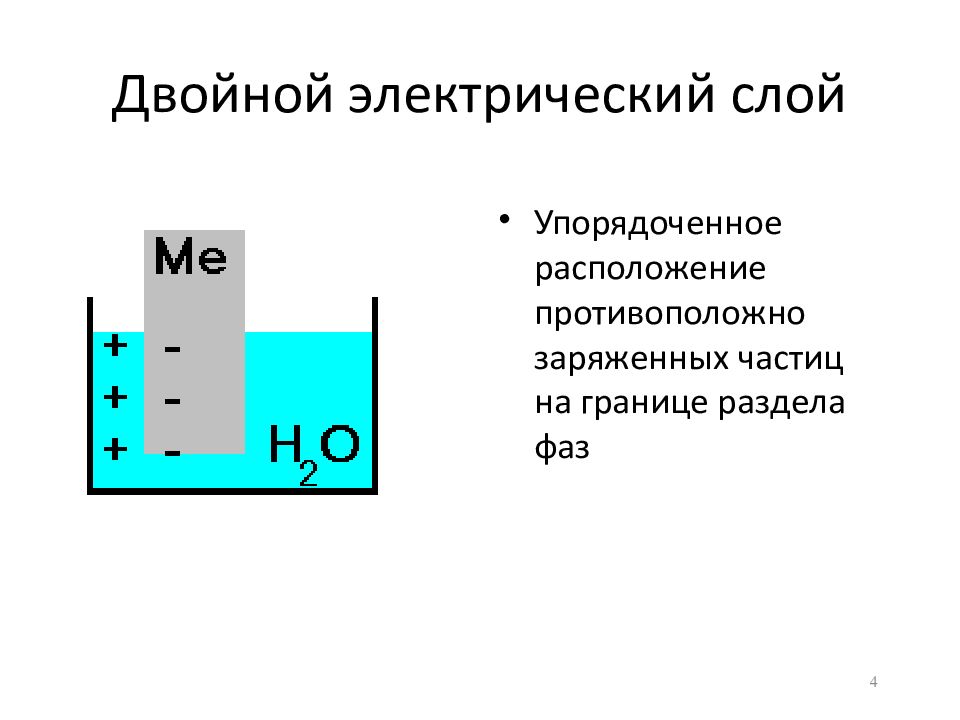
Слайд 4: Двойной электрический слой
Упорядоченное расположение противоположно заряженных частиц на границе раздела фаз 4
Слайд 5
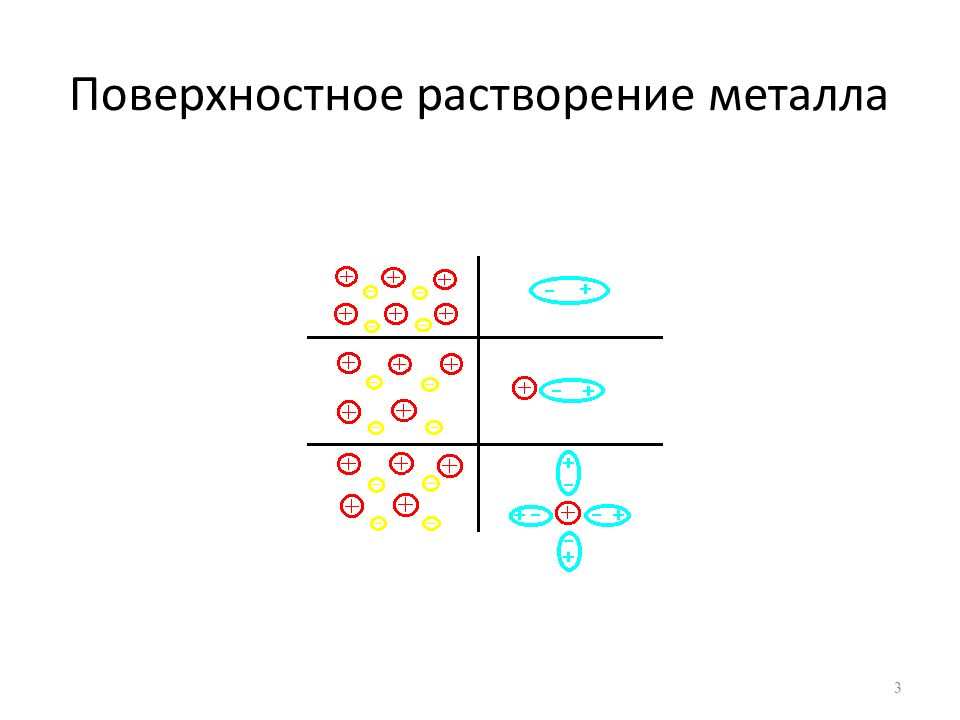
Устанавливается подвижное равновесие (скорость растворения = скорости осаждения) Образовавшаяся пограничная разность потенциалов получила название электродного потенциала Е (лат. р otentia – возможность, мощь) 5
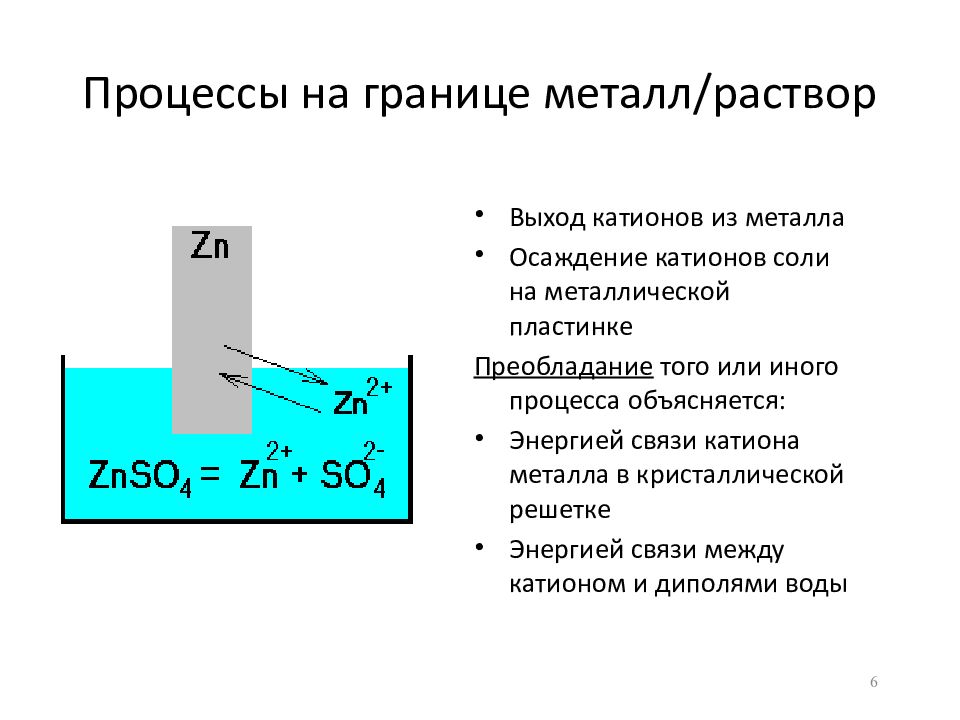
Слайд 6: Процессы на границе металл/раствор
Выход катионов из металла Осаждение катионов соли на металлической пластинке Преобладание того или иного процесса объясняется: Энергией связи катиона металла в кристаллической решетке Энергией связи между катионом и диполями воды 6
Слайд 7
Химически активные металлы ( Zn, Mg, Al, Fe ) характеризуются большими величинами растворимости. При любых больших концентрациях их солей, которые можно получить практически, эти металлы всегда будут в большей или меньшей степени растворяться, а возникающие при этом электродные потенциалы будут отрицательными (Е < 0) Величины растворимости химически малоактивных металлов ( Cu, Hg, Ag, Au, Pt ) ничтожно малы. Даже при малых концентрациях солей этих металлов на границе металл / раствор будет преобладать процесс осаждения ионов металла из раствора на металлическую поверхность (Е > 0) 7
Слайд 8: Уравнение Нернста
2,3 RT 2,3 RT E = --------- -- lgK + ---------- lg a nF nF Е – электродный потенциал R = 8,31 Дж/моль К F = 96 500 Кл – число Фарадея К – константа, характеризующая природу металла а – активность катиона металла 8
Потенциал, возникающий на границе металл / раствор при активности катионов металла в растворе 1 моль/л и температуре 298 К 2,3 RT Е = Е ° + ----------- lg a (К + ) nF 0,2Т Е = Е ° + ----------- lg a (К + ) n Зависит от природы металла, от заряда катиона, от активности иона, от температуры 9
Слайд 10: Ряд напряжений
Расположение металлов в порядке возрастания их стандартных электродных потенциалов 10 Li K Na Zn Fe H Cu Ag Au -3,05 -2,09 -2,70 -0,76 -0,44 0 +0,34 +0,8 +1,7
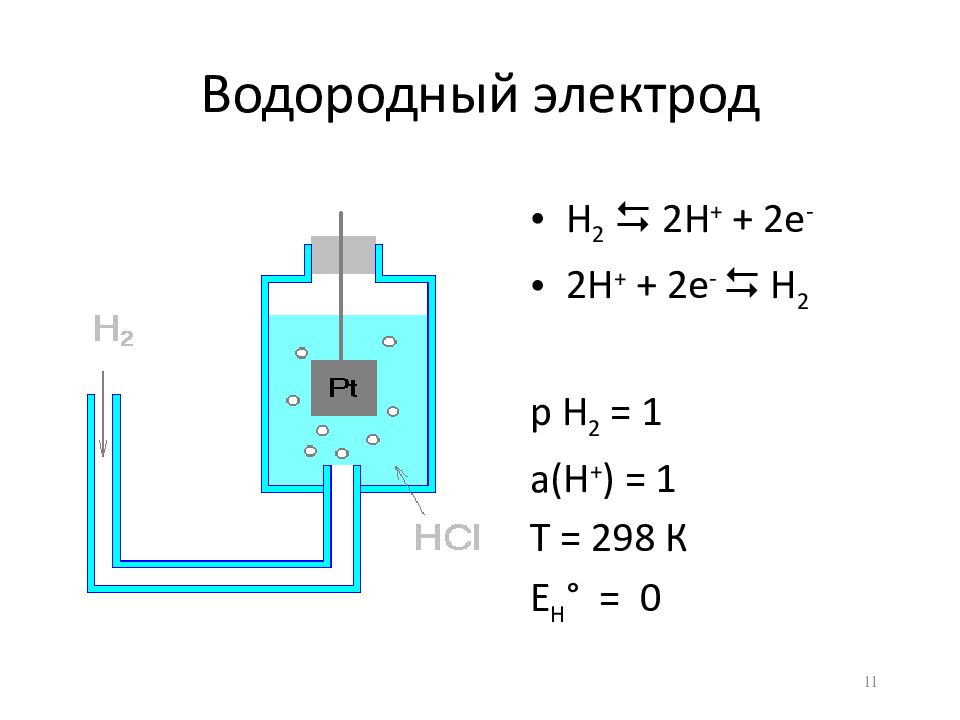
Слайд 11: Водородный электрод
H 2 2H + + 2e - 2H + + 2e - H 2 р Н 2 = 1 а(Н + ) = 1 Т = 298 К Е Н ° = 0 11
Слайд 12: Недостатки стандартного водородного электрода
Трудно изготавливать, сохранять и поддерживать в рабочем состоянии Водород должен быть химически чистым Давление и реакция среды должны быть постоянными 12
Слайд 13: Названия электродов
Анод – электрод, на котором протекает реакция окисления, т.е. отдача электронов; активный металл, заряд отрицательный Катод – электрод, на котором протекает реакция восстановления, т.е. присоединение электронов, заряд положительный 13
Слайд 14: Хлорсеребряный электрод
AgCl Ag + + Cl - Ag + + е - Ag ° KCl K + + Cl - Раствор хлорида калия – насыщенный ( Е ° = +222 мВ) 14
Слайд 15: Классификация электродов Электроды I типа
Электродный потенциал создается на границе металл / раствор в результате окислительно-восстановительной реакции Ионометаллические – потенциал возникает в результате обмена ионами Окислительно-восстановительные (редокс-электроды) – в результате обмена электронами 15
Слайд 16: Ионометаллические электроды
1-го рода : электроды, обратимые относительно или катиона или аниона (цинковый, медный, газовые). Представляет собой металл, опущенный в раствор собственной соли 2-го рода : электроды, обратимые относительно и катиона и аниона. Электродный потенциал зависит от концентрации катиона и аниона (хлорсеребряный). Представляют собой трехфазную систему, в которой металл покрыт труднорастворимой солью и погружен в раствор, содержащий анионы этой соли 16
Слайд 17: Окислительно-восстановительные электроды
Электроды, в которых материал электрода в окислительно-восстановительном процессе не участвует; он является только переносчиком электронов Представляют собой систему, содержащую окисленную и восстановленную формы одного и того же вещества. В его раствор опущен инертный металлический электрод ( Pt, Au), который является или поставщиком электронов или их переносчиком 17
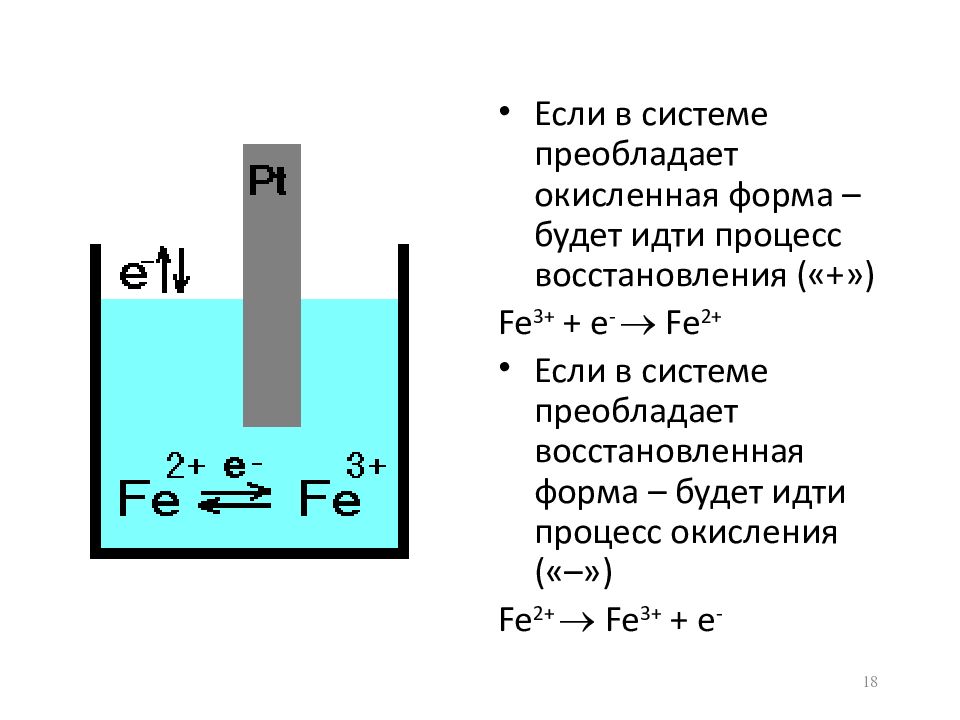
Слайд 18
Если в системе преобладает окисленная форма – будет идти процесс восстановления («+») Fe 3+ + e - Fe 2+ Если в системе преобладает восстановленная форма – будет идти процесс окисления («–») Fe 2+ Fe 3+ + e - 18
Слайд 19: Уравнение Нернста-Петерса
0,2Т [OX] E о-в = Е ° о-в + ---------- lg----------- n [Red] n – количество электронов, которые передаются от одной формы к другой Е ° о-в – потенциал окислительно-восстановительной системы, в которой соотношение окисленной и восстановленной форм = 1 19
Слайд 20
I вида: ОХ + z е - Red II вида: ОХ + z е - + m Н + Red 0,2Т [OX][H + ] m E о-в = Е ° о-в + ---------- lg---------------- n [Red] 20
Слайд 21: Электроды II типа
Электродный потенциал возникает на границе раздела двух растворов, отделенных мембраной с избирательной проницаемостью для отдельных ионов – мембранные электроды (ферментные) 21
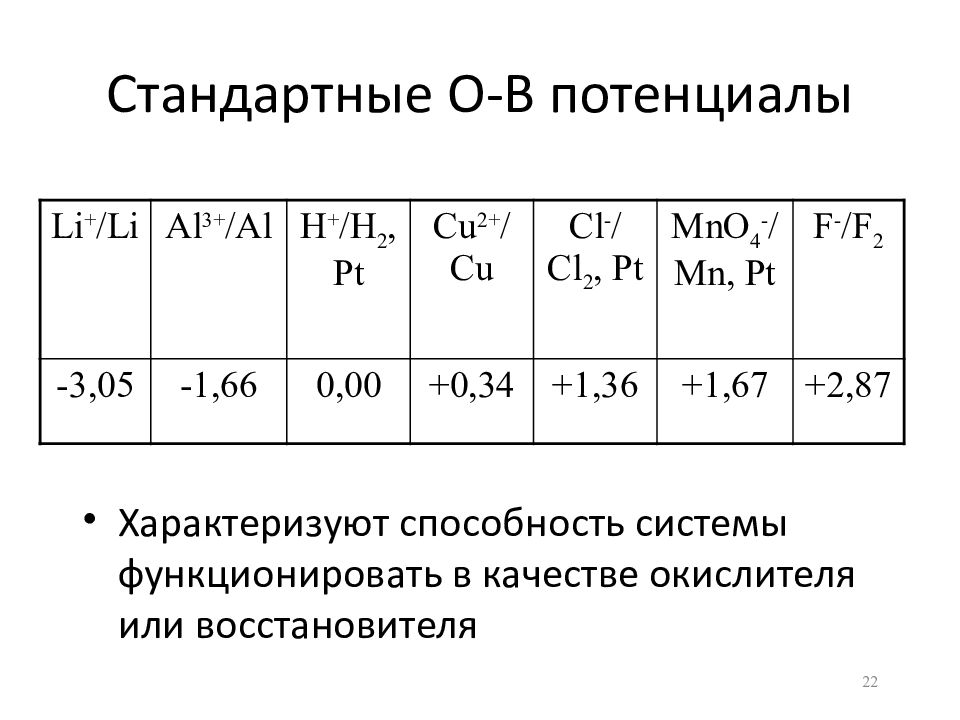
Слайд 22: Стандартные О-В потенциалы
Li + / Li Al 3+ / Al H + / H 2, Pt Cu 2+ / Cu Cl - / Cl 2, Pt MnO 4 - / Mn, Pt F - / F 2 -3,05 -1,66 0,00 +0,34 +1,36 +1,67 +2,87 Характеризуют способность системы функционировать в качестве окислителя или восстановителя 22
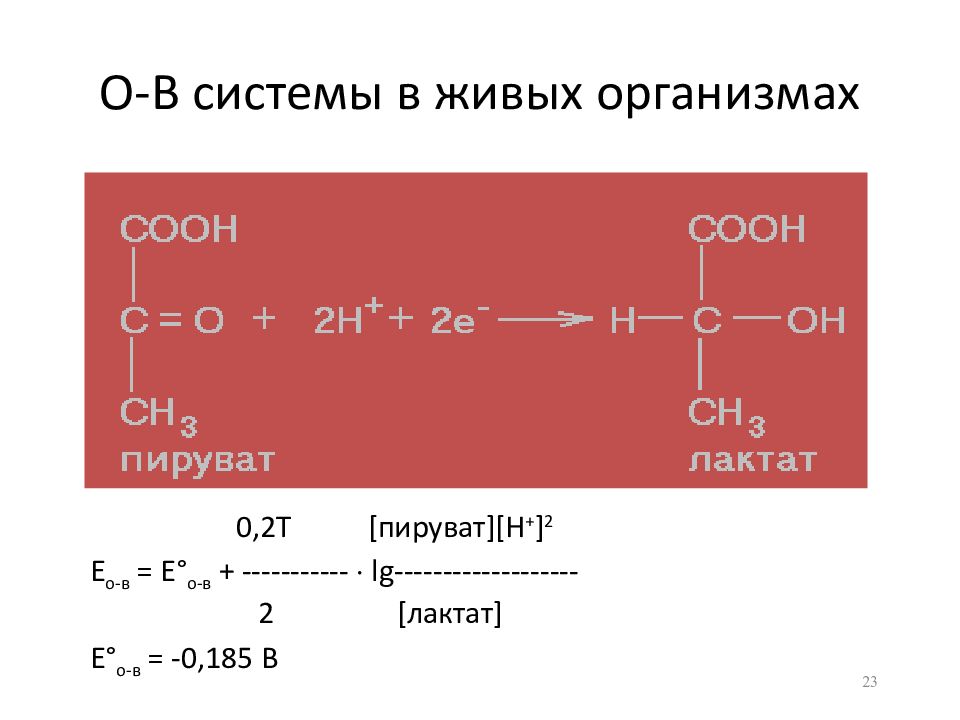
Слайд 23: О-В системы в живых организмах
0,2Т [ пируват ][H + ] 2 Е о-в = Е ° о-в + ----------- lg ---------------- --- 2 [ лактат ] Е ° о-в = -0,185 В 23
Последний слайд презентации: Электрохимия
Весь путь биологического окисления характеризуется изменением потенциала от –0,42 до +0,81 В При переходе электронов от одной формы вещества к другой в цепи реакций потенциал изменяется постепенно Минимальная разность потенциалов, необходимая для превращения АДФ в АТФ составляет 0,17 В 24