МККОС. Л.К. № 9. Попова Людмила Федоровна 3 Теоретические основы электрохимических методов Электрохимические методы основаны на изучении и использовании процессов, протекающих на поверхности электрода или в приэлектродном пространстве. Основной узел любого электрохимического прибора – электрохимическая ячейка. Виды электрохимических ячеек: Гальванический элемент; Электролитическая ячейка. Каждая ячейка содержит два электрода: электрод сравнения и индикаторный электрод.
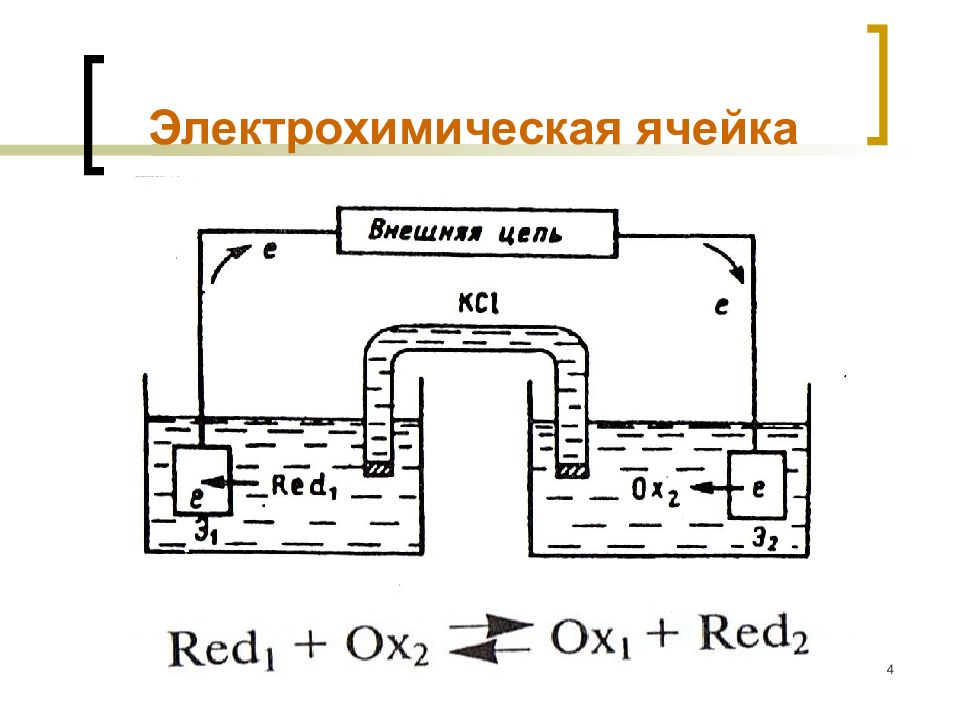
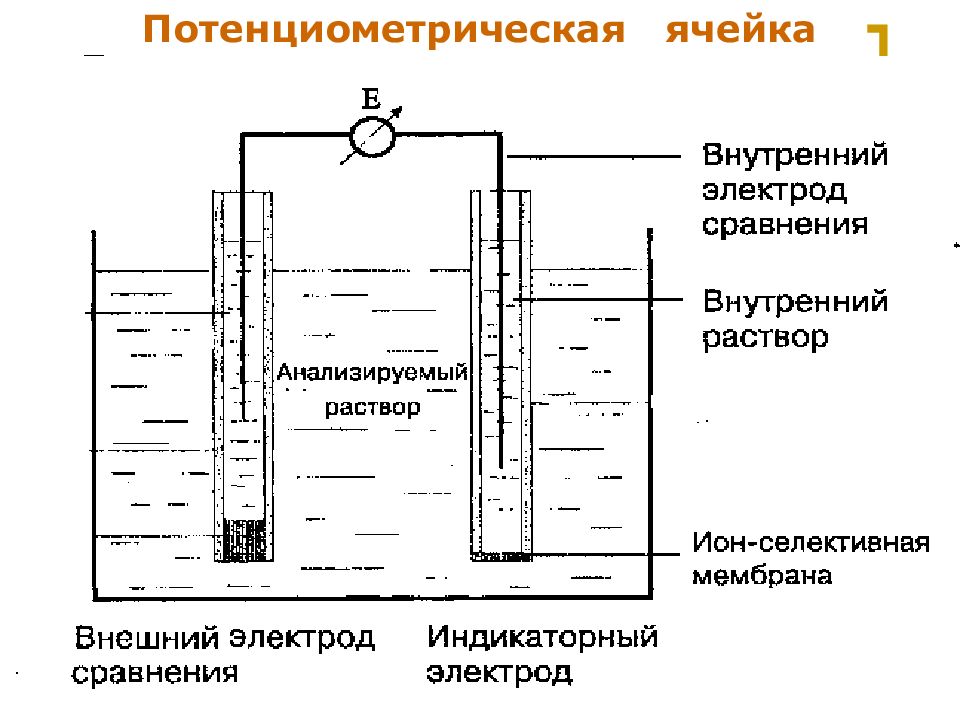
Слайд 4: Электрохимическая ячейка
МККОС. Л.К. № 9. Попова Людмила Федоровна 4 Электрохимическая ячейка
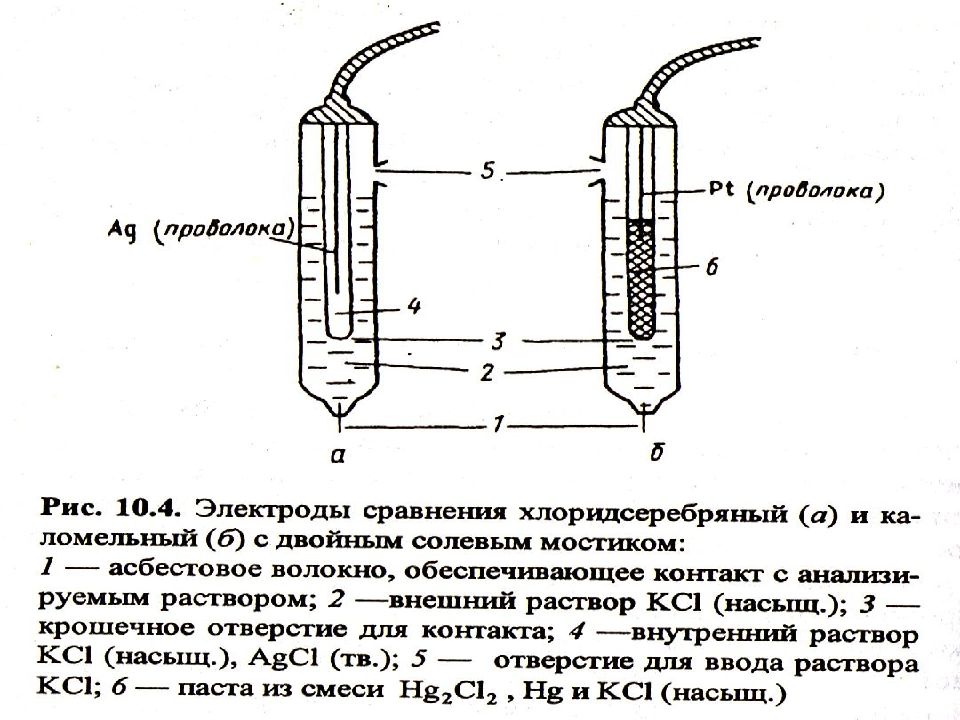
МККОС. Л.К. № 9. Попова Людмила Федоровна 5 Электроды, используемые в электрохимии Электроды первого рода (обратимые относительно катиона, общего с материалом электрода): Металлические электроды; Амальгамные электроды; Газовые электроды (водородный). Электроды второго рода (обратимые относительно аниона, общего с материалом электрода): Электроды сравнения (хлоридсеребряный, каломельный); Газовые электроды (хлорный). Электроды третьего рода (редокс-электроды): Металлические электроды, погруженные в редокс-систему; Хингидронный электрод.
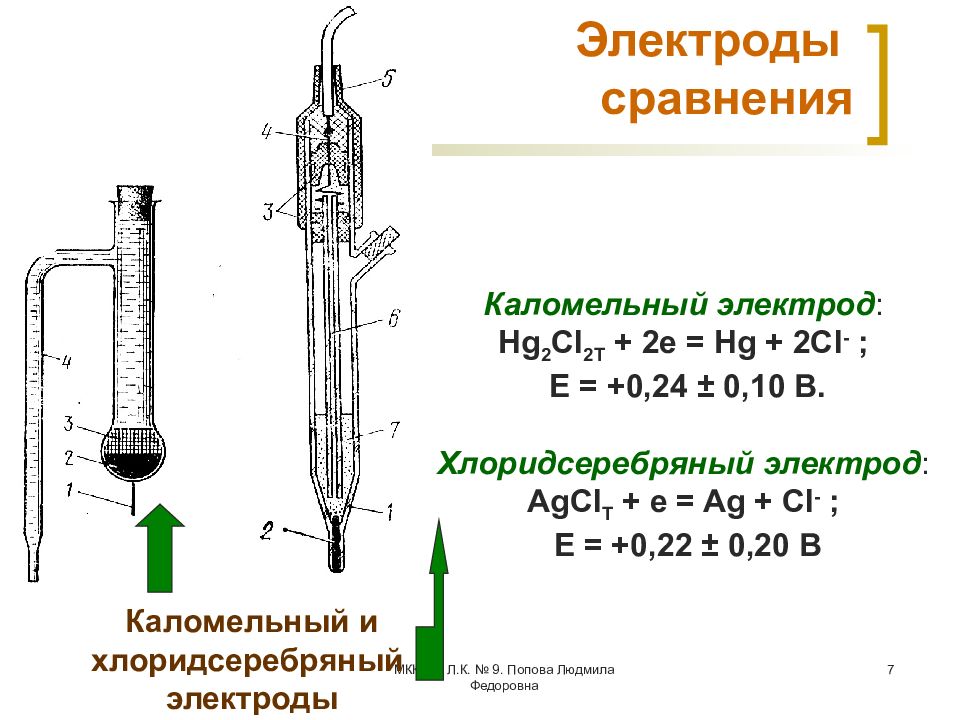
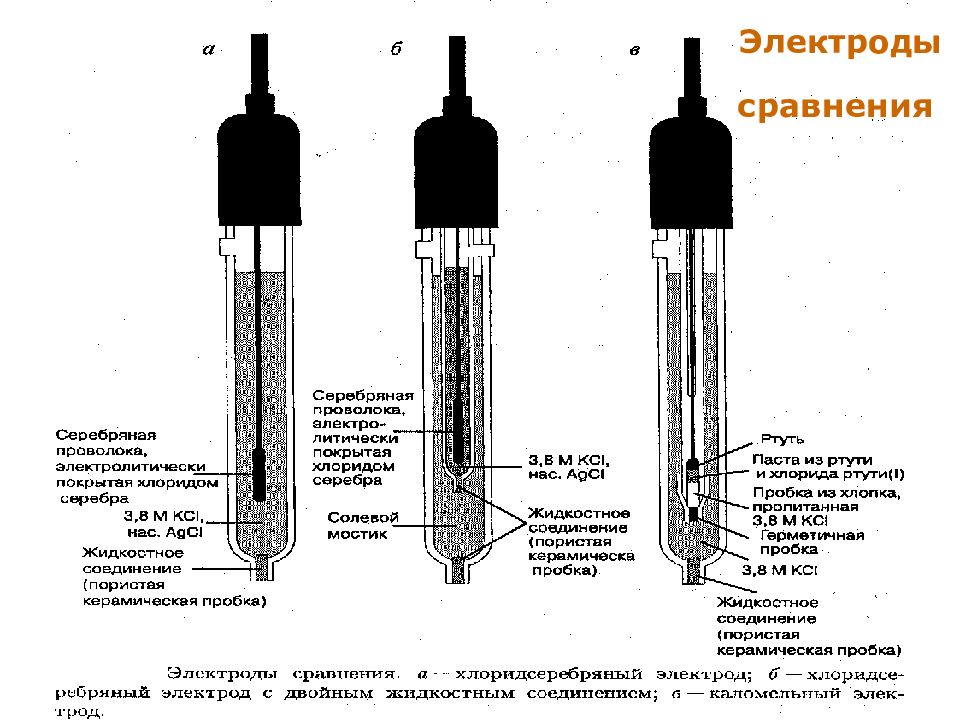
Слайд 7: Электроды сравнения
МККОС. Л.К. № 9. Попова Людмила Федоровна 7 Электроды сравнения Каломельный и хлоридсеребряный электроды Каломельный электрод : Hg 2 Cl 2Т + 2 e = Hg + 2 Cl - ; Е = +0,24 ± 0,10 В. Хлоридсеребряный электрод : AgCl Т + e = Ag + Cl - ; Е = +0,22 ± 0,20 В
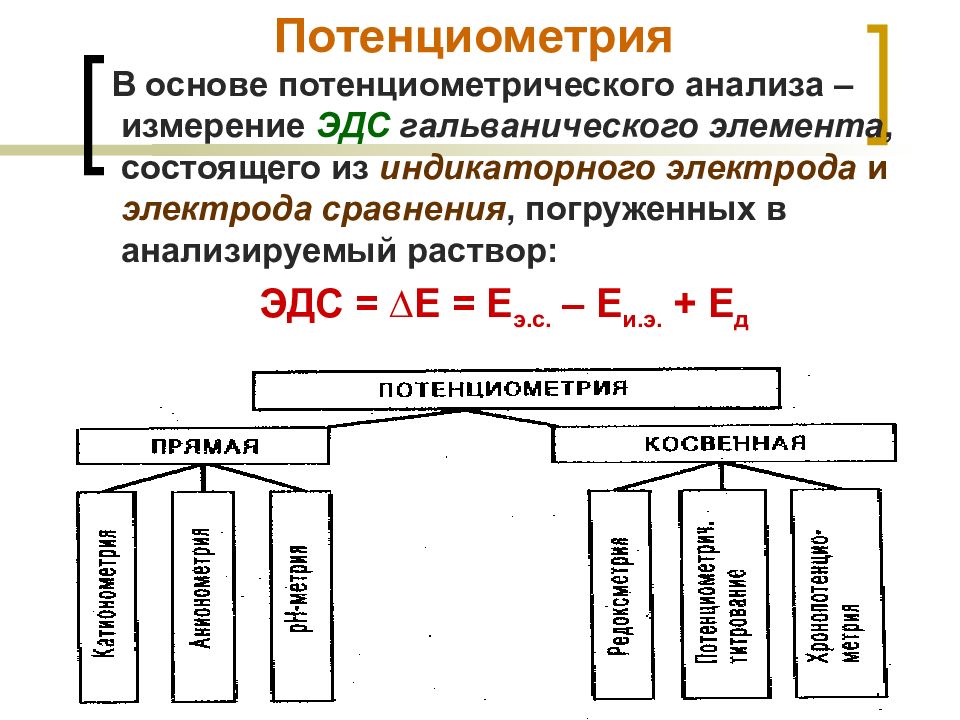
Слайд 10: Потенциометрия
МККОС. Л.К. № 9. Попова Людмила Федоровна 10 Потенциометрия В основе потенциометрического анализа – измерение ЭДС гальванического элемента, состоящего из индикаторного электрода и электрода сравнения, погруженных в анализируемый раствор: ЭДС = ∆Е = Е э.с. – Е и.э. + Е д
Слайд 11
МККОС. Л.К. № 9. Попова Людмила Федоровна 11 В основе потенциометрических измерений лежит зависимость равновесного потенциала индикаторного электрода от состава и концентрации анализируемого раствора, описываемая уравнением Нернста (25 0 С): Е = Е 0 Ox / Red + ( RT / nF ) • ln ( a Ox / a Red ) = = Е 0 Ox / Red + (0,059/ n ) • lg ( a Ox / a Red ), где Е – равновесный электродный потенциал; n – число электронов, участвующих в полуреакции; Е 0 – стандартный электродный потенциал; Т – абсолютная температура; F – постоянная Фарадея; R – универсальная газовая постоянная.
Слайд 14: Индикаторные электроды
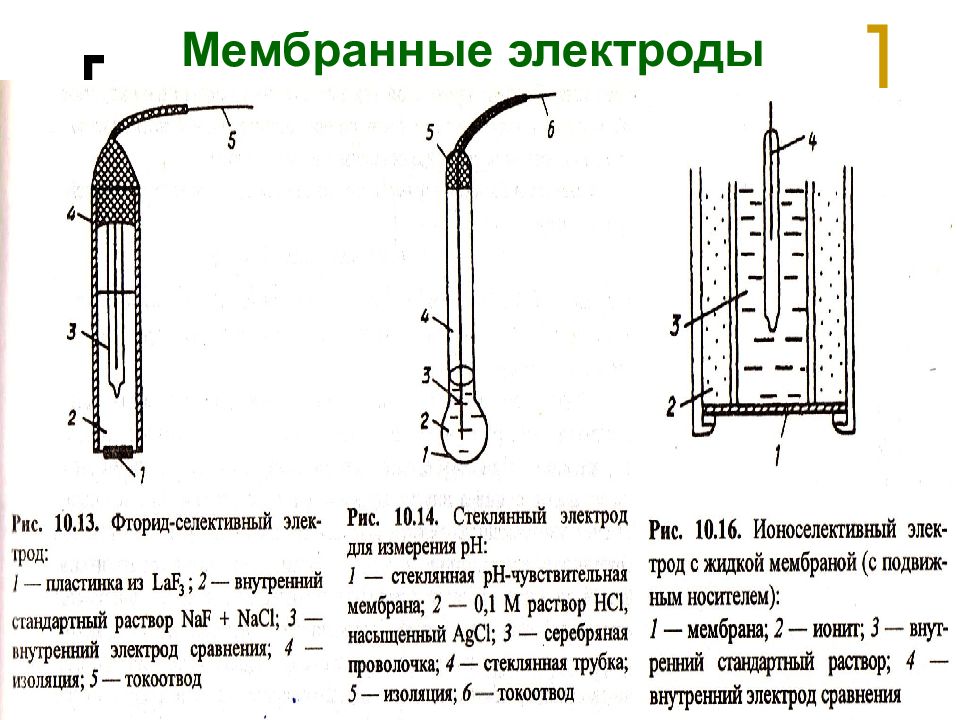
МККОС. Л.К. № 9. Попова Людмила Федоровна 14 Индикаторные электроды Металлические: Активные (первого рода); Инертные (третьего рода). Ионоселективные (мембранные): Простые: С твердой мембраной: с жесткой матрицей (стеклянные); с кристаллическими мембранами (монокристалл, таблетка). С жидкой мембраной (подвижным носителем): жидкие ионообменные («+» и «–» заряженные; с нейтральными носителями (незаряженные). Сложные (многомембранные): Сенсибилизированные (активированные электроды): газочувствительные; ферментные.
Слайд 15: Металлические электроды
МККОС. Л.К. № 9. Попова Людмила Федоровна 15 Металлические электроды Активные МЭ изготавливают из металлов ( Ag, Pb, Cu, Cd). Любой такой электрод в растворе, содержащем собственные ионы, приобретает Е, обратимо изменяющийся при изменении активности этих ионов: Ag + + e = Ag 0 ; E = E 0 + 0,059•lg(a Ag + ). Инертные МЭ изготавливают из благородных металлов ( Pt, Au). Они служат переносчиками е от Red -формы к Ох-форме. Е таких электродов зависят от соотношения Ох и Red форм полуреакции: Е = Е 0 ( Fe 3+ /Fe 2+ ) + 0,059•lg(a Fe 3+ /a Fe 2+ ). Измеряя потенциал такого электрода можно проследить за изменением соотношения: ( a Fe 3+ /a Fe 2+ ).
Слайд 16: Мембранные электроды
МККОС. Л.К. № 9. Попова Людмила Федоровна 16 Мембранные электроды
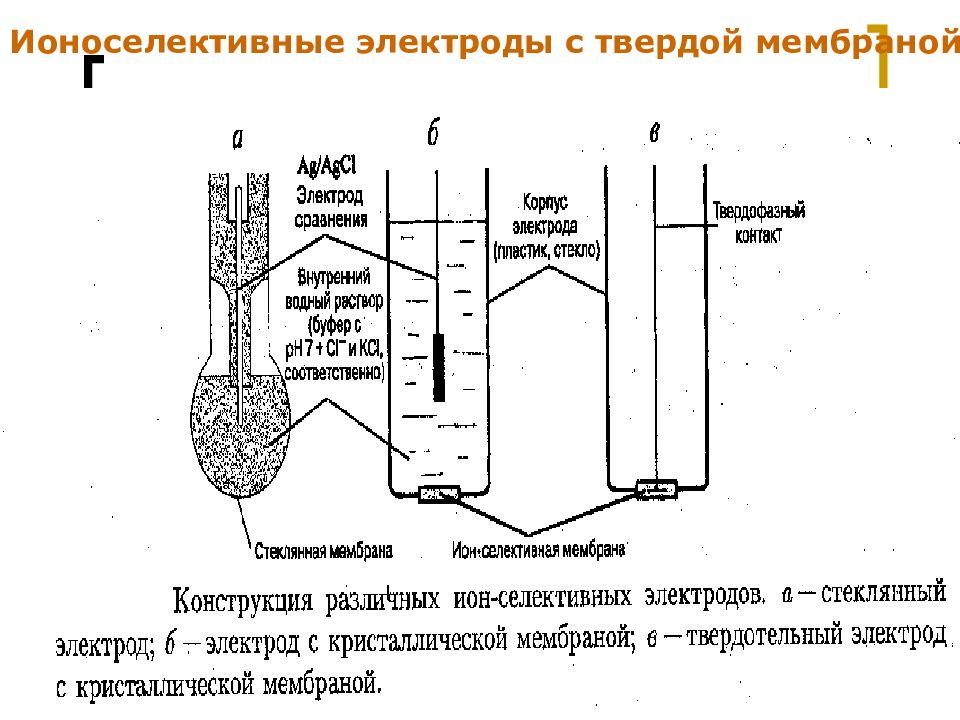
Слайд 17
МККОС. Л.К. № 9. Попова Людмила Федоровна 17 Ионоселективные электроды с твердой мембраной
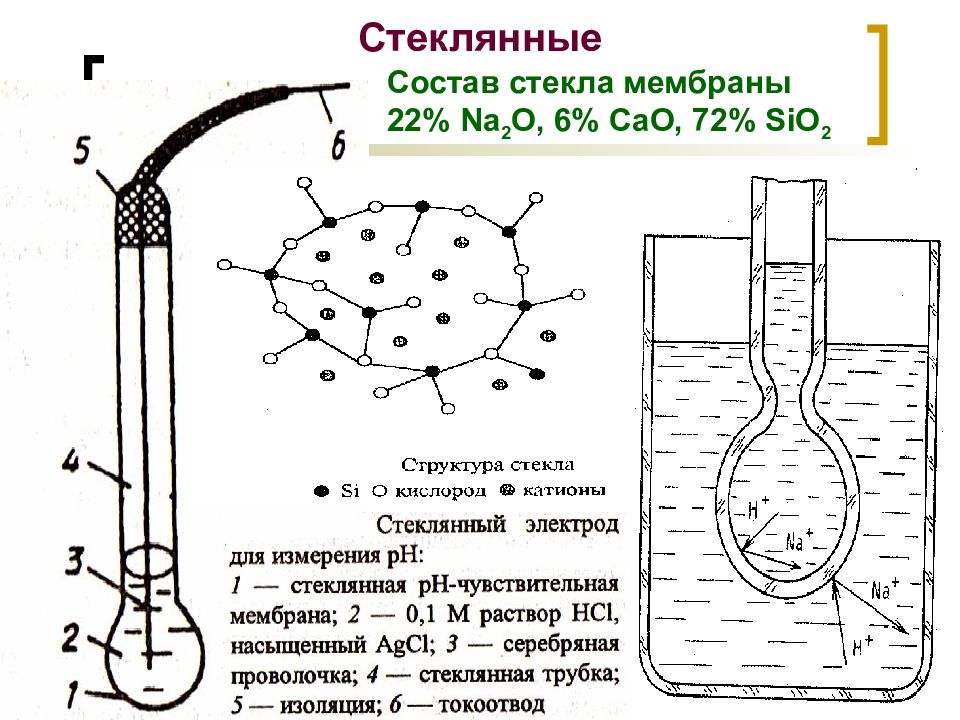
Слайд 18: Стеклянные
МККОС. Л.К. № 9. Попова Людмила Федоровна 18 Стеклянные Состав стекла мембраны 22% Na 2 O, 6% CaO, 72% SiO 2
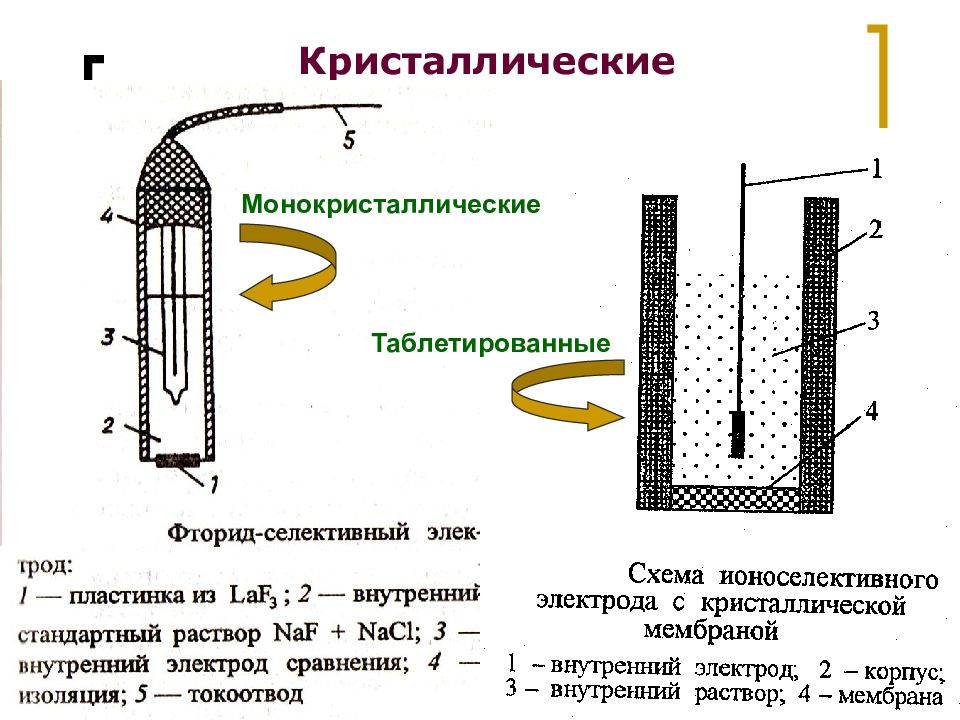
Слайд 19
МККОС. Л.К. № 9. Попова Людмила Федоровна 19 Кристаллические Монокристаллические Таблетированные
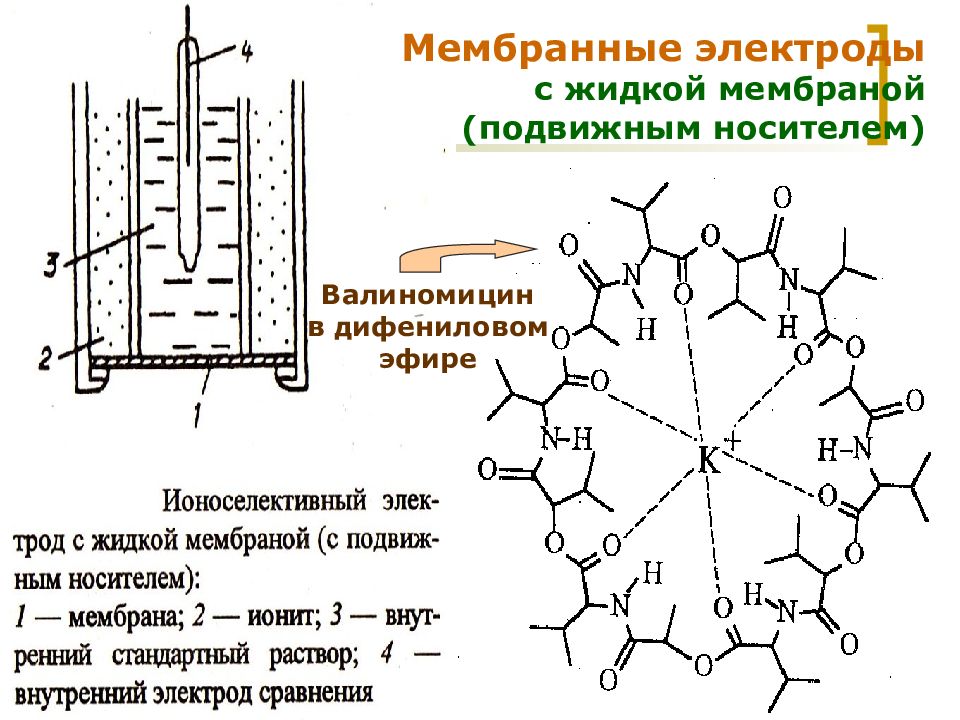
Слайд 20
МККОС. Л.К. № 9. Попова Людмила Федоровна 20 Мембранные электроды с жидкой мембраной (подвижным носителем) Валиномицин в дифениловом эфире
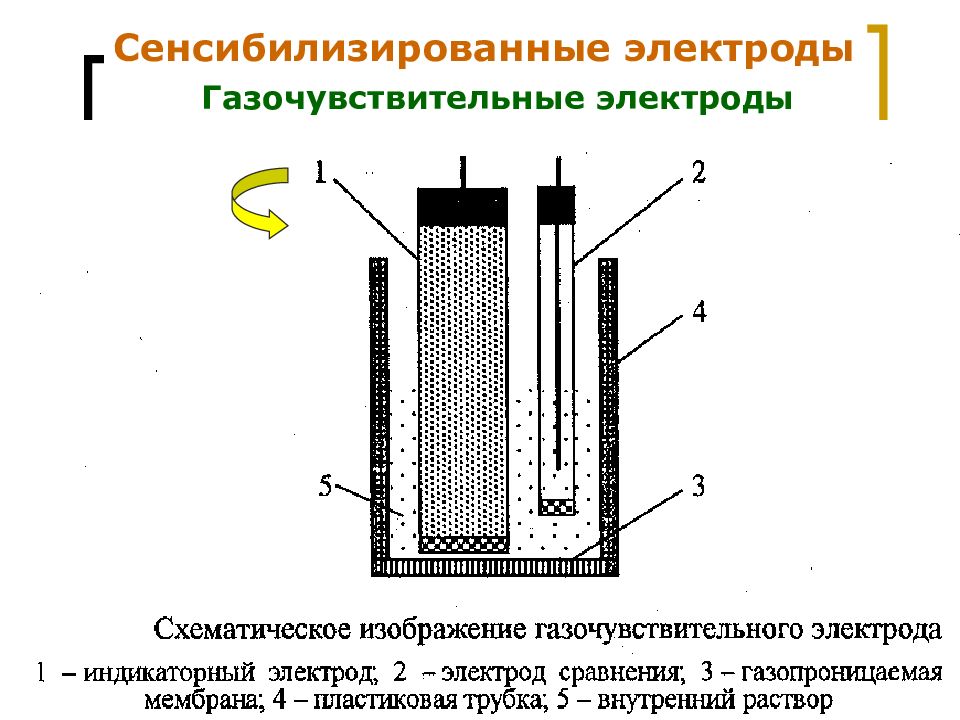
Слайд 21
МККОС. Л.К. № 9. Попова Людмила Федоровна 21 Сенсибилизированные электроды Газочувствительные электроды
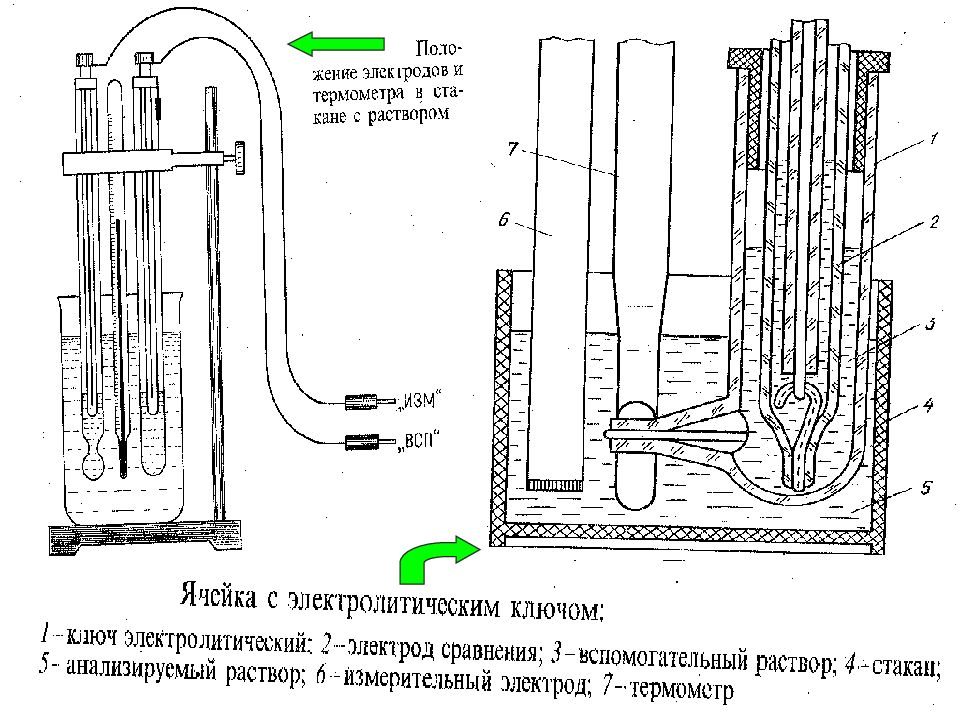
Слайд 22: Оборудование для потенциометрии
МККОС. Л.К. № 9. Попова Людмила Федоровна 22 Оборудование для потенциометрии
Слайд 24: Прямая потенциометрия
МККОС. Л.К. № 9. Попова Людмила Федоровна 24 Прямая потенциометрия В основе метода – зависимость равновесного потенциала индикаторного электрода от концентрации иона в анализируемом растворе, выражаемое уравнением Нернста :
Слайд 25: Ионометрия
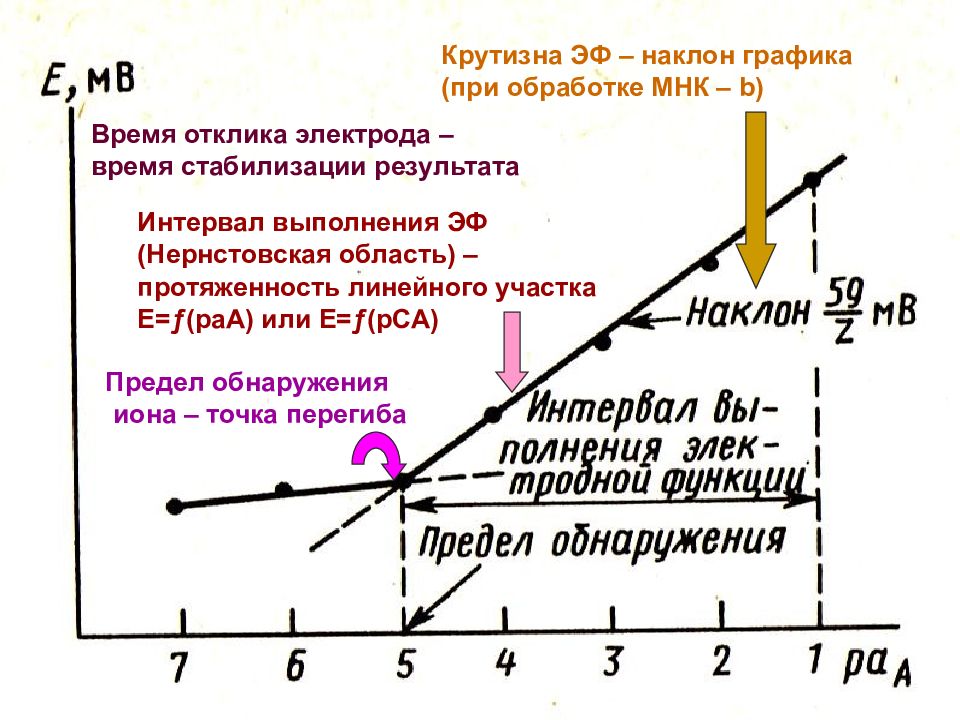
МККОС. Л.К. № 9. Попова Людмила Федоровна 25 Ионометрия Построить калибровочный график и по нему определить основные характеристики ионоселективного электрода (см. далее рис.): Крутизна электродной функции (наклон графика – b ); Время отклика электрода ; Нернстовская область ( интервал выполнения электродной функции); Предел обнаружения определяемого иона. Провести анализ природного объекта. Расчетно или графически определить концентрацию иона в ООС.
Слайд 26
МККОС. Л.К. № 9. Попова Людмила Федоровна 26 Крутизна ЭФ – наклон графика (при обработке МНК – b) Время отклика электрода – время стабилизации результата Интервал выполнения ЭФ (Нернстовская область) – протяженность линейного участка Е= ƒ (раА) или Е= ƒ (рСА) Предел обнаружения иона – точка перегиба
Слайд 27: Способы определения концентрации
МККОС. Л.К. № 9. Попова Людмила Федоровна 27 Способы определения концентрации Способ калибровочного графика
Слайд 28
МККОС. Л.К. № 9. Попова Людмила Федоровна 28 Способ добавок с учетом разбавления ; без учета разбавления
Слайд 29: Потенциометрическое титрование
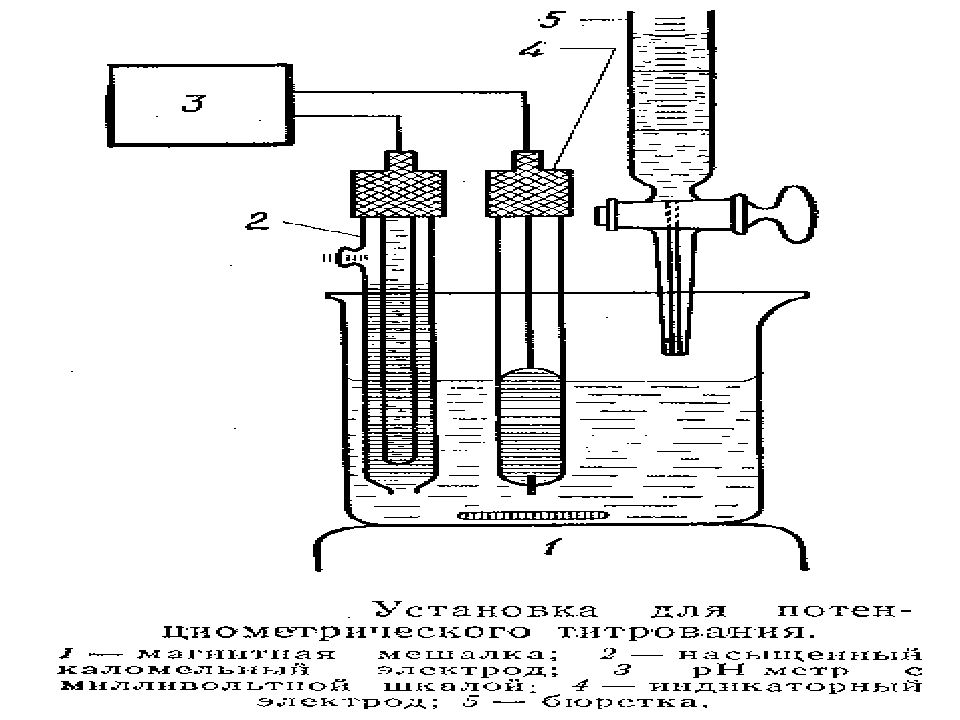
МККОС. Л.К. № 9. Попова Людмила Федоровна 29 Потенциометрическое титрование Сущность метода – измерение потенциала индикаторного электрода (ЭДС) в ходе титрования для последующего определения конечной точки титрования (КТТ). Для этого необходимо : Построить кривую титрования. Определить на кривой скачок потенциала. По скачку определить объем титранта в точке эквивалентности. Рассчитать концентрацию определяемого иона по закону эквивалентов.
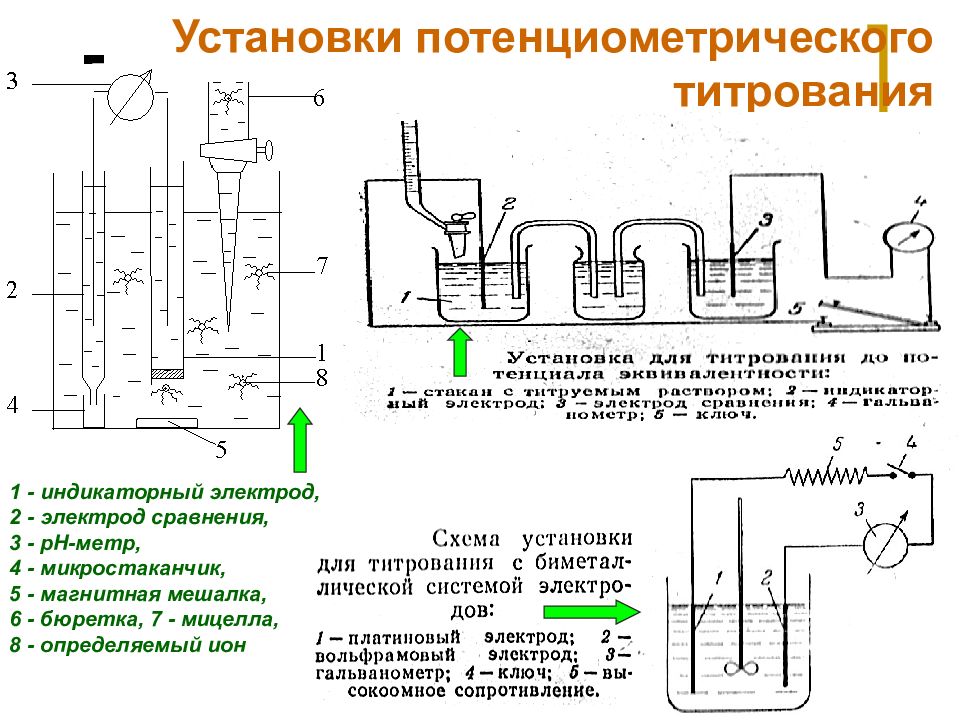
Слайд 31: Установки потенциометрического титрования
МККОС. Л.К. № 9. Попова Людмила Федоровна 31 Установки потенциометрического титрования 1 - индикаторный электрод, 2 - электрод сравнения, 3 - pH-метр, 4 - микростаканчик, 5 - магнитная мешалка, 6 - бюретка, 7 - мицелла, 8 - определяемый ион
Слайд 32
МККОС. Л.К. № 9. Попова Людмила Федоровна 32 Автотитраторы (современные установки)
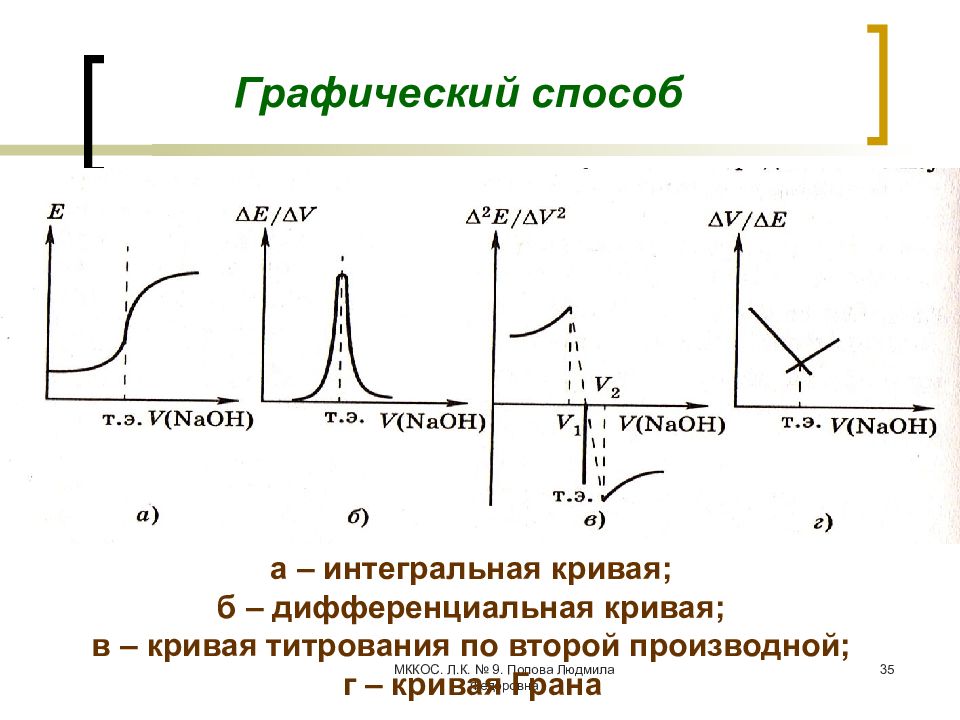
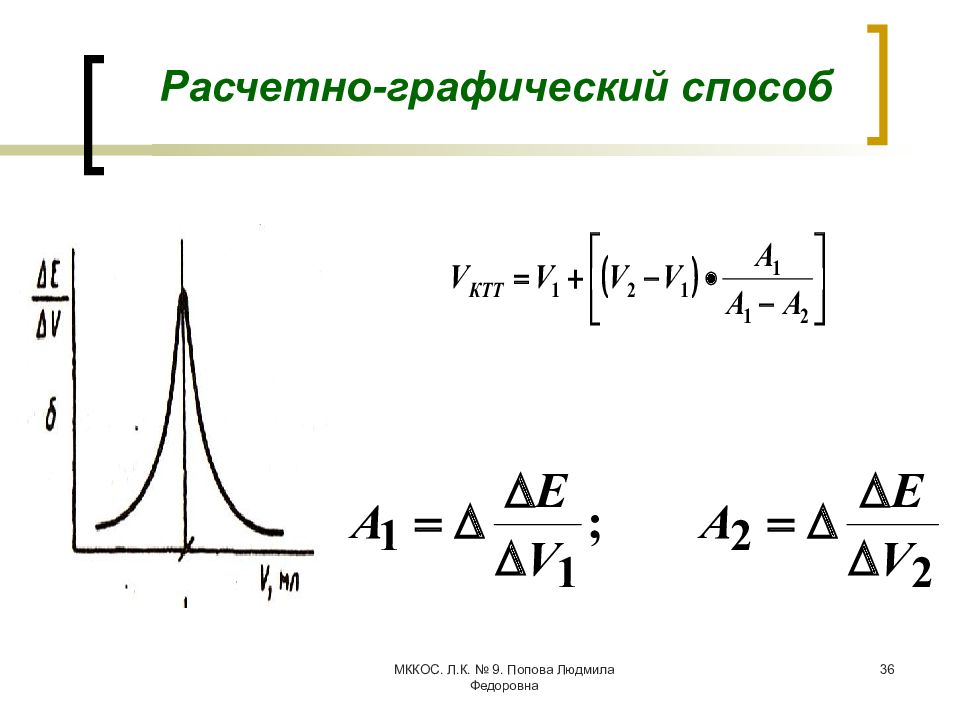
Слайд 34: Способы определения КТТ
МККОС. Л.К. № 9. Попова Людмила Федоровна 34 Способы определения КТТ Расчетный способ N – число капель; V к – объем капли; m – число капель, прибавленных до скачка потенциала; n – число капель, составляющее порцию раствора титранта, вызвавшую скачок ∆Е; V 1 = V КТТ - 1; V 2 – общий объем затраченного титранта
Слайд 35
МККОС. Л.К. № 9. Попова Людмила Федоровна 35 Графический способ а – интегральная кривая; б – дифференциальная кривая; в – кривая титрования по второй производной; г – кривая Грана
Слайд 36
МККОС. Л.К. № 9. Попова Людмила Федоровна 36 Расчетно-графический способ
Слайд 37: Виды потенциометрического титрования
МККОС. Л.К. № 9. Попова Людмила Федоровна 37 Виды потенциометрического титрования Кислотно-основное (рН-селективный электрод). Комплексонометрическое (Ме-селективные электроды ). Окислительно-восстановительное ( Pt -электрод). Осадительное ( Ag -электрод; другие ионоселективные электроды).
Слайд 38: Кондуктометрия
МККОС. Л.К. № 9. Попова Людмила Федоровна 38 Кондуктометрия Основана на измерении удельной электропроводности анализируемого раствора. Электрическая проводимость – способность веществ пропускать электрический ток под действием внешнего электрического поля. Единица измерения – сименс (См). Вещества, пропускающие электрический ток ( проводники ) по механизму переноса электричества делятся на 3 класса: проводники первого рода ( электронные ): Ме, полупроводники, сплавы, С, некоторые твердые соли и оксиды; проводники второго рода ( ионные ): растворы и расплавы электролитов; проводники третьего рода ( смешанные ): растворы щелочных и щелочноземельных Ме в жидком аммиаке, некоторые жидкие сплавы и соли.
Слайд 39: Теоретические основы метода
МККОС. Л.К. № 9. Попова Людмила Федоровна 39 Теоретические основы метода Электрическая проводимость – W – величина обратная электрическому сопротивлению – R (W = 1/R).
Слайд 40
МККОС. Л.К. № 9. Попова Людмила Федоровна 40 Удельная электропроводность æ ( См/см или Ом -1 •см -1 ) равна электрической проводимости 1 мл раствора, находящегося между параллельными электродами площадью 1см 2 при расстоянии между ними 1 см, другими словами, - это электрическая проводимость столба раствора длиной 1 см и площадью поперечного сечения 1 см 2. Ее можно измерить, или рассчитать по формуле: æ = 1 / ρ = l / ( R • S ) Для измерения удельной электропроводности анализируемого раствора используется электролитическая ячейка с переменным током.
Слайд 42
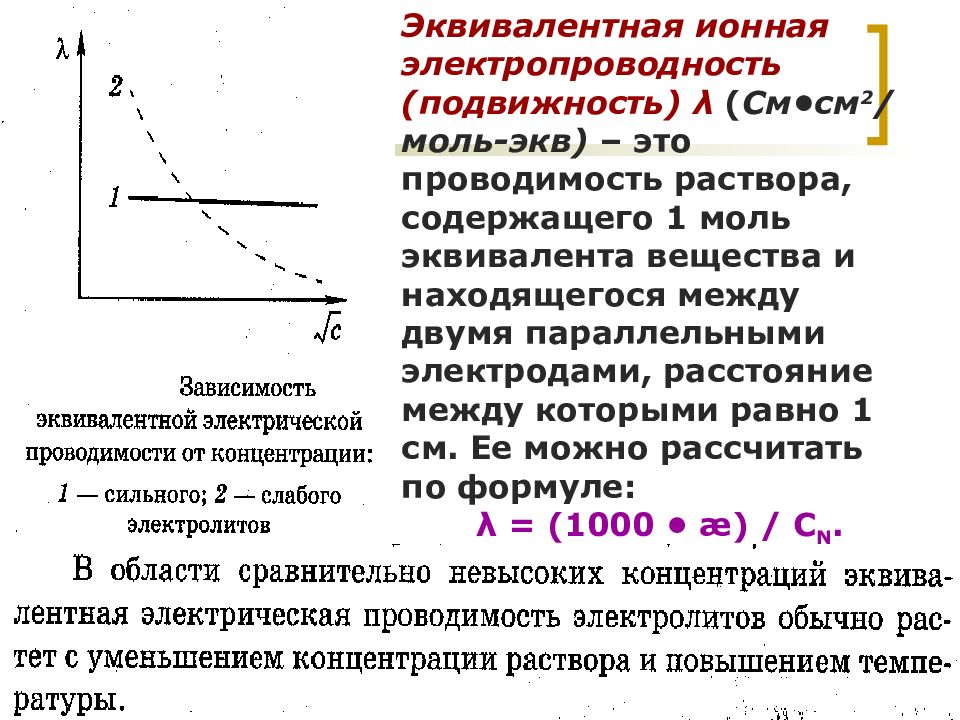
МККОС. Л.К. № 9. Попова Людмила Федоровна 42 Эквивалентная ионная электропроводность (подвижность) λ ( См•см 2 /моль-экв) – это проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми равно 1 см. Ее можно рассчитать по формуле: λ = (1000 • æ) / С N.
Слайд 43
МККОС. Л.К. № 9. Попова Людмила Федоровна 43 В соответствии с законом независимого движения ионов Кольрауша эквивалентная электропроводность раствора электролита при бесконечном разбавлении называется предельной эквивалентной электропроводностью ( λ или λ 0 ) и может быть представлена суммой предельных электрических проводимостей, или предельных подвижностей ионов : λ = λ 0(-) + λ 0(+). Подвижности ионов в растворах с конечной концентрацией не являются постоянными и зависят от концентрации раствора: с ростом концентрации раствора подвижность ионов уменьшается : λ = λ 0 – а • √С N, где а – константа. Закон аддитивности электрической проводимости
Слайд 44
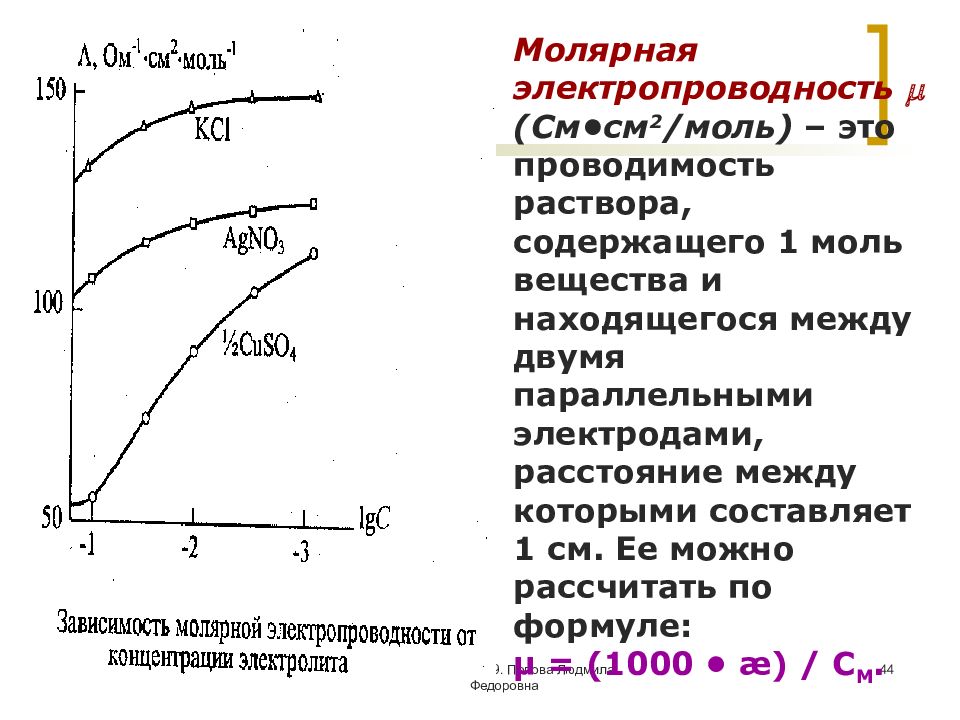
МККОС. Л.К. № 9. Попова Людмила Федоровна 44 Молярная электропроводность (См•см 2 /моль) – это проводимость раствора, содержащего 1 моль вещества и находящегося между двумя параллельными электродами, расстояние между которыми составляет 1 см. Ее можно рассчитать по формуле: μ = (1000 • æ) / С M.
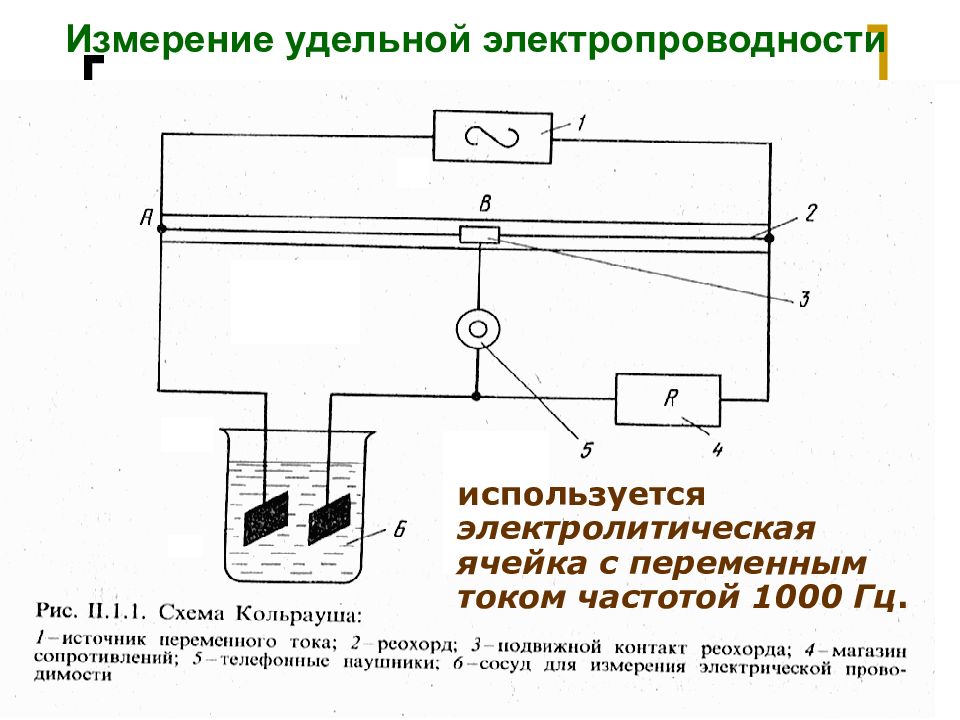
Слайд 46: Измерение удельной электропроводности
МККОС. Л.К. № 9. Попова Людмила Федоровна 46 Измерение удельной электропроводности используется электролитическая ячейка с переменным током частотой 1000 Гц.
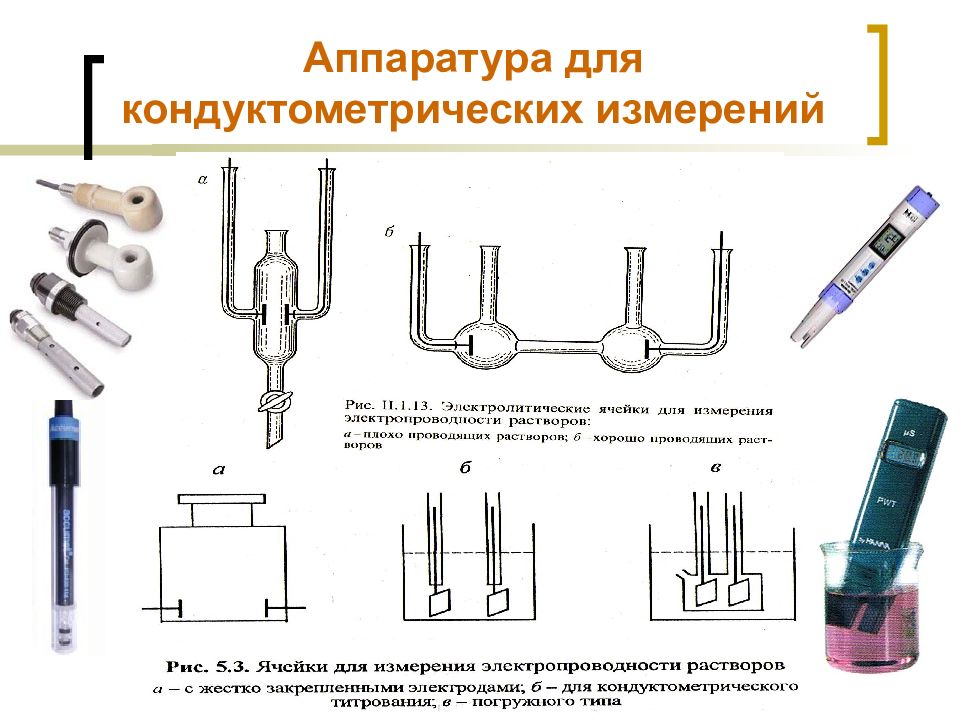
Слайд 47: Аппаратура для кондуктометрических измерений
МККОС. Л.К. № 9. Попова Людмила Федоровна 47 Аппаратура для кондуктометрических измерений
Слайд 48: Аналитическая кондуктометрия
МККОС. Л.К. № 9. Попова Людмила Федоровна 48 Аналитическая кондуктометрия
Слайд 49
МККОС. Л.К. № 9. Попова Людмила Федоровна 49 Кондуктометрически можно определять: физико-химические свойства и характеристики веществ, например: степень диссоциации, константу диссоциации, растворимость малорастворимых соединений и др. Для их расчета можно использовать формулы: степень диссоциации : α = λ / λ ; константа диссоциации : К д = { λ 2 / [ λ • ( λ - λ )]} • C N ; растворимость малорастворимого соединения : S = (1000 • æ нас ) / λ .
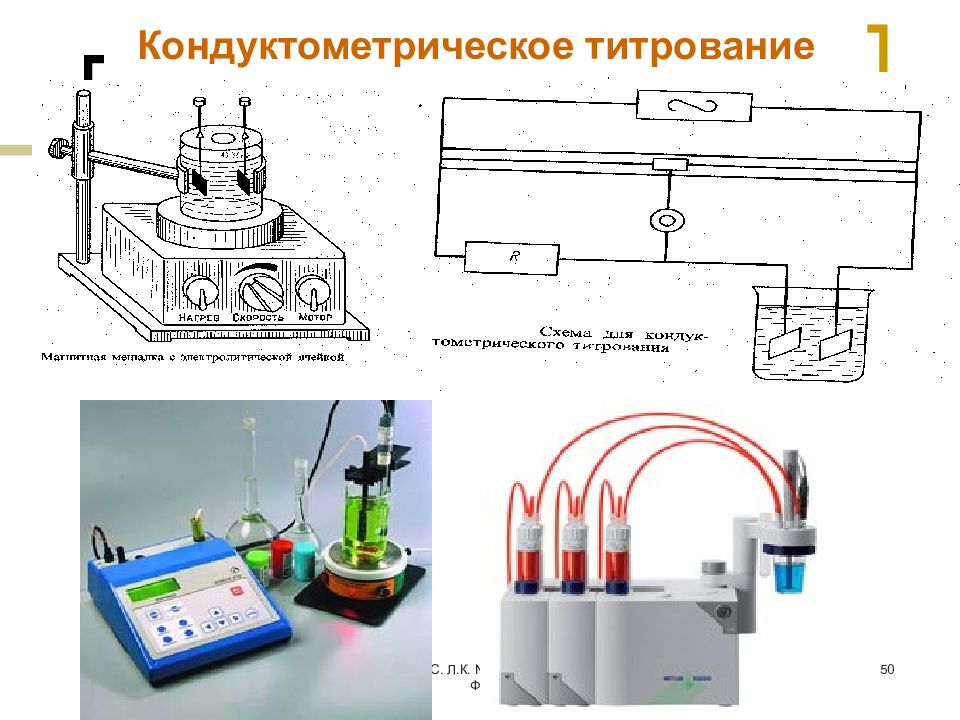
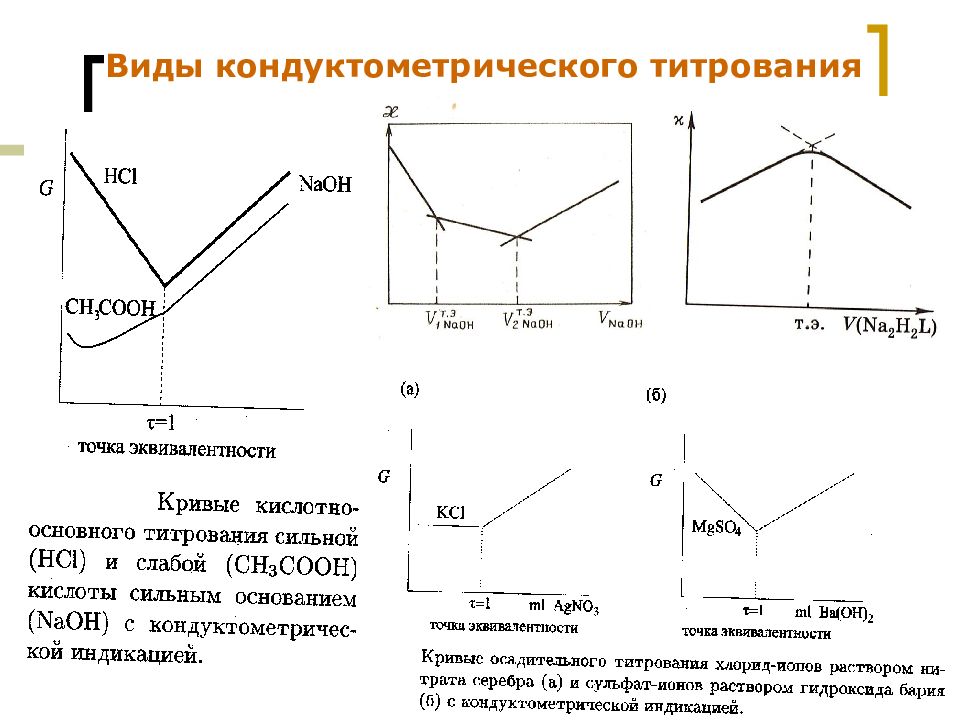
Слайд 50: Кондуктометрическое титрование
МККОС. Л.К. № 9. Попова Людмила Федоровна 50 Кондуктометрическое титрование