Первый слайд презентации: Электродные потенциалы
Лектор доцент кафедры общей химии к.х.н. Оксененко О. И. Курский государственный медицинский университет Кафедра общей химии http://www.analyticaexpo.ru/2003/images/productions/file1011.jpg
Слайд 2
Теории возникновения потенциалов Осмотическая теория (Нернст) Электродный потенциал определяется скачком потенциала на границе металл-раствор. Потенциал возникает только в результате обмена ионами между металлом и раствором. Движущими силами обмена ионами являются осмотическое давление растворенного вещества и электрохимическая упругость растворения металла Р. >P – наблюдается переход ионов из раствора на металл; электрод заряжается положительно. <P – ионы переходят из металла в раствор; электрод заряжается отрицательно. Возможны ситуации
Слайд 3
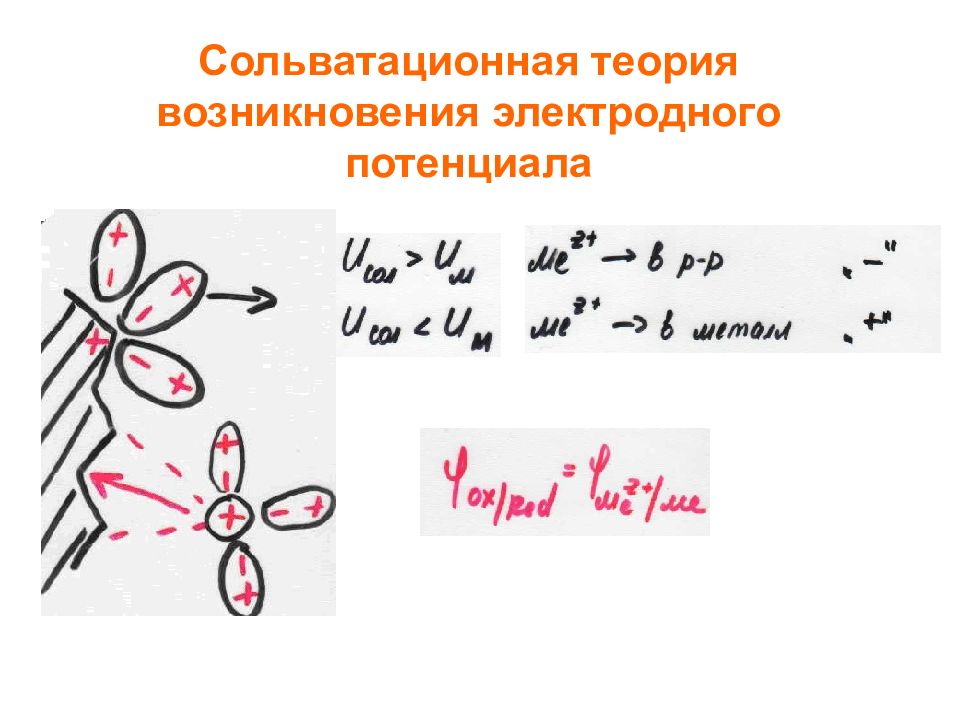
Теории возникновения потенциалов Сольватационная теория (Писаржевский, Изгарышев, Герни) Скачок потенциала на границе раствор-металл вызван: Ионизацией атомов металла на ионы и электроны внутри металла: M M z+ + ze. Определяется U M Сольватацией ионов металла, находящихся на его поверхности, при соприкосновении с молекулами растворителя: M z+ + nL M z+ nL. Определяется U solv. U M >U solv – наблюдается переход ионов из раствора на металл; электрод заряжается положительно. U M <U solv – ионы переходят из металла в раствор; электрод заряжается отрицательно. Возможны ситуации
Слайд 4
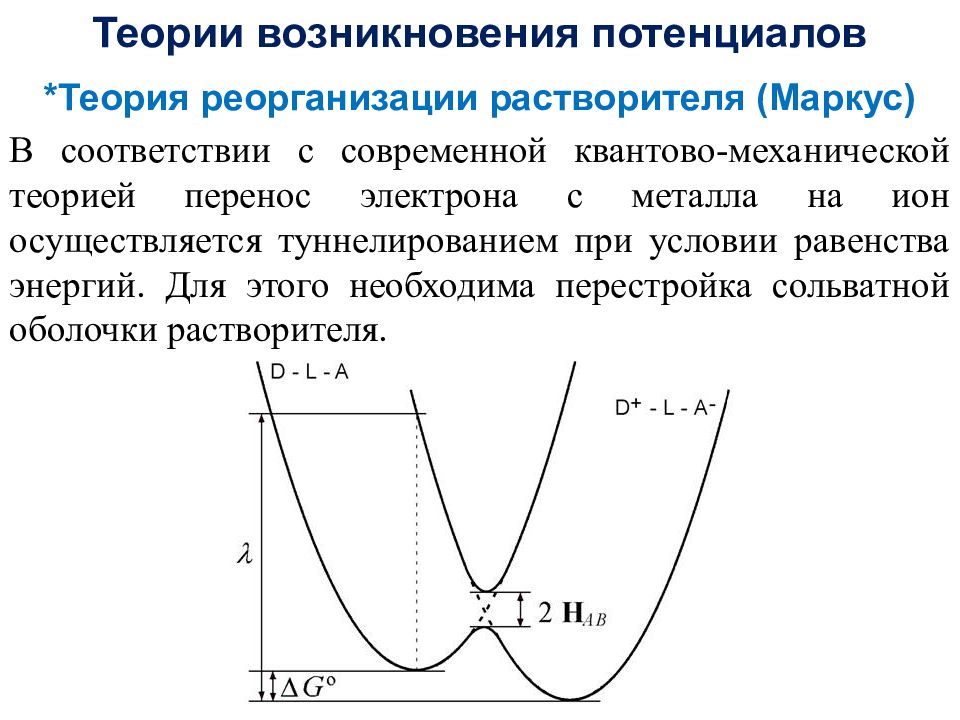
Теории возникновения потенциалов *Теория реорганизации растворителя (Маркус) В соответствии с современной квантово-механической теорией перенос электрона с металла на ион осуществляется туннелированием при условии равенства энергий. Для этого необходима перестройка сольватной оболочки растворителя.
Слайд 5
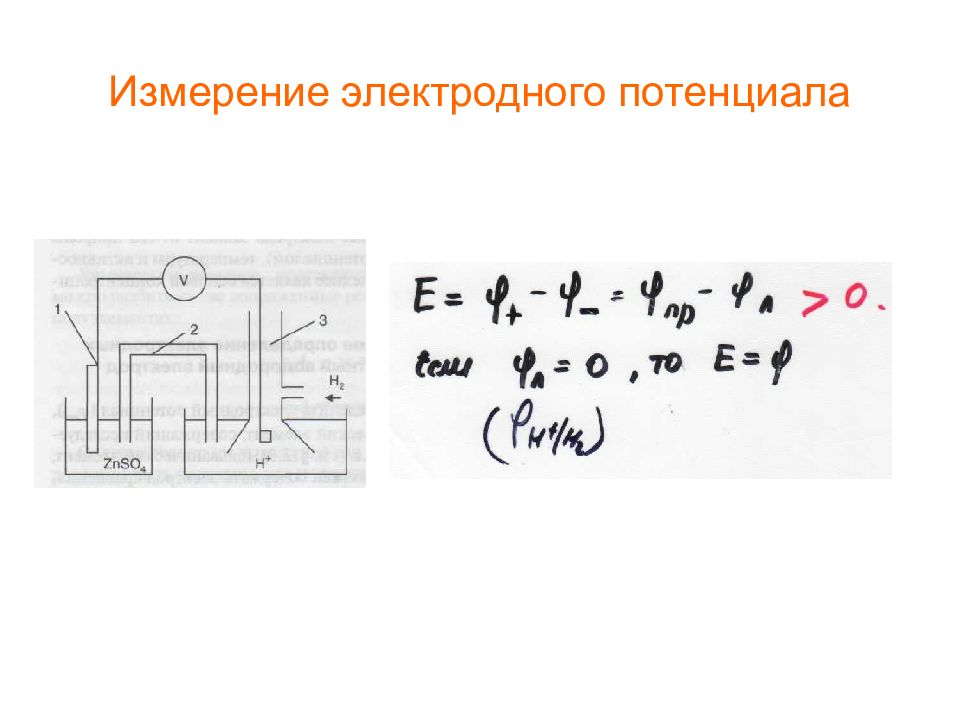
* Электродный потенциал Таким образом, условием равновесия электрохимических систем является равенство электрохимических потенциалов заряженных частиц в контактирующих фазах. Химический потенциал иона в металле ( II ) является постоянной величиной, а химический потенциал иона в растворе. Тогда
Слайд 8: Электродный потенциал
Зависит: 1) от природы электрода, 2) температуры, 3) активности (или концентрации) ионов, относительно которых электрод обратим.
Слайд 11: Стандартный электродный потенциал ( φ 0 )
- потенциал, возникающий на границе металл/раствор его соли, измеренный относительно стандартного водородного электрода при концентрации ионов металла 1 моль/л и р=1 атм (101 325 Па). (характеризует электрохимическую активность электрода) Зависит 1) от природы электрода, 2) температуры, 3) природы растворителя.
Слайд 12: Потенциал водородного электрода
при стандартных условиях (p = 1 атм, [H+] = 1 моль/л ) и T = 298 К равен 0 В.
Слайд 14: Классификация электродов
I. По механизму возникновения электродного потенциала: 1. Электроды I рода 2. Электроды II рода 3. Окислительно-восстановительные электроды 4. Ионоселективные электроды
Слайд 15
II. По применению выделяют : 1. Электроды сравнения(вспомогательные) - электроды, потенциал которых известен и не зависит от концентрации определяемых ионов. Примеры: СВЭ, каломельный, хлорсеребряный. 2. Индикаторные электроды (измерительные, определения) - электроды, потенциал которых зависит от концентрации определяемых ионов. Примеры: водородный электрод определения, хингидронный электрод, стеклянный электрод.
Слайд 16
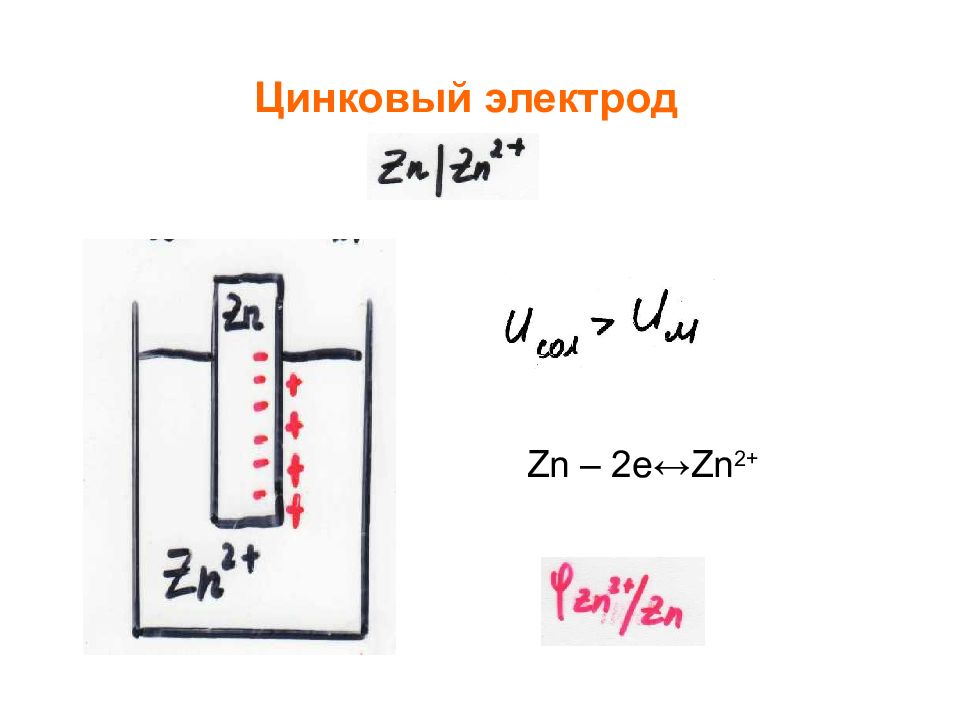
- электроды, обратимые относительно или катиона или аниона. обратимые относительно катиона : Пример - цинковый электрод, водородный электрод обратимые относительно аниона, Пример, хлорный электрод Электроды I рода
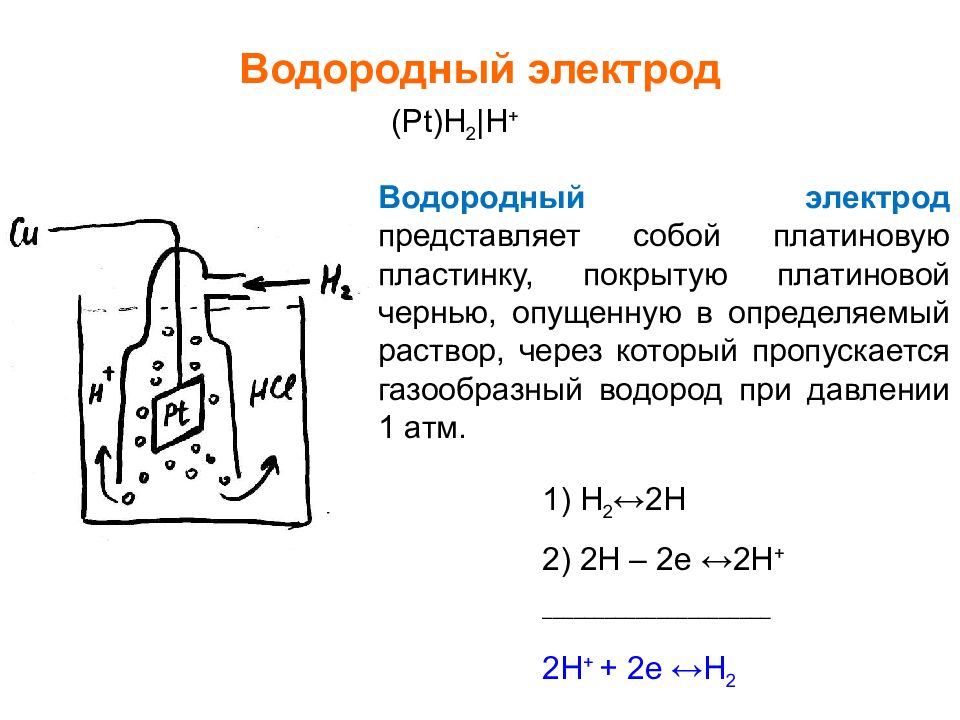
Слайд 17: Водородный электрод
( Pt ) H 2 | H + Водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью, опущенную в определяемый раствор, через который пропускается газообразный водород при давлении 1 атм. 1) H 2 ↔2H 2) 2H – 2e ↔2H + ______________________ 2H + + 2e ↔H 2
Слайд 18
Как электрод определения: Как электрод сравнения: В стандартном водородном электроде используется раствор H 2 SO 4 с активностью ионов Н + = 1 моль/л. Потенциал такого электрода при любой температуре принят равным 0 В.
Слайд 19: Электроды II рода -
это электроды, которые можно рассматривать обратимыми как к катиону, так и к аниону. Они состоят из металла, покрытого слоем малорастворимой соли этого металла и опущенного в раствор хорошо растворимой соли, имеющей общий анион с малорастворимой солью. Примеры: каломельный и хлоридсеребряный электроды.
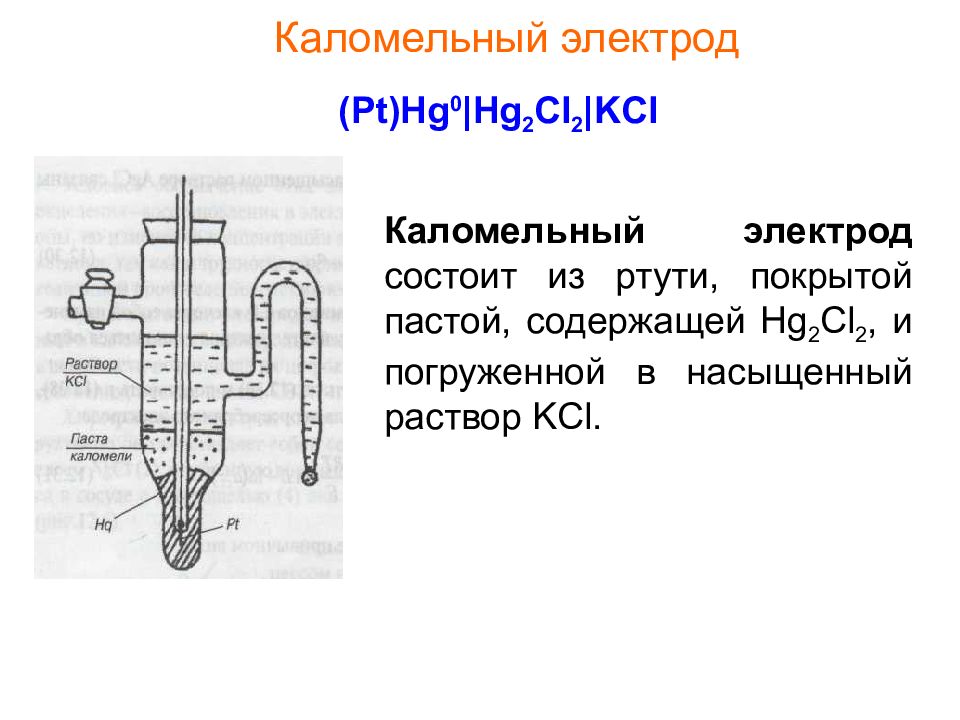
Слайд 20: Каломельный электрод
( Pt)Hg 0 |Hg 2 Cl 2 |KCl Каломельный электрод состоит из ртути, покрытой пастой, содержащей Hg 2 Cl 2, и погруженной в насыщенный раствор KCl.
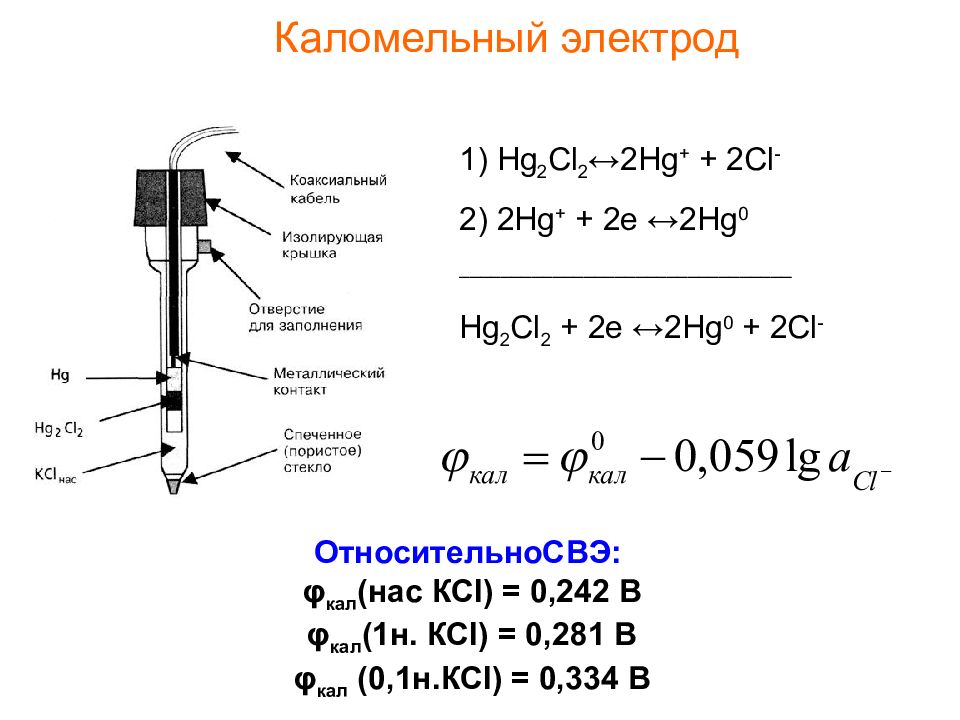
Слайд 21: Каломельный электрод
ОтносительноСВЭ: φ кал (нас КС l ) = 0,242 В φ кал (1н. КС l ) = 0,281 В φ кал (0,1н.КС l ) = 0,334 В 1) Hg 2 Cl 2 ↔2Hg + + 2Cl - 2) 2Hg + + 2e ↔2Hg 0 ________________________________ Hg 2 Cl 2 + 2e ↔2Hg 0 + 2Cl -
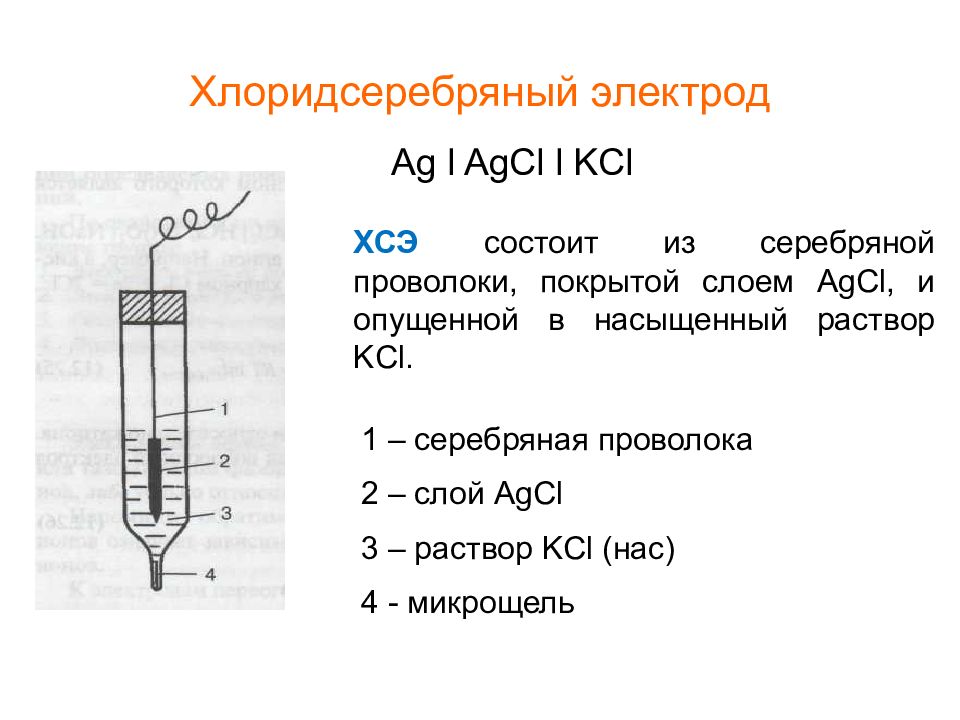
Слайд 22: Хлоридсеребряный электрод
Ag l AgCl l KCl 1 – серебряная проволока 2 – слой AgCl 3 – раствор KCl ( нас) 4 - микрощель ХСЭ состоит из серебряной проволоки, покрытой слоем AgCl, и опущенной в насыщенный раствор KCl.
Слайд 23: Хлоридсеребряный электрод
1) Ag + + e ↔Ag 2) AgCl ↔ Ag + + Cl - _____________________________ AgCl + e ↔ Ag + Cl - φ хс = φ хс 0 – 0,059 lg a Cl - При t = 25 0 C, KCl ( нас) φ хс = 0,222 В относительно СВЭ
Слайд 24
Окислительно-восстановительные (редокс) электроды Окислительно-восстановительными называют электроды, материал которых не участвует в потенциалопределяющих реакциях. Они состоят из инертного металла (платины), погруженного в раствор, в котором происходит окислительно-восстановительная реакция. Например, Sn 4+, Sn 2+ Pt или MnO 4 , MnO 4 2 Pt Уравнение Нернста-Петерса:
Слайд 25
Окислительно-восстановительные электроды Fe 3+, Fe 2+ l (Pt) Fe 3+ + e ↔ Fe 2+
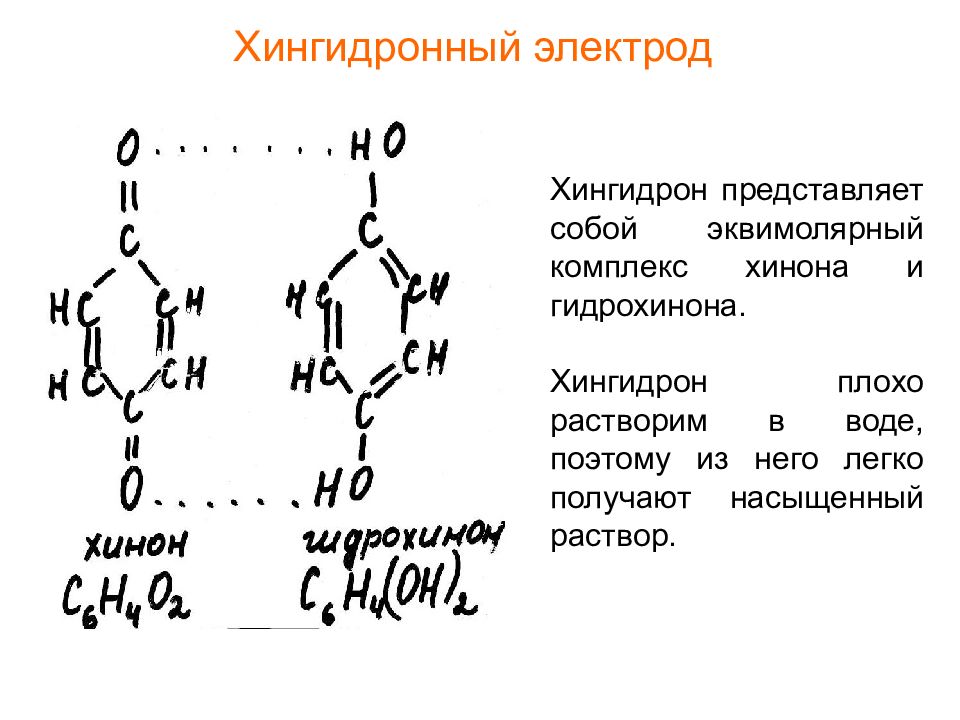
Слайд 26: Хингидронный электрод
Хингидрон представляет собой эквимолярный комплекс хинона и гидрохинона. Хингидрон плохо растворим в воде, поэтому из него легко получают насыщенный раствор.
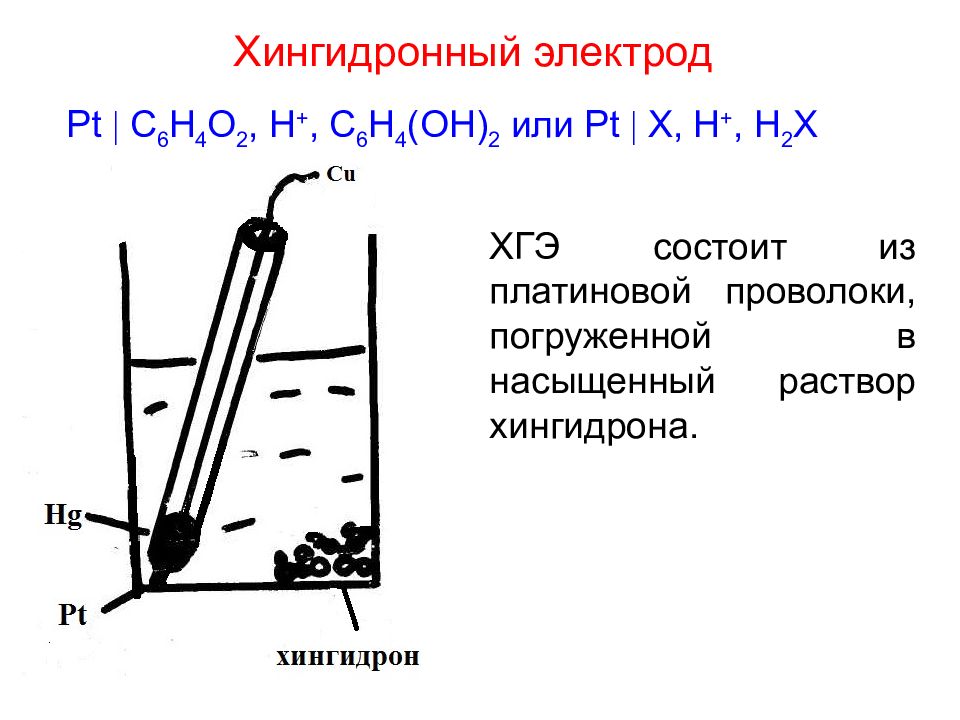
Слайд 27: Хингидронный электрод
ХГЭ состоит из платиновой проволоки, погруженной в насыщенный раствор хингидрона. Pt C 6 H 4 O 2, H +, C 6 H 4 (OH) 2 или Pt X, H +, H 2 X
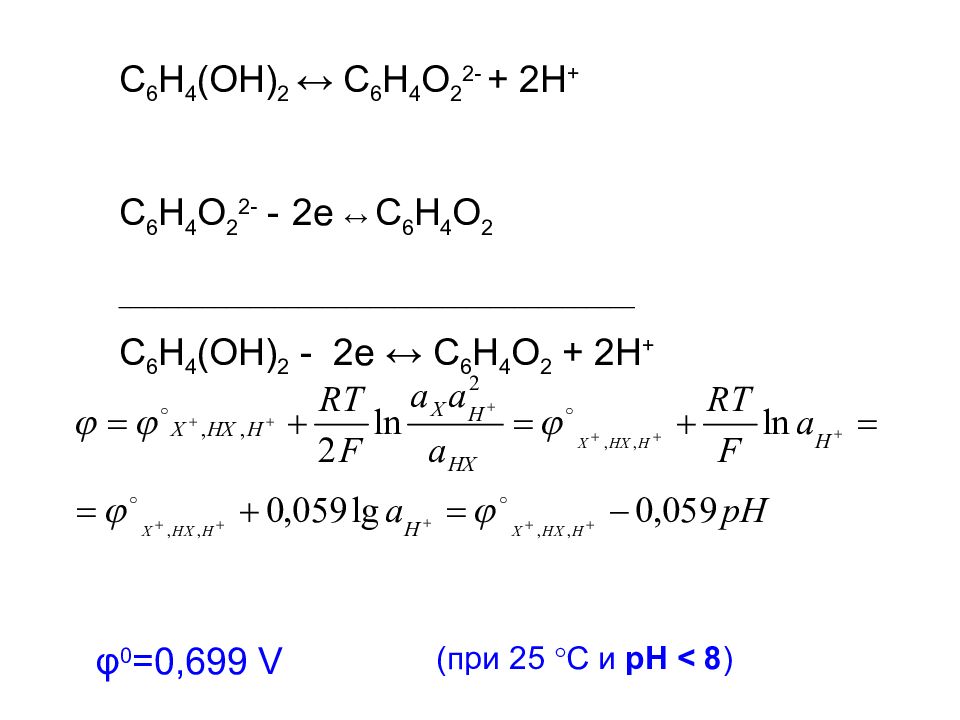
Слайд 28
C 6 H 4 (OH) 2 ↔ C 6 H 4 O 2 2- + 2H + C 6 H 4 O 2 2- - 2e ↔ C 6 H 4 O 2 ___________________________________________ C 6 H 4 (OH) 2 - 2e ↔ C 6 H 4 O 2 + 2H + φ 0 =0,699 V ( при 25 С и рН < 8 )
Слайд 29
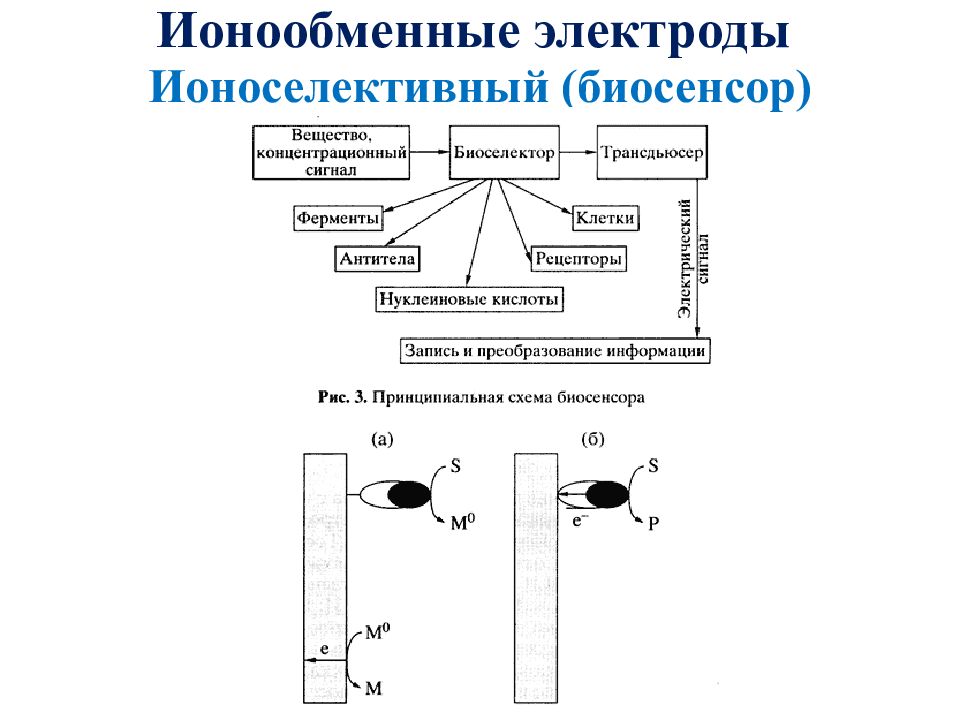
Ионообменные электроды (ионоселективные) http://www.cniga.com.ua/index.files/image43201.jpg состоят из двух фаз: ионита и раствора, а потенциал на границе раздела двух фаз возникает за счет ионообменного процесса. Иониты обладают повышенной избирательной способностью к определенному виду ионов, находящихся в растворе.
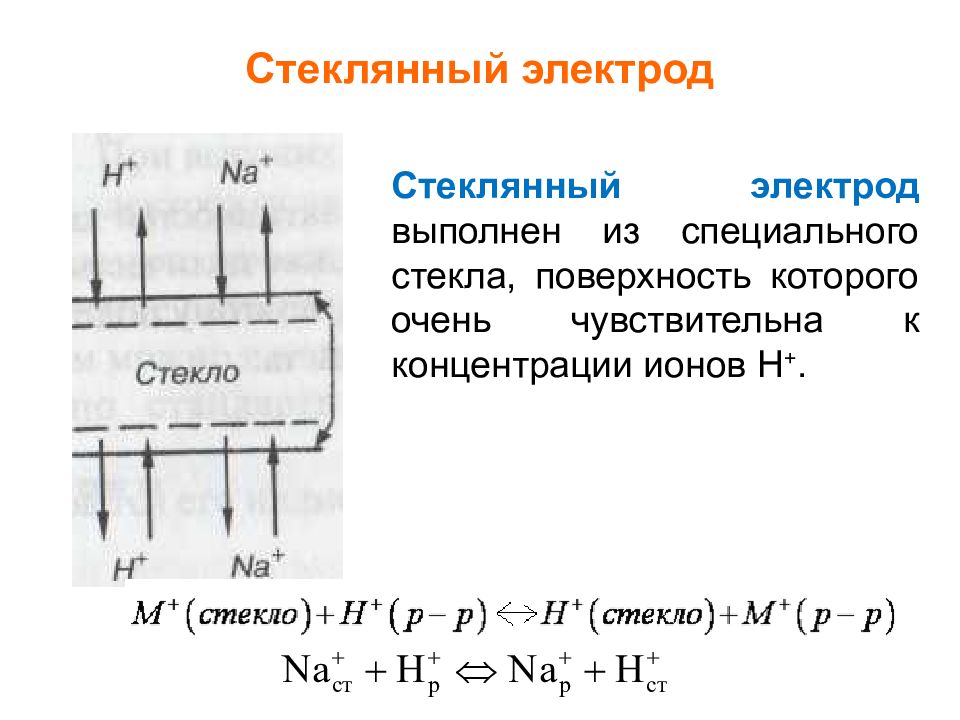
Слайд 30: Стеклянный электрод
Стеклянный электрод выполнен из специального стекла, поверхность которого очень чувствительна к концентрации ионов Н +.
Слайд 31: Стеклянный электрод
При 25 С: Ag | AgCl | HCl (0,1M) | стекло | Н + Он позволяет непосредственно измерять рН среды в диапазоне от 1 до 12.
Слайд 32
Ионообменные электроды Стеклянный Мембрана стеклянного электрода имеет избирательную адсорбционную активность по отношению к иону Н +. Потенциал мембраны измеряется с помощью двух одинаковых электродов сравнения: внутреннего и внешнего. Электрод широко используется для определения рН различных жидкостей, как в аналитической, так и в медико-санитарной практике.
Слайд 33
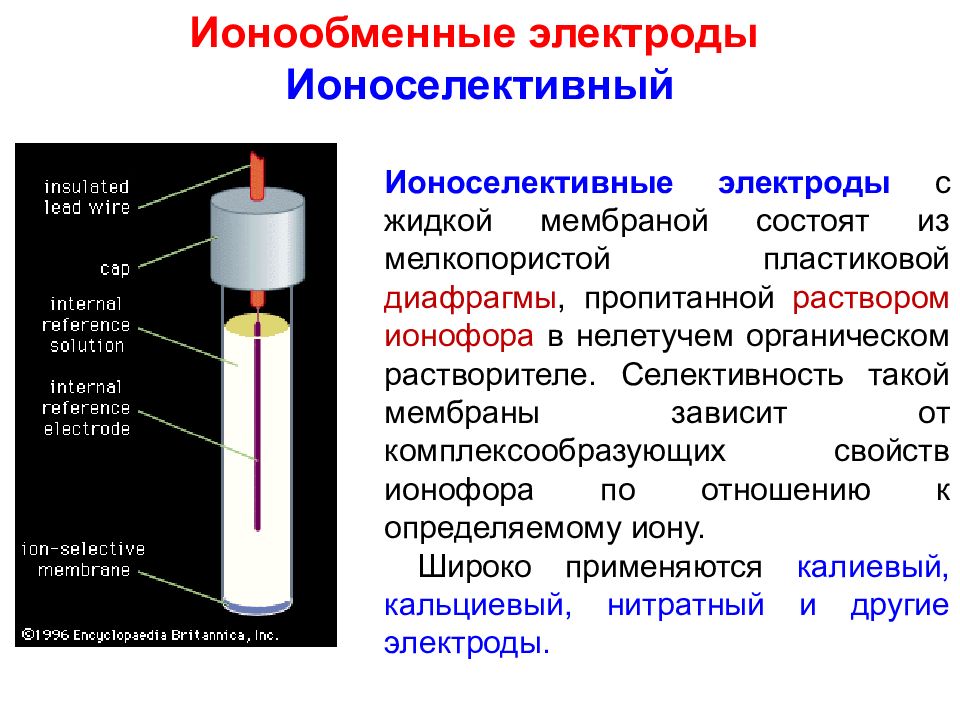
Ионообменные электроды Ионоселективный Ионоселективные электроды с жидкой мембраной состоят из мелкопористой пластиковой диафрагмы, пропитанной раствором ионофора в нелетучем органическом растворителе. Селективность такой мембраны зависит от комплексообразующих свойств ионофора по отношению к определяемому иону. Широко применяются калиевый, кальциевый, нитратный и другие электроды.
Слайд 35: Потенциометрия
Лектор доцент кафедры общей химии к.х.н. Оксененко О. И. Курский государственный медицинский университет Кафедра общей химии
Слайд 36: Потенциометрия
метод физико-химического анализа, основанный на экспериментальном определении равновесных электродных потенциалов с помощью измерения эдс соответствующих электрохимических цепей.
Слайд 38: Применение потенциометрии
Определение рН, с и γ, т/д параметров химической реакции, растворимости малорастворимых веществ и др.
Слайд 39: Преимущества потенциометрического метода:
точность; быстрота; возможность автоматизации; возможность работы в мутных и окрашенных средах; посторонние электролиты не мешают определению.
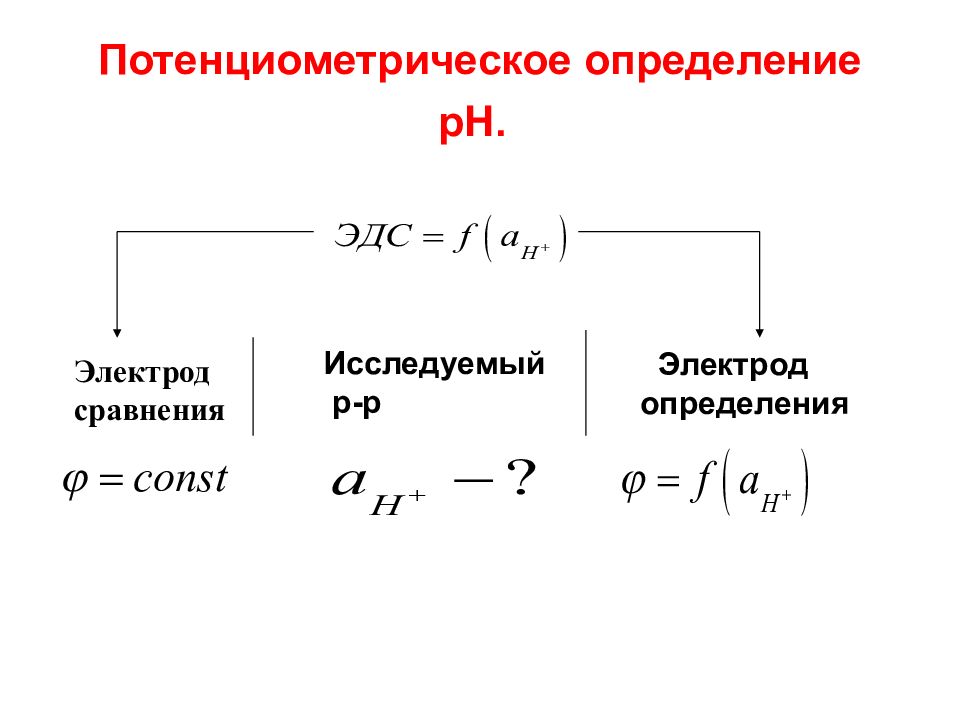
Слайд 41: Потенциометрическое определение рН
Электрод сравнения Исследуемый р-р Электрод определения
Слайд 43: Электрод сравнения—каломельный Индикаторный ЭД – водородный
Из справочника:
Слайд 44: Электрод сравнения – каломельный Индикаторный электрод – хингидронный
Справочные данные:
Слайд 45: Электрод сравнения – хлоридсеребряный Индикаторный электрод – стеклянный
Внутренний ЭД сравнения Внешний ЭД сравнения
Слайд 46: Определение термодинамических параметров химических реакций
1. Определение изменения энергии Гиббса
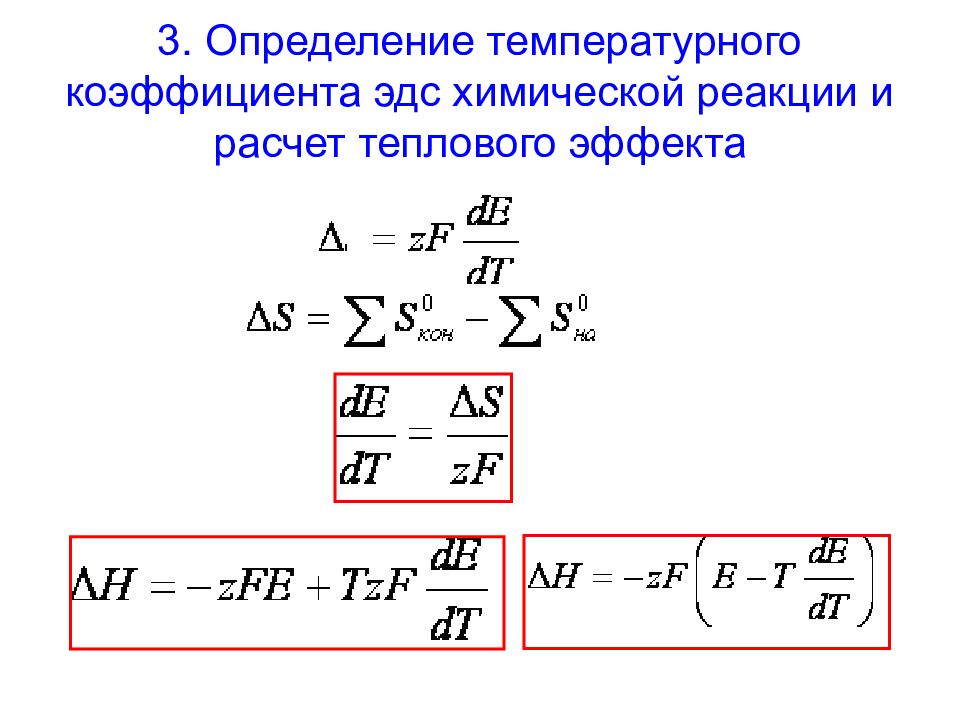
Слайд 48: 3. Определение температурного коэффициента эдс химической реакции и расчет теплового эффекта
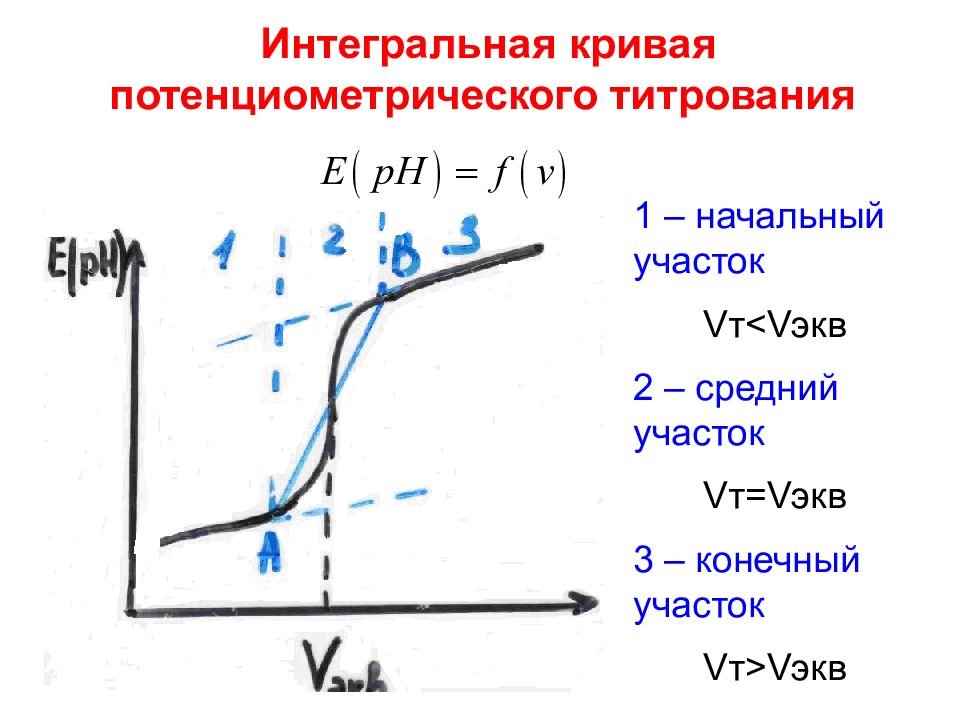
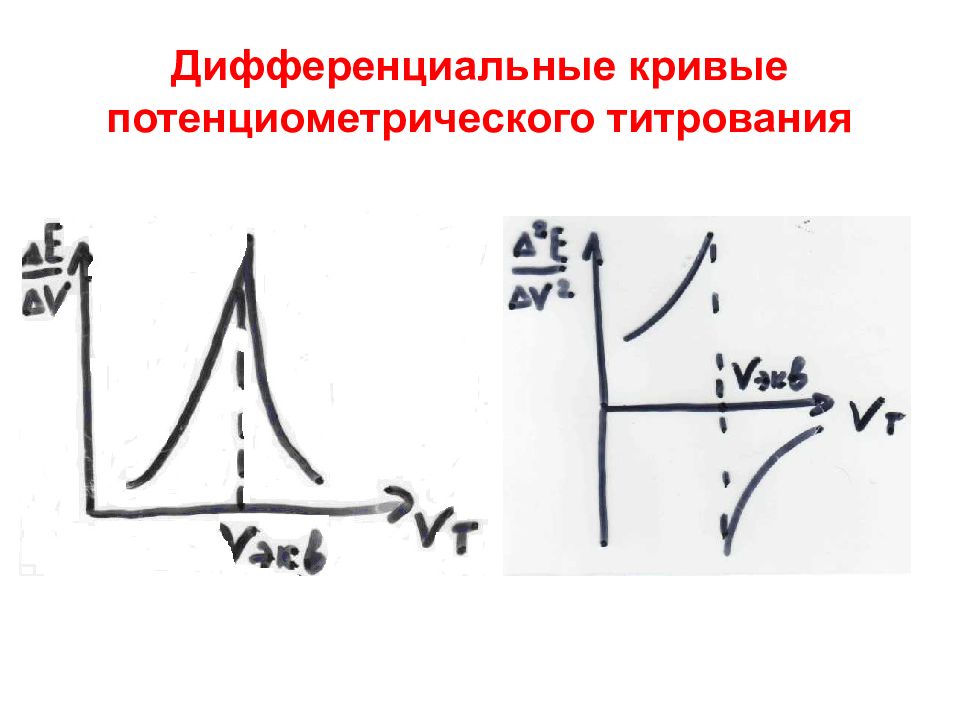
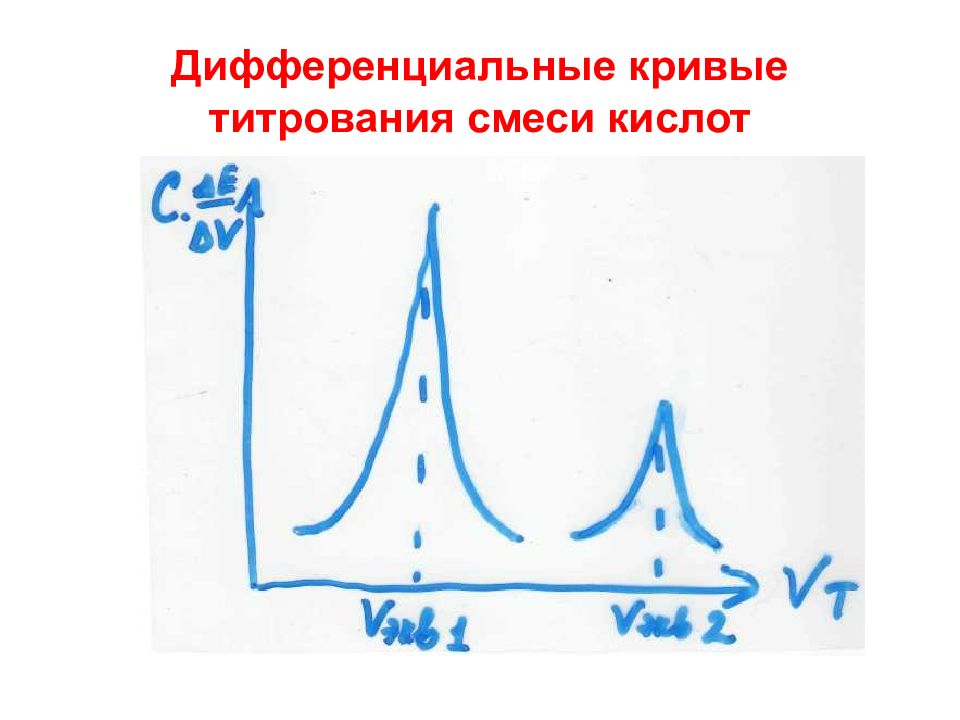
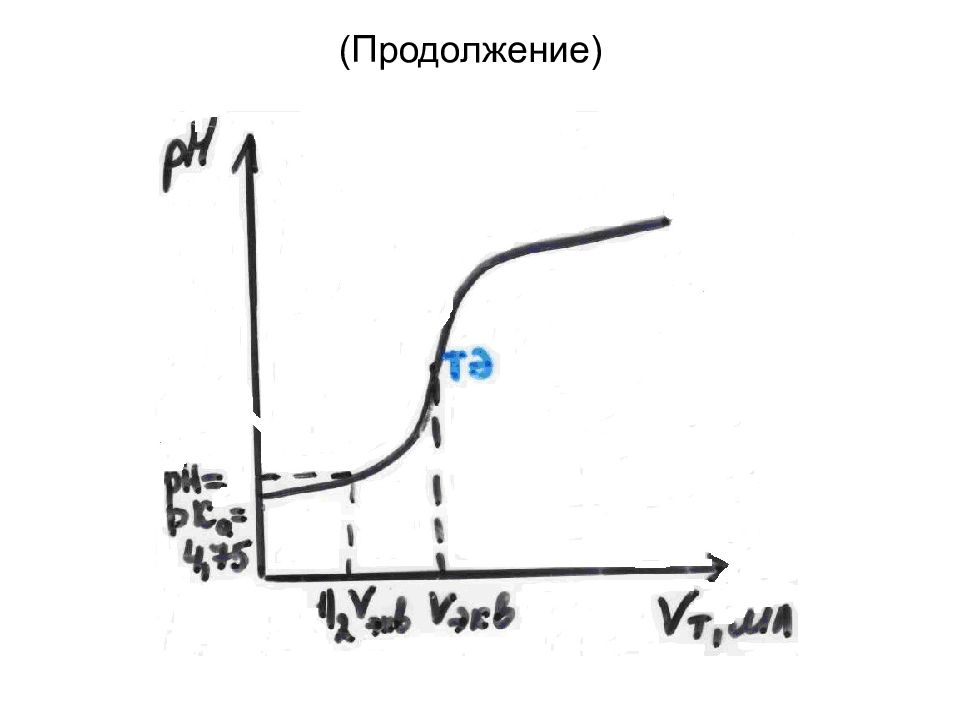
Слайд 49: Интегральная кривая потенциометрического титрования
1 – начальный участок V т <V экв 2 – средний участок V т= V экв 3 – конечный участок V т >V экв
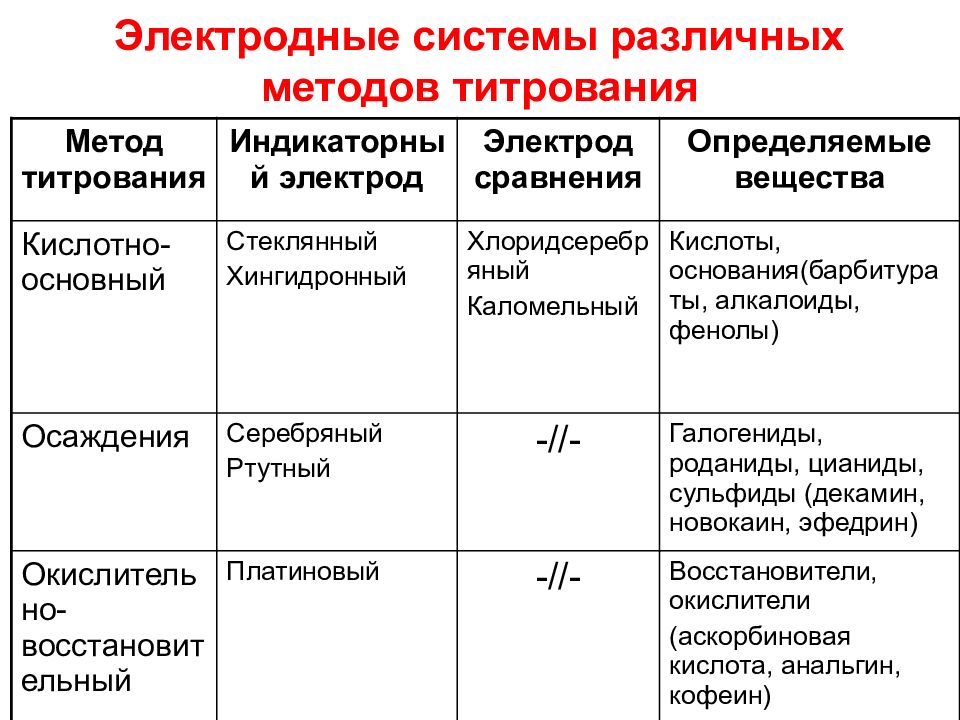
Слайд 53: Электродные системы различных методов титрования
Метод титрования Индикаторный электрод Электрод сравнения Определяемые вещества Кислотно-основный Стеклянный Хингидронный Хлоридсеребряный Каломельный Кислоты, основания(барбитураты, алкалоиды, фенолы) Осаждения Серебряный Ртутный -//- Галогениды, роданиды, цианиды, сульфиды (декамин, новокаин, эфедрин) Окислительно-восстановительный Платиновый -//- Восстановители, окислители (аскорбиновая кислота, анальгин, кофеин)
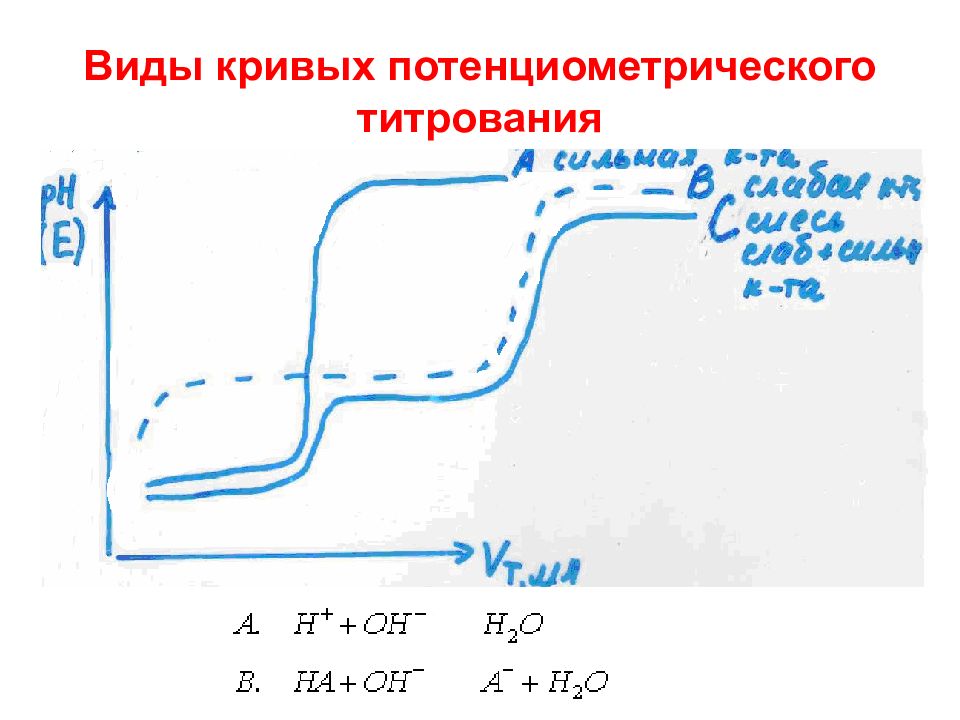
Слайд 54: Определение Кд слабой кислоты методом потенциометрического титрования
CH 3 COOH + NaOH = CH 3 COONa + H 2 O CH 3 COOH + OH - = CH 3 COO - + H 2 O
Слайд 56: Список литературы
1. Физическая и коллоидная химия: Учебник/Под ред. Проф. А.П. Беляева. - М.: ГЭОТАР-Медиа, 2008.-704с. 2. Физическая химия. В 2 кн. Кн.1/Под ред. К.С. Краснова - М: Высшая школа, 2001.-512с.