Первый слайд презентации
Химия неметаллов. Общая характеристика. Лекция № 13 VIIA, VIA, VA подгруппы
Слайд 2
VII А подгруппа - галогены F [He] 2s 2 2p 5 Cl [Ne] 3s 2 3p 5 Br [Ar] 3d 10 4s 2 4p 5 I [Kr] 4d 10 5s 2 5p 5 At [Xe] 4f 14 5d 10 6s 2 6p 5 Эл. строение r ат ЭО ns 2 np 5 - I - I, I, III, (IV), V, (VI), VII - I, I, III, V, VII - I, I, III, V, VII Степени окисления
Слайд 3
О [He] 2s 2 2p 4 S [Ne] 3s 2 3p 4 Se [Ar] 3d 10 4s 2 4p 4 Te [Kr] 4d 10 5s 2 5p 4 Po [Xe] 4f 14 5d 10 6s 2 6p 4 Эл. строение r ат ЭО VI А подгруппа - халькогены …n s 2 n p 4 - II, ( -I ) - II, ( -I ), IV, VI II, IV Степени окисления
Слайд 4
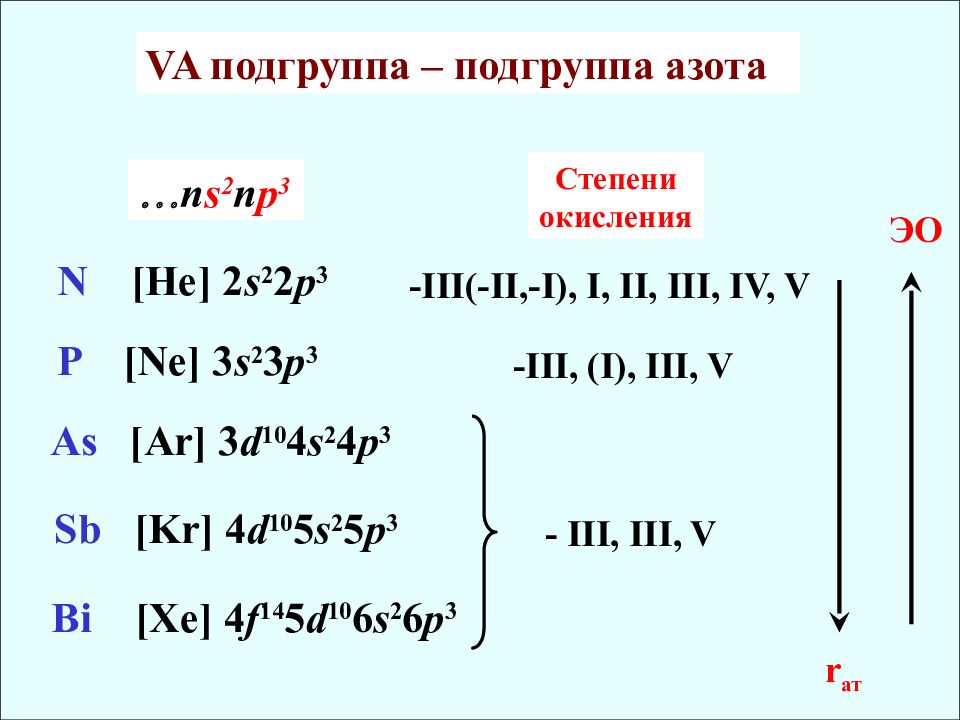
N [He] 2 s 2 2 p 3 P [Ne] 3 s 2 3 p 3 As [Ar] 3 d 10 4 s 2 4 p 3 Sb [Kr] 4 d 10 5 s 2 5 p 3 Bi [Xe] 4 f 14 5 d 10 6 s 2 6 p 3 Степени окисления -III(-II,-I), I, II, III, IV, V - III, III, V r ат ЭО - III, (I), III, V n s 2 n p 3 VA подгруппа – подгруппа азота
Слайд 5
Физические свойства галогенов I 2( к) I 2( г) газы жёлто-зелёного цвета F 2( г), Cl 2( г) Фтор – трудносжижаемый газ, t кип = -188 ºC Хлор – легко сжижается, t кип = -34 º С Br 2( ж) Красно-коричневая жидкость с тяжелыми коричневыми парами t кип = - 59,8 °С Блестящие темно-фиолетовые кристаллы Твердое вещество
Слайд 6
Озон O 3 – бесцветный токсичный газ с характерным резким запахом жидкий кислород t кип = –183 °C Кислород O 2 - газ без запаха, без цвета Физические свойства халькогенов
Слайд 7
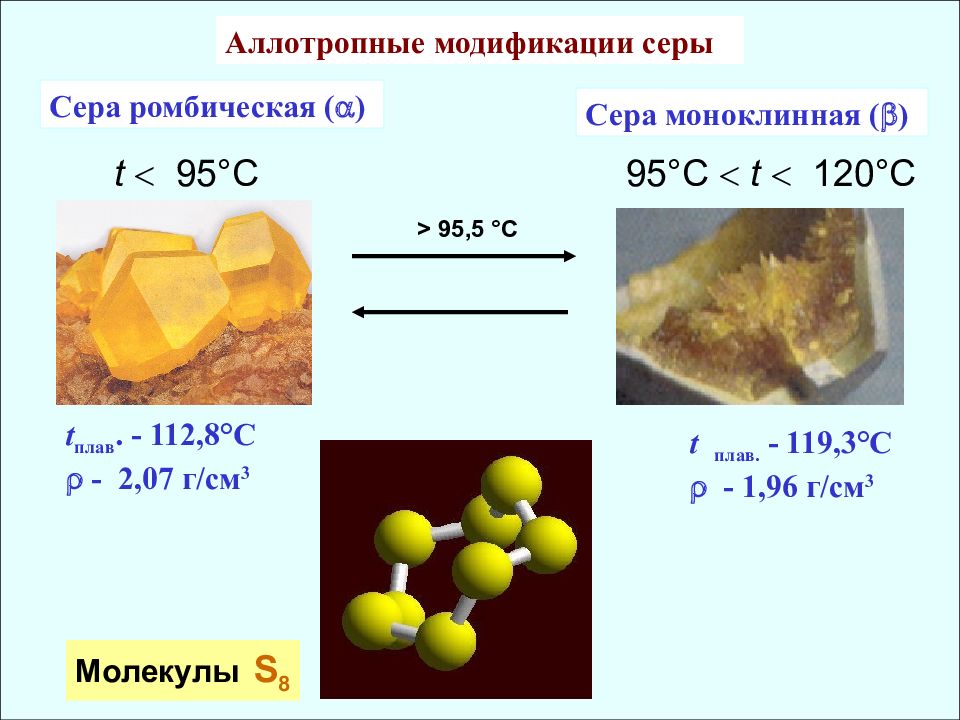
Сера ромбическая ( ) t 95 °C Молекулы S 8 95 °C t 120°C Сера моноклинная ( ) t плав. - 112,8° С - 2,07 г / см 3 t плав. - 119,3°C - 1,96 г / см 3 > 95,5 °C Аллотропные модификации серы
Слайд 8
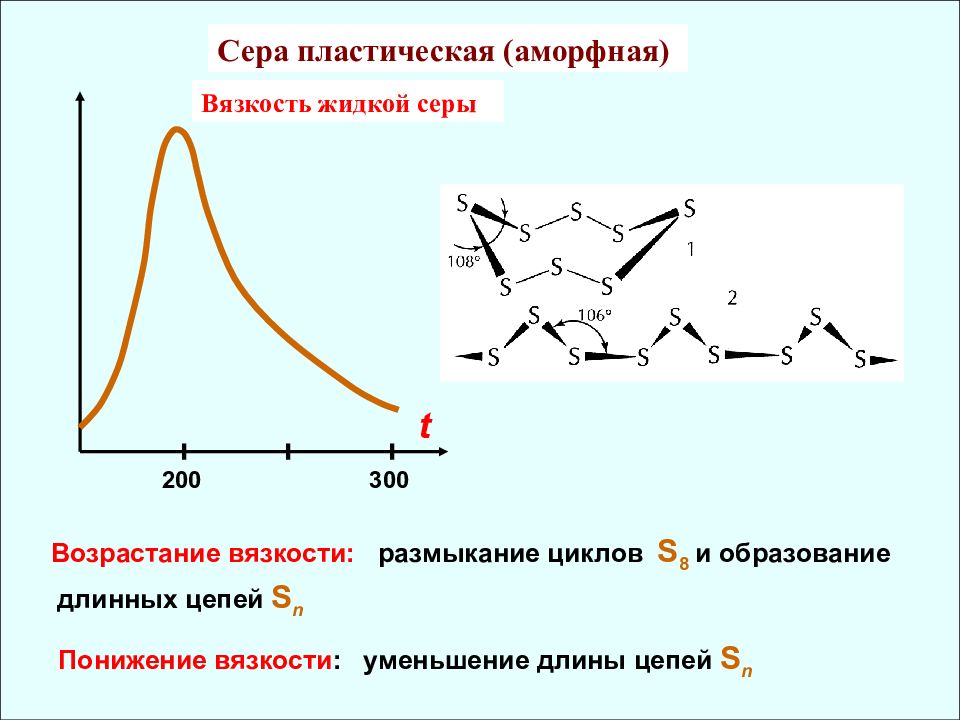
Вязкость жидкой серы t 200 300 Возрастание вязкости: размыкание циклов S 8 и образование длинных цепей S n Понижение вязкости : уменьшение длины цепей S n Сера пластическая (аморфная)
Слайд 9
N 2 - газ жидкий азот T кип = –196 °C содержат в сосудах Дьюара Физические свойства азота 80 % (по объёму) N 2 в воздухе NaNO 3 - чилийская селитра
Слайд 10
Химические свойства галогенов Все галогены - типичные окислители, их активность уменьшается при переходе от фтора к иоду C металлами : 2Al + 3F 2 2AlF 3 + Q 3Cl 2 + 2Al 2AlCl 3 + Q Br 2 + Al AlBr 3 C неметаллами : F 2 + Si SiF 4 H 2 + F 2 HF H 2 + Cl 2 2HCl Br 2 + H 2 2HBr I 2 + H 2 2HI Взрыв ! Экзотерм. t – 200-300 ºC t – 5 00- 6 00 ºC
Слайд 11
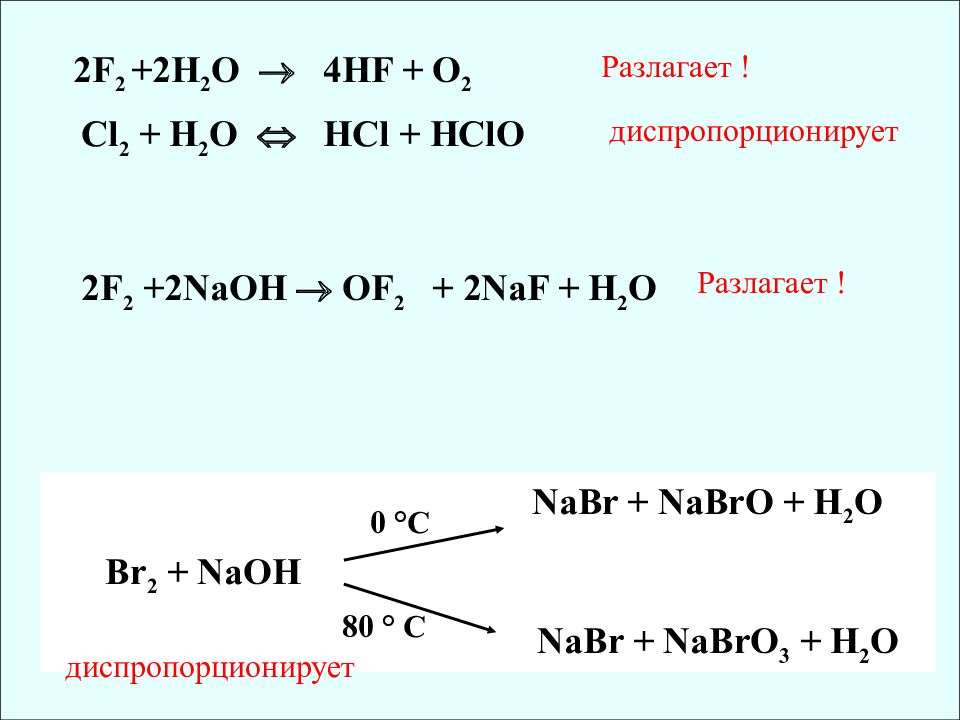
2F 2 +2H 2 O 4HF + O 2 2 F 2 +2NaOH OF 2 + 2NaF + H 2 O Cl 2 + Н 2 О HCl + HClO Разлагает ! диспропорционирует NaBr + NaBrO + H 2 O Br 2 + NaOH NaBr + NaBrO 3 + H 2 O 0 °C 80 ° C Разлагает ! диспропорционирует
Слайд 12
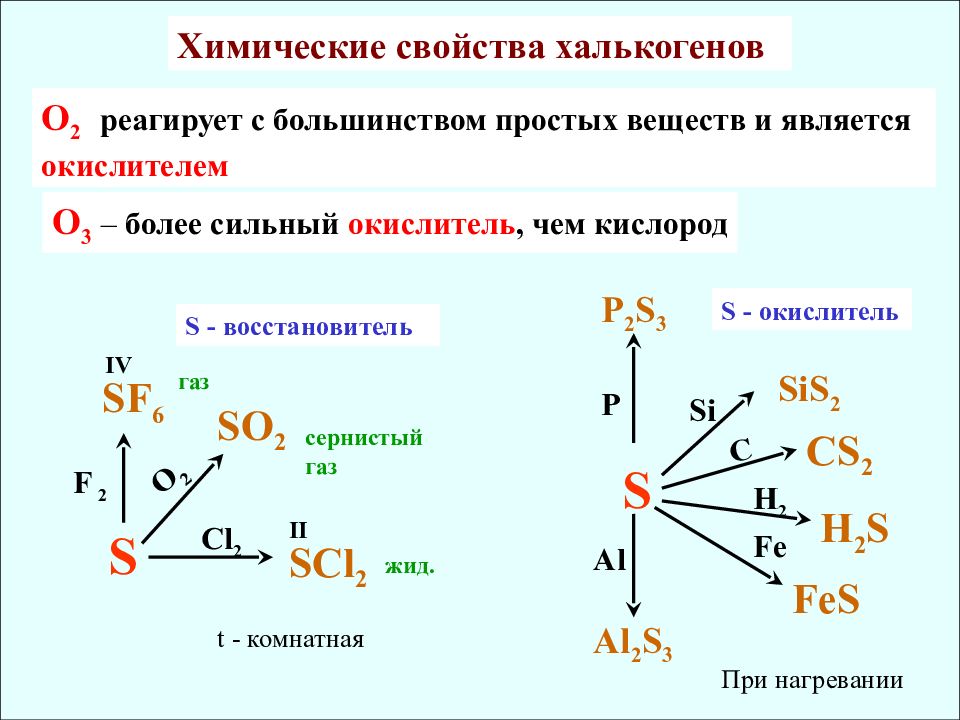
Химические свойства халькогенов O 2 реагирует с большинством простых веществ и является окислителем O 3 – более сильный окислитель, чем кислород S S О 2 SF 6 О 2 F 2 SCl 2 газ сернистый газ С l 2 IV II жид. FeS H 2 S Fe S Н 2 CS 2 C Si SiS 2 P P 2 S 3 Al Al 2 S 3 S - восстановитель S - окислитель t - комнатная При нагревании
Слайд 13
Химические свойства азота АЗОТ – « безжизненный» :N N: Азот - активный неметалл и малоактивное простое вещество из-за высокой прочности тройной связи в молекуле N 2 + O 2 NO N 2 + H 2 NH 3 Li + N 2 Li 3 N N 2 + Na Na 3 N N 2 + Mg Mg 3 N 2 N 2 + Al AlN истинные нитриды Ti + N 2 Ti x N y Zr + N 2 Zr x N y нитриды переменного состава тугоплавкие, коррозионностойкие материалы
Слайд 14
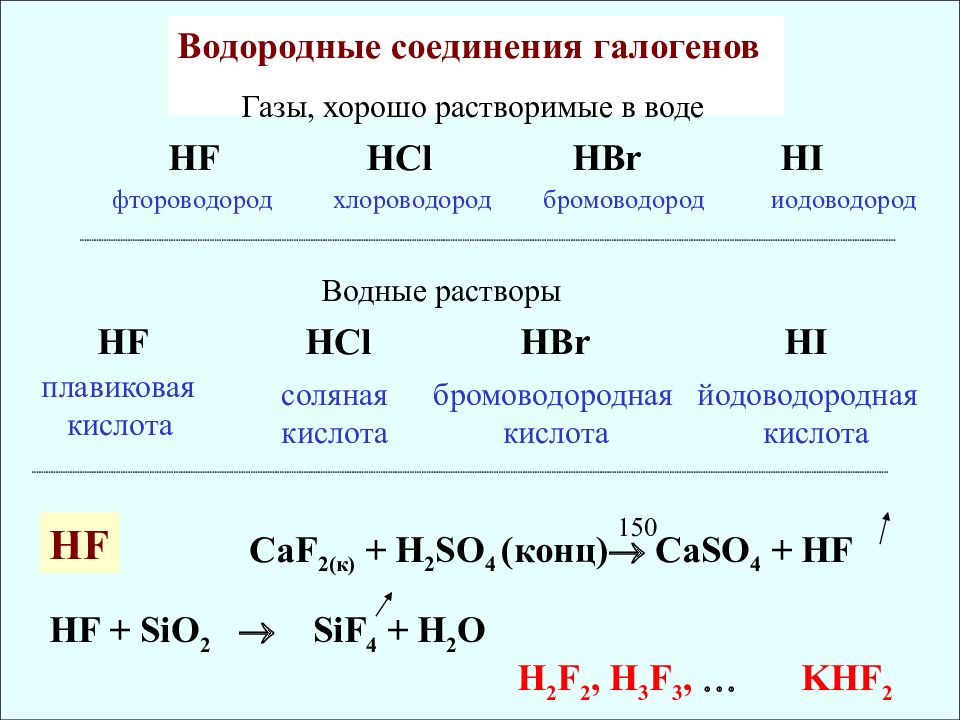
Водородные соединения галогенов HF HCl HBr HI плавиковая кислота соляная кислота бромоводородная кислота йодоводородная кислота Водные растворы HF + SiO 2 SiF 4 + H 2 O KHF 2 H 2 F 2, H 3 F 3, HF HCl HBr HI фтороводород хлороводород бромоводород иодоводород Газы, хорошо растворимые в воде С aF 2( к ) + H 2 SO 4 (конц) CaSO 4 + HF HF 150
Слайд 15
HCl H 2 + Cl 2 HCl ( на свету ) h NaCl( тв.) + H 2 SO 4 ( конц.) = HCl ↑ + Na 2 SO 4 Растворимость HCl в воде велика, в 1 л воды при 25 ° С растворяется 426 л HCl. Максимальная концентрация кислоты составляет 35-38 % HCl конц. + KMnO 4 Cl 2 + HBr и HI – сильные кислоты. В ОВР являются восстановителями : 2Cu 2+ + 4I ˉ = 2CuI + I 2 2Br ˉ + Cl 2 = Br 2 + 2Clˉ 2I ˉ + Br 2 = I 2 + 2Brˉ HCl конц. - сильнейший восстановитель HBr HI
Слайд 16
Большинство солей – хлоридов, бромидов и йодидов хорошо растворимы в воде, фториды хуже. Однако фторид серебра хорошо растворим. Cоли галогенов (галогениды) AgCl AgBr AgI AgF белый кремовый бледно-желтый растворим CuCl PbCl 2 белый белый CuI Pb I 2 белый белый
Слайд 17
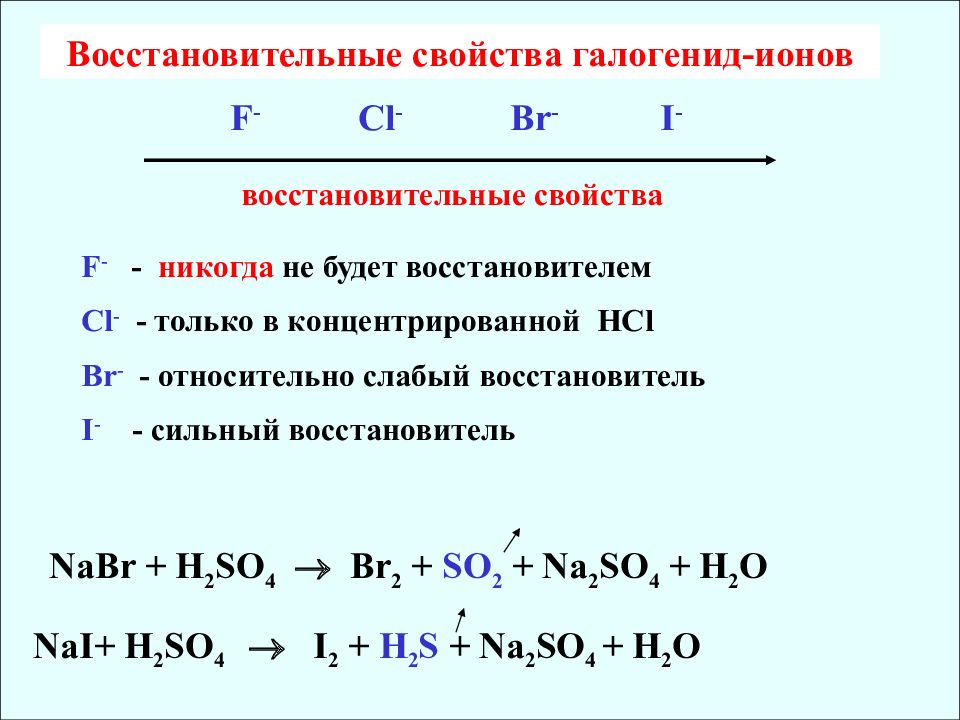
Восстановительные свойства галогенид-ионов F - Cl - Br - I - восстановительные свойства F - - никогда не будет восстановителем Cl - - только в концентрированной HCl Br - - относительно слабый восстановитель I - - сильный восстановитель NaBr + H 2 SO 4 Br 2 + SO 2 + Na 2 SO 4 + H 2 O NaI+ H 2 SO 4 I 2 + H 2 S + Na 2 SO 4 + H 2 O
Слайд 18
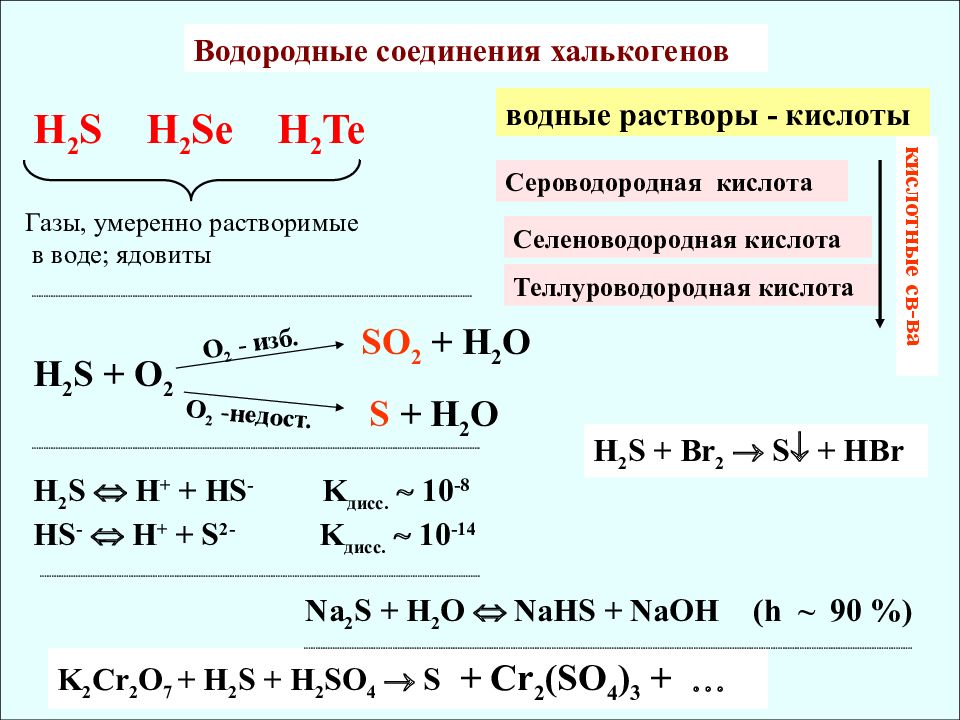
H 2 S H 2 Se H 2 Te Газы, умеренно растворимые в воде; ядовиты Водородные соединения халькогенов водные растворы - кислоты Сероводородная кислота Селеноводородная кислота Теллуроводородная кислота кислотные св-ва H 2 S + O 2 SO 2 + H 2 O S + H 2 O O 2 - изб. O 2 -недост. H 2 S H + + HS - K дисс. 10 -8 HS - H + + S 2- K дисс. 10 -14 Na 2 S + H 2 O NaHS + NaOH (h ~ 90 %) H 2 S + Br 2 S + HBr K 2 Cr 2 O 7 + H 2 S + H 2 SO 4 S + Cr 2 (SO 4 ) 3 +
Слайд 19
Cульфиды черные PbS, С uS, FeS, Ag 2 S, HgS желтые CdS, SnS 2 белы Й ZnS p озовый (телесный) MnS Na 2 S + S = Na 2 S 2 дисульфид натрия ( Na 2 S x ) x - от 2 до 9 Na — S — S — Na C ульфиды – сильные восстановители FeS 2 Полисульфиды
Слайд 20
Аммиак (степень окисления азота - III) Бесцветный газ с резким запахом (запах нашатыря), сжижается при -33, 4°С NH 3 NH 4 Cl + Ca(OH) 2 NH 3 + CaCl 2 + H 2 O ( t = 200 C) При 20 º С в 1 объеме Н 2 О - 70 0 объемов NH 3 ~ 25% р-р 10 %-ный раствор NH 3 – «нашатырный спирт» H 3 N HOH NH 3 • H 2 O водородная связь NH 4 + : NH 3 + H + NH 4 + донорно-акцепторный механизм NH 3 + H 2 O NH 3 • H 2 O NH 4 OH NH 4 + + OH - К дисс 10 -5 рН = 11,8 слабое основание
Слайд 21
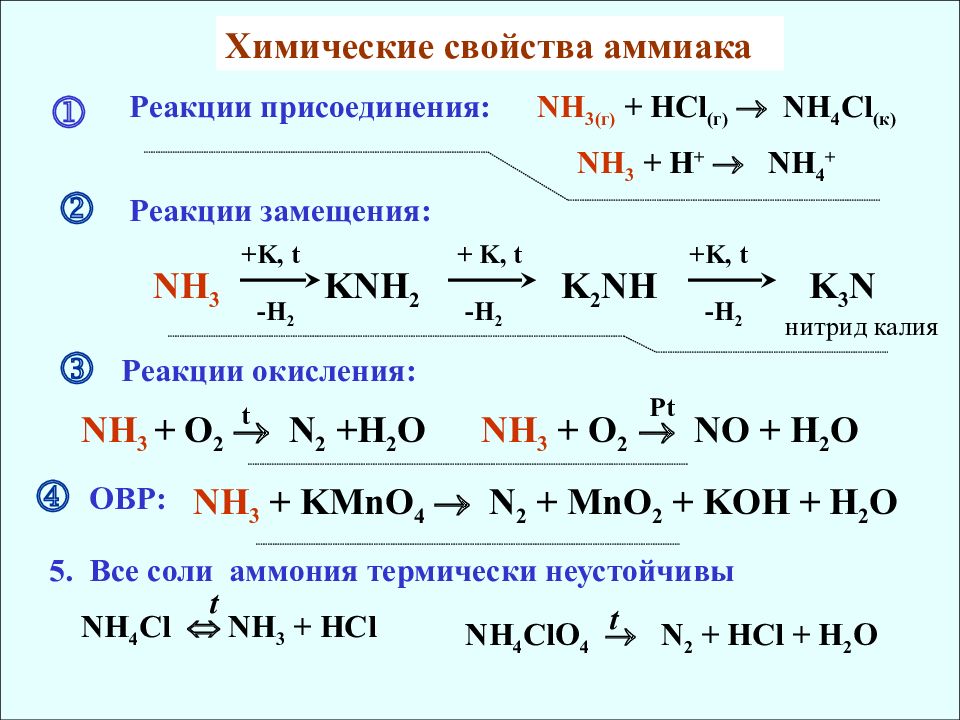
Химические свойства аммиака Реакции присоединения: NH 3( г) + HCl (г) NH 4 Cl (к) NH 3 + H + NH 4 + Реакции замещения: NH 3 KNH 2 +K, t + K, t +K, t -H 2 -H 2 K 2 NH -H 2 K 3 N нитрид калия Реакции окисления: NH 3 + O 2 N 2 +H 2 O t NH 3 + O 2 NO + H 2 O Pt ОВР: NH 3 + KMnO 4 N 2 + MnO 2 + KOH + H 2 O 5. Все соли аммония термически неустойчивы NH 4 Cl NH 3 + HCl t NH 4 ClO 4 N 2 + HCl + H 2 O t
Слайд 22
Дополнительные материалы Лекция № 13 ХИМИЯ НЕМЕТАЛЛОВ ОБЩАЯ ХАРАКТЕРИСТИКА
Слайд 23
Распространение в природе галогенов Cодержание в земной коре, % F Cl Br I At 0,03 0,2 10 -4 10 -5 F флюорит CaF 2 криолит Na 3 AlF 6 фторапатит Ca 5 F(PO 4 ) 3 С l сильвин KCl поваренная соль NaCl бишофит MgCl 2 карналлит MgCl 2 · KCl · 6H 2 O Br бромиды калия, натрия, магния - содержатся в морской воде, в воде озер, в подземных рассолах I водоросли морской воды, подземные воды, соли иодаты, периодаты, сопутствующие другим минералам
Слайд 27
Содержание в земной коре, масс.% О S Se Te Po 4 7, 0 0,05 10 –4 10 – 7 10 –14 Распространение в природе халькогенов
Слайд 28
- макс. содержание на высоте 25 км (озоновый слой). Сера - самородная сера; - минералы двух видов: сульфидные и сульфатные. Кислород - самый распространённый элемент; - входит в состав воды, оксидов кремния и алюминия; - cоставляет 21 % земной атмосферы Озон - c ера встречается в природном газе и сырой нефти
Слайд 29
Селен и теллур - находятся в виде примесей в сульфидных рудах. CaSO 4 2H 2 O - гипс BaSO 4 - барит или тяжелый шпат MgSO 4 7 H 2 O - горькая или английская соль Au 2 Te - калаверит или теллуристое золото FeS 2 - пирит, а также железный или серный колчедан PbS - галенит или свинцовый блеск ZnS - c фалерит или цинковая обманка HgS - киноварь Cu 2 S - халькозин NiS - миллерит С uFeS 2 - халькопирит или медный колчедан Основные минералы серы
Слайд 30
Природные соединения серы Самородная сера Сульфидная руда CuFeS 2 Халькопирит (медный колчедан) Сульфатная руда Гипс CaSO 4 ·2 H 2 O
Слайд 32
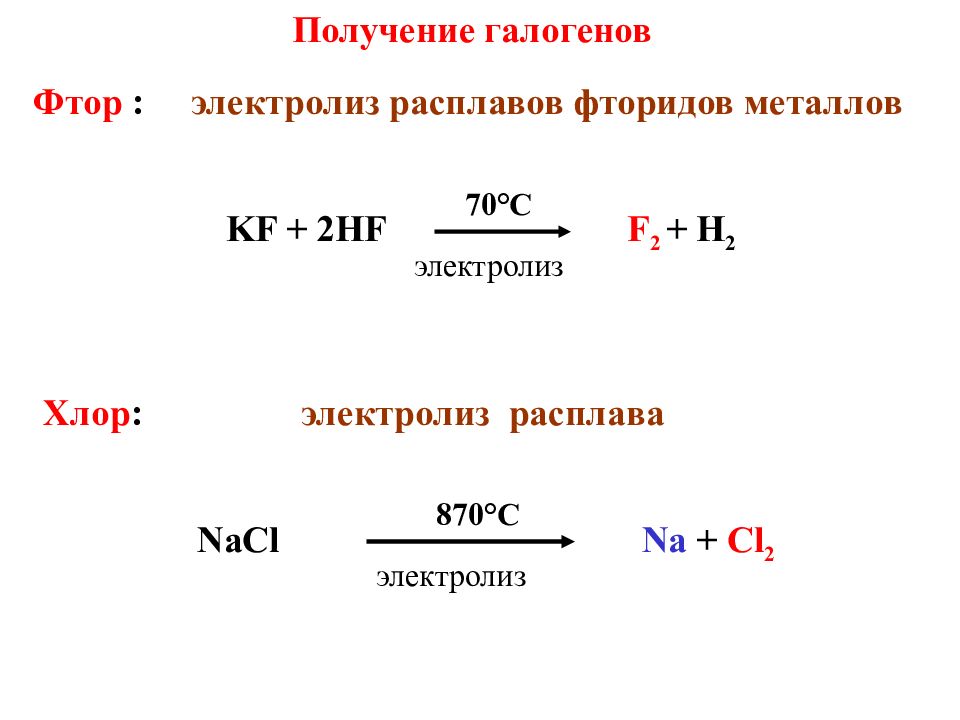
Получение галогенов Фтор : электролиз расплавов фторидов металлов KF + 2HF F 2 + H 2 70°C Хлор : электролиз расплава NaCl Na + Cl 2 870 ° С электролиз электролиз
Слайд 33
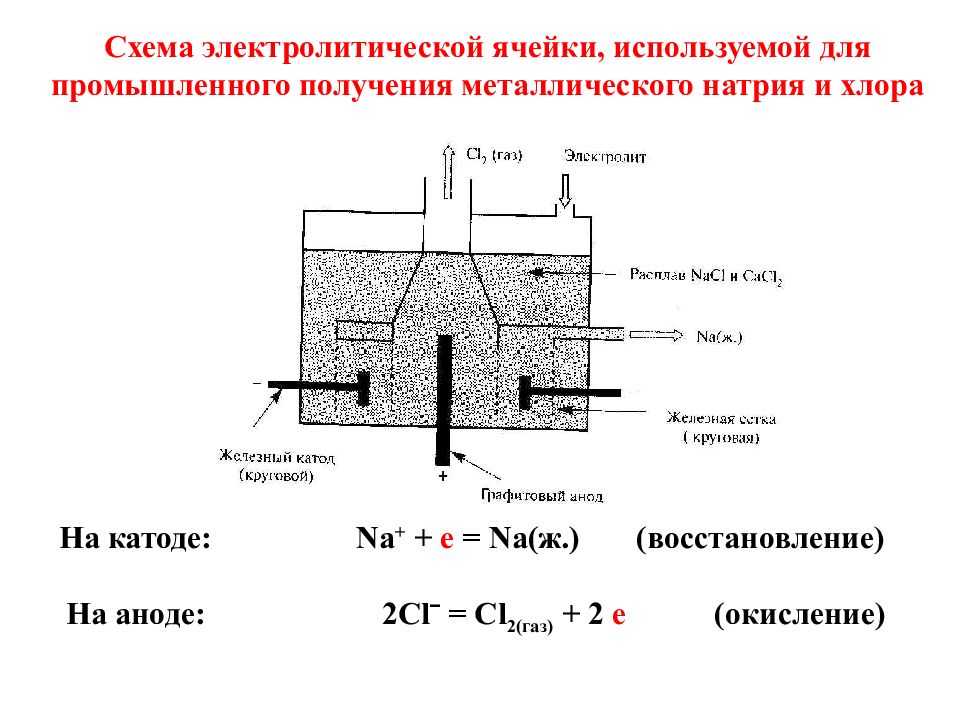
C хема электролитической ячейки, используемой для промышленного получения металлического натрия и хлора На катоде : Na + + e = Na( ж.) (восстановление) На аноде : 2 Cl ˉ = Cl 2( газ) + 2 е (окисление)
Слайд 34
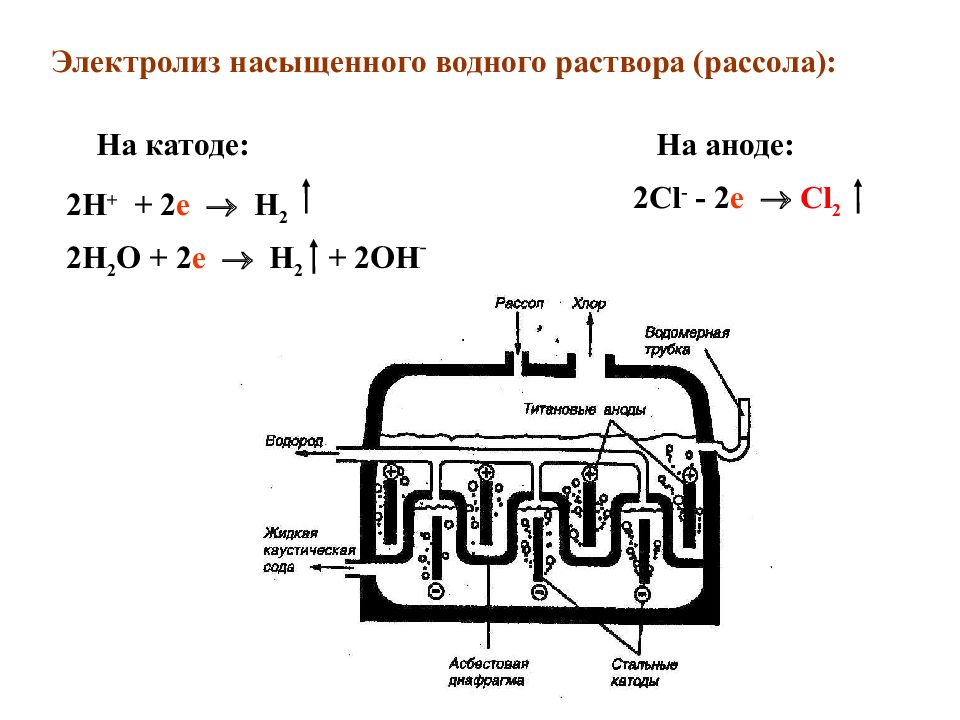
Электролиз насыщенного водного раствора ( рассола) : 2H + + 2 e H 2 2H 2 O + 2 e H 2 + 2OH ˉ 2Cl - - 2 e Cl 2 На катоде : На аноде :
Слайд 35
2NaCl + 2H 2 O H 2 + 2NaOH + Cl 2 Cуммарная реакция электр. ток диафрагма продукты электролиза : хлор, водород, едкий натр (каустическая сода) В лаборатории его синтезируют по реакции : М nO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O Бром и иод получают, пропуская хлор через растворы бромидов и иодидов (используя морские и подземные буровые воды) 2KBr + Cl 2 = Br 2 + 2KCl 2KI + Cl 2 = I 2 + 2KCl
Слайд 36
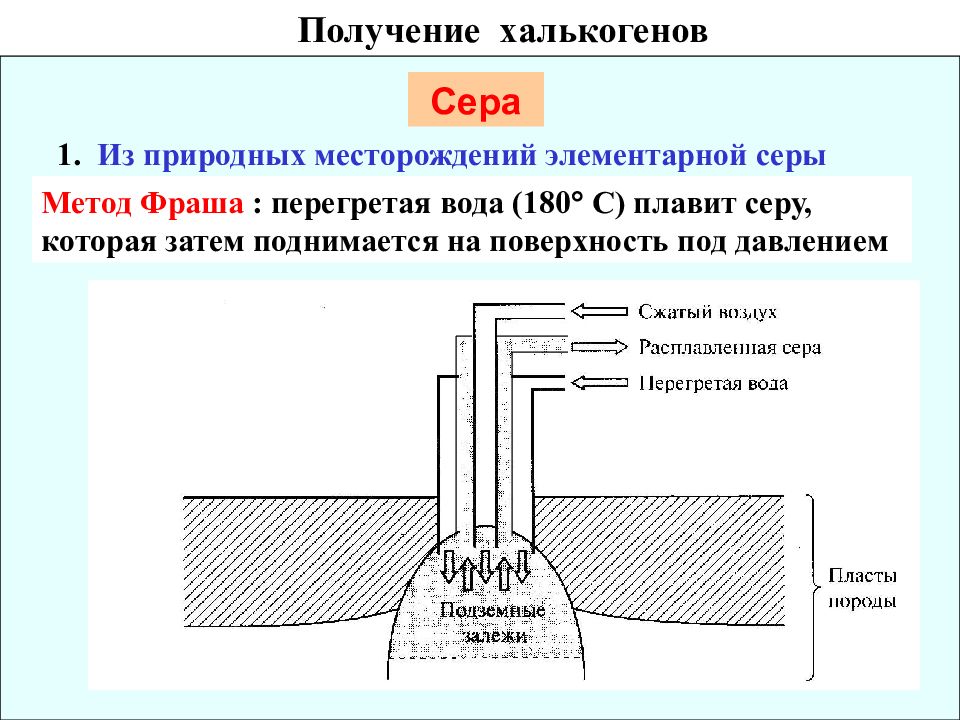
1. Из природных месторождений элементарной серы Сера Метод Фраша : перегретая вода (180 С) плавит серу, которая затем поднимается на поверхность под давлением Получение халькогенов
Слайд 37
2. Попутно из сульфидных руд. Важным источником получения серы служит железный колчедан (пирит) FeS 2 + H 2 SO 4 + O 2 S + Fe 2 (SO 4 ) 3 + H 2 O t в автоклаве Cелен Теллур Получают попутно из полупродуктов металлургии Pb, Cu, Ni Так, в производстве меди при электролитическом рафинировании в шламе накапливаются Se, Te, Ag, Au и др. элементы, откуда их извлекают.
Слайд 38
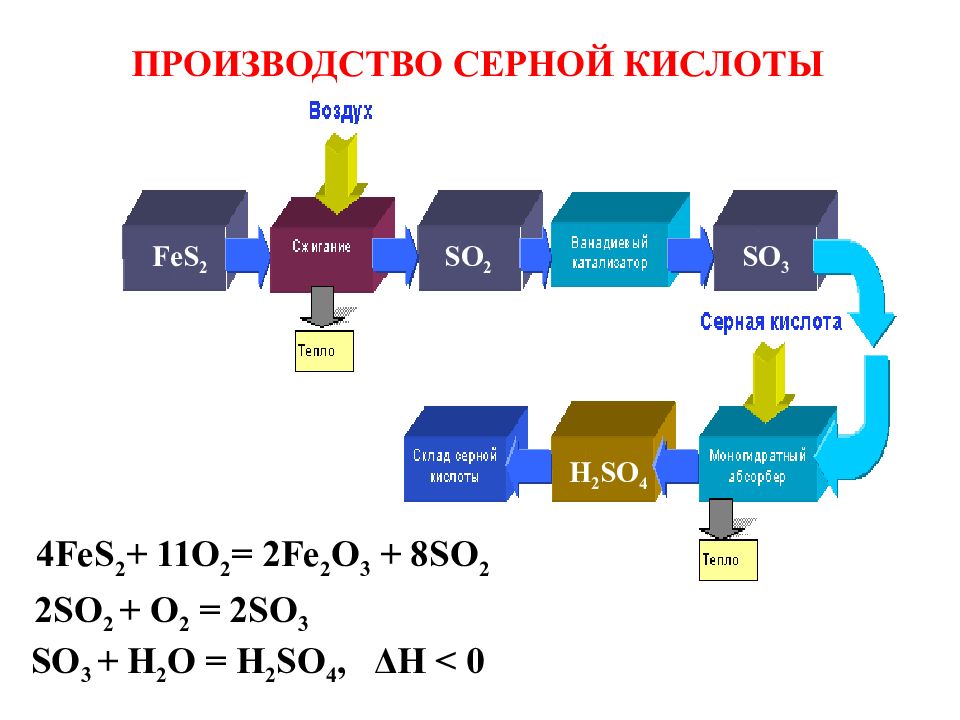
ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ SO 2 SO 3 FeS 2 H 2 SO 4 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 2SO 2 + O 2 = 2SO 3 SO 3 + H 2 O = H 2 SO 4, Δ H < 0
Слайд 39
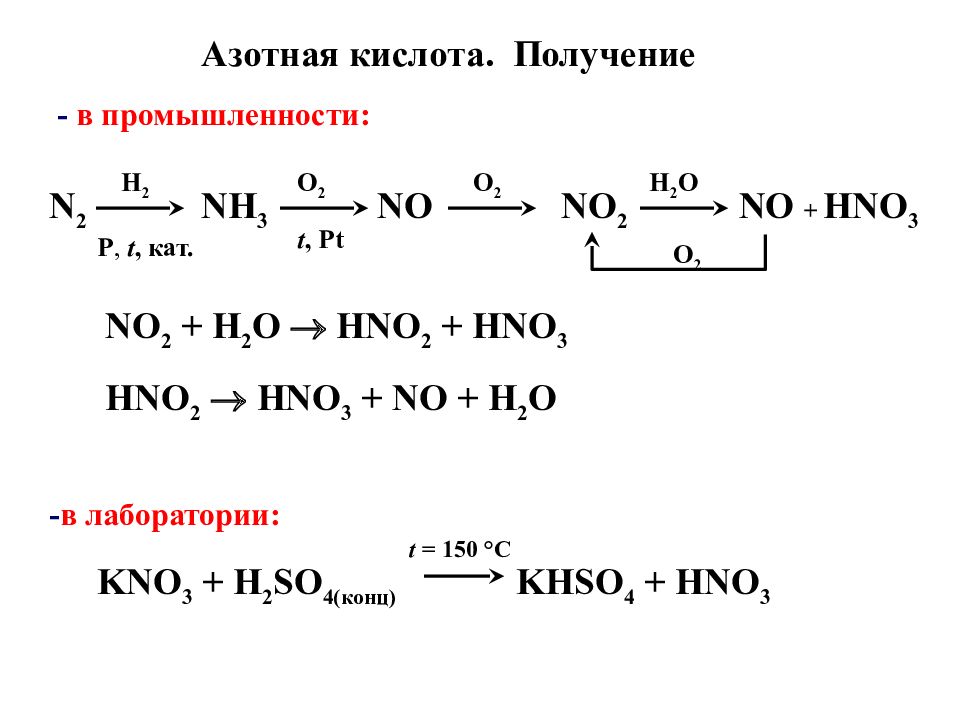
KNO 3 + H 2 SO 4 (конц) KHSO 4 + HNO 3 t = 150 °C - в лаборатории: - в промышленности: N 2 NH 3 H 2 O 2 t, Pt NO NO 2 O 2 H 2 O O 2 NO 2 + H 2 O HNO 2 + HNO 3 HNO 2 HNO 3 + NO + H 2 O Р, t, кат. NO + HNO 3 Азотная кислота. Получение
Слайд 41
Области применения галогенов - металлургия Al, Be, Zr, Nb … получение фторопластов, фреонов; - оптические материалы и волоконная оптика; - разделение изотопов урана в виде UF 6 ; - хлорная металлургия; - производство полимеров и растворителей; - синтез HCl; производство ПВХ - получение металлов высокой чистоты; - галогенные лампы; - медицина; фотография; F Cl Br I -
Слайд 42
- производство серной кислоты - вулканизация каучука, органический синтез - производство спичек и черного пороха - сельское хозяйство Se Те - добавка к сплавам S - производство фотоэлементов и выпрямителей электрического тока, оптических приборов, в фотографии - медицина Области применения халькогенов
Слайд 43
- производство неорганических кислот; - гидрометаллургия: производство цветных металлов; - травление металлов; - органический синтез; - производство взрывчатых веществ; - для очистки нефтепродуктов; - производство лекарственных препаратов и др. Основные области применения серной кислоты
Последний слайд презентации: Химия неметаллов. Общая характеристика. Лекция № 13 VIIA, VIA, VA подгруппы
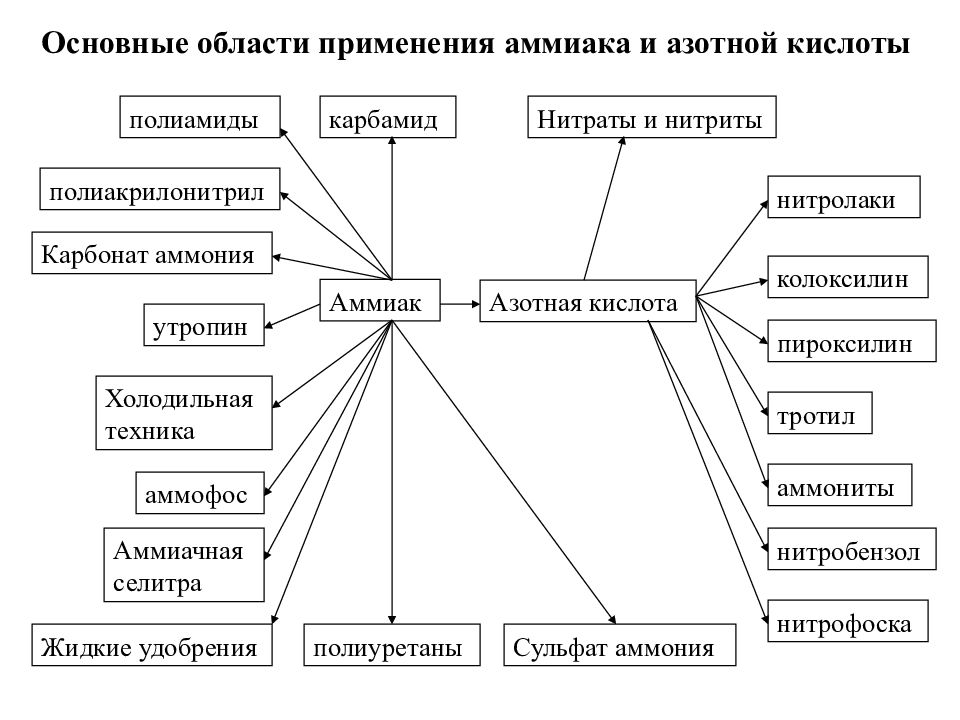
Основные области применения аммиака и азотной кислоты Аммиак Азотная кислота полиамиды полиакрилонитрил Карбонат аммония утропин Холодильная техника Сульфат аммония аммофос Аммиачная селитра Жидкие удобрения полиуретаны Нитраты и нитриты нитролаки колоксилин пироксилин тротил аммониты нитробензол нитрофоска карбамид