Первый слайд презентации
ФармФ Органическая химия СПИРТЫ ФЕНОЛЫ ПРОСТЫЕ ЭФИРЫ Лекция 11
Слайд 2
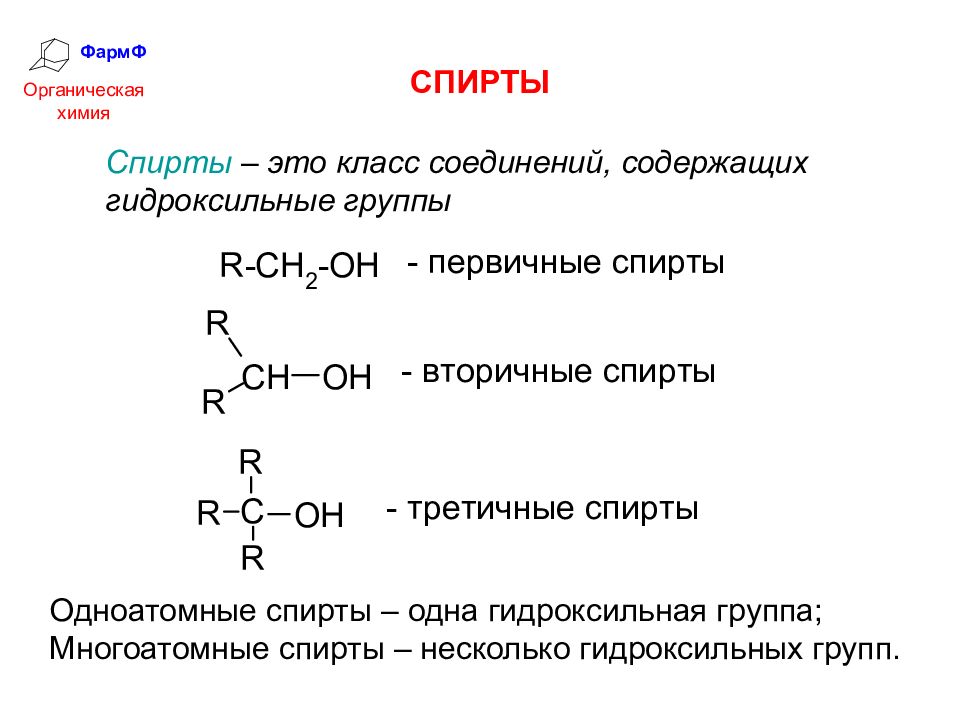
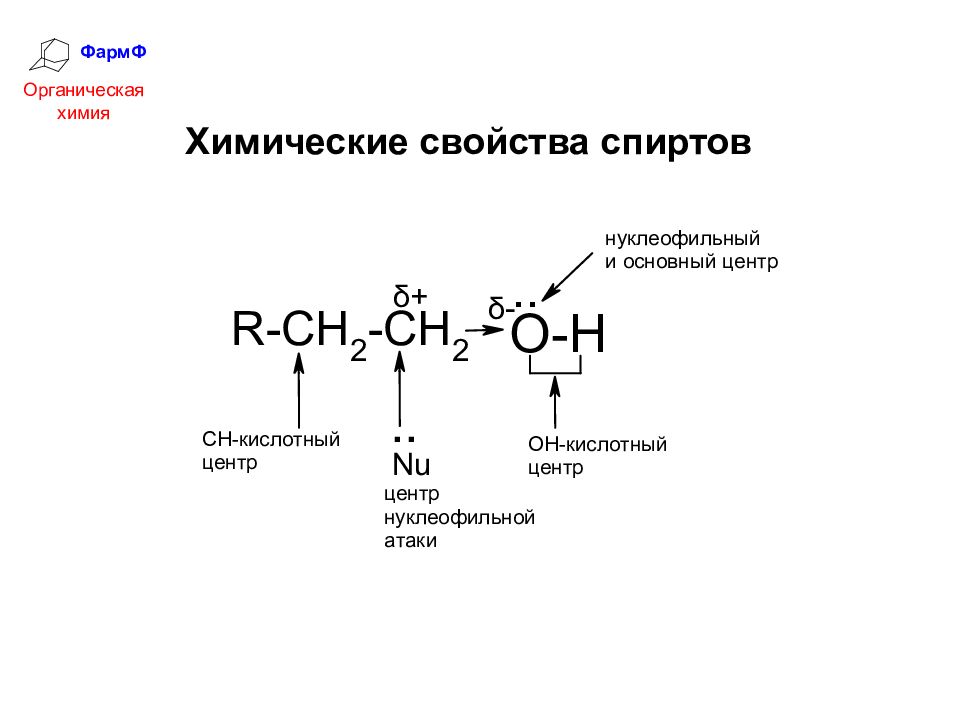
ФармФ Органическая химия СПИРТЫ Одноатомные спирты – одна гидроксильная группа; Многоатомные спирты – несколько гидроксильных групп. Спирты – это класс соединений, содержащих гидроксильные группы
Слайд 3
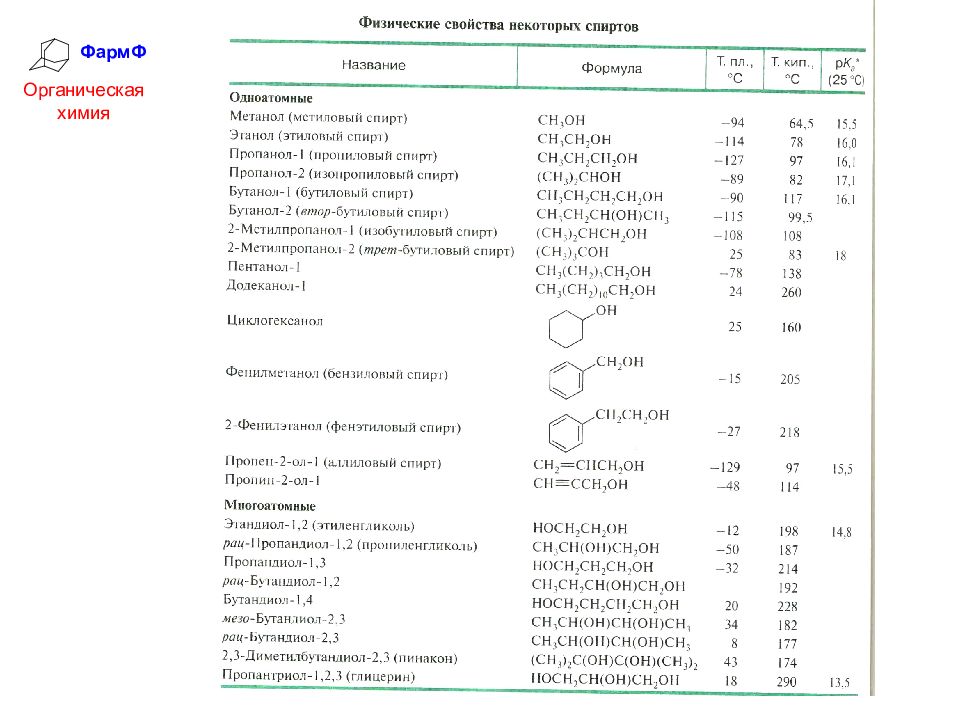
ФармФ Органическая химия Физические свойства спиртов Спирты до 11 С-атомов – жидкости, более тяжелые – твердые, плотность их меньше 1. Низшие спирты имеют характерный алкогольный запах, обладают сильным физиологическим действием. Молекулы спиртов полярны и ассоциированы межмолекулярными водородными связями, это является причиной их аномально высоких температур кипения. С водой спирты также образуют водородные связи. Низшие спирты хорошо гидратируются и поэтому растворимы в воде.
Слайд 5
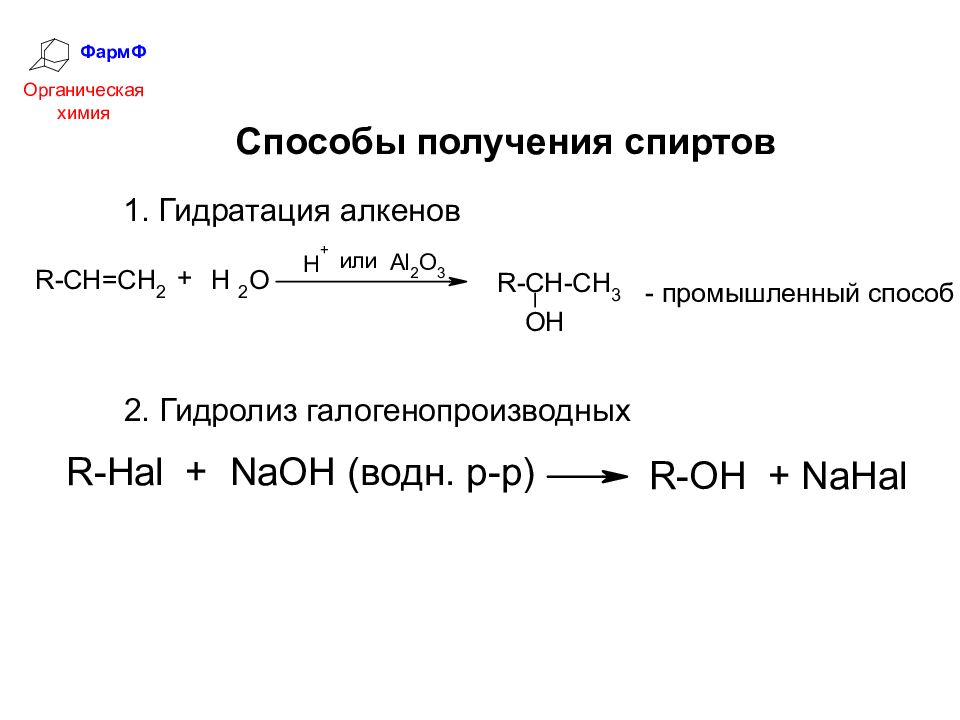
ФармФ Органическая химия Способы получения спиртов 1. Гидратация алкенов 2. Гидролиз галогенопроизводных
Слайд 6
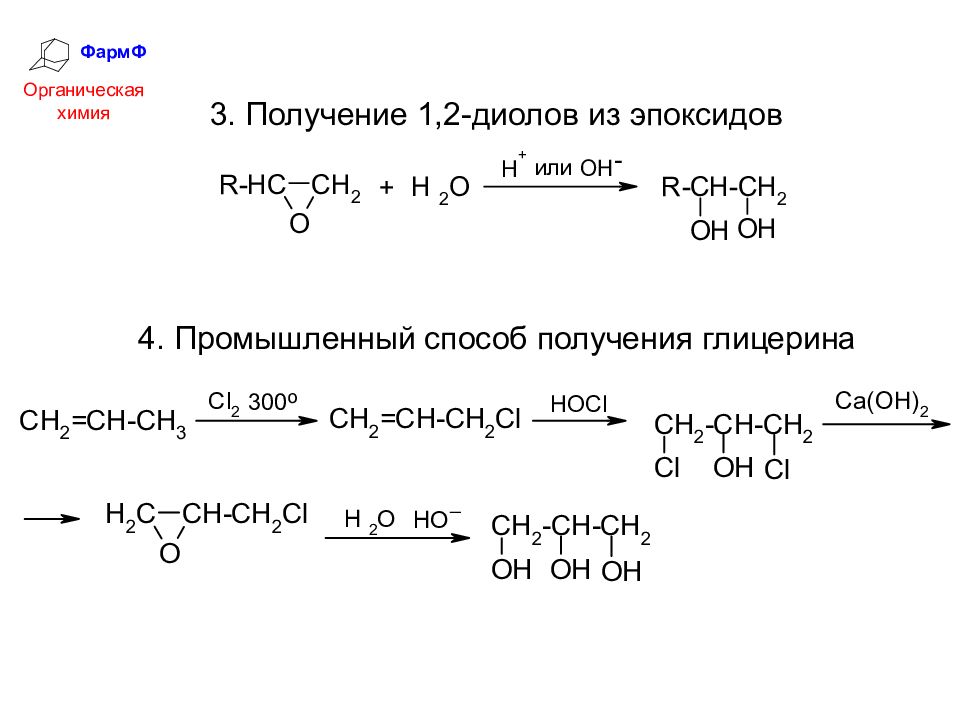
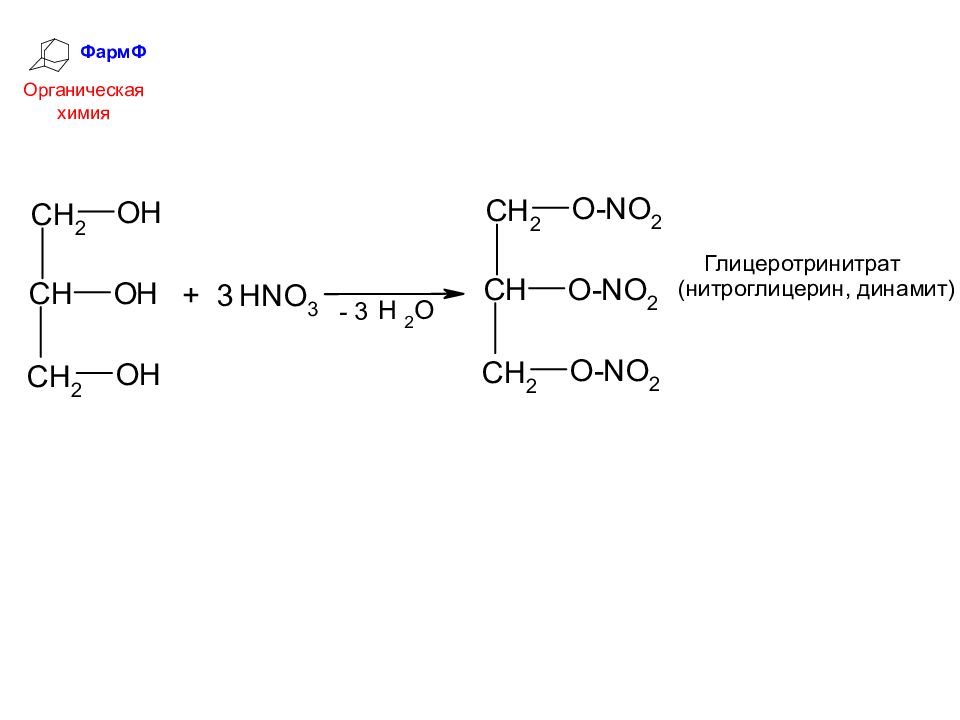
ФармФ Органическая химия 3. Получение 1,2-диолов из эпоксидов 4. Промышленный способ получения глицерина
Слайд 8
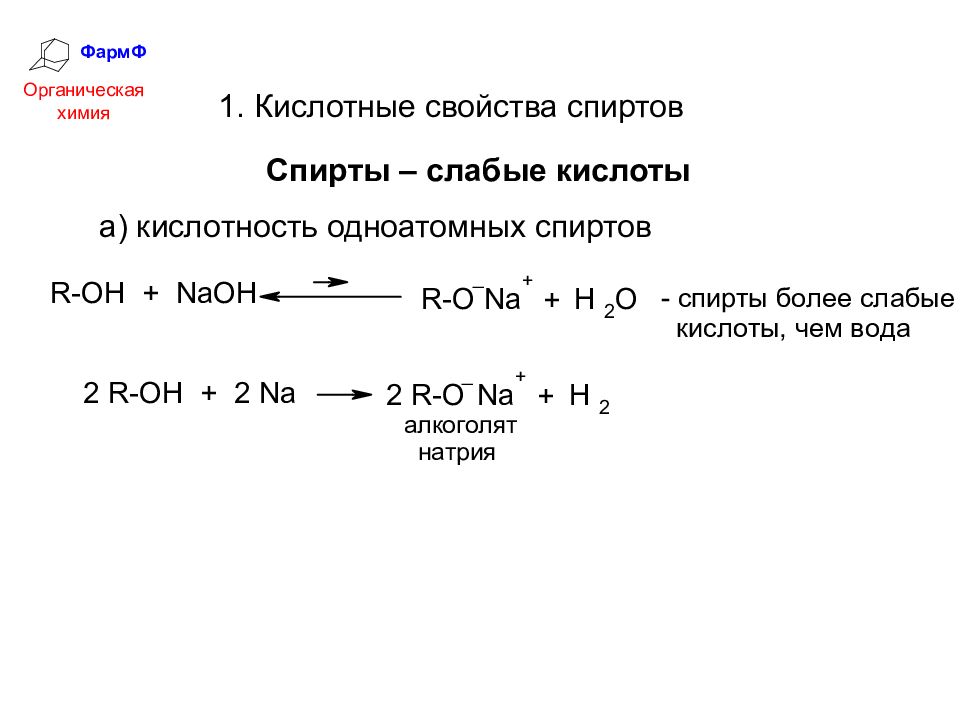
ФармФ Органическая химия 1. Кислотные свойства спиртов Спирты – слабые кислоты а) кислотность одноатомных спиртов
Слайд 9
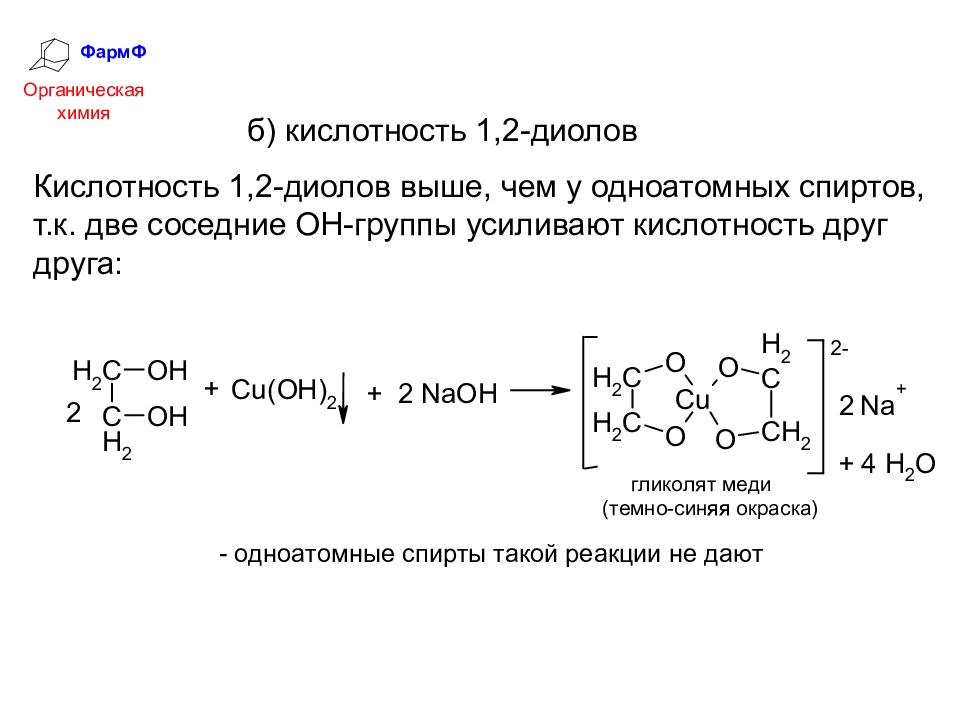
ФармФ Органическая химия б) кислотность 1,2-диолов Кислотность 1,2-диолов выше, чем у одноатомных спиртов, т.к. две соседние ОН-группы усиливают кислотность друг друга:
Слайд 10
ФармФ Органическая химия 2. Основные свойства спиртов Спирты – слабые основания
Слайд 11
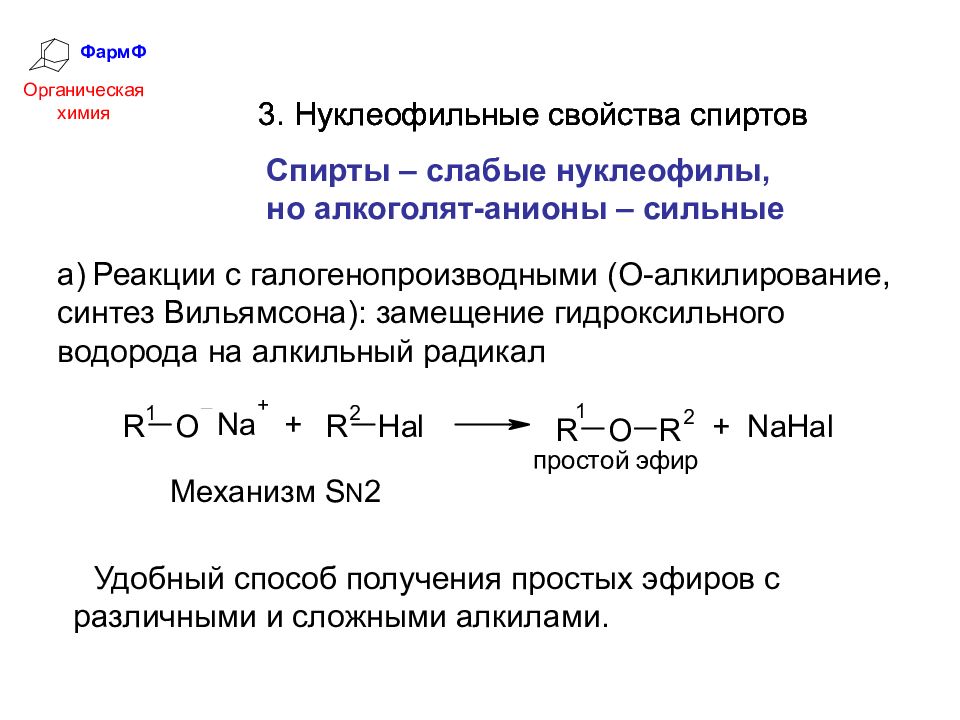
ФармФ Органическая химия 3. Нуклеофильные свойства спиртов Спирты – слабые нуклеофилы, но алкоголят-анионы – сильные а) Реакции с галогенопроизводными (О-алкилирование, синтез Вильямсона): замещение гидроксильного водорода на алкильный радикал Удобный способ получения простых эфиров с различными и сложными алкилами. 3. Нуклеофильные свойства спиртов 3. Нуклеофильные свойства спиртов
Слайд 12
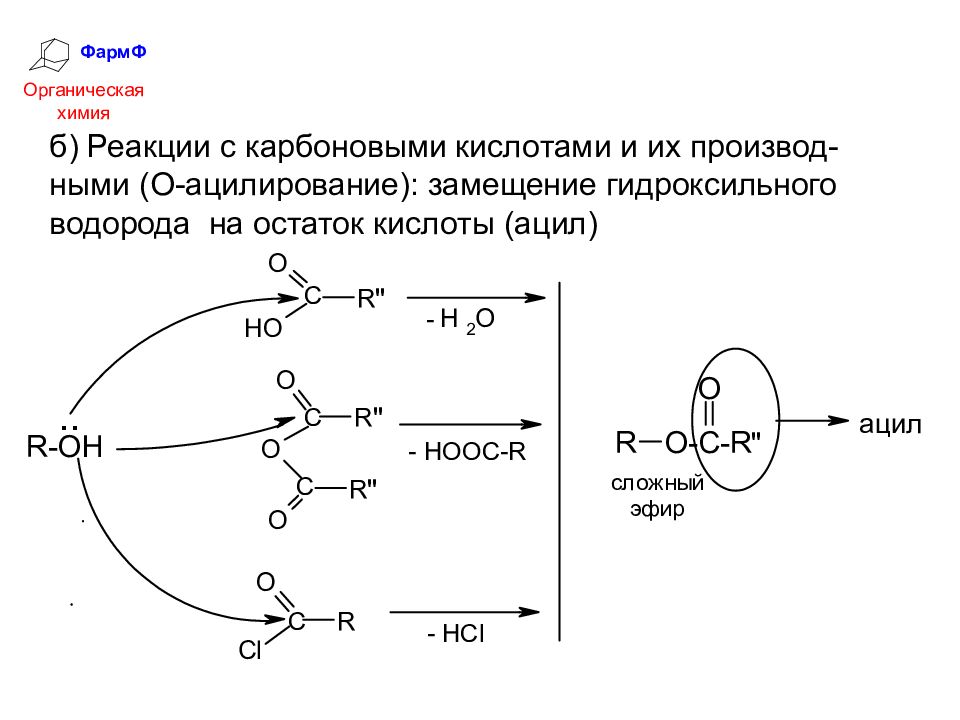
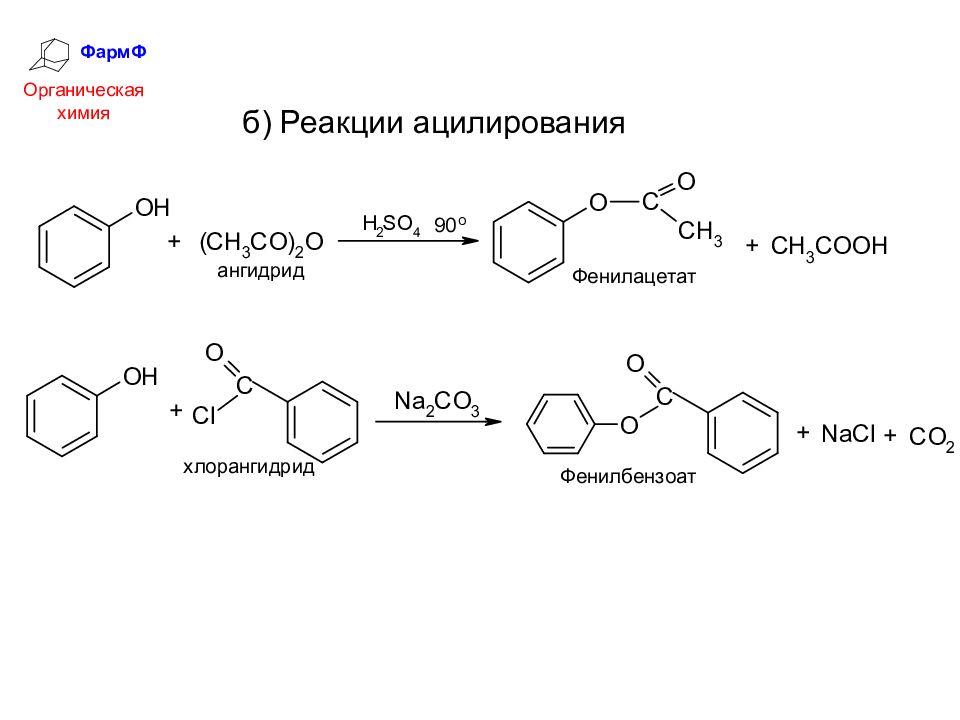
ФармФ Органическая химия б) Реакции с карбоновыми кислотами и их производ-ными (О-ацилирование): замещение гидроксильного водорода на остаток кислоты (ацил)
Слайд 15
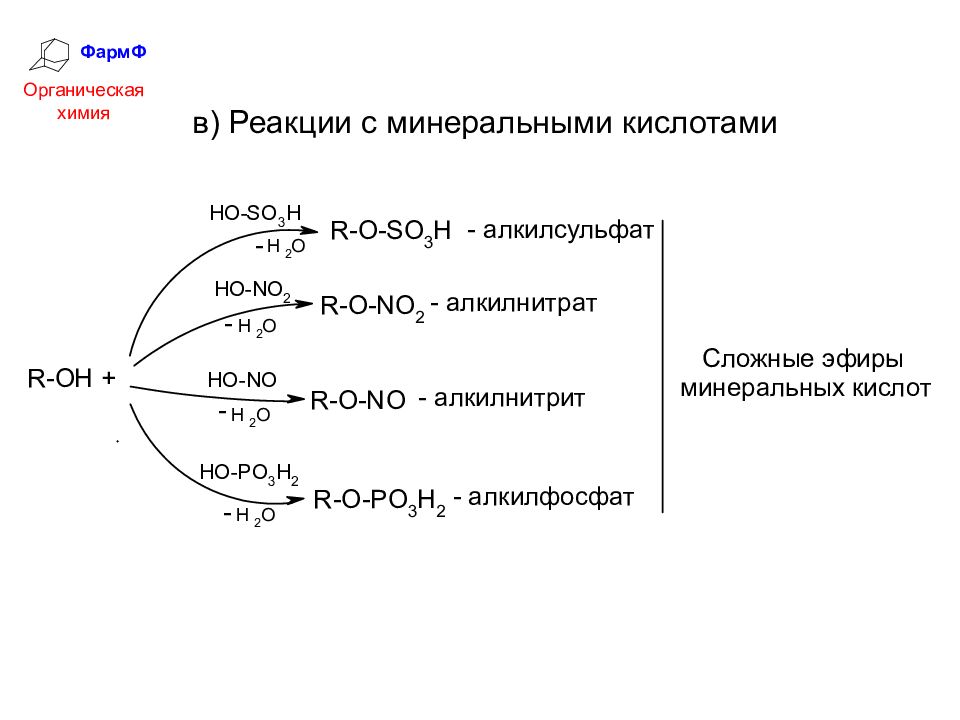
ФармФ Органическая химия 3. Нуклеофильное замещение гидроксильной группы ОН – трудно уходящая группа. Её уход значительно облегчается превращением в оксоний-катион: Чем сильнее HHal, тем легче идет реакция: HCl < HBr < HI Скорость реакции увеличивается в ряду: Alk = первичный < вторичный < третичный < аллил
Слайд 16
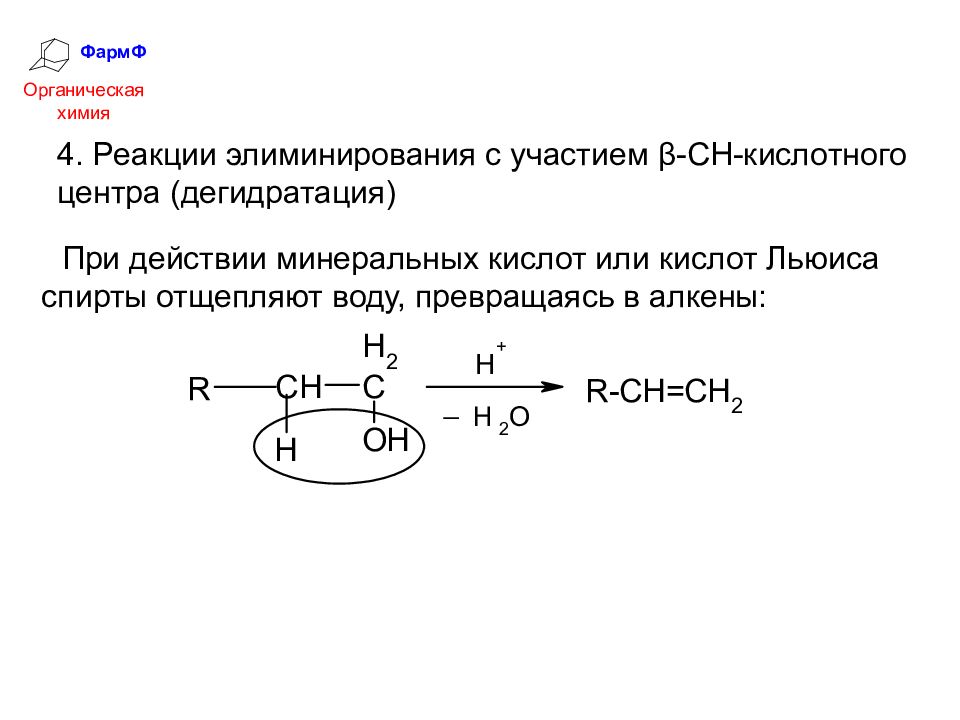
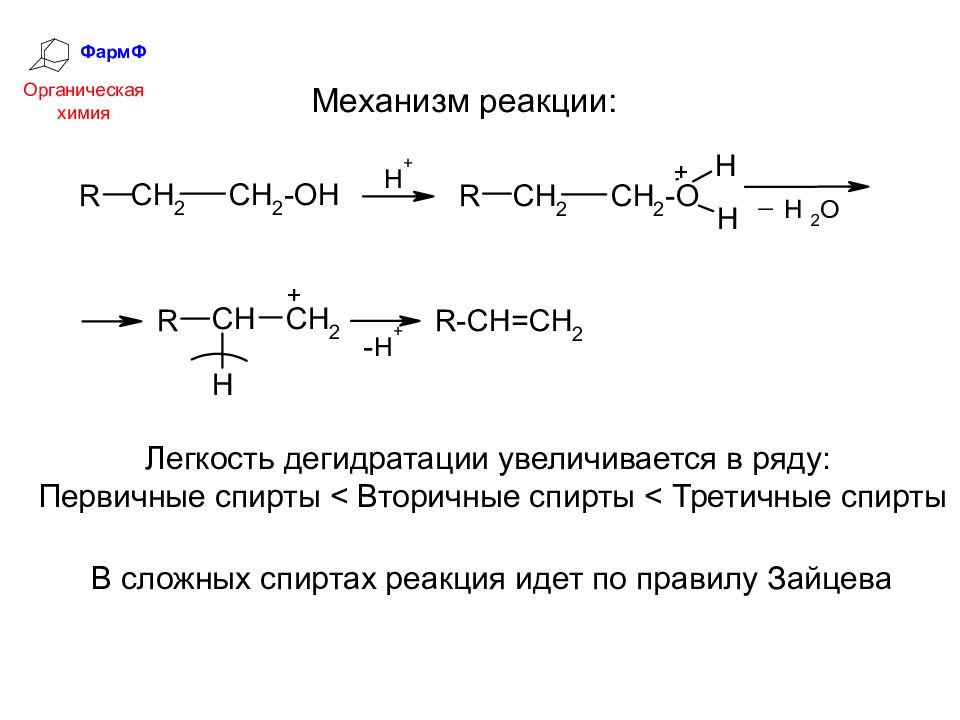
ФармФ Органическая химия 4. Реакции элиминирования с участием β-СН-кислотного центра (дегидратация) При действии минеральных кислот или кислот Льюиса спирты отщепляют воду, превращаясь в алкены:
Слайд 17
ФармФ Органическая химия Легкость дегидратации увеличивается в ряду: Первичные спирты < Вторичные спирты < Третичные спирты В сложных спиртах реакция идет по правилу Зайцева
Слайд 18
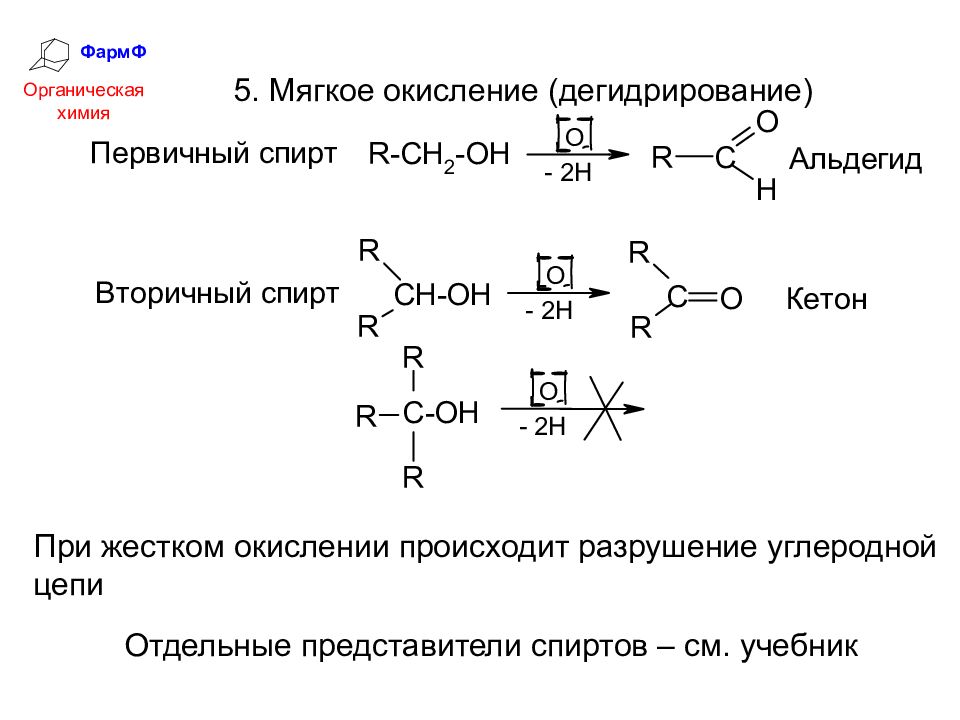
ФармФ Органическая химия 5. Мягкое окисление (дегидрирование) При жестком окислении происходит разрушение углеродной цепи Отдельные представители спиртов – см. учебник
Слайд 19
ФармФ Органическая химия Фенолы (ароматические спирты) – это гидроксильные производные ароматических углеводородов ФЕНОЛЫ Различные сложные фенолы представлены в растительном мире: это пигменты, дубильные вещества, лигнин. Фенолы широко используются в технике, медицине, фармации: полимеры, красители, консерванты, антисептики.
Слайд 20
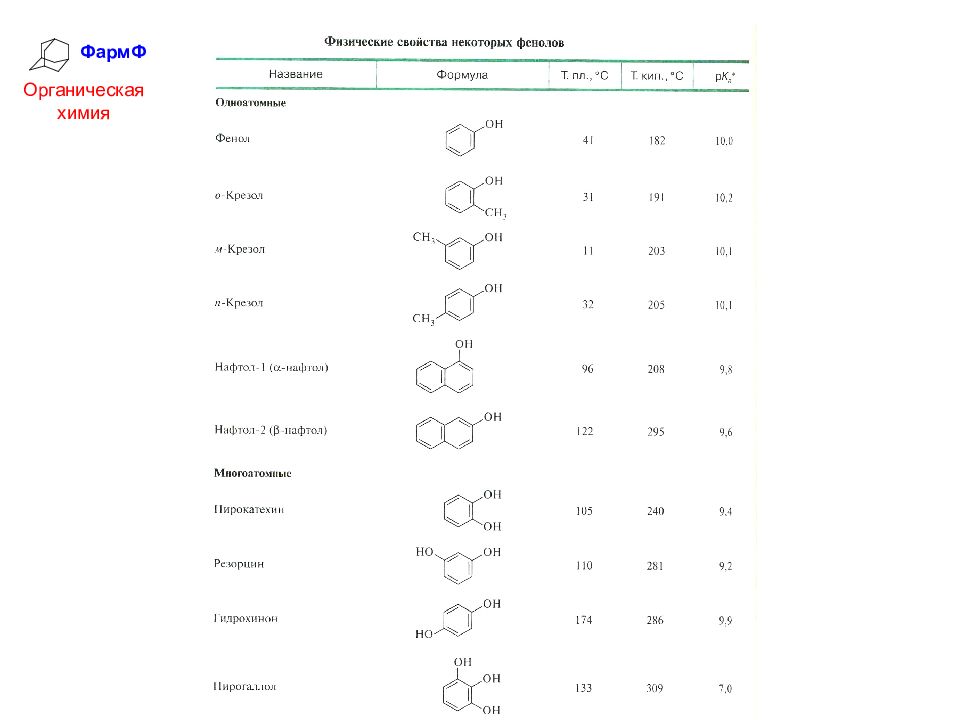
ФармФ Органическая химия Физические свойства фенолов Одноатомные фенолы – низкоплавкие твердые вещества с характерным запахом ("карболка", крезолы), плохо растворимы в воде, хорошо растворимы в органических растворителях. Многоатомные фенолы менее летучи, без запаха, хорошо растворимы в воде.
Слайд 22
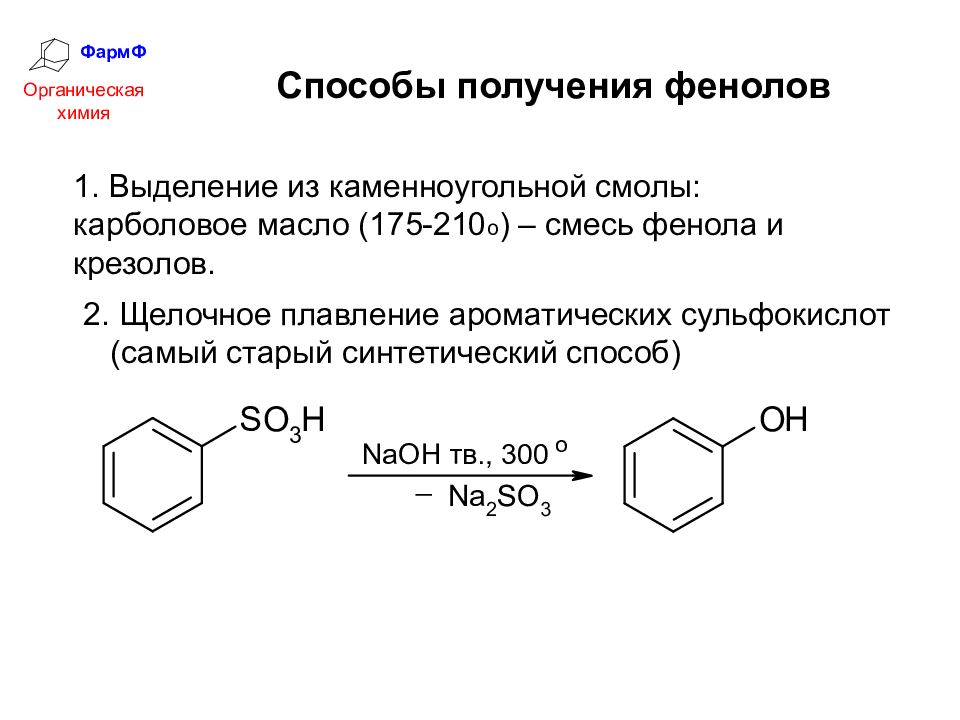
ФармФ Органическая химия Способы получения фенолов 1. Выделение из каменноугольной смолы: карболовое масло (175-210 о ) – смесь фенола и крезолов. 2. Щелочное плавление ароматических сульфокислот (самый старый синтетический способ)
Слайд 23
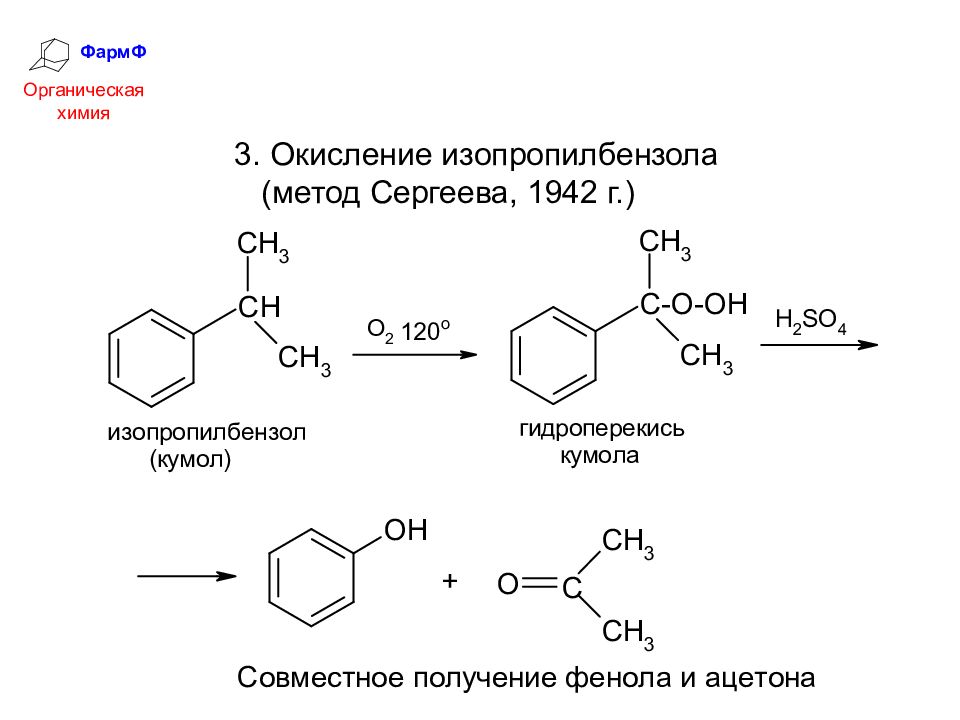
ФармФ Органическая химия 3. Окисление изопропилбензола (метод Сергеева, 1942 г.)
Слайд 24
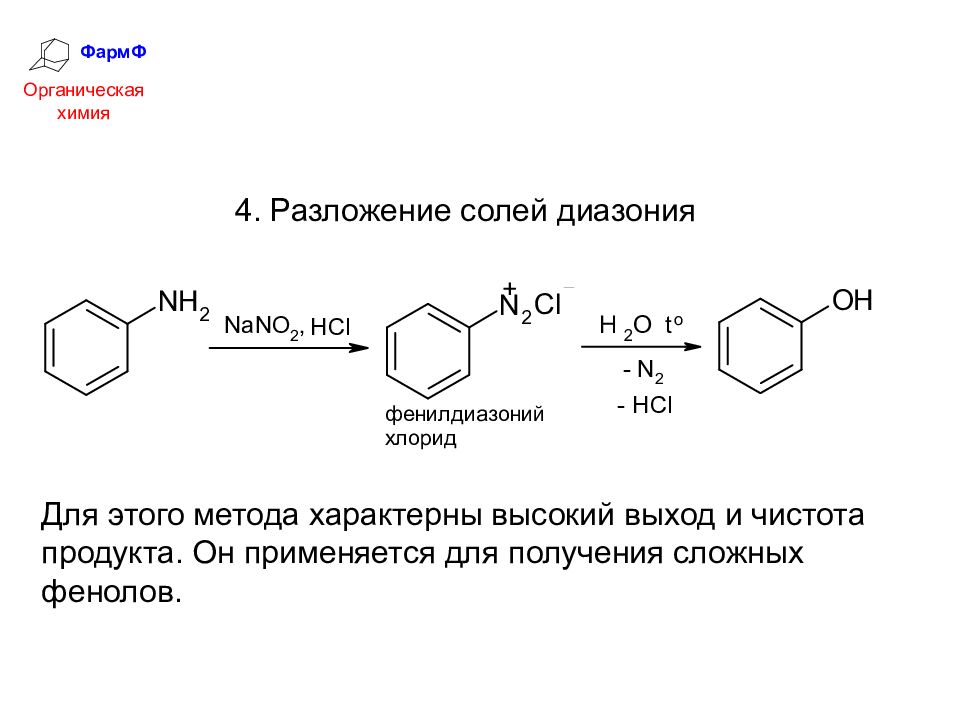
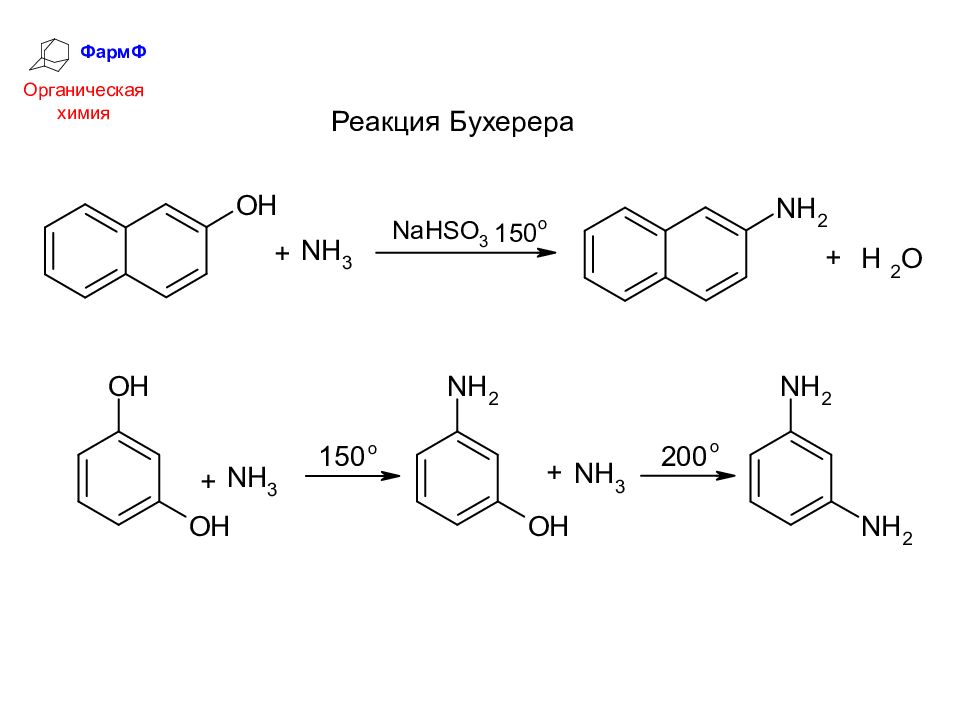
ФармФ Органическая химия 4. Разложение солей диазония Для этого метода характерны высокий выход и чистота продукта. Он применяется для получения сложных фенолов.
Слайд 25
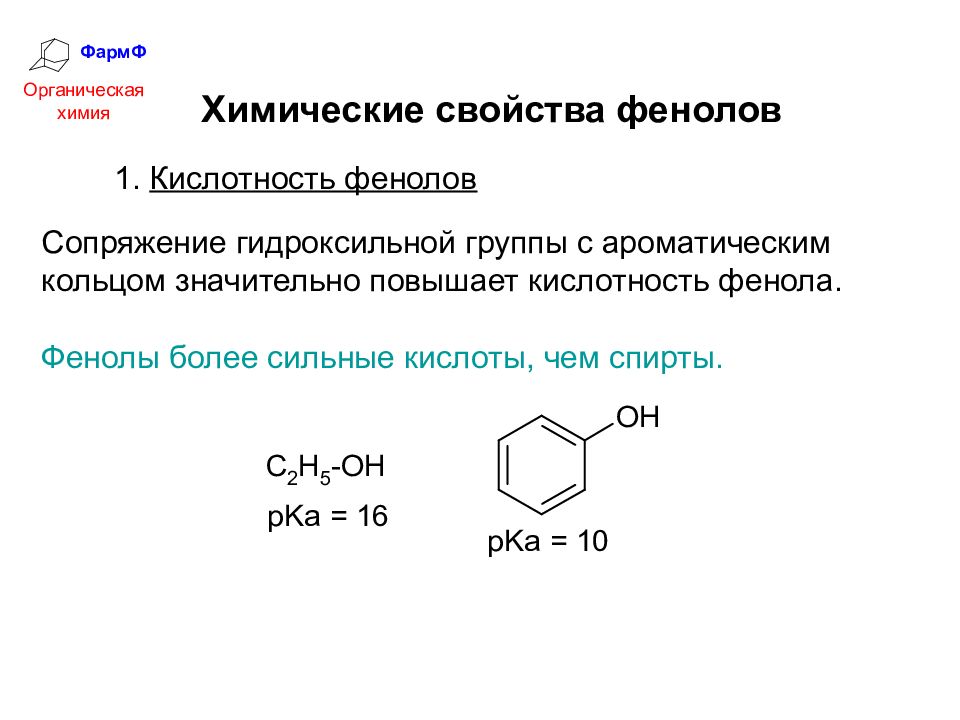
ФармФ Органическая химия Химические свойства фенолов 1. Кислотность фенолов Сопряжение гидроксильной группы с ароматическим кольцом значительно повышает кислотность фенола. Фенолы более сильные кислоты, чем спирты.
Слайд 26
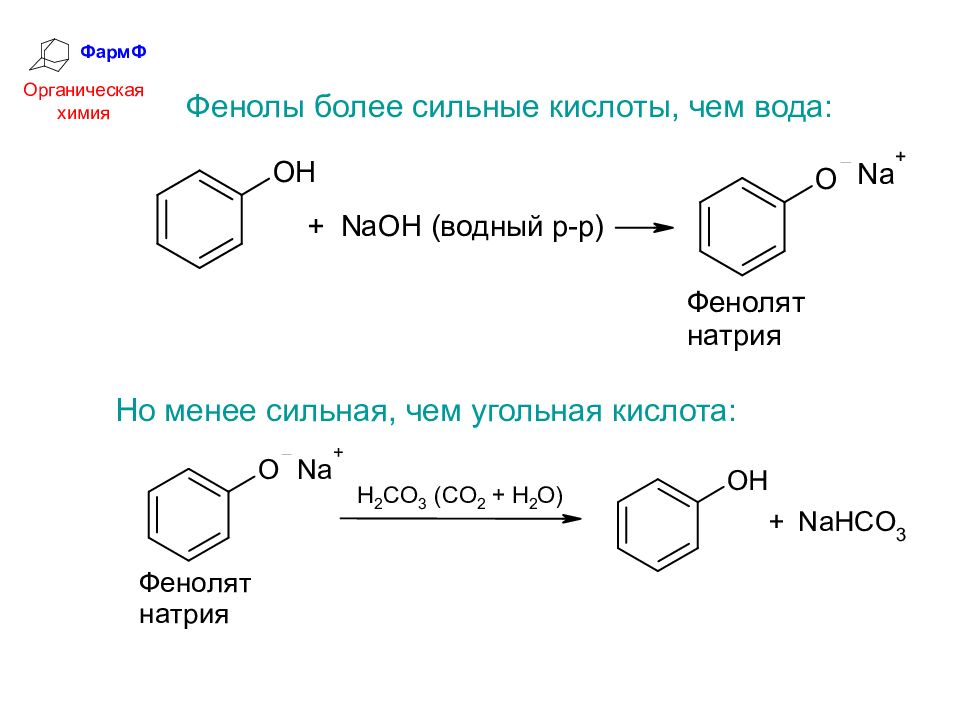
ФармФ Органическая химия Фенолы более сильные кислоты, чем вода: Но менее сильная, чем угольная кислота:
Слайд 27
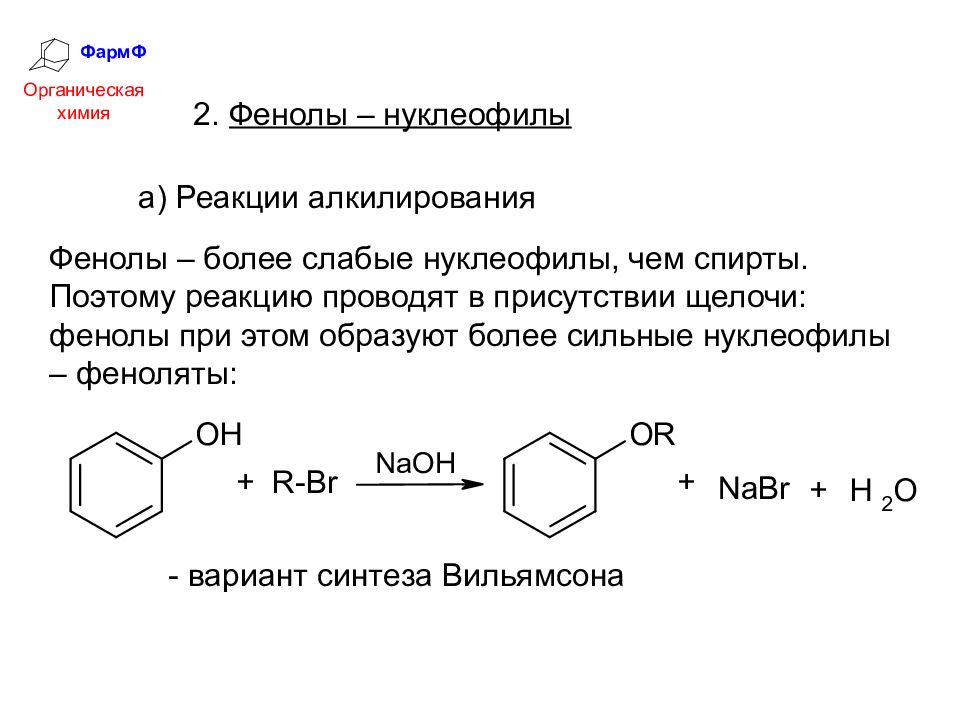
ФармФ Органическая химия 2. Фенолы – нуклеофилы Фенолы – более слабые нуклеофилы, чем спирты. Поэтому реакцию проводят в присутствии щелочи: фенолы при этом образуют более сильные нуклеофилы – феноляты: а) Реакции алкилирования
Слайд 29
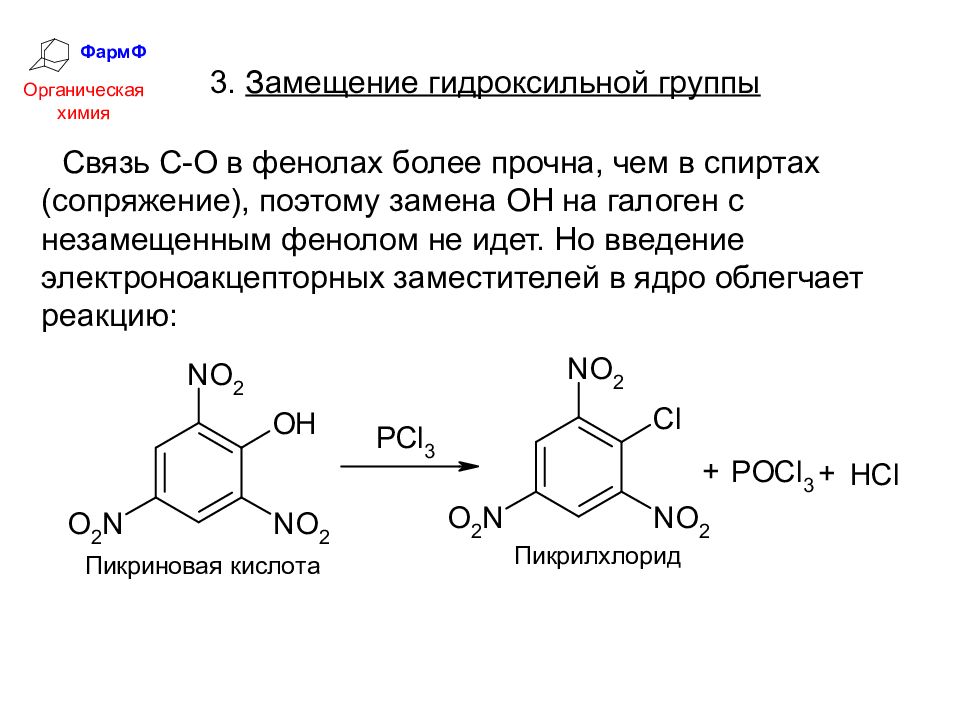
ФармФ Органическая химия 3. Замещение гидроксильной группы Связь С-О в фенолах более прочна, чем в спиртах (сопряжение), поэтому замена ОН на галоген с незамещенным фенолом не идет. Но введение электроноакцепторных заместителей в ядро облегчает реакцию:
Слайд 31
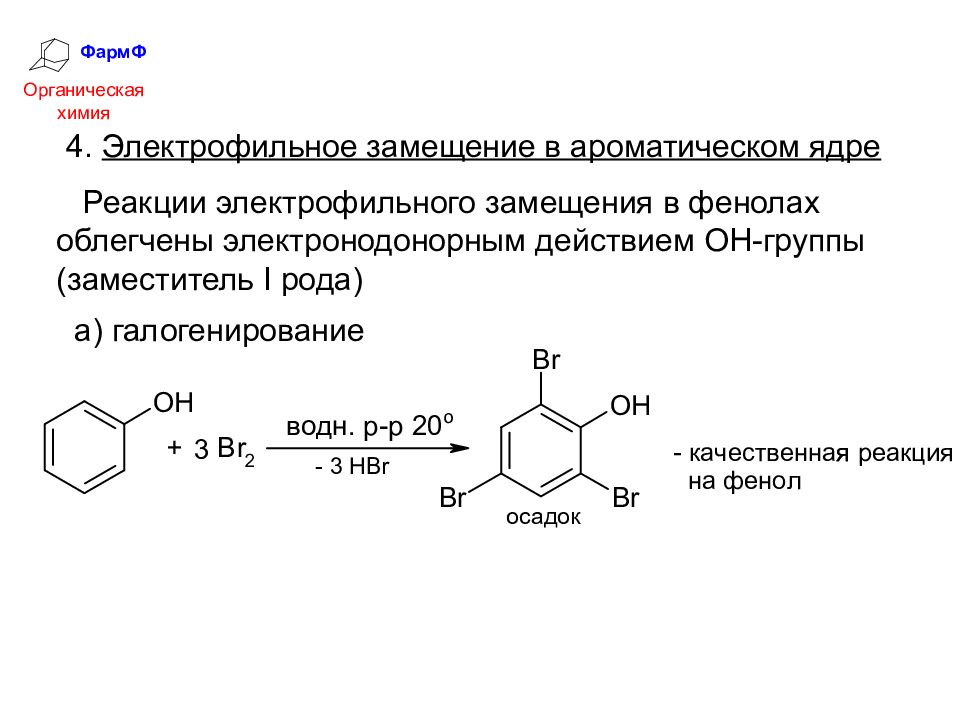
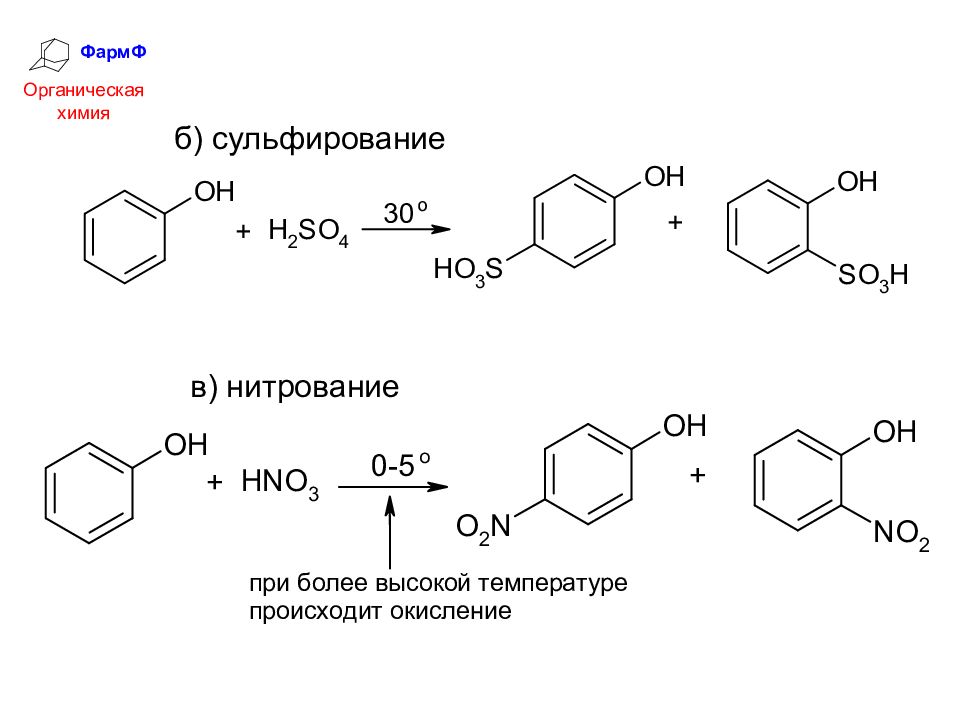
ФармФ Органическая химия 4. Электрофильное замещение в ароматическом ядре Реакции электрофильного замещения в фенолах облегчены электронодонорным действием ОН-группы (заместитель I рода) а) галогенирование
Слайд 33
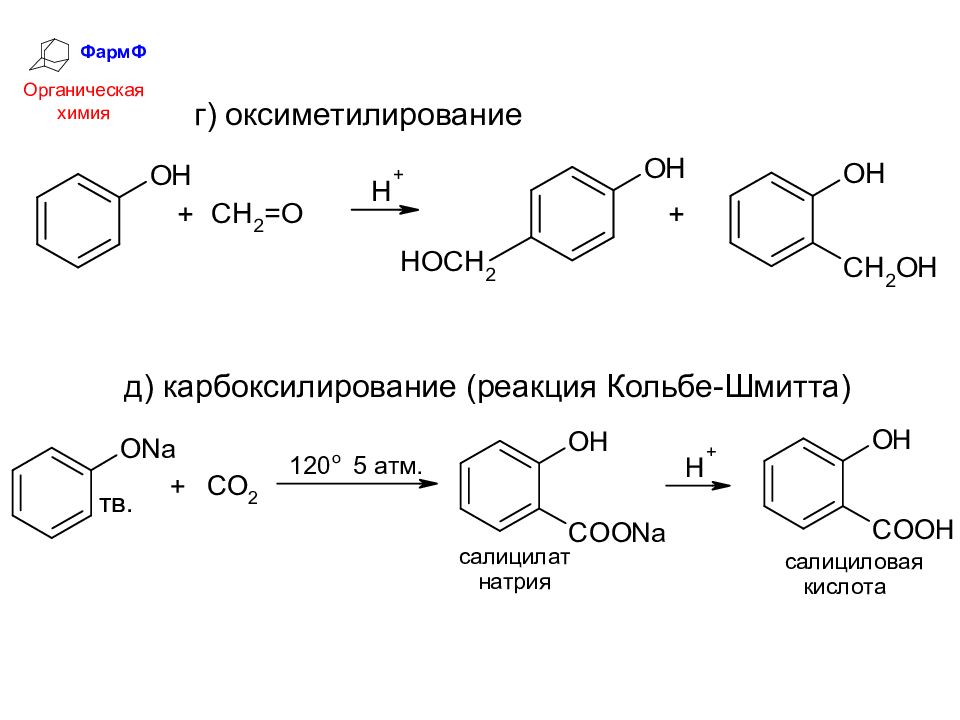
ФармФ Органическая химия г) оксиметилирование д) карбоксилирование (реакция Кольбе-Шмитта)
Слайд 34
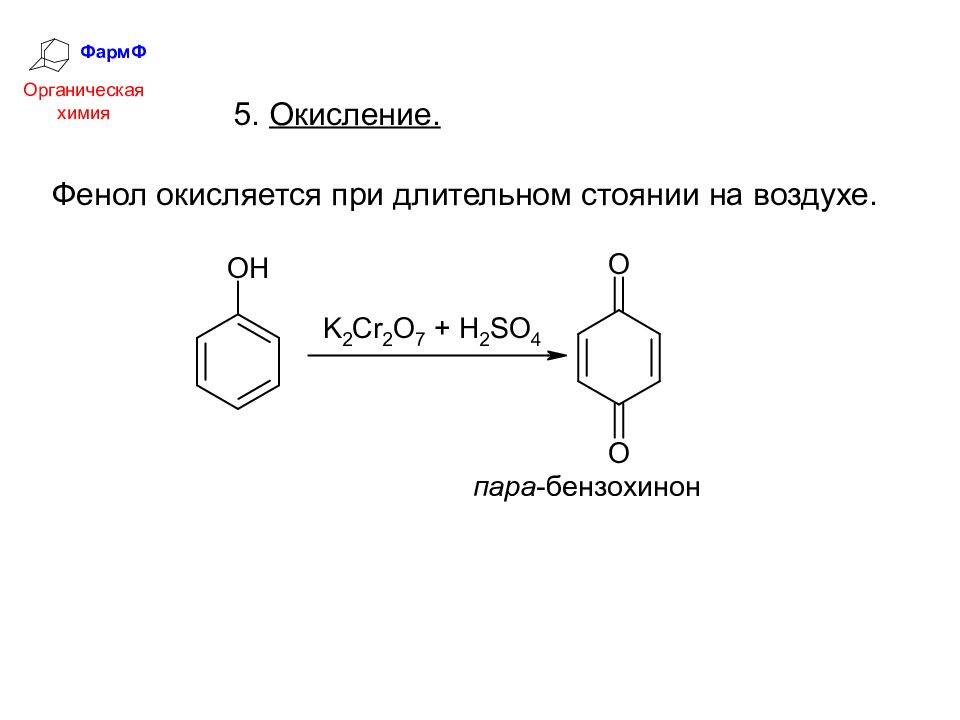
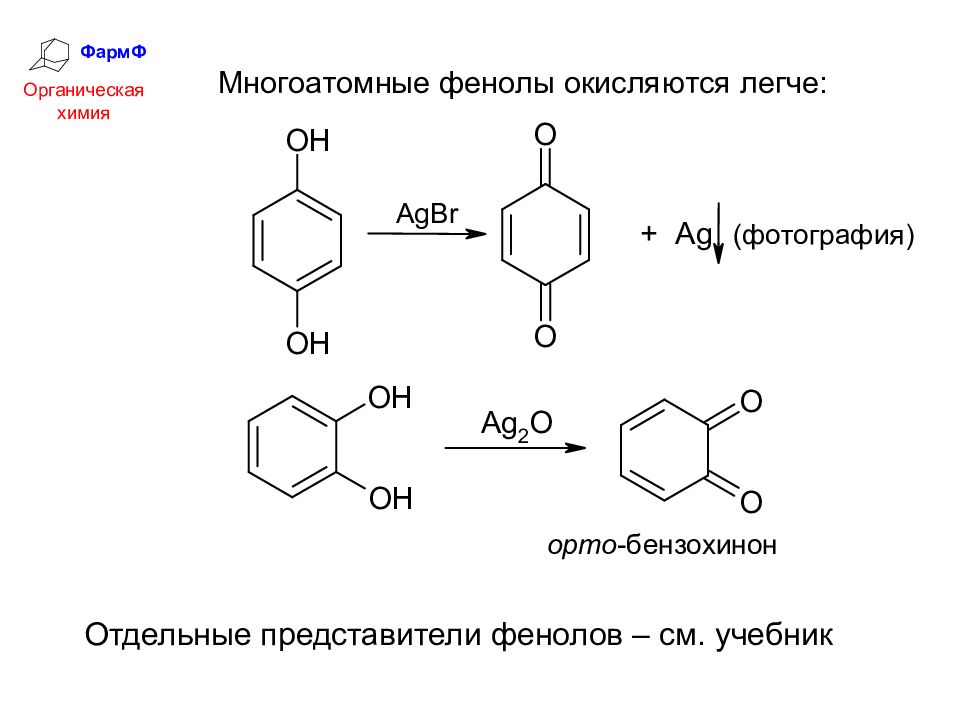
ФармФ Органическая химия 5. Окисление. Фенол окисляется при длительном стоянии на воздухе.
Слайд 36
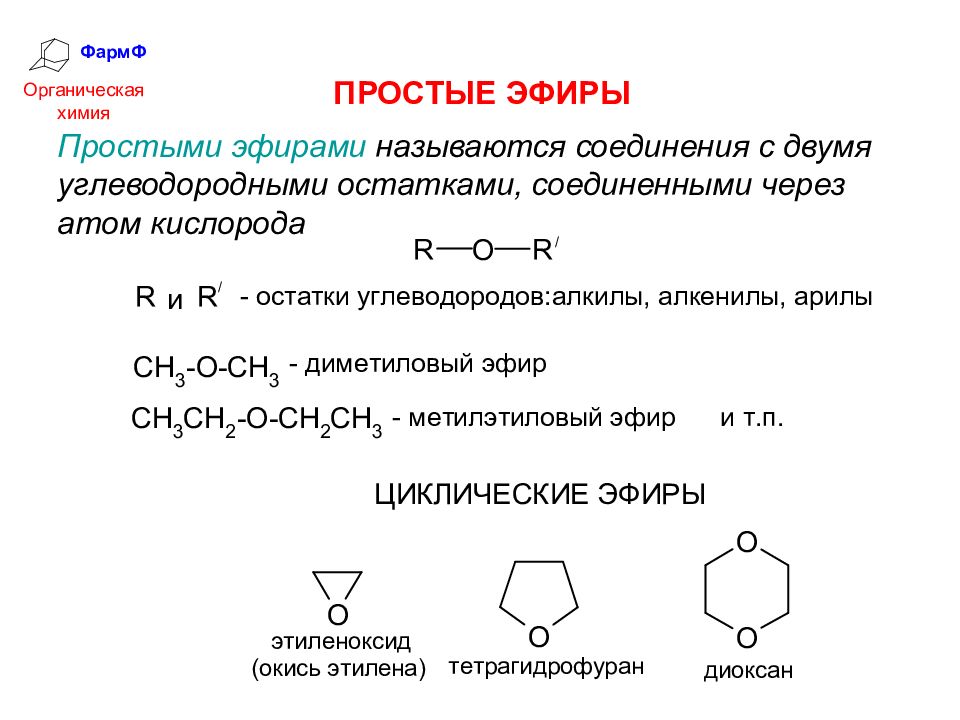
ФармФ Органическая химия ПРОСТЫЕ ЭФИРЫ Простыми эфирами называются соединения с двумя углеводородными остатками, соединенными через атом кислорода
Слайд 37
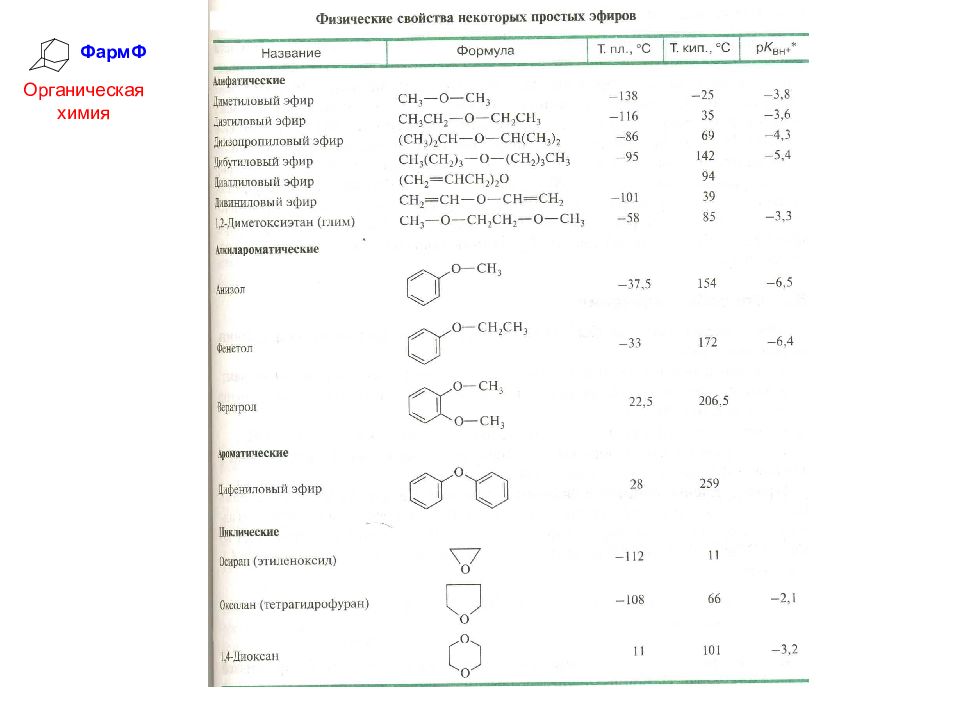
ФармФ Органическая химия Физические свойства простых эфиров Молекулы простых эфиров не образуют ассоциатов, поэтому все они, за исключением диариловых эфиров, представляют собой жидкости со сравнительно низкой температурой кипения. Молекулы простых эфиров не гидратируются, поэтому они нерастворимы в воде и хорошо растворимы в органических растворителях.
Слайд 39
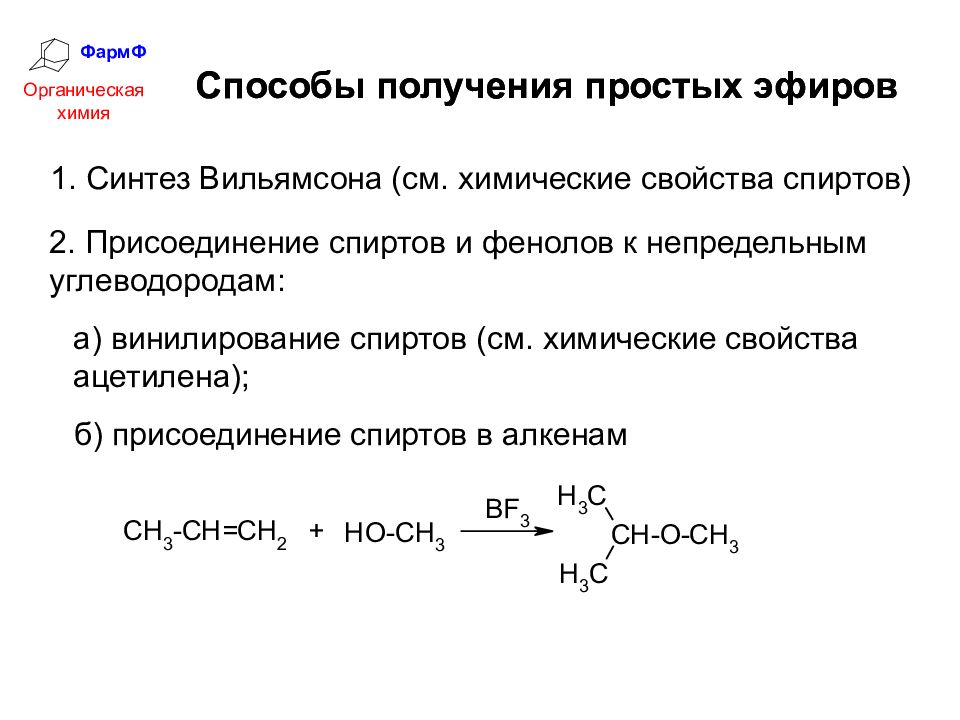
ФармФ Органическая химия Способы получения простых эфиров 1. Синтез Вильямсона (см. химические свойства спиртов) 2. Присоединение спиртов и фенолов к непредельным углеводородам: а) винилирование спиртов (см. химические свойства ацетилена); б) присоединение спиртов в алкенам Способы получения простых эфиров
Слайд 40
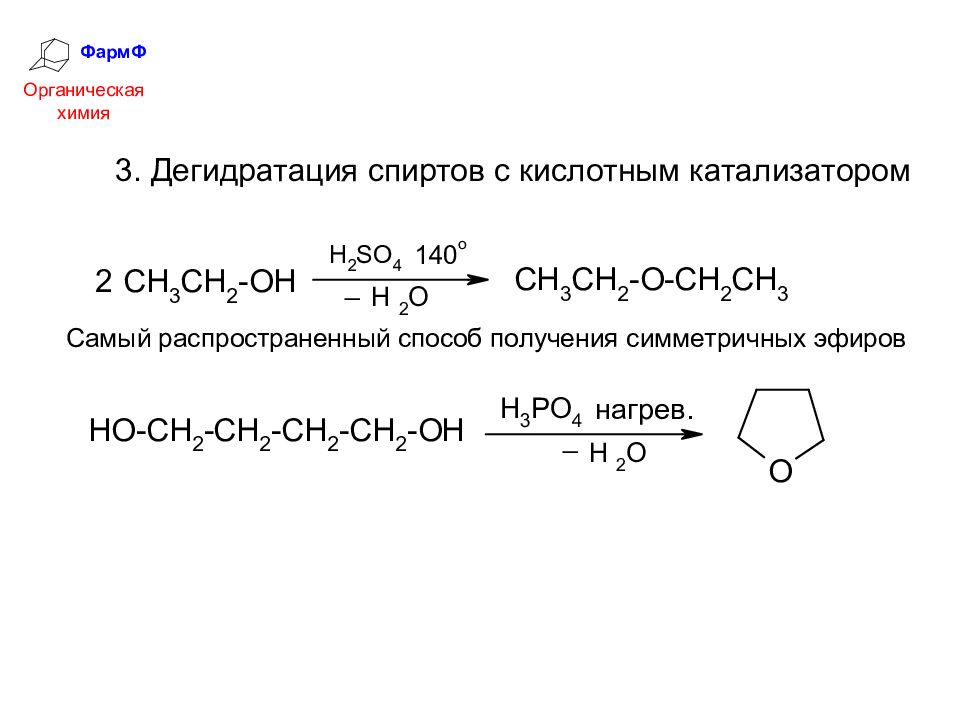
ФармФ Органическая химия 3. Дегидратация спиртов с кислотным катализатором
Слайд 41
ФармФ Органическая химия Химические свойства простых эфиров Простые эфиры сравнительно инертны (используются как инертные растворители). Связь С-О в них полярна, но прочна: С-О- и С-С-связи близки по энергии и разрываются в жестких условиях. 1. Основные свойства Простые эфиры не растворимы в воде, но растворяются в концентрированной серной кислоте с образованием оксониевых солей:
Слайд 42
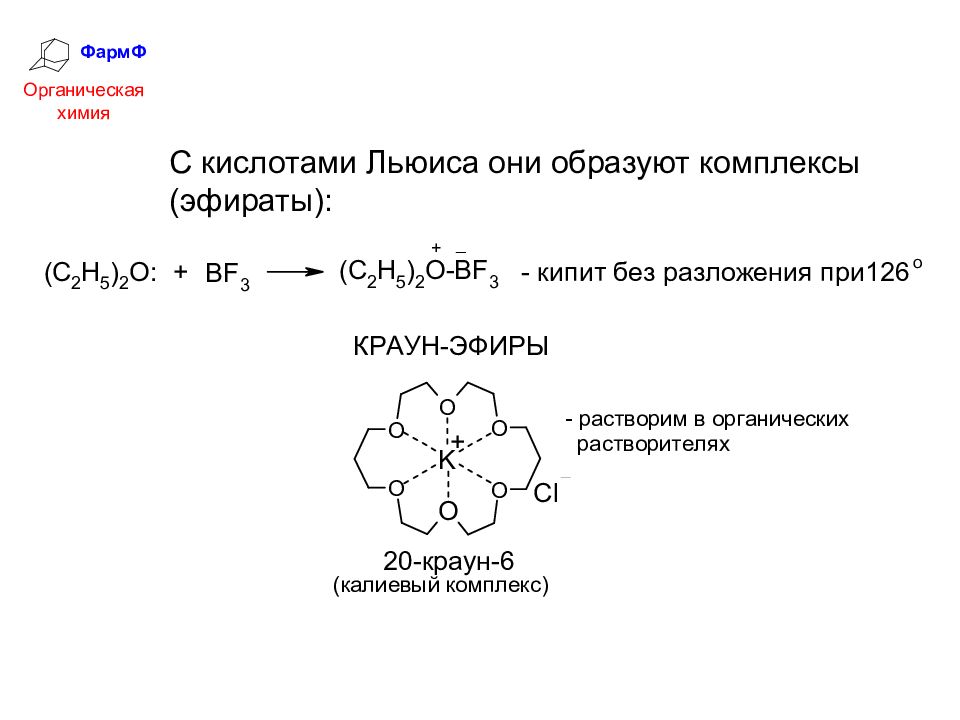
ФармФ Органическая химия С кислотами Льюиса они образуют комплексы (эфираты):
Слайд 43
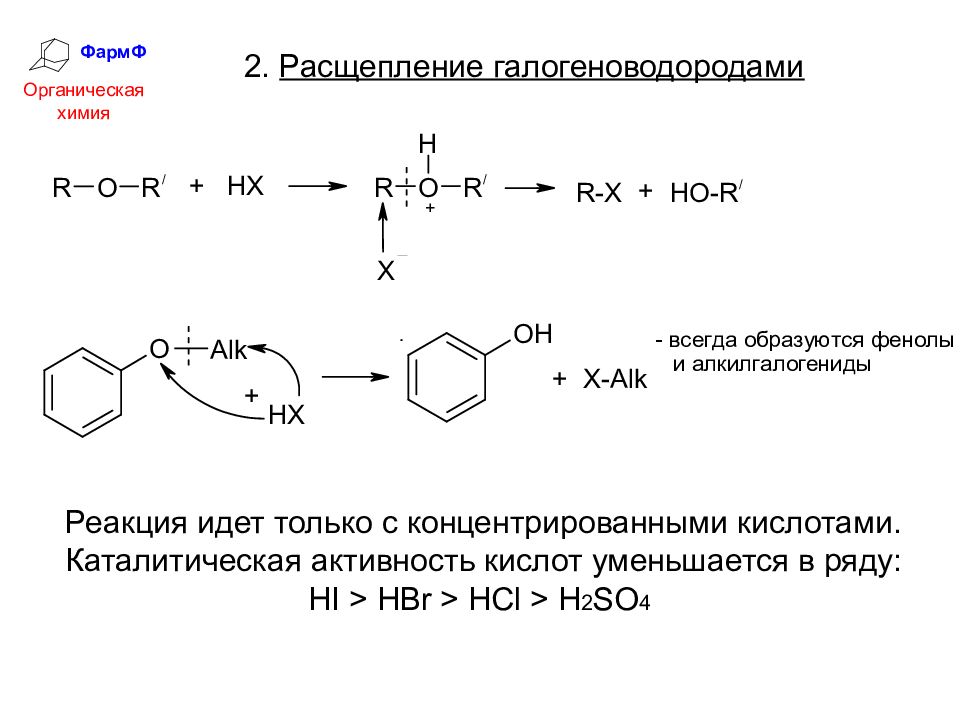
ФармФ Органическая химия 2. Расщепление галогеноводородами Реакция идет только с концентрированными кислотами. Каталитическая активность кислот уменьшается в ряду: HI > HBr > HCl > H 2 SO 4
Слайд 44
ФармФ Органическая химия В растворах щелочей и разбавленных кислот простые эфиры устойчивы. 3. Окисление кислородом воздуха Все простые эфиры при хранении на воздухе окисляются кислородом с образованием взрывоопасных гидроперекисей:
Слайд 45
ФармФ Органическая химия Распространенные растворители – диэтиловый эфир, тетрагидрофуран, диоксан – перед применением нужно проверять на наличие гидроперекисей и при необхо-димости проводить очистку от них.
Слайд 46
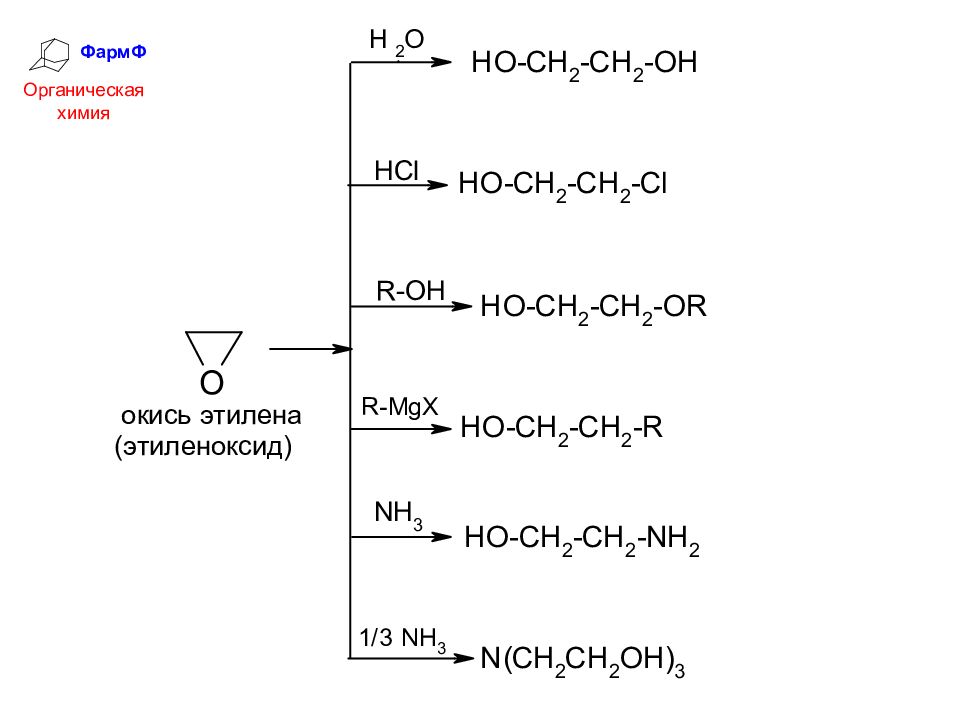
ФармФ Органическая химия ОКСИРАНЫ (1,2-ЭПОКСИДЫ) Оксиранами (1,2-эпоксидами) называются соединения, содержащие трехчленный цикл с атомом кислорода. Трехчленный цикл эпоксидов легко разрывается под действием нуклеофилов:
Последний слайд презентации: ФармФ Органическая химия СПИРТЫ ФЕНОЛЫ ПРОСТЫЕ ЭФИРЫ Лекция 11
ФармФ Органическая химия Отдельные представители простых эфиров – см. учебник. ЛИТЕРАТУРА : 1. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. – Органическая химия (основной курс) – ДРОФА, М., 2003 г., с. 340 – 404. 26.08.09