Слайд 2
ФармФ Органическая химия Алкалоиды – большая группа природных соединений. Их название ( alkali – подобный щелочи) указывает на их общее отличительное свойство – все они являются азотистыми основаниями. Это соединения в основном, растительного происхождения. Они образуются в процессе биосинтеза из аминокислот и содержатся в растениях в виде солей с органическими кислотами. К настоящему времени выделено более 5000 алкалоидов, для 3000 из них установлена молекулярная структура.
Слайд 3
ФармФ Органическая химия С глубокой древности растительные препараты, содержащие алкалоиды, использовались для лечения различных заболеваний. И в настоящее время, несмотря на наличие большого количества синтетических лекарственных веществ, алкалоиды не утратили своего значения в фармации. Химическая структура алкалоидов используется как модель для получения новых синтетических лекарственных препаратов, более простых по строению и часто более эффективных.
Слайд 4
ФармФ Органическая химия Различаются три типа алкалоидов: 1. Истинные алкалоиды. Они синтезируются из аминокислот и основой их структуры являются азотистые гетероциклы; 2. Протоалкалоиды. Не содержат гетероциклического фрагмента, но являются растительными аминами и также образуются из аминокислот; 3. Псевдоалкалоиды – соединения, содержащие аминогруппу, но образованные не из аминокислот. К ним относятся терпеновые и стероидные алкалоиды.
Слайд 5
ФармФ Органическая химия Классификация и номенклатура алкалоидов Алкалоиды классифицируются по трем признакам: 1. Химическая структура 2. Природные источники 3. Путь биосинтеза
Слайд 6
ФармФ Органическая химия Наиболее последовательна и универсальна классификация алкалоидов по структуре основного азотистого гетероцикла. Она в сочетании с классификацией по растительным источникам является практически исчерпывающей.
Слайд 7
ФармФ Органическая химия Индивидуальные алкалоиды всегда носят тривиальные названия, происходящие, как правило, от названия из природного растительного источника. Пользоваться систематической номенклатурой в ряду алкалоидов практически невозможно из-за сложности их структуры.
Слайд 8
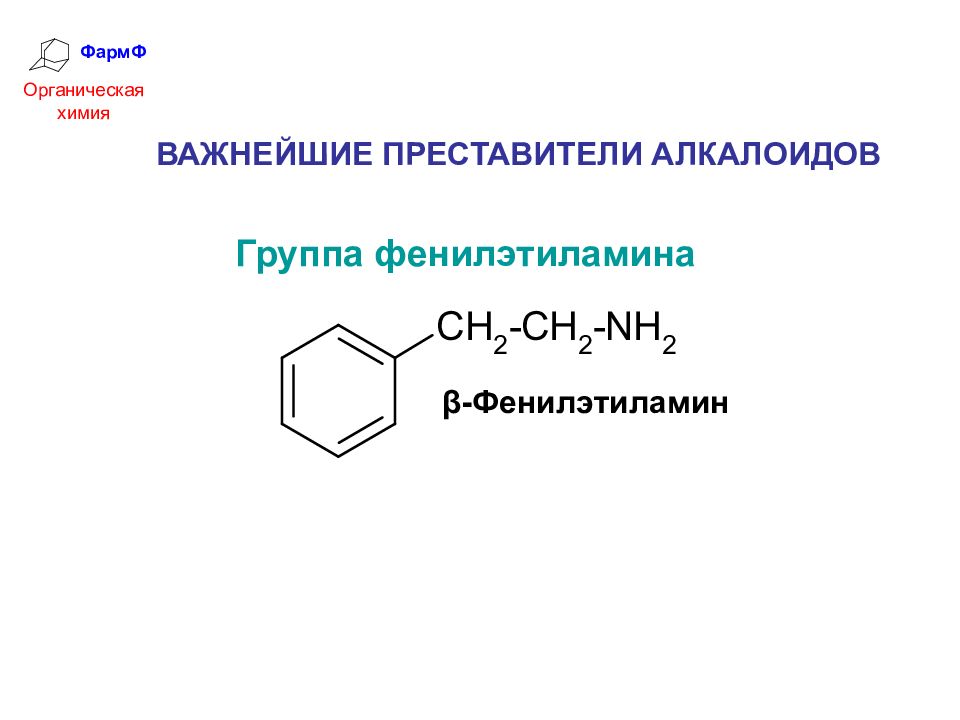
ФармФ Органическая химия ВАЖНЕЙШИЕ ПРЕСТАВИТЕЛИ АЛКАЛОИДОВ Группа фенилэтиламина β-Фенилэтиламин
Слайд 9
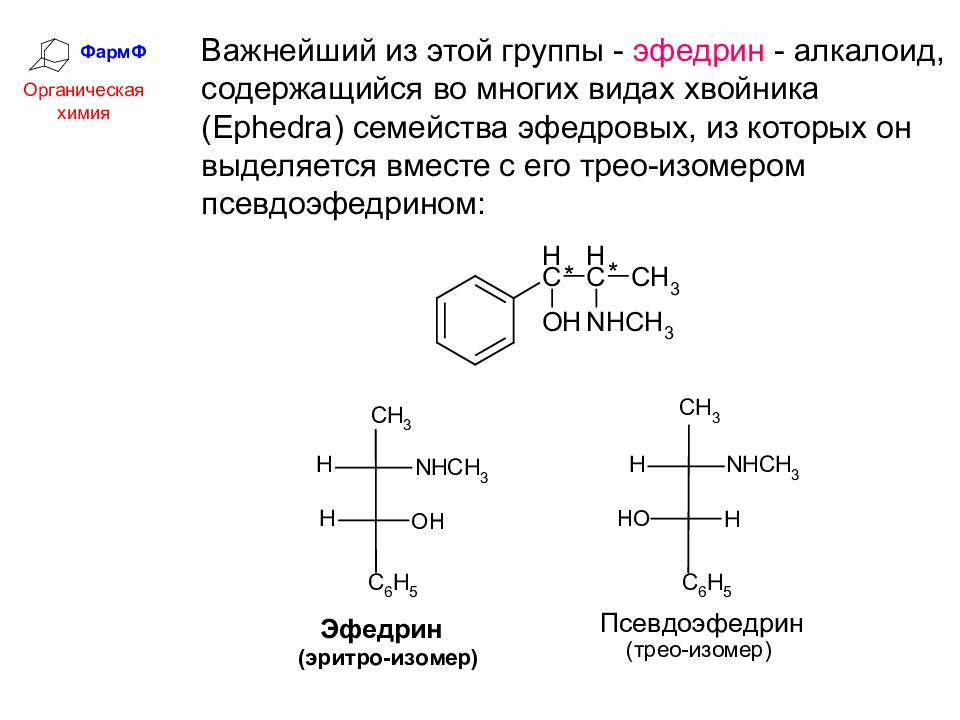
ФармФ Органическая химия Важнейший из этой группы - эфедрин - алкалоид, содержащийся во многих видах хвойника (Ephedra) семейства эфедровых, из которых он выделяется вместе с его трео-изомером псевдоэфедрином:
Слайд 10
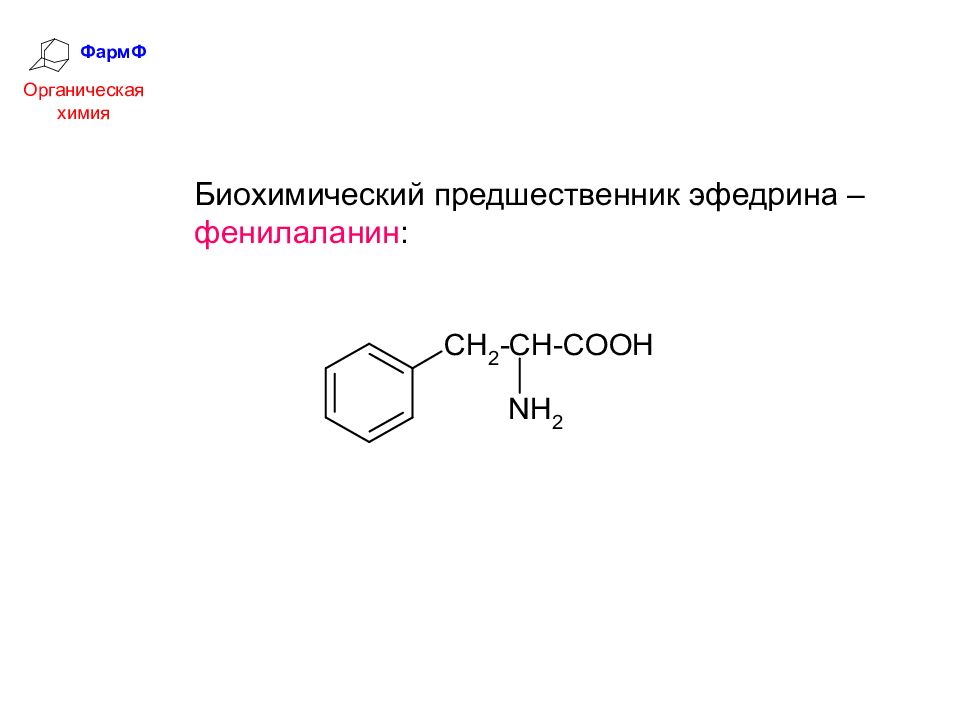
ФармФ Органическая химия Биохимический предшественник эфедрина – фенилаланин :
Слайд 11
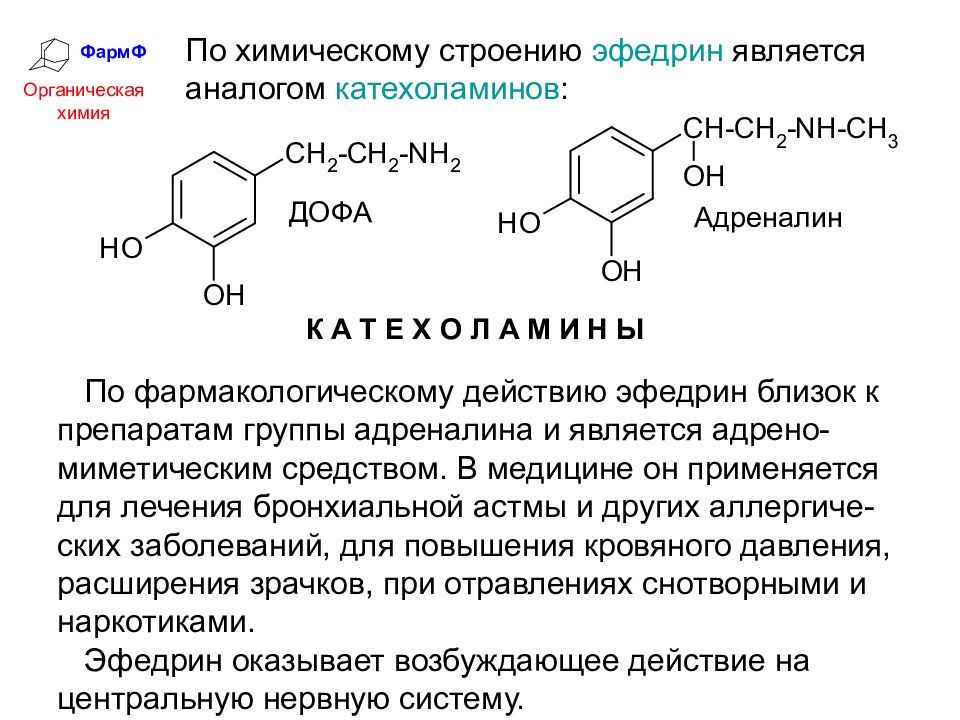
ФармФ Органическая химия По химическому строению эфедрин является аналогом катехоламинов : По фармакологическому действию эфедрин близок к препаратам группы адреналина и является адрено-миметическим средством. В медицине он применяется для лечения бронхиальной астмы и других аллергиче-ских заболеваний, для повышения кровяного давления, расширения зрачков, при отравлениях снотворными и наркотиками. Эфедрин оказывает возбуждающее действие на центральную нервную систему.
Слайд 12
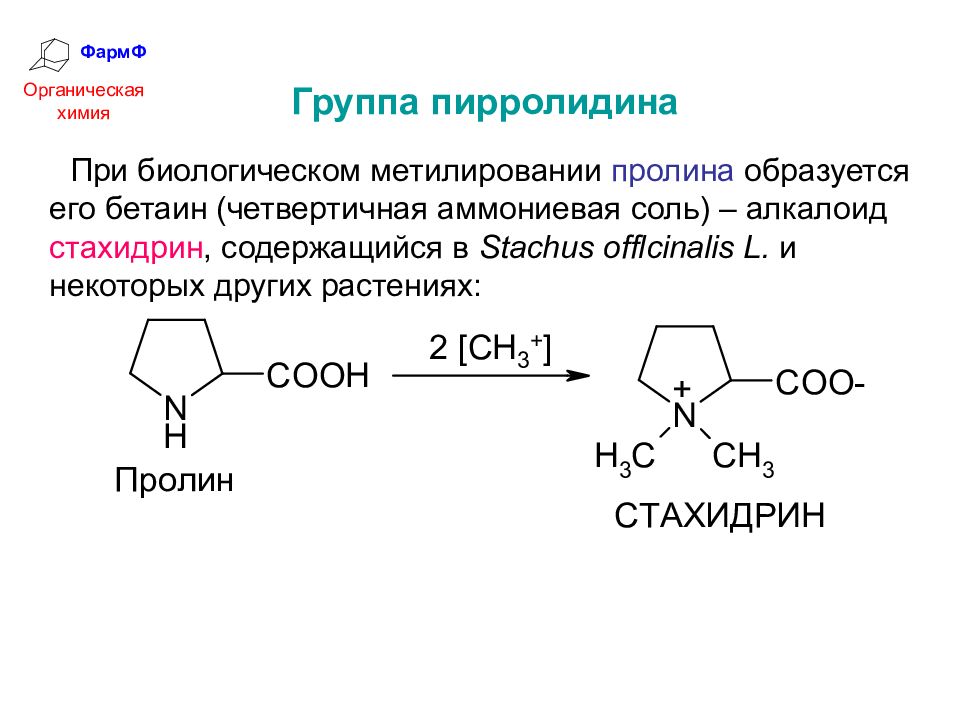
ФармФ Органическая химия Группа пирролидина При биологическом метилировании пролина образуется его бетаин (четвертичная аммониевая соль) – алкалоид стахидрин, содержащийся в Stachus offlcinalis L. и некоторых других растениях:
Слайд 13
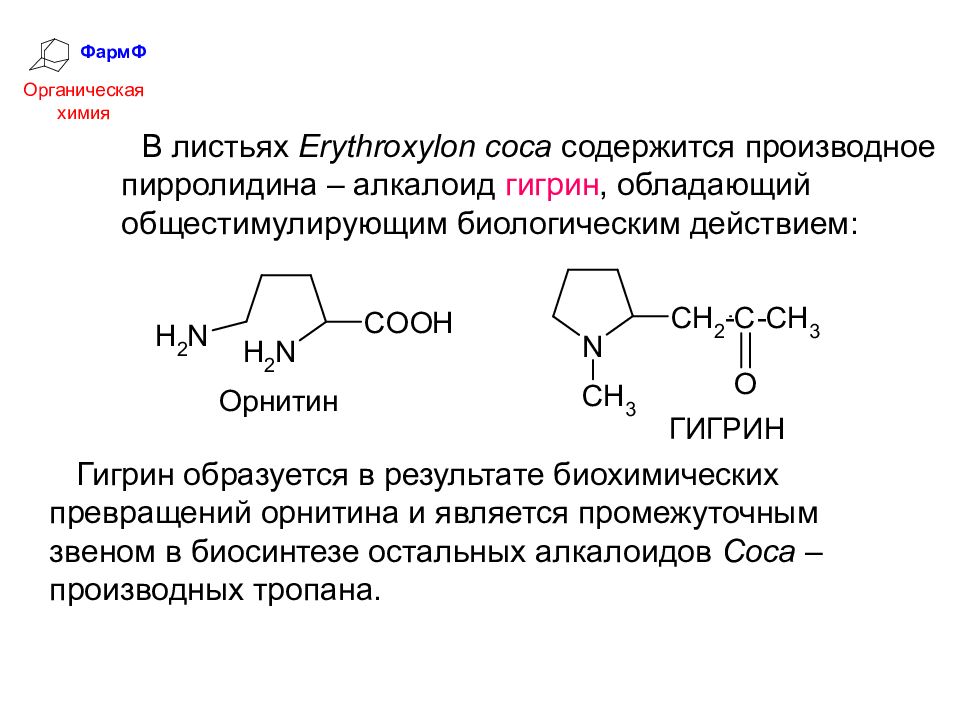
ФармФ Органическая химия В листьях Erythroxylon coca содержится производное пирролидина – алкалоид гигрин, обладающий общестимулирующим биологическим действием: Гигрин образуется в результате биохимических превращений орнитина и является промежуточным звеном в биосинтезе остальных алкалоидов Coca – производных тропана.
Слайд 14
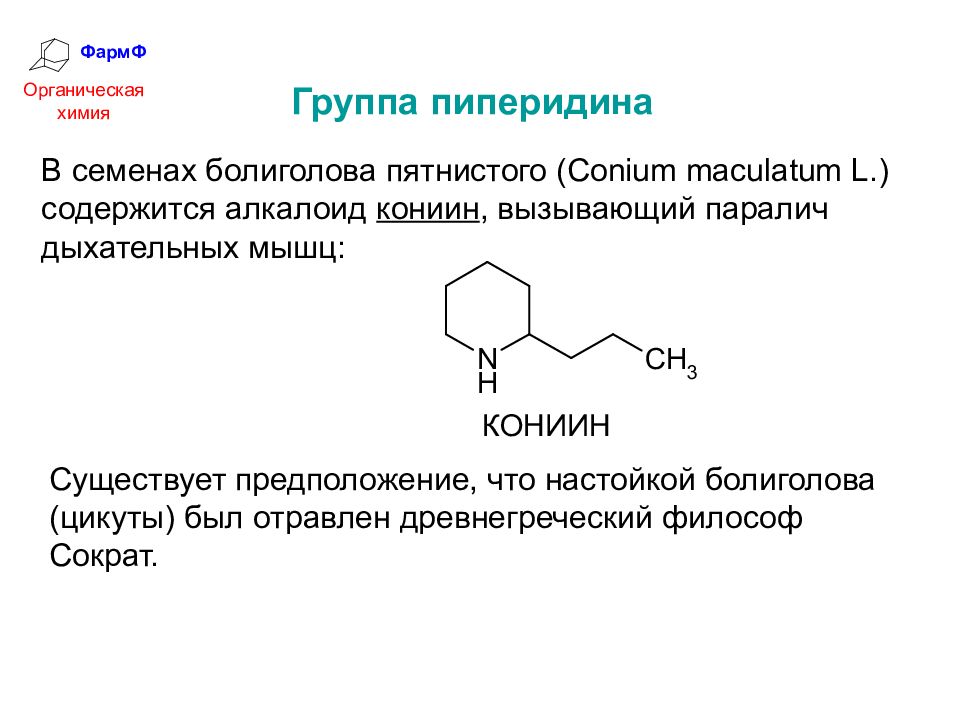
ФармФ Органическая химия Группа пиперидина В семенах болиголова пятнистого ( Conium maculatum L.) содержится алкалоид кониин, вызывающий паралич дыхательных мышц: Существует предположение, что настойкой болиголова (цикуты) был отравлен древнегреческий философ Сократ.
Слайд 15
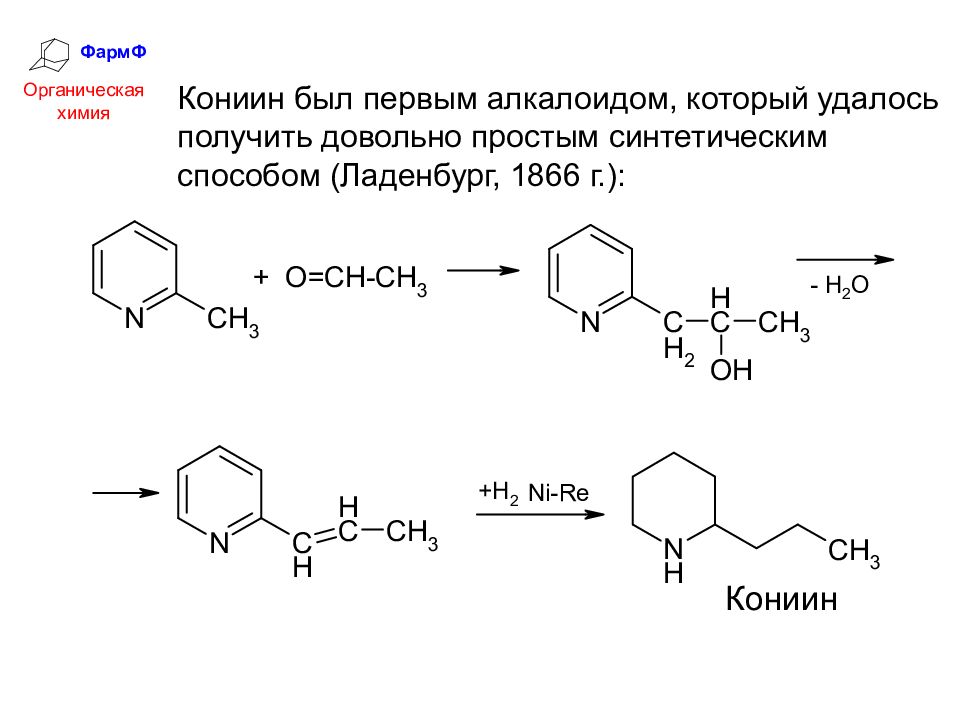
ФармФ Органическая химия Кониин был первым алкалоидом, который удалось получить довольно простым синтетическим способом (Ладенбург, 1866 г.):
Слайд 16
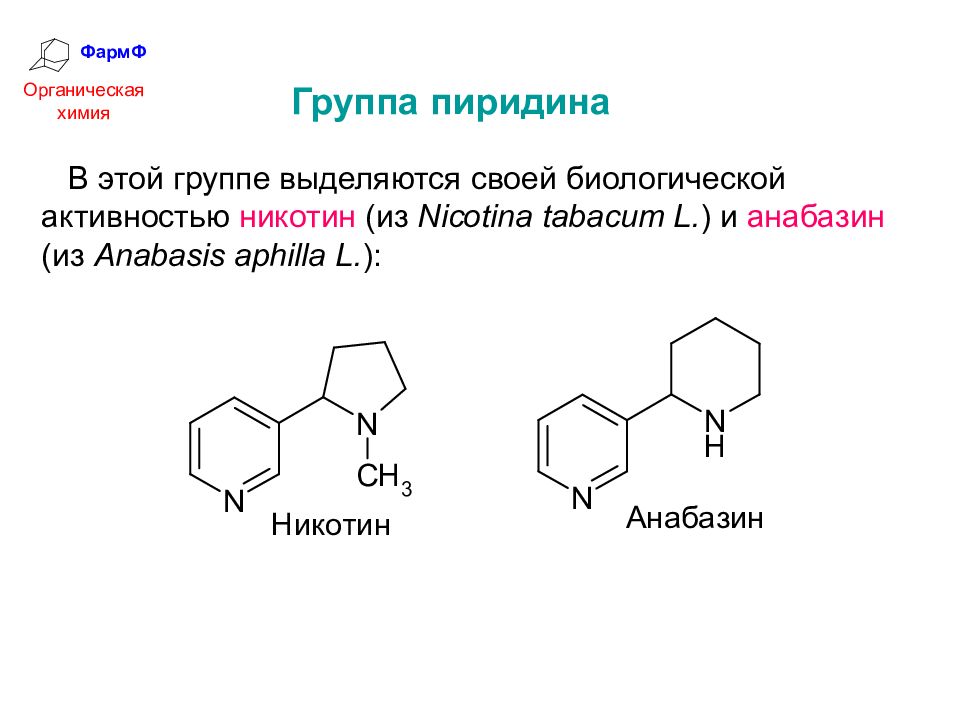
ФармФ Органическая химия Группа пиридина В этой группе выделяются своей биологической активностью никотин (из Nicotina tabacum L. ) и анабазин (из Anabasis aphilla L. ):
Слайд 18
ФармФ Органическая химия Никотин – бесцветная маслянистая жидкость с характерным табачным запахом, хорошо растворимая в воде и органических растворителях. В виде солей с лимонной или малеиновой кислотами он в значительных количествах (2-8%) содержится в сухих листьях табака, откуда может быть извлечен. В малых дозах никотин возбуждает ЦНС, в больших дозах – угнетает её, и, в конечном счете, приводит к параличу ЦНС, дыхания и сердечной деятельности.
Слайд 19
ФармФ Органическая химия Анабазин по фармакологическому действию похож на никотин. Ранее он применялся как средство, облегчающее отвыкание от курения, в настоящее время снят с производства из-за высокой токсичности. Никотин и анабазин неплохие инсектициды и используются в сельском хозяйстве.
Слайд 20
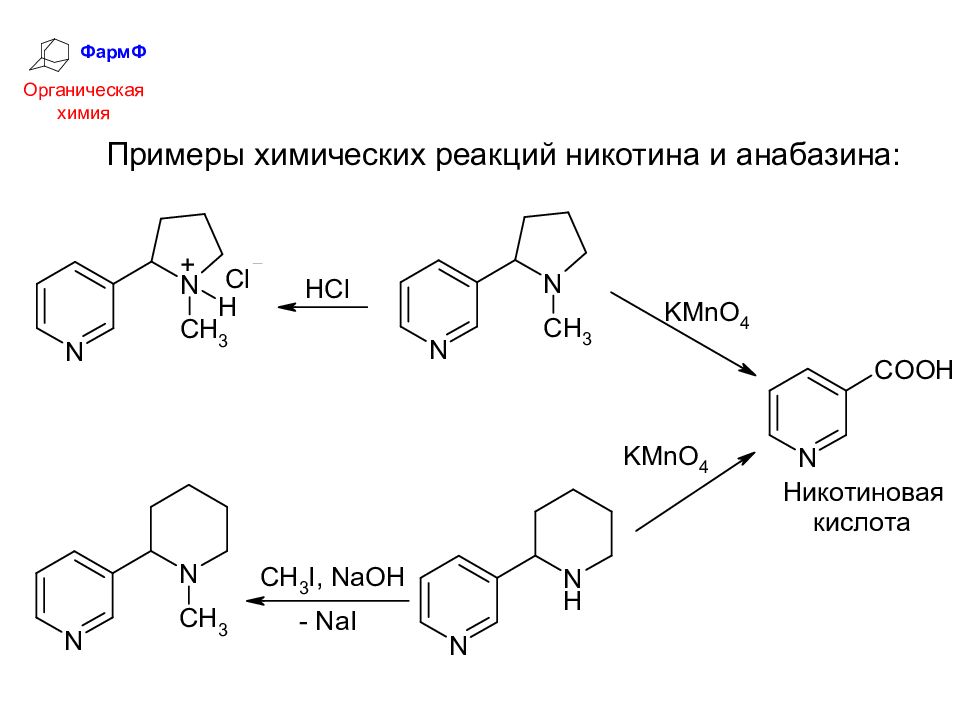
ФармФ Органическая химия Примеры химических реакций никотина и анабазина:
Слайд 21
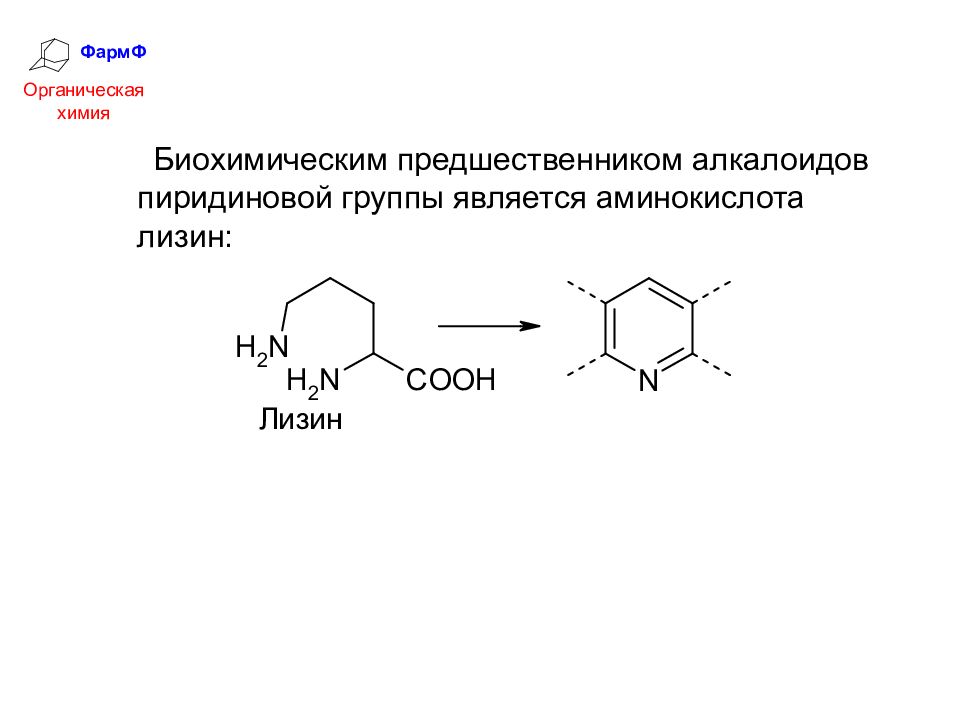
ФармФ Органическая химия Биохимическим предшественником алкалоидов пиридиновой группы является аминокислота лизин:
Слайд 22
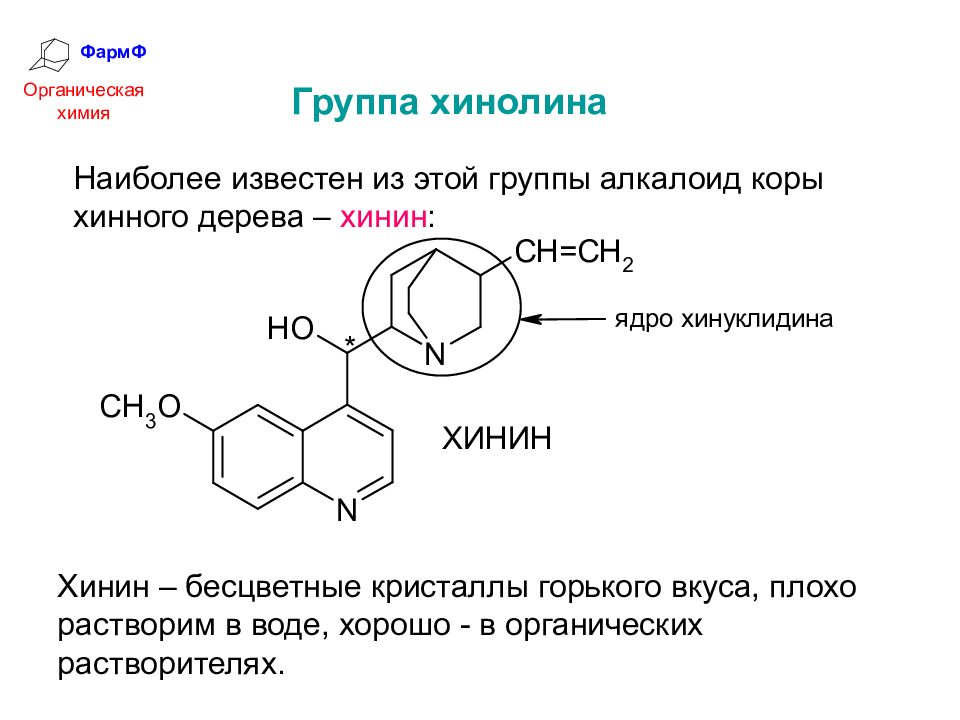
ФармФ Органическая химия Группа хинолина Наиболее известен из этой группы алкалоид коры хинного дерева – хинин : Хинин – бесцветные кристаллы горького вкуса, плохо растворим в воде, хорошо - в органических растворителях.
Слайд 23
ФармФ Органическая химия Xинин имеет два атома азота различной основности. Он образует два ряда солей, в которых протонируется сначала хинуклидиновый N -атом, а затем оба атома азота. Соли хинина представляют собой бесцветные кристаллы горького вкуса.
Слайд 24
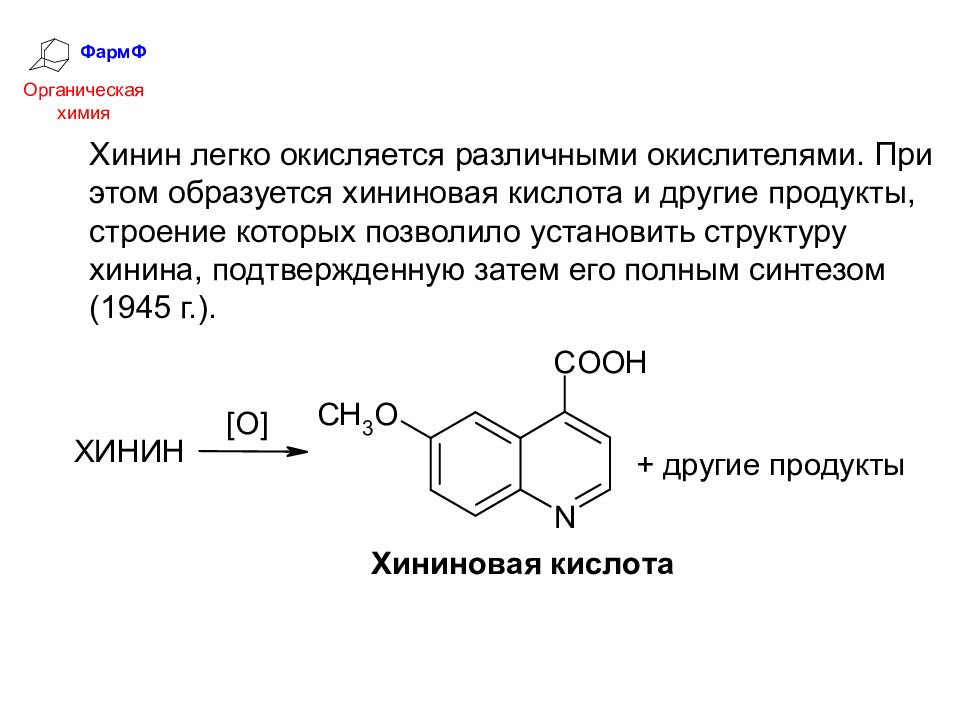
ФармФ Органическая химия Хинин легко окисляется различными окислителями. При этом образуется хининовая кислота и другие продукты, строение которых позволило установить структуру хинина, подтвержденную затем его полным синтезом (1945 г.).
Слайд 25
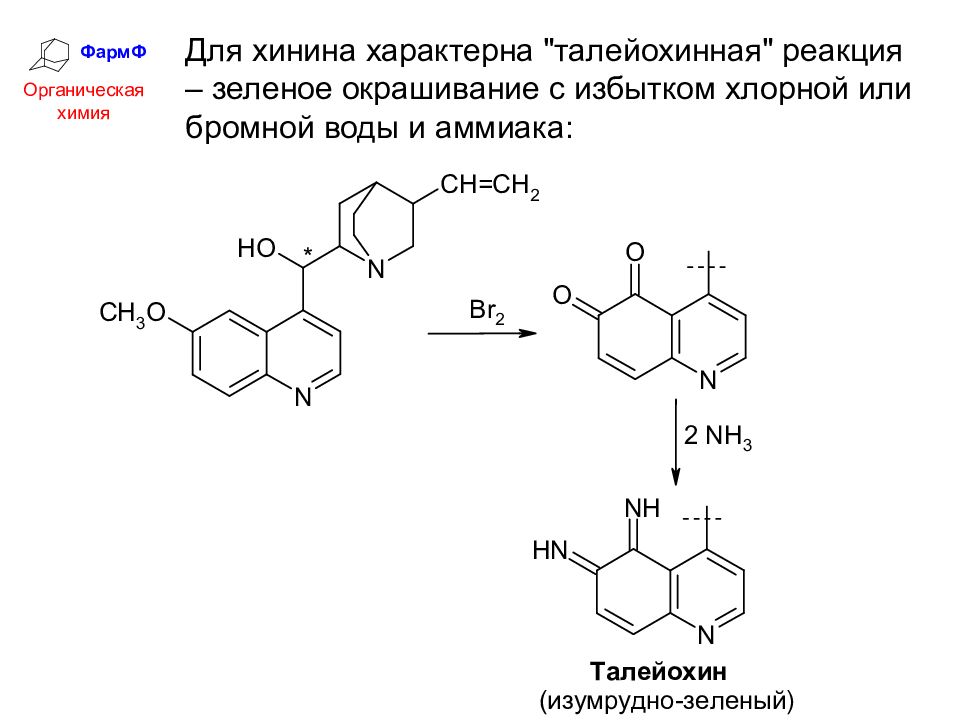
ФармФ Органическая химия Для хинина характерна "талейохинная" реакция – зеленое окрашивание с избытком хлорной или бромной воды и аммиака:
Слайд 26
ФармФ Органическая химия Xинин токсичен по отношению ко многим бактериям и другим одноклеточным организмам. Он оказывает разностороннее действие на организм человека. Характерное свойство хинина - противомалярийное действие. Причем рацематы и синтетические энантиомеры хинина обладают таким же действием. В медицинской практике для лечения малярии применяют гидрохлорид и сульфат хинина. Хинин в очень малых дозах добавляют в прохладительные напитки для придания горечи.
Слайд 27
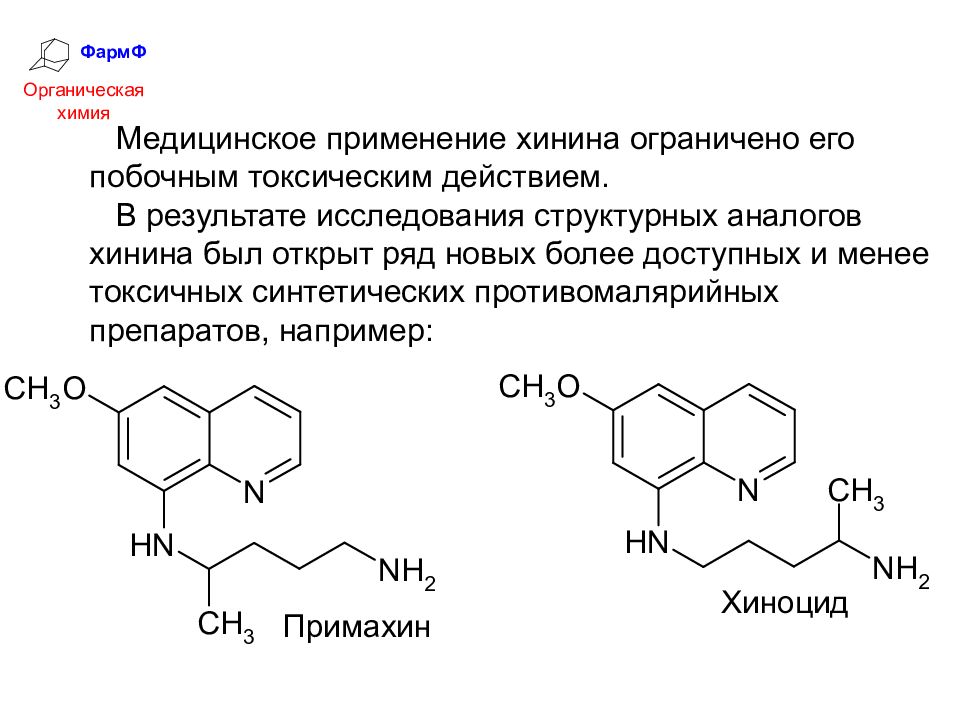
ФармФ Органическая химия Медицинское применение хинина ограничено его побочным токсическим действием. В результате исследования структурных аналогов хинина был открыт ряд новых более доступных и менее токсичных синтетических противомалярийных препаратов, например:
Слайд 29
ФармФ Органическая химия Алкалоиды, выделяемые из снотворного, или опийного, мака ( Papaver somniferum ), можно разделить на две группы: 1) производные фенантрена, содержащие цикл пиперидина; 2) производные изохинолина.
Слайд 30
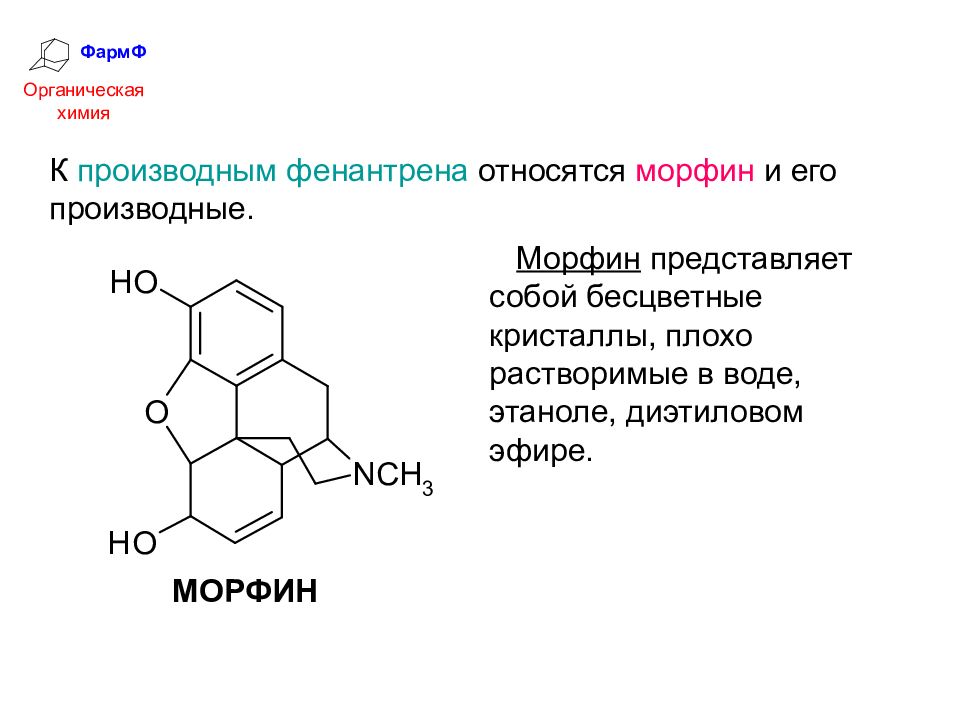
ФармФ Органическая химия К производным фенантрена относятся морфин и его производные. Морфин представляет собой бесцветные кристаллы, плохо растворимые в воде, этаноле, диэтиловом эфире.
Слайд 31
ФармФ Органическая химия Морфин получают из опия - сгущенного млечного сока, вытекающего из надрезов на недозрелых головках снотворного мака. Содержание морфина в опии колеблется от 10 до 20%. В растении морфин образуется из тирозина.
Слайд 32
ФармФ Органическая химия Морфин - наркотический анальгетик. Он оказывает сильное болеутоляющее, противошоковое, а в больших дозах – снотворное действие; при этом угнетает дыхательный центр и вызывает эйфорию. При повторном применении морфина быстро развивается болезненное пристрастие (морфинизм). Эти свойства морфина ограничивают в его медицинское использование. Применяют морфин при травмах и заболеваниях, сопровождающихся сильными болевыми ощущениями.
Слайд 33
ФармФ Органическая химия Наряду с морфином в опии содержатся его моно- и диметильное производные – кодеин и тебаин : Их наркотическое действие гораздо слабее, чем у морфина. Кодеин обладает свойством угнетать кашлевый центр и применяется в медицине как средство от кашля.
Слайд 34
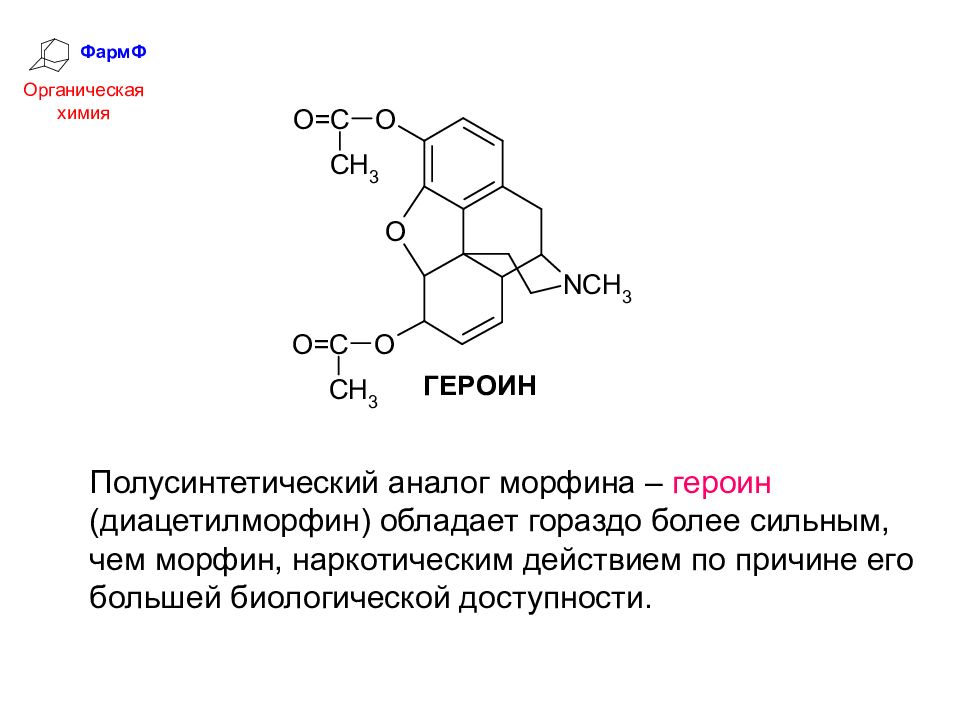
ФармФ Органическая химия Полусинтетический аналог морфина – героин (диацетилморфин) обладает гораздо более сильным, чем морфин, наркотическим действием по причине его большей биологической доступности.
Слайд 35
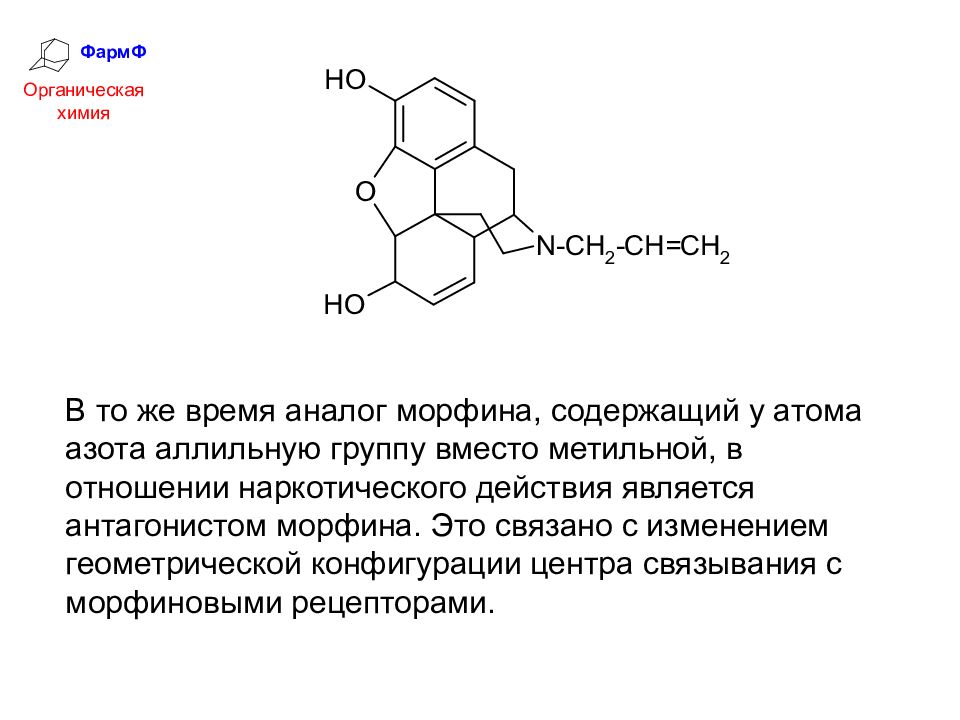
ФармФ Органическая химия В то же время аналог морфина, содержащий у атома азота аллильную группу вместо метильной, в отношении наркотического действия является антагонистом морфина. Это связано с изменением геометрической конфигурации центра связывания с морфиновыми рецепторами.
Слайд 36
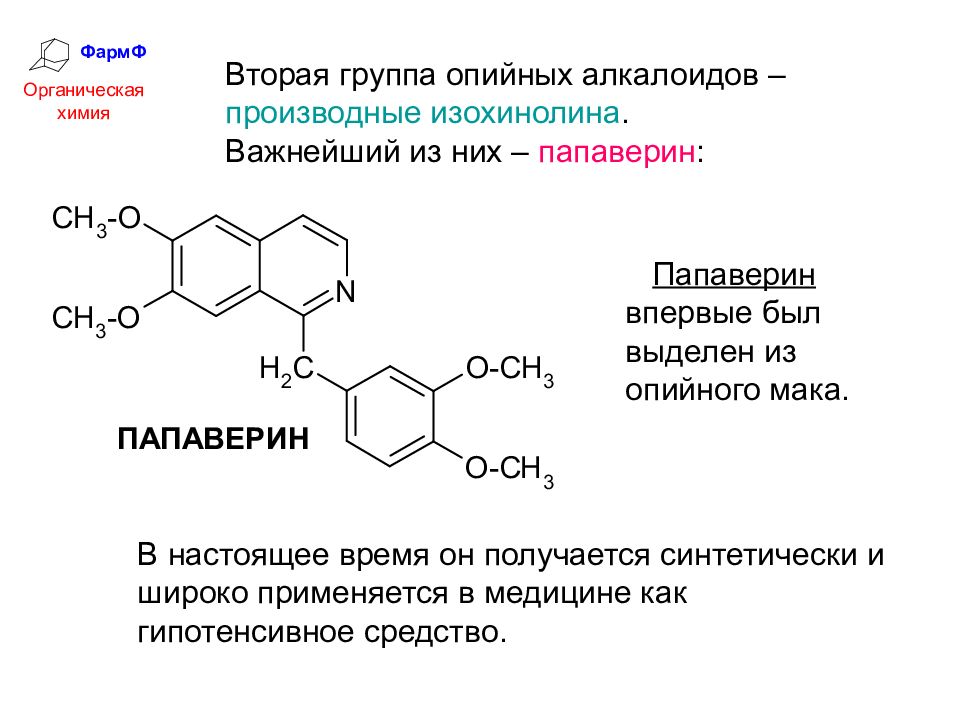
ФармФ Органическая химия Вторая группа опийных алкалоидов – производные изохинолина. Важнейший из них – папаверин : Папаверин впервые был выделен из опийного мака. В настоящее время он получается синтетически и широко применяется в медицине как гипотенсивное средство.
Слайд 37
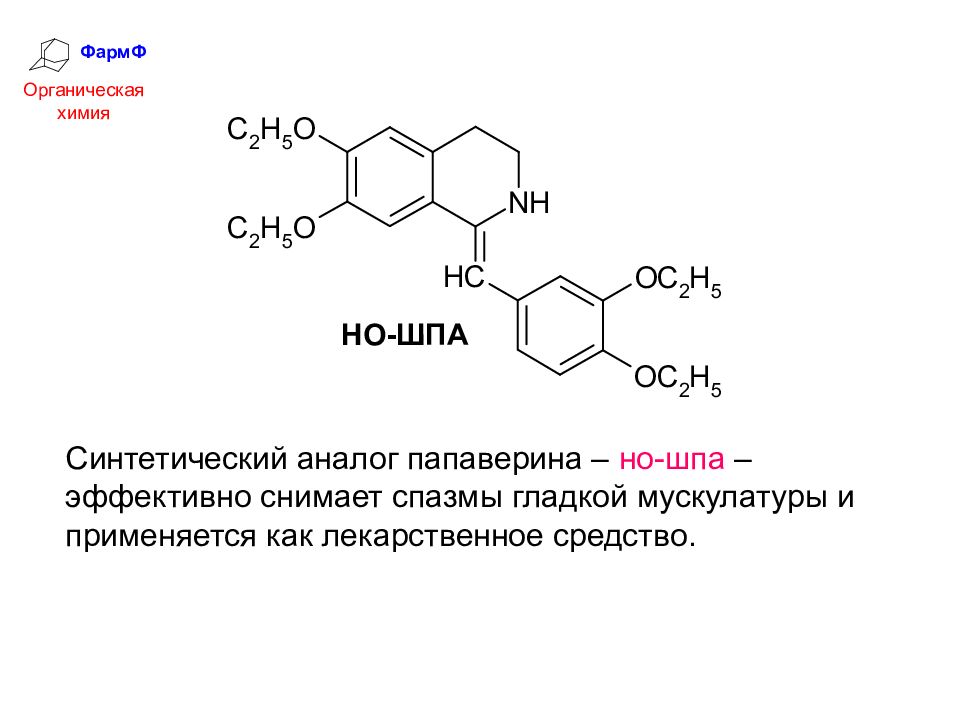
ФармФ Органическая химия Синтетический аналог папаверина – но-шпа – эффективно снимает спазмы гладкой мускулатуры и применяется как лекарственное средство.
Слайд 38
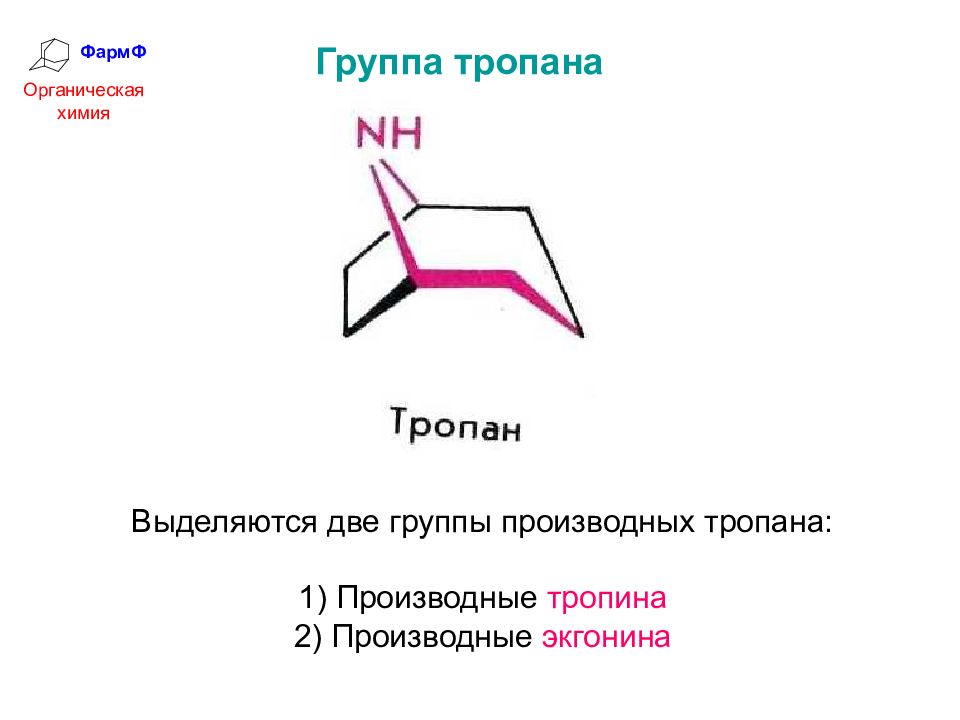
ФармФ Органическая химия Группа тропана Выделяются две группы производных тропана: 1) Производные тропина 2) Производные экгонина
Слайд 39
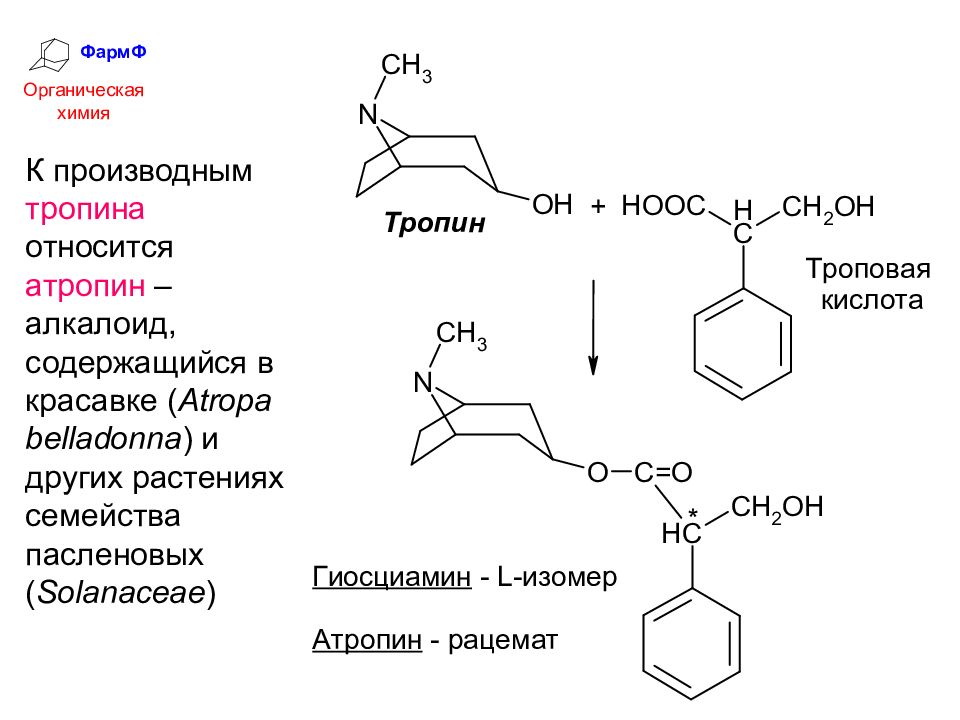
ФармФ Органическая химия К производным тропина относится атропин – алкалоид, содержащийся в красавке ( Atropa belladonna ) и других растениях семейства пасленовых ( Solanaceae )
Слайд 40
ФармФ Органическая химия Атропин – блокатор холинорецепторов, расслабляющий гладкую мускулатуру. Его применяют как спазмолитическое средство в глазной практике для диагностических и лечебных целей. Он используется также как противоядие при отравлении мускарином и другими веществами антиацетил-холинэстеразного действия, а также наркотиками и снотворными.
Слайд 41
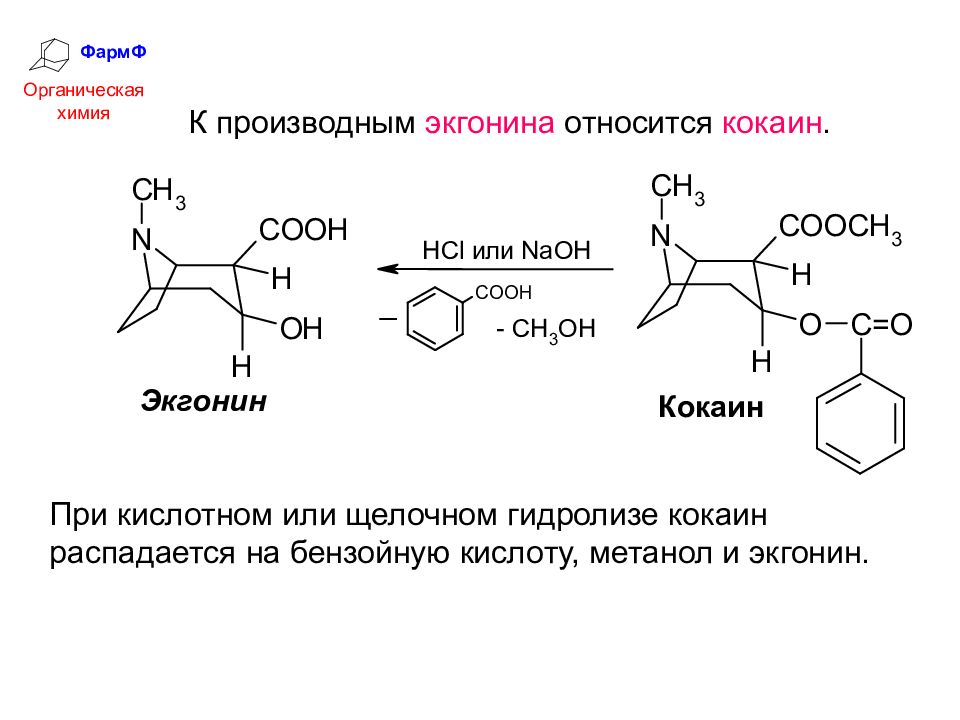
ФармФ Органическая химия К производным экгонина относится кокаин. При кислотном или щелочном гидролизе кокаин распадается на бензойную кислоту, метанол и экгонин.
Слайд 42
ФармФ Органическая химия Кокаин содержится в листьях кустарника кока ( Erythroxylon coca ) в количестве около 1 %.
Слайд 43
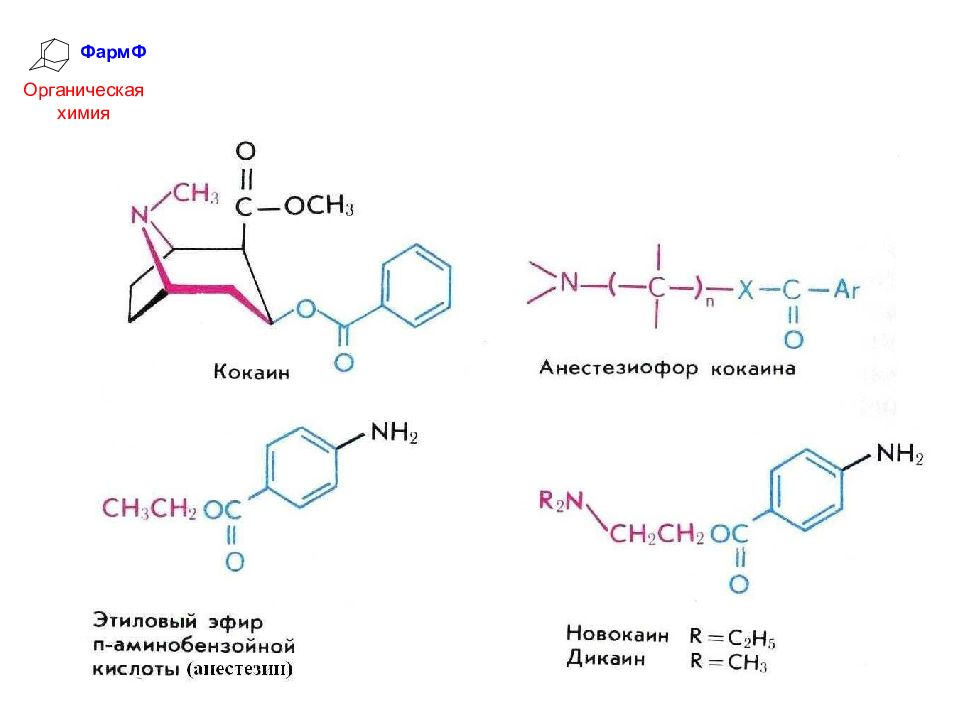
ФармФ Органическая химия Кокаин – один из первых местноанестезирующих препаратов. Недостатком его является наркотическое действие. Синтетические аналоги кокаина – анестезин, новокаин, дикаин - лишены наркотических свойств и широко применяются в медицинской практике как местные анестетики:
Слайд 45
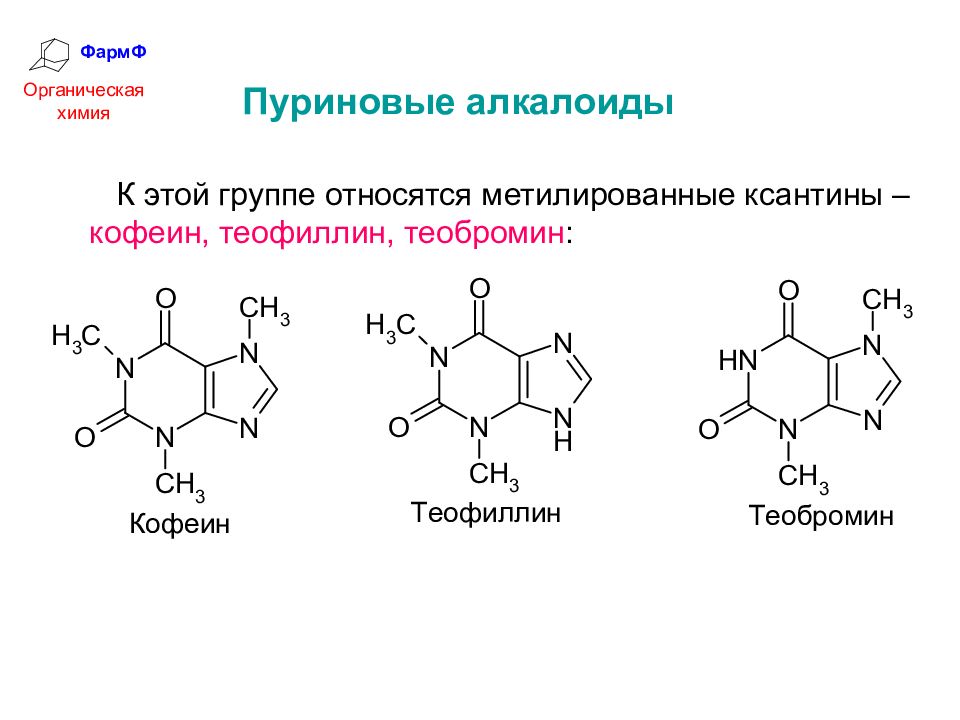
ФармФ Органическая химия Пуриновые алкалоиды К этой группе относятся метилированные ксантины – кофеин, теофиллин, теобромин :
Слайд 46
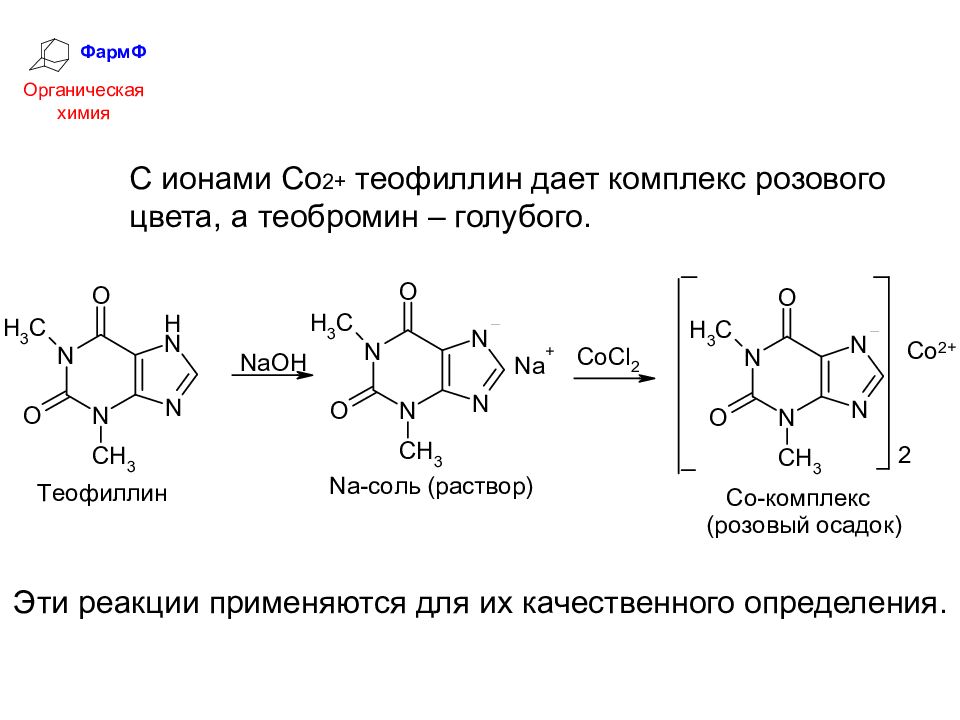
ФармФ Органическая химия Оснóвные свойства метилированных ксантинов выражены очень слабо. Их соли с минеральными кислотами гидролизуются. В то же время теофиллин и теобромин обладают NH -кислотностью: они образуют растворимые соли со щелочами, а ионами переходных металлов дают нерастворимые окрашенные комплексы.
Слайд 47
ФармФ Органическая химия С ионами Со 2+ теофиллин дает комплекс розового цвета, а теобромин – голубого. Эти реакции применяются для их качественного определения.
Слайд 48
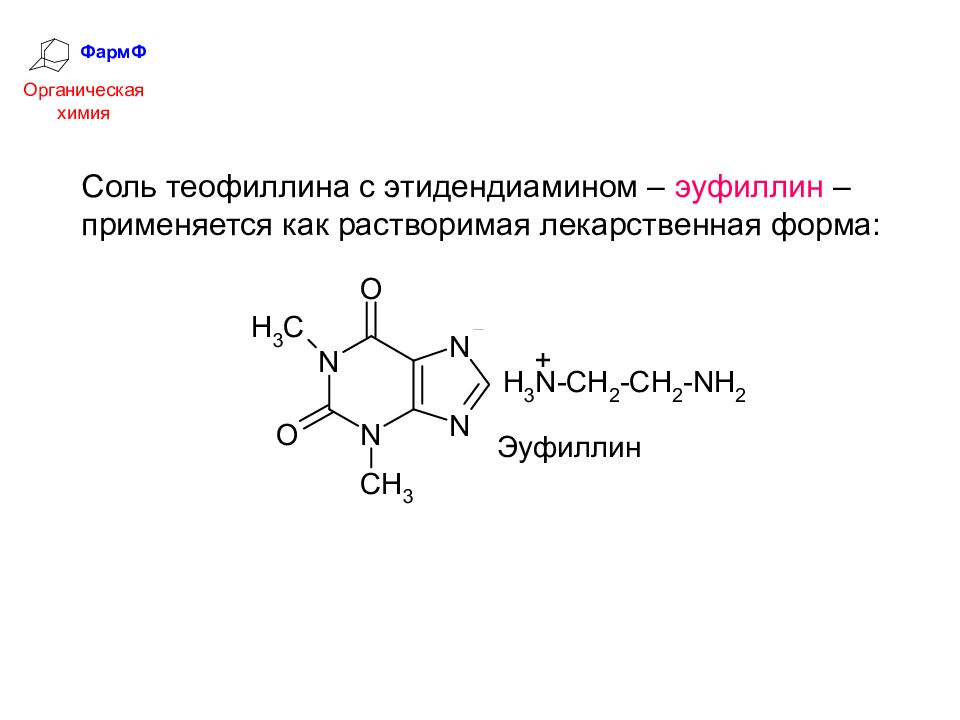
ФармФ Органическая химия Соль теофиллина с этидендиамином – эуфиллин – применяется как растворимая лекарственная форма:
Слайд 49
ФармФ Органическая химия Пуриновые алкалоиды широко распространены в растительном мире, их источники – чай, кофе, какао. В настоящее время все они получаются синтетически. Биологическая активность их во многом сходна: они стимулируют ЦНС (особенно кофеин), расширяют бронхи, усиливают сердечную деятельность и диурез.
Слайд 50
ФармФ Органическая химия Кофеин широко применяется при лечении заболеваний, связанных с угнетением ЦНС и сердечно-сосудистой системы, спазмах сосудов головного мозга, для повышении работоспособности, при отравлении наркотиками, а также как пищевая добавка:~ 80% производимого кофеина потребляется пищевой промышленностью.
Слайд 51
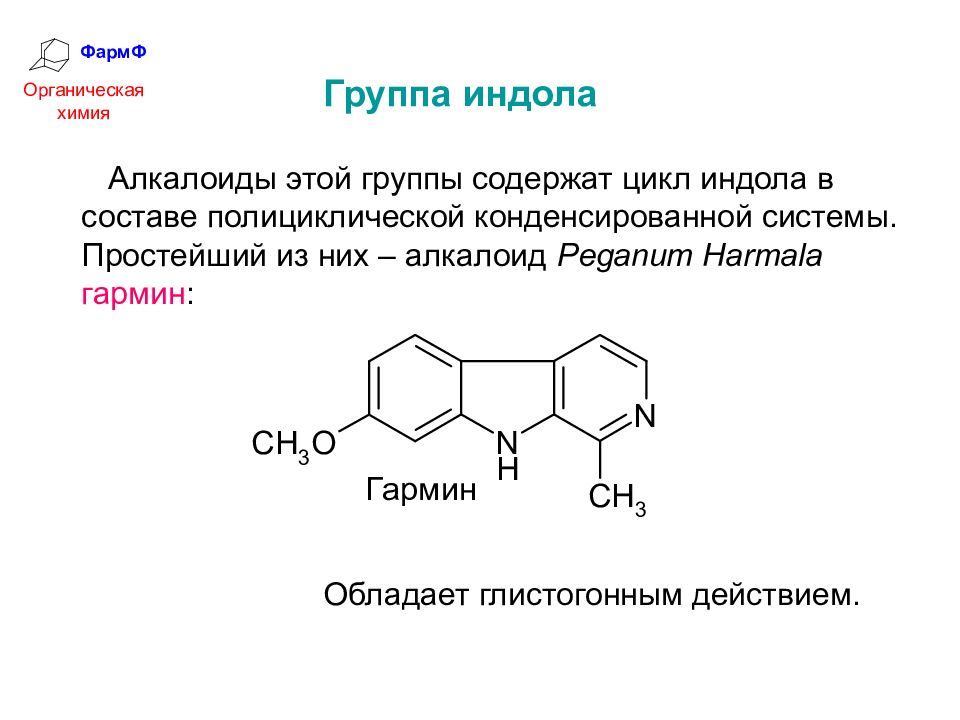
ФармФ Органическая химия Группа индола Алкалоиды этой группы содержат цикл индола в составе полициклической конденсированной системы. Простейший из них – алкалоид Peganum Harmala гармин : Обладает глистогонным действием.
Слайд 52
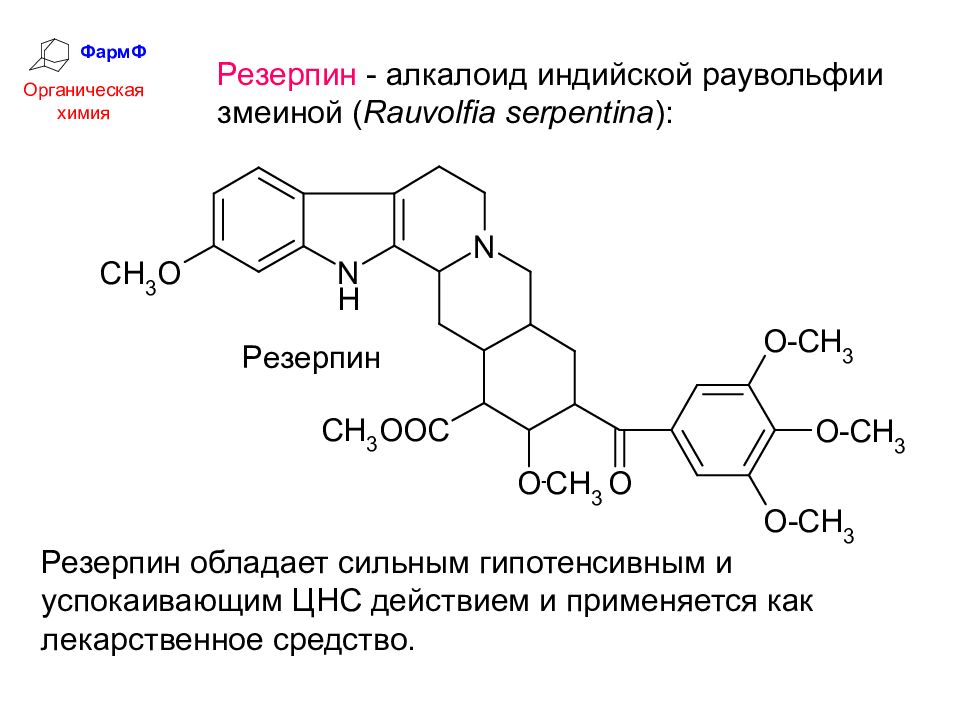
ФармФ Органическая химия Резерпин - алкалоид индийской раувольфии змеиной ( Rauvolfia serpentina ): Резерпин обладает сильным гипотенсивным и успокаивающим ЦНС действием и применяется как лекарственное средство.
Слайд 53
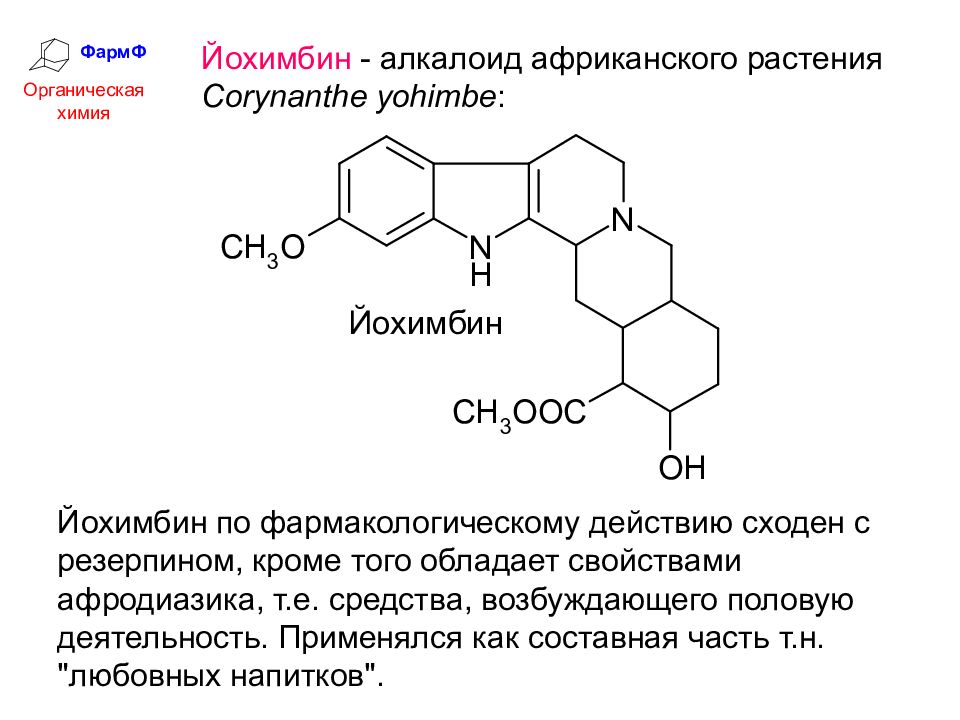
ФармФ Органическая химия Йохимбин - алкалоид африканского растения Corynanthe yohimbe : Йохимбин по фармакологическому действию сходен с резерпином, кроме того обладает свойствами афродиазика, т.е. средства, возбуждающего половую деятельность. Применялся как составная часть т.н. "любовных напитков".
Слайд 54
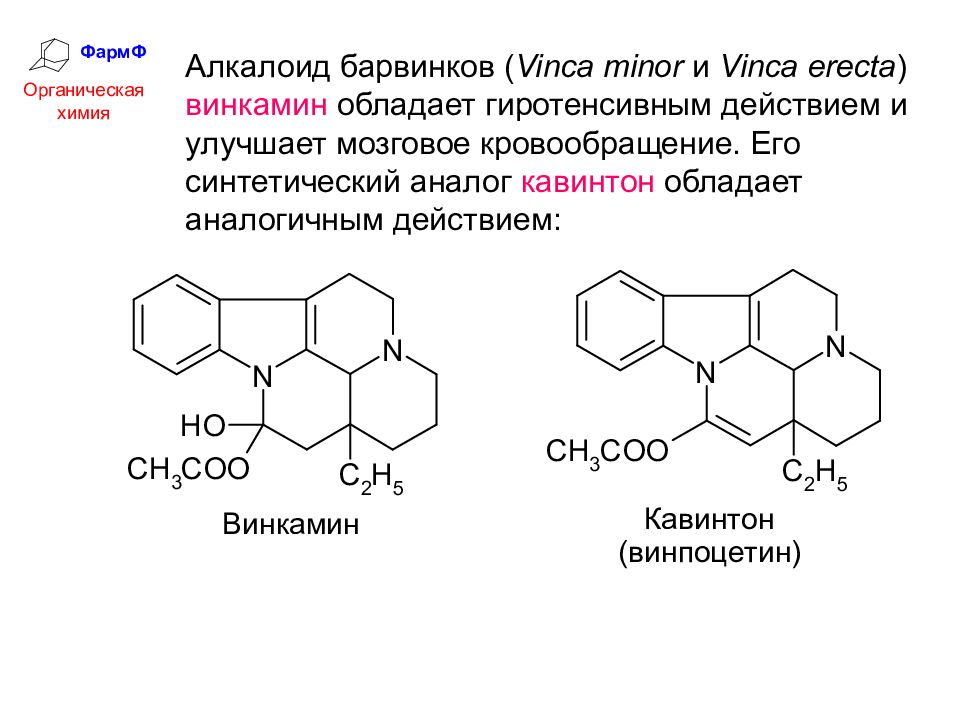
ФармФ Органическая химия Алкалоид барвинков ( Vinca minor и Vinca erecta ) винкамин обладает гиротенсивным действием и улучшает мозговое кровообращение. Его синтетический аналог кавинтон обладает аналогичным действием:
Слайд 55
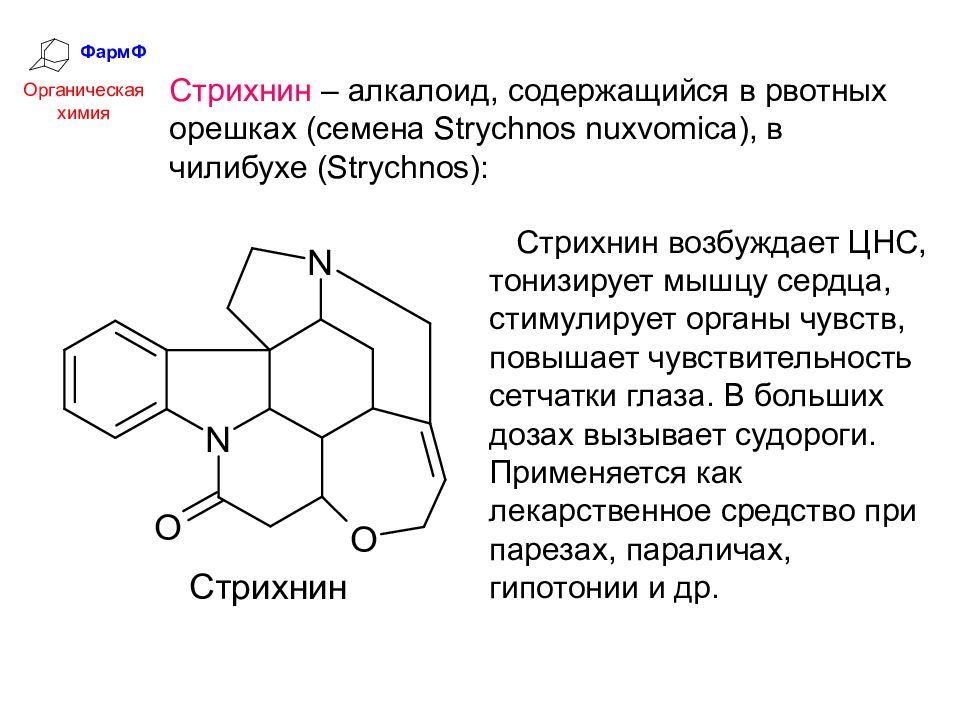
ФармФ Органическая химия Стрихнин – алкалоид, содержащийся в рвотных орешках (семена Strychnos nuxvomica), в чилибухе (Strychnos): Стрихнин возбуждает ЦНС, тонизирует мышцу сердца, стимулирует органы чувств, повышает чувствительность сетчатки глаза. В больших дозах вызывает судороги. Применяется как лекарственное средство при парезах, параличах, гипотонии и др.
Слайд 56
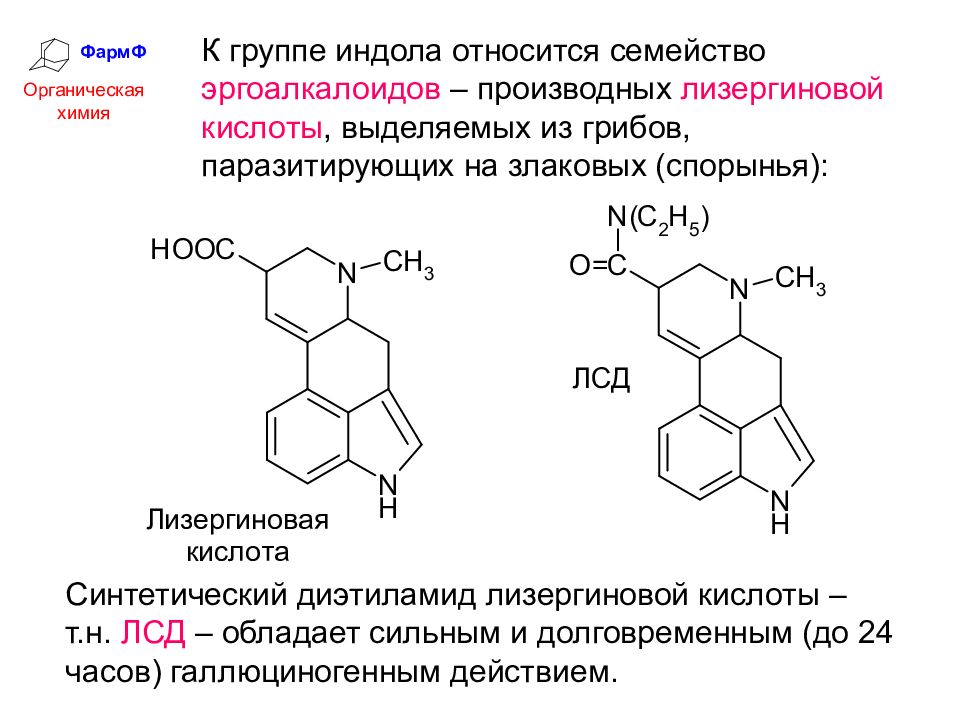
ФармФ Органическая химия К группе индола относится семейство эргоалкалоидов – производных лизергиновой кислоты, выделяемых из грибов, паразитирующих на злаковых (спорынья): Синтетический диэтиламид лизергиновой кислоты – т.н. ЛСД – обладает сильным и долговременным (до 24 часов) галлюциногенным действием.
Слайд 57
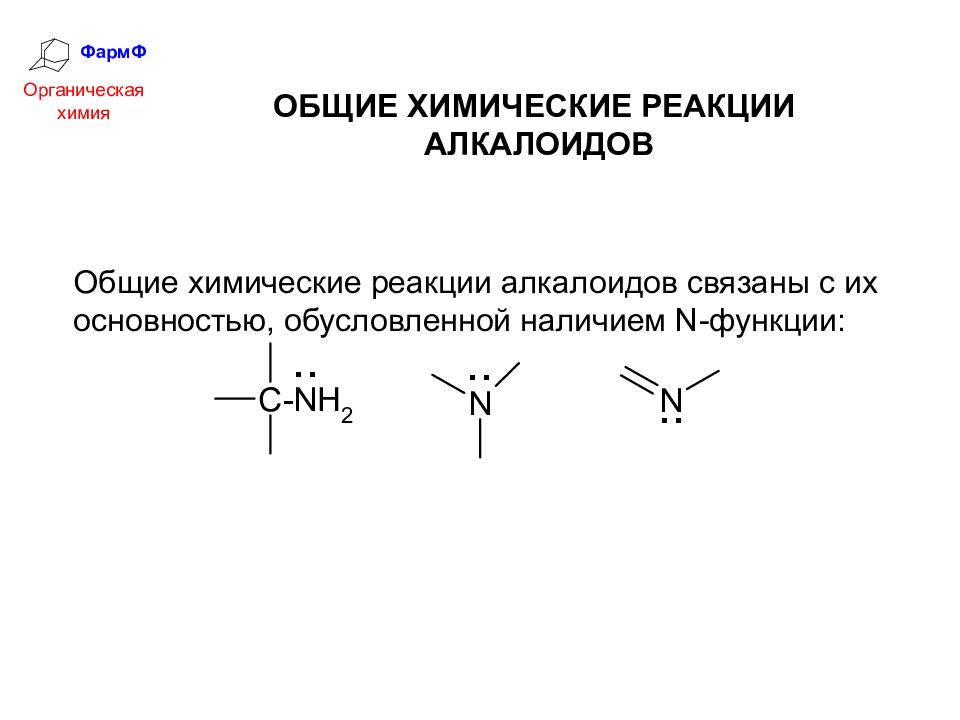
ФармФ Органическая химия ОБЩИЕ ХИМИЧЕСКИЕ РЕАКЦИИ АЛКАЛОИДОВ Общие химические реакции алкалоидов связаны с их основностью, обусловленной наличием N -функции:
Слайд 58
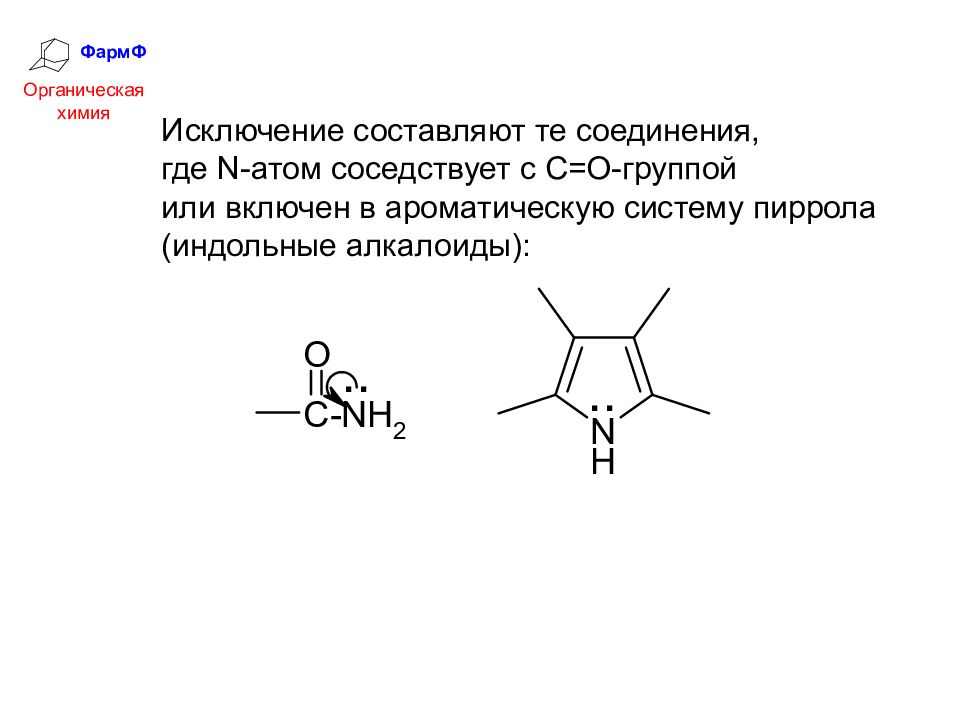
ФармФ Органическая химия Исключение составляют те соединения, где N -атом соседствует с С=О-группой или включен в ароматическую систему пиррола (индольные алкалоиды):
Слайд 59
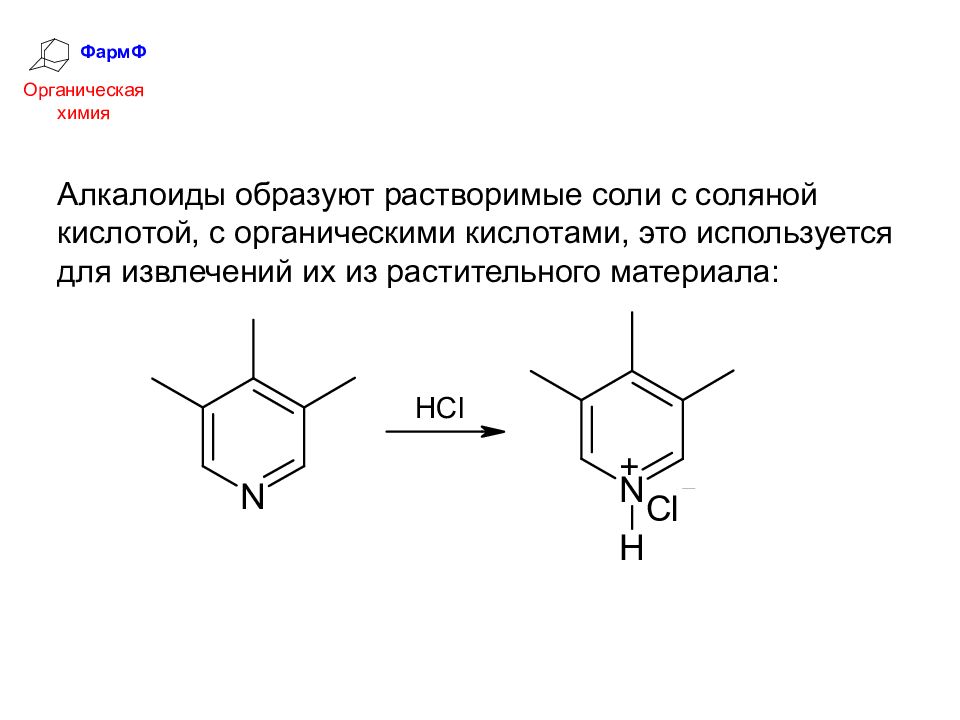
ФармФ Органическая химия Алкалоиды образуют растворимые соли с соляной кислотой, с органическими кислотами, это используется для извлечений их из растительного материала:
Слайд 60
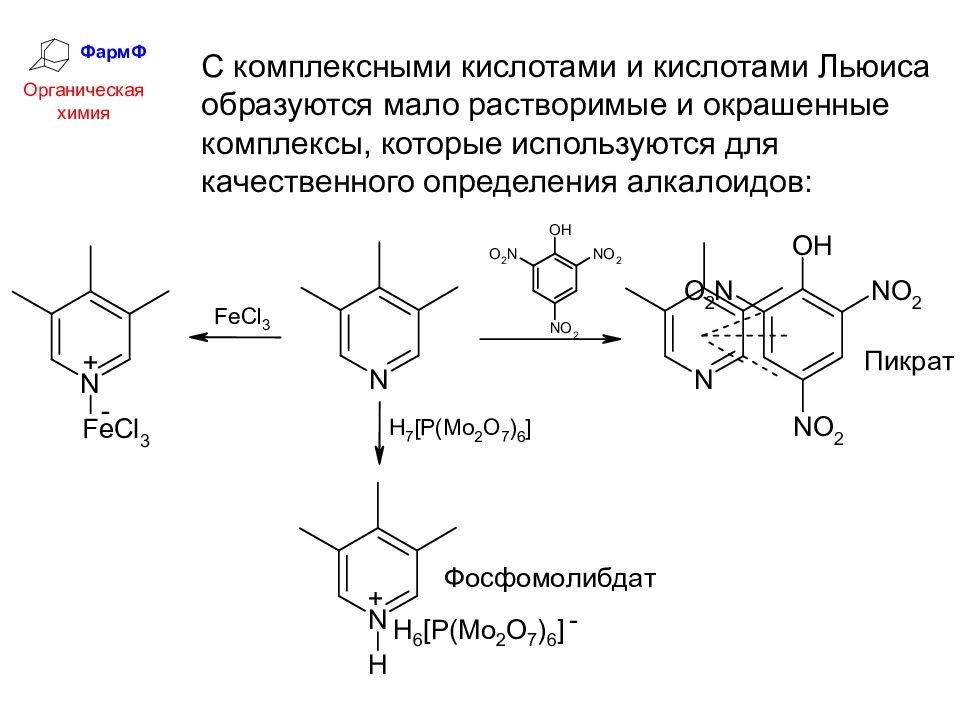
ФармФ Органическая химия С комплексными кислотами и кислотами Льюиса образуются мало растворимые и окрашенные комплексы, которые используются для качественного определения алкалоидов:
Последний слайд презентации: ФармФ Органическая химия Лекция 31 АЛКАЛОИДЫ
ФармФ Органическая химия ЛИТЕРАТУРА : Основная: 1. Тюкавкина Н.А., Зурабян С.Э., Белобородов В.Л. и др. – Органическая химия (специальный курс), кн.2 – Дрофа, М., 2008 г., с.228-236, 289-317. 2. Н.А.Тюкавкина, Ю.И.Бауков – Биоорганическая химия – ДРОФА, М., 2007 г., с. 444-464. Дополнительная: 1. Овчинников Ю.А. – Биоорганическая химия – М., Просвещение, 1987, с.638-668. 2. В.В.Племенков – Введение в химию природных соединений – Учебное пособие для химических, биологических и медицинских специальностей ВУЗов, Казань, 2001, с. 223-261. 01.11.09