Первый слайд презентации: Федеральный закон от 12 апреля 2010 года N 61-ФЗ " Об обращении лекарственных средств"
Слайд 3: 1. ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
ФЗ регулирует отношения, возникающие в связи с обращением ЛС ФЗ устанавливает приоритет государственного регулирования безопасности, качества и эффективности ЛС при их обращении Клинические исследования 1. Общие положения
Слайд 4: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка ЛС - поиск новых фармакологически активных веществ, последующее изучение их лекарственных свойств, доклинические исследования, разработка технологий производства фармацевтических субстанций, разработка составов и технологий производства лекарственных препаратов Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 5: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка ЛС - поиск новых фармакологически активных веществ, последующее изучение их лекарственных свойств, доклинические исследования, разработка технологий производства фармацевтических субстанций, разработка составов и технологий производства лекарственных препаратов Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 6: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования ЛС - применение научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 7: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования ЛС - применение научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 8: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования ЛС - исследования, проводимые для государственной регистрации лекарственных препаратов и иного предназначения в одной или нескольких медицинских организациях в соответствии с правилами клинической практики Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 9: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования ЛС - исследования, проводимые для государственной регистрации лекарственных препаратов и иного предназначения в одной или нескольких медицинских организациях в соответствии с правилами клинической практики Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 10: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза ЛС – рассмотрение документов для получения разрешения на проведение клинического исследования лекарственного препарата, изучение предложенных методов контроля качества лекарственного средства и качества представленных образцов лекарственного средства с использованием этих методов исследование отношения ожидаемой пользы к возможному риску применения лекарственного препарата, осуществляемые после проведения его клинического исследования Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 11: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза ЛС – рассмотрение документов для получения разрешения на проведение клинического исследования лекарственного препарата, изучение предложенных методов контроля качества лекарственного средства и качества представленных образцов лекарственного средства с использованием этих методов исследование отношения ожидаемой пользы к возможному риску применения лекарственного препарата, осуществляемые после проведения его клинического исследования Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 12: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация ЛС - процедура введения лекарственного препарата в гражданский оборот на территории РФ Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 13: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация ЛС - процедура введения лекарственного препарата в гражданский оборот на территории РФ Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 14: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества ЛС - проверка соответствия лекарственного средства требованиям общей фармакопейной статьи, фармакопейной статьи или нормативной документации, нормативного документа Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 15: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества ЛС - проверка соответствия лекарственного средства требованиям общей фармакопейной статьи, фармакопейной статьи или нормативной документации, нормативного документа Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 16: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление ЛС - деятельность, осуществляемая с соблюдением требований промышленного регламента и в соответствии с правилами, утвержденными уполномоченным федеральным органом исполнительной власти Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 17: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление ЛС - деятельность, осуществляемая с соблюдением требований промышленного регламента и в соответствии с правилами, утвержденными уполномоченным федеральным органом исполнительной власти Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 18: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение ЛС - деятельность по обеспечению сохранности ЛП и фармацевтических субстанций, осуществляемая производителями ЛС, организациями оптовой торговли ЛС, аптечными организациями, ветеринарными аптечными организациями, ИП, имеющими лицензию на фармацевтическую деятельность или лицензию на медицинскую деятельность, и иными организациями Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 19: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение ЛС - деятельность по обеспечению сохранности ЛП и фармацевтических субстанций, осуществляемая производителями ЛС, организациями оптовой торговли ЛС, аптечными организациями, ветеринарными аптечными организациями, ИП, имеющими лицензию на фармацевтическую деятельность или лицензию на медицинскую деятельность, и иными организациями Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 20: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка ЛС, их ввоз в РФ и вывоз из РФ Реклама Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 21: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама ЛС - распространение в общедоступной форме информации о лекарственном препарате, отпускаемом без рецепта Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 22: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама ЛС - распространение в общедоступной форме информации о лекарственном препарате, отпускаемом без рецепта Отпуск, передача и реализация Применение Уничтожение 1. Общие положения
Слайд 23: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация ЛС - виды фармацевтической деятельности, осуществляемые в соответствии с Порядком отпуска лекарственных средств и иными нормативными правовыми актами Реализация Применение Уничтожение 1. Общие положения
Слайд 24: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация ЛС - виды фармацевтической деятельности, осуществляемые в соответствии с Порядком отпуска лекарственных средств и иными нормативными правовыми актами Реализация Применение Уничтожение 1. Общие положения
Слайд 25: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение ЛС (медицинское и ветеринарное) - использование ЛС по назначению Уничтожение 1. Общие положения
Слайд 26: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение ЛС (медицинское или ветеринарное) - использование ЛС по назначению Уничтожение 1. Общие положения
Слайд 27: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение ЛС - меры, принимаемые к недоброкачественным или фальсифицированным лекарственным средствам, изъятым из гражданского оборота 1. Общие положения
Слайд 28: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение ЛС - меры, принимаемые к недоброкачественным или фальсифицированным лекарственным средствам, изъятым из гражданского оборота 1. Общие положения
Слайд 29: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
Разработка Доклинические исследования Клинические исследования Экспертиза Государственная регистрация Стандартизация и контроль качества Производство и изготовление Хранение Перевозка Реклама Отпуск, передача и реализация Применение Уничтожение ЛС 1. Общие положения
Слайд 30: ПРЕДМЕТ РЕГУЛИРОВАНИЯ ФЗ
ФЗ регулирует отношения, возникающие в связи с обращением ЛС ФЗ устанавливает приоритет государственного регулирования безопасности, качества и эффективности ЛС при их обращении Лицензирование ФД Единые правила производства ЛС (ГОСТ Р 52249-2009) Государственный контроль КИ Мониторинг безопасности ЛС 1. Общие положения
Слайд 31: 3. ЗАКОНОДАТЕЛЬСТВО ОБ ОБРАЩЕНИИ ЛС
Три уровня законодательства об обращении ЛС: ФЗ №61; 1. Общие положения
Слайд 32: 3. ЗАКОНОДАТЕЛЬСТВО ОБ ОБРАЩЕНИИ ЛС
Три уровня законодательства об обращении ЛС: ФЗ №61; иные федеральные законы ; ФЗ "О наркотических средствах и психотропных веществах ", ФЗ "О рекламе ", ФЗ "Об основах охраны здоровья граждан в Российской Федерации". 1. Общие положения
Слайд 33: 3. ЗАКОНОДАТЕЛЬСТВО ОБ ОБРАЩЕНИИ ЛС
Три уровня законодательства об обращении ЛС: ФЗ №61; иные федеральные законы ; иные нормативные правовые акты РФ: указы Президента РФ, 1. Общие положения
Слайд 34: 3. ЗАКОНОДАТЕЛЬСТВО ОБ ОБРАЩЕНИИ ЛС
Три уровня законодательства об обращении ЛС: ФЗ №61; иные федеральные законы ; иные нормативные правовые акты РФ: указы Президента РФ, постановления Правительства РФ, №681 "Об утверждении Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации " №674 "Об утверждении Правил уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств " № 865 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов " и др. 1. Общие положения
Слайд 35: 3. ЗАКОНОДАТЕЛЬСТВО ОБ ОБРАЩЕНИИ ЛС
Три уровня законодательства об обращении ЛС: ФЗ №61; иные федеральные законы ; иные нормативные правовые акты РФ: указы Президента РФ, постановления Правительства РФ, нормативные правовые акты федеральных органов исполнительной власти (приказы Министерства здравоохранения РФ ). 1. Общие положения нормативные правовые акты федеральных органов исполнительной власти (приказы Министерства здравоохранения РФ): приказ Министерства здравоохранения РФ от 13 ноября 1996 года N 377 "Об утверждении инструкции по организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения " приказ Министерства здравоохранения РФ от 16 июля 1997 года N 214 "О контроле качества лекарственных средств, изготавливаемых в аптечных организациях (аптеках ) " приказ Министерства здравоохранения РФ от 28 мая 2003 года N 224 "Об утверждении Положения об информационной системе, обеспечивающей субъекты обращения лекарственных средств необходимой информацией " приказ Министерства здравоохранения РФ от 19 июня 2003 года N 266 "Об утверждении Правил клинической практики в Российской Федерации " приказ Минздравсоцразвития от 31 января 2007 года N 73 "О Государственной фармакопее Российской Федерации " приказ Министерства сельского хозяйства РФ от 1 апреля 2005 года N 48 "Об утверждении Правил государственной регистрации лекарственных средств для животных и кормовых добавок" и др.
Слайд 36: 3. ЗАКОНОДАТЕЛЬСТВО ОБ ОБРАЩЕНИИ ЛС
Действие ФЗ распространяется на обращение НС и ПВ с учетом особенностей, установленных законодательством РФ о НС, ПВ и об их прекурсорах. гос.монополия оборот НС и ПВ осуществляется только в целях и порядке, установленных настоящим законом производство, хранение, ввоз (вывоз) НС и ПВ осуществляется в пределах квот, устанавливаемых Правительством РФ 1. Общие положения
Слайд 37: 3. ЗАКОНОДАТЕЛЬСТВО ОБ ОБРАЩЕНИИ ЛС
Действие ФЗ распространяется на обращение радиофармацевтических ЛС с учетом особенностей, установленных законодательством РФ в области обеспечения радиационной безопасности. Федеральный закон от 9 января 1996 года N 3-ФЗ "О радиационной безопасности населения " Радиофармацевтические ЛС - ЛС, которые содержат в готовой для использования форме один радионуклид или несколько радионуклидов (радиоактивных изотопов). Радиационная безопасность населения - состояние защищенности настоящего и будущего поколений людей от вредного для их здоровья воздействия ионизирующего излучения 1. Общие положения
Слайд 38: 3. ЗАКОНОДАТЕЛЬСТВО ОБ ОБРАЩЕНИИ ЛС
Если международным договором Российской Федерации установлены иные правила, чем те, которые предусмотрены настоящим Федеральным законом, применяются правила международного договора Единая конвенция о наркотических средствах (Нью-Йорк, 1961) Международный пакт о гражданских и политических правах ( Ген.Ассамблея ООН, 1966) Конвенция о психотропных веществах (Вена, 1971) Протокол о поправках к Единой конвенции о наркотических средствах 1961 года (Женева, 1972) Конвенция о борьбе против незаконного оборота наркотических средств и психотропных веществ (Вена, 1988) Соглашение между Правительством РФ и Правительством Республики Беларусь о развитии сотрудничества в области производства и взаимных поставок лекарственных средств (Минск, 2007) Соглашение о сотрудничестве в борьбе с обращением фальсифицированных лекарственных средств (Кишинев, 2008) 1. Общие положения
Слайд 39: 3. ЗАКОНОДАТЕЛЬСТВО ОБ ОБРАЩЕНИИ ЛС
В РФ в соответствии с международными договорами РФ и (или) на основе принципа взаимности признаются результаты КИ ЛС для медицинского применения, проведенных за пределами территории РФ 1. Общие положения
Слайд 40: 4. ОСНОВНЫЕ ПОНЯТИЯ
Вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики (за исключением веществ или их комбинаций, не контактирующих с организмом человека или животного), лечения заболевания, реабилитации, сохранения, предотвращения или прерывания беременности и полученные из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий - 1. Общие положения ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Слайд 41: 4. ОСНОВНЫЕ ПОНЯТИЯ
Лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность - 1. Общие положения ФАРМАЦЕВТИЧЕСКАЯ СУБСТАНЦИЯ
Слайд 42: 4. ОСНОВНЫЕ ПОНЯТИЯ
Вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств - 1. Общие положения ВСПОМОГАТЕЛЬНЫЕ ВЕЩЕСТВА
Слайд 43: 4. ОСНОВНЫЕ ПОНЯТИЯ
Лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности - 1. Общие положения ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
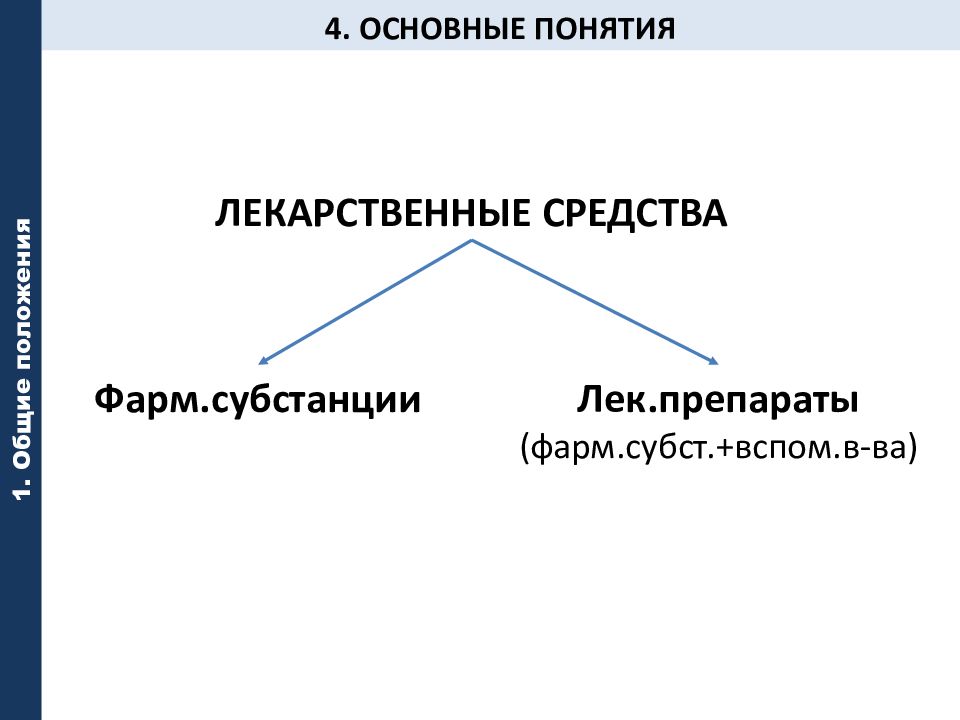
Слайд 44: 4. ОСНОВНЫЕ ПОНЯТИЯ
1. Общие положения ЛЕКАРСТВЕННЫЕ СРЕДСТВА Фарм.субстанции Лек.препараты (фарм. субст.+ вспом.в-ва )
Слайд 45: 4. ОСНОВНЫЕ ПОНЯТИЯ
Состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта - 1. Общие положения ЛЕКАРСТВЕННАЯ ФОРМА
Слайд 46: 4. ОСНОВНЫЕ ПОНЯТИЯ
Ежегодно утверждаемый Правительством РФ перечень ЛП для медицинского применения, обеспечивающих приоритетные потребности здравоохранения в целях профилактики и лечения заболеваний, в том числе преобладающих в структуре заболеваемости в РФ - 1. Общие положения ПЕРЕЧЕНЬ ЖНВЛС
Слайд 47: 4. ОСНОВНЫЕ ПОНЯТИЯ
Лекарственные препараты биологического происхождения, предназначенные для иммунологических диагностики, профилактики и лечения заболеваний - 1. Общие положения ИММУНОБИОЛОГИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
Слайд 48: 4. ОСНОВНЫЕ ПОНЯТИЯ
Лекарственные препараты и фармацевтические субстанции, содержащие наркотические средства и включенные в Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, в соответствии с законодательством Российской Федерации, международными договорами Российской Федерации, в том числе Единой конвенцией о наркотических средствах 1961 года - 1. Общие положения НАРКОТИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА Постановление Правительства РФ от 30 июня 1998 года №681 " Об утверждении Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации"
Слайд 49: 4. ОСНОВНЫЕ ПОНЯТИЯ
Лекарственные препараты и фармацевтические субстанции, содержащие психотропные вещества и включенные в Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, в соответствии с законодательством Российской Федерации, международными договорами Российской Федерации, в том числе Конвенцией о психотропных веществах 1971 года - 1. Общие положения ПСИХОТРОПНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Слайд 50: 4. ОСНОВНЫЕ ПОНЯТИЯ
Лекарственное средство, содержащее впервые полученную фармацевтическую субстанцию или новую комбинацию фармацевтических субстанций, эффективность и безопасность которых подтверждены результатами доклинических исследований ЛС и клинических исследований ЛП - 1. Общие положения ОРИГИНАЛЬНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО Оригинальные ЛС защищаются патентами (как правило, на срок до 10-20 лет ). Directive 2004/27/ЕС of the European Parliament and of the Council, Art. 10.1.
Слайд 51: 4. ОСНОВНЫЕ ПОНЯТИЯ
Лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства - 1. Общие положения ВОСПРОИЗВЕДЕННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО, или дженерик
Слайд 52: 4. ОСНОВНЫЕ ПОНЯТИЯ
Свежие или высушенные растения либо их части, используемые для производства ЛС организациями - производителями ЛС или изготовления ЛП аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность - 1. Общие положения ЛЕКАРСТВЕННОЕ РАСТИТЕЛЬНОЕ СЫРЬЕ
Слайд 53: 4. ОСНОВНЫЕ ПОНЯТИЯ
ЛП, произведенный или изготовленный из одного вида ЛРС или нескольких видов такого сырья и реализуемый в расфасованном виде во вторичной (потребительской) упаковке - 1. Общие положения ЛЕКАРСТВЕННЫЙ РАСТИТЕЛЬНЫЙ ПРЕПАРАТ
Слайд 54: 4. ОСНОВНЫЕ ПОНЯТИЯ
Лекарственное средство, произведенное или изготовленное по специальной технологии - 1. Общие положения ГОМЕОПАТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО
Слайд 55: 4. ОСНОВНЫЕ ПОНЯТИЯ
Наименование фармацевтической субстанции, рекомендованное Всемирной организацией здравоохранения - 1. Общие положения МЕЖДУНАРОДНОЕ НЕПАТЕНТОВАННОЕ НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО СРЕДСТВА Правовые особенности МНН: а) МНН указывается в заявлении о государственной регистрации ЛП б) МНН содержится в Гос. реестре ЛС в отношении каждого ЛП в) МНН указывается на первичной упаковке ЛП (за исключением растительных ЛП, а также ЛП, изготовленных российскими организациями) и на вторичной (потребительской) упаковке г) МНН указывается в Перечне ЖНВЛС, а также в Гос. реестре предельных отпускных цен производителей на ЛП, включенных в указанный Перечень Список МНН насчитывает > 8000 и ежегодно увеличивается на 120-150 новых МНН
Слайд 56: 4. ОСНОВНЫЕ ПОНЯТИЯ
Наименование лекарственного средства, присвоенное его разработчиком - 1. Общие положения ТОРГОВОЕ НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО СРЕДСТВА Торговое наименование является коммерческой собственностью фирмы-производителя (торговая марка) и находится под правовой защитой (на ТН выдается патент).
Слайд 57: 4. ОСНОВНЫЕ ПОНЯТИЯ
Документ, утвержденный уполномоченным федеральным органом исполнительной власти и содержащий перечень показателей качества и (или) методов контроля качества конкретной ЛФ, ЛРС, описания биологических, биохимических, микробиологических, физико-химических, физических, химических и других методов анализа ЛС для медицинского применения, а также требования к используемым в целях проведения данного анализа реактивам, титрованным растворам, индикаторам - 1. Общие положения ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Слайд 58: 4. ОСНОВНЫЕ ПОНЯТИЯ
Документ, содержащий перечень определяемых по результатам соответствующих экспертиз показателей качества лекарственного средства для медицинского применения, методов контроля его качества и установленный его производителем - 1. Общие положения НОРМАТИВНАЯ ДОКУМЕНТАЦИЯ
Слайд 59: 4. ОСНОВНЫЕ ПОНЯТИЯ
Документ, содержащий перечень определяемых по результатам соответствующих экспертиз показателей качества и (или) методов контроля качества ЛФ, описания биологических, биохимических, микробиологических, физико-химических, физических, химических и других методов анализа лекарственных средств для ветеринарного применения, требования к используемым в целях проведения данного анализа реактивам, титрованным растворам, индикаторам и установленный его производителем - 1. Общие положения НОРМАТИВНЫЙ ДОКУМЕНТ
Слайд 60: 4. ОСНОВНЫЕ ПОНЯТИЯ
Соответствие лекарственного средства требованиям фармакопейной статьи либо, в случае ее отсутствия, нормативной документации или нормативного документа - 1. Общие положения КАЧЕСТВО ЛЕКАРСТВЕННОГО СРЕДСТВА эффективность и безопасность самой фармацевтической субстанции ; соответствие готового ЛС нормативно установленным требованиям ; соответствие конкретного образца препарата требованиям собственной спецификации, изложенным в регистрационном досье.
Слайд 61: 4. ОСНОВНЫЕ ПОНЯТИЯ
Характеристика лекарственного средства, основанная на сравнительном анализе его эффективности и риска причинения вреда здоровью - 1. Общие положения БЕЗОПАСНОСТЬ ЛЕКАРСТВЕННОГО СРЕДСТВА
Слайд 62: 4. ОСНОВНЫЕ ПОНЯТИЯ
Характеристика степени положительного влияния ЛП на течение, продолжительность заболевания или его предотвращение, реабилитацию, на сохранение, предотвращение или прерывание беременности - 1. Общие положения ЭФФЕКТИВНОСТЬ ЛЕКАРСТВЕННОГО ПРЕПАРАТА подлинность ЛС (ЛП); однородность содержания фармацевтической субстанции ; химическая чистота ЛС (ЛП); микробиологическая чистота ЛС (ЛП), его стерильность ; токсичность ЛС (ЛП); характеристики использованных вспомогательных веществ ; технология изготовления ЛП и многое другое.
Слайд 63: 4. ОСНОВНЫЕ ПОНЯТИЯ
Количество лекарственного средства, произведенное в результате одного технологического цикла его производителем - 1. Общие положения СЕРИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА
Слайд 64: 4. ОСНОВНЫЕ ПОНЯТИЯ
Кодовое обозначение, присвоенное лекарственному препарату при его государственной регистрации - 1. Общие положения РЕГИСТРАЦИОННЫЙ НОМЕР
Слайд 65: 4. ОСНОВНЫЕ ПОНЯТИЯ
Документ, подтверждающий факт государственной регистрации лекарственного препарата - 1. Общие положения РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Слайд 66: 4. ОСНОВНЫЕ ПОНЯТИЯ
Разработка, доклинические исследования, клинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества, производство, изготовление, хранение, перевозка, ввоз в Российскую Федерацию, вывоз из Российской Федерации, реклама, отпуск, реализация, передача, применение, уничтожение лекарственных средств - 1. Общие положения ОБРАЩЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Слайд 67: 4. ОСНОВНЫЕ ПОНЯТИЯ
Физические лица, в том числе индивидуальные предприниматели, и юридические лица, осуществляющие деятельность при обращении лекарственных средств - 1. Общие положения СУБЪЕКТЫ ОБРАЩЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ - разработчики лекарственных средств - производители лекарственных средств - организации оптовой торговли ЛС - аптечные организации - ветеринарные аптечные организации
Слайд 68: 4. ОСНОВНЫЕ ПОНЯТИЯ
Организация, обладающая правами на результаты доклинических исследований лекарственного средства, клинических исследований лекарственного препарата, а также на технологию производства лекарственного средства - 1. Общие положения РАЗРАБОТЧИК ЛЕКАРСТВЕННОГО СРЕДСТВА
Слайд 69: 4. ОСНОВНЫЕ ПОНЯТИЯ
Организация, осуществляющая производство лекарственных средств в соответствии с требованиями настоящего Федерального закона - 1. Общие положения ПРОИЗВОДИТЕЛЬ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Слайд 70: 4. ОСНОВНЫЕ ПОНЯТИЯ
Организация, осуществляющая оптовую торговлю лекарственными средствами, их хранение, перевозку в соответствии с требованиями настоящего Федерального закона - 1. Общие положения ОРГАНИЗАЦИЯ ОПТОВОЙ ТОРГОВЛИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ
Слайд 71: 4. ОСНОВНЫЕ ПОНЯТИЯ
Организация, структурное подразделение медицинской организации, осуществляющие розничную торговлю ЛП, хранение, перевозку, изготовление и отпуск ЛП для медицинского применения в соответствии с требованиями настоящего Федерального закона - 1. Общие положения АПТЕЧНАЯ ОРГАНИЗАЦИЯ
Слайд 72: 4. ОСНОВНЫЕ ПОНЯТИЯ
Деятельность по производству ЛС организациями - производителями лекарственных средств на одной стадии, нескольких или всех стадиях технологического процесса, а также по хранению и реализации произведенных ЛС - 1. Общие положения ПРОИЗВОДСТВО ЛЕКАРСТВЕННЫХ СРЕДСТВ
Слайд 73: 4. ОСНОВНЫЕ ПОНЯТИЯ
Деятельность, включающая в себя оптовую торговлю ЛС, их хранение, перевозку и (или) розничную торговлю ЛП, их отпуск, хранение, перевозку, изготовление ЛП - 1. Общие положения ФАРМАЦЕВТИЧЕСКАЯ ДЕЯТЕЛЬНОСТЬ
Слайд 74: 4. ОСНОВНЫЕ ПОНЯТИЯ
ЛС, сопровождаемое ложной информацией о его составе и (или) производителе - 1. Общие положения ФАЛЬСИФИЦИРОВАННОЕ ЛС ЛС, не соответствующее требованиям фармакопейной статьи либо в случае ее отсутствия требованиям нормативной документации или нормативного документа - НЕДОБРОКАЧЕСТВЕННОЕ ЛС ЛС, находящееся в обороте с нарушением гражданского законодательства - КОНТРАФАКТНОЕ ЛС
Слайд 75: 4. ОСНОВНЫЕ ПОНЯТИЯ
1. Общие положения ФАЛЬСИФИЦИРОВАННОЕ ЛС НЕДОБРОКАЧЕСТВЕННОЕ ЛС запрещены к ввозу на территорию РФ подлежат изъятию и последующему уничтожению или вывозу из РФ запрещены к продаже КОНТРАФАКТНОЕ ЛС
Слайд 76: 4. ОСНОВНЫЕ ПОНЯТИЯ
Биологические, микробиологические, иммунологические, токсикологические, фармакологические, физические, химические и другие исследования лекарственного средства путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства - 1. Общие положения ДОКЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛЕКАРСТВЕННОГО СРЕДСТВА
Слайд 77: 4. ОСНОВНЫЕ ПОНЯТИЯ
Изучение диагностических, лечебных, профилактических, фармакологических свойств ЛП в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности ЛП, данных о нежелательных реакциях организма человека, животного на применение ЛП и об эффекте его взаимодействия с другими ЛП и (или) пищевыми продуктами, кормами - 1. Общие положения КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Слайд 78: 4. ОСНОВНЫЕ ПОНЯТИЯ
Клиническое исследование лекарственного препарата для медицинского применения, проводимое разработчиком лекарственного препарата в двух и более медицинских организациях по единому протоколу клинического исследования лекарственного препарата - 1. Общие положения МНОГОЦЕНТРОВОЕ КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛП
Слайд 79: 4. ОСНОВНЫЕ ПОНЯТИЯ
Клиническое исследование лекарственного препарата для медицинского применения, проводимое разработчиком лекарственного препарата в различных странах по единому протоколу клинического исследования лекарственного препарата - 1. Общие положения МЕЖДУНАРОДНОЕ МНОГОЦЕНТРОВОЕ КИ ЛП
Слайд 80: 4. ОСНОВНЫЕ ПОНЯТИЯ
Клиническое исследование лекарственного препарата для медицинского применения, проводимое производителем лекарственного препарата, гражданский оборот которого осуществляется после государственной регистрации, в целях дополнительного сбора данных о его безопасности и эффективности, расширения показаний к применению данного лекарственного препарата, а также выявления нежелательных реакций пациентов на его действие - 1. Общие положения ПОСТРЕГИСТРАЦИОННОЕ КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛП
Слайд 81: 4. ОСНОВНЫЕ ПОНЯТИЯ
Вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения фармацевтической субстанции, количества фармацевтической субстанции, достигающего системного кровотока, и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке соответствующему оригинальному ЛП - 1. Общие положения ИССЛЕДОВАНИЕ БИОЭКВИВАЛЕНТНОСТИ ЛП
Слайд 82: 4. ОСНОВНЫЕ ПОНЯТИЯ
Вид клинического исследования лекарственных препаратов, проведение которого осуществляется для выявления одинаковых свойств лекарственных препаратов определенной лекарственной формы, а также наличия одинаковых показателей безопасности и эффективности лекарственных препаратов, одинаковых клинических эффектов при их применении - 1. Общие положения ИССЛЕДОВАНИЕ ТЕРАПЕВТИЧЕСКОЙ ЭКВИВАЛЕНТНОСТИ ЛП
Слайд 83: 4. ОСНОВНЫЕ ПОНЯТИЯ
Документ, в котором определяются цели, формы организации и методология проведения клинического исследования, статистические методы обработки результатов такого исследования и меры по обеспечению безопасности физических лиц, участвующих в клиническом исследовании лекарственного препарата - 1. Общие положения ПРОТОКОЛ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ ЛП
Слайд 84: 4. ОСНОВНЫЕ ПОНЯТИЯ
Сводное изложение результатов доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для медицинского применения - 1. Общие положения БРОШЮРА ИССЛЕДОВАТЕЛЯ
Слайд 85: 4. ОСНОВНЫЕ ПОНЯТИЯ
Документ, в котором содержатся в доступной форме сведения, касающиеся проводимого клинического исследования лекарственного препарата, и в письменной форме добровольное согласие пациента на участие в клиническом исследовании лекарственного препарата после ознакомления с особенностями клинического исследования, имеющими значение для выражения такого согласия - 1. Общие положения ИНФОРМАЦИОННЫЙ ЛИСТОК ПАЦИЕНТА
Слайд 86: 4. ОСНОВНЫЕ ПОНЯТИЯ
Реакция организма, возникшая в связи с применением лекарственного препарата в дозах, рекомендуемых в инструкции по его применению, для профилактики, диагностики, лечения заболевания или для реабилитации - 1. Общие положения ПОБОЧНОЕ ДЕЙСТВИЕ
Слайд 87: 4. ОСНОВНЫЕ ПОНЯТИЯ
Нежелательная реакция организма, связанная с применением лекарственного препарата, приведшая к смерти, врожденным аномалиям или порокам развития либо представляющая собой угрозу жизни, требующая госпитализации или приведшая к стойкой утрате трудоспособности и (или) инвалидности - 1. Общие положения СЕРЬЕЗНАЯ НЕЖЕЛАТЕЛЬНАЯ РЕАКЦИЯ
Слайд 88: 4. ОСНОВНЫЕ ПОНЯТИЯ
Нежелательная реакция организма (в том числе связанная с применением лекарственного препарата в соответствии с инструкцией по его применению), сущность и тяжесть которой не соответствуют информации о лекарственном препарате, содержащейся в инструкции по его применению - 1. Общие положения НЕПРЕДВИДЕННАЯ НЕЖЕЛАТЕЛЬНАЯ РЕАКЦИЯ
Слайд 89: 4. ОСНОВНЫЕ ПОНЯТИЯ
возможные побочные действия должны быть описаны в проекте инструкции по применению ЛС, входящей в регистрационное досье; побочные действия ЛП фиксируются в Государственном реестре ЛС; субъекты обращения ЛС обязаны сообщать в установленном уполномоченным федеральным органом исполнительной власти порядке обо всех случаях побочных действий, не указанных в инструкции по применению ЛП, о серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении ЛП; при получении информации о побочных действиях, не указанных в инструкции по применению ЛП, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении ЛП, об особенностях его взаимодействия с другими ЛП, которые могут представлять угрозу жизни или здоровью пациентов, уполномоченный федеральный орган исполнительной власти рассматривает вопрос о возможности приостановления применения такого ЛП. 1. Общие положения НЕПРЕДВИДЕННАЯ НЕЖЕЛАТЕЛЬНАЯ РЕАКЦИЯ СЕРЬЕЗНАЯ НЕЖЕЛАТЕЛЬНАЯ РЕАКЦИЯ ПОБОЧНОЕ ДЕЙСТВИЕ
Слайд 90: 4. ОСНОВНЫЕ ПОНЯТИЯ
Письменное назначение лекарственного препарата по установленной форме, выданное медицинским или ветеринарным работником, имеющим на это право, в целях отпуска лекарственного препарата или его изготовления и отпуска - 1. Общие положения РЕЦЕПТ НА ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ
Слайд 91: 4. ОСНОВНЫЕ ПОНЯТИЯ
Документ установленной формы, который выписан медицинским или ветеринарным работником, имеющим на это право, и содержит в письменной форме указание аптечной организации об отпуске лекарственного препарата или о его изготовлении и об отпуске для обеспечения лечебного процесса в медицинской организации, ветеринарной организации - 1. Общие положения ТРЕБОВАНИЕ МЕДИЦИНСКОЙ (ВЕТЕРИНАРНОЙ) ОРГАНИЗАЦИИ
Слайд 92: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
N 2-ФКЗ "О Правительстве Российской Федерации " - Правительство РФ принимает меры по реализации прав граждан на охрану здоровья 2. Полномочия органов исполнительной власти 1) Проведение в РФ единой государственной политики в области обеспечения ЛП граждан на территории РФ Правительство РФ издает: а) акты, имеющие нормативный характер, - Постановления Правительства РФ б) акты по оперативным и другим текущим вопросам - Распоряжения Правительства РФ Например, распоряжение Правительства РФ от 6 июля 2010 года N 1141-р, которым утвержден Перечень стратегически значимых ЛС, производство которых должно быть обеспечено на территории РФ
Слайд 93: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Положение о МЗРФ, утвержденное постановлением Правительства РФ от 19 июня 2012 года N 608 : МЗРФ - федеральный органом исполнительной власти, осуществляющий функции по выработке и реализации гос.политики и нормативно-правовому регулированию в сфере здравоохранения, ОМС, обращения ЛС для медицинского применения, включая обеспечение качества, эффективности и безопасности ЛС для медицинского применения 2. Полномочия органов исполнительной власти 1) Проведение в РФ единой государственной политики в области обеспечения ЛП граждан на территории РФ МЗРФ издает такие правовые акты, как: а) порядок разработки общих фармакопейных статей и фармакопейных статей и включения их в гос. фармакопею б) правила проведения экспертизы ЛС для медицинского применения и форма заключения комиссии экспертов
Слайд 94: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Порядок разработки общих фармакопейных статей и фармакопейных статей и включения их в государственную фармакопею ( утвержден приказом Минздравсоцразвития от 26 августа 2010 года N 756н ): Общие фармакопейные статьи и фармакопейные статьи разрабатываются Министерством здравоохранения, в том числе на основании предложений, поступивших от субъектов обращения лекарственных средств. 2. Полномочия органов исполнительной власти 2 ) Утверждение общих фармакопейных статей, фармакопейных статей, издание государственной фармакопеи
Слайд 95: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
лицензионный контроль в сфере производства лекарственных средств и в сфере фармацевтической деятельности федеральный государственный надзор в сфере обращения лекарственных средств проверки соблюдения субъектами обращения ЛС установленных ФЗ61 и принятыми в соответствии с ним иными нормативными правовыми актами РФ требований проверки соответствия ЛС, находящихся в обращении, установленным обязательным требованиям к их качеству выдача разрешений на ввоз ЛС на территорию РФ организацию и проведение мониторинга безопасности ЛП применение мер по пресечению выявленных нарушений обязательных требований и (или) устранению последствий таких нарушений 2. Полномочия органов исполнительной власти 3 ) Осуществление государственного контроля (надзора) в сфере обращения ЛС
Слайд 96: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Положение о лицензировании производства лекарственных средств: Министерство промышленности и торговли Российской Федерации, Федеральная служба по ветеринарному и фитосанитарному надзору 2. Полномочия органов исполнительной власти 4) Лицензирование производства ЛС и фармацевтической деятельности в соответствии с законодательством РФ Положение о лицензировании фармацевтической деятельности : Федеральная служба по надзору в сфере здравоохранения Федеральная служба по ветеринарному и фитосанитарному надзору органы исполнительной власти субъектов РФ
Слайд 97: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Федеральное государственное бюджетное учреждение "Научный центр экспертизы средств медицинского применения" (ФГБУ НЦЭСМП Минздрава России) 2. Полномочия органов исполнительной власти 5 ) Организация экспертизы ЛС, этической экспертизы возможности проведения КИ ЛП
Слайд 98: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Выдача разрешений: Министерство здравоохранения в соответствии с Порядком выдачи разрешения на проведение клинического исследования ЛП для медицинского применения (утвержден приказом Минздравсоцразвития РФ от 26 августа 2010 года N 748н ) 2. Полномочия органов исполнительной власти 6 ) Выдача разрешений на проведение КИ ЛП, ведение реестра выданных разрешений на проведение КИ ЛП
Слайд 99: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Государственной регистрации подлежат: оригинальные ЛП, воспроизведенные ЛП, новые комбинации зарегистрированных ранее ЛП, ЛП, зарегистрированные ранее, но произведенные в других лекарственных формах, в новой дозировке 2. Полномочия органов исполнительной власти 7 ) Государственная регистрация ЛП, ведение гос. реестра ЛС
Слайд 100: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Инспектирование производства - осуществление периодических проверок организаций - производителей ЛС уполномоченным органом власти. ГОСТ Р 52249-2009 ЕС Guide to Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use (2009) 2. Полномочия органов исполнительной власти 8 ) Инспектирование производства ЛС на соответствие правилам организации производства и контроля качества ЛС, выдача заключений о соответствии производителя ЛС требованиям правил организации производства и контроля качества ЛС
Слайд 101: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Постановление Правительства РФ от 19 июня 2012 года N 608 МЗ РФ Правила государственной регистрации предельных отпускных цен производителей на ЛП, включенные в перечень ЖНВЛС ( постановление Правительства РФ от 29 октября 2010 года N 865 ) 2. Полномочия органов исполнительной власти 9 ) Гос. регистрация установленных производителями ЛП предельных отпускных цен на ЖНВЛС и ведение гос. реестра предельных отпускных цен производителей на ЛП, включенные в перечень ЖНВЛС
Слайд 102: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Правила ввоза ЛС для медицинского применения на территорию Российской Федерации ( утв. постановлением Правительства РФ от 29 сентября 2010 года N 771 ) МЗ РФ(разрешение) таможенные органы (контроль) Вывоз ЛС из РФ – отдельным нормативным актом не регламентируется 2. Полномочия органов исполнительной власти 10 ) Установление порядка ввоза ЛС на территорию РФ и вывоза ЛС с территории РФ
Слайд 103: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Совет по этике Приказ Минздравсоцразвития от 31 августа 2010 года №774н МЗ РФ(разрешение) таможенные органы (контроль) Фармакологический совет (учредитель - Министерство здравоохранения РФ ) 2. Полномочия органов исполнительной власти 11 ) Создание советов по вопросам, связанным с обращением ЛС
Слайд 104: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Сертификация - объективная оценка уровня компетенции специалиста. Аттестация - оценка знаний и практических навыков специалиста в целях присвоения ему определенной квалификационной категории. Положение о порядке получения квалификационных категорий медицинскими и фармацевтическими работниками (утв. приказом Минздравсоцразвития от 25 июля 2011 года № 808н ) Порядок определения уровня профессиональной подготовки экспертов федерального государственного бюджетного учреждения по проведению экспертизы ЛС для медицинского применения и аттестации их на право проведения экспертизы ЛС для медицинского применения (утв. приказом Минздравсоцразвития от 26 августа 2010 года № 755н ) Экспертно-квалификационная комиссия Министерства ЗО 2. Полномочия органов исполнительной власти 12 ) Аттестация и сертификация специалистов
Слайд 105: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
Мониторинг безопасности ЛП - система непрерывного отслеживания последствий применения ЛС на территории РФ с целью выявления возможных негативных последствий их применения, предупреждения пациентов и их защиты от применения таких препаратов. Приказ Минздравсоцразвития от 26 августа 2010 года N 757н "Об утверждении Порядка осуществления мониторинга безопасности ЛП для медицинского применения, регистрации побочных действий, серьезных нежелательных реакций, непредвиденных нежелательных реакций при применении ЛП для медицинского применения". 2. Полномочия органов исполнительной власти 14) Мониторинг безопасности лекарственных препаратов
Слайд 106: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
2. Полномочия органов исполнительной власти 15 ) Участие в международном сотрудничестве п.5.11 Положения о МЗ РФ : взаимодействие в установленном порядке с органами государственной власти иностранных государств и международными организациями, включая представление по поручению Правительства РФ интересов РФ во Всемирной организации здравоохранения, в Международной федерации обществ Красного Креста и Красного Полумесяца, других международных организациях.
Слайд 107: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
2. Полномочия органов исполнительной власти 16 ) Получение по запросам уполномоченного федерального органа исполнительной власти от органов исполнительной власти субъектов РФ, а также от субъектов обращения ЛС для медицинского применения информации по вопросам установления и применения цен на ЛП и надбавок к ним Глава 12 ФЗ №61
Слайд 108: 5. ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ
2. Полномочия органов исполнительной власти 17 ) Применение мер ответственности за нарушение законодательства Российской Федерации
Слайд 109: 6. ПОЛНОМОЧИЯ ОРГАНОВ ИСПОЛНИТ.ВЛАСТИ
2. Полномочия органов исполнительной власти Разработка и реализация региональных программ обеспечения населения ЛП Установление предельных размеров оптовых надбавок и предельных размеров розничных надбавок к фактическим отпускным ценам, установленным производителями ЛП, на ЛП, включенные в перечень ЖНВЛС Осуществление регионального государственного контроля за применением цен на ЛП, включенные в перечень ЖНВЛС, организациями оптовой торговли, аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность.
Слайд 110: 7. РАЗРАБОТКА И ИЗДАНИЕ ГФ
3. Государственная фармакопея Государственная фармакопея - свод общих фармакопейных статей и фармакопейных статей. Общие ФС - информация о методах контроля качества ЛФ и ЛРС ФС - информация о методах контроля качества ЛС для медицинского применения.
Слайд 111: 7. РАЗРАБОТКА И ИЗДАНИЕ ГФ
3. Государственная фармакопея Разработка общих фармакопейных статей и фармакопейных статей и включение их в государственную фармакопею осуществляются в порядке, установленном уполномоченным федеральным органом исполнительной власти. Приказом Минздравсоцразвития от 26 августа 2010 года №756н введен в действие Порядок разработки общих фармакопейных статей и фармакопейных статей и включения их в Государственную фармакопею, а также размещения на официальном сайте в сети "Интернет" данных о Государственной фармакопее".
Слайд 112: 7. РАЗРАБОТКА И ИЗДАНИЕ ГФ
3. Государственная фармакопея Разработка фармакопейной статьи на оригинальное ЛС и включение ее в ГФ в течение срока действия защиты исключительного права, удостоверенного патентом на оригинальное ЛС, осуществляются с согласия его разработчика. ГФ издается уполномоченным федеральным органом исполнительной власти за счет средств федерального бюджета и подлежит переизданиям не реже чем 1 раз в 5 лет, в период между которыми издаются приложения к ГФ, содержащие ОФС и (или) ФС, утвержденные после издания или переиздания ГФ. Уполномоченный федеральный орган исполнительной власти размещает данные о ГФ и приложениях к ней на своем официальном сайте в сети "Интернет" в установленном им порядке.
Слайд 113: 8. ЛИЦЕНЗИРОВАНИЕ ПРОИЗВОДСТВА ЛС И ФД
4. Гос.контроль при обращении ЛС Лицензирование производства ЛС и ФД осуществляется в соответствии с законодательством РФ. ФЗ от 4 мая 2011 г. №99-ФЗ «О лицензировании отдельных видов деятельности» ФЗ от 21 ноября 2011 г. №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации » Постановление Правительства РФ от 22 декабря 2011 г. №1081 «О лицензировании фармацевтической деятельности » Постановление Правительства РФ от 30 июня 2004 г. №323 «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения и социального развития »
Слайд 114: 8. ЛИЦЕНЗИРОВАНИЕ ПРОИЗВОДСТВА ЛС И ФД
4. Гос.контроль при обращении ЛС Обязательным условием предоставления лицензии на производство ЛС является приложение к заявлению соискателя лицензии перечня ЛФ и (или) видов фармацевтических субстанций, которые производитель ЛС намерен производить. В случае необходимости расширения производства ЛС за счет новых ЛФ и видов фармацевтических субстанций производитель ЛС должен получить новую лицензию на производство ЛС.
Слайд 115: 9. ГОС.КОНТРОЛЬ (НАДЗОР) В СФЕРЕ ОБРАЩЕНИЯ ЛС
4. Гос.контроль при обращении ЛС Гос. контроль (надзор) в сфере обращения ЛС включает в себя: 1) лицензионный контроль в сфере производства ЛС и в сфере ФД 2) федеральный государственный надзор в сфере обращения ЛС Осуществляется уполномоченными федеральным органом исполнительной власти и органами исполнительной власти субъектов Российской Федерации ФЗ от 26 декабря 2008 года N 294-ФЗ "О защите прав ЮЛ и ИП при осуществлении гос. контроля (надзора) и муниципального контроля", ФЗ от 4 мая 2011 года N 99-ФЗ "О лицензировании отдельных видов деятельности". Осуществляется уполномоченными федеральными органами исполнительной власти (далее - органы государственного надзора) согласно их компетенции в порядке, установленном Правительством Российской Федерации
Слайд 116: 9. ГОС.КОНТРОЛЬ (НАДЗОР) В СФЕРЕ ОБРАЩЕНИЯ ЛС
4. Гос.контроль при обращении ЛС Лицензионный контроль в сфере обращения ЛС включает: деятельность уполномоченных органов государственной власти, направленная на предупреждение, выявление и пресечение нарушений ЮЛ, их руководителями и иными должностными лицами, ИП, их уполномоченными представителями требований, установленных нормативными правовыми актами РФ и субъектов РФ, посредством организации и проведения плановых и внеплановых, а также документарных и выездных проверок.
Слайд 117: 9. ГОС.КОНТРОЛЬ (НАДЗОР) В СФЕРЕ ОБРАЩЕНИЯ ЛС
4. Гос.контроль при обращении ЛС Лицензионный контроль в сфере обращения ЛС осуществляют: в сфере фармацевтической деятельности - Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор ), в сфере обращения ЛС для ветеринарного применения - Федеральная служба по ветеринарному и фитосанитарному надзору ( Россельхознадзор ) в сфере производства ЛС : для медицинского применения - Министерство промышленности и торговли РФ, для ветеринарного применения - Россельхознадзор. ФЗ "О лицензировании отдельных видов деятельности" Положение о лицензировании производства лекарственных средств
Слайд 118: 9. ГОС.КОНТРОЛЬ (НАДЗОР) В СФЕРЕ ОБРАЩЕНИЯ ЛС
4. Гос.контроль при обращении ЛС 4. Федеральный гос. надзор в сфере обращения ЛС включает: проведение проверок исполнения всего комплекса требований нормативных правовых актов при обращении ЛС, выдачу разрешений на ввоз ЛС на территорию РФ, организацию и проведение мониторинга безопасности ЛП, применение мер по пресечению выявленных нарушений обязательных требований и (или) устранению последствий таких нарушений, выдачу предписаний об устранении выявленных нарушений обязательных требований и привлечение к ответственности лиц, совершивших такие нарушения.
Слайд 119: 9. ГОС.КОНТРОЛЬ (НАДЗОР) В СФЕРЕ ОБРАЩЕНИЯ ЛС
4. Гос.контроль при обращении ЛС 6. Должностные лица органа гос. надзора в порядке, установленном законодательством РФ, имеют право: получать на основании мотивированных письменных запросов от субъектов обращения ЛС, органов исполнительной власти субъектов РФ и органов местного самоуправления документы и информацию по вопросам обращения ЛС беспрепятственно по предъявлении служебного удостоверения и копии приказа (распоряжения) органа государственного надзора о назначении проверки посещать используемые ЮЛ, ИП, являющимися субъектами обращения ЛС, при осуществлении своей деятельности территории, здания, помещения и сооружения в целях проведения мероприятий по контролю
Слайд 120: 9. ГОС.КОНТРОЛЬ (НАДЗОР) В СФЕРЕ ОБРАЩЕНИЯ ЛС
4. Гос.контроль при обращении ЛС 6. Должностные лица органа гос. надзора в порядке, установленном законодательством РФ, имеют право: проводить отбор образцов ЛС, предназначенных для реализации и реализуемых субъектами обращения ЛС, для проверки их качества, проведения исследований, испытаний в соответствии с правилами отбора образцов, установленными уполномоченным федеральным органом исполнительной власти; выдавать субъектам обращения ЛС предписания о прекращении нарушений и об устранении выявленных нарушений обязательных требований; направлять в уполномоченные органы материалы, связанные с нарушениями обязательных требований, для решения вопросов о возбуждении уголовных дел по признакам преступлений.
Слайд 121: 10. РАЗРАБОТКА ЛС
5. Разработка и ДКИ ЛС 1. Разработка ЛС включает: поиск новых фармакологически активных веществ, последующее изучение их лекарственных свойств, ДКИ, разработку технологий производства фармацевтических субстанций, разработку составов и технологий производства ЛП.
Слайд 122: 10. РАЗРАБОТКА ЛС
5. Разработка и ДКИ ЛС Стратегия развития фармацевтической промышленности Российской Федерации на период до 2020 года ( Приказ Минпромторга РФ от 23 октября 2009 года №965 ) I этап - Локализация производства и разработки ЛС на территории РФ II этап - Развитие фармацевтической отрасли на рынке РФ III этап - Развитие фармацевтической отрасли на внешних рынках
Слайд 123: 10. РАЗРАБОТКА ЛС
5. Разработка и ДКИ ЛС 2. Финансовое обеспечение разработки ЛС осуществляется за счет: 1) средств федерального бюджета 2) средств разработчиков ЛС 3) средств производителей ЛС при выполнении научно-исследовательских работ по договору между разработчиком ЛС и производителем ЛС 4) иных не запрещенных законодательством РФ источников Инвестиции в разработку ЛС в РФ - от 100 000 до 5 млн.долл. Доля импорта в РФ – 80%. Доля инновационных ЛП на фармацевтическом рынке: в РФ не превышает 12%, в США составляет 82%, в Японии – 76%.
Слайд 124: 10. РАЗРАБОТКА ЛС
5. Разработка и ДКИ ЛС 3. Права разработчика ЛС охраняются гражданским законодательством. Патентное законодательство Законодательство о товарных знаках Принцип эксклюзивной информации ( Data exclusivity ) - использовать данные о новом ЛП с целью его копирования, производства и ввода на рынок дженериков запрещено в течение определенного периода времени (от 5 до 11 лет).
Слайд 125: 11. ДОКЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛС
5. Разработка и ДКИ ЛС 1. ДКИ ЛС для медицинского применения проводится путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности ЛС.
Слайд 126: 11. ДОКЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛС
5. Разработка и ДКИ ЛС Этапы (фазы) проведения ДКИ ЛС: Первый этап - отбор перспективных субстанций Второй этап – оценка фармакодинамики и фармакокинетики у животных Третий этап - оценка безопасности препарата, включающая исследования: острой токсичности хронической токсичности токсичности по действию на репродуктивную систему исследование мутагенности воздействия ЛП на иммунную систему выявление кожно-аллергических реакций Четвертый этап – ранняя техническая разработка Продолжительность ДКИ – 1-3 года (в среднем 18 месяцев)
Слайд 127: 11. ДОКЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛС
5. Разработка и ДКИ ЛС 2. ДКИ ЛС для медицинского применения проводится в соответствии с правилами лабораторной практики, утвержденными уполномоченным федеральным органом исполнительной власти. Национальный стандарт Российской Федерации ГОСТ Р 53434-2009 "Принципы надлежащей лабораторной практики" ( GLP) ( утвержден Приказом Ростехрегулирования от 2 декабря 2009 года N 544-ст "Об утверждении национального стандарта " ) Правила лабораторной практики ( утверждены приказом Минздравсоцразвития РФ от 23 августа 2010 года N 708н "Об утверждении Правил лабораторной практики " )
Слайд 128: 11. ДОКЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛС
5. Разработка и ДКИ ЛС 3. Для организации и проведения ДКИ ЛС для медицинского применения разработчики ЛС могут привлекать научно-исследовательские организации, образовательные организации высшего образования, имеющие необходимую материально-техническую базу и квалифицированных специалистов в соответствующей области исследования.
Слайд 129: 11. ДОКЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛС
5. Разработка и ДКИ ЛС 4. ДКИ ЛС для медицинского применения проводится по утвержденному разработчиком ЛС плану с ведением протокола ДКИ и составлением отчета, в котором содержатся результаты этого исследования и заключение о возможности проведения КИ ЛП для медицинского применения.
Слайд 130: 11. ДОКЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛС
5. Разработка и ДКИ ЛС 5. Проведение проверок соблюдения правил лабораторной практики и правовых норм использования животных при проведении ДКИ ЛС для медицинского применения осуществляется уполномоченным федеральным органом исполнительной власти
Слайд 131: 11. ДОКЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛС
5. Разработка и ДКИ ЛС 6. Результаты ДКИ ЛС для медицинского применения могут быть представлены в уполномоченный федеральный орган исполнительной власти в установленном порядке в целях государственной регистрации ЛП
Слайд 132: 13. ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛП
6. Государственная регистрация ЛП 1. ЛП вводятся в гражданский оборот на территории РФ, если они зарегистрированы соответствующим уполномоченным федеральным органом исполнительной власти Осуществляет МЗ РФ п.5.5.23 Положения о Министерстве здравоохранения РФ, утв. постановлением Правительства РФ от 19 июня 2012 года N 608 ) Гос.реестр ЛС Порядок ведения Государственного реестра лекарственных средств для медицинского применения, у тв. приказом Минздравсоцразвития РФ от 26 августа 2010 года N 746н
Слайд 133: 13. ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛП
6. Государственная регистрация ЛП 2. Государственной регистрации подлежат : 1) оригинальные ЛП 2) воспроизведенные ЛП 3) новые комбинации зарегистрированных ранее ЛП 4) ЛП, зарегистрированные ранее, но произведенные в других ЛФ, в новой дозировке.
Слайд 134: 13. ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛП
6. Государственная регистрация ЛП 3. Государственная регистрация ЛП для медицинского применения осуществляется по результатам экспертизы ЛС и этической экспертизы возможности проведения КИ ЛП для медицинского применения.
Слайд 135: 13. ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛП
6. Государственная регистрация ЛП 4. Гос. регистрация ЛП осуществляется соответствующим уполномоченным федеральным органом исполнительной власти в срок, не превышающий двухсот десяти рабочих дней со дня принятия заявления о государственной регистрации ЛП. в срок включается время, необходимое для проведения повторной экспертизы (этической или экспертизы ЛС) срок гос. регистрации ЛП исчисляется со дня принятия МЗ РФ заявления о гос. регистрации ЛП с приложением необходимых документов по день выдачи регистрационного удостоверения ЛП время проведения КИ ЛП не учитывается при исчислении срока
Слайд 136: 13. ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛП
6. Государственная регистрация ЛП 5. Государственной регистрации не подлежат : 1 ) ЛП, изготовленные АО, ветеринарными АО, ИП, которые имеют лицензию на ФД, по рецептам на ЛП и требованиям медицинских организаций, ветеринарных организаций 2 ) ЛРС 3) ЛП, приобретенные физ. лицами за пределами территории РФ и предназначенные для личного использования 4 ) ЛП, предназначенные для экспорта 5 ) радиофармацевтические ЛП, изготовленные непосредственно в медицинских организациях в порядке, установленном уполномоченным федеральным органом исполнительной власти
Слайд 137: 13. ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛП
6. Государственная регистрация ЛП 6. Не допускается государственная регистрация : 1 ) различных ЛП под одинаковым торговым наименованием 2 ) одного ЛП, выпускаемого производителем под различными торговыми наименованиями и представленного на государственную регистрацию в виде двух и более ЛП
Слайд 138: 14. ЭКСПЕРТИЗА ЛС И ЭТИЧЕСКАЯ ЭКСПЕРТИЗА
6. Государственная регистрация ЛП 1. Экспертиза ЛС и этическая экспертиза основываются на принципах: законности, соблюдения прав и свобод человека и гражданина, прав юридического лица, независимости эксперта, объективности, всесторонности и полноты исследований, проводимых с использованием современных достижений науки и техники, ответственности федерального государственного бюджетного учреждения по проведению экспертизы ЛС и экспертов за проведение и качество экспертизы.
Слайд 139: 14. ЭКСПЕРТИЗА ЛС И ЭТИЧЕСКАЯ ЭКСПЕРТИЗА
6. Государственная регистрация ЛП 2. Экспертиза ЛС для медицинского применения проводится поэтапно : 1 этап - экспертиза документов для получения разрешения на проведение КИ ЛП, за исключением: а ) ЛП, которые разрешены для медицинского применения на территории РФ более двадцати лет и в отношении которых невозможно проведение исследования биоэквивалентности б ) ЛП для медицинского применения, в отношении которых проведены международные многоцентровые КИ, часть из которых проведена на территории РФ 2 этап - экспертиза предложенных методов контроля качества ЛС и качества представленных образцов ЛС с использованием этих методов и экспертиза отношения ожидаемой пользы к возможному риску применения ЛП, осуществляемые после проведения его КИ
Слайд 140: 14. ЭКСПЕРТИЗА ЛС И ЭТИЧЕСКАЯ ЭКСПЕРТИЗА
6. Государственная регистрация ЛП 3. Экспертиза ЛС для ветеринарного применения проводится одноэтапно и включает в себя экспертизу качества ЛС и экспертизу отношения ожидаемой пользы к возможному риску применения ЛП
Слайд 141: 15. ФГБУ ПО ПРОВЕДЕНИЮ ЭКСПЕРТИЗЫ ЛС
6. Государственная регистрация ЛП 3. Экспертиза ЛС проводится ФГБУ соответствующего уполномоченного федерального органа исполнительной власти, созданным для обеспечения исполнения полномочий этого федерального органа по выдаче разрешений на проведение КИ ЛП и (или) по государственной регистрации ЛП (далее - экспертное учреждение). ФГБУ "Научный центр экспертизы средств медицинского применения" (ФГБУ НЦЭСМП Минздрава России) http://www.regmed.ru / - отдел экспертизы КИ (Центры клинической фармакологии, планирования и координации научно-исследовательских работ, экспертизы безопасности ЛС, образовательных программ, фармакопеи и международного сотрудничества); - контрольно-организационное управление; - управление обеспечения качества (Центры экспертизы и контроля ГЛС, экспертизы качества ЛС, медицинских иммунобиологических препаратов); - управление информатизации.
Слайд 142: 16. ОРГАНИЗАЦИЯ ЭКСПЕРТИЗЫ ЛС
6. Государственная регистрация ЛП 1. Экспертиза ЛС проводится комиссией экспертов экспертного учреждения, назначенной его руководителем, на основании задания на проведение экспертизы ЛС, выданного уполномоченным федеральным органом исполнительной власти. Руководитель экспертного учреждения обеспечивает надлежащее проведение экспертизы ЛС в соответствии с заданием, выданным уполномоченным федеральным органом исполнительной власти, и организует подготовку сводного заключения этой комиссии. В состав этой комиссии по решению руководителя экспертного учреждения могут быть включены в качестве экспертов лица, не работающие в данном экспертном учреждении, если их специальные знания необходимы для проведения экспертизы и такие эксперты отсутствуют в данном экспертном учреждении.
Слайд 143: 16. ОРГАНИЗАЦИЯ ЭКСПЕРТИЗЫ ЛС
6. Государственная регистрация ЛП 9. Результаты экспертизы лекарственного средства оформляются заключением комиссии экспертов. В заключении комиссии экспертов указываются перечень исследований, объем проведенных каждым экспертом исследований, установленные каждым из них факты и сделанные в результате исследований выводы.
Слайд 144: 16. ОРГАНИЗАЦИЯ ЭКСПЕРТИЗЫ ЛС
6. Государственная регистрация ЛП 6. Эксперт не вправе: 1) проводить экспертизу ЛС по обращению непосредственно к нему организаций или физических лиц; 2) самостоятельно собирать материалы для проведения экспертизы ЛС; 3) проводить экспертизу ЛС в качестве негосударственного эксперта.
Слайд 145: 16. ОРГАНИЗАЦИЯ ЭКСПЕРТИЗЫ ЛС
6. Государственная регистрация ЛП 12. Правила проведения экспертизы ЛС и форма заключения комиссии экспертов устанавливаются соответствующим уполномоченным федеральным органом исполнительной власти. - приказ Минздравсоцразвития от 26 августа 2010 года N 750н "Об утверждении правил проведения экспертизы лекарственных средств для медицинского применения и формы заключения комиссии экспертов" ; - приказ Министерства сельского хозяйства РФ от 5 июня 2012 года N 311 "Об утверждении правил проведения экспертизы лекарственных средств для ветеринарного применения и формы заключения комиссии экспертов".
Слайд 146: 17. ЭТИЧЕСКАЯ ЭКСПЕРТИЗА
6. Государственная регистрация ЛП 1. Этическая экспертиза проводится в целях выдачи заключения об этической обоснованности возможности проведения КИ ЛП для медицинского применения советом по этике, созданным в порядке, установленном уполномоченным федеральным органом исполнительной власти. Совет по этике, созданный приказом Минздравсоцразвития от 31 августа 2010 года N 774н Основные принципы: независимость, гласность, справедливость, соблюдение прав и свобод человека и гражданина, прав ЮЛ, объективность, компетентность, ответственность экспертов за проведение и качество этической экспертизы. Основные задачи Совета по этике: а) проведение этической экспертизы документов, связанных с проведением КИ ЛП для медицинского применения; б) выдача заключения об этической обоснованности возможности или невозможности проведения КИ ЛП для медицинского применения.
Слайд 147: 17. ЭТИЧЕСКАЯ ЭКСПЕРТИЗА
6. Государственная регистрация ЛП 2. Экспертами совета по этике могут быть представители медицинских, научных организаций, образовательных организаций высшего образования, а также представители общественных организаций, религиозных организаций и средств массовой информации. Данные эксперты не должны находиться в какой-либо зависимости от разработчиков лекарственных препаратов и других лиц, заинтересованных в результатах этической экспертизы. заключение этической экспертизы
Слайд 148: 18. ПОДАЧА ЗАЯВЛЕНИЙ О ГОС.РЕГИСТРАЦИИ ЛП
6. Государственная регистрация ЛП 1. Для гос. регистрации ЛП разработчик ЛП представляет в соответствующий уполномоченный федеральный орган исполнительной власти, осуществляющий гос. регистрацию ЛП, заявление о гос. регистрации ЛП, а также в порядке, установленном соответствующим уполномоченным федеральным органом исполнительной власти, необходимые документы, из которых формируется регистрационное досье на ЛП В регистрационное досье входят документы, чье содержание касается: - самого ЛП (схема технологического процесса производства, проект нормативной документации или фармакопейной статьи, информация об условиях хранения, проект первичной и вторичной упаковки и пр.); - фармацевтической субстанции (ее наименование, срок годности, показатели качества и т.д.); - производителя ЛП (документ, подтверждающий соответствие производителя регистрируемого ЛП требованиям правил организации производства и контроля качества ЛС, выданный компетентным органом страны производителя и т.д.); - ДКИ и КИ ЛП (отчеты о ДКИ, проект протокола КИ, брошюра исследователя, информационный листок пациента и т.д.).
Слайд 149: 27. РЕШЕНИЕ О ГОС.РЕГИСТРАЦИИ ЛП
6. Государственная регистрация ЛП В срок, не превышающий 5 рабочих дней со дня получения заключений комиссии экспертов по результатам экспертизы качества ЛС и экспертизы отношения ожидаемой пользы к возможному риску применения ЛП, соответствующий уполномоченный федеральный орган исполнительной власти: 1) осуществляет оценку таких заключений для определения их соответствия заданию на проведение указанных экспертиз; 2 ) принимает решение о государственной регистрации ЛП или об отказе в государственной регистрации ЛП; 3 ) вносит при принятии решения о гос. регистрации ЛП данные о зарегистрированном ЛП, в том числе о фармацевтической субстанции, входящей в состав ЛП, в государственный реестр лекарственных средств 4) выдает заявителю регистрационное удостоверение ЛП
Слайд 150: 27. РЕШЕНИЕ О ГОС.РЕГИСТРАЦИИ ЛП
6. Государственная регистрация ЛП 2. Основанием для отказа в государственной регистрации лекарственного препарата является решение соответствующего уполномоченного федерального органа исполнительной власти о том, что : 1) качество и (или) эффективность регистрируемого лекарственного препарата не подтверждены полученными данными 2 ) риск причинения вреда здоровью человека или животного вследствие приема лекарственного препарата превышает эффективность его применения
Слайд 151: 27. РЕШЕНИЕ О ГОС.РЕГИСТРАЦИИ ЛП
6. Государственная регистрация ЛП 3. При государственной регистрации лекарственного препарата, включенного в перечень жизненно необходимых и важнейших лекарственных препаратов, необходимые данные заносятся в государственный реестр предельных отпускных цен производителей на лекарственные препараты, включенные в указанный перечень.
Слайд 152: 28. РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ ЛП
6. Государственная регистрация ЛП 1. Регистрационное удостоверение ЛП с указанием ЛФ и дозировок выдается бессрочно, за исключением регистрационного удостоверения ЛП, выдаваемого со сроком действия 5 лет, на впервые регистрируемые в РФ ЛП. 2. По истечении указанного в части 1 настоящей статьи срока выдается бессрочное регистрационное удостоверение ЛП при условии подтверждения его государственной регистрации.
Слайд 153: 32. ОТМЕНА ГОС.РЕГИСТРАЦИИ ЛП
6. Государственная регистрация ЛП 1) представление МЗ РФ заключения о риске или об угрозе здоровью, жизни человека или животного при применении ЛП, превышающих его эффективность, по результатам мониторинга безопасности ЛП; 2) подача разработчиком ЛС или уполномоченным им другим юридическим лицом заявления об отмене гос. регистрации ЛП; 3) неподтверждение гос. регистрации ЛП по истечении срока действия регистрационного удостоверения, выданного на 5лет; 4) непредставление заявителем информации, которая может повлечь за собой необходимость внесения изменений в документы, содержащиеся в регистрационном досье на зарегистрированный ЛП, в течение 30 рабочих дней со дня наступления этих изменений ; 5) осуществление гос. регистрации ЛП под торговым наименованием зарегистрированного ранее под этим торговым наименованием ЛП; 6) осуществление гос. регистрации заявителем одного и того же ЛП под различными торговыми наименованиями ; 7) вынесение судом решения о нарушении прав правообладателя объектов интеллектуальной собственности при обращении ЛС.
Слайд 154: 33. ГОСУДАРСТВЕННЫЙ РЕЕСТР ЛС
6. Государственная регистрация ЛП 1. Гос. реестр ЛС содержит перечень ЛП, прошедших государственную регистрацию, перечень фармацевтических субстанций, входящих в состав ЛП, и следующую информацию: 1) в отношении ЛП: а ) наименование ЛП (МНН или химическое и торговое наименования); б ) ЛФ с указанием дозировки ЛП и его количества в потребительской упаковке; в ) наименование разработчика ЛП; г ) наименование и адрес производителя ЛП; д ) фармакотерапевтическая группа ЛП; е ) показания и противопоказания к применению ЛП; ж ) побочные действия ЛП; з ) срок годности ЛП; и ) условия хранения ЛП; к ) условия отпуска ЛП; л ) номер фармакопейной статьи или в случае ее отсутствия номер нормативной документации либо нормативного документа; м ) дата государственной регистрации ЛП и его регистрационный номер;
Слайд 155: 33. ГОСУДАРСТВЕННЫЙ РЕЕСТР ЛС
6. Государственная регистрация ЛП 1. Гос. реестр ЛС содержит перечень ЛП, прошедших государственную регистрацию, перечень фармацевтических субстанций, входящих в состав ЛП, и следующую информацию: 2 ) в отношении фармацевтических субстанций: а) наименование фармацевтической субстанции (МНН или химическое и торговое наименования); б) наименование и адрес производителя фармацевтической субстанции; в) срок годности фармацевтической субстанции; г) условия хранения фармацевтической субстанции; д ) номер фармакопейной статьи или в случае ее отсутствия номер нормативной документации либо нормативного документа.
Слайд 156: 33. ГОСУДАРСТВЕННЫЙ РЕЕСТР ЛС
6. Государственная регистрация ЛП 3. Порядок ведения гос. реестра ЛС для медицинского применения и порядок ведения гос. реестра ЛС для ветеринарного применения утверждаются соответствующим уполномоченным федеральным органом исполнительной власти : Порядок ведения государственного реестра лекарственных средств для медицинского применения, утвержденный приказом Минздравсоцразвития от 26 августа 2010 года N 746н. http://grls.rosminzdrav.ru /
Слайд 157: 38. КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ ЛП
7. Клинические исследования ЛП 1. КИ ЛП для МП, в том числе ММЦ, МЦ, ПР, проводятся для гос. регистрации ЛП в одной или нескольких МО в соответствии с правилами клинической практики, утвержденными уполномоченным федеральным органом исполнительной власти, в целях: 1) установление безопасности ЛП для здоровых добровольцев и (или) переносимости их здоровыми добровольцами, за исключением таких исследований ЛП, произведенных за пределами РФ; 2 ) подбор оптимальных дозировок ЛП и курса лечения для пациентов с определенным заболеванием, оптимальных доз и схем вакцинации иммунобиологическими ЛП здоровых добровольцев; 3 ) установление безопасности ЛП и его эффективности для пациентов с определенным заболеванием, профилактической эффективности иммунобиологических ЛП для здоровых добровольцев; 4 ) изучение возможности расширения показаний для медицинского применения и выявления ранее неизвестных побочных действий зарегистрированных ЛП. Правила клинической практики, у тв. приказом МЗ РФ от 19 июня 2003 года N 266 Надлежащая клиническая практика (GCP). ГОСТ Р 52379-2005
Слайд 158: 38. КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ ЛП
7. Клинические исследования ЛП 2. В отношении воспроизведенных ЛП для МП проводятся исследования биоэквивалентности и (или) терапевтической эквивалентности в порядке, установленном уполномоченным федеральным органом исполнительной власти БЭ ЛП – ЛП, обеспечивающие одинаковую БД ЛС. БД отражает количество неизмененного действующего вещества, достигающего системного кровотока (степень всасывания) относительно исходной дозы ЛС. ЛФ пролонгированного действия; ЛФ, обеспечивающие немедленное высвобождение ЛС при приеме внутрь (таблетки, капсулы, суспензии и др., за исключением растворов); трансдермальные терапевтические систем; суппозитории, а также комбинированные ЛП (по основным компонентам). Оригинальное ЛС, зарегистрированное в РФ. Содержание действующего вещества не должно отличаться более чем на 5 %.
Слайд 159: 38. КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ ЛП
7. Клинические исследования ЛП 3. Организацию проведения КИ ЛП для МП вправе осуществлять: разработчик ЛП или уполномоченное им лицо; образовательные организации высшего образования, организации дополнительного профессионального образования ; научно-исследовательские организации.
Слайд 160: 45. ПРОИЗВОДСТВО ЛС
8. Производство и маркировка ЛС 1. Производство ЛС должно соответствовать правилам организации производства и контроля качества ЛС, утвержденным уполномоченным федеральным органом исполнительной власти - дисбаланс регуляторных требований к отечественным и зарубежным предприятиям-производителям; - дефицит высококвалифицированных кадров для фармацевтической отрасли; - отсутствие механизмов финансирования разработок ЛС; - недостаточный уровень российского патентного законодательства и правоприменительной практики относительно международных стандартов; - отсутствие обязательных для исполнения правил производства и контроля качества ЛС, идентичных международным правилам GMP и др. Приказ Минздрава РФ и Минэкономики РФ от 3 декабря 1999 года N 432/512 "О введении в действие Стандарта отрасли ОСТ 42-510-98 "Правила организации производства и контроля качества лекарственных средств (GMP)"
Слайд 161: 45. ПРОИЗВОДСТВО ЛС
8. Производство и маркировка ЛС 2. Производство ЛС на территории РФ осуществляется производителями, имеющими лицензию на производство ЛС Положение о лицензировании производства лекарственных средств утверждено постановлением Правительства РФ 06 июля 2012 года N 686 Приложение к Положению о лицензировании производства ЛС Министерство промышленности и торговли РФ
Слайд 162: 45. ПРОИЗВОДСТВО ЛС
8. Производство и маркировка ЛС 3. Производство ЛС осуществляется с соблюдением требований промышленного регламента, который утверждается руководителем производителя ЛС и включает в себя перечень используемых фарм. субстанций и вспомогательных веществ с указанием количества каждого из них, данные об используемом оборудовании, описание технологического процесса и методов контроля на всех этапах производства ЛС.
Слайд 163: 45. ПРОИЗВОДСТВО ЛС
8. Производство и маркировка ЛС 4. При производстве ЛС используются фармацевтические субстанции, включенные в государственный реестр ЛС. Положение о Гос. реестре ЛС - Приказ МЗ РФ от 1 декабря 1998 года N 01/29-15. Порядок ведения государственного реестра ЛС для медицинского применения утвержден приказом Минздравсоцразвития от 26 августа 2010 года N 746н.
Слайд 164: 45. ПРОИЗВОДСТВО ЛС
8. Производство и маркировка ЛС 5. Запрещается производство: 1 ) ЛС, не включенных в гос. реестр ЛС, за исключением ЛС, производимых для проведения КИ и для экспорта; 2 ) фальсифицированных ЛС; 3 ) ЛС без лицензии на производство ЛС; 4) ЛС с нарушением правил организации производства и контроля качества ЛС.
Слайд 165: 45. ПРОИЗВОДСТВО ЛС
8. Производство и маркировка ЛС 8. Производители ЛС могут осуществлять продажу ЛС или передавать их в установленном законодательством РФ порядке: 1) другим производителям ЛС (для производства ЛС) 2 ) организациям оптовой торговли ЛС 3) аптечным организациям, ветеринарным аптечным организациям, ИП, имеющим лицензию на ФД или лицензию на медицинскую деятельность 4 ) научно-исследовательским организациям (для научно-исследовательской работы) 5) медицинским организациям и ветеринарным организациям 6) организациям, осуществляющим разведение, выращивание и содержание животных
Слайд 166: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 1. ЛП, за исключением ЛП, изготовленных АО, ветеринарными АО, ИП, имеющими лицензию на ФД, должны поступать в обращение, если: 1) на их первичной упаковке (за исключением первичной упаковки лекарственных растительных препаратов) хорошо читаемым шрифтом на русском языке указаны наименование ЛП (МНН, или химическое, или ТН), номер серии, дата выпуска (для иммунобиологических ЛП), срок годности, дозировка или концентрация, объем, активность в единицах действия или количество доз
Слайд 167: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 1. ЛП, за исключением ЛП, изготовленных АО, ветеринарными АО, ИП, имеющими лицензию на ФД, должны поступать в обращение, если: 2) на вторичной упаковке -//- наименование ЛП (МНН или химическое и ТН), наименование производителя ЛП, номер серии, дата выпуска (для иммунобиологических ЛП), номер регистрационного удостоверения, срок годности, способ применения, дозировка или концентрация, объем, активность в ед.д. либо количество доз в упаковке, лекарственная форма, условия отпуска, условия хранения, предупредительные надписи
Слайд 168: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС Макировка – информация в виде надписей, цифровых, цветовых и условных обозначений, наносимая на продукцию, упаковку, этикетку или ярлык для обеспечения идентификации и ускорения обработки при погрузочно-разгрузочных работах, транспортировании и хранении п.3.4 ГОСТ 17527-2003 Межгосударственный стандарт. Упаковка. Термины и определения). Упаковка – средство или комплекс средств, обеспечивающих защиту продукции от повреждения и потерь, окружающей среды от загрязнений, а также обеспечивающих процесс обращения продукции. Первичная упаковка — упаковка, предназначенная для непосредственной упаковки продукта и находящаяся в прямом контакте с ним; удаляется или распечатывается перед употреблением упакованного товара (блистер).
Слайд 169: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 3. ЛС в качестве сывороток должны поступать в обращение с указанием животного, из крови, плазмы крови, органов и тканей которого они получены.
Слайд 170: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 4. На вторичную (потребительскую) упаковку ЛС, полученных из крови, плазмы крови, органов и тканей человека, должна наноситься надпись: " Антитела к ВИЧ-1, ВИЧ-2, к вирусу гепатита С и поверхностный антиген вируса гепатита В отсутствуют".
Слайд 171: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 5. На первичную упаковку и вторичную (потребительскую) упаковку радиофармацевтических лекарственных средств должен наноситься знак радиационной опасности.
Слайд 172: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 6. На вторичную (потребительскую) упаковку гомеопатических лекарственных препаратов должна наноситься надпись: " Гомеопатический"
Слайд 173: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 7. На вторичную (потребительскую) упаковку лекарственных растительных препаратов должна наноситься надпись: " Продукция прошла радиационный контроль".
Слайд 174: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 8. На первичную упаковку и вторичную (потребительскую) упаковку лекарственных препаратов, предназначенных для клинических исследований, должна наноситься надпись: " Для клинических исследований ".
Слайд 175: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 9. Упаковка ЛС, предназначенных исключительно для экспорта, маркируется в соответствии с требованиями страны-импортера.
Слайд 176: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 10. На транспортную тару, которая не предназначена для потребителей и в которую помещено ЛС, должна наноситься информация: о наименовании, серии ЛС, дате выпуска, количестве вторичных (потребительских) упаковок ЛС, производителе ЛС с указанием наименования и местонахождения производителя ЛС (адрес, в том числе страна и (или) место производства лекарственного средства), сроке годности ЛС и об условиях его хранения и перевозки, необходимые предупредительные надписи и манипуляторные знаки. ГОСТ 14192-96 "Маркировка грузов " ГОСТ 19433-88 "Грузы опасные. Классификация и маркировка "
Слайд 177: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 11. На первичную упаковку и вторичную (потребительскую) упаковку лекарственных средств для ветеринарного применения должна наноситься надпись: " Для ветеринарного применения"
Слайд 178: 46. МАРКИРОВКА ЛС
8. Производство и маркировка ЛС 12. На вторичную (потребительскую) упаковку лекарственного препарата наносится штриховой код.
Слайд 179: 47. ПОРЯДОК ВВОЗА ВЫВОЗА ЛС
9. Ввоз ЛС в РФ и вывоз ЛС из РФ 1. Ввоз ЛС осуществляется в порядке, установленном Правительством РФ в соответствии с внутригосударственным и международным таможенным законодательством. Правила ввоза ЛС для медицинского применения на территорию РФ утверждены постановлением Правительства РФ от 29 сентября 2010 года N 771.
Слайд 180: 47. ПОРЯДОК ВВОЗА ВЫВОЗА ЛС
9. Ввоз ЛС в РФ и вывоз ЛС из РФ 2. Ввозимые в РФ ЛС должны быть включены в гос. реестр ЛС.
Слайд 181: 47. ПОРЯДОК ВВОЗА ВЫВОЗА ЛС
9. Ввоз ЛС в РФ и вывоз ЛС из РФ 3. Допускается ввоз в РФ конкретной партии зарегистрированных и (или) незарегистрированных ЛС, предназначенных для: - проведения КИ ЛП, - проведения экспертизы ЛС для осуществления гос. регистрации ЛП - для оказания МП по жизненным показаниям конкретного пациента на основании разрешения, выданного уполномоченным федеральным органом исполнительной власти.
Слайд 182: 47. ПОРЯДОК ВВОЗА ВЫВОЗА ЛС
9. Ввоз ЛС в РФ и вывоз ЛС из РФ 4. В РФ можно ввозить ЛС, качество которых подтверждено сертификатом производителя ЛС, удостоверяющим соответствие ввозимых ЛС требованиям фармакопейных статей либо в случае их отсутствия нормативной документации или нормативного документа. 5. Запрещается ввоз в РФ фальсифицированных ЛС, недоброкачественных ЛС, контрафактных ЛС. 6. Фальсифицированные ЛС, недоброкачественные ЛС подлежат изъятию и последующему уничтожению или вывозу из РФ, контрафактные ЛС - изъятию и последующему уничтожению. Правила уничтожения недоброкачественных ЛС, фальсифицированных ЛС и контрафактных ЛС, утв. Пост-ем Правительства РФ от 3 сентября 2010 года N 674
Слайд 183: 47. ПОРЯДОК ВВОЗА ВЫВОЗА ЛС
9. Ввоз ЛС в РФ и вывоз ЛС из РФ 7. Вывоз ЛС из РФ осуществляется без применения ограничений, установленных таможенным законодательством Таможенного союза и (или) законодательством РФ о государственном регулировании внешнеторговой деятельности. Вывоз ЛП для МП, предназначенных для гуманитарной помощи (содействия) или помощи при ЧС, из РФ осуществляется в порядке, установленном Правительством РФ.
Слайд 184: 52. ОСУЩЕСТВЛЕНИЕ ФД
10. Фармацевтическая деятельность 1. ФД осуществляется: - организациями оптовой торговли ЛС, - аптечными организациями, - ветеринарными аптечными организациями, - индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, - медицинскими организациями, имеющими лицензию на фармацевтическую деятельность, - их обособленными подразделениями (амбулаториями, фельдшерскими и фельдшерско-акушерскими пунктами, центрами (отделениями) общей врачебной (семейной) практики), расположенными в сельских населенных пунктах, в которых отсутствуют АО, - ветеринарными организациями, имеющими лицензию на ФД.
Слайд 185: 52. ОСУЩЕСТВЛЕНИЕ ФД
10. Фармацевтическая деятельность 2. Физические лица могут осуществлять ФД при наличии высшего или среднего фармацевтического образования и сертификата специалиста, высшего или среднего ветеринарного образования и сертификата специалиста, высшего или среднего медицинского образования, сертификата специалиста и дополнительного профессионального образования в части розничной торговли ЛП при условии их работы в обособленных подразделениях медицинских организаций, указанных в части 1 настоящей статьи.
Слайд 186: 52. ОСУЩЕСТВЛЕНИЕ ФД
10. Фармацевтическая деятельность В сфере обращения лекарственных средств для медицинского применения к фармацевтической деятельности относятся: - оптовая торговля ЛС для МП; - хранение ЛС для МП; - хранение ЛП для МП; - перевозка ЛС для МП; - перевозка ЛП для МП; - розничная торговля ЛП для МП; - отпуск ЛП для медицинского применения; - изготовление ЛП для МП.
Слайд 187: 52. ОСУЩЕСТВЛЕНИЕ ФД
10. Фармацевтическая деятельность Лицензирующими органами фармацевтической деятельности являются: - Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор) - Федеральная служба по ветеринарному и фитосанитарному надзору ( Росселъхознадзор ) - органы исполнительной власти субъектов РФ
Слайд 188: 53. ПРОДАЖА ЛС ОПТОВЫМИ ОРГАНИЗАЦИЯМИ
10. Фармацевтическая деятельность 1. Организации оптовой торговли лекарственными средствами могут осуществлять продажу лекарственных средств или передавать их в установленном законодательством Российской Федерации порядке : 1) другим организациям оптовой торговли ЛС; 2 ) производителям ЛС (для целей производства ЛС); 3 ) АО и ветеринарным АО; 4 ) научно-исследовательским организациям (для научно-исследовательской работы); 5 ) ИП, имеющим лицензию на ФД или лицензию на МД; 6 ) МО, ветеринарным организациям ; 7 ) организациям, осуществляющим разведение, выращивание и содержание животных.
Слайд 189: 55. ПОРЯДОК РОЗНИЧНОЙ ТОРГОВЛИ ЛП
10. Фармацевтическая деятельность Розничная торговля ЛП - это торговля ЛП в количествах, необходимых для выполнения врачебных (фельдшерских) назначений или назначений специалистов в области ветеринарии. Розничной торговлей ЛП могут заниматься: - аптечные организации; - ветеринарные аптечные организации, - ИП, имеющие лицензию на ФД, - медицинские организации, имеющие лицензию на ФД, и их обособленные подразделения (амбулатории, фельдшерские и фельдшерско-акушерские пункты, центры (отделения) общей врачебной (семейной) практики), расположенные в сельских поселениях, в которых отсутствуют аптечные организации - ветеринарные организации, имеющие лицензию на ФД.
Слайд 190: 55. ПОРЯДОК РОЗНИЧНОЙ ТОРГОВЛИ ЛП
10. Фармацевтическая деятельность 2. Уполномоченным федеральным органом исполнительной власти (МЗ РФ ) утверждаются : - виды аптечных учреждений – аптека, апт.пункт, апт.киоск Приказ МЗСР от 27 июля 2010 года N 553н "Об утверждении видов АО" - правила отпуска ЛП для МП аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на ФД; Приказ МЗ РФ от 4 марта 2003 года N 80 "Об утверждении Отраслевого стандарта "Правила отпуска (реализации) лекарственных средств в аптечных организациях. Основные положения " Приказ МЗСР от 14 декабря 2005 года N 785 "О порядке отпуска лекарственных средств " - правила отпуска ЛП для МП медицинскими организациями, имеющими лицензию на ФД, и их обособленными подразделениями Приказ МЗСР от 26 августа 2010 года N 735н "Об утверждении Правил отпуска ЛП для МП медицинскими организациями, имеющими лицензию на ФД, и их обособленными подразделениями (…)".
Слайд 191: 55. ПОРЯДОК РОЗНИЧНОЙ ТОРГОВЛИ ЛП
10. Фармацевтическая деятельность 3. Правила отпуска НС и ПВ, зарегистрированных в качестве ЛП, ЛП, содержащих НС и ПВ, утверждаются уполномоченным ФОИВ по согласованию с ФОИВ, осуществляющим функции по выработке гос. политики, нормативно-правовому регулированию, контролю и надзору в сфере оборота НС, ПВ и их прекурсоров, а также в области противодействия их незаконному обороту. Правила распределения, отпуска и реализации НС и ПВ утверждены пост-ем Правительства РФ от 26 июля 2010 года N 558 "О порядке распределения, отпуска и реализации НС и ПВ" Перечень должностей медицинских и фармацевтических работников, а также организаций и учреждений, которым предоставлено право отпуска НС и ПВ физическим лицам утвержден приказом МЗСР от 13 мая 2005 года N 330 Федеральный закон от 8 января 1998 г. N 3-ФЗ "О наркотических средствах и психотропных веществах"
Слайд 192: 55. ПОРЯДОК РОЗНИЧНОЙ ТОРГОВЛИ ЛП
10. Фармацевтическая деятельность 6. АО, ИП, имеющие лицензию на ФД, обязаны обеспечивать утвержденный Правительством РФ и формируемый в установленном им порядке минимальный ассортимент ЛП, необходимых для оказания медицинской помощи. Приказ Минздравсоцразвития от 15 сентября 2010 года N 805н "Об утверждении минимального ассортимента лекарственных препаратов для медицинского применения, необходимых для оказания медицинской помощи"
Слайд 193: 55. ПОРЯДОК РОЗНИЧНОЙ ТОРГОВЛИ ЛП
10. Фармацевтическая деятельность 6. АО, ИП, имеющие лицензию на ФД, наряду с ЛП имеют право приобретать и продавать: изделия медицинского назначения, дезинфицирующие средства, предметы и средства личной гигиены, посуду для медицинских целей, предметы и средства, предназначенные для ухода за больными, новорожденными и детьми, не достигшими возраста трех лет, очковую оптику и средства ухода за ней, минеральные воды, продукты лечебного, детского и диетического питания, биологически активные добавки, парфюмерные и косметические средства, медицинские и санитарно-просветительные печатные издания, предназначенные для пропаганды здорового образа жизни.
Слайд 194: 56. ИЗГОТОВЛЕНИЕ И ОТПУСК ЛП
10. Фармацевтическая деятельность 1. Изготовление ЛП аптечными организациями, ветеринарными АО, ИП, имеющими лицензию на ФД, осуществляется по рецептам на ЛП, по требованиям МО, ветеринарных организаций в соответствии с правилами изготовления и отпуска ЛП, утвержденными уполномоченным федеральным органом исполнительной власти. - приказ МЗ РФ от 16 июля 1997 года N 214 "О контроле качества ЛС, изготовляемых в аптеках" ; - приказ МЗ РФ от 21 октября 1997 года N 308 "Об утверждении инструкции по изготовлению в аптеках жидких форм" ; - приказ МЗ РФ от 21 октября 1997 года N 309 "Об утверждении инструкции по санитарному режиму АО (аптек ); - приказ МЗ РФ от 16 октября 1997 года N 305 "Об утверждении норм естественной убыли ЛС и ИМН в АО независимо от организационно-правовой формы и формы собственности" ; - приказ МЗ РФ от 4 марта 2003 N 80 "Об утверждении Отраслевого стандарта "Правила отпуска (реализации) ЛС в АО. Основные положения"
Слайд 195: 57. ЗАПРЕЩЕНИЕ ПРОДАЖИ ФЛС, НДКЛС, КФЛС
10. Фармацевтическая деятельность 1. Продажа фальсифицированных лекарственных средств, недоброкачественных лекарственных средств, контрафактных лекарственных средств запрещается.
Слайд 196: 58. ХРАНЕНИЕ ЛС
10. Фармацевтическая деятельность 1. Хранение ЛС осуществляется производителями ЛС, организациями оптовой торговли ЛС, АО, ветеринарными АО, ИП, имеющими лицензию на ФД или лицензию на медицинскую деятельность, медицинскими организациями, ветеринарными организациями иными организациями, осуществляющими обращение ЛС.
Слайд 197: 58. ХРАНЕНИЕ ЛС
10. Фармацевтическая деятельность 2. Правила хранения ЛС утверждаются соответствующим уполномоченным федеральным органом исполнительной власти. Правила хранения лекарственных средств Утв. Приказ Минздравсоцразвития от 23 августа 2010 года N 706н
Слайд 198: 58. ХРАНЕНИЕ ЛС
10. Фармацевтическая деятельность 3. Хранение наркотических ЛС, психотропных ЛС, радиофармацевтических ЛС осуществляется в соответствии с законодательством РФ ФЗ от 8 января 1998 г. N 3 "О НС и ПВ" Перечень НС, ПВ и их прекурсоров, подлежащих контролю в РФ утвержден постановлением Правительства РФ от 30 июня 1998 года N 681 "Об утверждении перечня НС, ПВ и их прекурсоров, подлежащих контролю в РФ". Данным постановлением утверждены два списка: - список НС, ПВ и их прекурсоров, оборот которых в РФ запрещен в соответствии с законодательством РФ и международными договорами Российской Федерации ( список I ); - список НС и ПВ, оборот которых в РФ ограничен и в отношении которых устанавливаются меры контроля в соответствии с законодательством РФ и международными договорами РФ ( список II ).
Слайд 199: 60. ГОС. РЕГУЛИРОВАНИЕ ЦЕН НА ЛП
12. Государственное регулирование цен на ЛП Элементы системы гос. регулирования цен на ЛП для МП. Утверждение перечня ЖНВЛ препаратов Перечень жизненно необходимых и важнейших лекарственных препаратов на 2013 год был утвержден распоряжением Правительства РФ от 30 июля 2012 года N 1378-р "Об установлении перечня жизненно необходимых и важнейших лекарственных препаратов на 2013 год" Утверждение методики установления производителями ЛП предельных отпускных цен Государственная регистрация установленных производителями ЛП отпускных цен Ведение гос. реестра предельных отпускных цен производителей Утверждение методики установления органами исполнительной власти субъектов РФ предельных размеров оптовых надбавок и предельных размеров розничных надбавок к фактическим отпускным ценам, установленным производителями ЛП Установление предельных размеров оптовых надбавок и предельных размеров розничных надбавок к фактическим отпускным ценам, установленным производителями ЛП, на ЛП, включенные в перечень ЖНВЛ препаратов.
Слайд 200: 64. МОНИТОРИНГ БЕЗОПАСНОСТИ ЛП
13. Мониторинг безопасности ЛП 1. ЛП, находящиеся в обращении на территории РФ, подлежат мониторингу безопасности в целях выявления возможных негативных последствий их применения, предупреждения пациентов и их защиты от применения таких препаратов. Мониторинг безопасности ЛП для медицинского применения включает в себя сбор, обработку, регистрацию и анализ информации о побочных действиях, серьезных и непредвиденных нежелательных реакциях, об особенностях взаимодействия лекарственных препаратов с другими лекарственными препаратами, которые были выявлены при проведении клинических исследований и применении лекарственных препаратов, в целях выявления возможных негативных последствий их применения, предупреждения и защиты пациентов (в отношении ЛП для МП) и животных (в отношении ЛП для ветеринарного применения) от применения таких препаратов и проводится с соблюдением законодательства РФ в области защиты персональных данных.
Слайд 201: 64. МОНИТОРИНГ БЕЗОПАСНОСТИ ЛП
13. Мониторинг безопасности ЛП 5. Порядок осуществления мониторинга безопасности ЛП, регистрации побочных действий, серьезных нежелательных реакций, непредвиденных нежелательных реакций при применении ЛП, в том числе представления информации об этом, устанавливается уполномоченным ФОИВ - приказ Минздрава России от 20 июня 2012 года N 12н "Об утверждении Порядка сообщения субъектами обращения медицинских изделий обо всех случаях выявления побочных действий, не указанных в инструкции по применению или руководстве по эксплуатации медицинского изделия, о нежелательных реакциях при его применении, об особенностях взаимодействия медицинских изделий между собой, о фактах и об обстоятельствах, создающих угрозу жизни и здоровью граждан и медицинских работников при применении и эксплуатации медицинских изделий" ; - приказ Минздравсоцразвития РФ от 26 августа 2010 года N 757н "Об утверждении порядка осуществления мониторинга безопасности ЛП для медицинского применения, регистрации побочных действий, серьезных нежелательных реакций, непредвиденных нежелательных реакций при применении ЛП для медицинского применения " ;
Слайд 202: 67. ИНФОРМАЦИЯ О ЛП
14. Информация о ЛП 1. Информация о ЛП, отпускаемых по рецепту, должна содержаться только в специализированных изданиях, предназначенных для медицинских, фармацевтических, ветеринарных работников. Информация о ЛП для специалистов в области обращения ЛС может содержаться в монографиях, справочниках, научных статьях, в докладах на конгрессах, конференциях, симпозиумах, научных советах, а также в инструкциях по применению ЛП. 2. Информация о ЛП, отпускаемых без рецепта, может содержаться в публикациях и объявлениях СМИ, специализированных и общих печатных изданиях, инструкциях по применению ЛП, иных изданиях субъектов обращения ЛС. Рекламные материалы о лекарственном препарате, отпускаемом без рецепта на ЛП, должны соответствовать инструкции по применению ЛП.
Слайд 203: 67.1. ОГРАНИЧЕНИЯ, НАЛАГАЕМЫЕ ПРИ ОСУЩЕСТВЛЕНИИ ФД
14.1. Ограничения на организации 1. Организации, занимающиеся разработкой, производством и (или) реализацией ЛП для МП, организации, обладающие правами на использование ТН ЛП для МП, организации оптовой торговли ЛС, АО (их представители, иные физические и юридические лица, осуществляющие свою деятельность от имени этих организаций) в отношении медицинских работников и руководителей МО не вправе : 1) вручать подарки, выплачивать денежные средства (за исключением вознаграждений по договорам при проведении клинических исследований лекарственных препаратов для медицинского применения, вознаграждений, связанных с осуществлением медицинским работником педагогической и (или) научной деятельности), в том числе оплачивать развлечения, отдых, проезд к месту отдыха, а также привлекать к участию в развлекательных мероприятиях, проводимых за счет своих средств
Слайд 204: 67.1. ОГРАНИЧЕНИЯ, НАЛАГАЕМЫЕ ПРИ ОСУЩЕСТВЛЕНИИ ФД
14.1. Ограничения на организации 1. Организации, занимающиеся разработкой, производством и (или) реализацией ЛП для МП, организации, обладающие правами на использование ТН ЛП для МП, организации оптовой торговли ЛС, АО (их представители, иные физические и юридические лица, осуществляющие свою деятельность от имени этих организаций) в отношении медицинских работников и руководителей МО не вправе : 2) заключать соглашения о назначении или рекомендации пациентам лекарственных препаратов для медицинского применения (за исключением договоров о проведении клинических исследований лекарственных препаратов для медицинского применения )
Слайд 205: 67.1. ОГРАНИЧЕНИЯ, НАЛАГАЕМЫЕ ПРИ ОСУЩЕСТВЛЕНИИ ФД
14.1. Ограничения на организации 1. Организации, занимающиеся разработкой, производством и (или) реализацией ЛП для МП, организации, обладающие правами на использование ТН ЛП для МП, организации оптовой торговли ЛС, АО (их представители, иные физические и юридические лица, осуществляющие свою деятельность от имени этих организаций) в отношении медицинских работников и руководителей МО не вправе : 3) предоставлять образцы лекарственных препаратов для медицинского применения в целях вручения пациентам (за исключением случаев, связанных с проведением клинических исследований лекарственных препаратов для медицинского применения )
Слайд 206: 67.1. ОГРАНИЧЕНИЯ, НАЛАГАЕМЫЕ ПРИ ОСУЩЕСТВЛЕНИИ ФД
14.1. Ограничения на организации 1. Организации, занимающиеся разработкой, производством и (или) реализацией ЛП для МП, организации, обладающие правами на использование ТН ЛП для МП, организации оптовой торговли ЛС, АО (их представители, иные физические и юридические лица, осуществляющие свою деятельность от имени этих организаций) в отношении медицинских работников и руководителей МО не вправе : 4) предоставлять недостоверную и (или) неполную информацию о лекарственных препаратах для медицинского применения
Слайд 207: 67.1. ОГРАНИЧЕНИЯ, НАЛАГАЕМЫЕ ПРИ ОСУЩЕСТВЛЕНИИ ФД
14.1. Ограничения на организации 1. Организации, занимающиеся разработкой, производством и (или) реализацией ЛП для МП, организации, обладающие правами на использование ТН ЛП для МП, организации оптовой торговли ЛС, АО (их представители, иные физические и юридические лица, осуществляющие свою деятельность от имени этих организаций) в отношении медицинских работников и руководителей МО не вправе : 5) посещать их в рабочее время на рабочих местах, за исключением случаев, связанных с проведением клинических исследований лекарственных препаратов для медицинского применения, с участием в порядке, установленном руководителем медицинской организации, в собраниях медицинских работников и иных мероприятиях, направленных на повышение их профессионального уровня или на предоставление информации, связанной с осуществлением мониторинга безопасности лекарственных препаратов
Слайд 208: 67.1. ОГРАНИЧЕНИЯ, НАЛАГАЕМЫЕ ПРИ ОСУЩЕСТВЛЕНИИ ФД
14.1. Ограничения на организации 1. Организации, занимающиеся разработкой, производством и (или) реализацией ЛП для МП, организации, обладающие правами на использование ТН ЛП для МП, организации оптовой торговли ЛС, АО (их представители, иные физические и юридические лица, осуществляющие свою деятельность от имени этих организаций) в отношении медицинских работников и руководителей МО не вправе : 6) побуждать к выписыванию лекарственных препаратов для медицинского применения на бланках, содержащих информацию рекламного характера, а также на рецептурных бланках, на которых заранее напечатано наименование лекарственного препарата для медицинского применения
Слайд 209: 67.1. ОГРАНИЧЕНИЯ, НАЛАГАЕМЫЕ ПРИ ОСУЩЕСТВЛЕНИИ ФД
14.1. Ограничения на организации 2. Организации, указанные в абзаце первом части 1 настоящей статьи, и их представители в отношении фармацевтических работников и руководителей аптечных организаций не вправе: 1 ) вручать подарки, выплачивать денежные средства, в том числе оплачивать развлечения, отдых, проезд к месту отдыха, и привлекать к участию в развлекательных мероприятиях, проводимых за счет своих средств; 2 ) предоставлять образцы лекарственных препаратов для медицинского применения для вручения населению; 3 ) заключать соглашения о предложении населению определенных лекарственных препаратов для медицинского применения; 4 ) предоставлять недостоверную и (или) неполную информацию о лекарственных препаратах для медицинского применения, в том числе имеющих одинаковое международное непатентованное наименование.
Слайд 210: 68. ОТВЕТСТВЕННОСТЬ ЗА НАРУШЕНИЕ ЗД РФ
15. Ответственность за нарушение ЗД РФ 1. Нарушение законодательства Российской Федерации при обращении лекарственных средств влечет за собой ответственность в соответствии с законодательством РФ.
Слайд 211: 69. ВОЗМЕЩЕНИЕ ВРЕДА ЗДОРОВЬЮ
15. Ответственность за нарушение ЗД РФ 1. Производитель ЛП обязан возместить вред, причиненный здоровью граждан вследствие применения ЛП, если доказано, что: 1) ЛП применялся по назначению в соответствии с инструкцией по применению ЛП и причиной вреда явился ввод в гражданский оборот недоброкачественного ЛП; 2) вред здоровью причинен вследствие недостоверной информации, содержащейся в инструкции по применению ЛП, изданной производителем ЛП.
Последний слайд презентации: Федеральный закон от 12 апреля 2010 года N 61-ФЗ " Об обращении лекарственных: 69. ВОЗМЕЩЕНИЕ ВРЕДА ЗДОРОВЬЮ
15. Ответственность за нарушение ЗД РФ 2. В случае, если вред здоровью граждан причинен вследствие применения ЛП, пришедшего в негодность в результате нарушения правил хранения ЛС, правил оптовой торговли ЛП, правил отпуска ЛП, правил изготовления и отпуска ЛП, возмещение вреда осуществляется организацией допустившими продажу или отпуск такого ЛП. В число субъектов, несущих ответственность по указанному основанию, законодатель включает: - организации оптовой торговли лекарственными средствами; - аптечные организации; - индивидуальных предпринимателей, имеющих лицензию на фармацевтическую или медицинскую деятельность; - медицинские организации, имеющие лицензию на фармацевтическую деятельность; - обособленные подразделения медицинских организаций, имеющих лицензию на фармацевтическую деятельность (амбулатории, фельдшерские и фельдшерско-акушерские пункты, центры (отделения) общей врачебной (семейной) практики), расположенные в сельском поселении, в котором отсутствует аптечная организация.