Первый слайд презентации
Обеспечение качества лекарственных средств в Российской Федерации Система государственного контроля
Слайд 2: План лекции
Нормативное правовое регулирование вопросов контроля качества ЛС Система государственного контроля качества ЛС в Российской Федерации
Слайд 3
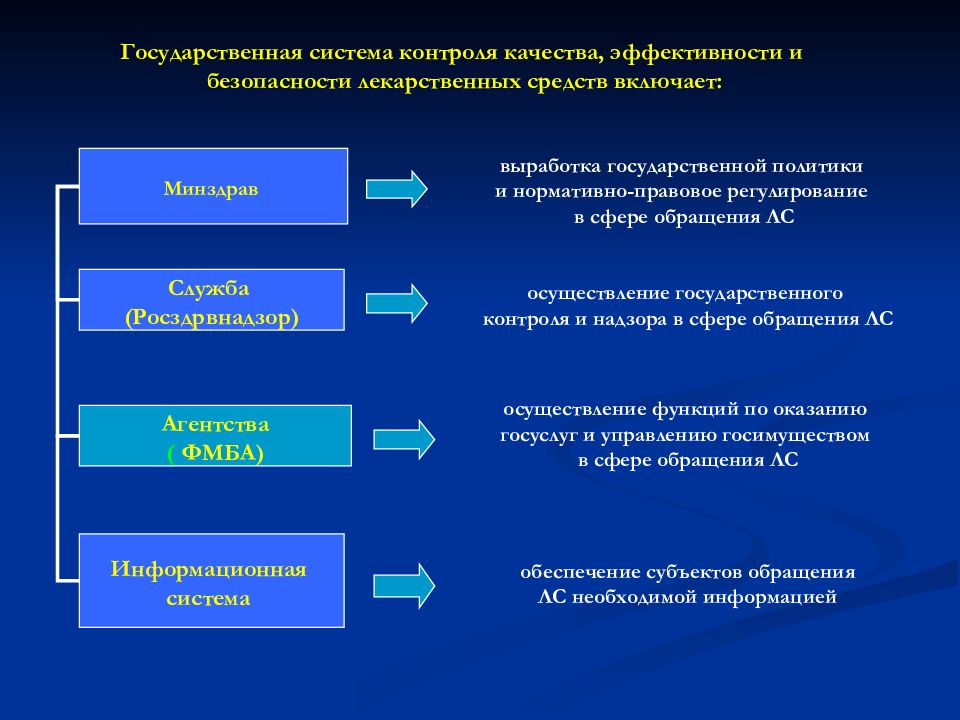
Минздрав Служба (Росздрвнадзор) Агентства ( ФМБА) Информационная система Государственная система контроля качества, эффективности и безопасности лекарственных средств включает: выработка государственной политики и нормативно-правовое регулирование в сфере обращения ЛС осуществление государственного контроля и надзора в сфере обращения ЛС осуществление функций по оказанию госуслуг и управлению госимуществом в сфере обращения ЛС обеспечение субъектов обращения ЛС необходимой информацией
Система качества лекарственных средств – совокупность организационной структуры, ресурсов и комплекса мер по обеспечению эффективности и безопасности ЛС и их соответствия установленным требованиям по показателям качества Законодательство в сфере обращения ЛС; Система контроля и надзора в сфере обращения ЛС (доклинические, клинические испытания, регистрация, производство, качество, ввоз, изготовление, реклама, оптовая и розничная торговля, применение, уничтожение ); Стандартизация в области качества ЛС и методов контроля; Система независимых лабораторий, осуществляющих экспертизу качества ЛС; Система научно-исследовательских учреждений
Законодательные акты Нормативные правовые акты федеральных органов исполнительной власти - Постановления Правительства РФ - Приказы Минздрава России - Приказы Росзравнадзора Нормативные акты органов исполнительной власти субъектов РФ Нормативные акты (приказы) на уровне организации
Слайд 6: Законодательные акты
1. Конституция Российской Федерации 2. «О защите прав потребителей» (от 07.02.1992 № 2300-1) ; «О защите прав юридических лиц и индивидуальных предпринимателей при проведении государственного контроля» (от 08.08.2001 № 134-ФЗ, ст.7 -12) ; «О лицензировании отдельных видов деятельности» (от 04.05.2011 № 99) ; «О техническом регулировании» (от 27.12.2002 № 184-ФЗ, ст.32 -40) ; «О наркотических средствах и психотропных веществах» (от 08.01.1998 № 3-ФЗ) «О рекламе» от 13.03.2006 № 38-ФЗ ; 3.«Основы законодательства РФ об охране здоровья граждан» (закон от 21.11.2011 № 323) ; «Об обращении лекарственных средств» (от 12.04.2010 № 61) ;
«Об утверждении положения о Федеральном государственном надзоре в сфере обращения лекарственных средств»
Слайд 8: Федеральный закон «О лекарственных средствах» (от 12.04.2010 № 61-ФЗ )
Роль: - создает правовую основу деятельности субъектов обращения ЛС; - устанавливает систему государственных органов, осуществляющих правоприменительную практику; - распределяет полномочия органов исполнительной власти в сфере обращения ЛС
Слайд 9: Федеральный закон «О лекарственных средствах» (от 12.04.2010 № 61-ФЗ)
Структура: Гл. 1 Общие положения Гл. 2 Полномочия органов исполнительной власти Гл. 3 Государственная фармакопея Гл. 4 Государственный контроль при обращении ЛС Гл. 5 Разработка, доклинические исследования ЛС Гл. 6 Государственная регистрация ЛС Гл. 7 Клинические исследования ЛС Гл. 8 Производство и маркировка ЛС Гл.9 Ввоз ЛС Гл. 10 Фармацевтическая деятельность Гл.11 Уничтожение ЛС ГЛ.12 Государственное регулирование цен на ЛС ГЛ.13 Мониторинг безопасности ЛП Гл.14 Информация о ЛП
Слайд 10: О техническом регулировании» (от 27.12.2002 № 184-ФЗ)
техническое регулирование - правовое регулирование отношений в области установления, применения и исполнения обязательных требований к продукции, процессам производства, эксплуатации, хранения, перевозки, реализации и утилизации, а также в в области оценки соответствия технический регламент - документ, который устанавливает обязательные для применения и исполнения требования к объектам технического регулирования (продукции, в том числе зданиям, строениям и сооружениям, процессам производства, эксплуатации, хранения, перевозки, реализации и утилизации ) Ст. 32 Органы государственного контроля за соблюдением требований технических регламентов Ст. 33 Объекты государственного контроля за соблюдением требований технических регламентов Ст. 34 Полномочия органов государственного контроля
Слайд 11: Нормативные правовые акты федеральных органов исполнительной власти
Постановления правительства «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения и социального развития» (от 30.06.2004 № 323) ; «Об утверждении Положения о лицензировании фармацевтической деятельности» (от 22.12.2012 № 1081); «Об утверждении Положения о лицензировании производства лекарственных средств» (от 06.07.2012 № 686) «Об утверждении правил продажи отдельных видов товаров, ….(от 19.01.1998 № 55);
Слайд 12
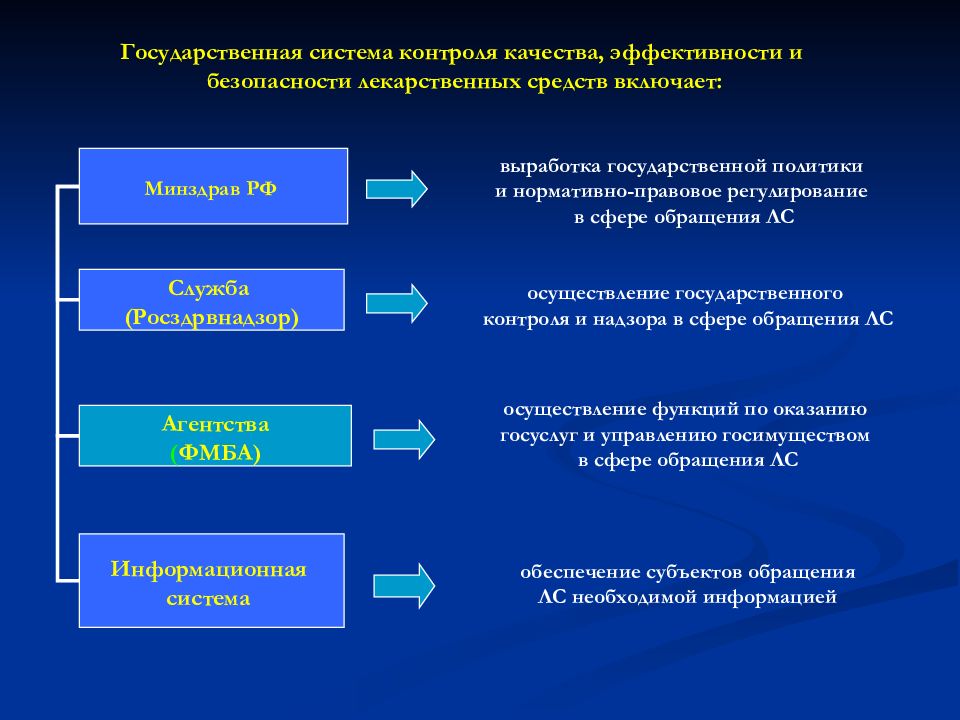
Минздрав РФ Служба (Росздрвнадзор) Агентства ( ФМБА) Информационная система Государственная система контроля качества, эффективности и безопасности лекарственных средств включает: выработка государственной политики и нормативно-правовое регулирование в сфере обращения ЛС осуществление государственного контроля и надзора в сфере обращения ЛС осуществление функций по оказанию госуслуг и управлению госимуществом в сфере обращения ЛС обеспечение субъектов обращения ЛС необходимой информацией
Слайд 13: Государственное регулирование отношений в сфере обращения ЛС
осуществляется путем: государственной регистрации ЛС; лицензирования отдельных видов деятельности в сфере обращения ЛС; аттестации и сертификации специалистов, занятых в сфере обращения ЛС; государственного контроля производства, изготовления, качества, эффективности, безопасности ЛС; государственного регулирования цен на ЛС
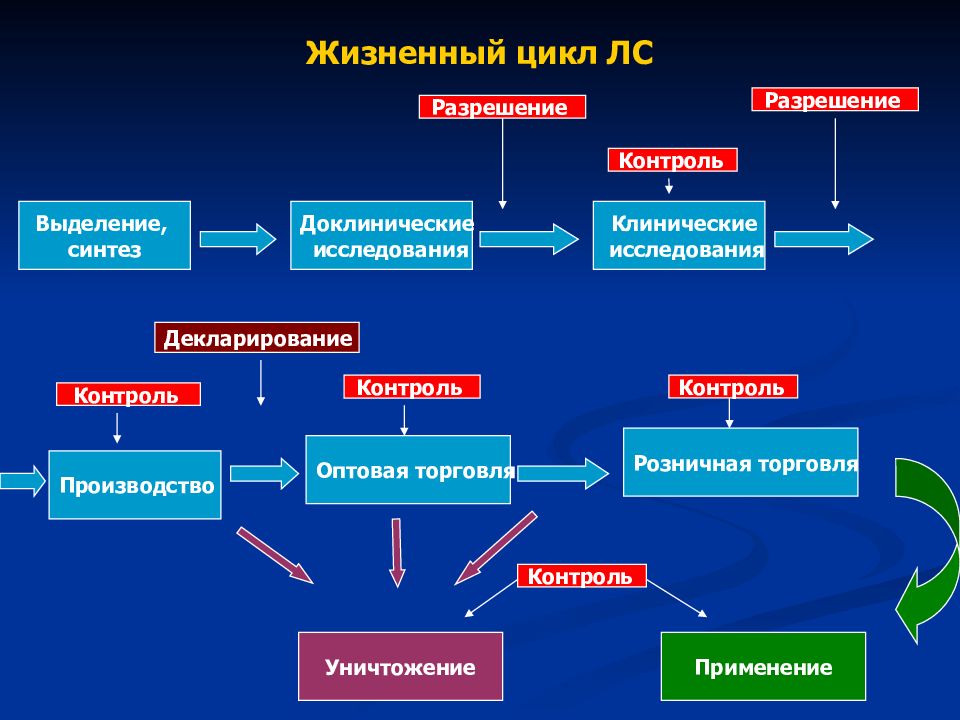
Слайд 14: Жизненный цикл ЛС
Выделение, синтез Доклинические исследования Клинические исследования Производство Разрешение Разрешение Оптовая торговля Розничная торговля Применение Уничтожение Декларирование Контроль Контроль Контроль Контроль Контроль
Слайд 15: Государственная система контроля качества, эффективности и безопасности ЛС
Государственному контролю подлежат все ЛС, произведенные на территории РФ и ввозимые на территорию РФ Порядок осуществления государственного контроля качества, эффективности, безопасности ЛС устанавливается: - Законом «Об обращении лекарственных средств»; - нормативными правовыми актами РФ, в том числе нормативными правовыми актами Минздравсоцразвития (Минздрава России).
Слайд 16
1 Этап На стадии регистрации ЛС (доклинические и клинические исследования, фармацевтическая экспертиза) 2 Этап До начала промышленного производства / регулярного импорта (предварительный государственный контроль) 3 Этап На этапе обращения (выборочный и повторный выборочный государственный контроль) Система государственного контроля в РФ в большей степени направлена на контроль готового продукта Этапы осуществления государственного контроля качества лекарственных средств
Слайд 17: Система государственного регулирования и контроля в развитых странах (Европа, США, Япония)
Основные элементы: Стандартизация в области контроля качества ЛС (ЕФ содержит 1800 монографий по вспомогательным веществам и реактивам, применяемым в производстве ЛС) Система стандартов GXP (GLP, GCP, GMP, GDP, CPP ); Фармацевтическая инспекция; Контроль за обращением ЛС Основной акцент государственного регулирования и контроля на: разработку ЛС; клинические исследования эффективности и безопасности; производство; допуск на рынок
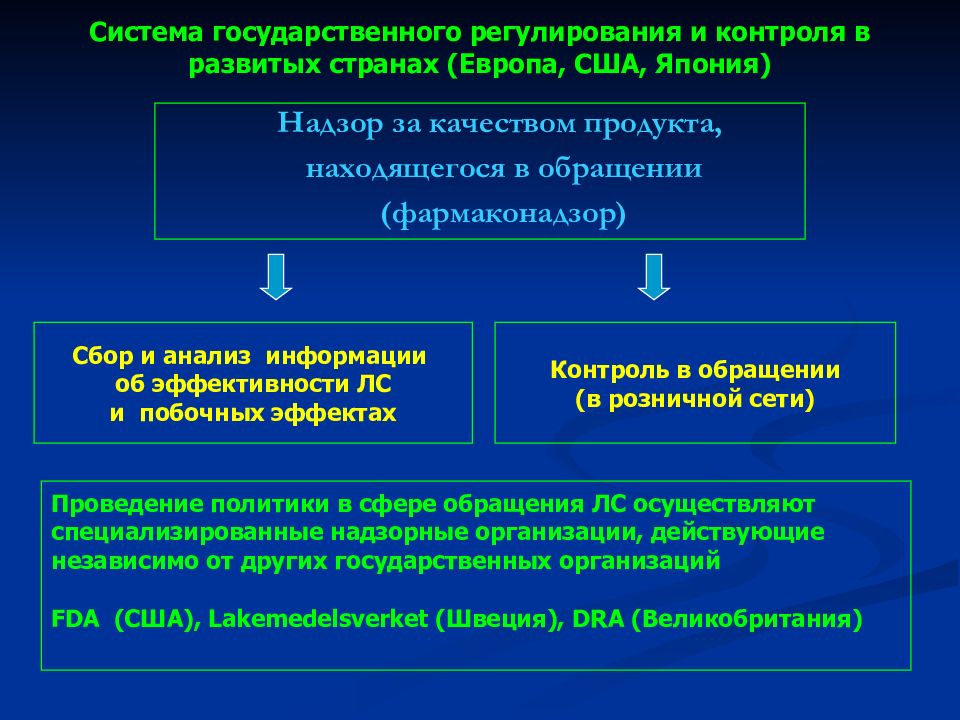
Слайд 18: Система государственного регулирования и контроля в развитых странах (Европа, США, Япония)
Надзор за качеством продукта, находящегося в обращении (фармаконадзор) Сбор и анализ информации об эффективности ЛС и побочных эффектах Контроль в обращении (в розничной сети) Проведение политики в сфере обращения ЛС осуществляют специализированные надзорные организации, действующие независимо от других государственных организаций FDA ( США), Lakemedelsverket (Швеция), DRA (Великобритания)
Слайд 19
Росздравнадзор осуществляет государственный контроль за производством, изготовлением, качеством, эффективностью, безопасностью, оборотом и порядком использования ЛС на территории Российской Федерации Органы государственного контроля качества ЛС в Российской Федераци Средствами контроля и надзора обеспечить предоставление населению эффективных и безопасных лекарственных средств Цель
Слайд 20
Закон «Об обращении лекарственных средств» ст 52. Осуществление фармацевтической деятельности Физические лица могут заниматься определенными видами фармацевтической деятельности при наличии высшего фармацевтического образования или среднего фармацевтического образования и сертификата специалиста Номенклатура специальностей специалистов с высшим послевузовским фармацевтическим образованием Специальность, полученная в ВУЗе Основная специальность Фармация Управление и экономика фармации Фармацевтическая технология Фармацевтическая химия и фармакогнозия
Слайд 21
Перечень соответствия врачебных и провизорских специальностей должностям специалистов Наименование провизорской должности Наименование провизорской специальности Заведующий - провизор Управление и экономика фармации Провизор - технолог Фармацевтическая технология Провизор – аналитик Фармацевтическая химия и фармакогнозия
Слайд 22: Утвержден приказом Министерства здравоохранения и социального развития Российской Федерации от 30.10.2006 г. № 734 АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ ФЕДЕРАЛЬНОЙ СЛУЖБЫ ПО НАДЗОРУ В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ ПО ИСПОЛНЕНИЮ ГОСУДАРСТВЕННОЙ ФУНКЦИИ ПО ОРГАНИЗАЦИИ ПРОВЕДЕНИЯ ЭКСПЕРТИЗЫ КАЧЕСТВА, ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Организация экспертизы качества ЛС в рамках государственного контроля
Слайд 23: Административный регламент
Административный регламент – нормативный правовой акт, определяющий требования к осуществлению административного процесса в рамках одного полномочия органа государственной власти Административная процедура – последовательность действий при исполнении государственной функции Организация проведения экспертизы качества, эффективности и безопасности ЛС - функция Росздравнадзора
Слайд 24: Административный регламент
Предварительный государственный контроль ЛС Выборочный государственный контроль ЛС Повторный выборочный государственный контроль ЛС Сбор и анализ информации о качестве ЛС Организация проведения экспертизы качества, эффективности и безопасности ЛС административные процедуры: Организация экспертизы при регистрации ЛС Сбор и анализ информации о побочных эффектах применения ЛС
Слайд 25: Предварительный государственный контроль
Впервые производимые и впервые ввозимые на территорию РФ Выпускаемые по измененной технологии 3. Выпускаемые после перерыва производства от трех лет и более 4. В связи с ухудшением качества
Слайд 26
«Осуществление сбора и анализа информации о качестве ЛС» План выборочного контроля Источники информации о качестве ЛС : перечни серий ЛС, выпущенных в обращение производителями или импортерами, результаты предварительного государственного контроля - результаты выборочного государственного контроля; информация о качестве ЛС, полученная в ходе сбора и анализа информации о побочных эффектах ЛС; информация о качестве ЛС, полученная в ходе работы с обращениями частных лиц, предпринимательских, государственных и общественных организаций.
Слайд 27
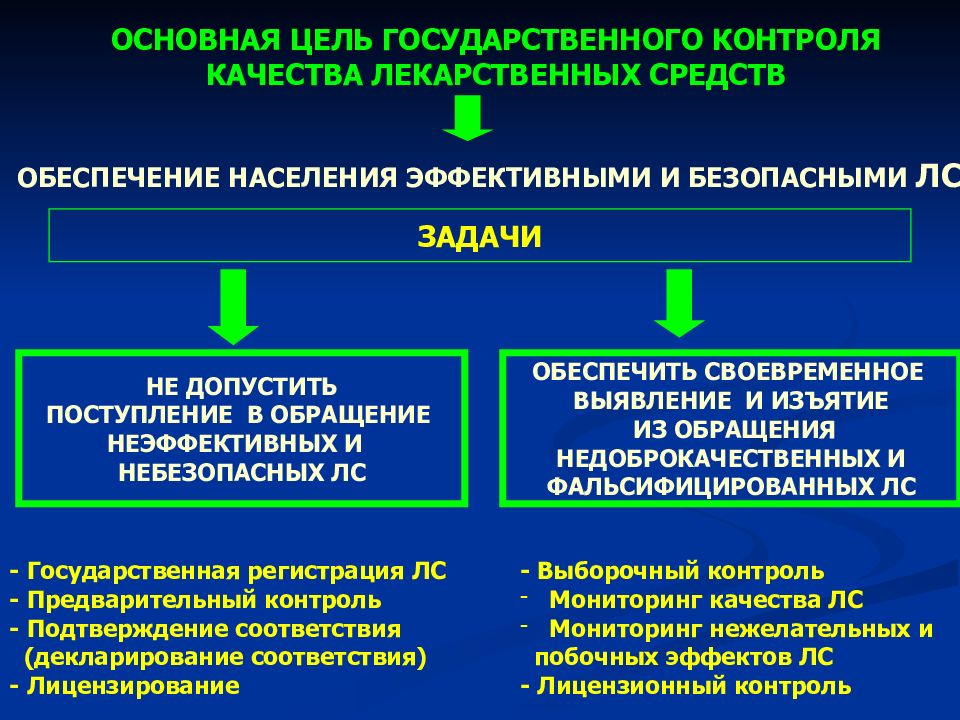
ОСНОВНАЯ ЦЕЛЬ ГОСУДАРСТВЕННОГО КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ НЕ ДОПУСТИТЬ ПОСТУПЛЕНИЕ В ОБРАЩЕНИЕ НЕЭФФЕКТИВНЫХ И НЕБЕЗОПАСНЫХ ЛС ОБЕСПЕЧИТЬ СВОЕВРЕМЕННОЕ ВЫЯВЛЕНИЕ И ИЗЪЯТИЕ ИЗ ОБРАЩЕНИЯ НЕДОБРОКАЧЕСТВЕННЫХ И ФАЛЬСИФИЦИРОВАННЫХ ЛС ОБЕСПЕЧЕНИЕ НАСЕЛЕНИЯ ЭФФЕКТИВНЫМИ И БЕЗОПАСНЫМИ ЛС ЗАДАЧИ - Государственная регистрация ЛС - Предварительный контроль - Подтверждение соответствия (декларирование соответствия) - Лицензирование - Выборочный контроль Мониторинг качества ЛС Мониторинг нежелательных и побочных эффектов ЛС - Лицензионный контроль
Слайд 28: Принципы эффективного функционирования системы государственного контроля качества ЛС
Четкое разделение функций и полномочий участников системы Научный и системный подход к организации работы Транспарентность (доступность информации, открытость и прозрачность процедур, гласность результатов экспертизы) Независимость и объективность экспертных организаций
Слайд 29: Условия эффективного функционирования системы
Наличие нормативной правовой базы, обеспечивающей функционирование системы Компетентность и высокий профессиональный уровень участников системы Техническая оснащенность экспертных организаций Достаточный уровень материальных и кадровых ресурсов Оперативность обмена информацией между участниками системы
Слайд 30
РЕШЕНИЯ РОСЗДРАВНАДЗОРА 1. Изъятие из обращения всей серии ЛП в случае выявления несоответствия качества ЛС по критическим показателям и выявления брака в других территориях 2. Изъятие из обращения конкретной партии лекарственных препаратов
Слайд 31
КРИТЕРИИ НЕСООТВЕТСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ Критические: влияют на качество ЛС и представляют реальную угрозу здоровью и жизни потребителя Подлинность Количественное содержание Токсичность Пирогенность Стерильность Микробиологическая чистота Бактериальные эндотоксины и др. Некритические : «не влияют на качество ЛС» Упаковка Маркировка и др.
Слайд 32: Постановление Правительства «Об утверждении Положения о лицензировании фармацевтической деятельности»
Несоблюдение требований о запрещении продажи: - ЛС, пришедших в негодность; - ЛС с истекшим сроком годности; - фальсифицированных ЛС; - ЛС, являющихся незаконными копиями ЛС, зарегистрированных в РФ; -требований об уничтожении таких ЛС является грубым нарушением лицензионных требований и условий при осуществлении фармацевтической деятельности
Слайд 33: Проект закона об ответственности за оборот поддельных, некачественных и контрафактных лекарств
- поправки в УК, КоАП, ФЗ-323 «Об основах охраны здоровья граждан РФ»; - наказание в виде лишения свободы от 3 до 5 лет; - группа лиц, извлечение дохода, причинение вреда здоровью – лишение свободы от 5 до 8 лет плюс штраф до 500 тыс. руб.; - Конвенция Совета Европы «Медиким», подписана в октябре 2011 года, не ратифицирована – предписывает на территории страны уголовную ответственность
Слайд 34: Ответственность за оборот фальсифицированных лекарственных препаратов в РФ
- Статья 159 УК РФ (мошенничество) – завладение чужим и денежными средствами обманным путем; - Статья 238 УК РФ – привлечение к ответственности за нарушение требований безопасности для жизни и здоровья потребителей;
Слайд 35: Ответственность за оборот фальсифицированных лекарственных препаратов в других странах
- США – штраф до 200 млрд. дол., лишение свободы до 20 лет; - Франция – штраф 400 тыс. евро, лишение свободы на 4 года; - Китай – расстрел;
Слайд 36
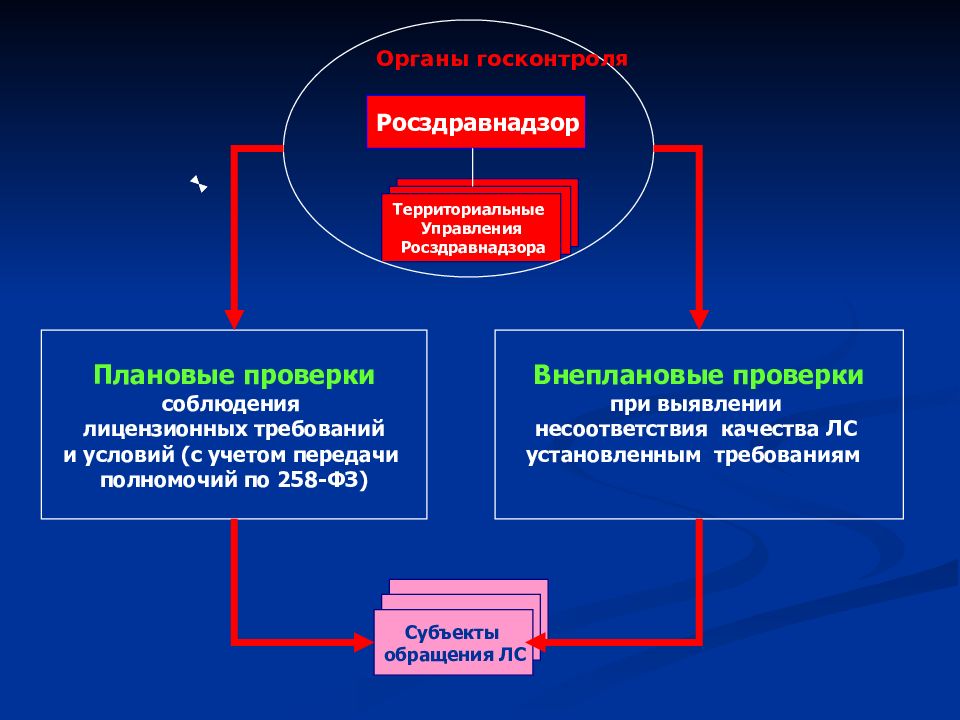
Росздравнадзор Территориальные Управления Росздравнадзора Субъекты обращения ЛС Органы госконтроля Плановые проверки соблюдения лицензионных требований и условий (с учетом передачи полномочий по 258-ФЗ) Внеплановые проверки при выявлении несоответствия качества ЛС установленным требованиям
Слайд 37: Проблемы обеспечения качества ЛС при хранении
Отсутствие и(или) нарушение условий для хранения ЛС в соответствии с требованиями государственных стандартов качества ЛС и отраслевыми стандартами: Использование бытового холодильного оборудования и систем кондиционирования воздуха, не обеспечивающих требуемый режим хранения; Отсутствие контроля за температурным режимом и влажностью
Слайд 38: Проблемы обеспечения качества при изготовлении ЛС
Отсутствие Единых правил изготовления ЛС лекарственных средств, утвержденных в установленном законодательством порядке Нарушение действующих нормативных правовых документов, определяющих требования к изготовлению ЛС в аптечных учреждениях
Слайд 39: Стандартизация в области качества ЛС и методов контроля
стандартизация - деятельность по установлению правил и характеристик в целях их многократного использования, направленная на достижение упорядоченности в сферах производства и обращения продукции Федеральный закон «Об обращении лекарственных средств»: качество ЛС - соответствие ЛС требованиям ФС либо в случае ее отсутствия нормативной документации или нормативного документа фармакопейная статья – документ, содержащий перечень показателей и методов контроля качества ЛС; государственная фармакопея - сборник фармакопейных статей
Слайд 40: ПРИКАЗ Минздрава России от 01.11.2001 № 388 О государственных стандартах качества лекарственных средств
ОТРАСЛЕВОЙ СТАНДАРТ. СТАНДАРТЫ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ. ОСНОВНЫЕ ПОЛОЖЕНИЯ ОСТ 91500.05.001.00 3.1. Государственные стандарты качества ЛС разрабатываются и утверждаются в следующих видах: - общая фармакопейная статья (ОФС); - фармакопейная статья (ФС); - фармакопейная статья на ЛС конкретного предприятия-производителя ЛС (ФСП). ОСТ не распространяется: - на кровь и ее компоненты; - на сырье животного происхождения, подлежащее дальнейшей промышленной переработке для приготовления ЛС; - на ЛС зарубежного производства; - на ЛС, изготавливаемые в аптечных учреждениях.
Слайд 41: ПРИКАЗ Минздрава России от 01.11.2001 № 388 «О государственных стандартах качества лекарственных средств»
ОФС и ФС составляют Государственную фармакопею. Государственная фармакопея подлежит переизданию каждые 5 лет Требования к качеству ЛС, содержащиеся в ФСП, должны быть не ниже требований, изложенных в Государственной фармакопее
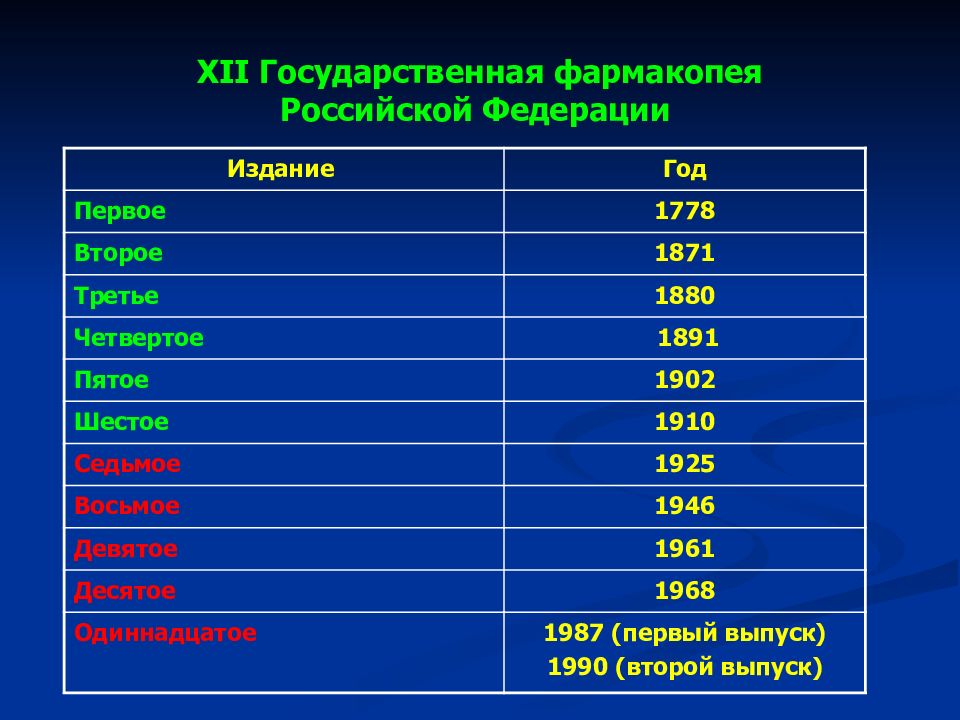
Слайд 42: XII Государственная фармакопея Российской Федерации
Издание Год Первое 1778 Второе 1871 Третье 1880 Четвертое 1891 Пятое 1902 Шестое 1910 Седьмое 1925 Восьмое 1946 Девятое 1961 Десятое 1968 Одиннадцатое 1987 (первый выпуск) 1990 (второй выпуск)
Слайд 44: XII Государственная фармакопея Российской Федерации
ГФ – сборник основных стандартов, применяемых в фармакопейном анализе и производстве ЛС Основу ГФ составляют ОФС и ФС ОФС – описывает общие положения, методы анализа и включает в себя перечень нормируемых показателей и методов испытаний определенной лекарственной формы ФС – определяет уровень требований к конкретным ЛС ГФ XII будет включать пять частей: первая часть: - общие положения; - методы анализа; - требования к субстанциям; - ФС на субстанции
Слайд 45: XII Государственная фармакопея (продолжение)
Последующие части: - физические, физико-химические и химические методы (продолжение); - «Статистическая обработка результатов химического эксперимента и биологического исследования»; - «Валидация аналитических методик»; - описание общих требований к лекарственным формам; - методы анализа лекарственного растительного сырья и препаратов на его основе; - стандарты качества на гомеопатические лекарственные препараты
Слайд 46: XII Государственная фармакопея 1 часть
45 ОФС новые: «Оборудование», «Осмолярность», «Ионометрия», «Остаточные органические растворители», «Бактериальные эндотоксины», «Определение эффективности антимикробных консервантов лекарственных средств», «Радиофармацевтические препараты», «Фармацевтические субстанции», «Сроки годности лекарственных средств» 77 ФС на фармацевтические субстанции
Слайд 47
ОСТ 91500.05.0002-2001 «Информационный стандарт лекарственного средства. Основные положения» ГИСЛС является официальным первоисточником информации о ЛС - совокупность нормативных документов, содержащих официальную информацию о ЛС, разрешенном к медицинскому применению Иные источники информации о лекарственном средстве должны соответствовать данным, содержащимся в ГИСЛС Информация о лекарственном средстве осуществляется в соответствии с требованиями ГИСЛС Общие требования
Слайд 48: Типоваые клинико-фармакологические статьи (более 3 тыс. на сегодняшний день)
Слайд 49: Типовая клинико – фармакологическая статья
ТКФС – официальный документ, содержащий сведения об основных свойствах ЛС или часто используемых (стандартных) его комбинаций, определяющих эффективность и безопасность ЛС
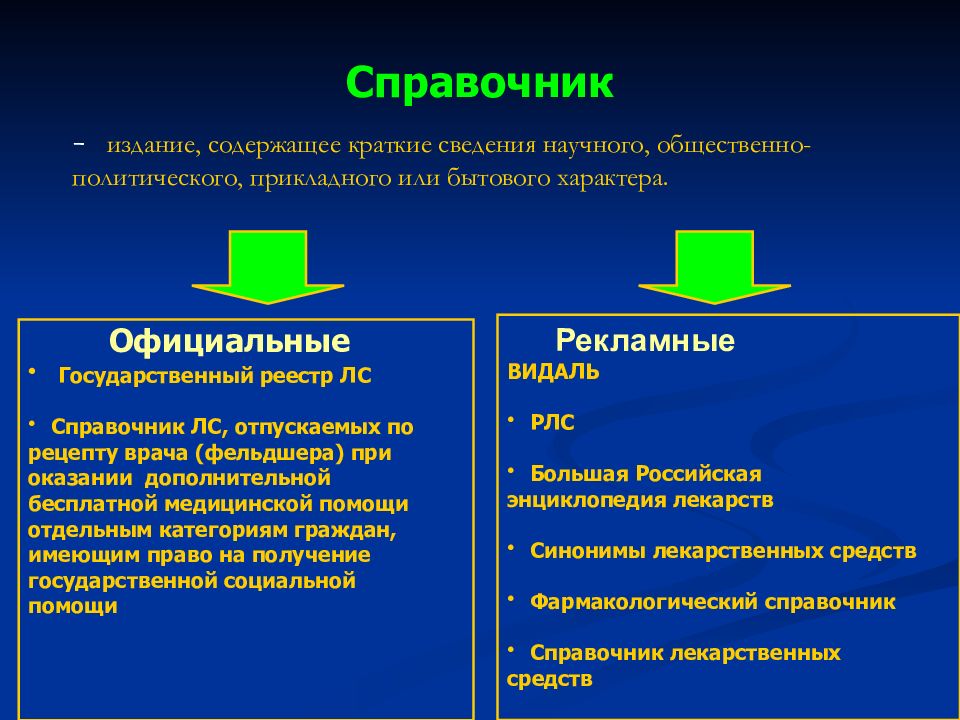
Слайд 50: Справочник
- издание, содержащее краткие сведения научного, общественно-политического, прикладного или бытового характера. Официальные Государственный реестр ЛС Справочник ЛС, отпускаемых по рецепту врача (фельдшера) при оказании дополнительной бесплатной медицинской помощи отдельным категориям граждан, имеющим право на получение государственной социальной помощи Рекламные ВИДАЛЬ РЛС Большая Российская энциклопедия лекарств Синонимы лекарственных средств Фармакологический справочник Справочник лекарственных средств
Слайд 51: Сравнение содержания раздела побочные эффекты статьи на ацетилсалициловую кислоту в справочнике ВИДАЛЬ и Государственном реестре
Государственный реестр ВИДАЛЬ Тошнота, снижение аппетита, гастралгия, диарея, аллергические реакции (кожная сыпь, ангионевротический отек, бронхоспазм), нарушение функции печени, нарушение функции почек, тромбоцитопения, анемия. При длительном применении – головокружение, головная боль, рвота, эрозивно-язвенные поражения ЖКТ, гипокоагуляция, кровотечения, нарушения зрения, шум в ушах лейкопения, синдром Рейе, «аспириновая» астма, снижение остроты слуха, папиллярный некроз, асептический менингит, усиление симптомов ХСН, отеки ?
Слайд 52: Приказ Минздрава России от 15.12.2002 № 382 « Об утверждении инструкции о порядке уничтожения лекарственных средств»
2. ЛС, пришедшие в негодность, и ЛС с истекшим сроком годности подлежат изъятию из обращения и последующему уничтожению в полном объеме. Продажа указанных ЛС запрещается. 3. Подлежат уничтожению ЛС, являющиеся подделками или незаконными копиями зарегистрированных в РФ ЛС, обнаруженные и конфискованные таможенными органами РФ при ввозе их на территорию РФ 4. Указанные в пунктах 2 и 3 ЛС конфисковываются и изымаются из обращения таможенными органами РФ, юридическими лицами и индивидуальными предпринимателями, которые являются собственниками или владельцами этих ЛС, и в установленном порядке направляются на предприятия, имеющие право на уничтожение ЛС
Слайд 53: Система качества лекарственных средств
Система качества лекарственных средств – совокупность - организационной структуры; - ресурсов (административных, финансовых, кадровых и пр.) - комплекса мер по обеспечению эффективности и безопасности ЛС и их соответствия установленным требованиям по показателям качества