Слайд 2: План:
1. Понятие «Формальдегид» 2. Его физические свойства, химические свойства. (реакции) 3. Получение в промышленности 4. Александр Михайлович Бутлеров 5. Получение в лаборатории 6. Экономические аспекты 7. Литература.
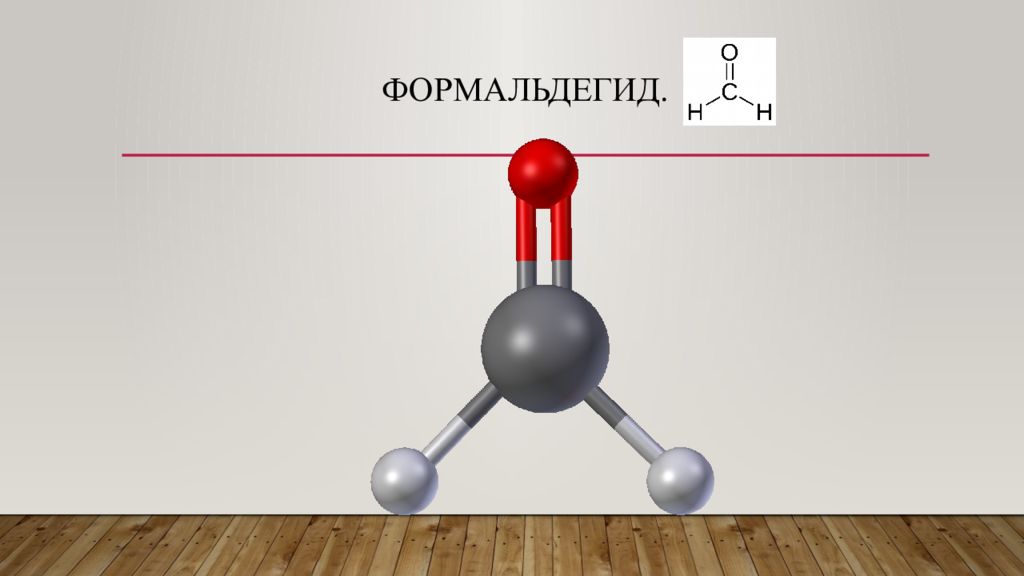
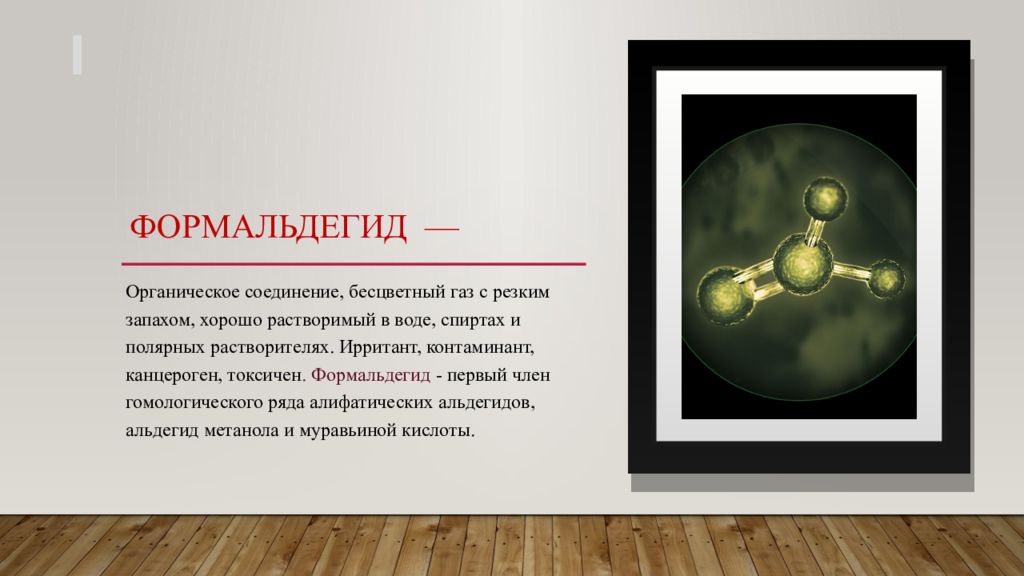
Слайд 3: Формальдегид —
Органическое соединение, бесцветный газ с резким запахом, хорошо растворимый в воде, спиртах и полярных растворителях. Ирритант, контаминант, канцероген, токсичен. Формальдегид - первый член гомологического ряда алифатических альдегидов, альдегид метанола и муравьиной кислоты. 1
Слайд 4
ВЕЛИЧИНА ЗНАЧЕНИЕ Ст. энергия Гиббса образования ΔG − 110 кДж/моль (г) Ст. энтропия образования S 218,66 Дж/ моль·K (г) Ст. мольная теплоёмкость Cp 35,35 Дж/ моль·K (г) Энтальпия кипения Δ H кип 23,3 кДж/моль Формальдегид является бесцветным газом с резким запахом. Даже в низких концентрациях он раздражает кожу, глаза и носоглотку и обнаруживается по запаху в количестве 0,05-1 м. д. Сжижается формальдегид при −19,2 °С, превращаясь в жидкость с плотностью 0,8153 г/см³. Ниже −118 °С формальдегид превращается в белую пасту. Жидкий и газообразный формальдегид при температурах до 80 °С активно полимеризуется, однако между 80 и 100 °С газообразный формальдегид устойчив. 2 Физические свойства Формальдегида.
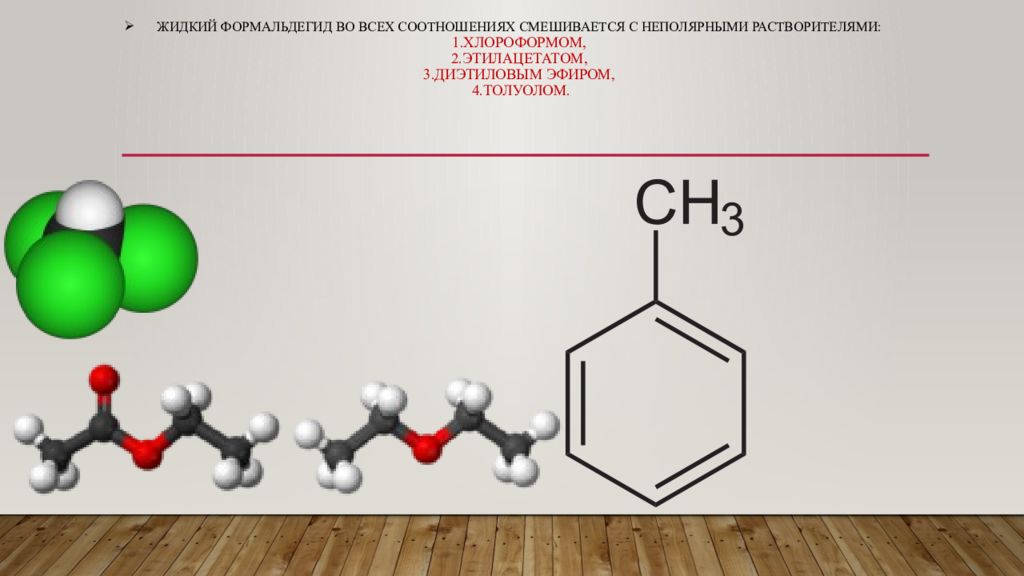
Слайд 5: Жидкий формальдегид во всех соотношениях смешивается с неполярными растворителями: 1.хлороформом, 2.этилацетатом, 3.диэтиловым эфиром, 4.толуолом
Слайд 6
Формальдегид вступает в типичные для альдегидов реакции нуклеофильного присоединения. При присоединении спиртов он образует ацетали, с сероводородом он даёт тритиан, а с HCN в присутствии щёлочи — циангидрин. С гидросульфитом натрия он даёт бисульфитное производное. Химические свойства. (реакции) Реакции присоединения Реакции конденсации Формальдегид вступает в альдольную конденсацию и аналогичные превращения. В присутствии концентрированной щёлочи он даёт реакцию Канниццаро, превращаясь в метанол и соль муравьиной кислоты, а с другими альдегидами — перекрёстную реакцию Канниццаро, выступая как восстановитель и превращаясь в соль муравьиной кислоты. С ацетальдегидом в присутствии гидроксида кальция он образует пентаэритрит, а в газовой фазе при 285 °С — акролеин. Также формальдегид вступает в реакцию Тищенко с образованием метилформиата.
Слайд 7
Реакции полимеризации Безводный формальдегид легко подвергается полимеризации, поэтому коммерчески он недоступен. Полимеризация катализируется полярными примесями: кислотами, щелочами, водой и др. В водных растворах формальдегид также склонен к полимеризации, поэтому в коммерческие партии добавляют метанол и другие стабилизаторы. При упаривании водных растворов образуется параформ. Окисление и восстановление Формальдегид восстанавливается водородом до метанола в присутствии никеля, платины, меди и других катализаторов. До муравьиной кислоты либо CO 2 и воды его окисляют перманганатом калия, дихроматом калия и азотной кислотой. Также он взаимодействует с солями многих металлов (серебра, платины, золота, висмута и др.), осаждая металлы из растворов и окисляясь при этом до муравьиной кислоты. При нагревании до 150 °С формальдегид разлагается до метанола и углекислого газа, а выше 350 °С — до CO и водорода.
Слайд 8
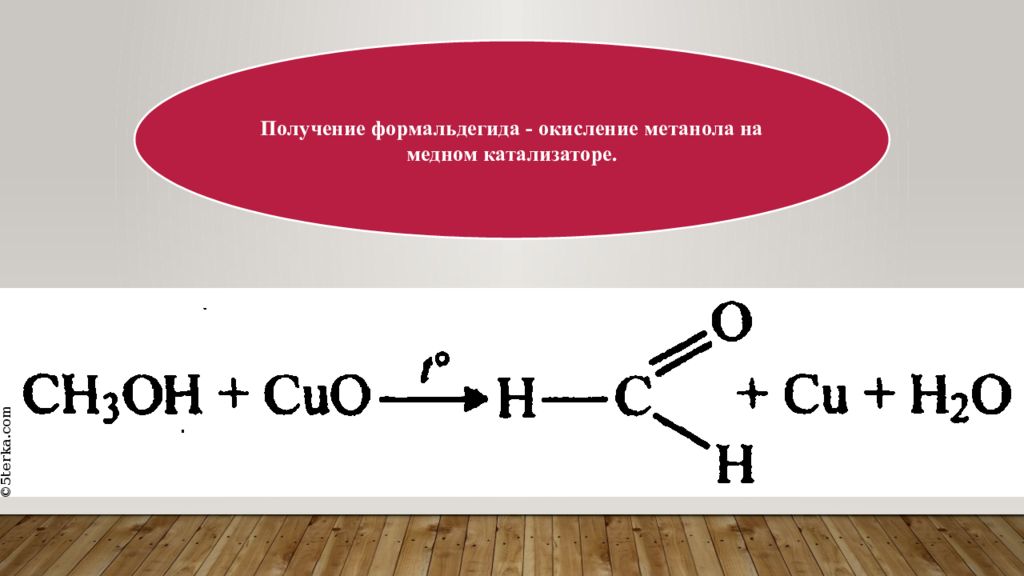
3 Формальдегид в промышленности получают из метанола тремя способами: 1. частичным окислением и дегидрированием под действием воздуха в присутствии кристаллов серебра, водяного пара и избытка метанола при 650—720 °С (BASF); 2. частичным окислением и дегидрированием под действием воздуха в присутствии кристаллического серебра или серебряной сетки, водяного пара и избытка метанола при 600—650 °С; 3. окислением избытком воздуха в присутствии катализатора на основе оксидов железа, молибдена и ванадия при 250—400 °С ( Формокс -процесс) Получение формальдегида в промышленности.
Слайд 9: Впервые формальдегид был синтезирован в 1859 году А. М. Бутлеровым. В 1867 году Гофман также синтезировал формальдегид, пропуская пары метанола и воздух над нагретой платиновой спиралью, и идентифицировал полученный продукт. В 1882 году Кекуле описал метод синтеза чистого формальдегида
4
Слайд 10
Алекса́ндр Миха́йлович Бу́тлеров (3 сентября [15 сентября] 1828, Чистополь — 5 августа [17 августа] 1886, деревня Бутлеровка, ныне Алексеевский район Татарстана) — русский химик, создатель теории химического строения органических веществ, родоначальник « бутлеровской школы» [5] русских химиков, учёный-пчеловод и лепидоптеролог, общественный деятель, ректор Императорского Казанского университета в 1860—1863 годах.
Слайд 11
5 Для получения формальдегида в лабораторных условиях метанол дегидрируют над медью, разлагают формиат цинка либо деполимеризуют параформ Получение формальдегида в лаборатории.
Слайд 13
Формальдегид является одним из наиболее ценных продуктов промышленности и используется в производстве тысяч других промышленных и потребительских продуктов. По экономическим причинам его редко можно заменить некими аналогами, а его токсичность была исследована даже лучше, чем токсичность этих аналогов. В 2011 году мировое производство формальдегида составило 18 млн тонн в год (рассчитано на 100%- ый формальдегид). 6
Последний слайд презентации: Формальдегид: Литература:
Розанов В. Н. Формальдегид // Химическая энциклопедия : в 5 т. / Н. С. Зефиров (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан— Ятрохимия. — С. 115–116. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9. Franz A. W., Kronemayer H., Pfeiffer D., Pilz R. D., Reuss G., Disteldorf W., Gamer A. O., Hilt A. Formaldehyde (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2016. — doi : 10.1002/14356007.a11_619.pub Алексеев П. Александр Михайлович Бутлеров (некролог) (рус.) // В.О.Ф.Э.М.. — 1886. — № 2. — С. 39—42. А. М. Бутлеров. 1828—1928: Сборник статей. — Л., 1929. А. М. Бутлеров. Избранные работы по органической химии. — М., Изд -во АН СССР, 1951. 7