Первый слайд презентации: Фосфатное сырьё и виды фосфорных удобрений
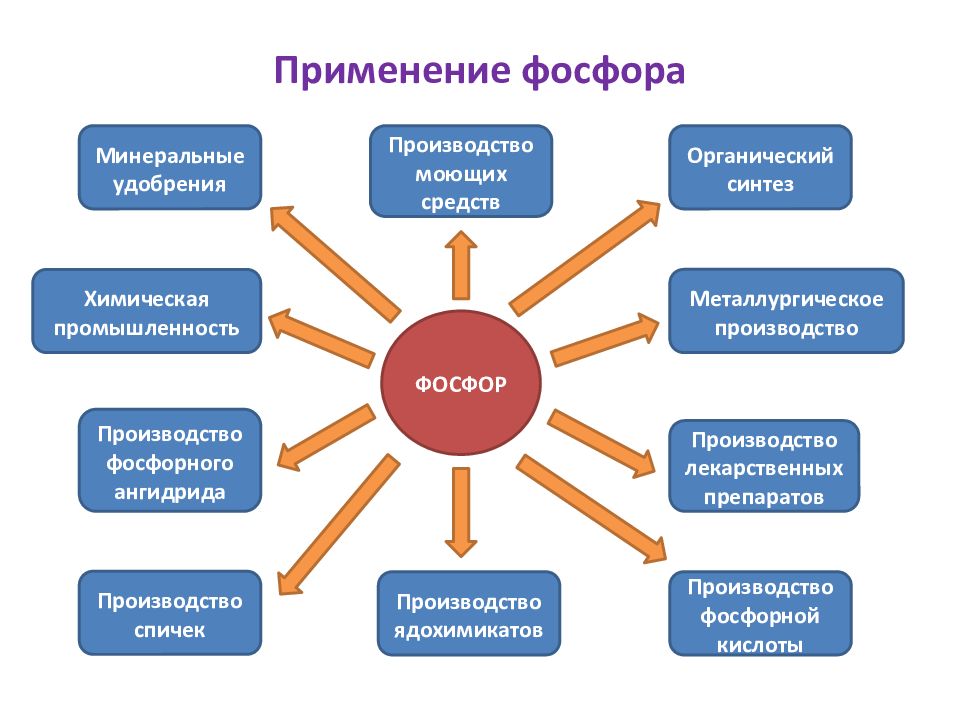
Слайд 2: Применение фосфора
ФОСФОР Органический синтез Металлургическое производство Производство лекарственных препаратов Производство ядохимикатов Производство спичек Производство фосфорного ангидрида Производство фосфорной кислоты Химическая промышленность Производство моющих средств Минеральные удобрения
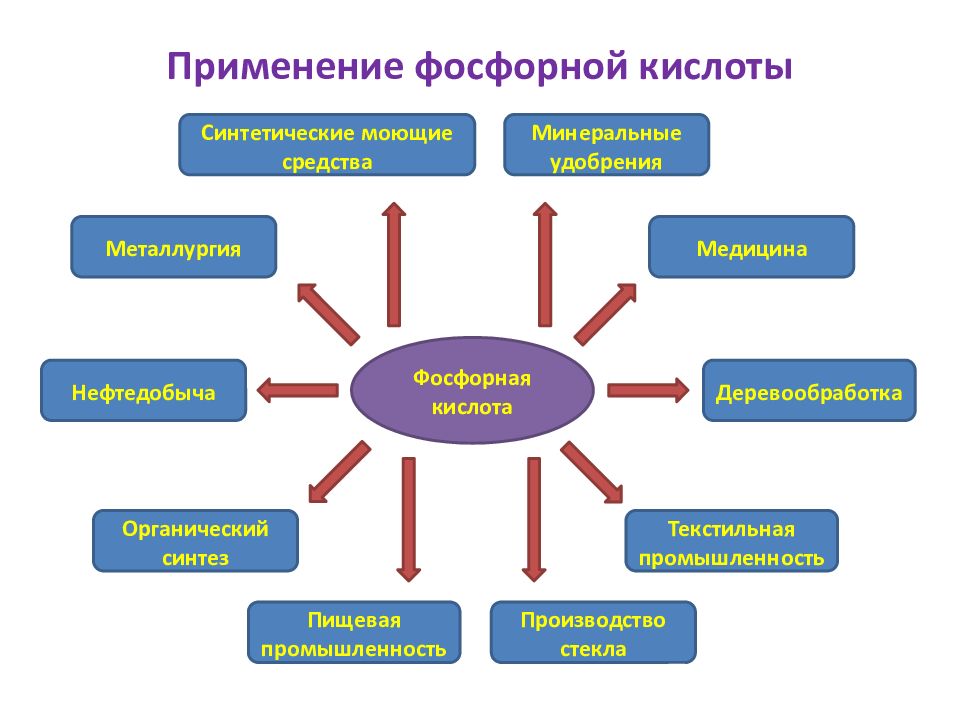
Слайд 3: Применение фосфорной кислоты
Фосфорная кислота Деревообработка Производство стекла Медицина Текстильная промышленность Пищевая промышленность Органический синтез Металлургия Нефтедобыча Минеральные удобрения Синтетические моющие средства
Слайд 4: Виды фосфорных удобрений
Основные однокомпонентные фосфорные удобрения – простой и двойной суперфосфаты; их главной составной частью является одновод -ный монокальцийфосфат. В простом суперфосфате доля связанного в монокальцийфосфат фос -фора достигает 60 –75 % (от общего количества), в двойном суперфос -фате – 75 – 85 %. Качество суперфосфата оценивается по содержанию в нем фосфатных соединений, которые могут переходить в почвенные растворы, т.е. по сумме водо - и цитратно-растворимого Р 2 О 5. При добавке к суперфосфату молотого известняка, мела, доломита, или фосфоритной муки получают нейтрализованный суперфосфат. При нейтрализации свободной кислотности суперфосфата аммиаком получают аммонизированный суперфосфат, негигроскопичный и содер-жащий помимо усвояемой Р 2 О 5 (15 %), еще один питатаельный элемент – азот (1,5 – 2,0 %).
Слайд 5: Виды фосфорных удобрений
Значительно более концентрированным фосфорным удобрением яв-ляется двойной суперфосфат, содержащий 42 – 50 % Р 2 О 5 усв. и выпус-каемый в РФ только в гранулированном виде. Выпускают также обогащенный суперфосфат, имеющий промежу -точный состав между простым и двойным. В качестве удобрений, наряду с водорастворимыми, применяют и водонерастворимые фосфаты – фосфоритную муку (размолотые природ- ные руды), фосфатные металлургические шлаки, плавленые магнезиаль-ные фосфаты, термофосфаты и обесфторенные фосфаты. В меньших масштабах, чем удобрения, выпускают кормовые фосфаты кальция – монокальций фосфат, дикальцийфосфат (преципитат), трикаль-цийфосфат, используемые в качестве минеральной добавки в корма сельскохозяйственных животных.
Слайд 6: Фосфатное сырьё
Исходным сырьем для производства соединений фосфора являются природные фосфатные руды – апатиты (магматического происхождения) и фосфориты (осадочного происхождения). Мировые запасы фосфатных руд представлены преимущественно фосфоритами, количество апатита не превышает 6 % достоверных запа -сов, а его доля составляет около 15 %. Известно 187 природных фосфорсодержащих минералов, но только минералы апатитовой группы, образующие достаточно мощные место-рождения, входят в состав агрономических руд, т.е. руд, используемых для получения удобрений.
Слайд 7: Фосфатное сырьё
Основными минералами являются: фторапатит Са 10 (РО 4 ) 6 F 2 гидроксилапатит Са 10 (РО 4 ) 6 (ОН) 2 хлорапатит Са 10 (РО 4 ) 6 Сl 2 карбонатапатит Са 10 Р 5 СО 23 (ОН) 3 фторкарбонатапатит Са 10 Р 5 СО 23 (F, ОН) 3. Апатиты в небольших количествах входят в состав многих изверженных горных пород, но промышленно ценные, концентрированные месторождения встречаются редко. В настоящее время эксплуатируются месторождения комплексных апатит-содержащих руд – апатито -нефелиновых, апатито -магнетитовых. Крупнейшее в мире месторождение апатита в виде апатито -нефелиновых руд находится в Хибинской тундре на Кольском полуострове.
Слайд 8: Фосфатное сырьё
Фосфоритами называют породы осадочного происхождения, образо-вавшиеся в результате осаждения фосфатов кальция из морской воды и содержащие помимо фосфатов кальция, зерна кварца SiО 2, кальцита СаСО 3, доломита СаСО 3 ×МgСО 3 и др. соединения. Фосфат кальция входит в фосфориты обычно в форме очень мелких зерен фторапатита. Большое содержание оксидов железа и алюминия затрудняет перера-ботку фосфоритов на удобрения и ухудшает качество последних. На территории РФ имеются следующие месторождения фосфоритов: Кингиссепское, Егорьевское, Вятско -Камское.
Наиболее распространенным приемом является разложение фосфатов кислотами – серной, азотной и фосфорной. Для кислотного разложения пригодны природные фосфаты, не содержащие значительных количеств карбоната кальция, карбоната и силиката магния, соединений железа и алюминия. Все эти примеси затрудняют переработку фосфатов и ухудшают качество удобрений. Другим приемом является восстановление фосфатов углеродом в при- сутствии диоксида кремния с извлечением элементарного фосфора и его последующей переработкой в фосфорную кислоту и ее соли. Этот способ позволяет перерабатывать менее качественное сырье. Третий путь – термическая обработка фосфатов, например, щелочное разложение при сплавлении и спекании с солями щелочных и щелочно-земельных металлов, гидротермическая переработка в присутствии водя- ного пара.
Предложены методы химического обогащения фосфатных руд. Карбо- наты кальция и магния можно удалить, обрабатывая руду слабокислыми концентрированными растворами некоторых солей, например, азотно-кислым раствором нитрата аммония или сернокислым раствором суль -фата аммония. В таких растворах, при рН = 2 - 4,5, скорость разложения карбонатов значительно больше, чем фосфатов. Можно подобрать усло -вия, при которых фосфат кальция практически почти не разрушается.
Слайд 12: Получение фосфоритной муки измельчением природных фосфатов – самый простой способ их переработки
Фосфоритная мука является наиболее дешевым, но сравнительно мало эффективным удобрением, т.к. Р 2 О 5 содержится в ней в виде трикальций -фосфата, т.е. в форме трудно извлекаемой растениями. Тонкоизмельченные фосфориты успешно применяют на кислых почвах в качестве медленно действующего удобрения. Фосфоритную муку применяют также как нейтрализующую добавку к суперфосфату. Поэтому для ее производства пригодны только те природные фосфаты, которые способны растворяться в кислых почвенных растворах и в слабой фосфорной кислоте.
Слайд 13
Выпускают четыре сорта фосфоритной муки: высший (флотационный концентрат) с содержанием в сухом веществе больше 30 % Р 2 О 5, 1 сорт – 25 % Р 2 О 5, 2 сорт – 22 % Р 2 О 5, 3 сорт – 19 % Р 2 О 5. Производство фосфоритной муки из природного фосфорита без его обогащения сводится к предварительному крупному дроблению на мо -лотковых или щековых дробилках, сушке фосфорита во вращающихся ба- рабанных сушилках дымовыми газами для понижения влажности мате-риала от 10 – 15 до 2 %, последующему среднему дроблению и мелкому помолу. Отделение размолотого материала от более крупных частиц, возвра-щаемых на помол, производится с помощью воздушного сепаратора.
Слайд 15: Характеристика простого суперфосфата
Простой суперфосфат – наиболее распространенное фосфорное удобрение. Получают разложением природных фосфатов серной кислотой. Суперфосфат представляет собой порошок или зерна серого цвета. Его глав- ными составными частями являются монокальцийфосфат Са (Н 2 РО 4 ) 2 ×Н 2 О и без-водный сульфат кальция СаSО 4. Он состоит из нескольких твердых фаз и пропитывающих их жидкой фазы. В твердых фазах находятся фосфаты кальция, магния, железа, алюминия, СаSО 4 с примесью СаSО 4 ×0,5Н 2 О, остатки неразложенных минералов, входящих в состав исходного фосфата, кремнегель и другие. Содержание твердых фаз составляет 65 – 72 %, в том числе 50 – 55 % СаSО 4. Жидкая фаза состоит из водного раствора фосфорной кислоты, насыщенного монокальцийфосфатом и содержащего ионы Мg +2, Fе +3, Аl +3, F - и др. Качество суперфосфата оценивают по содержанию в нем усвояемой Р 2 О 5, т.е. суммы водорастворимой Р 2 О 5 (содержащейся в виде свободной фосфорной кис-лоты, монокальций и мономагнийфосфатов ) и цитратнорастворимой Р 2 О 5 (в фор- ме дикальций и димагнийфосфатов, фосфатов железа и алюминия). Чем полнее разложение природного фосфата, тем большее количество Р 2 О 5 переходит в усвояемую форму.
Слайд 16: Физико-химические основы процесса
Сущность производства суперфосфата состоит в том, что нерастворимая в воде нейтральная кальциевая соль ортофосфорной кислоты Са 3 (РО 4 ) 2, содержащаяся в природных фосфатах в виде фторапатита Са 5 F(РО 4 ) 3, при взаимодействии с серной кислотой превращается в растворимые кислые соли, преимущественно в монокальций фосфат Са (Н 2 РО 4 ) 2, при этом часть ионов Са +2 связывается с образованием малорастворимого сульфата каль-ция. Присутствующие в природных фосфатах минеральные примеси также реагируют с серной кислотой.
Слайд 17: Физико-химические основы процесса
Разложение фторапатита серной кислотой протекает в две стадии: вначале образуется фосфорная кислота по реакции: 7Са 5 F(РО 4 ) 3 + 35Н 2 SО 4 + 17,5Н 2 О = 21Н 3 РО 4 + 35СаSО 4 ×0,5Н 2 О + 7НF а затем, только после полного израсходования серной кислоты, образовав- шаяся фосфорная кислота взаимодействует с фторапатитом : 3Са 5 F (РО 4 ) 3 + 21Н 3 РО 4 + 15Н 2 О = 15Са(Н 2 РО 4 ) 2 ×Н 2 О + 3НF При стехиометрическом соотношении компонентов в первой стадии процесса серной кислотой разлагается 70% апатита, во второй стадии фос-форной кислотой – остальные 30% апатита.
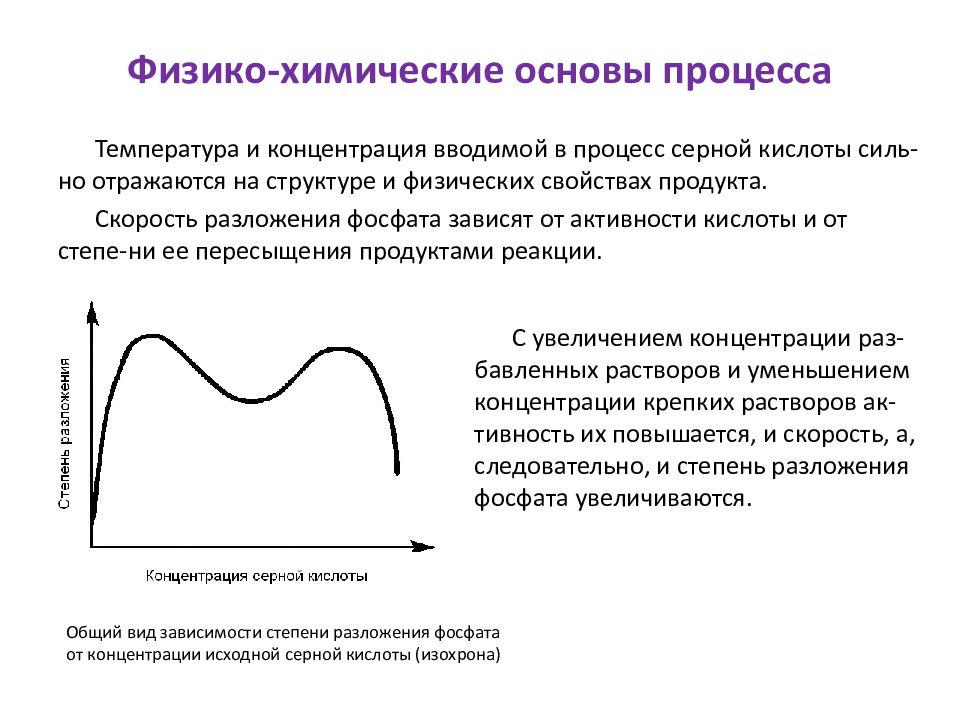
Слайд 18: Физико-химические основы процесса
Температура и концентрация вводимой в процесс серной кислоты силь -но отражаются на структуре и физических свойствах продукта. Скорость разложения фосфата зависят от активности кислоты и от степе-ни ее пересыщения продуктами реакции. Общий вид зависимости степени разложения фосфата от концентрации исходной серной кислоты ( изохрона ) С увеличением концентрации раз- бавленных растворов и уменьшением концентрации крепких растворов ак-тивность их повышается, и скорость, а, следовательно, и степень разложения фосфата увеличиваются.
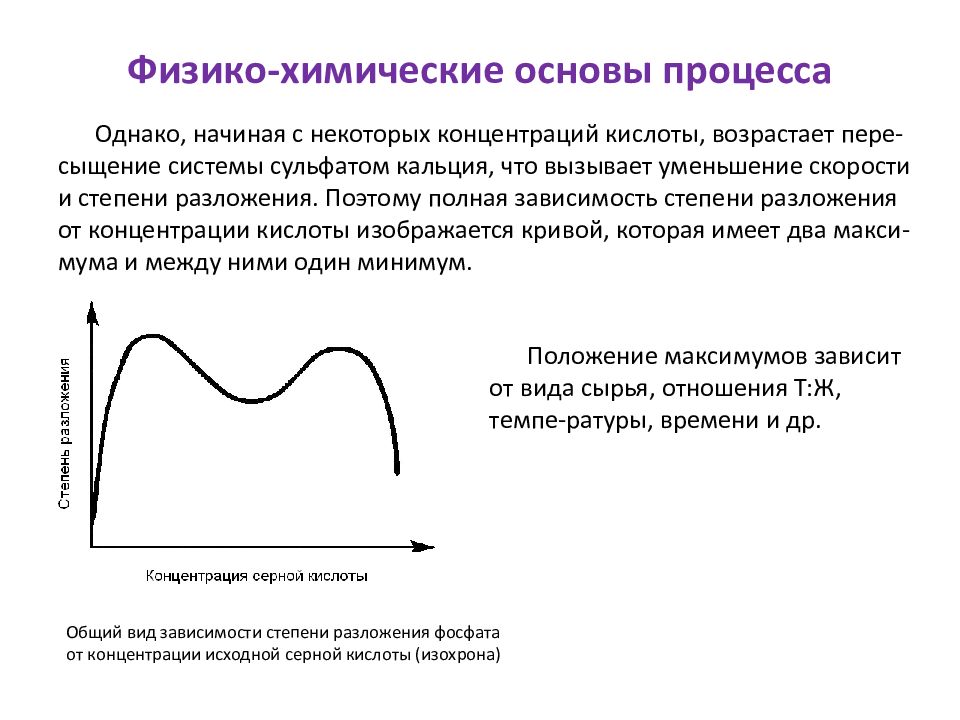
Слайд 19: Физико-химические основы процесса
Однако, начиная с некоторых концентраций кислоты, возрастает пере- сыщение системы сульфатом кальция, что вызывает уменьшение скорости и степени разложения. Поэтому полная зависимость степени разложения от концентрации кислоты изображается кривой, которая имеет два макси- мума и между ними один минимум. Общий вид зависимости степени разложения фосфата от концентрации исходной серной кислоты ( изохрона ) Положение максимумов зависит от вида сырья, отношения Т:Ж, темпе- ратуры, времени и др.
Слайд 20: Физико-химические основы процесса
Основным фактором, определяющим скорость взаимодействия апатита с серной кислотой, является скорость диффузии иона кальция на поверх- ности зерна апатита. Скорость диффузии, а, следовательно, и скорость разложения апатита, будет тем больше, чем выше концентрация ионов кальция в пограничном слое. Так как концентрация ионов кальция в пограничном слое зависит от растворимости кристаллогидратов сульфата кальция, то скорость разло-жения фосфатов будет возрастать в условиях, способствующих увеличению растворимости сульфата кальция.
Слайд 21: Физико-химические основы процесса
Кристаллизация сульфата кальция может тормозить процесс разложения апатита серной кислотой. Мелкие кристаллы отлагаются на поверхности зерен апатита и препят-ствуют проникновению серной кислоты. Чем крупнее кристаллы сульфата кальция, тем более рыхлый проницаемый слой образуется на зернах апа-тита. Мелкие кристаллы выпадают в тех случаях, когда кристаллизация идет с большой скоростью и появляется много центров кристаллизации. Чем выше степень пересыщения раствора, тем больше скорость кристаллизации. При максимальной растворимости сульфата кальция степень пересыщения раствора, а значит и скорость кристаллизации, минимальна. Это приводит к осаждению относительно крупных кристаллов, образующих более рыхлый слой. Экспериментально найдено, что скорость сернокислотного разложения апатита достигает максимума в области концентраций серной кислоты 5-10 % Н 2 SО 4.
Слайд 22: Физико-химические основы процесса
Скорость взаимодействия природных фосфатов с серной кислотой увели- чивается с повышением температуры. При 90 0 С фосфориты разлагаются серной кислотой практически пол-ностью менее чем за 10 мин. Кристаллический апатитовый концентрат разлагается медленнее, но ско-рость процесса также увеличивается с повышением температуры. Разло-жение апатита серной кислотой связано с образованием фосфорной кисло-ты в первой стадии процесса. Присутствие фосфорной кислоты положительно отражается на кинетике процесса, так как она разбавляет серную кислоту, приближая ее концентра- цию к оптимальной. Особенно большой эффект получается при непрерывном введении ре-агентов в смеситель, в котором поддерживается постоянный объем реак-ционной смеси, содержащей в жидкой фазе фосфорную кислоту.
Слайд 23: Физико-химические основы процесса
Степень разложения фосфатов серной кислотой зависит от их измельче-ния. В соответствии со стандартом в апатитовом концентрате, используемом в производстве суперфосфата, содержание частиц размером 160 мкм и бо -лее не должно превышать 11,5 %. О полноте разложения фосфатного сырья судят по коэффициенту раз- ложения – отношению количества усвояемого Р 2 О 5 к общему количеству Р 2 О 5 в суперфосфате. Коэффициент разложения тем больше, чем больше норма серной кисло-ты. При норме 68 – 72 коэффициент разложения в камерном суперфосфате из апатитового концентрата равен 83 – 88 %, и суперфосфат содержит значи -тельное количество свободной фосфорной кислоты (до 12 %). Коэффициент разложения в суперфосфате после складского дозревания достигает 93 – 95 %, причем содержание свободной Р 2 О 5 снижается до 5 %.
Слайд 24: Физико-химические основы процесса
В производстве суперфосфата большое значение имеет концентрация серной кислоты. При концентрации более 63 % Н 2 SО 4 жидкая фаза пересыщается сульфа -том кальция, который выпадает в этих условиях в виде мелких иглообразных кристаллов, покрывающих всю поверхность фосфата и замедляющих его раз- ложение. При концентрации кислоты менее 63 % Н 2 SО 4 раствор пересыщается в меньшей степени, вследствие чего выпадают более крупные кристаллы суль -фата кальция ( 10 – 15 мкм). Чем ниже концентрация серной кислоты, тем крупнее образующиеся кристаллы и выше скорость разложения фосфатов.
Слайд 25: Физико-химические основы процесса
Отношение количества полученного суперфосфата к количеству затра-ченного на его производство фосфата называют выходом суперфосфата. Выход свежеприготовленного суперфосфата из апатита составляет 1,94 – 2,01, из фосфоритов – 1,5 – 1,9. При хранении на складе выход несколько понижается вследствие ис -парения части воды. При длительном хранении суперфосфата, полученного из фосфоритов, возникают условия для ретроградации водорастоворимой Р 2 О 5. Этот процесс протекает особенно заметно, если отношение 100Fе 2 О 3 :Р 2 О 5 в сырье превышает 7,5 – 8. В суперфосфате из апатитового концентрата ( 100Fе 2 О 3 :Р 2 О 5 = 2 – 4 ) ретроградация Р 2 О 5 обычно не происходит.
Слайд 26: Качество суперфосфата
Суперфосфат выпускают в следующих видах: порошкообразный, не нейтрализованный, содержащий до 5 % свободного Р 2 О 5 ; порошкообразный нейтрализованный карбонатом кальция или фосфатом кальция; гранулированный (обычно нейтрализованный); аммонизированный. Порошкообразный нейтрализованный суперфосфат имеет значитель-ную гигроскопичность и сильно слеживается в результате кристаллизации из жидкой фазы монокальцийфосфата. Меньше слеживается охлажденный и хорошо вызревший суперфос -фат, в котором кристаллизация закончилась. Почти не слеживается нейтрализованный и гранулированный супер-фосфат.
Слайд 27: Качество суперфосфата
Простой гранулированный суперфосфат - дешевое фосфорное удобре-ние. Однако он имеет существенный недостаток - низкое содержание ос- новного компонента (19 – 21 % усвояемого Р 2 О 5 ) и высокую долю бал-ласта - сульфата кальция. Его производят, как правило, в районах потребления удобрений, так как экономичнее доставлять концентрированное фосфатное сырье к су- перфосфатным заводам, чем перевозить на дальние расстояния низко-концентрированный простой суперфосфат. Суперфосфат с высокой свободной кислотностью при 20 0 С в тех слу -чаях, когда относительная влажность воздуха составляет 70 – 100 %, поглощает атмосферную влагу.
Слайд 28: Качество суперфосфата
Поглощенная влага растворяет некоторое количество монокальций -фосфата, вызывая его разложение на дикальцийфосфат и фосфорную кислоту. Выделение же дополнительного количества свободной фосфорной кислоты еще больше увеличивает гигроскопичность суперфосфата. Такой суперфосфат обладает плохими физическими свойствами: слеживается, зависает в бункерах механических сеялок, вызывает корро-зию механизмов и тары. Поэтому свободную кислотность вызревшего суперфосфата нейтра-лизуют, обрабатывая его добавками, легко разлагаемыми фосфорной кислотой. Обычно нейтрализацию совмещают с гранулированием. В качестве добавок используют фосфоритную муку, мел, известняк и др.
Слайд 29: Качество суперфосфата
Одним из способов улучшения качества суперфосфата является его аммонизация – нейтрализация свободной кислотности аммиаком. Аммонизированный суперфосфат представляет собой сухой негигро-скопичный, неслеживающийся порошок, содержащий 2 - 3 % азота. Содержащийся в нем азот – полезный питательный элемент. Отношение Р 2 О 5 :N в таком удобрении очень велико, а в азотно- фос - форных удобрениях содержание Р 2 О 5 должно быть в пределах 1 – 4 кг на 1 кг азота. Поэтому аммонизированный суперфосфат обычно смешивают с азот- ными удобрениями. Аммонизацию суперфосфата осуществляют во вращающемся бара-бане – аммонизаторе, вводя в него непрерывно суперфосфат и газооб -разный аммиак прямотоком.
Слайд 30: Качество суперфосфата
При аммонизации суперфосфата протекает реакция нейтрализации фосфорной кислоты. При неглубокой нейтрализации образуется моноам-монийфосфат : Н 3 РО 4 (ж ) + NН 3 (г) = NН 4 Н 2 РО 4 ( тв ) + 147 кДж Вследствие выделения тепла нейтрализации температура продукта повышается до 80 0 С, благодаря чему суперфосфат подсушивается до влажности 2,5 %. При стехиометрическом расходе аммиака содержание водорастворимой формы Р 2 О 5 в суперфосфате не снижается. При более глубокой аммонизации образуется диаммонийфосфат : Н 3 РО 4 (ж ) + 2NН 3 (г) = (NН 4 ) 2 НРО 4 ( тв ) + 215кДж Затраты на сырье в производстве суперфосфата составляют 89 – 95 %, энергетические расходы лишь 0,2 – 1 % от заводской себестоимости про- дукта.
Слайд 31: Виды технологических схем
Основными операциями в производстве суперфосфата являются сме-шение апатитового концентрата или фосфоритной муки с серной кисло-той и отверждение (схватывание) получаемой суспензии в камерах созре-вания суперфосфата. Окончательное дозревание его происходит при вылеживании и дооб -работке на складе, который в данном случае больше является химичес -ким цехом, чем хранилищем продукции. Выделяющиеся из смесителей сырья и из суперфосфатных камер фто-ристые газы улавливаются и перерабатываются на фторсодержащие и другие продукты.
Слайд 32: Виды технологических схем
Существует много способов производства суперфосфата, различающихся конструкцией смесителей и суперфосфатных камер. Эти способы можно разделить: на периодические – смешение реагентов и созревание суперфосфатной массы осуществляется в периодически действующих аппаратах; на полунепрерывные – для смешения фосфата с серной кислотой при-меняют непрерывно действующие смесители, а суперфосфатные каме-ры работают с периодической загрузкой и выгрузкой материала; на непрерывные – обе основные операции осуществляются в непрерыв -но-действующих аппаратах. В РФ суперфосфатные заводы работают непрерывным способом с ис -пользованием 3-4-х камерных смесителей и кольцевых вращающихся ка-мер.
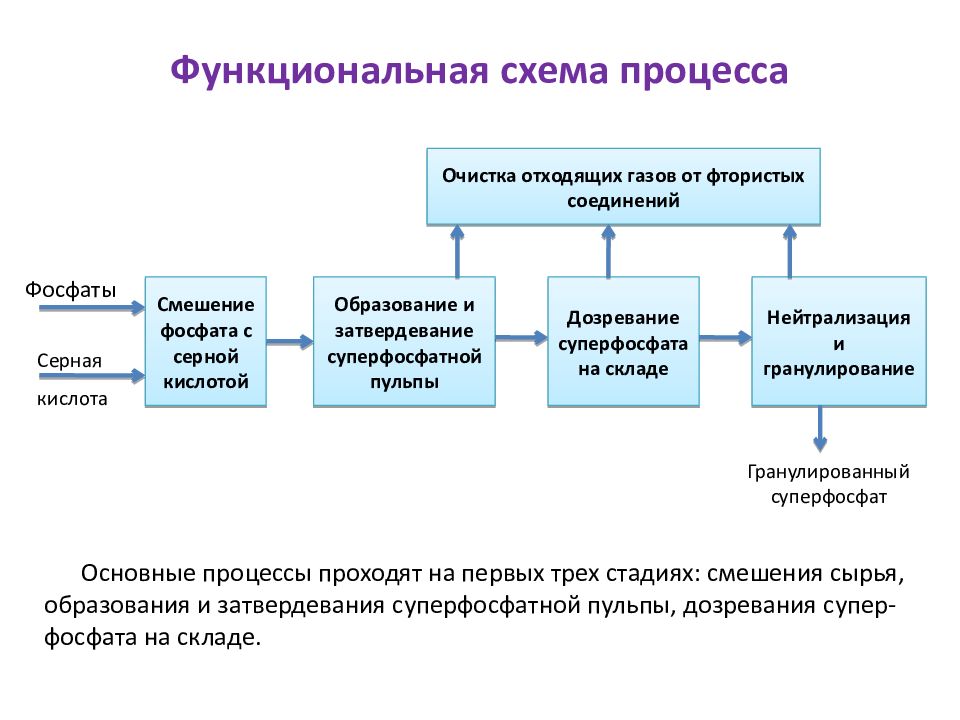
Слайд 33: Функциональная схема процесса
Основные процессы проходят на первых трех стадиях: смешения сырья, образования и затвердевания суперфосфатной пульпы, дозревания супер-фосфата на складе. Смешение фосфата с серной кислотой Образование и затвердевание суперфосфатной пульпы Дозревание суперфосфата на складе Нейтрализация и гранулирование Очистка отходящих газов от фтористых соединений Фосфаты Серная кислота Гранулированный суперфосфат
Слайд 34
Для обеспечения высокой скорости гетерогенного процесса сернокис-лотного разложения фосфатов используют ряд технологических приемов: серную кислоту для разложения фосфатов берут в небольшом избытке (в 1,07 – 1,14 раза больше стехиометрического количества ); используют 68,5 – 69,5 %- ную серную кислоту: такая концентрация явля-ется оптимальной для кристаллизации сульфата кальция и дальнейшего разложения фосфатов; температуру в суперфосфатной камере поддерживают на уровне 115 – 120 0 С, что обеспечивает достаточную скорость разложения и в то же время позволяет получить продукт (суперфосфат), обладающий хоро-шими физическими свойствами. Для получения товарного продукта более высокого качества суперфос -фат после дозревания подвергают нейтрализации твердыми добавками (известняком, фосфоритной мукой и т. п.) и гранулируют.
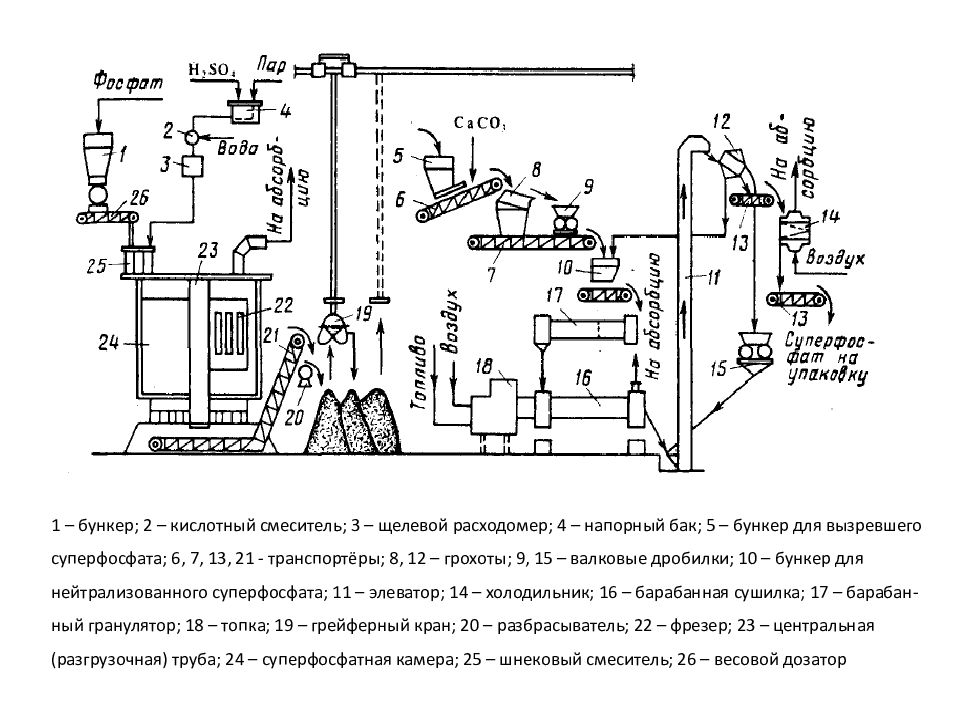
Слайд 35
1 – бункер; 2 – кислотный смеситель; 3 – щелевой расходомер; 4 – напорный бак; 5 – бункер для вызревшего суперфосфата; 6, 7, 13, 21 - транспортёры; 8, 12 – грохоты; 9, 15 – валковые дробилки; 10 – бункер для нейтрализованного суперфосфата; 11 – элеватор; 14 – холодильник; 16 – барабанная сушилка; 17 – барабан- ный гранулятор ; 18 – топка; 19 – грейферный кран; 20 – разбрасыватель; 22 – фрезер; 23 – центральная (разгрузочная) труба; 24 – суперфосфатная камера; 25 – шнековый смеситель; 26 – весовой дозатор
Слайд 37: Характеристика двойного суперфосфата
При разложении природных фосфатов фосфорной кислотой получа-ется двойной суперфосфат, содержащий в отличие от простого суперфос -фата в основном фосфатные соединения ( монокальцийфосфат и некото -рое количество свободной фосфорной кислоты). Примесь сульфата кальция в двойном суперфосфате может присутст-вовать лишь при разложении фосфата экстракционной фосфорной кисло-той, содержащей сульфат-ион, или при наличии сульфата в исходной руде. Фазовый состав двойного суперфосфата практически не отличается от состава простого суперфосфата. В зависимости от состава исходного сырья в двойном суперфосфате содержится 42 – 50 % усвояемого Р 2 О 5, в том числе в водорастворимой форме 27 – 42 % Р 2 О 5, т.е. в 2-3 раза больше чем простой.
Слайд 38: Характеристика двойного суперфосфата
Двойной суперфосфат, как и простой, может подвергаться аммони-зации для нейтрализации большей части свободной кислотности. Гигроскопическая точка двойного суперфосфата находится в пределах 62,5 –74 %. Ее значение зависит от содержания свободной фосфорной кислоты и влажности продукта. При большой свободной кислотности ( 4 – 6 % Р 2 О 5 и выше) суперфос -фат тем более гигроскопичен, чем меньше его влажность. Поэтому сушка «кислых» суперфосфатов целесообразна только до та-кого содержания в них влаги, при котором гигроскопическая точка про- дукта соответствует средней относительной влажности воздуха в мест- ности, где хранят и применяют суперфосфат. При меньшей влажности суперфосфат будет поглощать влагу до установления равновесного состояния.
Слайд 39: Характеристика двойного суперфосфата
При нейтрализации свободной кислоты до 1,5 – 2 % Р 2 О 5, двойной суперфосфат можно высушивать до стабильной влажности 2 – 4 %. Если норма усвояемой Р 2 О 5, вносимой с двойным суперфосфатом, такая же, как и с простым, их эффективность одинакова. Основным преимуществом двойного суперфосфата по сравнению с простым является высокая концентрация усвояемой Р 2 О 5. Благодаря этому сокращаются затраты на транспортировку и склад- ское хранение удобрения с равным количеством действующих веществ.
Слайд 40: Физико-химические основы процесса
В основе производства двойного суперфосфата лежит превращение неусвояемого фторапатита в водорастоворимую кислую соль – монокаль-цийфосфат, что достигается взаимодействием измельченного фосфатного сырья с фосфорной кислотой по общему уравнению: Са 5 F(РО 4 ) 3( тв ) + Н 3 РО 4(ж) + 5Н 2 О = 5Са(Н 2 РО 4 ) 2 ×Н 2 О ( тв ) + НF (ж) + 132.3 кДж В этом процессе фосфорная кислота служит не только реагентом, заменяющим серную кислоту, но и носителем действующего вещества – фосфора, чем объясняется более высокая концентрация усвояемого Р 2 О 5 в двойном суперфосфате по сравнению с простым.
Слайд 41: Физико-химические основы процесса
При взаимодействии с фторапатитом фосфорная кислота насыщается монокальцийфосфатом. Из этого раствора кристаллизуются твердые фазы, состав которых зави -сит от относительного содержания фторапатита и фосфорной кислоты, концентрации кислоты и температуры процесса. В зависимости от указанных условий в твердой фазе могут находиться монокальцийфосфат безводный Са (Н 2 РО 4 ) 2, монокальцийфосфат моно-гидрат Са (Н 2 РО 4 ) 2 ×Н 2 О, дикальцийфосфат безводный СаНРО 4. В области низких концентраций фосфорной кислоты жидкая фаза находится в равновесии с дикальцийфосфатом СаНРО 4. В более концентрированных растворах стабильны твердые фазы Са (Н 2 РО 4 ) 2 и Са (Н 2 РО 4 ) 2 ×Н2О.
Слайд 42: Физико-химические основы процесса
Скорость разложения апатита фосфорной кислотой зависит не только от пассивирования поверхности зерен фосфата кристаллическим осадком, но и от разности концентраций ионов кальция у поверхности разлагаемых частиц фосфата и в объеме раствора, от скорости диффузии ионов водо-рода к поверхности раздела твердой и жидкой фаз, от активности ионов водорода, от вязкости жидкой фазы и других физико-химических парамет -ров. Загрязнение экстракционной фосфорной кислоты полуторными окси- дами и фосфатами магния отрицательно влияет на полноту разложения фосфатов. Наиболее активны термическая фосфорная кислота и экстрак-ционная, полученная из апатитового концентрата. В производственных условиях обычно берут 100 – 110 % фосфорной кислоты от стехиометрической нормы, при этом фосфаты разлагаются в реакционном аппарате не более чем на 60 – 70 %. Только при длительном вызревании на складе или при сушке степень разложения увеличивается до 80 %.
Слайд 43: Технология производства
Процесс получения двойного суперфосфата состоит из двух ступеней: получение фосфорной кислоты экстракционным или электротермическим методом и разложения природных фосфатов фосфорной кислотой. В производстве двойного суперфосфата используются три метода, раз- личающиеся аппаратурным оформлением, концентрацией используемой фосфорной кислоты и температурным режимом процесса. Камерный метод с использованием суперфосфатных камер непрерыв-ного действия и выдерживанием продукта для созревания на складе. Для разложения используют концентрированную фосфорную кислоту. При разложении апатита термической фосфорной кислотой содержание в ней Р 2 О 5 должно составлять 54,8 - 58 % при ее расходе порядка 110 % от стехиометрической нормы.
Слайд 44: Технология производства
Образующаяся пульпа в этих условиях быстро затвердевает, что позво-ляет вести непрерывный процесс разложения в камерах типа ленточного транспортера. При разложении апатита большое значение имеет температура в сме-сителе, которую поддерживают на уровне 80 – 90 0 С при условии, что тем- пература исходной фосфорной кислоты 50 – 70 0 С. В смесителе взаимодействие апатита с фосфорной кислотой протекает в течение 5 – 6 минут, а фосфоритов –1,5 мин. При получении двойного суперфосфата из апатита образуется очень твёрдая монолитная масса; выгрузка ее из камеры и дообработка на складе связаны с большими затруднениями. Для устранения этого недостатка камерного процесса в пульпу в конце смесителя непрерывно добавляют около 3 % известняка. Выделяющаяся при разложении известняка двуокись углерода придает суперфосфату рыхлость и пористость.
Слайд 45: Технология производства
Продукт измельчают и гранулируют также как и простой суперфосфат. Нейтрализованный известняком суперфосфат увлажняется водой в бараба -не- грануляторе до влажности 18 % и окатывается вместе с ретуром в тече-ние 10 мин. Влажный суперфосфат после окатывания сушат в сушильных барабанах до влажности не более 9 %. Процесс затвердевания пульпы в камере длится 1 – 1,5 ч. Его недостатками являются длительное складское дозревание продукта, сопровождающееся неорганизованными выделениями вредных соедине-ний фтора в атмосферу, и необходимость применения концентрированной фосфорной кислоты. Камерно-поточный метод с использованием аналогичных камер, но без операции складского созревания. Для разложения фосфатов исполь-зуется экстракционная кислота концентрацией 47-49%.
Слайд 46: Технология производства
Поточный (бескамерный) метод с использованием неупаренной кисло-ты концентрацией 30 % P 2 O 5. В отличие от предыдущих методов, здесь разложение сырья осуществ-ляют в две ступени. В первой стадии сырье обрабатывается при 50 – 100 0 С фосфорной кислотой концентрацией 28 – 40 % P 2 O 5, что отвечает оптималь-ным условиям данной стадии. Так как, при этой концентрации кислоты вто -рая стадия процесса практически не идет, то процесс завершают при сушке реакционной массы, когда вследствие испарения воды повышается актив- ность реакционной массы. Для этого применяются сушилки различного типа: распылительные, барабанные гранулятор -сушилки (далее БГС), распыли-тельные сушилки- грануляторы кипящего слоя. Наиболее распространены схемы с использованием аппаратов БГС. Поточный (бескамерный) метод обеспечивает хорошее качество продук -та, экологически менее опасен, и чаще используется при производстве двой-ного суперфосфата.
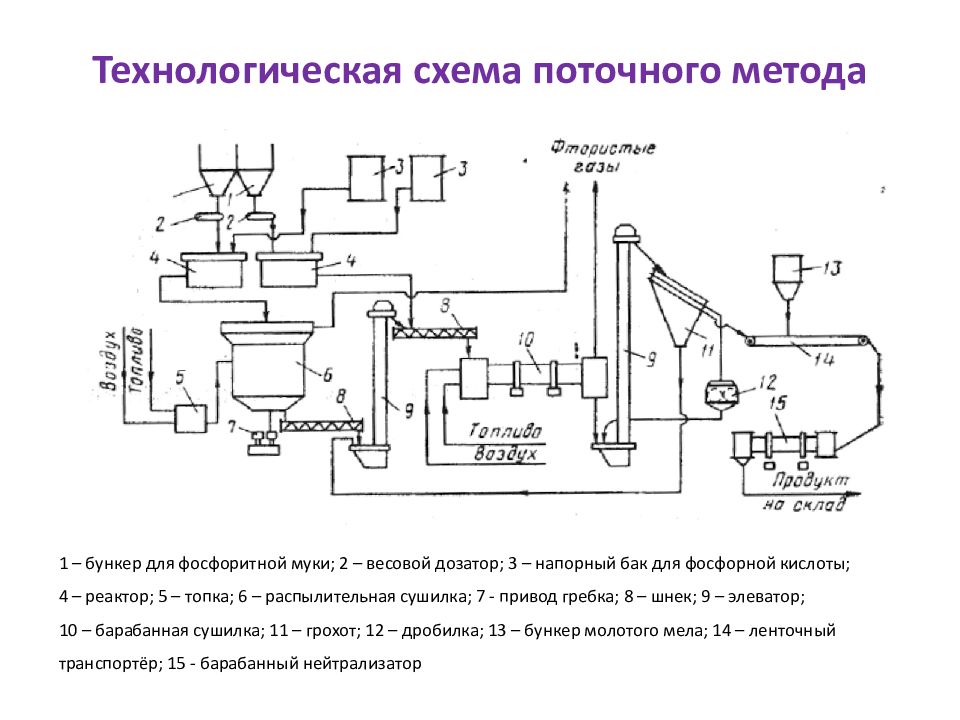
Слайд 47: Технологическая схема поточного метода
1 – бункер для фосфоритной муки; 2 – весовой дозатор; 3 – напорный бак для фосфорной кислоты; 4 – реактор; 5 – топка; 6 – распылительная сушилка; 7 - привод гребка; 8 – шнек; 9 – элеватор; 10 – барабанная сушилка; 11 – грохот; 12 – дробилка; 13 – бункер молотого мела; 14 – ленточный транспортёр; 15 - барабанный нейтрализатор
Последний слайд презентации: Фосфатное сырьё и виды фосфорных удобрений
Простой и двойной суперфосфаты содержат Р 2 О 5 в легко усваиваемой растениями форме. Однако в последние годы больше внимания стало уделяться выпуску удобрений с регулируемым сроком действия, в частности долговременно действующих. Для получения таких удобрений можно покрыть гранулы суперфосфата оболочкой, регулирующей высвобождение питательных веществ. Другой путь – смешение двойного суперфосфата с фосфоритной мукой. Например, таким долговременно действующим фосфатным удобрением является суперфос. Это удобрение содержит 37 – 38 % Р 2 О 5, в том числе около половины – в быстродействующей водорастворимой форме и около половины – в медленнодействующей. Применение такого удобрения удлиняет срок его эффективного дейст -вия в почве.