Первый слайд презентации: Фотобиология
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Фотобиология
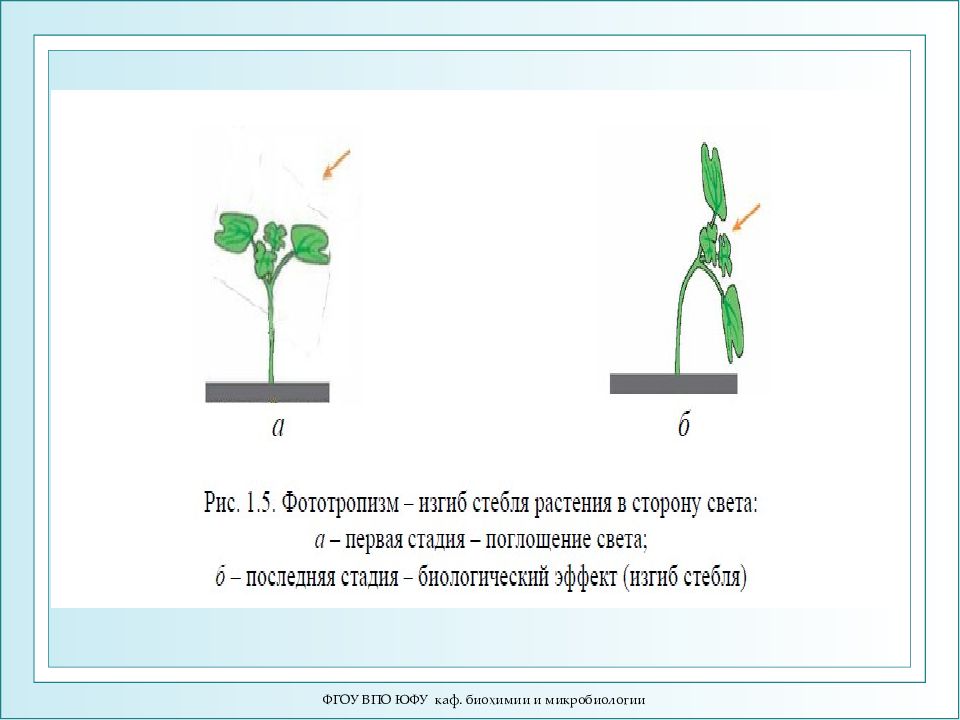
Слайд 2
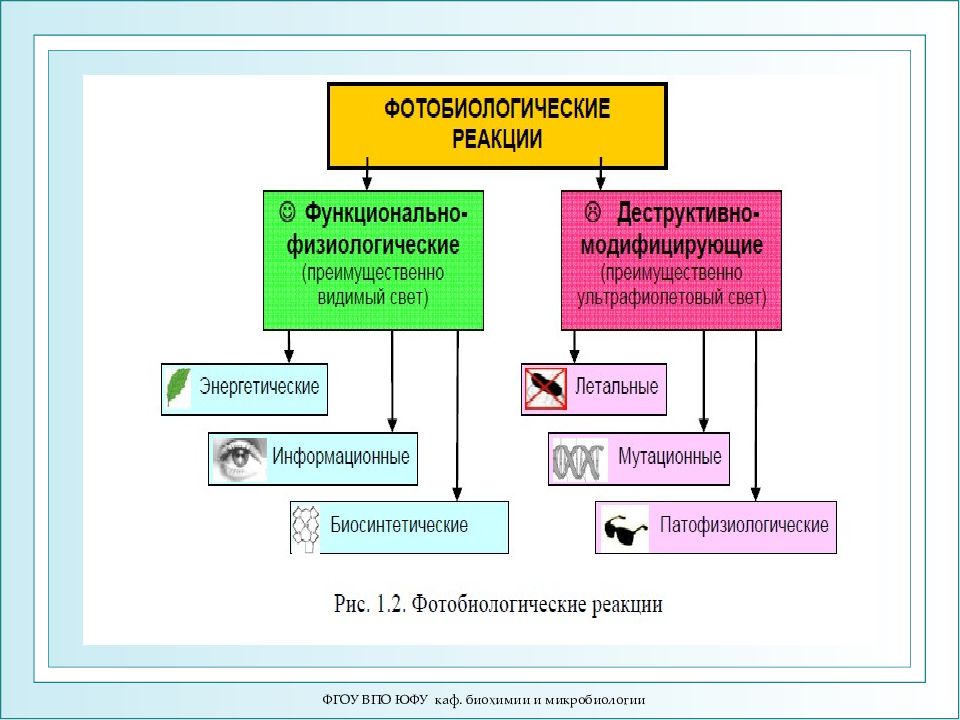
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Фотобиология (ФБ, квантовая биофизика) – наука, изучающая механизм действия света на биосистемы - видимого (380-760 нм), ультрафиолетового (120-380 нм) и ближнего инфракрасного (760-900 нм) света. Биологическим эффектом обладает только поглощенный свет
Слайд 4: Шкала электромагнитных колебаний
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Оптическая область спектра
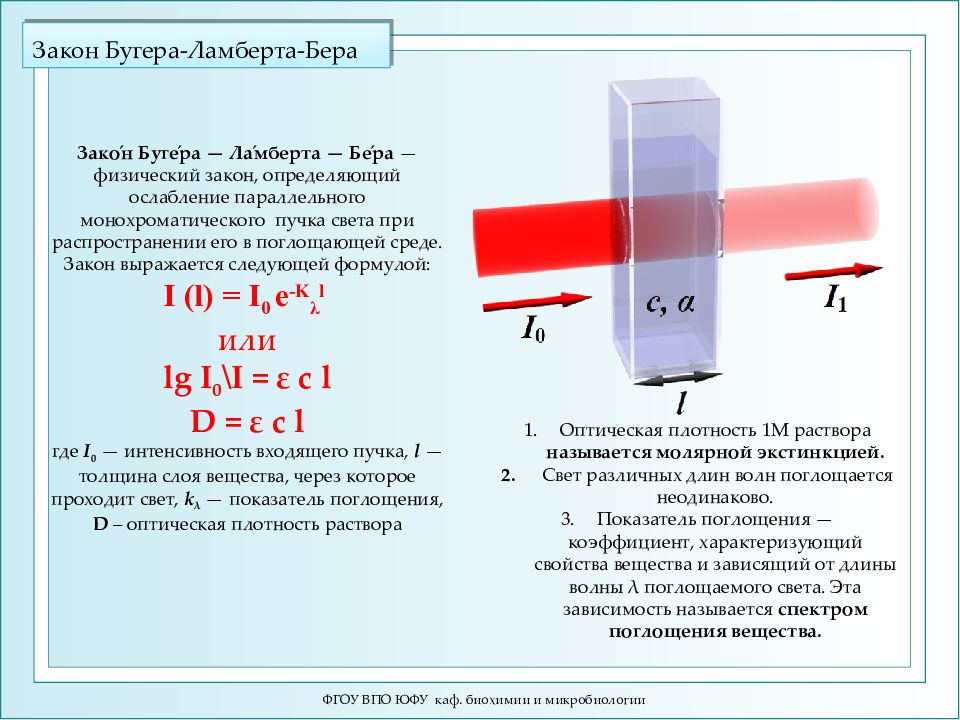
Слайд 5: Закон Бугера-Ламберта-Бера
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Зако́н Буге́ра — Ла́мберта — Бе́ра — физический закон, определяющий ослабление параллельного монохроматического пучка света при распространении его в поглощающей среде. Закон выражается следующей формулой: I (l) = I 0 e -K λ l или lg I 0 \I = ε c l D = ε c l где I 0 — интенсивность входящего пучка, l — толщина слоя вещества, через которое проходит свет, k λ — показатель поглощения, D – оптическая плотность раствора Оптическая плотность 1М раствора называется молярной экстинкцией. Свет различных длин волн поглощается неодинаково. Показатель поглощения — коэффициент, характеризующий свойства вещества и зависящий от длины волны λ поглощаемого света. Эта зависимость называется спектром поглощения вещества.
Слайд 7
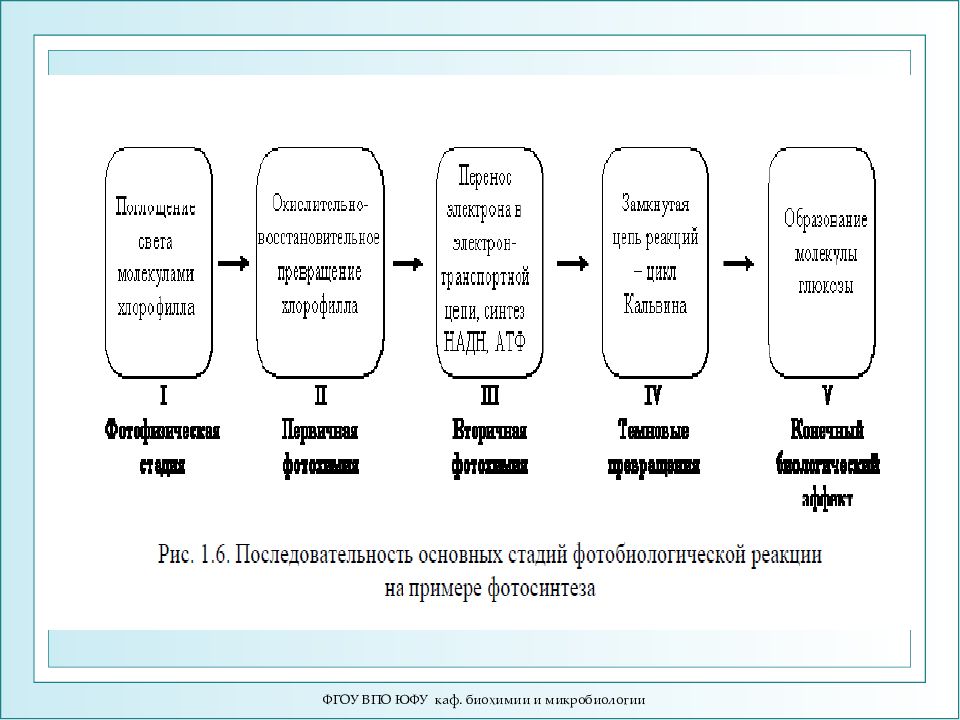
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Основные стадии фотобиологического процесса 1.Фотофизическая (поглощение кванта света, размен и миграция энергии) 2.Первичная фотохимическая (образование первичного фотопродукта) 3.Вторичная фотохимическая (образование стабильного продукта) 4.Темновые реакции (цепь биохимических реакций или перестройки клеточных структур) 5.Биологический эффект (физиологический ответ на действие света)
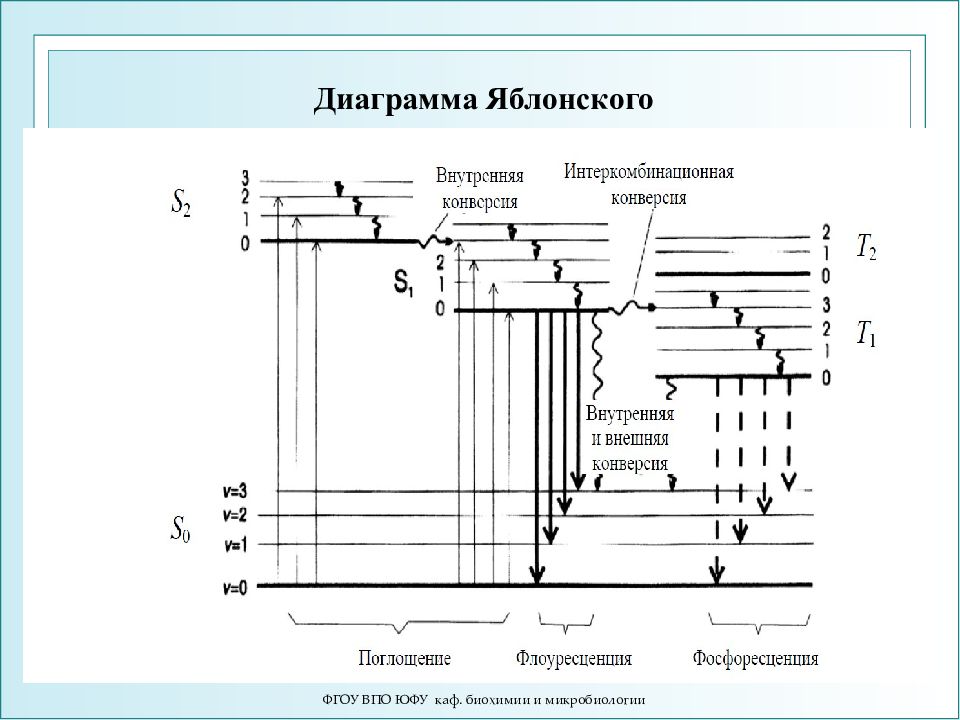
Слайд 11
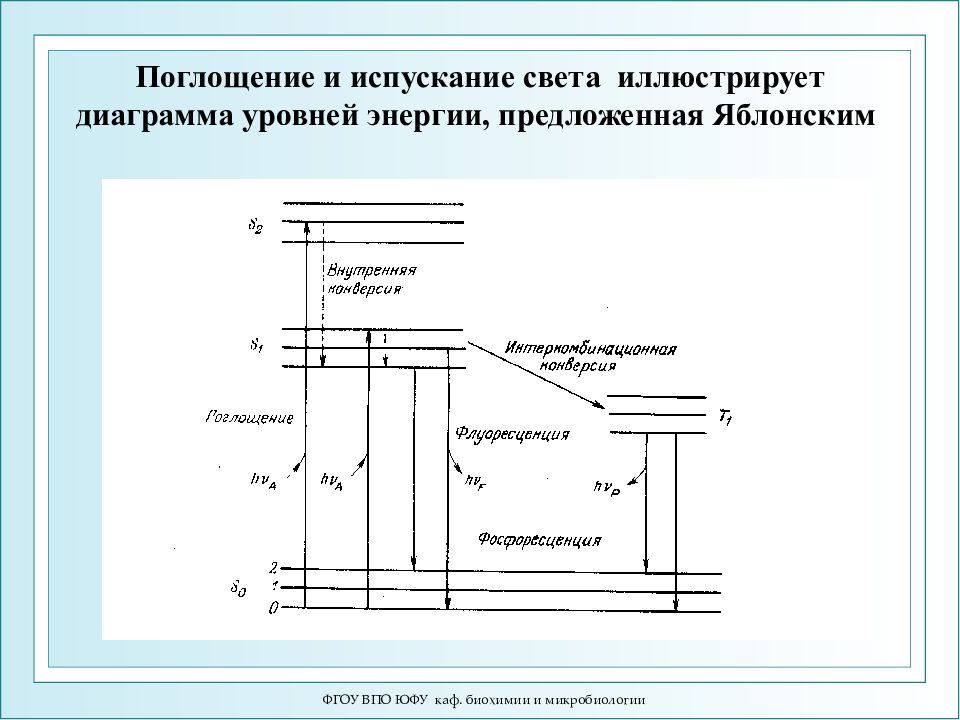
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Поглощение и испускание света иллюстрирует диаграмма уровней энергии, предложенная Яблонским
Слайд 12
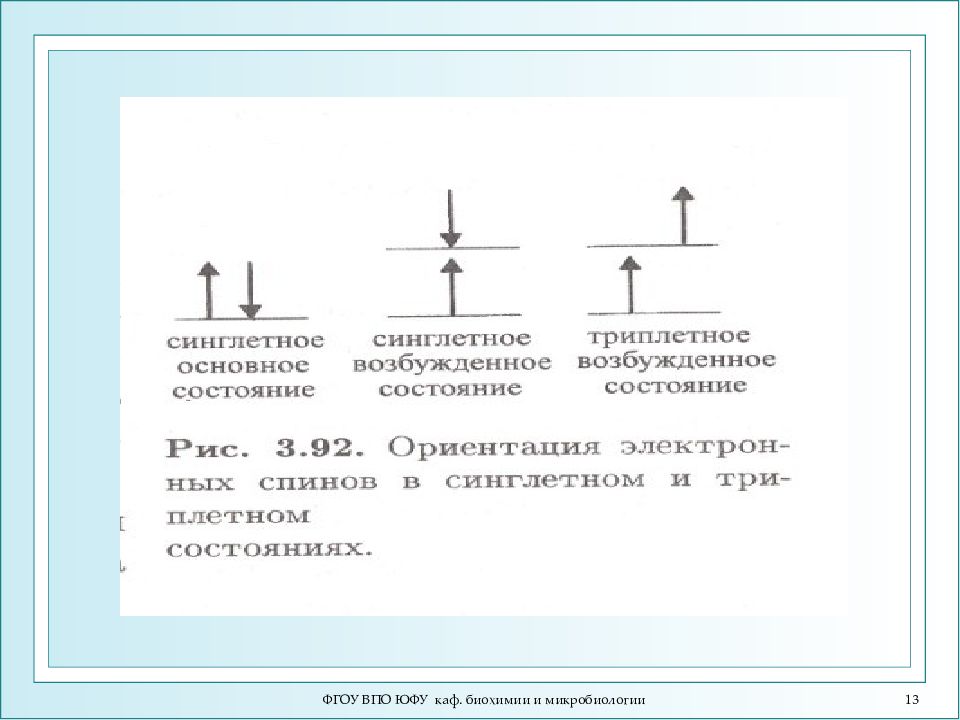
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Взаимодействие молекул с фотонами Возбуждение молекулы →переход электрона из основного состояния в возбужденное (с большей энергией) →переход в основное состояние + h ν. Энергия молекуля складывается из 3 частей: Различают два главных состояния электронных оболочек: 1) синглетное основное и возбужденное состояние (все спины электронов антипараллельны, неспаренные электроны отсутствуют) 2) триплетное основное и возбужденное состояние (спины электронов параллельны, имеются неспаренные электроны). Основное состояние для большинства веществ - синглетное, за исключением кислорода, для которого основное состояние – триплетное. Е мол = Е е + Е кол + Е вр Е е >> Е кол >> Е вр
Слайд 14
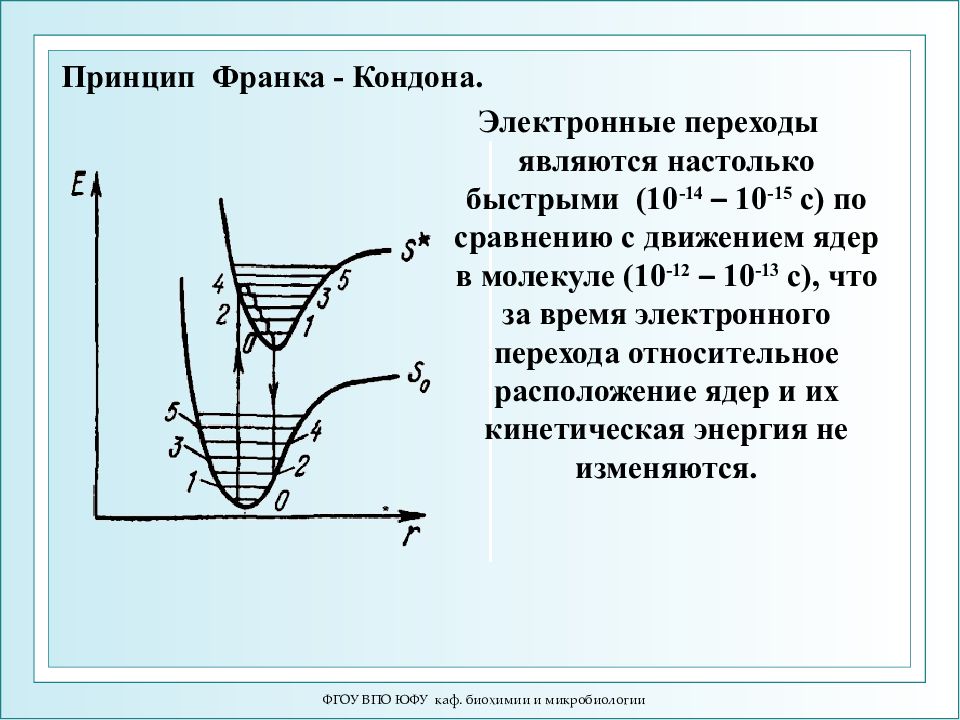
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Электронные переходы являются настолько быстрыми (10 -14 – 10 -15 с) по сравнению с движением ядер в молекуле (10 -12 – 10 -13 с), что за время электронного перехода относительное расположение ядер и их кинетическая энергия не изменяются. Принцип Франка - Кондона.
Слайд 15
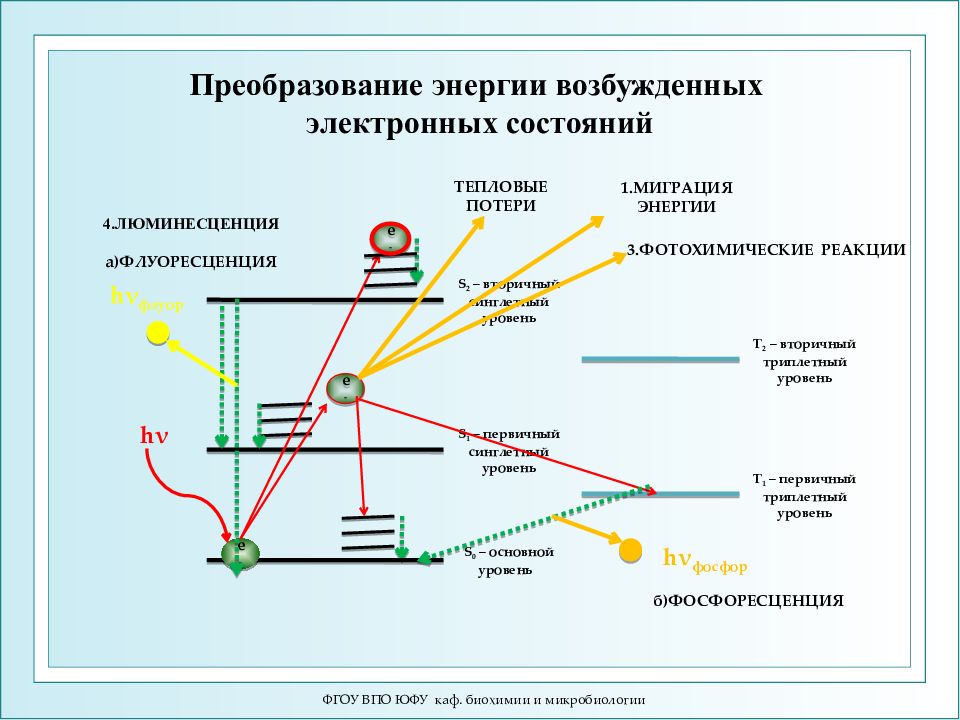
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии S 0 – основной уровень S 1 – первичный синглетный уровень S 2 – вторичный синглетный уровень Т 1 – первичный триплетный уровень Т 2 – вторичный триплетный уровень e - h ν e - e - 3.ФОТОХИМИЧЕСКИЕ РЕАКЦИИ 1.МИГРАЦИЯ ЭНЕРГИИ ТЕПЛОВЫЕ ПОТЕРИ h ν флуор 4.ЛЮМИНЕСЦЕНЦИЯ а)ФЛУОРЕСЦЕНЦИЯ h ν фосфор б)ФОСФОРЕСЦЕНЦИЯ Преобразование энергии возбужденных электронных состояний
Слайд 16: Трансформация энергии электронного возбуждения (внутренняя конверсия)
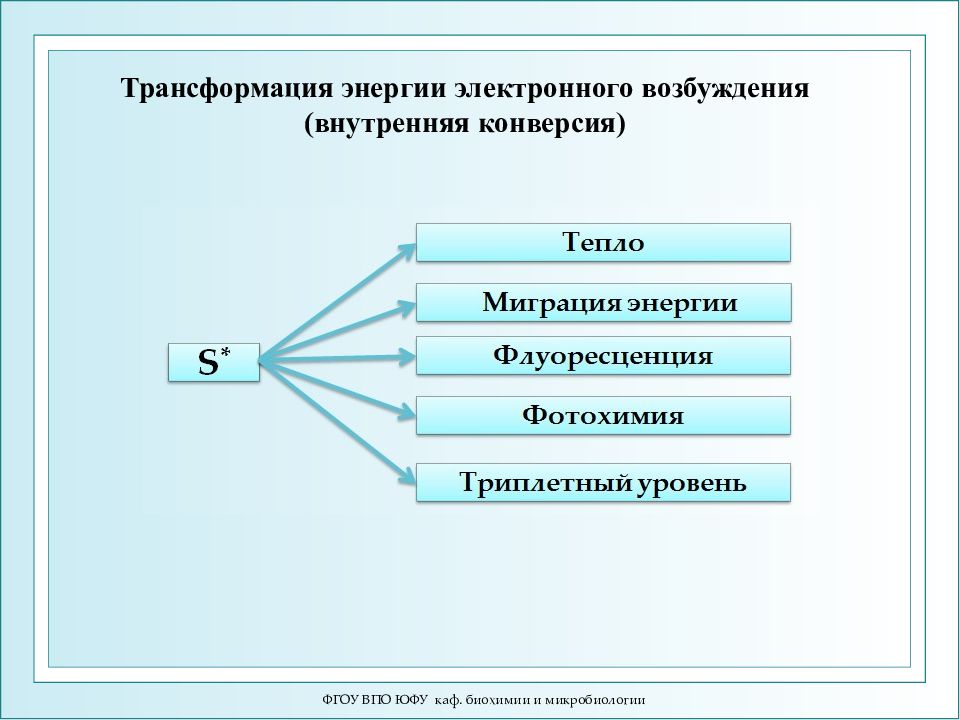
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Трансформация энергии электронного возбуждения (внутренняя конверсия)
Слайд 17
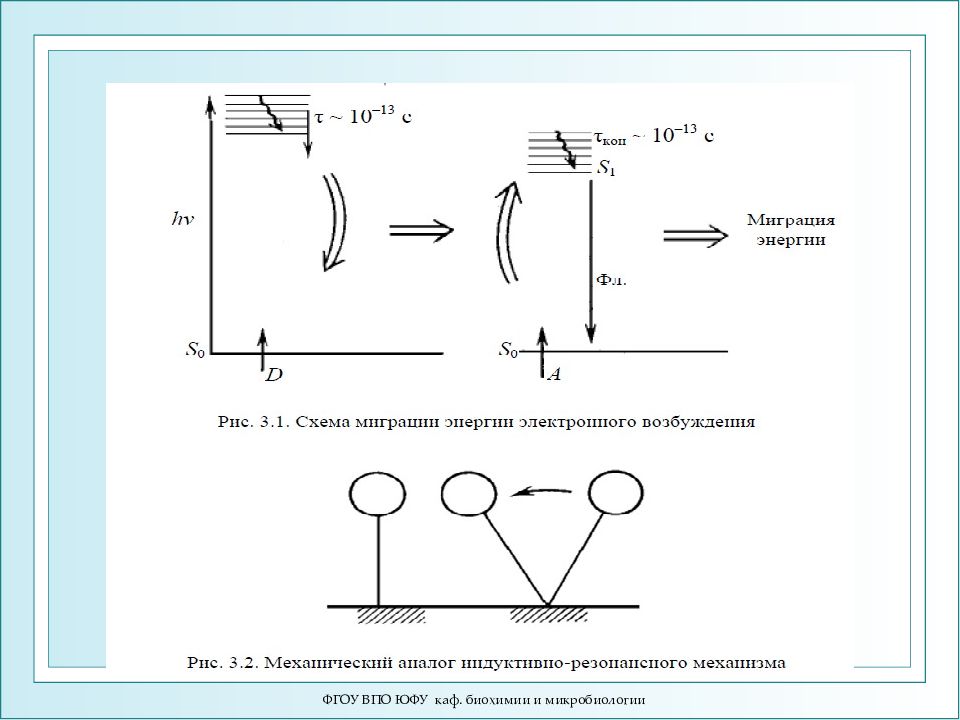
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 1. Миграция энергии - это безызлучательный обмен энергией между возбужденной молекулой донора (D) и молекулой акцептора (А) в основном состоянии: D * + A → D + A * Известно 3 механизма миграции энергии: 1. Индуктивно-резонансный 2. Обменно-резонансный 3. Экситонный
Слайд 18
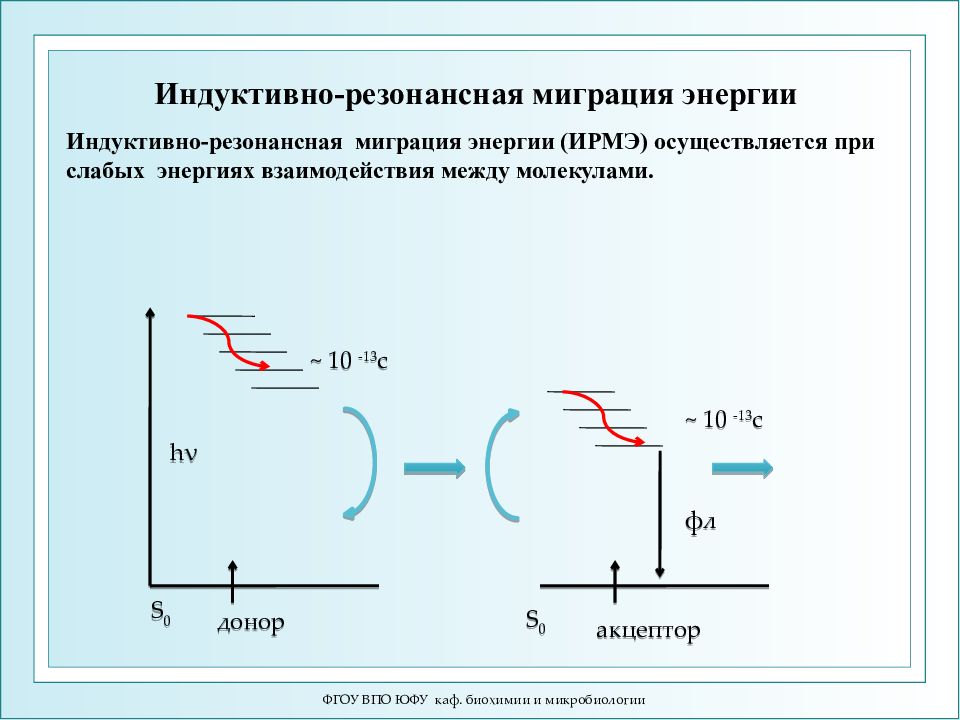
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии S 0 h ν донор ~ 10 -13 c акцептор S 0 ~ 10 -13 c фл Индуктивно-резонансная миграция энергии Индуктивно-резонансная миграция энергии (ИРМЭ) осуществляется при слабых энергиях взаимодействия между молекулами.
Слайд 19
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Условия ИРМЭ: 1. Донор (D) должен быть способен к люминесценции. 2. Расстояние между донором (D) и акцептором (A) 2 - 10 нм. 3. Спектр флуоресценции донора (D) должен перекрываться со спектром поглощения акцептора (A). Эффективность миграции прямо пропорциональна площади перекрытия. Особенности ИРМЭ: 1. Перенос энергии происходит с очень большой скоростью: V = 10 -6 - 10 -11 с 2. Перенос энергии происходит на расстояния > 10 нм. 3. ИРМЭ проходит не только между S-уровнями D и A, но и путем "запрещенных" переходов: Т → S, S → T.
Слайд 21: Обменно-резонансная миграция энергия (ОРМЭ), Т-Т миграция
Открыта А.Терениным и В.Ермолаевым в 1952 г. 2. Миграция происходит по триплетным уровням донора и акцептора. 3. Происходит за счет перекрывания триплетных е-орбиталей и электростатического взаимодействия электронов донора и акцептора, идет обмен электронами. 4. Расстояние между донором и акцептором < 2 нм. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 22
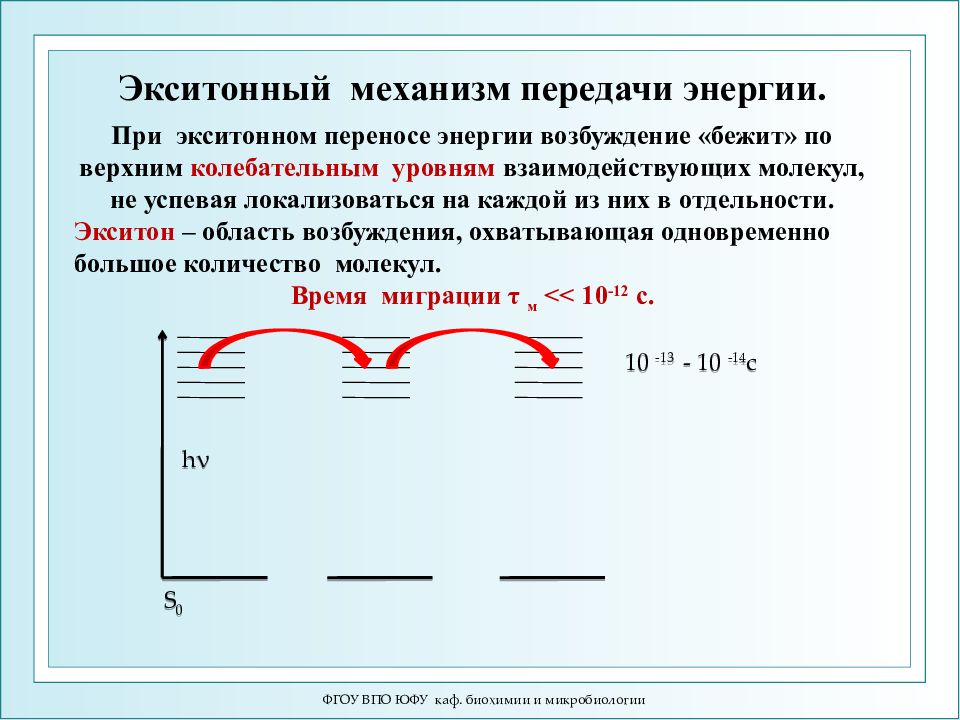
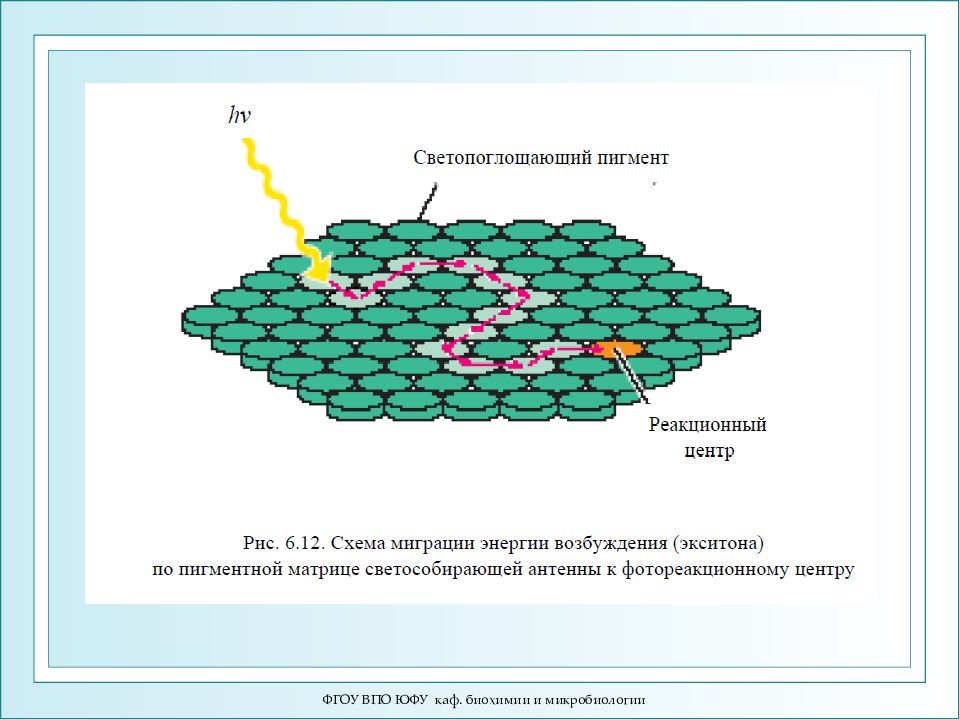
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии S 0 h ν 10 -13 - 10 -1 4 c При экситонном переносе энергии возбуждение «бежит» по верхним колебательным уровням взаимодействующих молекул, не успевая локализоваться на каждой из них в отдельности. Экситон – область возбуждения, охватывающая одновременно большое количество молекул. Время миграции τ м << 10 -12 с. Экситонный механизм передачи энергии.
Слайд 24
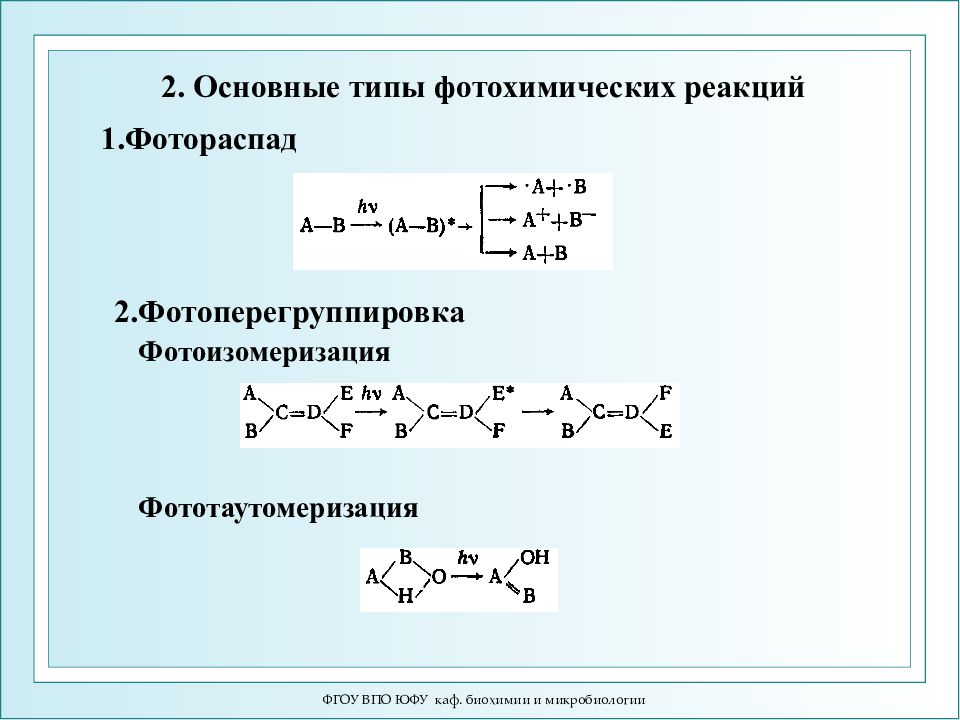
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 2. Основные типы фотохимических реакций 1.Фотораспад 2.Фотоперегруппировка Фотоизомеризация Фототаутомеризация
Слайд 25
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 3. Фотоприсоединение Фотодимеризация А* + А = (А*….А) = А2 Фотогидратация А* + Н 2 О = НАОН 4. Фотоперенос электронов Фотоокисление А* + В = А+ + Х- Фотовосстановление А* + С = А- + С+ 5. Фотоперенос протона фотоприсоединение Н+ А + ВН =АН + + В - фотоотдача Н+ АН + + В = А - + Н + В 6. Фотогидролиз А-В → А-В* + Н 2 О → АН + ВОН
Слайд 26
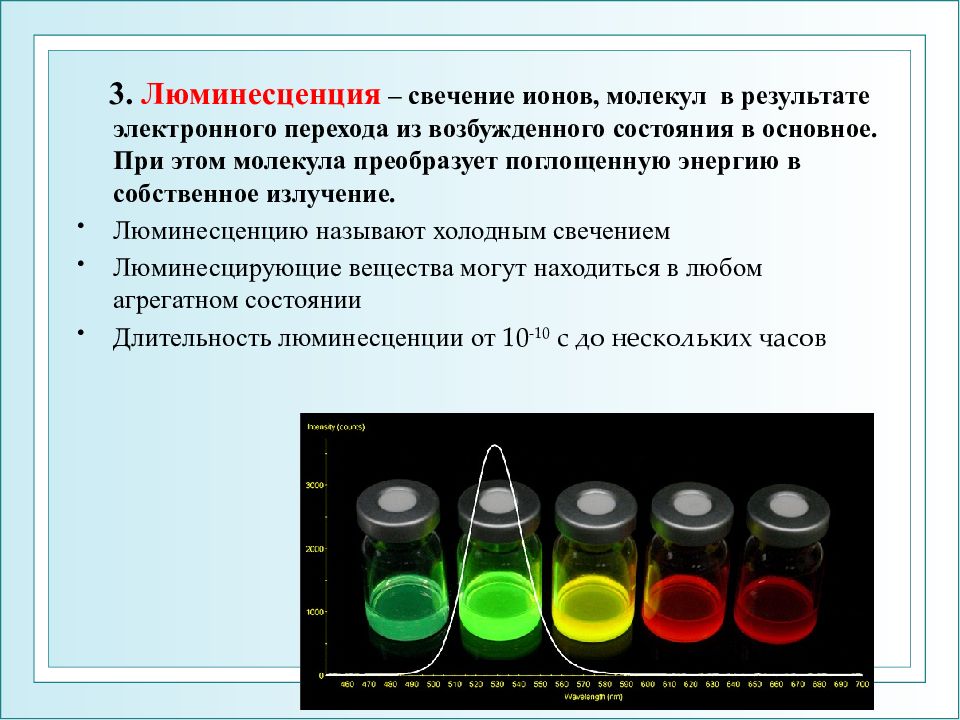
3. Люминесценция – свечение ионов, молекул в результате электронного перехода из возбужденного состояния в основное. При этом молекула преобразует поглощенную энергию в собственное излучение. Люминесценцию называют холодным свечением Люминесцирующие вещества могут находиться в любом агрегатном состоянии Длительность люминесценции от 10 -10 с до нескольких часов
Слайд 27: Классификация видов фотолюминесценции
По длительности свечения 2. По способу возбуждения
Слайд 28: Классификация фотолюминесценции по длительности свечения
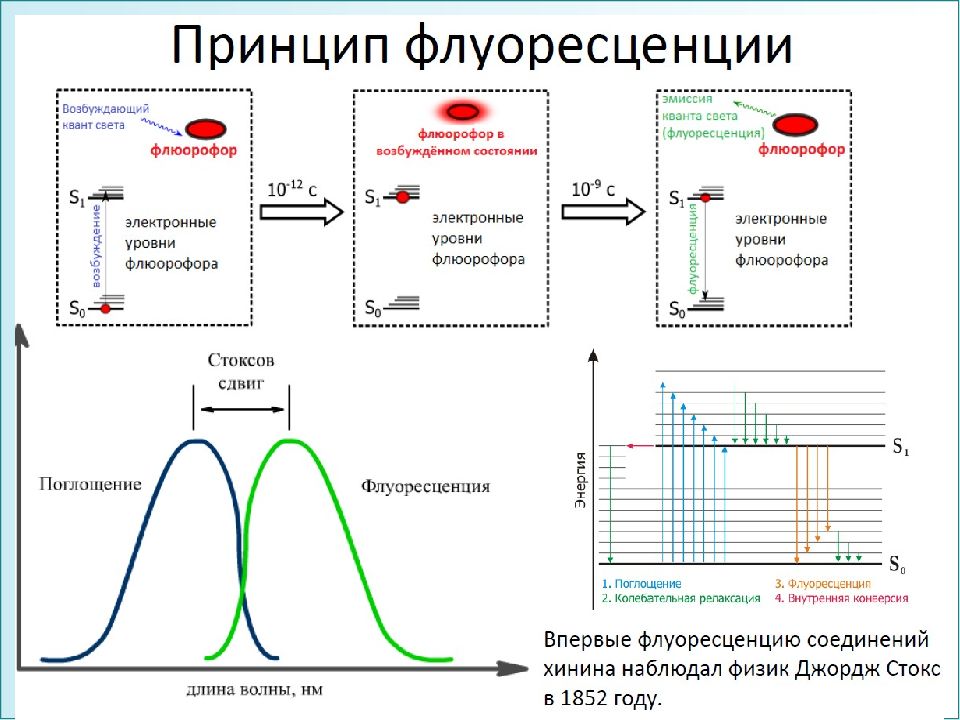
1. Флуоресценция ( ~10 -8 c) – фотолюминесценция, при которой молекула переходит из короткоживущего возбужденного состояния S * в основное S 0. Наблюдается сразу же после поглощения квантов света и быстро затухает в результате столкновений излучающей молекулы с другими молекулами в растворе. 2. Фосфоресценция ( 10 - 3 с - секунды) – фотолюминесценция, при которой молекула переходит из относительно долгоживущего возбужденного состояния S * в основное S 0 → S * → Т* → S 0, называется послесвечением. Для фосфоресценции характерны большая длина волны излучения, меньшая интенсивность.
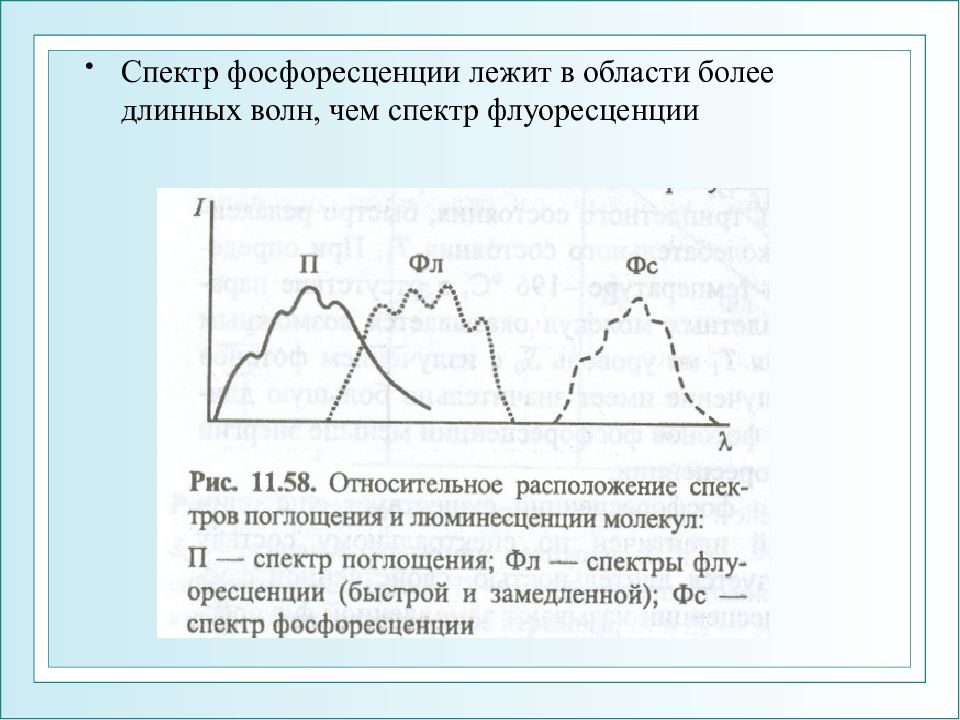
Слайд 31
Спектр фосфоресценции лежит в области более длинных волн, чем спектр флуоресценции
Фотолюминесценция Термолюминесценция Электролюминесценция Сонолюминесценция Триболюминесценция Хемилюминесценция Биолюминесценция ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
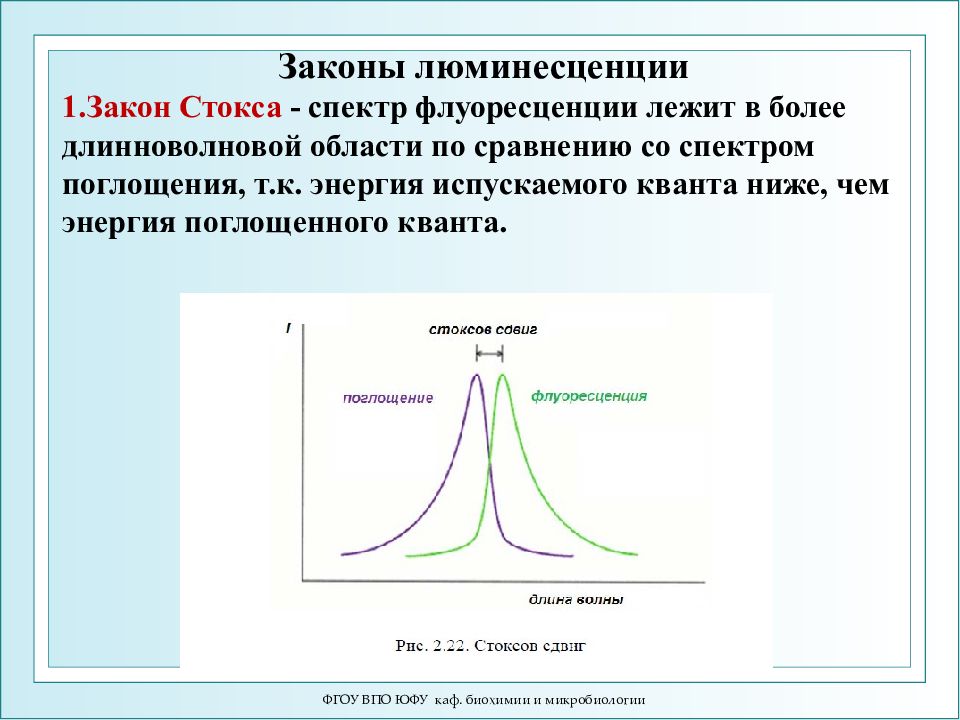
Слайд 33
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Законы люминесценции 1.Закон Стокса - спектр флуоресценции лежит в более длинноволновой области по сравнению со спектром поглощения, т.к. энергия испускаемого кванта ниже, чем энергия поглощенного кванта.
Слайд 34
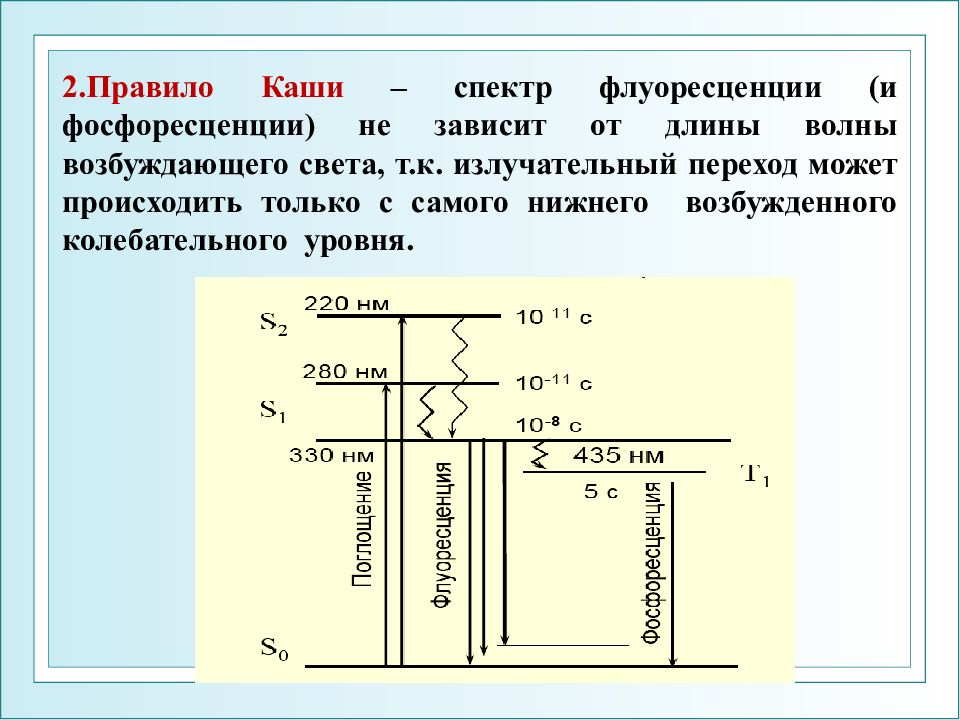
2.Правило Каши – спектр флуоресценции (и фосфоресценции) не зависит от длины волны возбуждающего света, т.к. излучательный переход может происходить только с самого нижнего возбужденного колебательного уровня.
Слайд 35
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 3. Закон Вавилова – квантовый выход флуоресценции ( Q ) не зависит от длины волны возбуждающего света, т.к. излучательный переход может происходить только с самого нижнего возбужденного колебательного уровня. Квантовый выход Q. - отношение числа излучаемых квантов к числу поглощенных квантов светового потока. Q (φ) = N/ N o N – количество излучаемых квантов N o – количество поглощенных квантов
Слайд 36
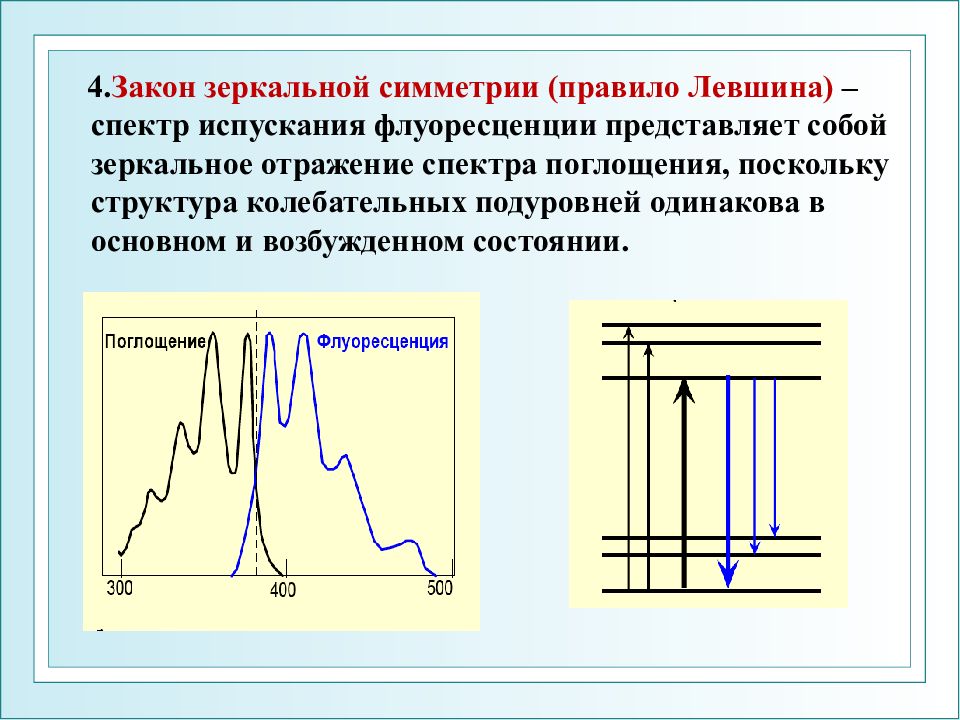
4. Закон зеркальной симметрии (правило Левшина) – спектр испускания флуоресценции представляет собой зеркальное отражение спектра поглощения, поскольку структура колебательных подуровней одинакова в основном и возбужденном состоянии.
Слайд 38: Хемилюминесценция (ХЛ) – это свечение, сопровождающее биохимические реакции
Процесс хемилюминесценции включает 2 стадии : Образование продукта в возбужденном состоянии (хемилюминесцентная реакция) А + В → Р* 2. Испускание кванта света (люминесценция) Р* → Р + фотон ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 40: Виды хемилюминесценции (ХЛ) в живых системах
Митогенетическое излучение Сверхслабое свечение (собственная хемилюминесценция СХЛ) клеток и тканей Биолюминесценция (БЛ) Активированная хемилюминесценция (АХЛ) ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 41: Эмпирические правила ХЛ
1.Спектр хемилюминесценции подобен спектру фосфоресценции, а не спектру флуоресценции. 2. Абсолютная величина квантового выхода в хемилюминесцентных реакциях имеет невысокие значения. 3. Энергия испускаемого фотона равна сумме энтальпии реакции и энергии активации люминесценции ( правило Одюбера). h ν = E а + ∆ H ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 42
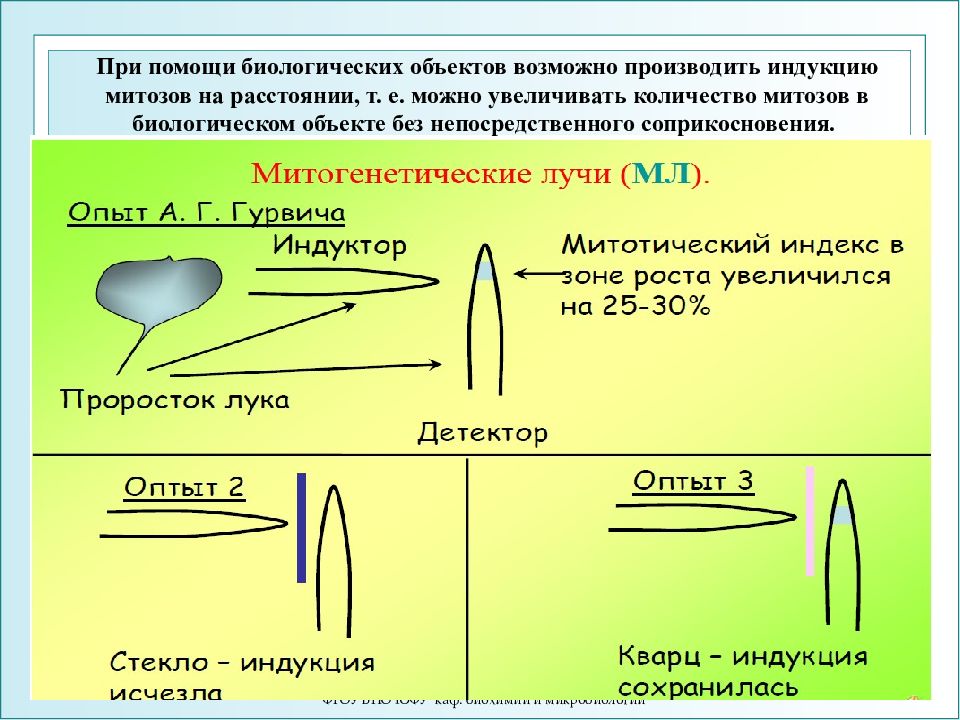
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 1. Митогенетическое излучение В 1923 году А.Гурвич обнаружил митогенетическое излучение делящихся клеток и определил его диапазон - область ультра-фиолетового излучения (λ = 180-300 нм). Создал концепцию морфогенетического поля организма, которое создает и поддерживает в живых системах специфическую молекулярную упорядоченность.
Слайд 43
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии При помощи биологических объектов возможно производить индукцию митозов на расстоянии, т. е. можно увеличивать количество митозов в биологическом объекте без непосредственного соприкосновения.
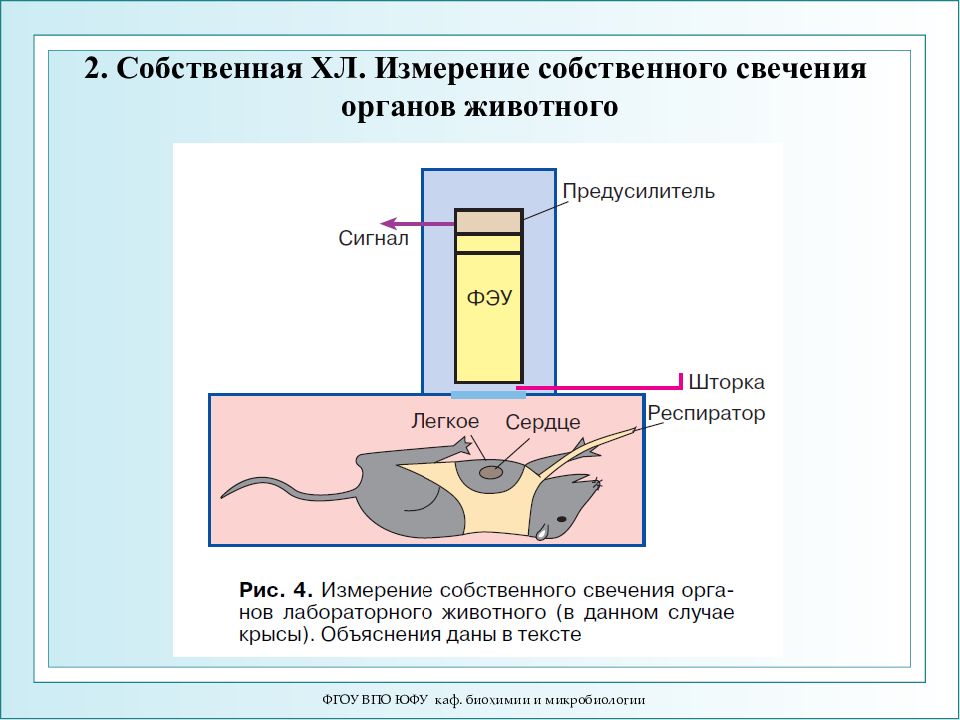
Слайд 44: 2. Собственная ХЛ. Измерение собственного свечения органов животного
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 2. Собственная ХЛ. Измерение собственного свечения органов животного
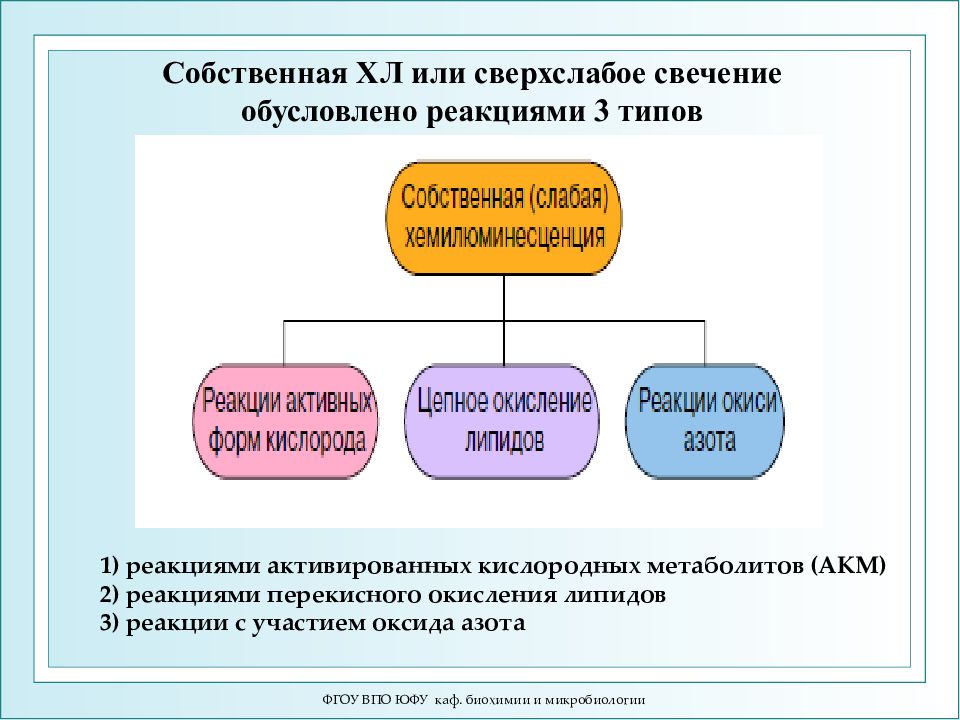
Слайд 45: 1) реакциями активированных кислородных метаболитов (АКМ) 2) реакциями перекисного окисления липидов 3) реакции с участием оксида азота
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 1) реакциями активированных кислородных метаболитов (АКМ) 2) реакциями перекисного окисления липидов 3) реакции с участием оксида азота Собственная ХЛ или сверхслабое свечение обусловлено реакциями 3 типов
Слайд 46: Реакции, сопровождающиеся сверхслабым свечением
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Реакции, сопровождающиеся сверхслабым свечением
Слайд 47
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 3.Биолюминесценция (БХЛ)— способность живых организмов светиться, которая достигается самостоятельно или с помощью симбионтов. Это видимое глазом свечение, связанное со специфическими ферментативными реакциями, при которых освобождающаяся энергия выделяется в виде света. Специфический фермент - люцифераза, а его субстрат – люциферин. БХЛ была открыта в 1887 г. Р. Дюбуа, который показал, что за БХЛ отвечают 2 фракции: 1)низкомолекулярная, устойчивая к нагреванию - люциферин ; 2) белковая, инактивирующаяся при нагревании, - люцифераза. Люциферины окисляются в присутствии люциферазы с образованием оксилюциферина и фотона.
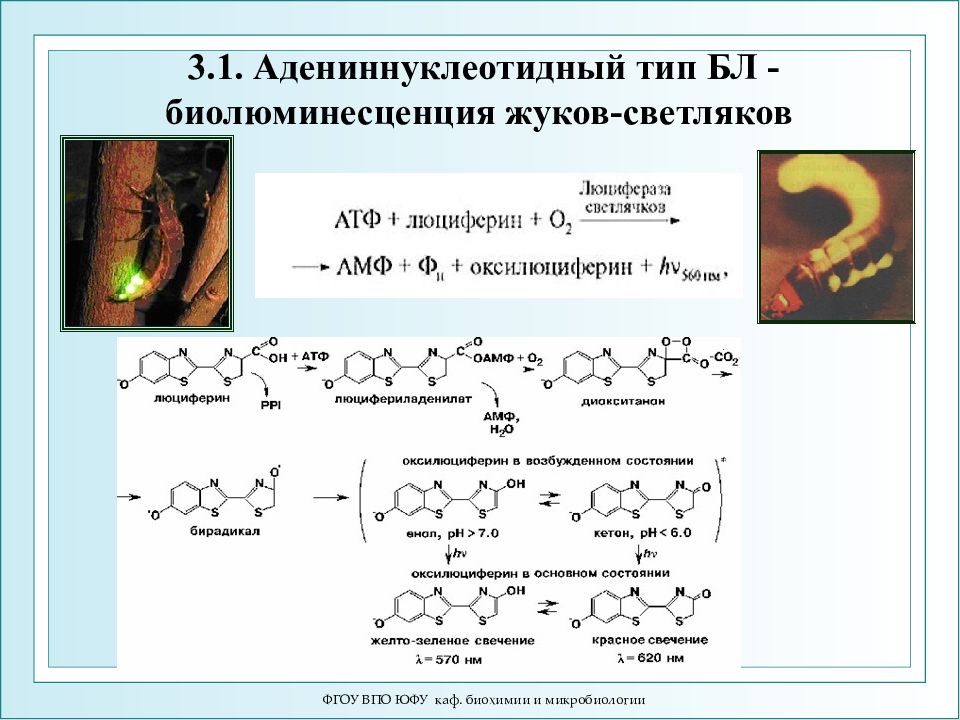
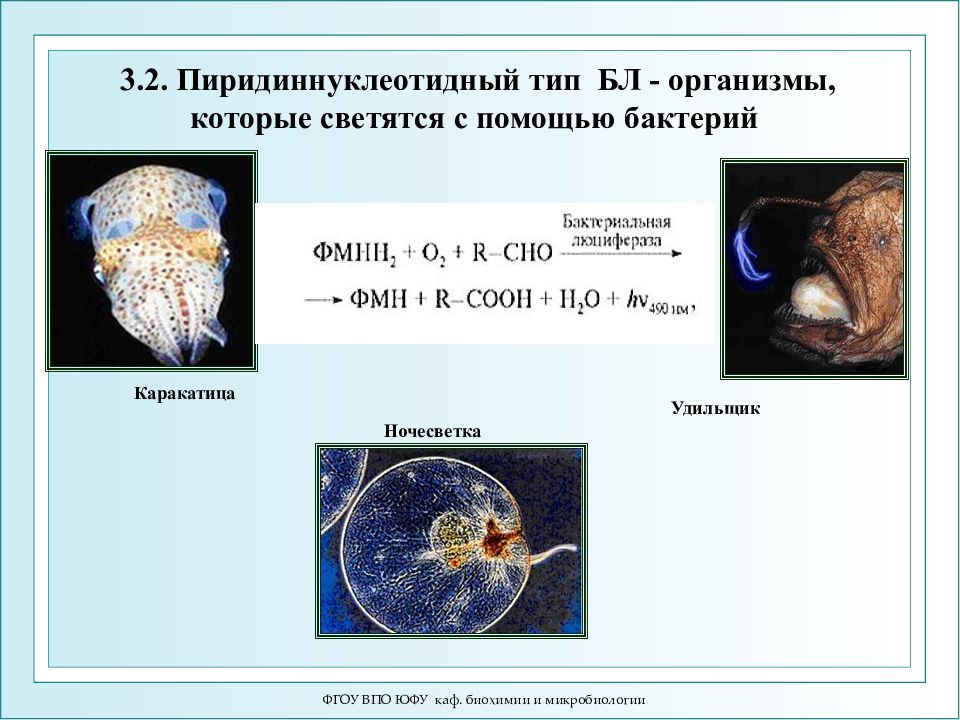
Слайд 48: Типы биолюминесценции (БЛ): 3.1.Адениннуклеотидная ЛН 2 + АТФ + О 2 → оксиЛ * +АМФ + СО 2 + Н 2 О + hν ↑ (λ=560 нм) 3.2.Пиридиннуклеотидная RCHO + O 2 + НАДН 2 + ФМН 2 → RCOOH + Н 2 О + НАДН + + ФМН + hν ↑ ( λ =490 нм) 3.3.Фотопротеины Целентеразин + Ca2+ = Целентерамид* + CO2 = Целентеразин + hν (469 нм)
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Типы биолюминесценции (БЛ): 3.1.Адениннуклеотидная ЛН 2 + АТФ + О 2 → оксиЛ * +АМФ + СО 2 + Н 2 О + hν ↑ (λ=560 нм) 3.2.Пиридиннуклеотидная RCHO + O 2 + НАДН 2 + ФМН 2 → RCOOH + Н 2 О + НАДН + + ФМН + hν ↑ ( λ =490 нм) 3.3.Фотопротеины Целентеразин + Ca2+ = Целентерамид* + CO2 = Целентеразин + hν (469 нм)
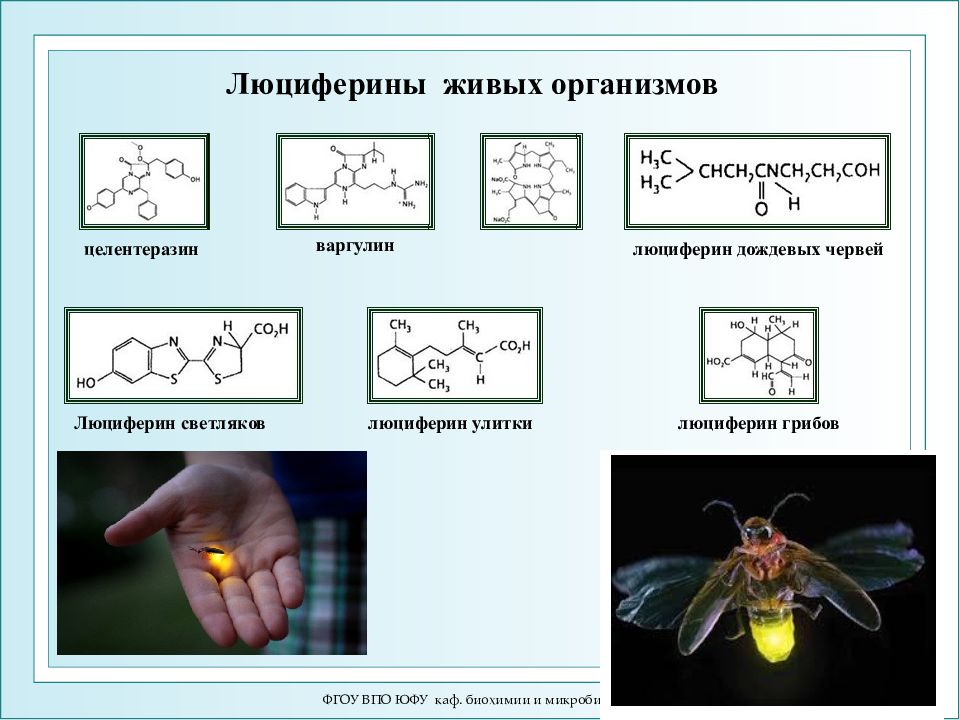
Слайд 49: Люциферины живых организмов
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Люциферины живых организмов Люциферин светляков люциферин дождевых червей целентеразин варгулин люциферин улитки люциферин грибов
Слайд 50
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 3.1. Адениннуклеотидный тип БЛ - биолюминесценция жуков-светляков
Слайд 51
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Каракатица Каракатица Ночесветка Удильщик 3.2. Пиридиннуклеотидный тип БЛ - организмы, которые светятся с помощью бактерий
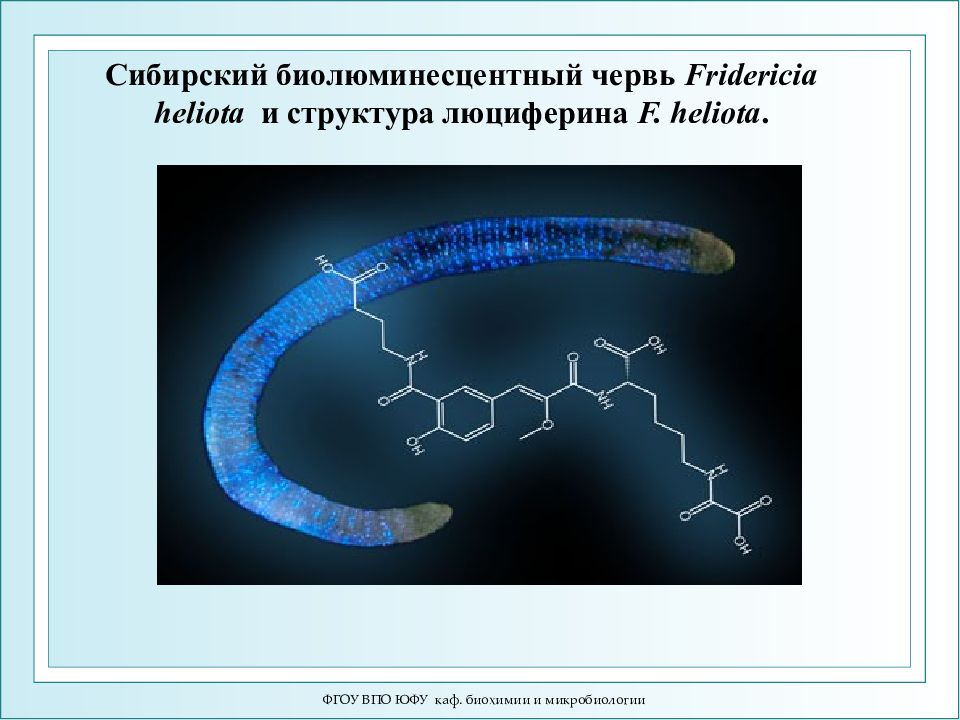
Слайд 52: Сибирский биолюминесцентный червь Fridericia heliota и структура люциферина F. heliota
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Сибирский биолюминесцентный червь Fridericia heliota и структура люциферина F. heliota.
Слайд 53
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 3.3. Фотопротеины - белки, способные к люминесценции (биолюминесценция медузы эквореи) Экворин — люминесцентный белок из медузы эквореи ( Aequorea victoria ) и некоторых других морских организмов. Впервые выделен в 1961—1962 годах американскими учеными Джонсоном и Шимомурой. Состоит из белковой части (апопротеина) и простетической группы целентеразина Люминесцирует в присутствии ионов кальция. целентеразин
Слайд 54
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Фотопротеины Исследование биолюминесцентной системы медузы Aequorea victoria Осама Шимомурой привели к открытию 2 белков – Са-регулируемого фотопротеина экворина и зеленого флуоресцирующего белка ( GFP). Биолюминесценция экворина инициируется ионами Са2+ и не зависит от кислорода. Фотопротеин состоит из апопротеина и простетической группы – целентеразина (имидазолпиразина).
Слайд 55
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Проблема, с которой всегда сталкиваются специалисты по биолюминесценции, — получение достаточного количества биомассы для выделения и исследования веществ, участвующих в реакции. Характерно в этом смысле описание сбора материала на биостанции Фрайди Харбор, которое дал Шимомура в своей нобелевской лекции: «Мы начинали собирать медуз в шесть утра, а в восемь - часть нашей группы принималась отрезать кольца (краевые участки зонтика медузы, наиболее ярко светящиеся). Всю вторую половину дня мы проводили, экстрагируя экворин из колец. Потом мы снова собирали медуз с семи до девяти вечера, на завтра. Наша лаборатория выглядела как фабрика по переработке медуз, и пахло в ней медузами».
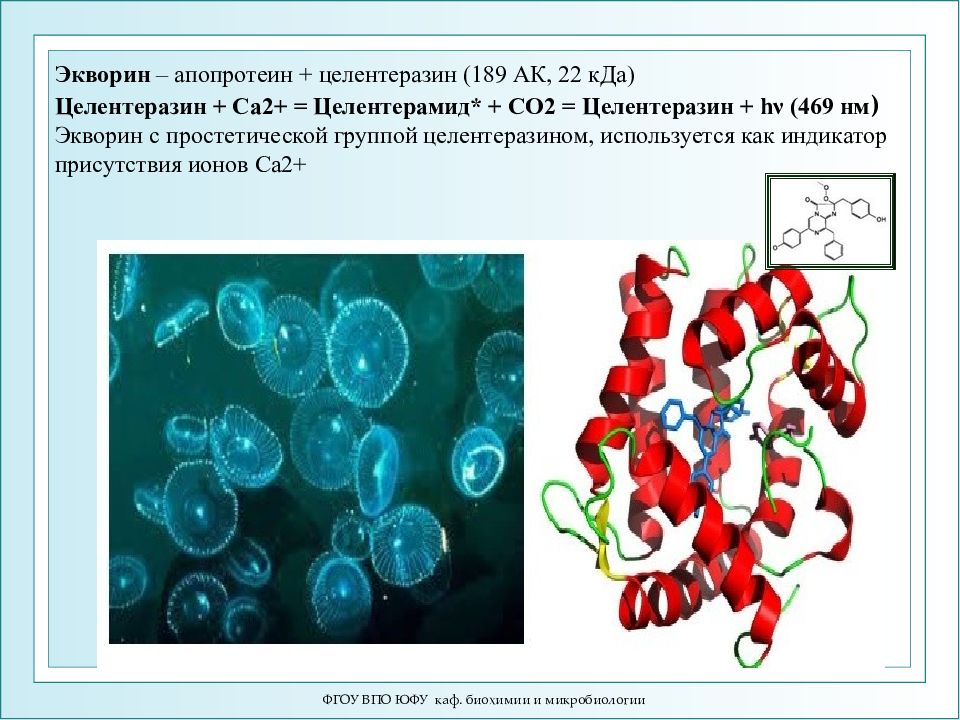
Слайд 56: Экворин – апопротеин + целентеразин (189 АК, 22 кДа) Целентеразин + Ca2+ = Целентерамид* + CO2 = Целентеразин + hν (469 нм ) Экворин с простетической группой целентеразином, используется как индикатор присутствия ионов Са2+
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 57
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Шимомура обнаружил, что выделенный из медузы и очищенный экворин in vitro излучает синий свет, в то время как живая медуза светится зелёным. Дальнейшие исследования показали, что за зелёное свечение ответственен другой белок — GFP ( green fluorescent protein — зелёный флуоресцентный белок ), флуоресцирующий зелёным светом под действием голубого излучния экворина.
Слайд 59
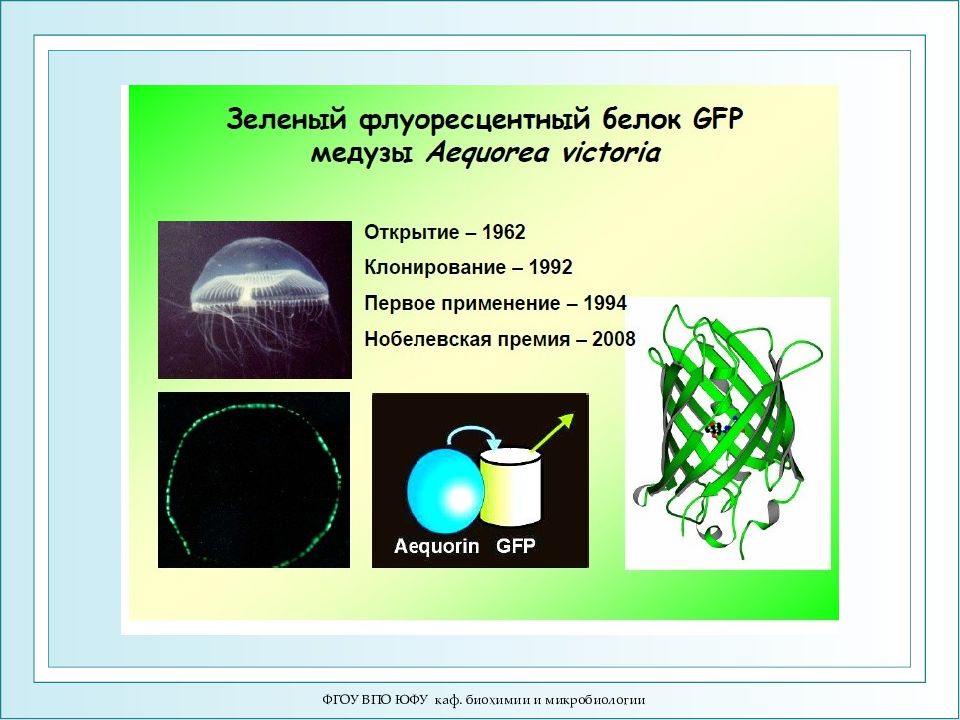
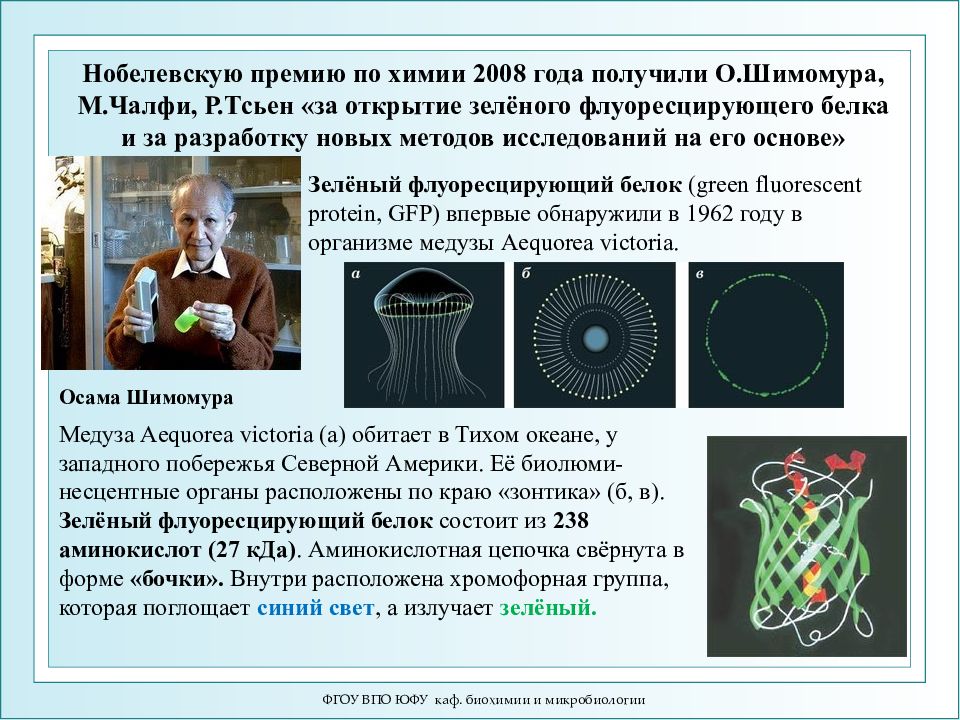
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Осама Шимомура Нобелевскую премию по химии 2008 года получили О.Шимомура, М.Чалфи, Р.Тсьен «за открытие зелёного флуоресцирующего белка и за разработку новых методов исследований на его основе» Зелёный флуоресцирующий белок ( green fluorescent protein, GFP) впервые обнаружили в 1962 году в организме медузы Aequorea victoria. Медуза Aequorea victoria (а) обитает в Тихом океане, у западного побережья Северной Америки. Её биолюми-несцентные органы расположены по краю «зонтика» (б, в). Зелёный флуоресцирующий белок состоит из 238 аминокислот (27 кДа). Аминокислотная цепочка свёрнута в форме «бочки». Внутри расположена хромофорная группа, которая поглощает синий свет, а излучает зелёный.
Слайд 60
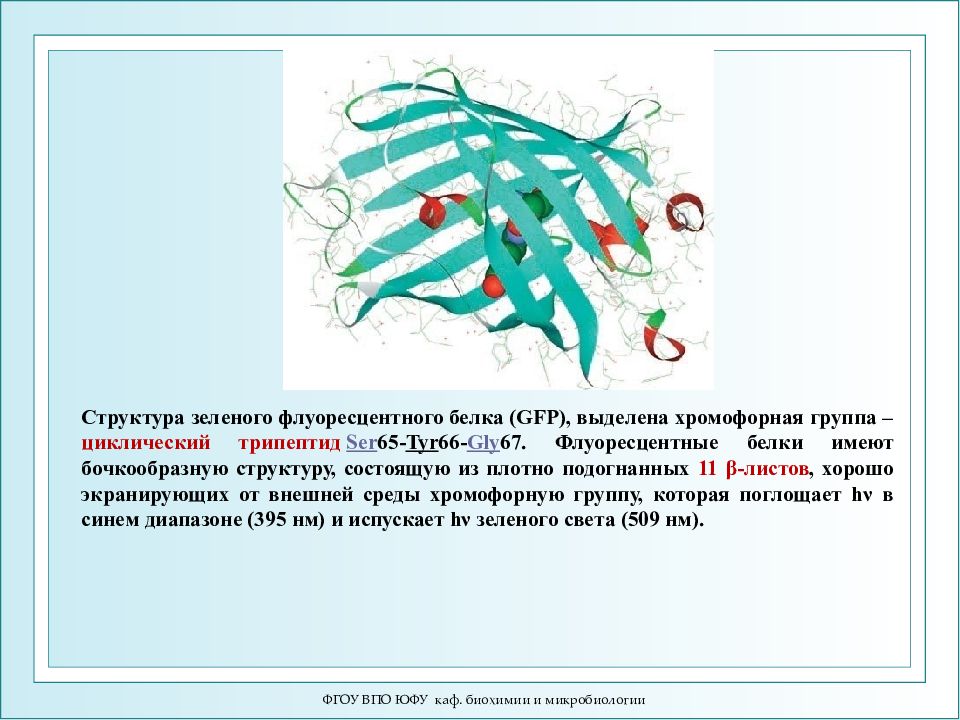
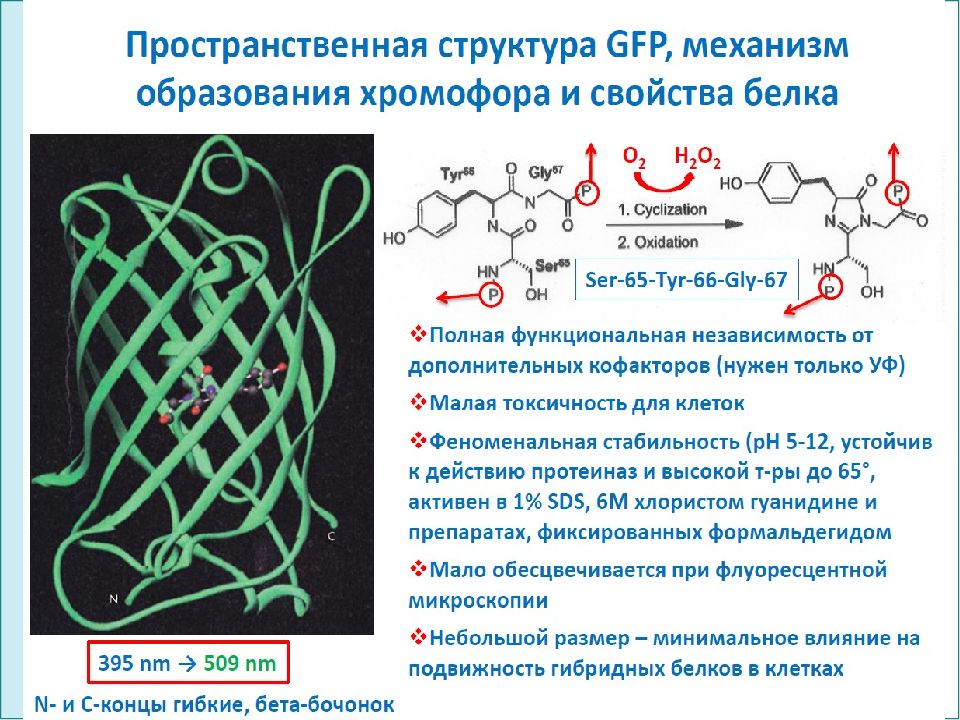
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Структура зеленого флуоресцентного белка (GFP), выделена хромофорная группа – циклический трипептид Ser 65- Tyr 66- Gly 67. Флуоресцентные белки имеют бочкообразную структуру, состоящую из плотно подогнанных 11 β-листов, хорошо экранирующих от внешней среды хромофорную группу, которая поглощает hν в синем диапазоне (395 нм) и испускает hν зеленого света (509 нм).
Слайд 62
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Скульптурная композиция, посвящённая GFP (Вашингтон, США).
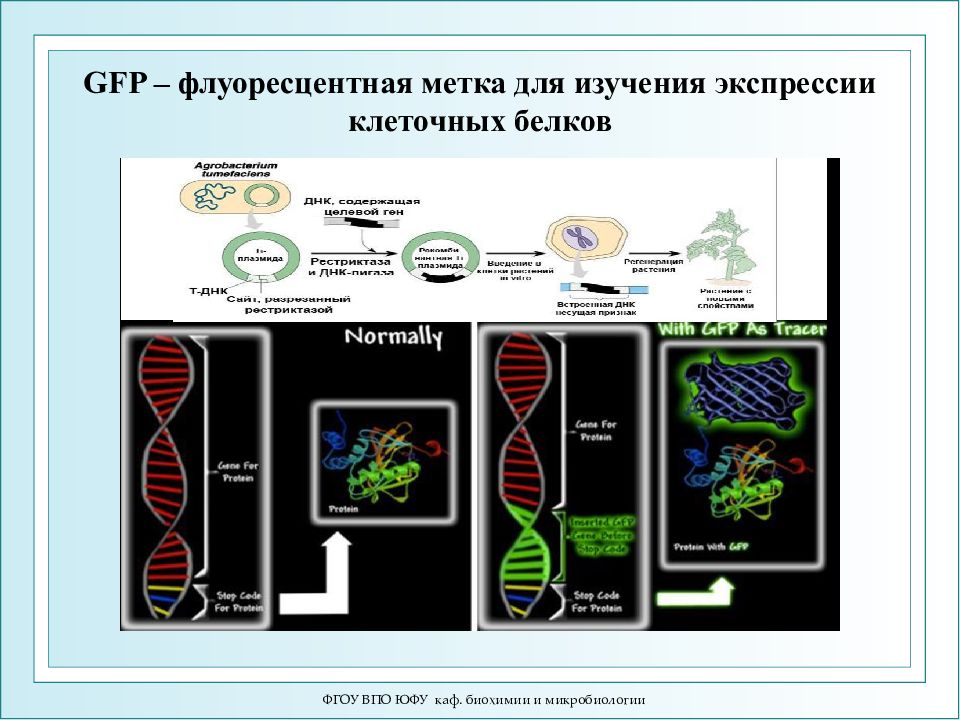
Слайд 63: GFP – флуоресцентная метка для изучения экспрессии клеточных белков
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
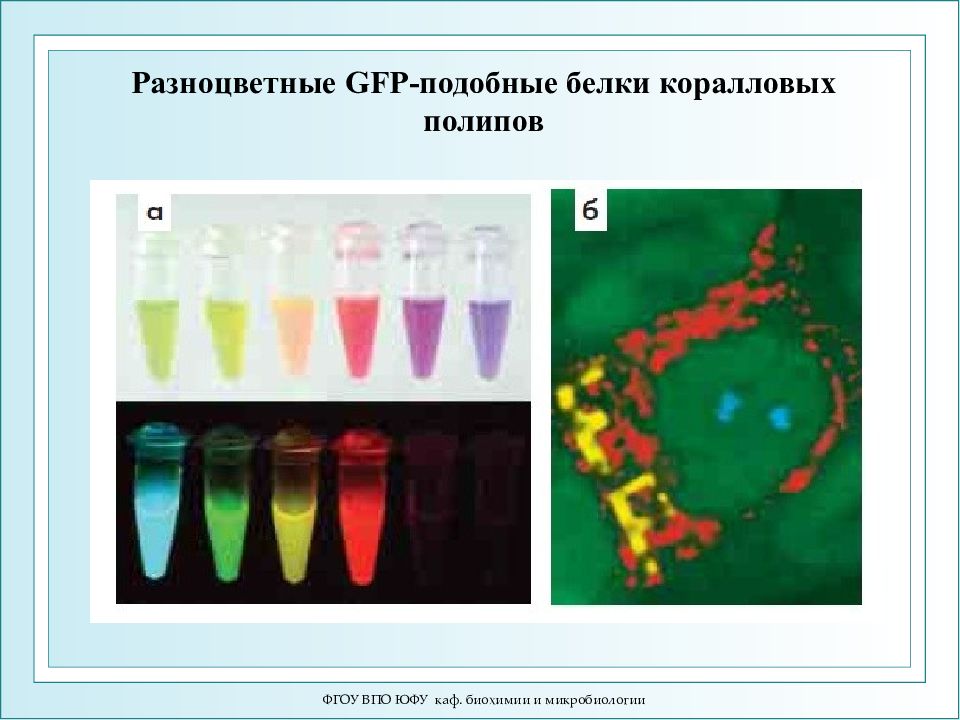
Слайд 64: Разноцветные GFP- подобные белки коралловых полипов
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Разноцветные GFP- подобные белки коралловых полипов
Слайд 65
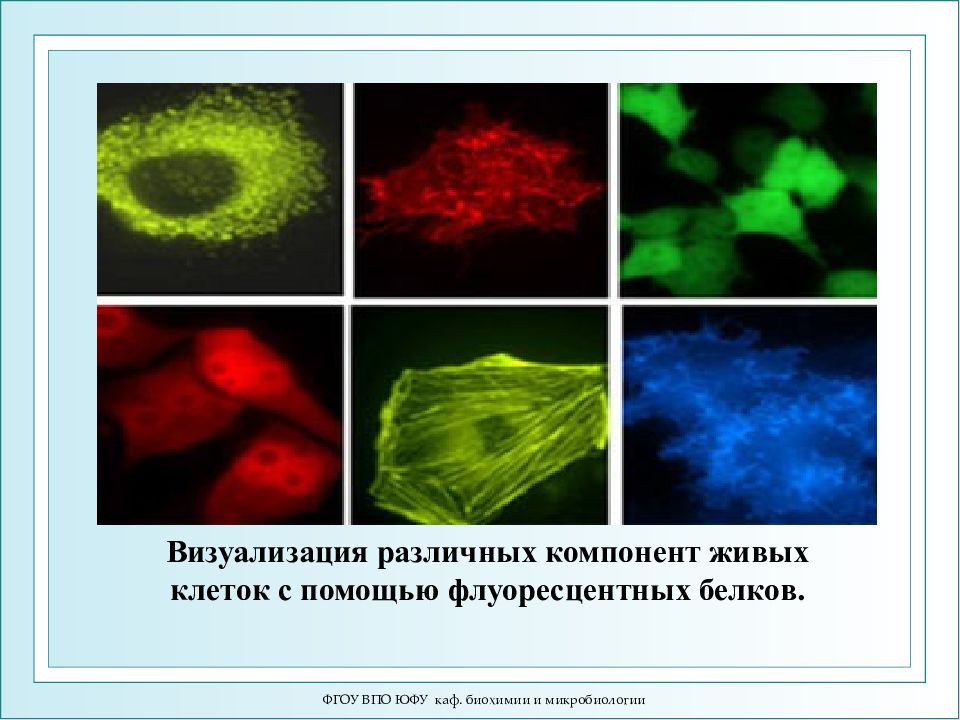
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Визуализация различных компонент живых клеток с помощью флуоресцентных белков.
Слайд 66
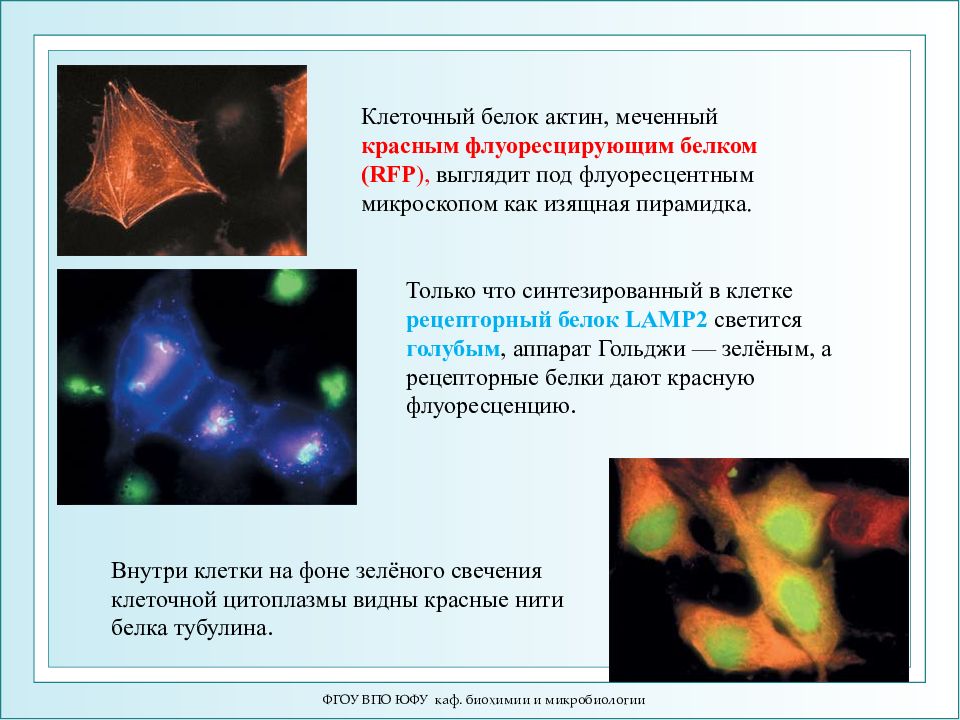
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Клеточный белок актин, меченный красным флуоресцирующим белком (RFP ), выглядит под флуоресцентным микроскопом как изящная пирамидка. Только что синтезированный в клетке рецепторный белок LAMP2 светится голубым, аппарат Гольджи — зелёным, а рецепторные белки дают красную флуоресценцию. Внутри клетки на фоне зелёного свечения клеточной цитоплазмы видны красные нити белка тубулина.
Слайд 67
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Американские ученые создали котов, невосприимчивых к кошачьему вирусу иммунодефицита (ВИК). Чтобы посмотреть, насколько ген, обеспечивающий устойчивость, активен в разных клетках животного, исследователи добавили к нему ген флуоресцирующего белка, благодаря которому генно-инженерные коты в ультрафиолетовых лучах светятся зеленым светом. С помощью вирусного вектора внедрили в ДНК кошачьей яйцеклетки ген противовирусного фактора макаки TRIMCyp, снабжающего клетки устойчивостью к вирусу иммунодефицита. Чтобы проверить, не используя сложных инструментальных методик, насколько этот ген будет активен в различных тканях трансгенных животных, ученые добавили к нему ген зеленого флуоресцирующего белка медузы Aequorea victoria. Зеленые кошки не болеют СПИДом
Слайд 68
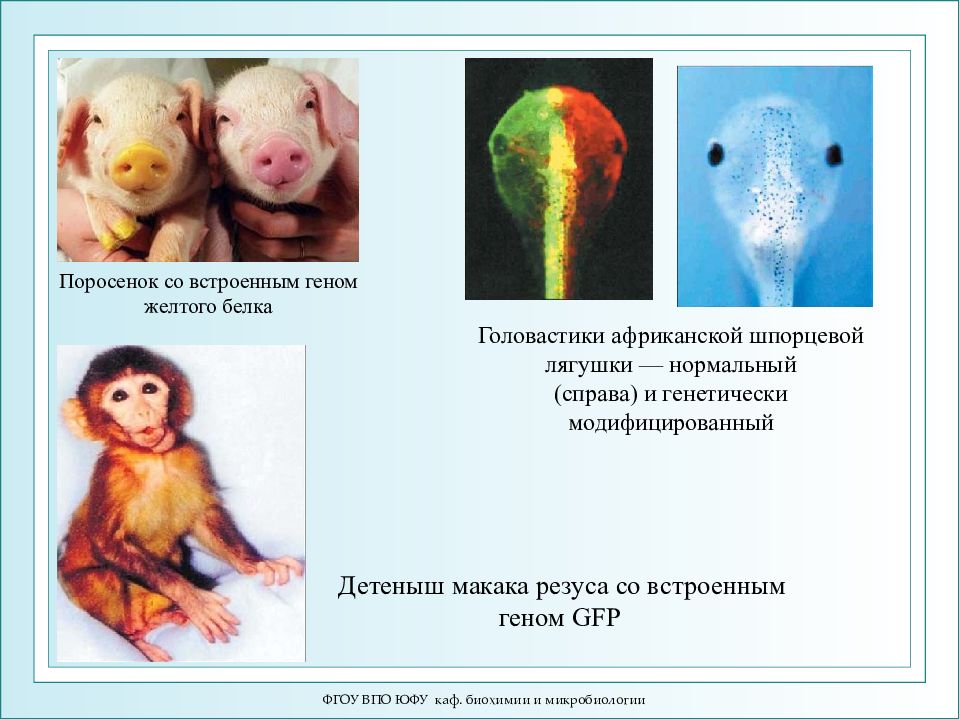
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Поросенок со встроенным геном желтого белка Головастики африканской шпорцевой лягушки — нормальный (справа) и генетически модифицированный Детеныш макака резуса со встроенным геном GFP
Слайд 69
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Флуоресцентное «творчество». А. «Рисунок» бактериями, экспрессирующими гены различных флуоресцентных белков, на чашке петри. Б. Мыши, несущие ген зеленого флуоресцентного белка, и обычные мыши.
Слайд 70
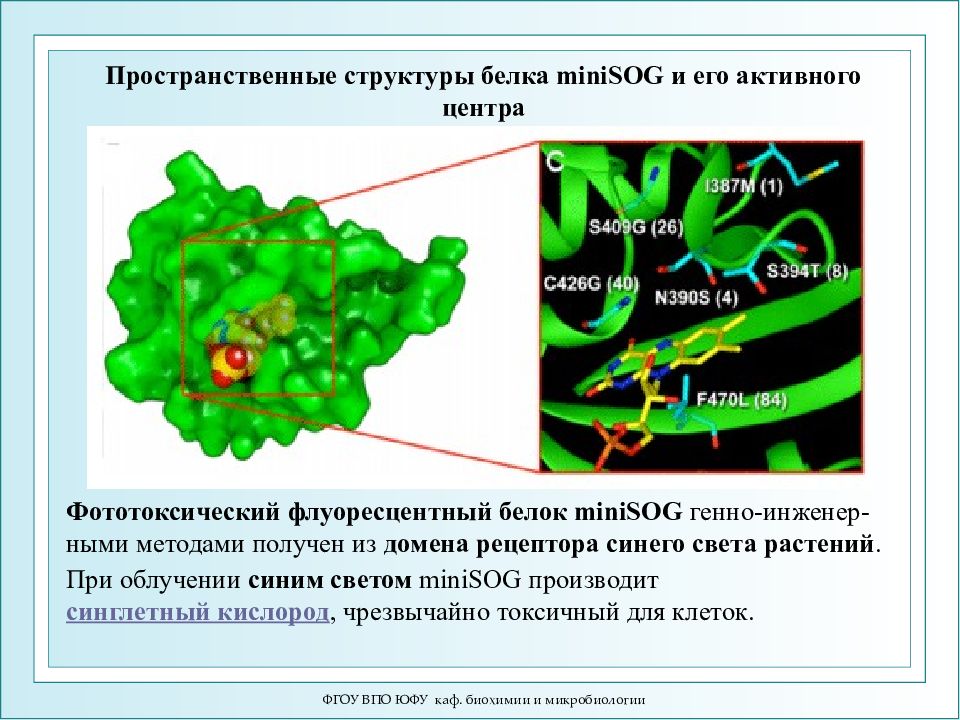
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Пространственные структуры белка miniSOG и его активного центра При облучении синим светом miniSOG производит синглетный кислород, чрезвычайно токсичный для клеток. Фототоксический флуоресцентный белок miniSOG генно-инженер-ными методами получен из домена рецептора синего света растений.
Слайд 71
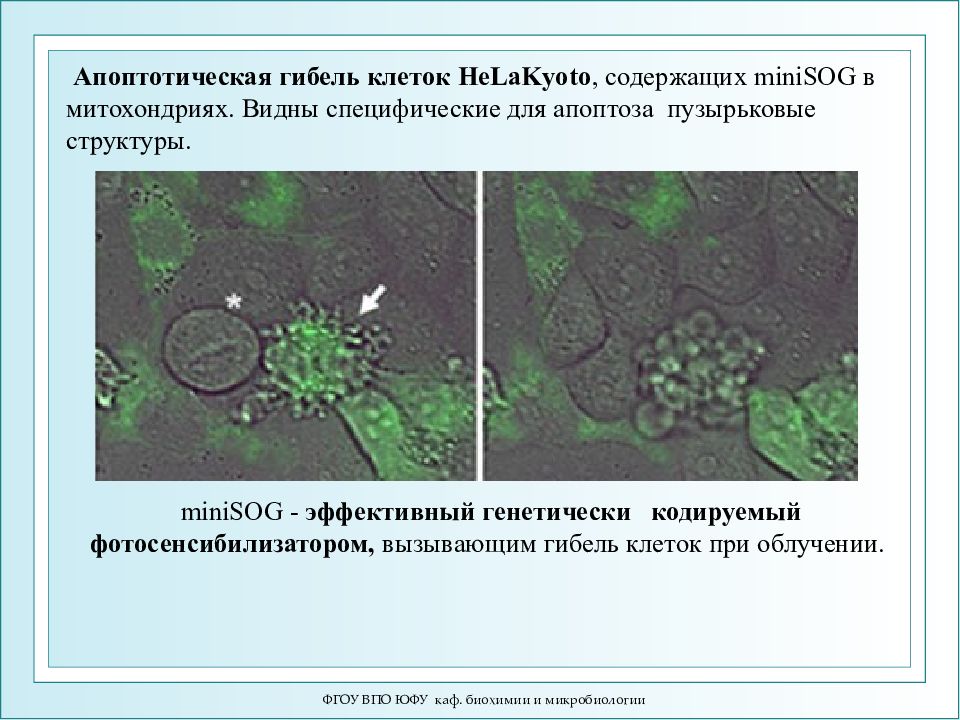
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Апоптотическая гибель клеток HeLaKyoto, содержащих miniSOG в митохондриях. Видны специфические для апоптоза пузырьковые структуры. miniSOG - эффективный генетически кодируемый фотосенсибилизатором, вызывающим гибель клеток при облучении.
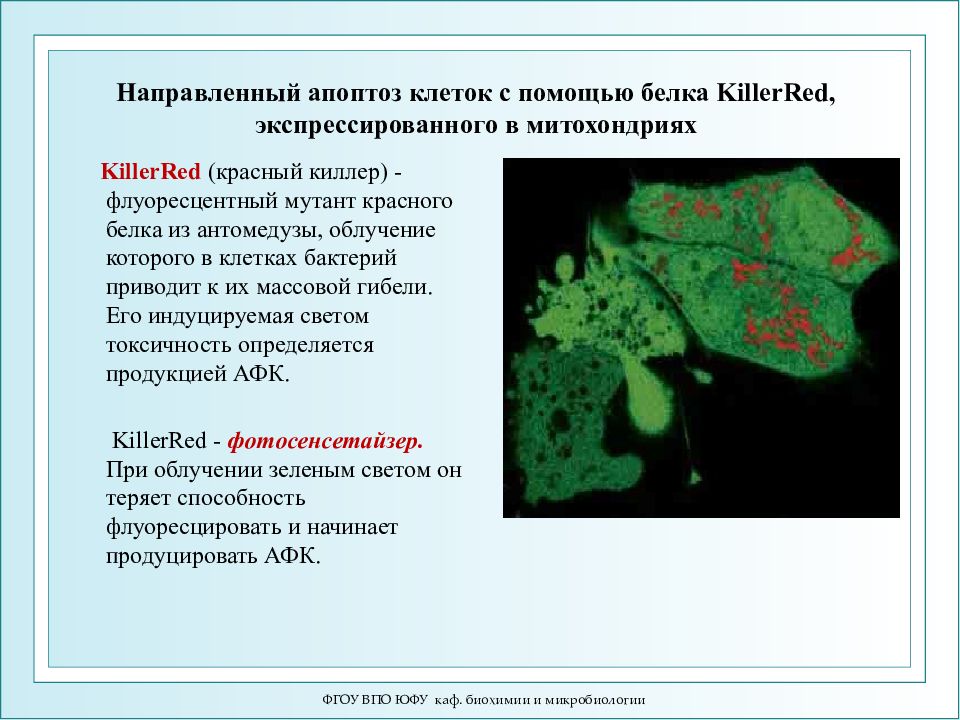
Слайд 72: Направленный апоптоз клеток с помощью белка KillerRed, экспрессированного в митохондриях
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Направленный апоптоз клеток с помощью белка KillerRed, экспрессированного в митохондриях KillerRed (красный киллер) - флуоресцентный мутант красного белка из антомедузы, облучение которого в клетках бактерий приводит к их массовой гибели. Его индуцируемая светом токсичность определяется продукцией АФК. KillerRed - фотосенсетайзер. При облучении зеленым светом он теряет способность флуоресцировать и начинает продуцировать АФК.
Слайд 74: Биолюминесцентный имиджинг (БИ)
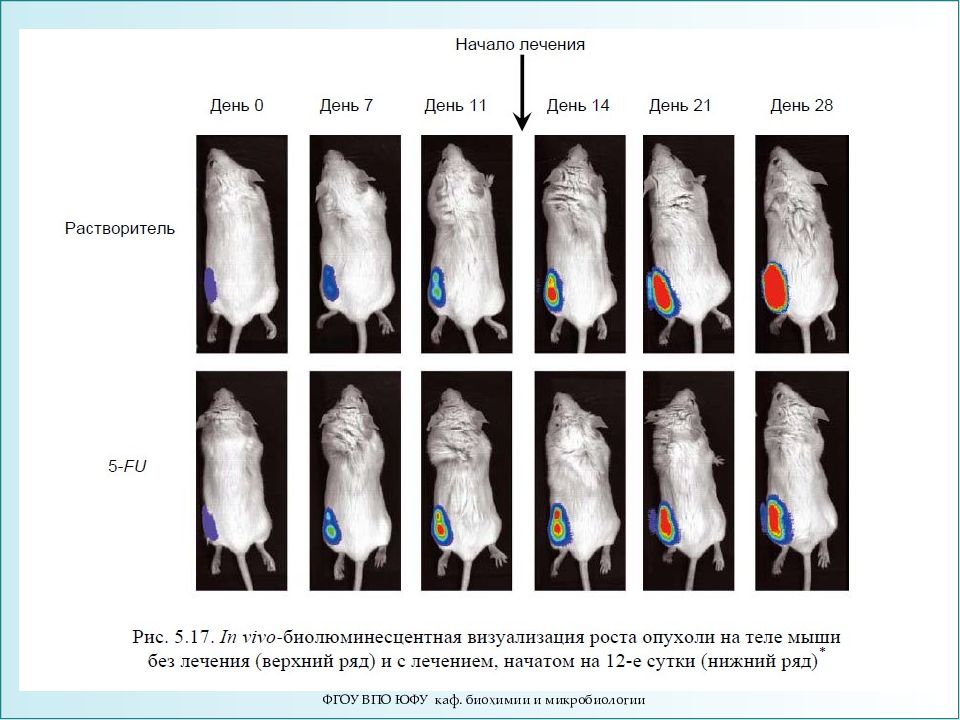
БИ основан на реакции окисления люциферазой субстрата, которая сопровождается испусканием кванта света. ДНК, кодирующую люциферазу, встраивают в геном целевых клеток, а субстрат вводится системно. БИ с использованием маркера luc2 - быстрый, крайне чувствительный и неинвазивный метод исследования, в том числе и онкологических процессов. Продемонстрирована возможность изучения : - генной экспрессии, - активности клеточных рецепторов, - путей сигнальной передачи, - процессинга РНК, - белок-белковых взаимодействий, - жизнедеятельности стволовых клеток, - процесса апоптоза ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
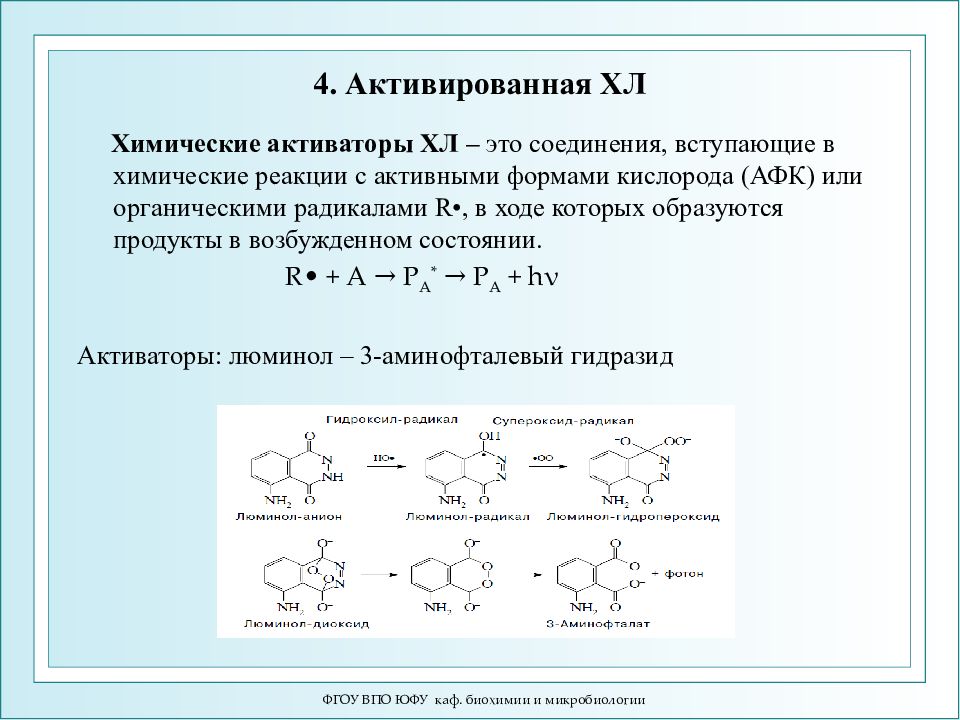
Слайд 75: 4. Активированная ХЛ
Химические активаторы ХЛ – это соединения, вступающие в химические реакции с активными формами кислорода (АФК) или органическими радикалами R•, в ходе которых образуются продукты в возбужденном состоянии. R• + А → Р А * → Р А + hν Активаторы: люминол – 3-аминофталевый гидразид ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 76
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Биофизика зрительного восприятия 1877 г. - Франц Болл открыл зрительный пурпур – родопсин сетчатки глаза, наблюдая выцветание сетчатки лягушки при освещении. 1967 г. – Джордж Уолд - Нобелевская премия по физиологии и медицине « за открытия, связанные с первичными физиологическими и химическими зрительными процессами »
Слайд 77
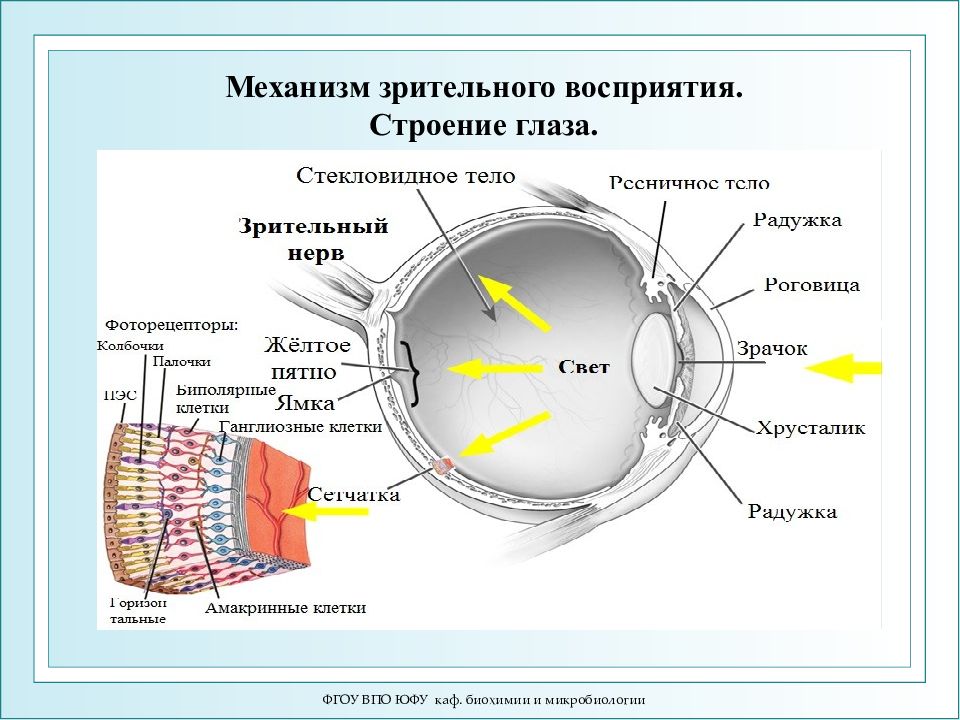
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Механизм зрительного восприятия. Строение глаза.
Слайд 78
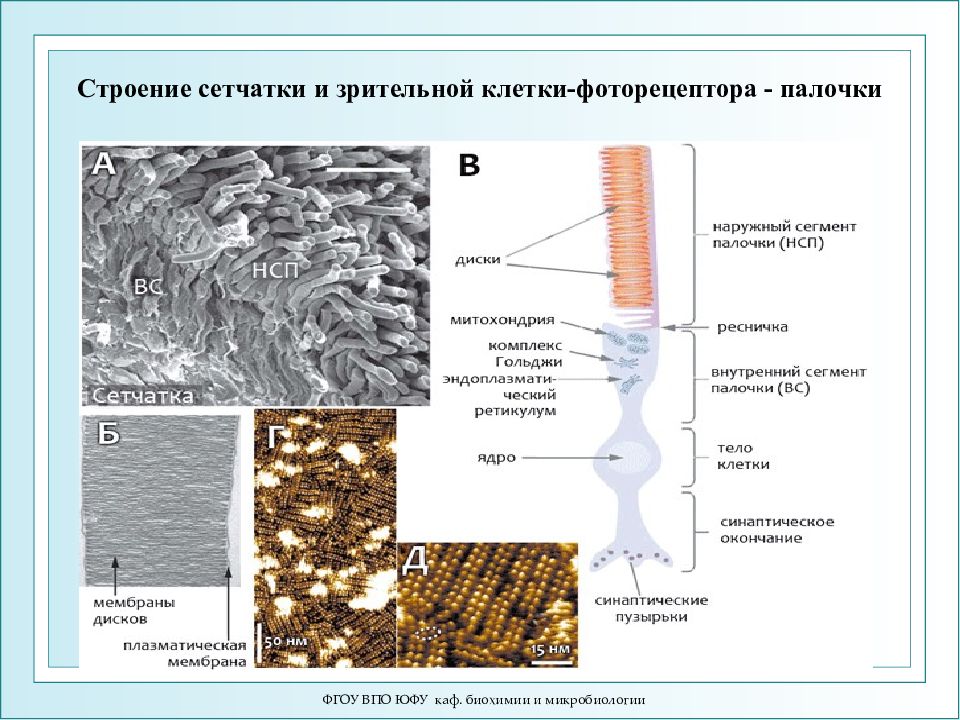
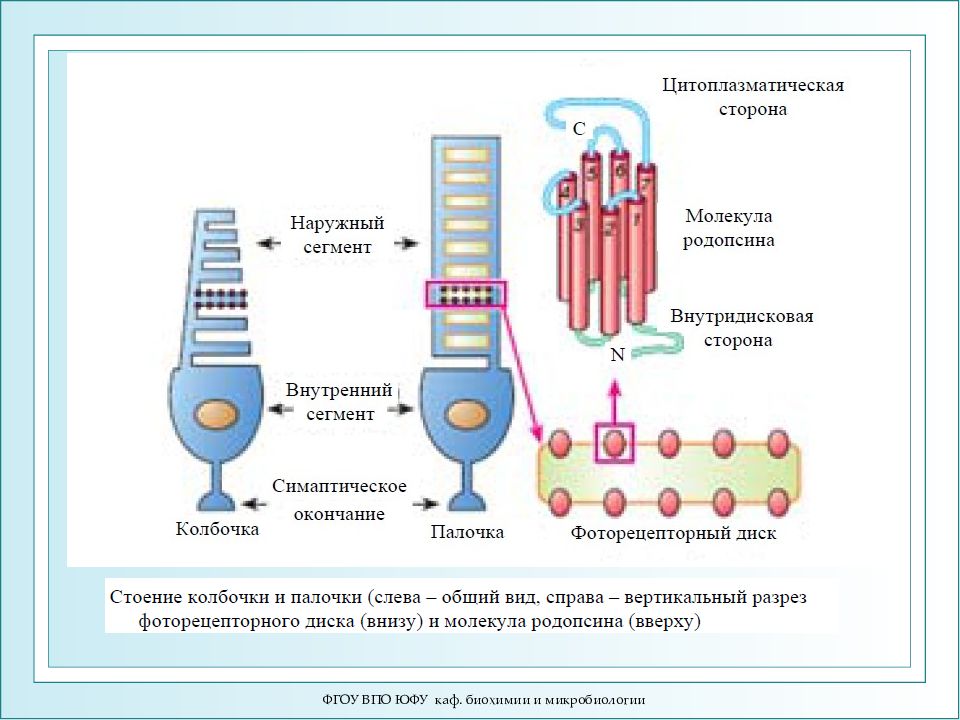
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Строение сетчатки и зрительной клетки-фоторецептора - палочки
Слайд 79
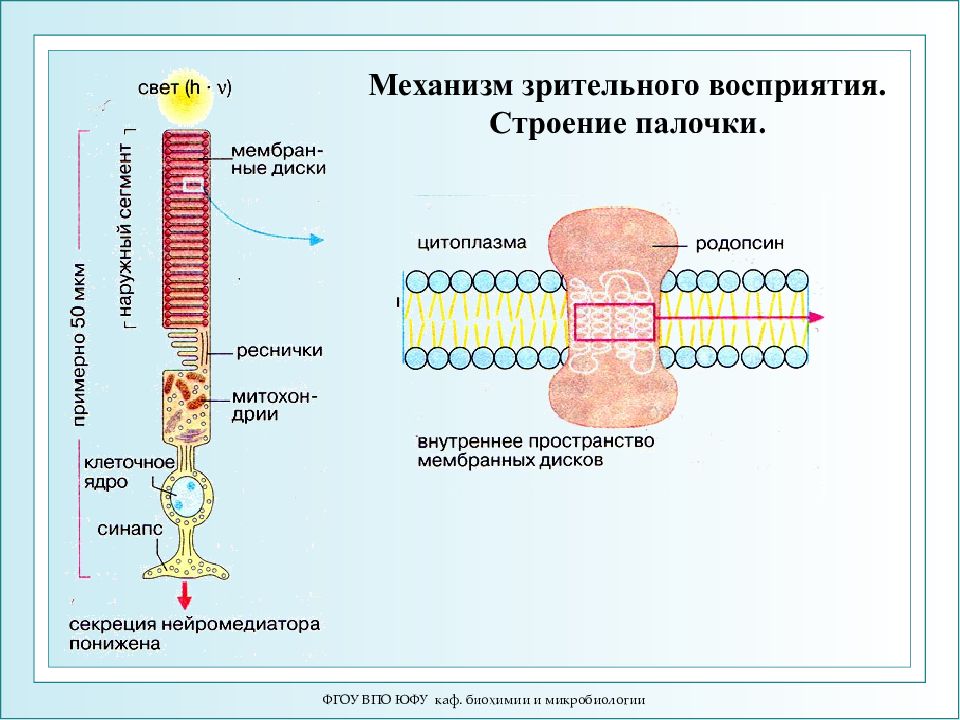
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Механизм зрительного восприятия. Строение палочки.
Слайд 80
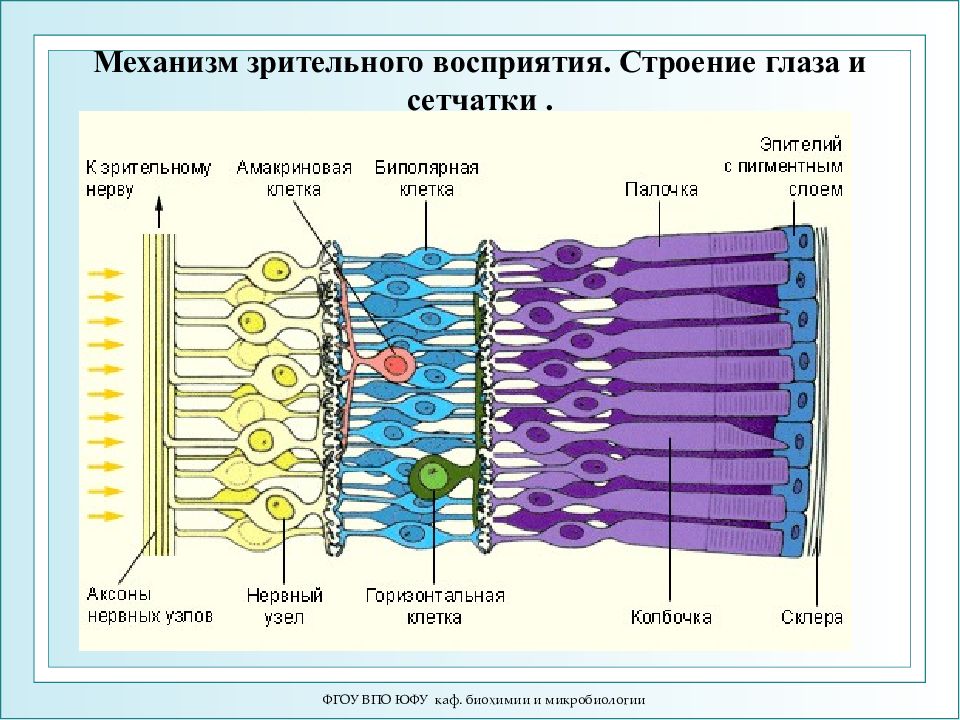
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Механизм зрительного восприятия. Строение глаза и сетчатки.
Слайд 82
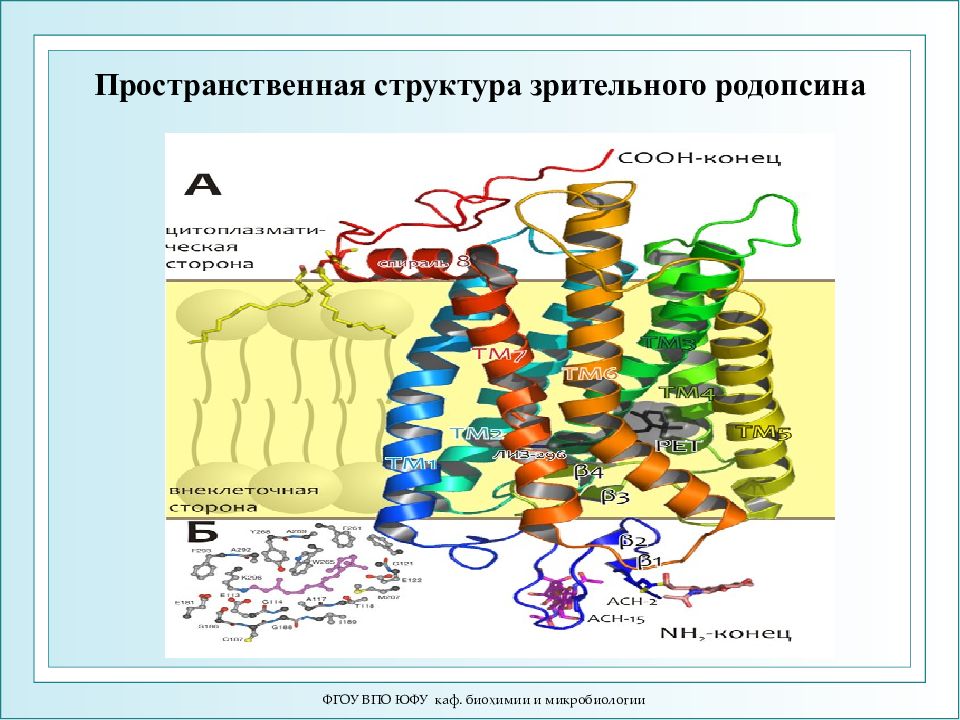
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Пространственная структура зрительного родопсина
Слайд 83
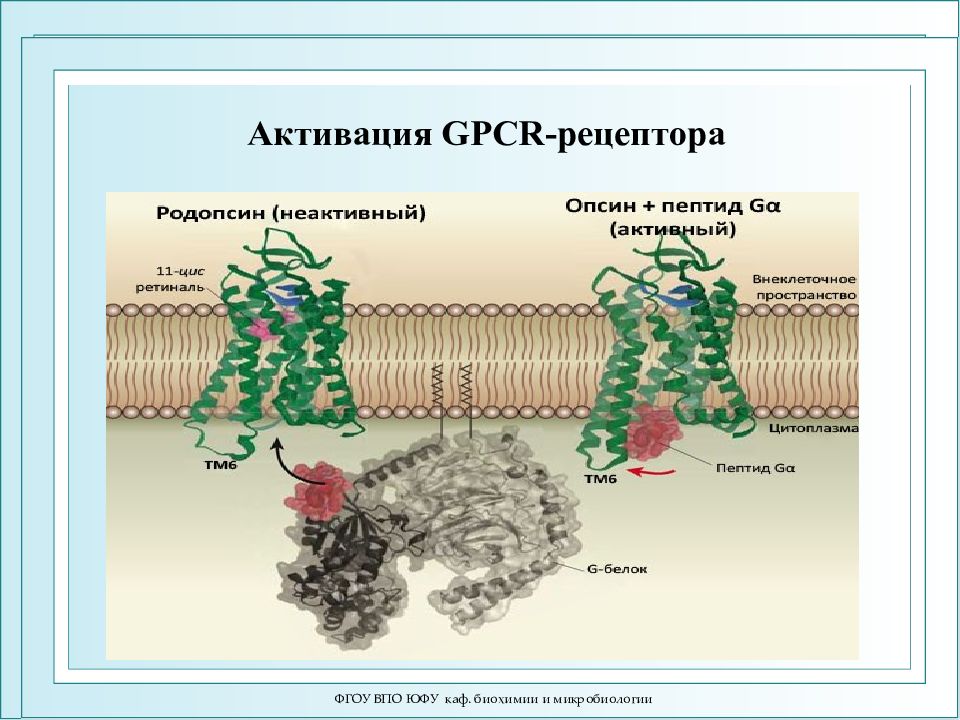
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Лауреаты Нобелевской премии 2012 г. по химии «за раскрытие подробной схемы того, как работают рецепторы, связанные с G -белками ( GPCRs )» Роберт Лефковиц Брайан Кобилка
Слайд 84
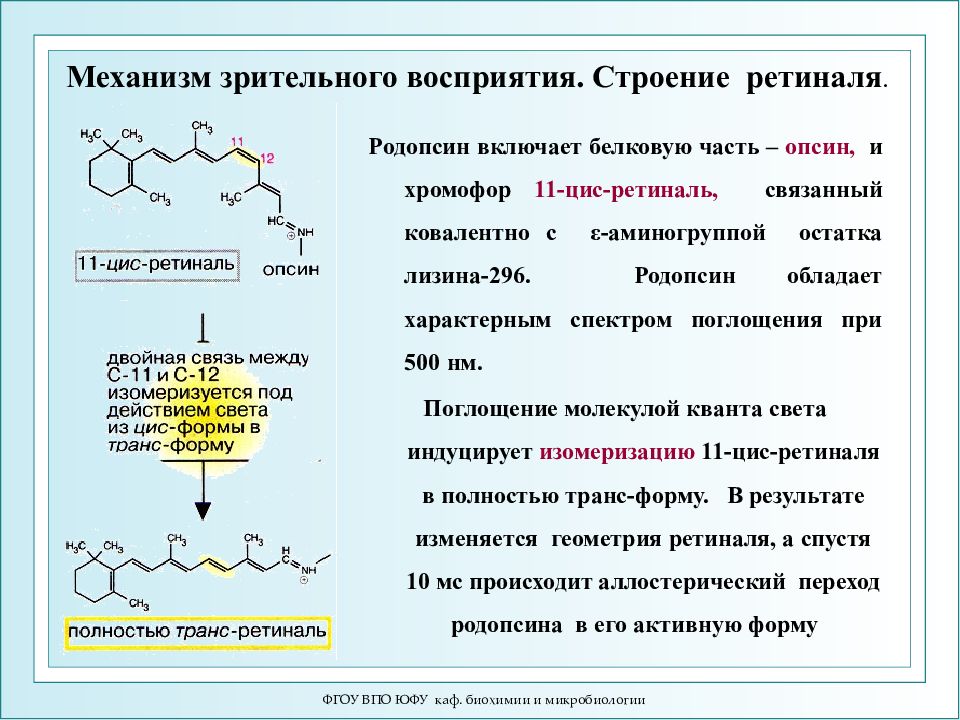
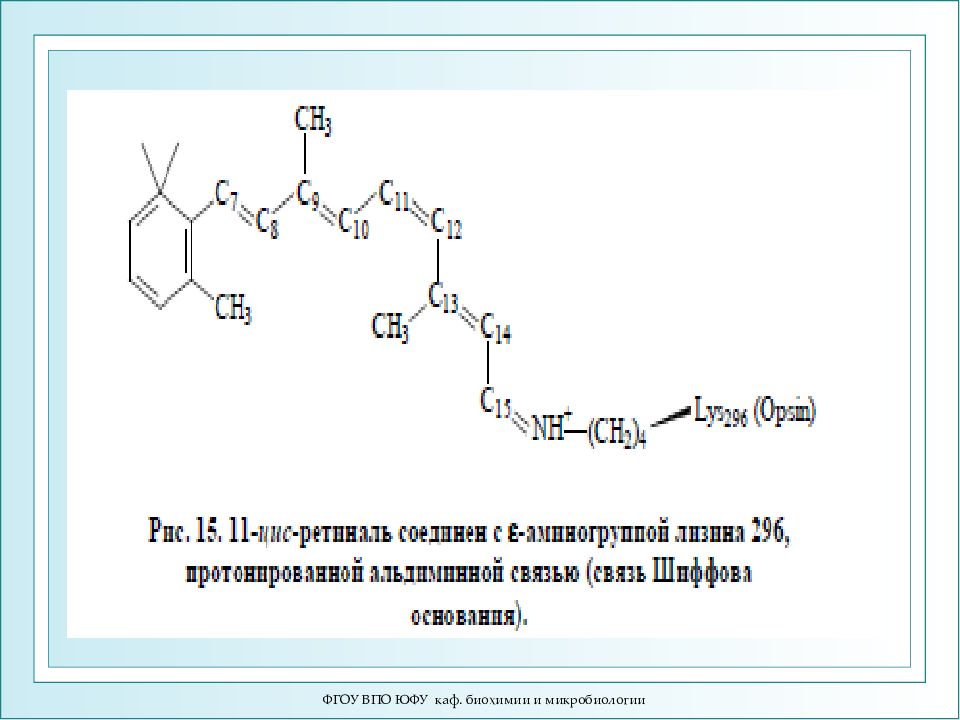
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Механизм зрительного восприятия. Строение ретиналя. Родопсин включает белковую часть – опсин, и хромофор 11-цис-ретиналь, связанный ковалентно с ε -аминогруппой остатка лизина-296. Родопсин обладает характерным спектром поглощения при 500 нм. Поглощение молекулой кванта света индуцирует изомеризацию 11-цис-ретиналя в полностью транс-форму. В результате изменяется геометрия ретиналя, а спустя 10 мс происходит аллостерический переход родопсина в его активную форму
Слайд 85
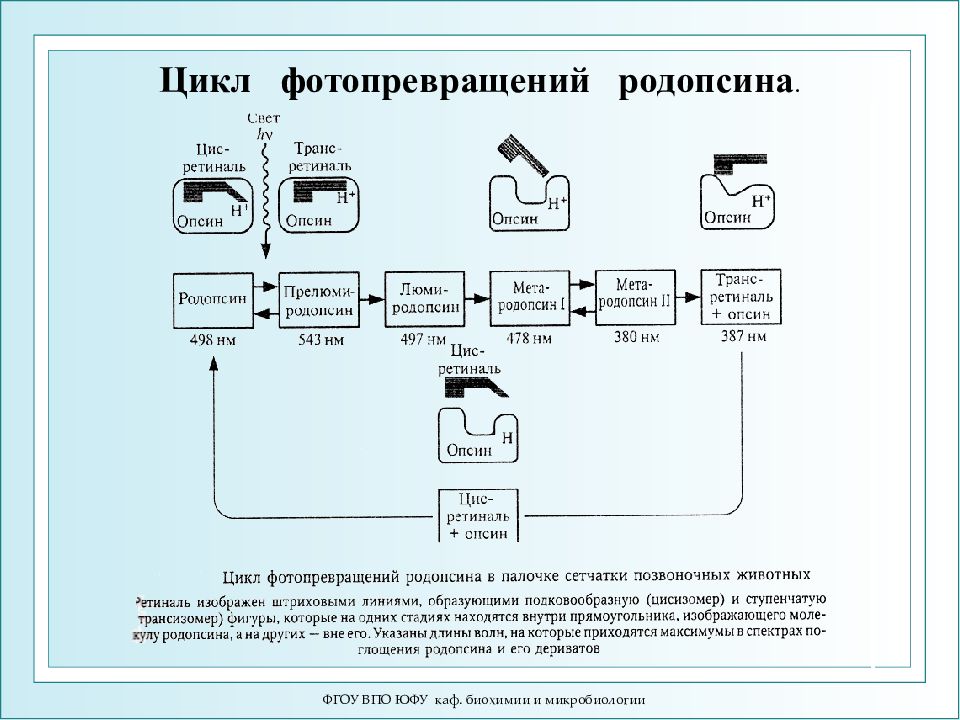
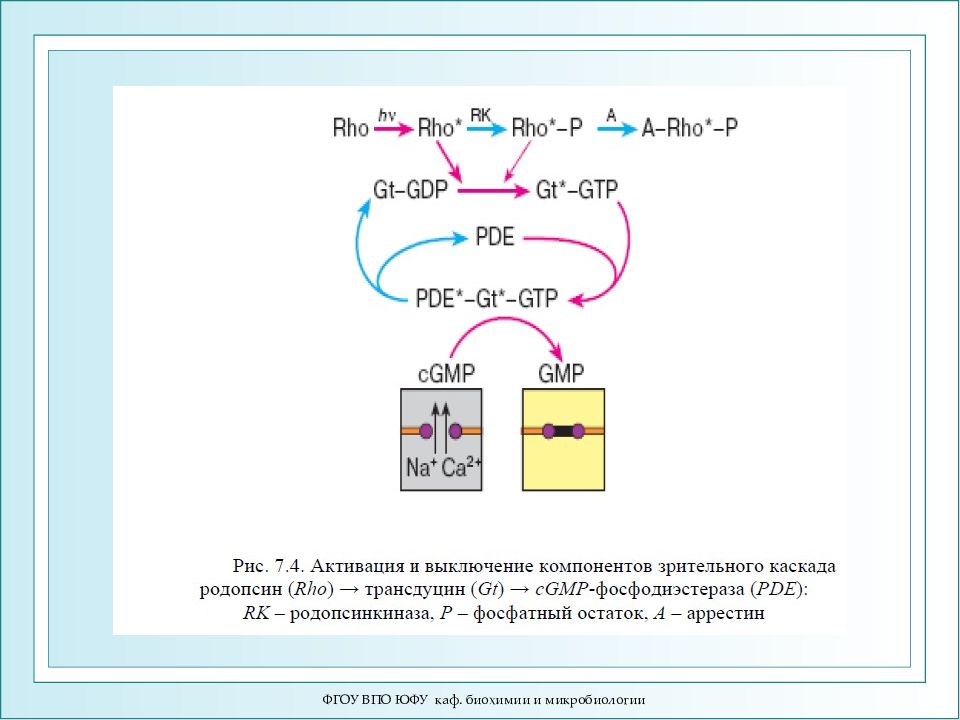
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Цикл фотопревращений родопсина.
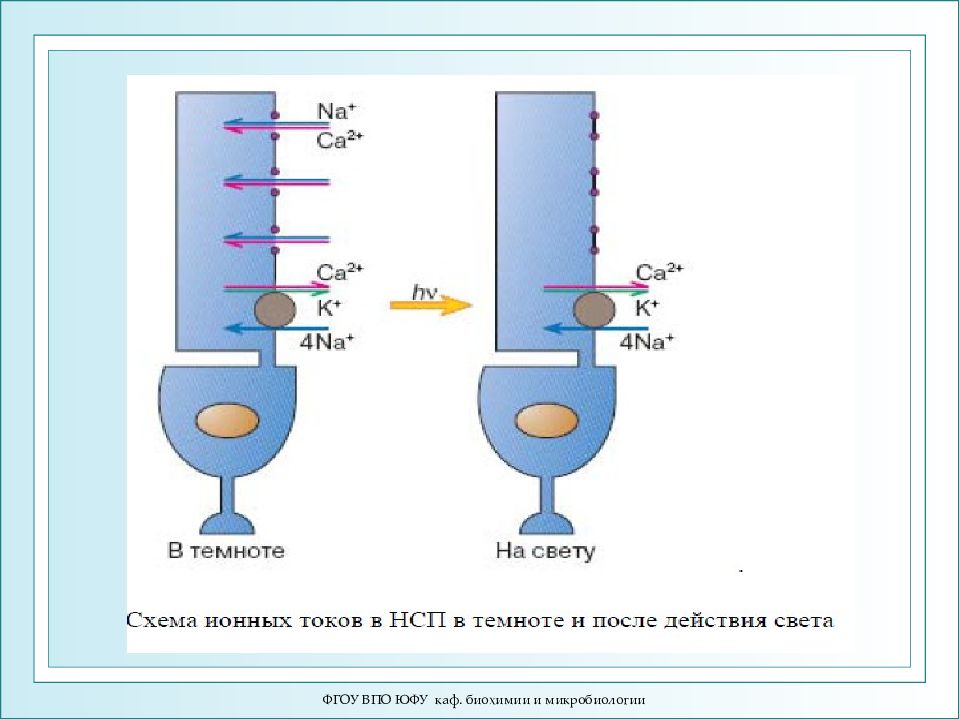
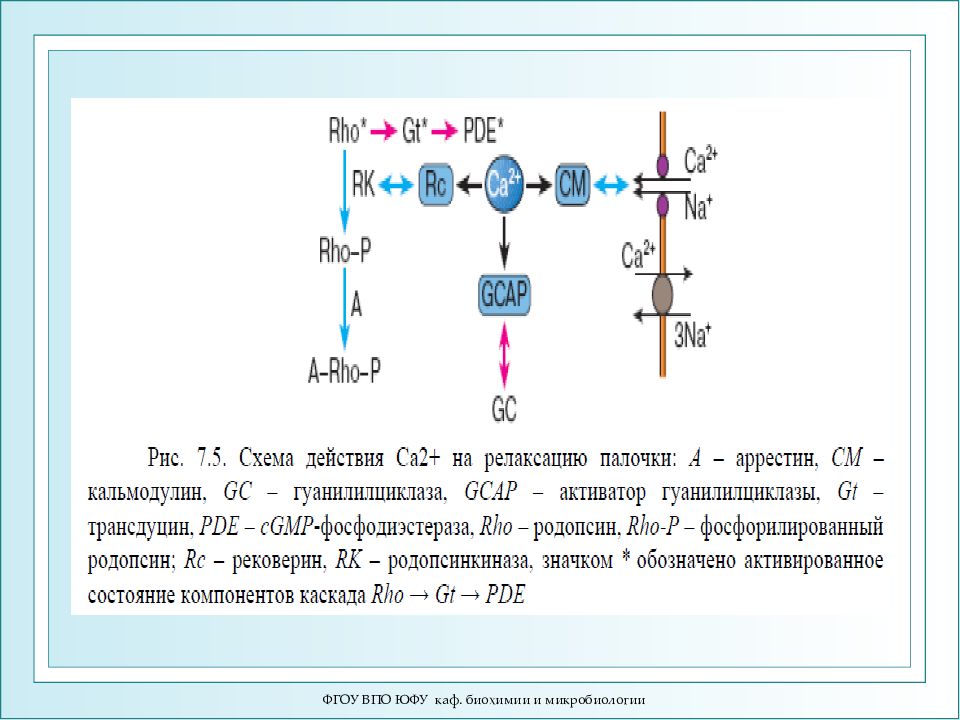
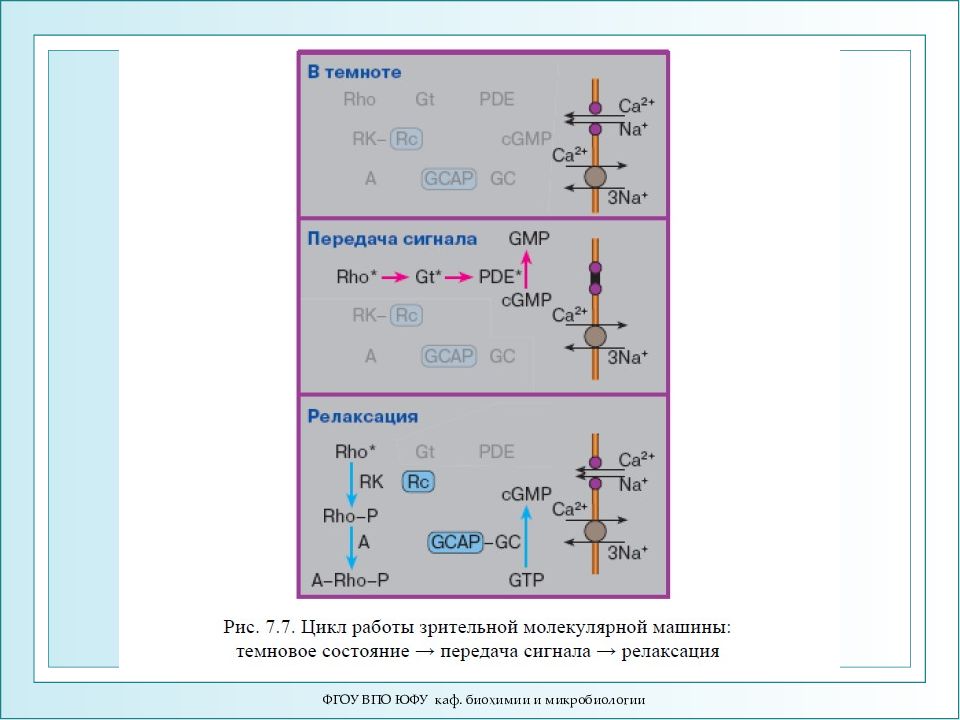
Слайд 88
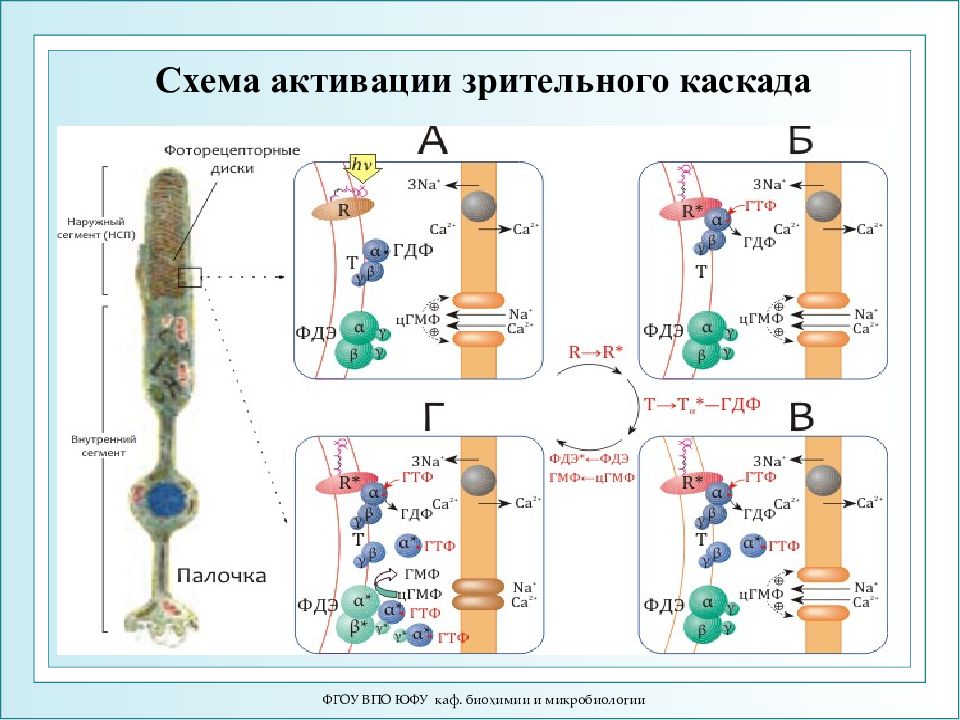
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Схема активации зрительного каскада
Слайд 94
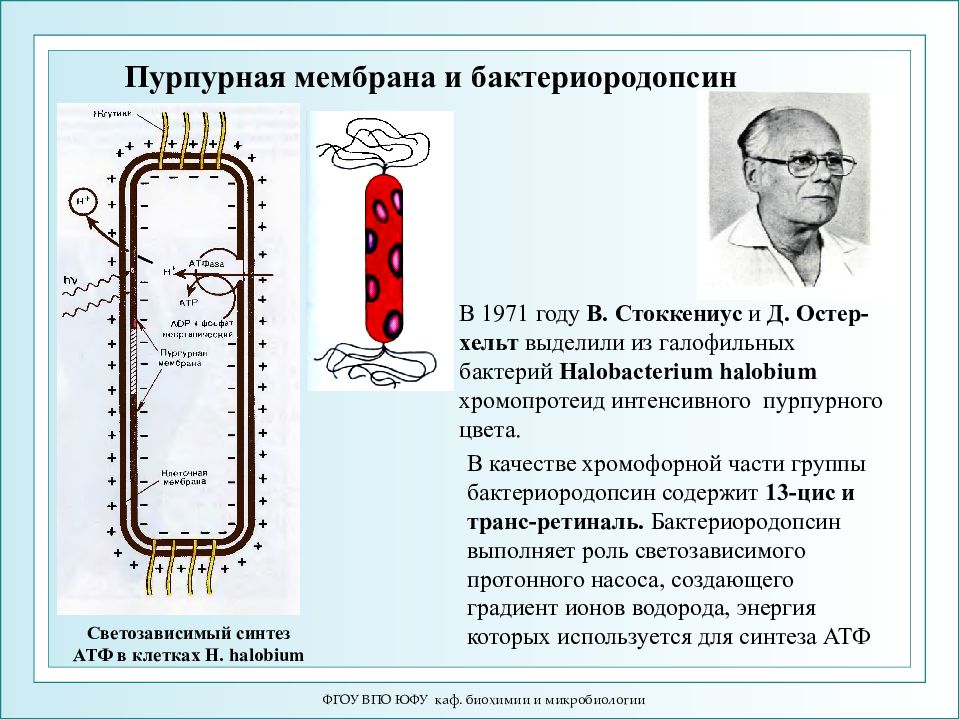
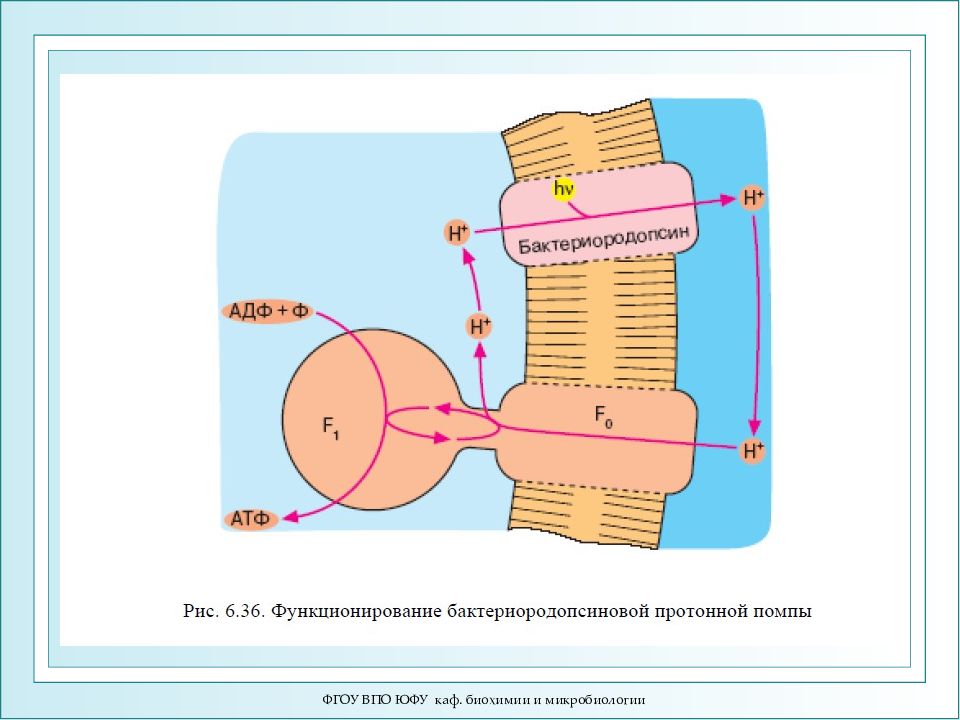
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Пурпурная мембрана и бактериородопсин Светозависимый синтез АТФ в клетках H. halobium В 1971 году В. Стоккениус и Д. Остер-хельт выделили из галофильных бактерий Halobacterium halobium хромопротеид интенсивного пурпурного цвета. В качестве хромофорной части группы бактериородопсин содержит 13-цис и транс-ретиналь. Бактериородопсин выполняет роль светозависимого протонного насоса, создающего градиент ионов водорода, энергия которых используется для синтеза АТФ
Слайд 95
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Пруды на юге Мертвого моря с галобактериями
Слайд 96
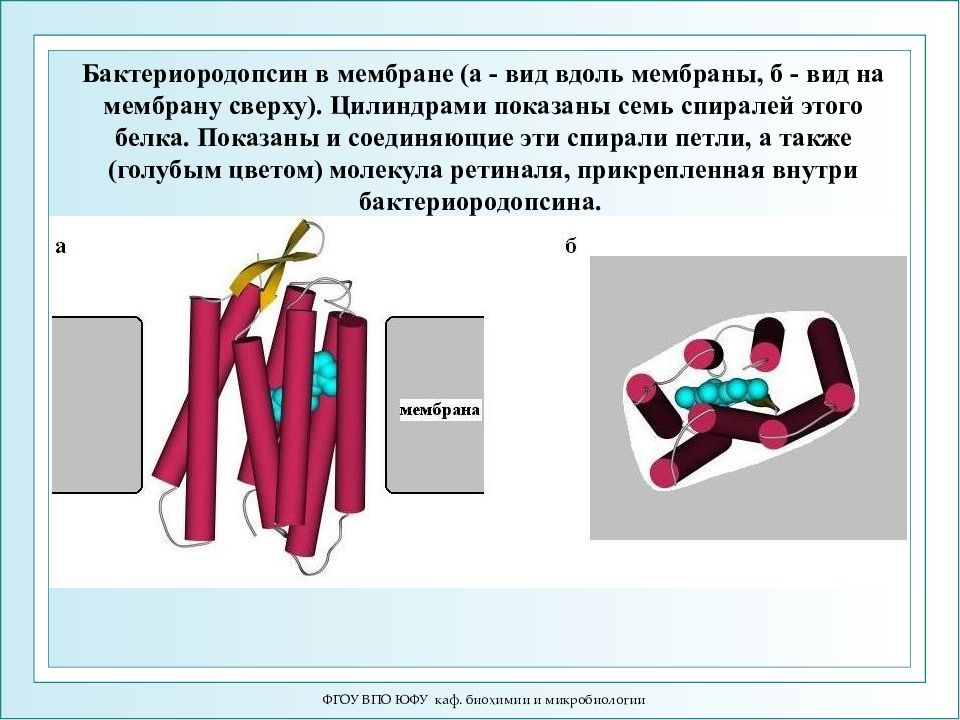
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Бактериородопсин в мембране (а - вид вдоль мембраны, б - вид на мембрану сверху). Цилиндрами показаны семь спиралей этого белка. Показаны и соединяющие эти спирали петли, а также (голубым цветом) молекула ретиналя, прикрепленная внутри бактериородопсина.
Слайд 97: Структура бактериородопсина и путь протона
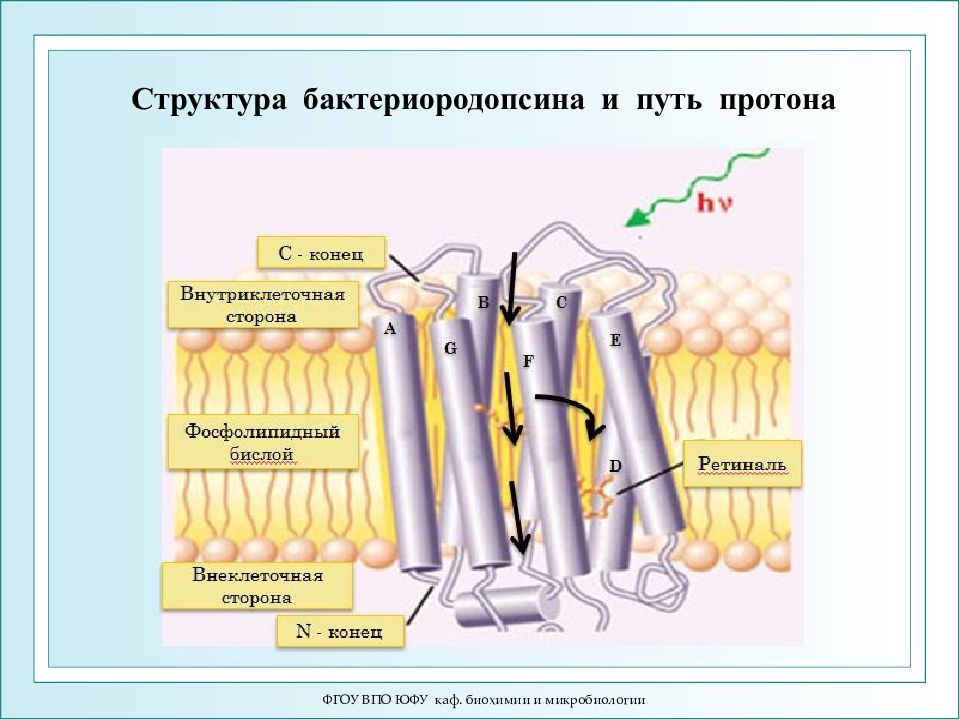
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Структура бактериородопсина и путь протона
Слайд 98: Механизм перекачивания протонов за счет энергии света у H. halobium
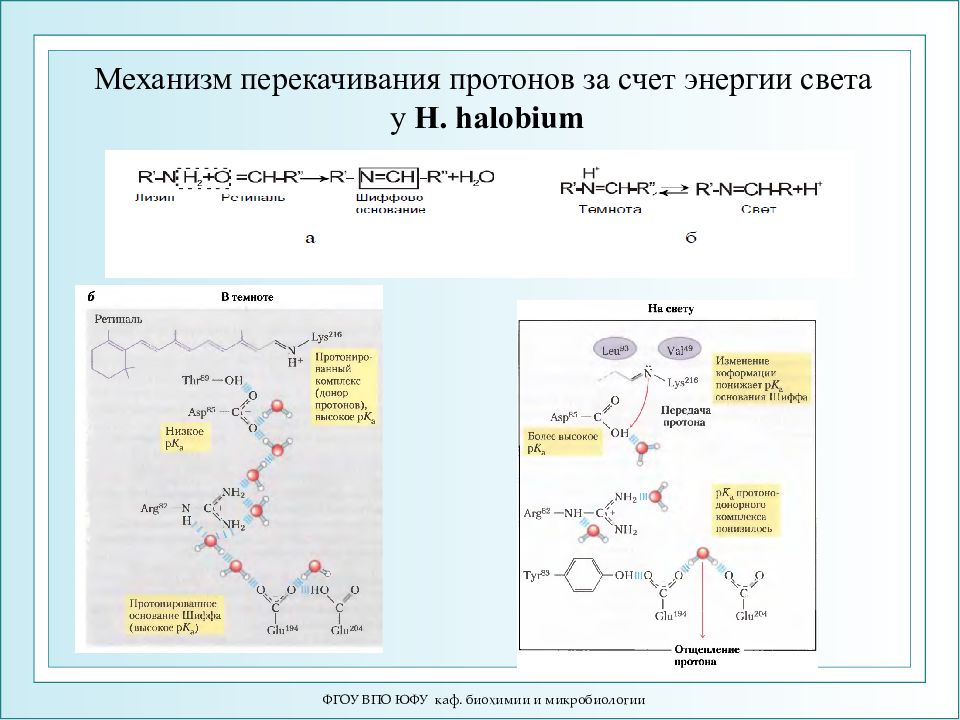
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Механизм перекачивания протонов за счет энергии света у H. halobium
Слайд 100
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Технические приложения бактериородопсина (проекты): протонный транспорт: генерация АТФ в реакторах; опреснение морской воды; генерация электрической энергии из света; фотоэлектрические применения: ультрабыстрая световая детекция; искусственная сетчатка; детекция подвижности; фотохромные применения: хранение информации : 2D-носители; 3D-носители; голографические носители; различные применения: детекция радиации; биосенсорные приложения.
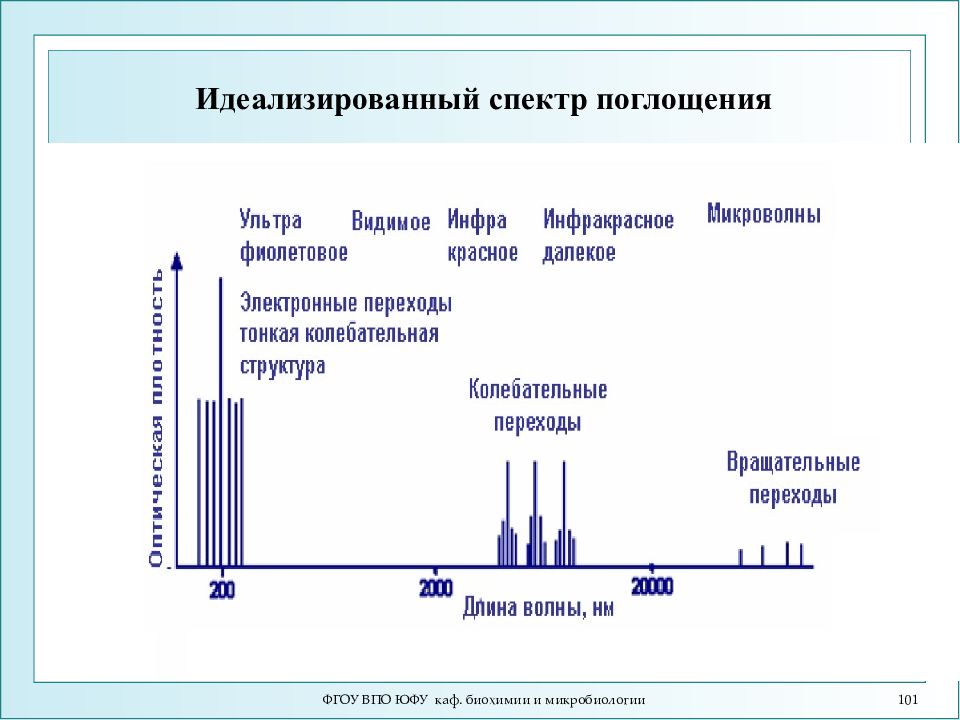
Слайд 101: Идеализированный спектр поглощения
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии 101
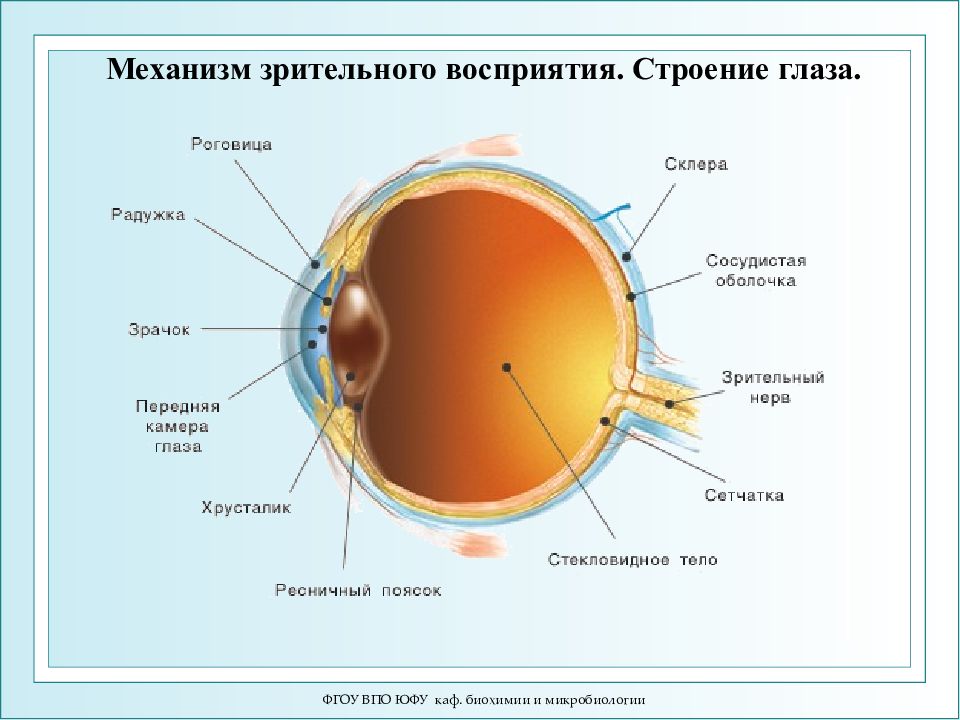
Слайд 102
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии Механизм зрительного восприятия. Строение глаза.
Последний слайд презентации: Фотобиология: Характеристики люминесцирующих молекул
Спектр возбуждения люминесценции - зависимость интенсивности люминесценции I от длины волны возбуждающего света Спектр люминесценции - зависимость интенсивности люминесценции от длины волны люминесценции I = f( λ ); I = f(v) Время жизни люминесценции – время, за которое интенсивность излучения уменьшится в е раз, поскольку затухание люминесценции происходит по закону : I t = I 0 e -t/τ t - время люминесценции τ – время затухания люминесценции