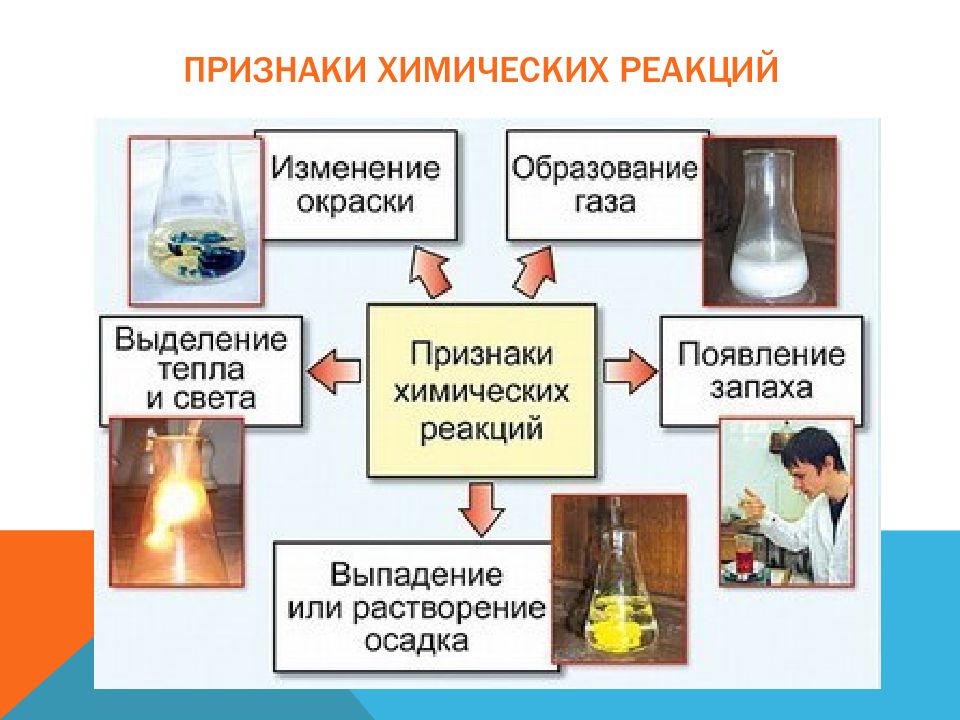
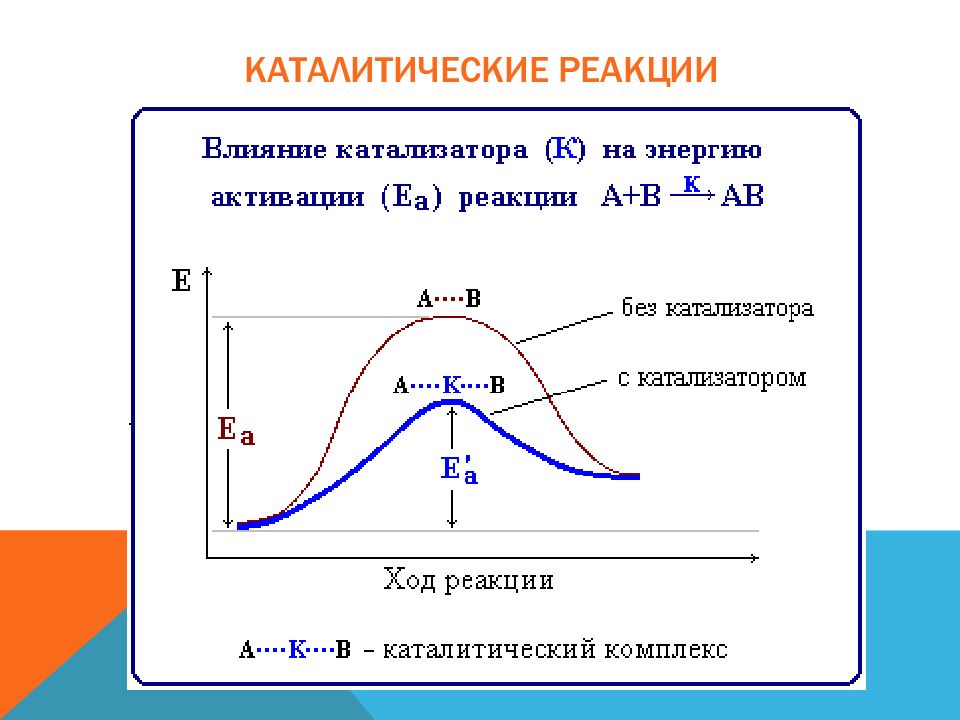
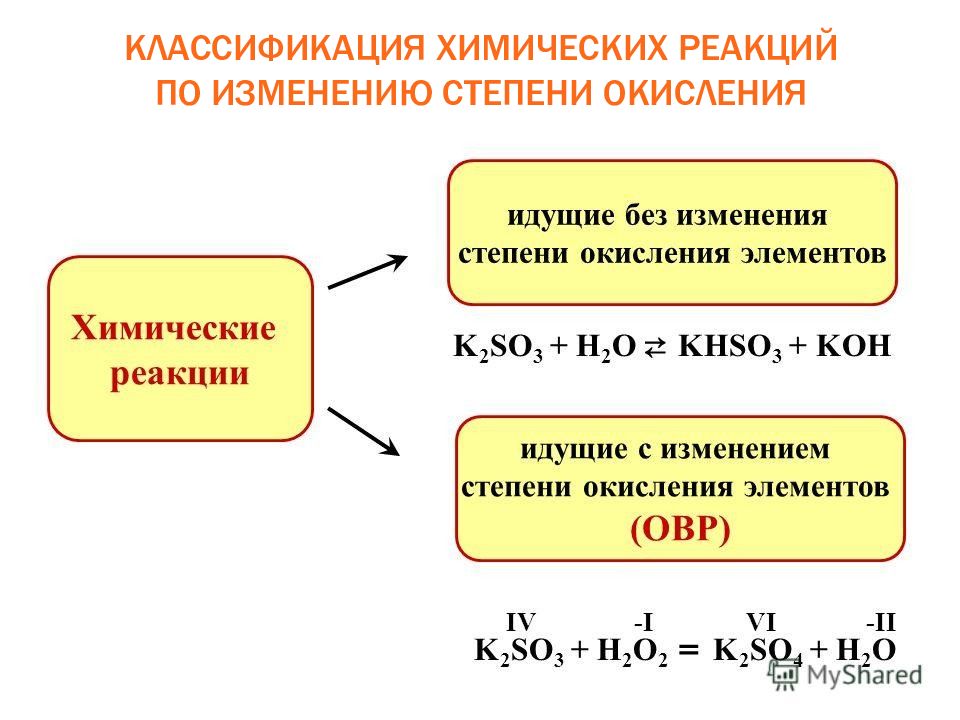
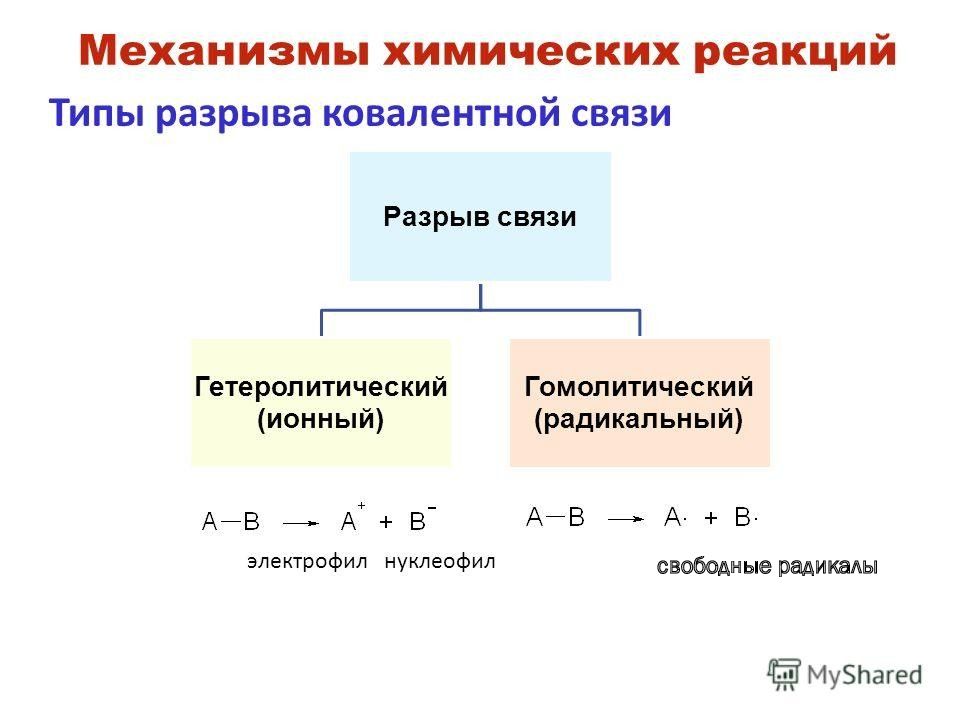
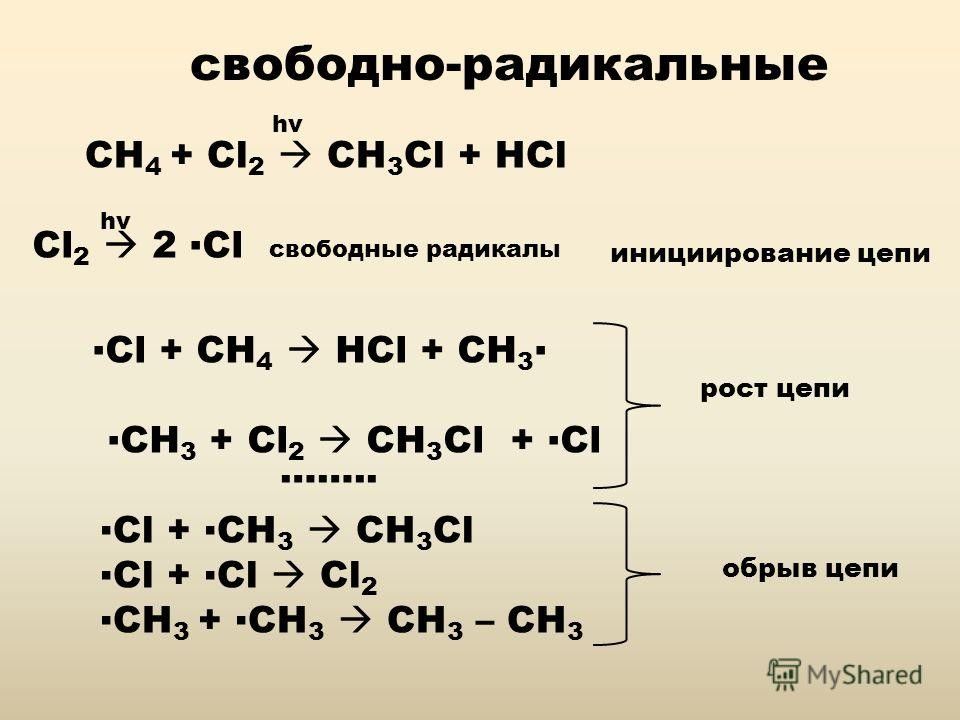
Слайд 4: Признаки химических реакций
Слайд 5: Химические реакции
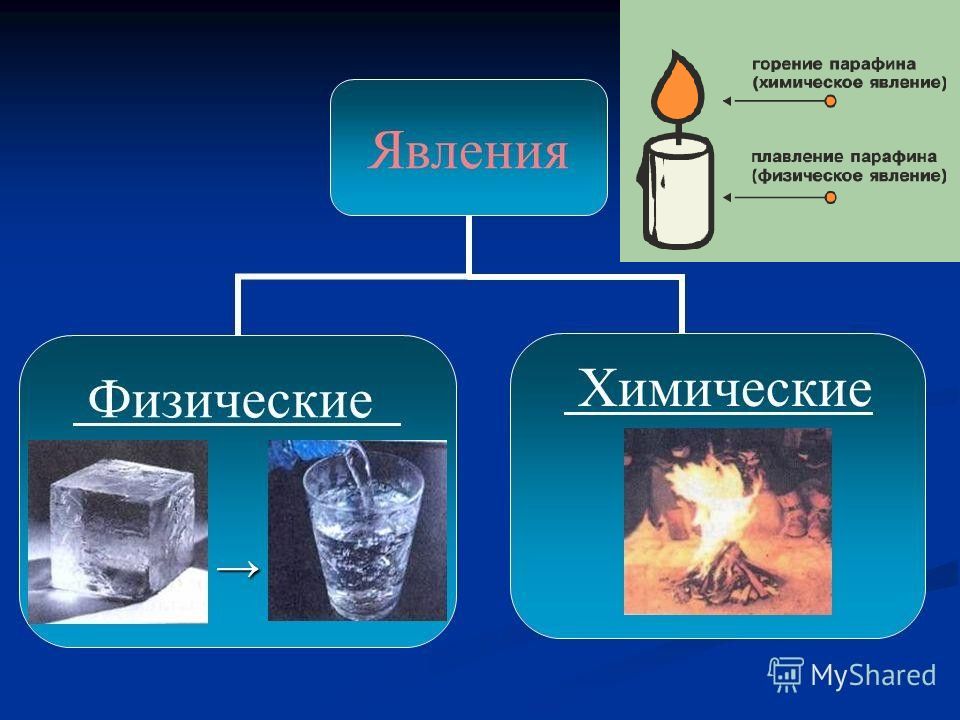
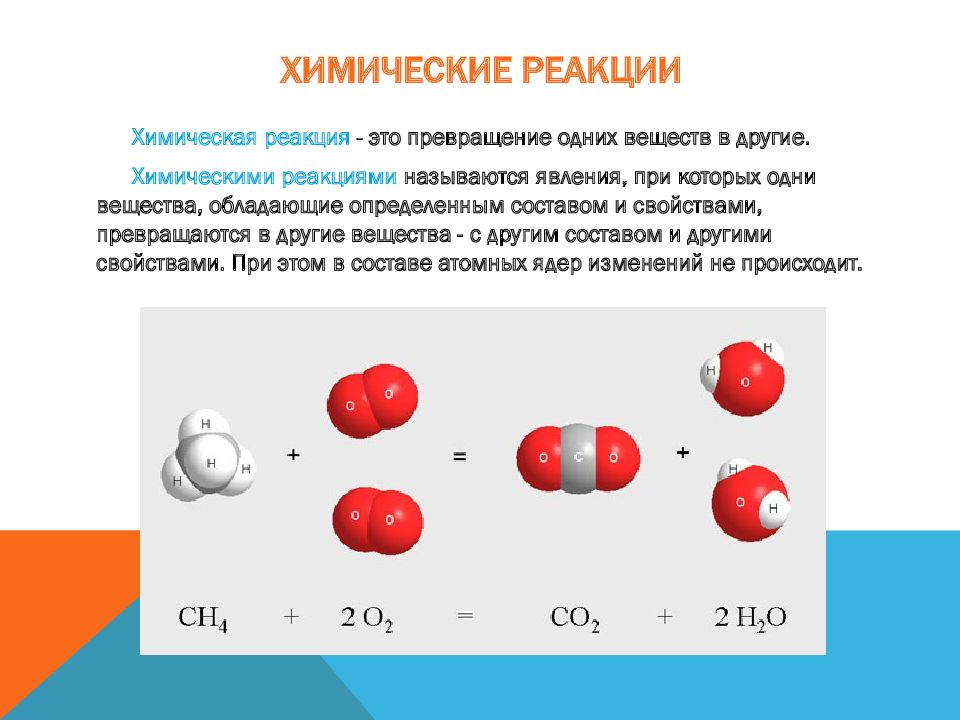
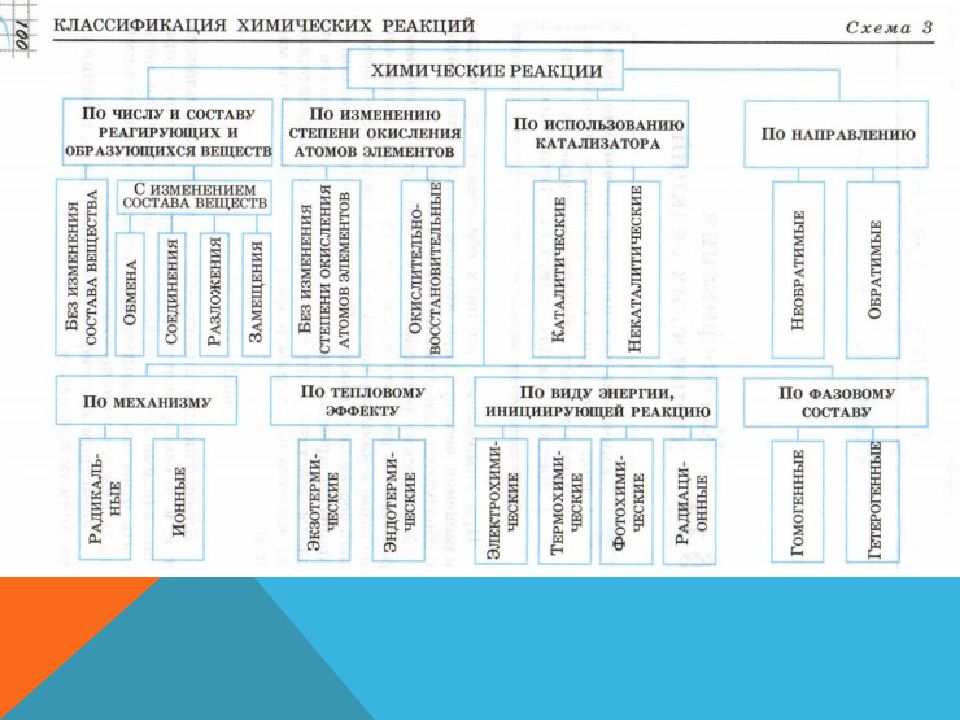
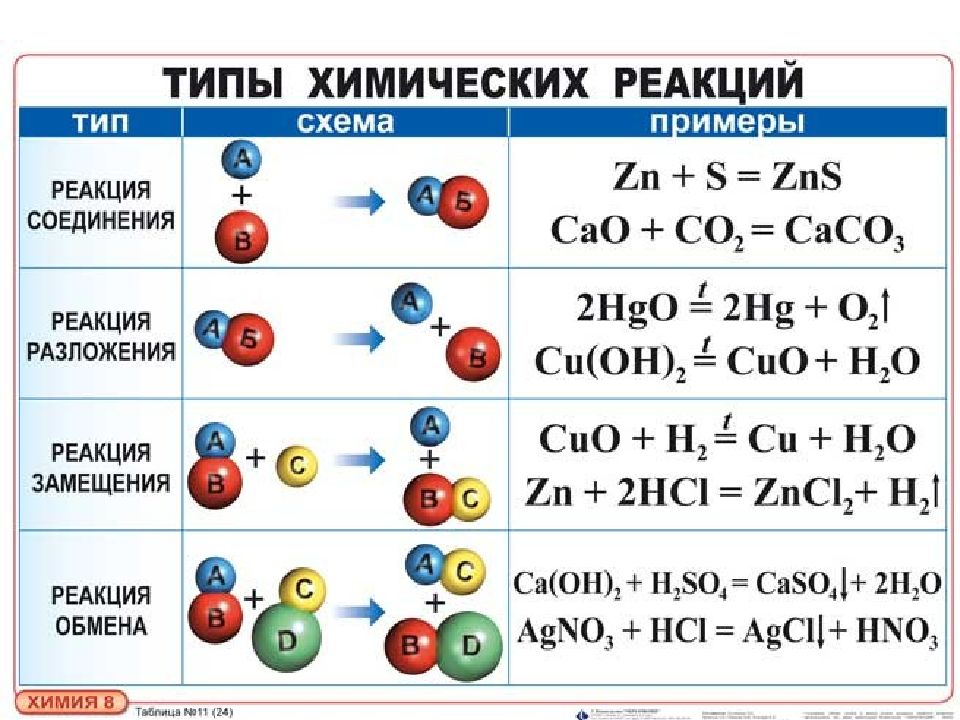
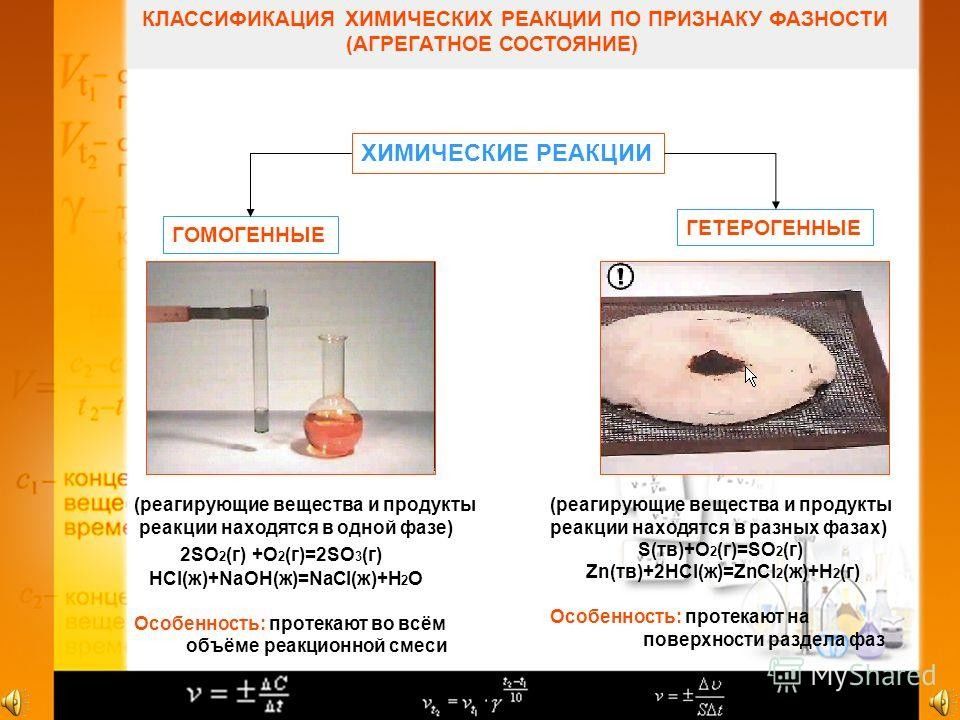
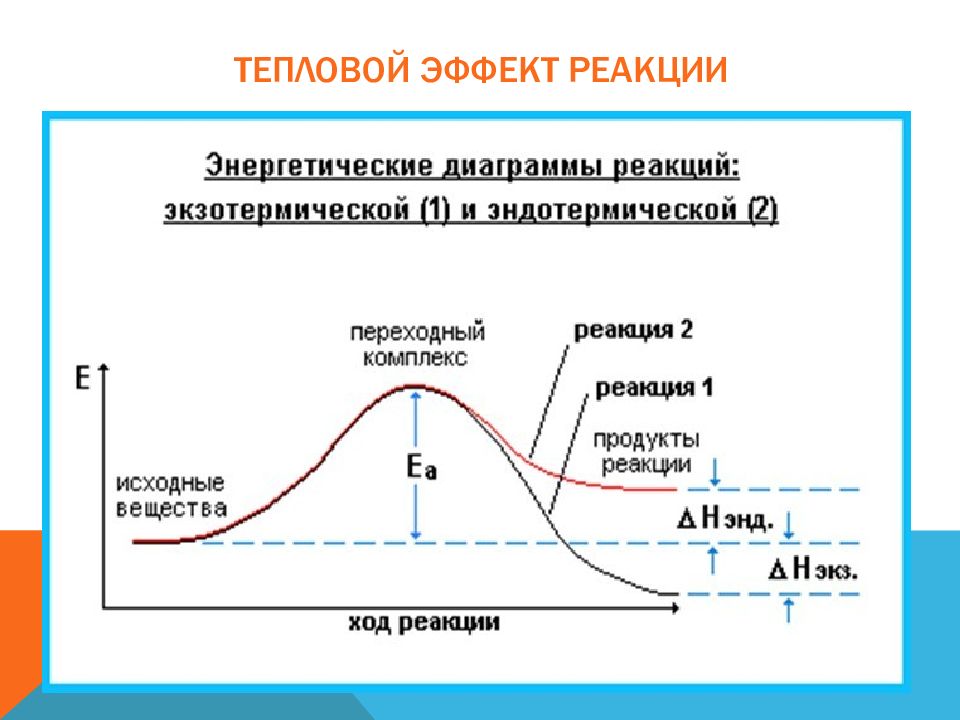
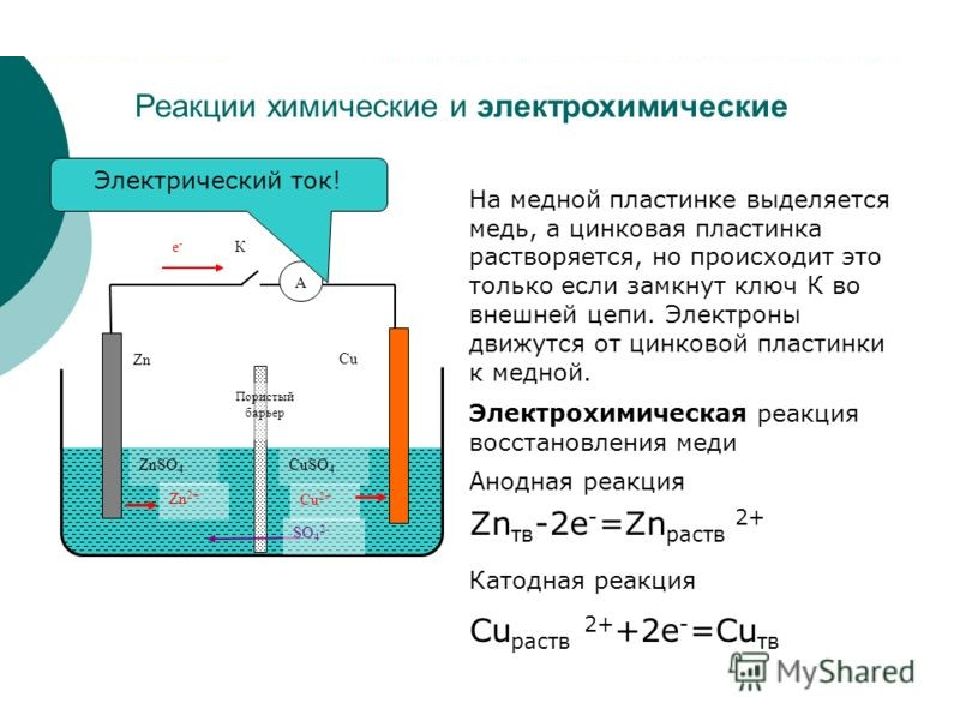
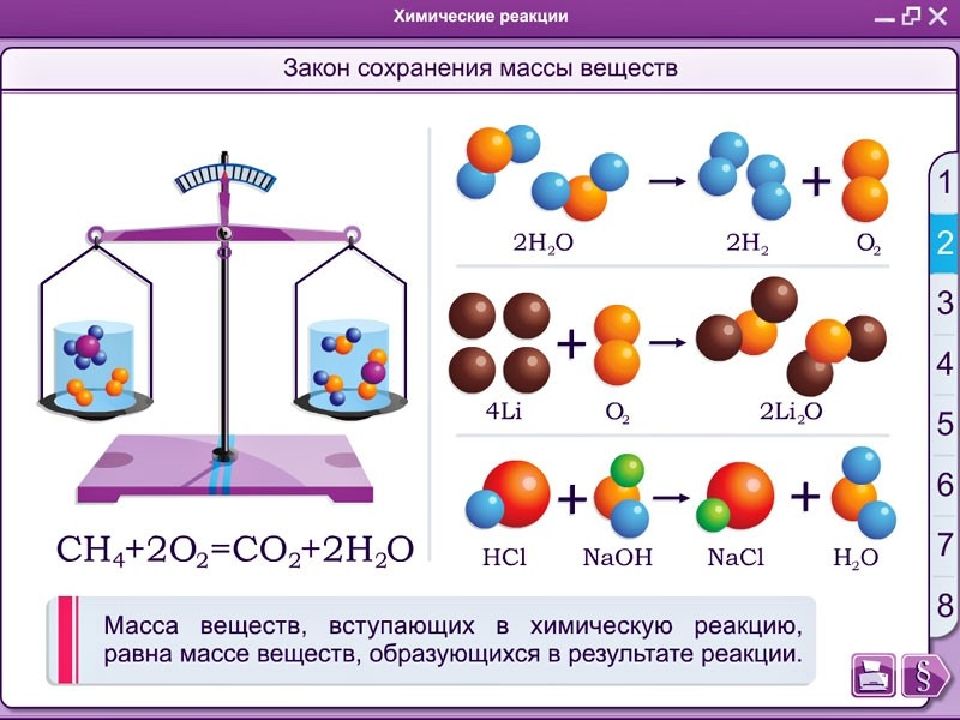
Химическая реакция - это превращение одних веществ в другие. Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества - с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Слайд 6: Прямая и обратная реакции
В отличие от математических уравнений, в уравнениях химических реакций нельзя переставлять левую и правую части. Вещества в левой части уравнения химической реакции называются реагентами, а в правой - продуктами реакции. Слева направо идет прямая реакция. Справа налево – обратная реакция.
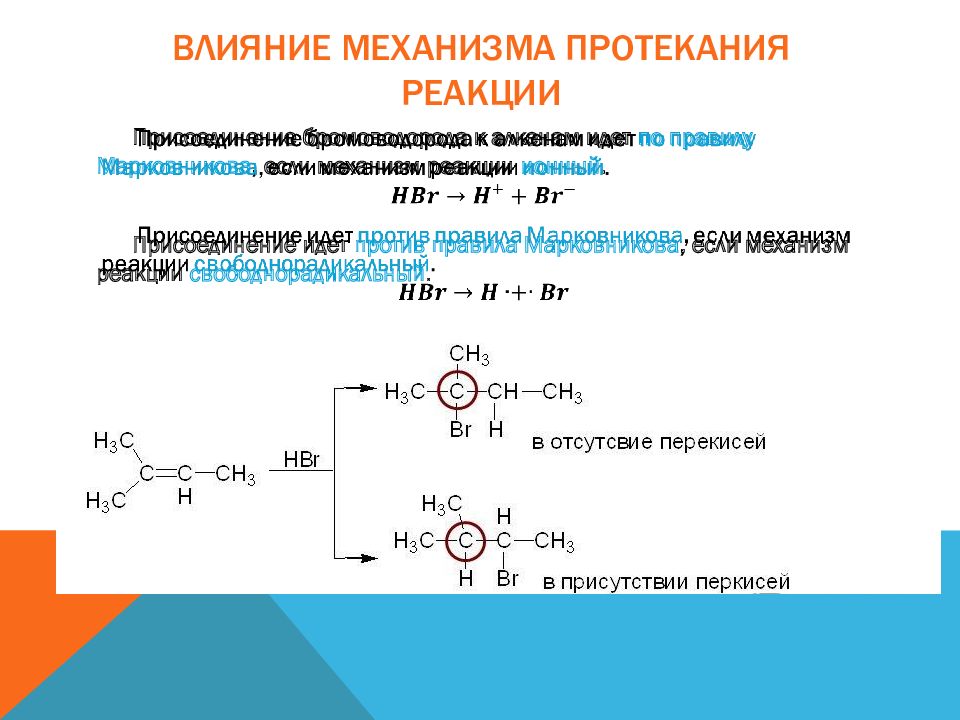
Слайд 27: Влияние механизма протекания реакции
Присоединение бромоводорода к алкенам идет по правилу Марковникова, если механизм реакции ионный. Присоединение идет против правила Марковникова, если механизм реакции свободнорадикальный.
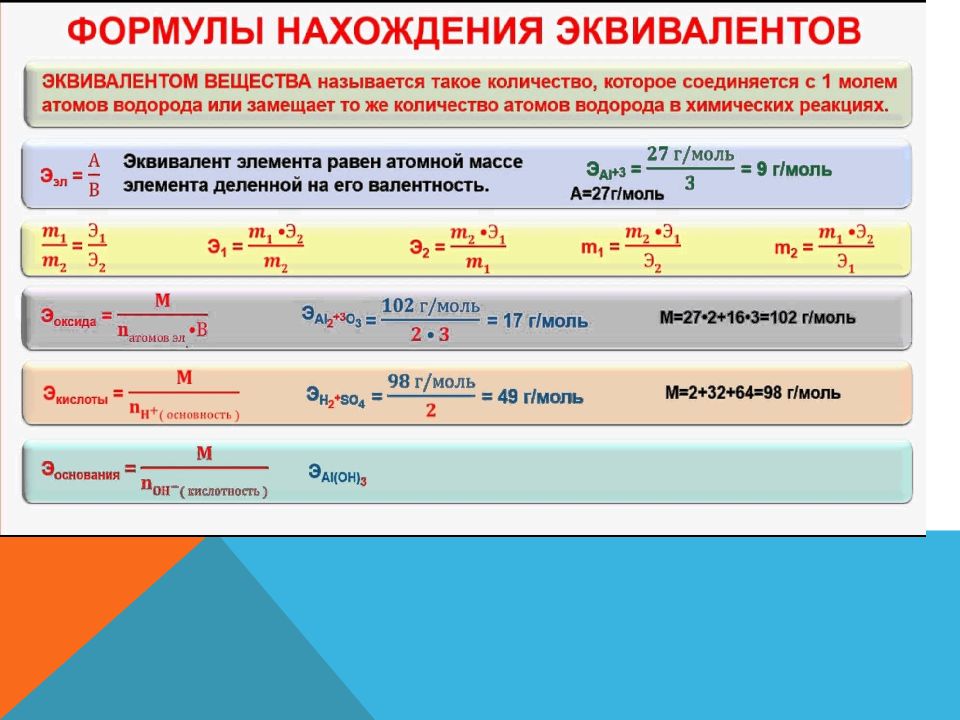
Слайд 36: Эквивалент вещества
Эквивалентом называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно восстановительных реакциях. Реальные частицы : атомы, молекулы, ионы, радикалы и т.п. Условные частицы : ½ молекулы H 2 SO 4, 1/3 иона Fe 3+, ¼ атома С и т.п. В общем случае эквивалент вещества Х определяется как ( 1/ z ) X. z – число эквивалентности 1/ z – фактор эквивалентности
Слайд 37: Молярная масса эквивалента
Масса 1 моля вещества эквивалента ( 1/ z ) X называется молярной массой эквивалента и представляет собой отношение массы вещества Х к количеству вещества эквивалента ( 1/ z ) X.
Слайд 43: Основной закон стехиометрии
Отношение количеств участвующих в реакции веществ (исходных веществ и продуктов) равно отношению соответствующих коэффициентов в уравнении реакции. aA + bB = cC + dD Количества веществ, точно соответствующие уравнению реакции, назы вают стехиометрическими. Если даны массы нескольких реагентов, то расчет масс продуктов ведут по тому из веществ, которое полностью израсходуется в реакции. Тот реагент, для которого это соотношение меньше, расходуется полностью, остальные находятся в избытке.