Слайд 2
Кондуктометриче c кий анализ основан на использовании зависимости между электропроводностью растворов электролитов и их концентрацией Фридрих Вильгельм Георг Кольрауш (1840-1910) Кондуктометрия от англ. с onductivity – электропроводность и греч. metreo - измеряю. Основатель кондуктометрического анализа - немецкий физик и физико-химик Кольрауш.
Слайд 3
Количественные параметры кондуктометрии l - толщина слоя раствора электролита между электродами S - площадь поверхности электродов - удельное электрическое сопротивление ϰ = 1/ - удельная электропроводность
Слайд 4
Основные понятия кондуктометрии Измеряемый аналитический сигнал в кондуктометрии – электропроводность (электрическая проводимость) растворов электролитов Удельная электропроводность ( ϰ – каппа) - это электропроводность 1 м 3 раствора, заключённого между электродами площадью 1 м 2 на расстоянии 1 м друг от друга. или Электропроводность электрического проводника площадью сечения 1 м 2 и длиной 1 м. Единицы измерения ϰ – сименс/метр (См/м); мСм/см, мкСм/см В справочниках - Ом -1 м -1 Ом -1 - это сименс (См) Удельная электропроводность зависит от природы электролита и растворителя, от концентрации раствора, от температуры.
Слайд 5
Молярная (эквивалентная) электропроводность - это удельная электропроводность раствора, содержащего 1 кмоль эквивалентов растворённого вещества = ϰ /С( f) За молярную массу эквивалента принимается молярная масса одинаковых частиц с единичным зарядовым числом («зарядом»), например, Н +, В r -, 1/2 Са 2+, 1/3 Fe 3+ Единицы измерения Ом -1 м 2 кмоль -1, См м 2 кмоль -1 мСм см 2 моль -1 Основные понятия кондуктометрии
Слайд 6
Основные понятия кондуктометрии 1. Эквивалентная электропроводность при бесконечно большом разбавлении (т.е. когда концентрация становится бесконечно малой) стремится к некоторому постоянному значению, не зависящему от концентрации электролита, но зависящему от температуры и природы электролита. Она называется предельной электропроводностью или . В разбавленных растворах электропроводность прямо пропорциональна количеству заряженных частиц. 2. Предельная электропроводность может быть экспериментально определена из зависимости = f(C).
Слайд 8
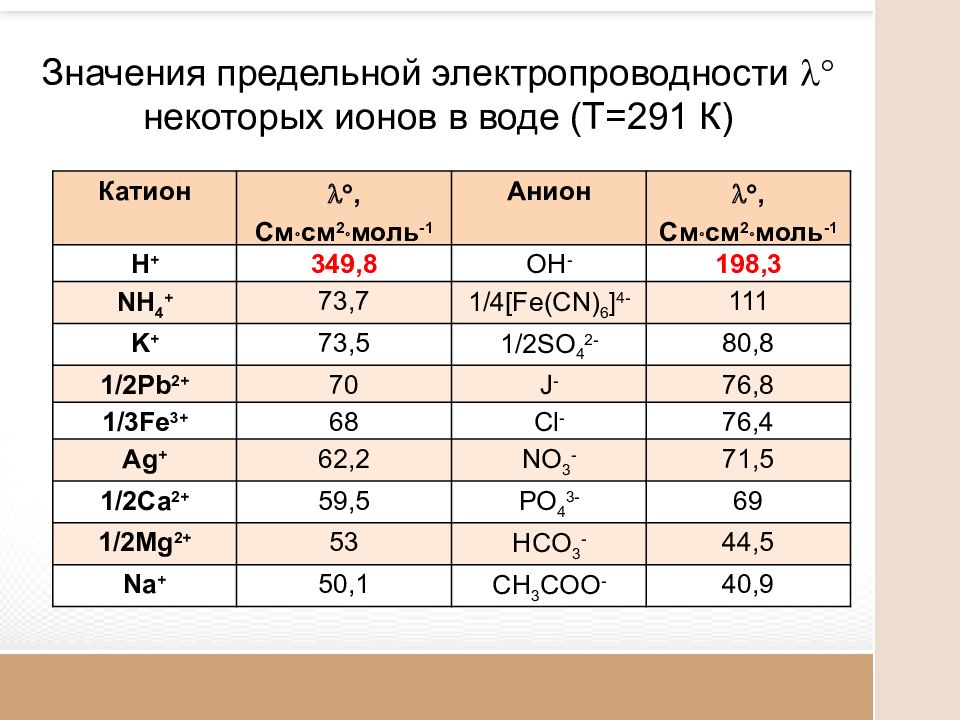
Значения предельной электропроводности некоторых ионов в воде (Т=291 К) Катион , См см 2 моль -1 Анион , См см 2 моль -1 H + 349,8 OH - 198,3 NH 4 + 73,7 1/ 4 [Fe(CN) 6 ] 4- 111 K + 73,5 1/2SO 4 2- 80,8 1/2Pb 2+ 70 J - 76,8 1/3Fe 3+ 68 Cl - 76,4 Ag + 62,2 NO 3 - 71,5 1/2Ca 2+ 59,5 PO 4 3- 69 1/2Mg 2+ 53 HCO 3 - 44,5 Na + 50,1 CH 3 COO - 40,9
Слайд 9
Факторы, влияющие на подвижность ионов На подвижность ионов существенно влияют: природа электролита, природа растворителя, температура. Величины эквивалентной электропроводности некоторых ионов Температура 18 С 25 С Ион Эквивалентная электропроводность , См см 2 моль -1 К at + 5,3 1,9 6,2 2,3 А n - 5,5 2,7 6,4 3,1 Н + 31,5 34,97 ОН - 17,4 19,8
Слайд 10
Прямая кондуктометрия 1. Расчетный метод. Концентрацию эквивалентов с электролита в растворе рассчитывают, если известны удельная электропроводность и молярная электропроводность : С( f) = ϰ / 2. Метод градуировочного графика Изучение зависимости = f(C) Электропроводность – величина аддитивная, т.е. равна сумме вкладов всех электропроводящих компонентов системы.
Слайд 11
Кондуктометрическое титрование Кондуктометрическое титрование используется при анализе индивидуальных веществ и смесей. Точку эквивалентности определяют по изменению электропроводности раствора. Кривая кондуктометрического титрования - зависимость электропроводности раствора от объёма добавленного титранта. Излом на кривой соответствует точке эквивалентности. Типы реакций в кондуктометрическом титровании кислотно-основные окислительно -восстановительные, реакции осаждения, реакции комплексообразования.
Слайд 12
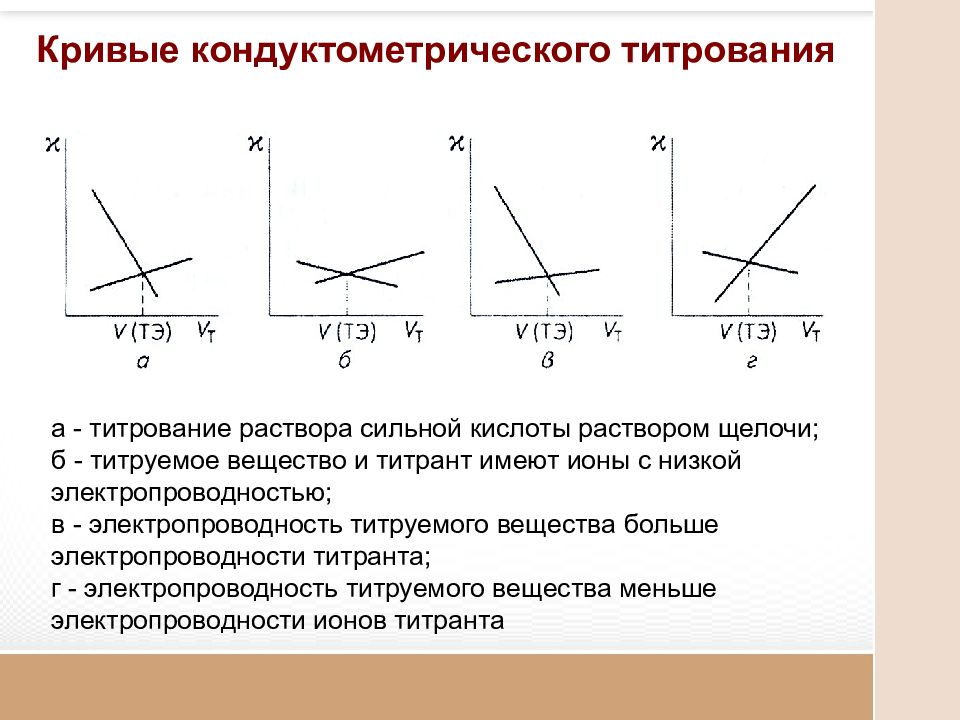
Кривые кондуктометрического титрования а - титрование раствора сильной кислоты раствором щелочи; б - титруемое вещество и титрант имеют ионы с низкой электропроводностью; в - электропроводность титруемого вещества больше электропроводности титранта; г - электропроводность титруемого вещества меньше электропроводности ионов титранта
Слайд 13
Прямая кондуктометрия используется для: определения растворимости малорастворимых электролитов, контроля качества дистиллированной воды и жидких пищевых продуктов (молока, напитков и др.), определения общего содержания солей в минеральной, морской, речной воде, в почвенных растворах, определения влажности почвы, зерна и других объектов. Применение прямой кондуктометрии
Последний слайд презентации: Кондуктометрия и кондуктометрическое титрование
Достоинства и недостатки кондуктометрии + Высокая чувствительность – нижняя граница определяемых содержаний 10 -4 - 10 -5 моль/л Простота методик, доступность аппаратуры Возможность титрования можно мутных, окрашенных, непрозрачных растворов Ошибка определения составляет от 0,1 до 2 %. Возможность автоматизации анализа Метод малоселективен, что ограничивает его применение в анализе. -