Первый слайд презентации: Кремний( Si ) и Углерод( C )
Элементы IV группы главной подгруппы
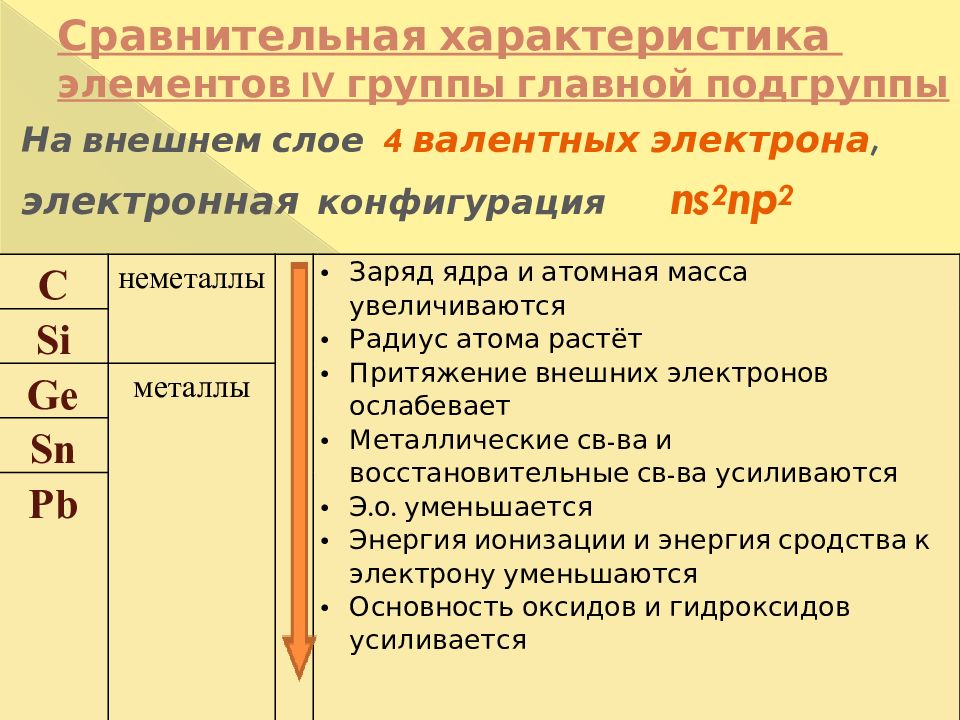
На внешнем слое 4 валентных электрона, электронная конфигурация ns 2 np 2 С неметаллы Заряд ядра и атомная масса увеличиваются Радиус атома растёт Притяжение внешних электронов ослабевает Металлические св-ва и восстановительные св-ва усиливаются Э.о. уменьшается Энергия ионизации и энергия сродства к электрону уменьшаются Основность оксидов и гидроксидов усиливается Si Ge металлы Sn Pb
Слайд 3
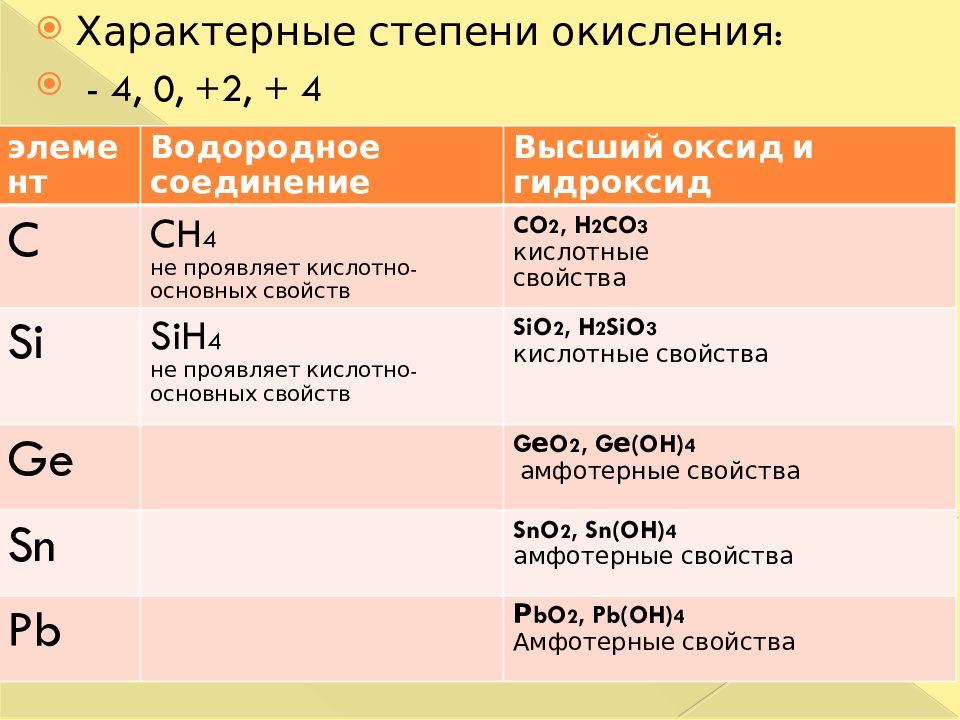
Характерные степени окисления: - 4, 0, +2, + 4 элемент Водородное соединение Высший оксид и гидроксид C CH 4 не проявляет кислотно-основных свойств CO 2, H 2 CO 3 кислотные свойства Si SiH 4 не проявляет кислотно-основных свойств SiO 2, H 2 SiO 3 кислотные свойства Ge G е O 2, G е( OH) 4 амфотерные свойства Sn SnO 2, Sn (OH) 4 амфотерные свойства Pb Р bO 2, Pb (OH) 4 Амфотерные свойства
Слайд 4: Изотопы элементов 4 группы
При выяснениии механизма реакций иногда используют изотоп углерода 13 С ( метод меченных атомов ). Поэтому полезно знать, что распространённость изотопов углерода: 12С - 98.89 % и 13С - 1.11 %. у кремния таких изотопа 3, у германия - 5, у олова - 10, у свинца 4 стабильных изотопа.
Слайд 5: Происхождение названия углерода
Международное название происходит от латинского carbo — уголь, связанного с древним корнем kar — огонь. Этот же корень в латинском cremare — гореть, а возможно, и в русском «гарь», «жар», «угореть» (в древнерусском « угорати » — обжигать, опалять). Отсюда — и «уголь».
Слайд 6: Углерод в природе
Кальцит мел мрамор известняк малахит магнезит живые организмы Нефть, природный газ, каменный уголь
Слайд 7: Углерод в природе
Углерод — биогенный элемент; его соединения играют особую роль в жизнедеятельности растительных и животных организмов (среднее содержание углерода — 18%). Углерод широко распространён в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода.
Слайд 8: Разновидности углерода
Аморфные модификации Аллотропные модификации Кокс Древесный уголь Сажа Активированный уголь Алмаз Графит Фуллерен карбин
Слайд 9: Алмаз
кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло. В вакууме или в инертном газе при повышенных температурах постепенно переходит в графит Применение: Изготовление бриллиантов – огранённые алмазы сильно преломляют свет. Для резки стекла, металлов, наконечники свёрл («алмазные жала»), буров и резцов – благодаря твёрдости. Алмазный порошок – для полировки и огранки драгоценных камней (рубинов) – твёрдость.
Слайд 10
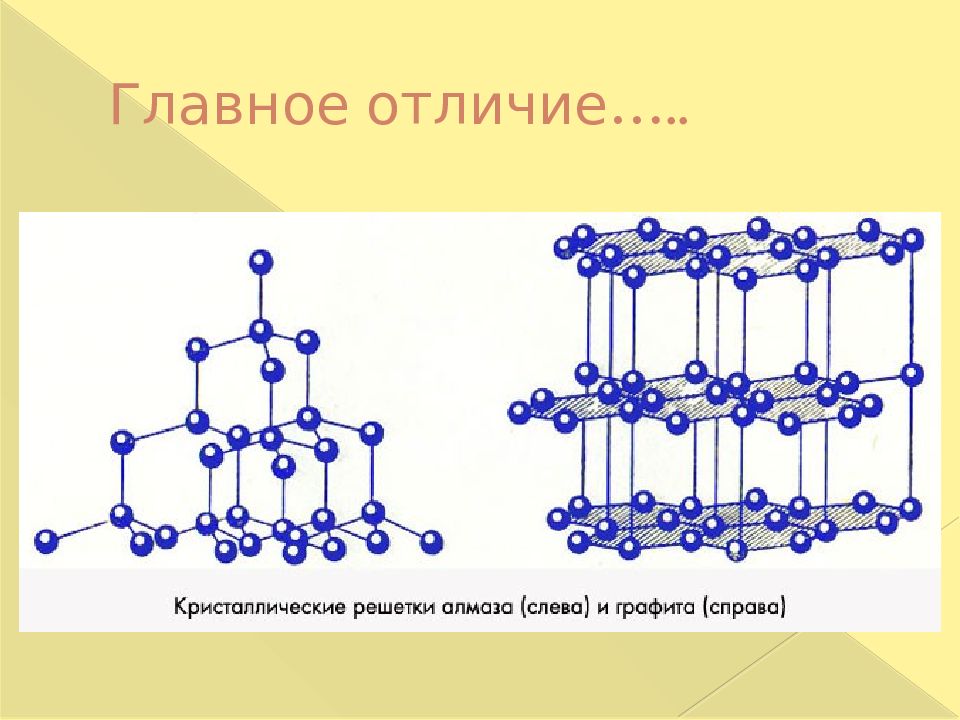
Название «графит», происходящее от греческого слова, означающего «писать», предложено А.Вернером в 1789 Распространенный в природе минерал. Встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию. Графит – мягкое вещество черного или серого цвета со слабым металлическим блеском, жирное на ощупь, проводит электрический ток..Самая устойчивая аллотропная модификация углерода. Искусственно получают: нагреванием смеси кокса или каменного угля с пеком;
Слайд 11: Применение графита
Графитовый порошок – изготовление минеральных красок. Смазочный материал (в смеси с маслом) – между отдельными слоями графита взаимодействие настолько слабо, что возникает скольжение. Графитовые стержни – электроды – электропроводность. Изготовление простых карандашей.
Слайд 12: Карбин
мелкокристаллический порошок чёрного цвета, полупроводник. По твердости карбин превосходит графит, но значительно уступает алмазу. Состоит из цепей, образованных участками: -С С-С С- ( карбин ) или =С=С=С=С= ( поликумулен ). Получен искусственным путем.
Слайд 13: Фуллерен
искусственно полученная модификация углерода, состоящая из молекул. Это черные вещества с металлическим блеском, обладающие свойствами полупроводников. Назван по имени американского инженера и архитектора Р.Б. Фуллера Виды молекул фуллеренов: чётное число атомов углерода в молекуле С60, С70, С72, С74, С76, С108, С960 и т.д. Поверхность «мяча» образована пяти- и шестиугольниками с общими рёбрами. Форма близка к сфере. Применение: Запоминающие устройства Сверхпроводники Лекарства с противоопухолевой активностью
Слайд 14: Алмаз, графит, фуллерен, карбин …
Вопрос: Как называется явление существования нескольких простых веществ, образованных одним химическим элементом?
Слайд 15: Почему?
Почему алмаз твёрдый, а графит – мягкий? Почему графит оставляет следы на бумаге, а алмаз может резать стекло? Почему из графита делают электроды, а из алмазов – ювелирные изделия? Как вы думаете, можно ли получить из графита алмаз, а из алмаза – графит? Почему? Будет ли гореть графит? А алмаз? Почему? Что общего у алмаза и графита?
Слайд 17: Литературная загадка…
В сказке Владимира Федоровича Одоевского «Мороз Иванович» есть отрывок: «между тем Рукодельница воротится, воду процедит, в кувшин нальет, да еще какая затейница: коли вода не чиста, так свернет лист бумаги, наложит в нее угольков да песку крупного насыплет, вставит ту бумагу в кувшин, да нальет в нее воды, а вода-то, знай, проходит сквозь песок да сквозь уголья и капает в кувшин чистая, словно хрустальная…» Вопрос: Какие методы очистки воды использует рукодельница?
Слайд 18: Древесный уголь Адсорбция
Образуется при разложении древесины без доступа воздуха. Обладает способностью к адсорбции – способностью поглощать различные вещества. Это явление используется для очистки сахара, спирта, в фильтре противогаза. Активированный уголь прокаливают на перегретом пару, число пор при этом увеличивается, что улучшает адсорбцию. Н.Д.Зелинский в годы первой мировой войны изобрёл противогаз
Слайд 19: Угольные фильтры
В бытовых фильтрах, в промышленном производстве, на очистных сооружениях – уголь поглощает вредные вещества из воды
Слайд 20: Сажа
Сажа - черный дисперсный продукт неполного сгорания или термического разложения углеродистых веществ. В технике получают из углеводородов (отсюда другое название сажи - технический углерод). Используют в производстве резины, пластмасс, пигмент для лакокрасочных материалов и др.
Слайд 21: кокс
Представляет собой твердое пористое вещество серого цвета, получаемое коксованием каменного угля. Физико-химические свойства каменноугольного кокса по общим характеристикам они близки к свойствам графита. Область применения: Каменноугольный кокс применяют главным образом в доменном процессе для выплавки чугуна (доменный кокс). Кокс здесь служит одновременно топливом и восстановителем железной руды. в химической промышленности, цветной металлургии и др.
Слайд 22: Химические свойства углерода
С неметаллами С + F 2 CF 4 С+ О 2 (недостаток) СО (угарный газ) С + О 2 ( изб) СО 2 (углекислый газ) С + H 2 CH 4 ( t, Ni) С + S CS 2 C + Si = SiC ( карборунд ) C + N2 = C2N2 дициан
Слайд 23
С металлами С + Ca CaC 2 карбид С + Al Al 4 С 3 С + Na Na2C2 Карбиды - это соединения углерода с металлами Карбиды, при гидролизе которых образуется метан – « метаниды »: Al 4 C 3, Be 2 C Al 4 С 3 +12HCl =4AlCl 3 + 3CH 4 Карбиды, при гидролизе которых получается ацетилен – « ацетилениды »: Na 2 C 2, Ag 2 C 2, CaC 2 СаС 2 +2Н 2 O=Са(OH) 2 +С 2 Н 2 Ag 2 C 2 + 2 HCl = 2 AgCl + C 2 H 2
Слайд 24
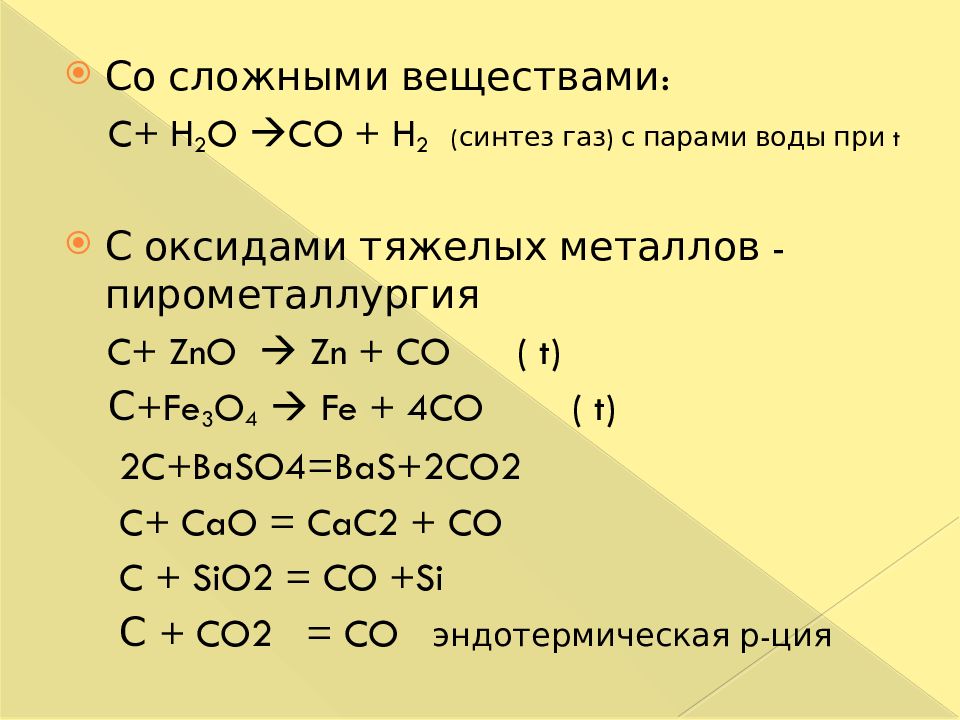
Со сложными веществами: C + H 2 O CO + H 2 ( синтез газ ) с парами воды при t С оксидами тяжелых металлов - пирометаллургия C + ZnO Zn + CO ( t) С +Fe 3 O 4 Fe + 4CO ( t) 2C+BaSO4=BaS+2CO2 C + CaO = CaC2 + CO C + SiO2 = CO +Si С + CO2 = CO эндотермическая р- ция
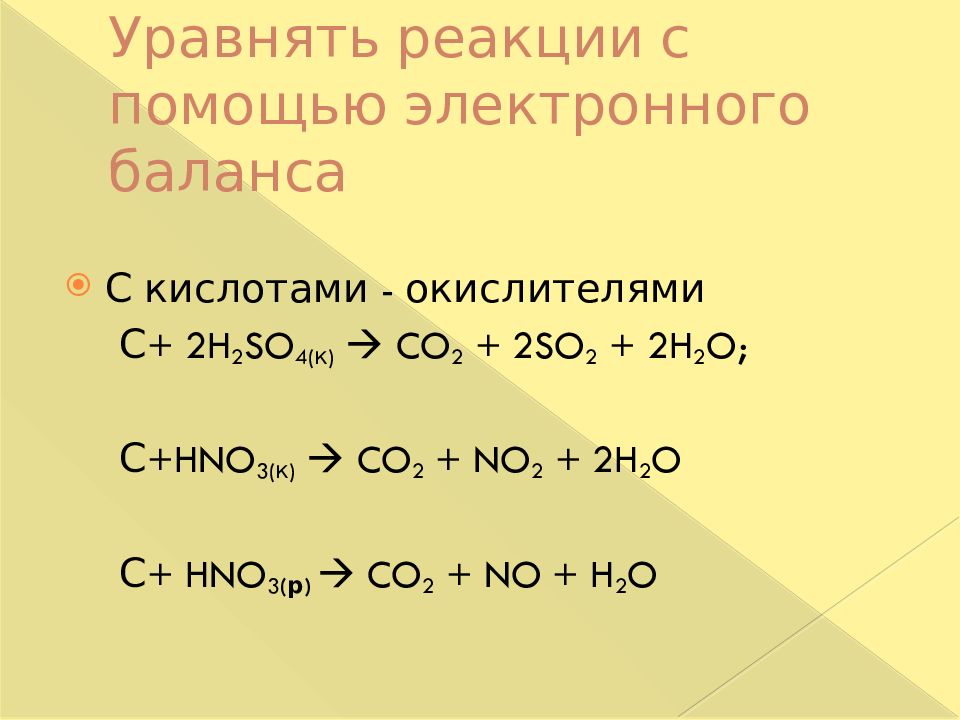
Слайд 25: Уравнять реакции с помощью электронного баланса
С кислотами - окислителями С + 2H 2 SO 4( к ) CO 2 + 2SO 2 + 2H 2 O; С +HNO 3( к ) CO 2 + NO 2 + 2H 2 O С + HNO 3 ( р ) CO 2 + NO + H 2 O
Слайд 26: Обобщение определите, в каких реакциях углерод является окислителем, восстановителем?
+ F 2 CF 4 + О 2 (недостаток) СО (угарный газ) + О 2 (изб) СО 2 (углекислый газ) + S CS 2 + H 2 ( – t, Ni) CH 4 + Ca CaC 2 + Al Al 4 С 3 + H 2 O CO + H 2.( угарный газ ) + ZnO ( – t) Zn + CO +Fe 3 O 4 ( – t) Fe + 4CO + 2H 2 SO 4( к ) CO 2 + 2SO 2 + 2H 2 O; +HNO 3( к ) CO 2 + NO 2 + 2H 2 O. + HNO 3 ( р ) CO 2 + NO + H 2 O 2C+BaSO4=BaS+2CO2 С
Слайд 27
С помощью учебника и схемы-конспекта подготовить отчет группы по плану: Формула оксида, степени окисления элемента в нем. Название по номенклатуре и тривиальное. Нахождение в природе. Тип химической связи в молекуле. Тип кристаллической решетки. Физические свойства. Химические свойства. Применение.
Слайд 29: Оксиды углерода
CO CO 2 Характеристика угарный газ – б\ц, б\з, ядовит, мало растворим в воде углекислый газ – б/ц, б/з, малорастворим в воде Получение C + O 2 = CO 2, CO 2 + C = 2CO. 2 ) термическое разложении муравьиной или щавелевой кислоты в присутствии концентрированной серной кислоты: HCOOH = H 2 O + CO, H 2 C 2 O 4 = CO + CO 2 + H 2 O Обжиг известняка : CaCO 3 = CaO + CO 2, Действие сильных кислот на карбонаты и гидрокарбонаты: CaCO 3 +2 HCl = CaCl 2 + H 2 O + CO 2, NaHCO 3 + HCl = NaCl +H 2 O +CO 2.
Слайд 30: Оксиды углерода
CO CO 2 Тип оксида CO + NaOH = HCOONa ( формиат натрия) 2СО + О 2 = 2СО 2 СО + Н 2 = С + Н 2 О СО + Cl 2 = COCl 2 ( фосген ) CO + CuO = С u + CO 2 Fe2O3+3CO=2Fe+3CO2 CO +Na2O2 = Na2CO3 СО + Н2O = СO2 + Н2 С + СО 2 = 2СО. 2Mg + CO 2 = 2MgO + C. Na 2 O + CO 2 = Na 2 CO 3, Na2O2 + CO2 = Na2CO3 + O2 2NaOH + CO 2 = Na 2 CO 3 +H 2 O, NaOH + CO 2 = NaHCO 3. Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды: Ca(OH) 2 + CO 2 =CaCO 3 ↓ + H 2 O.
Слайд 31: Экологические акценты
Изменение климата планеты вследствие концентрации парниковых газов в атмосфере является на сегодняшний день одной из основных глобальных экологических проблем. Примерно 80% парникового эффекта приходится на углекислый газ, около 15% - на метан, остальные газы составляют менее 5 %. В настоящее время уровень углерода выше на 30%, чем был 250 лет назад, и при этом, увеличение произошло в основном во второй половине 20-го столетия вследствие антропогенной деятельности. Необходимо учитывать, что из всех наземных природных экосистем, охваченных хозяйственной деятельностью, леса вносят наибольший вклад в формирование углеродного баланса планеты. Снизить содержание углерода в атмосфере и способствовать предотвращению дальнейшего изменения климата может лесной сектор, который обладает значительным потенциалом снижения эмиссии парниковых газов. Суть парникового эффекта состоит в том, что углекислый газ поглощает инфракрасные лучи и мешает отведению тепла от поверхности земли.
Слайд 32: Литературная загадка…
В произведении В. Короткевича «Черный замок Ольшанский. Дикая охота короля Стаха » мы читаем: «…- Вы слышали об эффекте «собачьей пещеры» в Италии?.. Есть там такая пещера – яма. Человек войдет и ходит, а собака или кролик погибают через несколько минут. - Почему? - Из вулканической трещины выделяется углекислый газ… А поскольку он…» Задание: Закончите фразу. Объясните «загадочную гибель животных».
Слайд 33: Химия и литература
В произведении В.Д. Одоевского «Мороз Иванович» пишется: «… а я затем в окошки стучусь, - отвечал Мороз Иванович, - а не то, ведь я знаю, есть такие неряхи, что печку истопить истопят, а трубу закрыть не закроют, да не вовремя, когда еще не все угольки прогорели, а оттого в горнице угарно бывает, голова у людей болит, в глазах зелено, даже и совсем от угара умереть можно» Вопрос: Угарный газ – сильный яд! Чем это объясняется? Какова первая помощь при отравлении угарным газом?
Слайд 34: Угольная кислота
При растворении углекислого газа в воде образуется очень слабая угольная кислота Н 2 СО 3, которую в свободном состоянии из водных растворов выделить нельзя, т.к. она распадается на СО2 и Н2О.
Слайд 35: Химия и литература
В романе Г.Р. Хаггарда «Клеопатра» читаем: « … она вынула из уха одну из тех огромных жемчужин… и… опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев, наблюдали, как несравненная жемчужина медленно растворяется в крепком уксусе. Вот от нее не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая уксус, и выпила весь до последней капли» Вопрос: объясните растворение жемчужины, запишите уравнение реакции, если формула уксусной кислоты СН3СООН
Слайд 36
Карбонаты 1) Карбонаты металлов ( кроме щелочных ) при нагревании разлагаются: CuCO 3 – t CuO + CO 2 2) При пропускании углекислого газа из карбонатов образуются гидрокарбонаты: СаСО 3 + СО 2 + Н 2 О = Са (НСО 3 ) 2. 3) Гидрокарбонаты разлагаются до карбонатов: 2 NaHCO 3 – t Na 2 CO 3 + H 2 O + CO 2. 4) Карбонаты и гидрокарбонаты вступают в обменные реакции: а) с сильными кислотами (качественная реакция на карбонаты): Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ↑; б) с растворимыми солями и основаниями, если образуется осадок: Na 2 CO 3 + Ва (ОН) 2 = ВаСО 3 ↓+ 2 NaOH Na 2 CO 3 + СаС l 2 = СаСО 3 ↓+ 2 NaCl 5) Гидрокарбонаты реагируют со щелочами, образуя средние соли: КНСО 3 + КОН = К 2 СО 3 + Н 2 О Кремний – типичный неметалл, может быть окислителем и восстановителем
Слайд 38: Физические свойства Si
Вещество темно-серого цвета с металлическим блеском, довольно хрупок. Второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния образует большое количество природных веществ – горный хрусталь, кварц, кремнезем. Применение кремния и его соединений. Кремний используется в электронике для изготовления полупроводниковых приборов. Диоксид кремния применяется для производства стекла, керамики, бетонных изделий и кирпича. Чистый кварц используется в приборостроении.
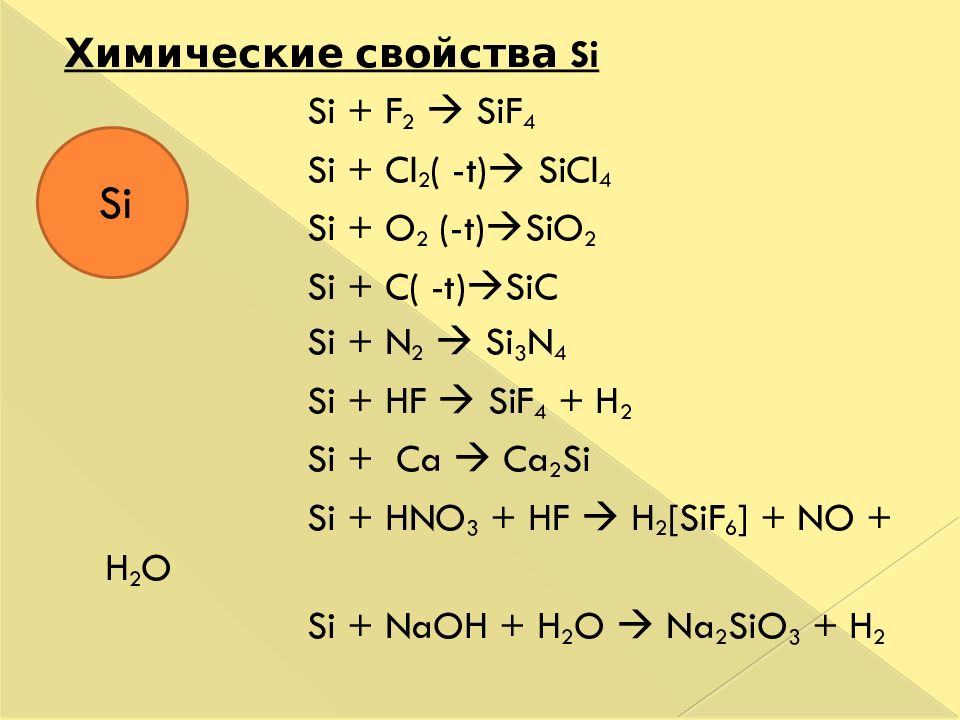
Слайд 39
Химические свойства Si Si + F 2 SiF 4 Si + Cl 2 ( -t) SiCl 4 Si + O 2 ( - t ) SiO 2 Si + C( -t) SiC Si + N 2 Si 3 N 4 Si + HF SiF 4 + H 2 Si + Ca Ca 2 Si Si + HNO 3 + HF H 2 [SiF 6 ] + NO + H 2 O Si + NaOH + H 2 O Na 2 SiO 3 + H 2 Si
Слайд 40: Силициды
Силициды – соединения кремния с металлами и неметаллами, в которых кремний имеет степень окисления -4. Ca 2 Si + 2H 2 SO 4 = 2CaSO 4 + SiH 4.( силан ). Среди таких силицидов наибольшее значение имеет карбид кремния – карборунд SiC, имеющий структуру алмаза. Получение: 2Mg + Si = Mg 2 Si, 2MgO + SiO 2 + 4C = Mg 2 Si + 4CO
Слайд 41: Силан SiH4
По физическим свойствам силаны сходны с углеводородами. Моносилан SiH4 и дисилан Si2Н6 являются бесцветными газами с неприятным запахом, трисилан Si3Н8 — бесцветная, ядовитая, летучая жидкость. Высшие члены гомологического ряда — твёрдые вещества. Силаны воспламеняются на воздухе, Si2Н6 взрывается при контакте с воздухом. Наиболее термически устойчивым является моносилан Силаны чрезвычайно легко окисляются. Моносилан в присутствии кислорода окисляется со вспышкой даже при температуре жидкого воздуха. В зависимости от условий реакции, продуктом окисления является либо SiO2, либо промежуточные вещества:
Слайд 42: Химические свойства
SiH4 + 2O2 = SiO2 + 2Н2O (самовоспламенение на воздухе) Активно взаимодействует со щелочами: SiH4 + 2NaOH + H2O = Na2SiO3 + 4H2. При наревании разлагается : SiH4 = Si + 2H2.
Слайд 43: получение
Образуются при действии на силицид магния соляной кислотой: Mg2Si + 4HCl = 2MgCl2 + SiH4.
Слайд 44: Оксид Кремния IV– кислотный оксид
В природе – речной песок, кварц. 1) Не реагирует с водой – т.к. кремниевая кислота нерастворима. 2) При сплавлении реагирует со щелочами: SiO2 + 2KOH = K2SiO3 + H2O 3) Реагирует с основными оксидами: SiO2 + MgО = MgSiO3 С карбонатами, фосфатами и сульфитами щелочных металлов: при сплавлении обр. газы: SiO2 + K2CO3 = K2SiO3 + CO2 SiO2+Са3(РО4)2 = Р2О5+СаSiO3 SiO2+ CaS O 3 = SO2 + СаSiO3 4) Из кислот растворяется только в плавиковой: SiO2 + 6HF = H2[SiF6] + 2H2O 5) При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний: SiO2 + 2Mg = Si + 2MgO или при избытке восстановителя – силициды: SiO2 + 4Mg = Mg2Si + 2MgO. 6) Взаимодействие с неметаллами. Реагирует с водородом: SiO2 + 2Н2 = Si + 2Н2O, Взаимодействует с углеродом: SiO2 + 3С = SiС + 2СO
Слайд 47: Кремниевая кислота
Получение : только косвенным путём, из солей: Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl Na2SiO3 + 2 Н2 O + 2CO2 = 2NaHCO3 +H2SiO3 ↓, Свойства: 1)Растворяются в концентрированных щелочах: H2SiO3 +4KOH = K2SiO3 + + 4H2O 2) Разлагаются при нагревании: H2SiO3 = SiO2 + H2O
Слайд 48
Силикаты Большинство нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом». Получение: 1) растворение кремния, кремниевой кислоты или оксида в щелочи: H 2 SiO 3 + 4KOH K 2 SiO 3 + 4H 2 O Si + 2NaOH + H 2 O = Na 2 SiO 3 + H 2 SiO 2 + 2KOH K 2 SiO 3 + H 2 O сплавление 2) Сплавление оксидов : СаО + SiO 2 CaSiO 3 3) Взаимодействие солей : K 2 SiO 3 + CaCl 2 = CaSiO 3 + 2KCl Стекло – тоже силикат.
Слайд 50: Запомни тривиальные названия веществ:
Na2CO3— кальцинированная сода NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия Na2CO3·10H2O - стиральная сода NaOH - Сода каустическая, Натр едкий K2CO3 - углекислый калий, пота́ш CaCO3 - Карбонат кальция (углекислый кальций ), мел, мрамор, известняк ( CuOH )2CO3 – Малахит CaSO4•2H2O - гипс
Слайд 51: Вопрос 1
Число электронов на внешнем энергетическом уровне атома углерода равно : 6 2 3 4
Слайд 53
В ряду C — Si — Ge — Sn неметаллические свойства элементов : уменьшаются увеличиваются не изменяются сначала уменьшаются, затем увеличиваются
Слайд 54
Наиболее устойчивой аллотропной модификацией углерода является : карбин графит алмаз поликумулен
Слайд 55
Какие реакции осуществимы : CaCO3 CaCO3 + 2HCl → CaCO3 + 2NaCl → CaCO3 + 2NaNO3 →
Слайд 56
Сокращенному ионному уравнению 2H+ + CO32- = H2O + CO2 соответствует взаимодействие между : HCl и Na2CO3( раствор) CaCO3 т и HCl ( раствор) Na2CO3 и H2SiO3 BaCO3 и HNO3
Слайд 57
Кремниевую кислоту можно получить из : CaSiO3 и CO2 SiO2 и H2O Na2SiO3 и HCl CaSiO3 и H2O
Слайд 58
Силан образуется при взаимодействии : кремния и водорода оксида кремния и водорода силицида магния и соляной кислоты силицида магния и воды
Слайд 59
В лаборатории углекислый газ получают в аппарате Киппа взаимодействием раствора соляной кислоты с карбонатом кальция. Почему его нельзя заменить карбонатом натрия ? карбонат натрия не реагирует с водой карбонат натрия растворяется в воде карбонат натрия бурно реагирует с соляной кислотой карбонат натрия нерастворим в воде
Слайд 60
Наличие углекислого газа можно доказать c помощью : NaCl Ca (OH)2 H2SO4 Na2CO3
Слайд 61
Метан выделяется при разложении водой следующего карбида : CaC2 BaC2 Al4C3 Ag2C2
Слайд 62
Ядовитый газ фосген имеет следующий элементарный состав в массовых долях: С — 12,1%, О — 16,2%, Cl — 71,7%. Его формула : C2O2Cl COCl COCl2 CO2Cl
Слайд 63
Через раствор, содержащий 16,8 г гидроксида калия, пропустили углекислый газ объемом 6,72 л (н. у.). В результате образовалась соль, массой : 60 г 30 г 15 г 3 г
Слайд 64
Объем углекислого газа (н. у.), полученного при прокаливании 10,92 г гидрокарбоната натрия и практическом выходе 92%, равен : 13.4 л 1.34 л 2.68 л 1.58 л
Слайд 65
К растворе массой 150г, в котором массовые доли NaOH и Na2CO3 соответсвенно равны 1,87% и 2,83%, добавили некоторое количество NaHCO3, при этом массовая доля NaOH снизилась до 1,05%. Найдите массовые доли остальных веществ в растворе (включая воду)
Слайд 66
1. Число электронов на внешнем уровне атома углерода. 1) 6; 2) 2; 3) 3; 4) 4; 5) 12. 2. Кристаллическая решетка у алмаза… 1) молекулярная; 2) ионная; 3) атомная; 4) металлическая. 3. Углерод проявляет восстановительные свойства в реакции. 1) Са + 2С = СаС2; 2) С+ 2FeO = Fe + CO; 3) CO2 + Li2O = Li2CO3; 4) 4Al + 3C = Al4C3.
Слайд 67
4. Углерод является окислителем в реакции. 1) Са + 2С = СаС2; 2) СО2+ ВаO = ВаCO3; 3) CO2 + Li2O = Li2CO3; 4) Н2О + С = СО + Н2. 5. Применяется в качестве термостойкого смазочного материала и для изготовления грифелей карандашей. 1) алмаз; 2) графит; 3) карбин ; 4) уголь;
Слайд 68
1. Число электронов на внешнем уровне атома кремния: 1) 6; 2) 2; 3) 3; 4) 4; 5) 12. 2. Кристаллическая решетка у графита… 1) молекулярная; 2) ионная; 3) атомная; 4) металлическая. 3. Углерод проявляет восстановительные свойства в реакции. 1) Ti + С = TiС ; 2) С+ ZnO = Zn + CO; 3) CO2 + Na2O = Na2CO3; 4) CO2 + 2KOH = K2CO3 + H2O
Слайд 69
4. Углерод является окислителем в реакции. 1) 2Н2 + С = СН4; 2) СО2+ ВаO = ВаCO3; 3) 3С+ 2Fe2O3 = 4Fe + 3CO2; 4) С + О2 = СО2 5. Применяется для резки стекла и шлифования драгоценных камней: 1) графит; 2) алмаз; 3) карбин ; 4) уголь;
Слайд 70
Программа А 1. Выберите правильный ответ. Оксиды металлов могут быть а) кислотными и основными б) основными и несолеобразующими в) кислотными и несолеобразующими 2. Установите соответствия. Характер свойств оксида Вещество 1. Кислотный 1.Оксид углерода (II) 2. Основной 2. Оксид углерода (IV) 3. Несолеобразующий 3. Оксид кремния (IV) 4. Амфотерный 3.Выберите правильные ответы. Кислотные оксиды реагируют с а) кислотами б) щелочами в) солями г) основными оксидами д) водой е) кислотными оксидами Программа В
Слайд 71
4Выберите правильный ответ Сокращенное ионное уравнение реакции оксидов кремния (IV) или углерода (IV) с раствором щелочи имеет вид а) RO2 + 2OH- = RO32- + H2O Б) RO2 + 2 Na + + 2OH- = Na 2RO3 + H2O в) RO2 + 2OH- = RO32-+ 2Н+ Программа С 5Выберите правильный ответ Вокислительно -восстановительных реакциях оксид углерода (IV) может проявлять свойства а) окислителя б) восстановителя в) окислителя и восстановителя 6Выберите правильный ответ Вокислительно -восстановительных реакциях оксид углерода (II) может проявлять свойства а) окислителя б) восстановителя в) окислителя и восстановителя
Слайд 72
Допишите уравнения химических реакций, определите окислитель и восстановитель: PbO+CO →; Fe2O3 + CO → CO+ O2 →