Первый слайд презентации
Лекция 11 Диаграмма состояния Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры Д/с показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, = диаграмма равновесия. 1 Температуры, соответствующие фазовым превращениям, называют критическими точками. Lk 11_OM
Слайд 2
2 Ликвидус - точки отвечающие началу кристаллизации, Солидус - точки отвечающие концу кристаллизации. По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс – концентрация компонентов, по оси ординат – температура Диаграммы состояния двухкомпонентных сплавов Lk 11_OM
Слайд 3
3 Д иаграмма состояния сплавов, образующих механические смеси - 1рода Анализ д /с К = 2 (компоненты А и В); 2. f = 3 (кристаллы компонента А, кристаллы компонента В, Ж. фаза). 3. линии диаграммы: · ликвидус DCE, состоит из двух ветвей, сходящихся в одной точке; · солидус FCG, параллельна оси концентраций стремится к осям компонентов, но не достигает их; Эвтектика – мелкодисперсная мех. смесь разнородных кристаллов, кристаллизующихся одновременно при постоянной, самой низкой для рассматриваемой системы, температуре. При образовании сплавов механических смесей эвтектика состоит из кристаллов компонентов А и В: Эвт. ( кр. А + кр. В) Lk 11_OM
Слайд 4
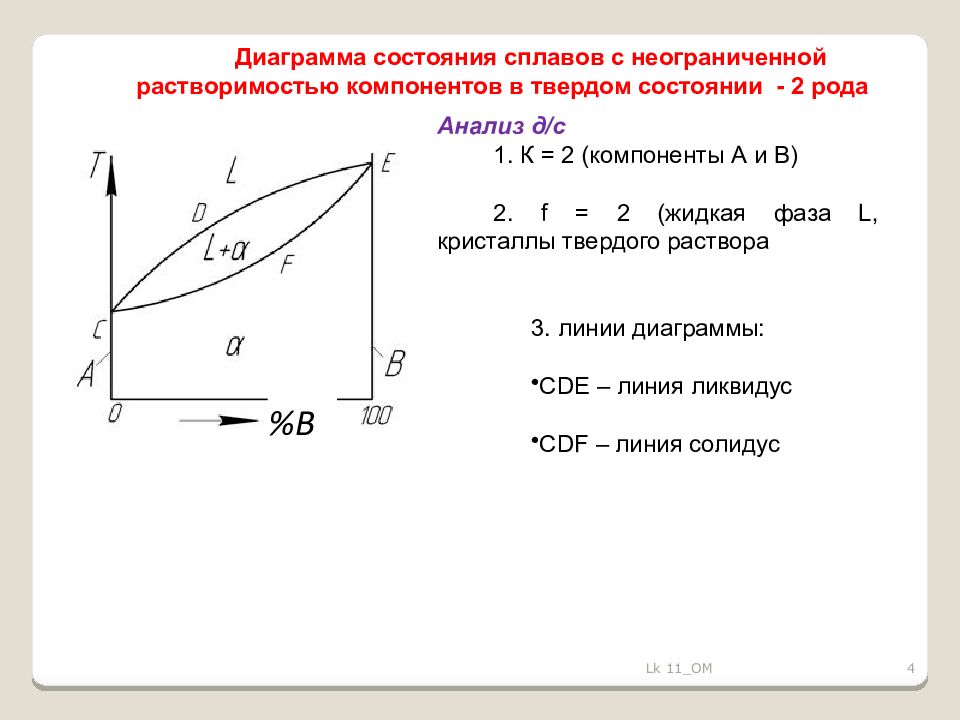
4 Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии - 2 рода %В Анализ д /с 1. К = 2 (компоненты А и В) 2. f = 2 (жидкая фаза L, кристаллы твердого раствора 3. линии диаграммы: CDE – линия ликвидус CDF – линия солидус Lk 11_OM
Слайд 5
5 Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии - 3 рода К = 2 (компоненты А и В); f = 3 (ж.фаза и кристаллы твердых растворов ( раствор компонента В в компоненте А) и ( раствор компонента А в компоненте В)); Анализ д /с Основные линии диаграммы: · линия ликвидус acb, состоит из двух ветвей, сходящихся в одной точке; · линия солидус аdcfb, состоит из трех участков; · dm – линия предельной концентрации компонента В в компоненте А; · fn – линия предельной концентрации компонента А в компоненте В. Lk 11_OM
Слайд 6
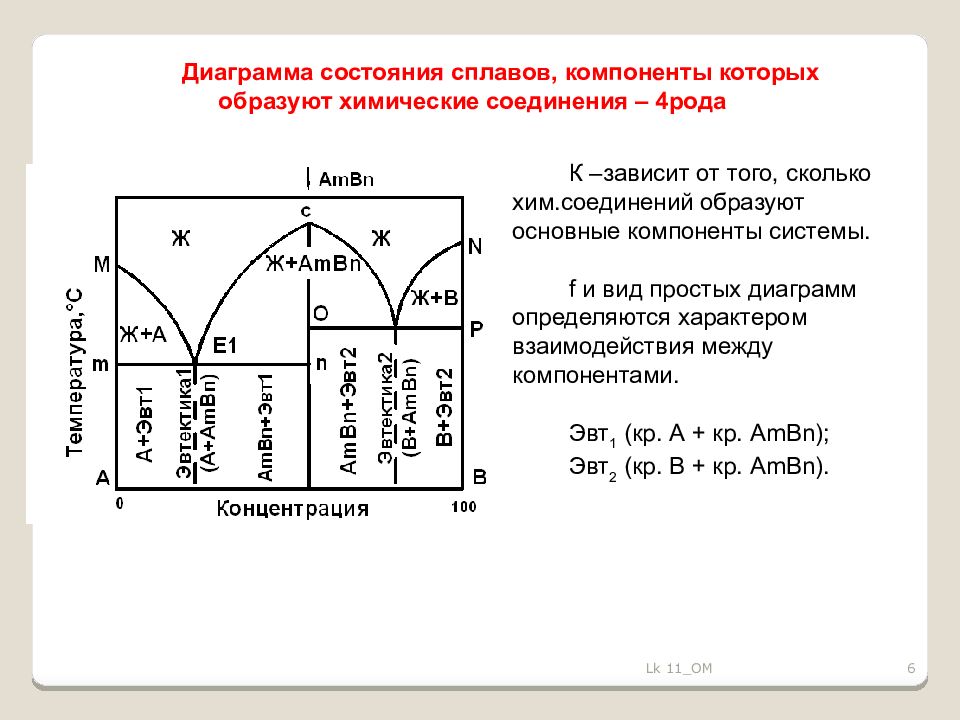
6 Диаграмма состояния сплавов, компоненты которых образуют химические соединения – 4рода К –зависит от того, сколько хим.соединений образуют основные компоненты системы. f и вид простых диаграмм определяются характером взаимодействия между компонентами. Эвт 1 ( кр. А + кр. AmBn ); Эвт 2 ( кр. B + кр. AmBn ). Lk 11_OM
Слайд 8
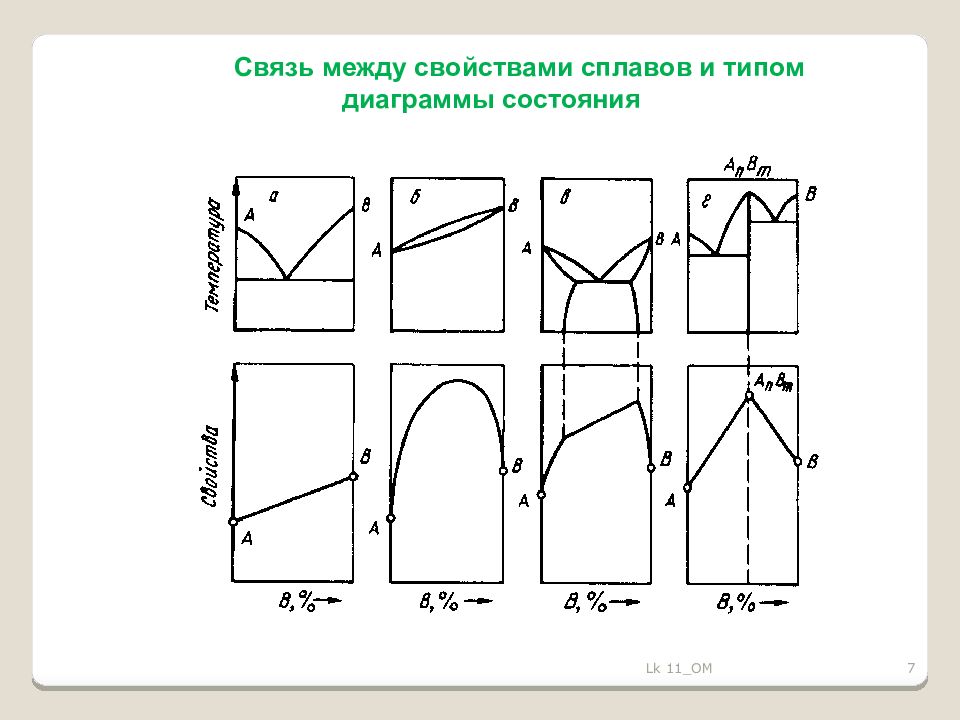
8 З ависимость установлена Курнаковым При образовании мех.смесей свойства изменяются по линейному закону. Значения характеристик свойств сплава находятся между характеристиками чистых компонентов. При образовании тв.растворов с неограниченной растворимостью свойства сплавов изменяются по криволинейной зависимости. При образовании тв.растворов с ограниченной растворимостью свойства в интервале концентраций, отвечающих однофазным твердым растворам, изменяются по криволинейному закону, а в двухфазной области – по линейному закону. При образовании хим.соединений концентрация химического соединения отвечает максимуму на кривой. Эта точка перелома, соответствующая химическому соединению, называется сингулярной точкой Lk 11_OM
Слайд 9
правило фаз или закон Гиббса Фазой называется однородная часть системы, отделенная от других частей системы (фаз) поверхность раздела, при переходе через которую химический состав или структура вещества изменяется скачком. Компонентами называются вещества, образующие систему. Под числом степеней свободы (вариантностью) системы понимают число внешних, и внутренних факторов (температура, давление и концентрация), которое можно изменять без изменения числа фаз в системе. 9 Lk 11_OM
Последний слайд презентации: Лекция 11 Диаграмма состояния Диаграмма состояния представляет собой
нонвариантная система - число степеней свободы равно нулю, нельзя изменять внешние и внутренние факторы системы без того, чтобы это не вызывало изменения числа фаз. моновариантная система - число степеней свободы равно единице, возможно изменение в некоторых пределах одного из перечисленных факторов, и это не вызовет уменьшения или увеличения числа фаз. Пусть система состоит из К независимых компонентов и находится в форме Ф различных, отделенных друг от друга поверхностью раздела частей (фаз). Число внешних переменных обозначим в общем случае через Р. С = К - Ф + Р или с= k-f+p правила фаз Закон Гиббса ( Gibbs ) При наличии практически постоянного давления и при отсутствии заметного влияния других внешних факторов равновесия, кроме температуры: С = К - Ф + 1 10 Lk 11_OM