Первый слайд презентации
Лекция 1 Основные понятия и законы химии Еремин Вадим Владимирович, Химический факультет МГУ vadim@educ.chem.msu.ru Физтех, 1 курс. Осень 2015
Физтех, 1 курс. Осень 2015 Всего – 16 лекций Введение – 1 лекция Строение вещества – 4 лекции Теоретическая неорганическая химия – 5 лекций Химия элементов – 5 лекций Химическая кинетика и катализ – 1 лекция Форма аттестации – экзамен 2
Слайд 3: Литература
Еремин В.В., Борщевский А.Я. Основы общей и физической химии. – М.: Интеллект, 2012. Глинка Н.Л. Общая химия. Изд. 28-е. – М.: Интеграл-пресс, 2000. Глинка Н.Л. Задачи и упражнения по общей химии. – М.: Интеграл-пресс, 2005. Ахметов Н.С. Общая и неорганическая химия. Изд. 4-е. – М.: Высшая школа, Академия, 2001. Неорганическая химия. В 3-х тт. / под ред. Третьякова Ю.Д. – М.: Академия, 2004-2007. В 2012 году вышел учебник «Общая и физическая химия», по сути – Химия для физиков Физтех, 1 курс. Осень 2015 3
Слайд 4: Наука
Современная наука – способ познания реального мира, включающего в себя как ощущаемую органами чувств человека реальность, так и реальность невидимую, способ познания, основанный на построении проверяемых моделей этой реальности. (Уильям Хетчер) Физтех, 1 курс. Осень 2015 4
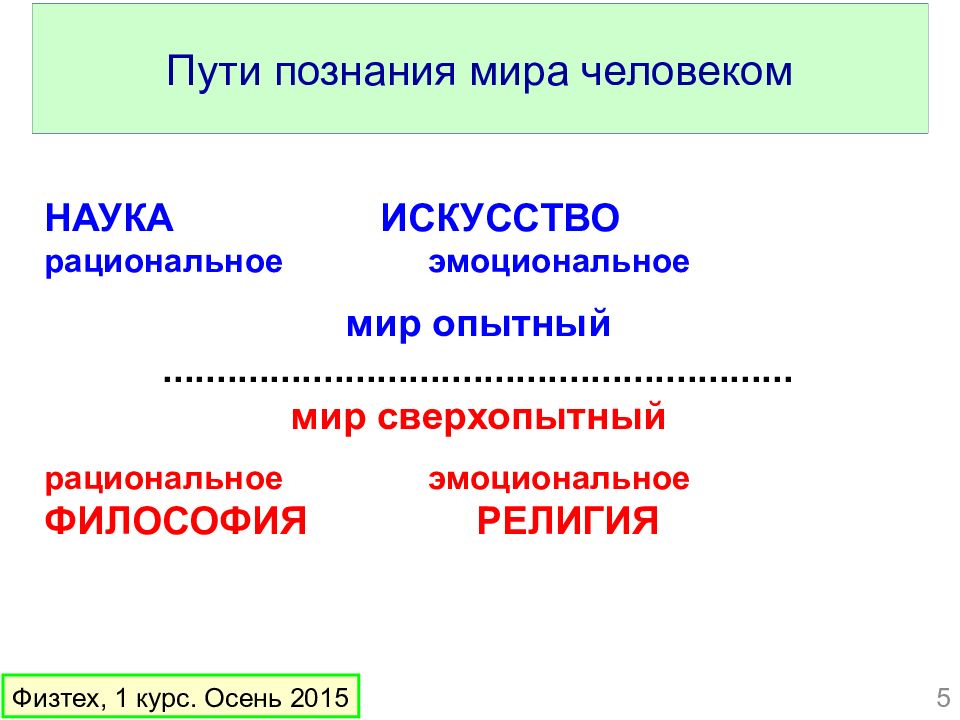
Слайд 5: Пути познания мира человеком
НАУКА ИСКУССТВО рациональное эмоциональное мир опытный ........................................................... мир сверхопытный рациональное эмоциональное ФИЛОСОФИЯ РЕЛИГИЯ Физтех, 1 курс. Осень 2015 5
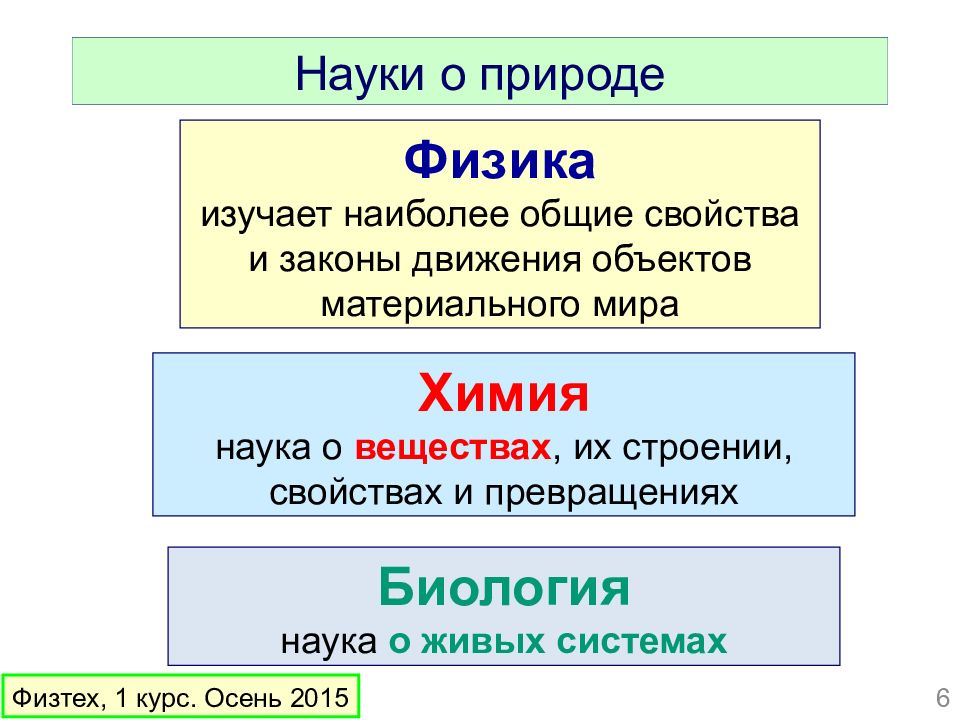
Слайд 6
Физика изучает наиболее общие свойства и законы движения объектов материального мира Химия наука о веществах, их строении, свойствах и превращениях Биология наука о живых системах Науки о природе Физтех, 1 курс. Осень 2015 6
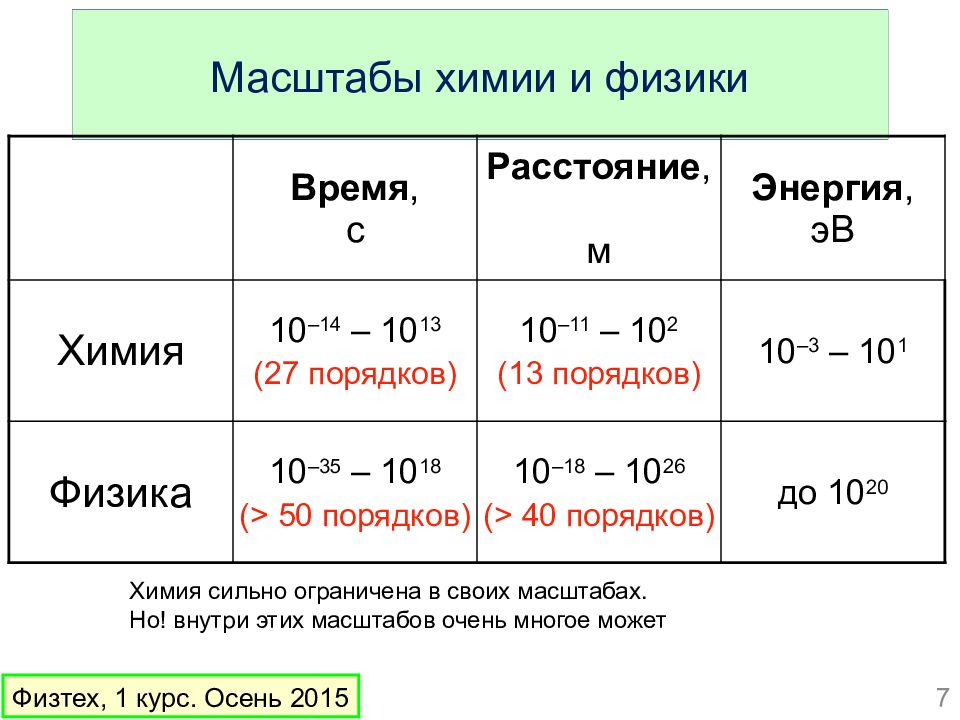
Слайд 7: Масштабы химии и физики
Время, с Расстояние, м Энергия, эВ Химия 10 –14 – 10 13 (27 порядков) 10 –1 1 – 10 2 ( 13 порядков) 10 – 3 – 10 1 Физика 10 –35 – 10 18 ( > 50 порядков) 10 – 18 – 10 26 ( > 4 0 порядков) до 10 20 Физтех, 1 курс. Осень 2015 Химия сильно ограничена в своих масштабах. Но! внутри этих масштабов очень многое может 7
Слайд 8
В основе химического мышления – атомно-молекулярная картина мира Физтех, 1 курс. Осень 2015 8
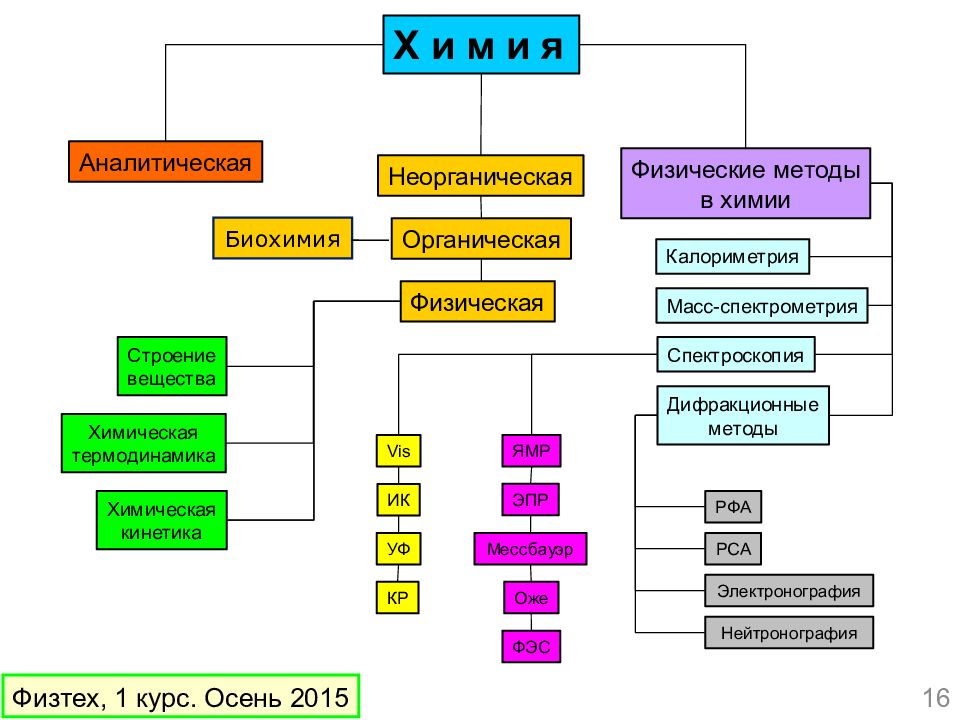
Слайд 9: Основные понятия химии. 1. Вещества
Вещества ( > 100 млн.) 29 июня 2015 года в базе данных CAS было зарегистрировано 100-миллионное вещество – терапевтическое средство от лейкемии: (4 S )-6-(4- хлорфенил )- N - этил -8-[2-[[4-[( гидроксидиметилсилил ) метил ] бензоил ] амино ] этокси ]-1- метил -4 H -[1,2,4] триазоло [4,3- α][1,4] бензодиазепин -4- ацетамид 9 Физтех, 1 курс. Осень 2015
Слайд 10: Что надо знать о веществах?
Формула (из чего состоит) Структура (как устроено) Физические свойства Химические свойства Способы получения (лаб. и промышл.) Практическое применение 10 Физтех, 1 курс. Осень 2015
Слайд 11: Основные понятия химии. 2. Реакции
Химические реакции ( > 80 млн.) Что надо знать о химической реакции? Условия проведения – температура, давление, агрегатное состояние веществ, растворитель, катализатор. Кинетические и термодинамические функции – энергия активации, теплота, энтропия и энергия Гиббса Механизм реакции – последовательность разрыва и образования химических связей 11 Физтех, 1 курс. Осень 2015
Слайд 12: Основные вопросы химии
Как устроены вещества? Как связано строение веществ с их свойствами? Корреляция структура-свойство Как создать вещество с заданной структурой и нужными свойствами? Молекулярный дизайн Какие надо создать условия, чтобы реакция шла в нужном направлении? 12 Физтех, 1 курс. Осень 2015
Слайд 13: Особенности химии как науки
Отсутствие собственных законов Многообразие объектов Создание собственного предмета для изучения – большинство из 100 млн. веществ не существует в природе Основная задача химии – создание веществ с полезными свойствами Никто не сделал так много для улучшения условий жизни людей, как химики. Г. Крото, Нобелевский лауреат по химии 1996 г. 13 Физтех, 1 курс. Осень 2015
Слайд 14: Сотрудничество химии и физики
Физическая химия исследует вещества, состоящие из большого числа атомов и молекул, с помощью физических методов и на основе законов физики. Химическая физика основной упор делает на физическое исследование элементарных химических процессов и строение молекул, ее предметом являются отдельные частицы вещества. Физико-химический факультет МГУ (2006 г.р.) 14 Физтех, 1 курс. Осень 2015
Слайд 15: Междисциплинарные журналы
Journal of Chemical Physics Journal of Physical Chemistry ( серии A, B, C) Chemical Physics Letters Physical Chemistry Chemical Physics (PCCP) Журнал физической химии Химическая физика 15 Физтех, 1 курс. Осень 2015
Слайд 17: Основные теории химии
Квантовая химия (квантовая механика в применении к атомам, молекулам и твердым телам) Химическая термодинамика Химическая кинетика Структурная теория + стереохимия 17 Физтех, 1 курс. Осень 2015
Слайд 18: Язык химии. 1. Формулы
Химические формулы отражают состав и (или) строение молекул а) молекулярные – С 6 H 6 б) эмпирические (брутто) – CH в) структурные – Названия веществ Уравнения и схемы реакций 18 Физтех, 1 курс. Осень 2015
Слайд 19: Элементный анализ
По массовым долям элементов можно определить брутто-формулу A x B y C z 19 Физтех, 1 курс. Осень 2015
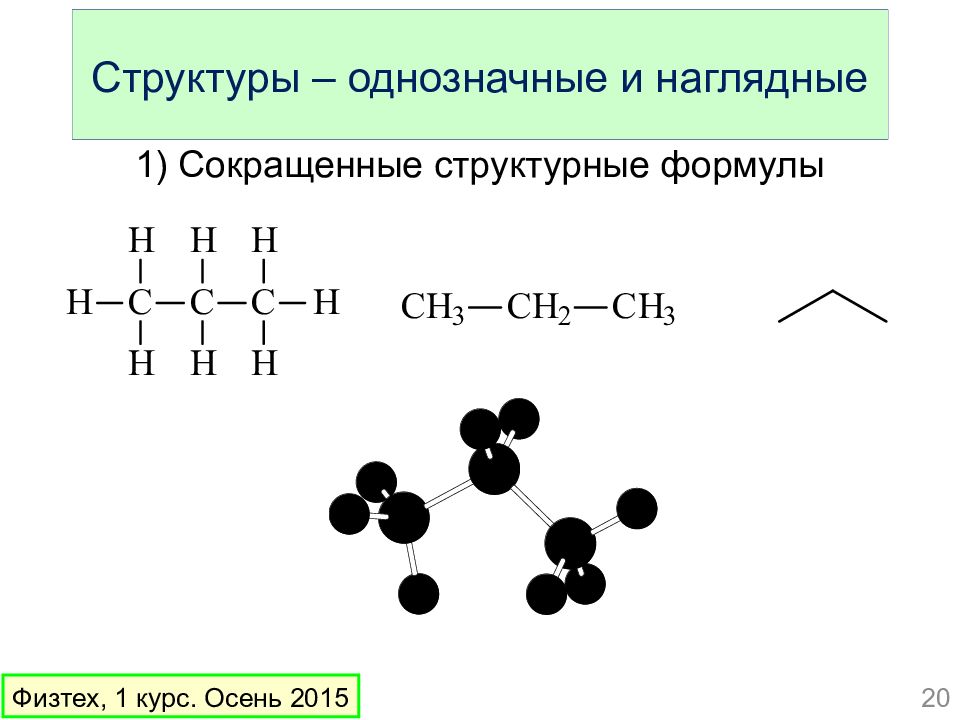
Слайд 20: Структуры – однозначные и наглядные
1) Сокращенные структурные формулы 20 Физтех, 1 курс. Осень 2015
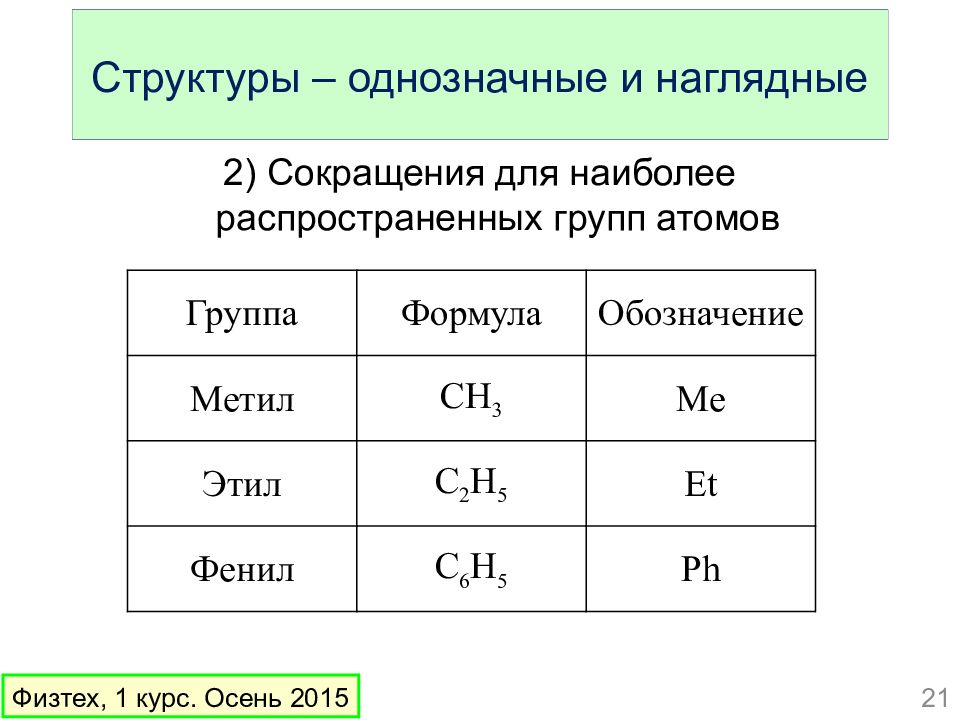
Слайд 21: Структуры – однозначные и наглядные
2) Сокращения для наиболее распространенных групп атомов Группа Формула Обозначение Метил CH 3 Me Этил C 2 H 5 Et Фенил C 6 H 5 Ph 21 Физтех, 1 курс. Осень 2015 Структуры – однозначные и наглядные
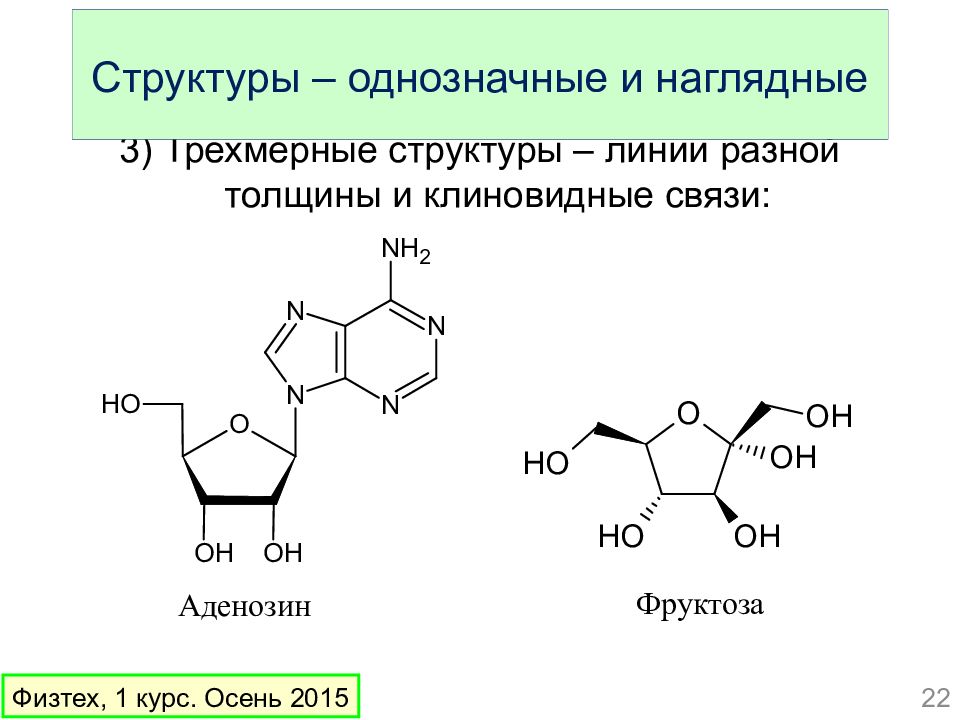
Слайд 22: Структуры – однозначные и наглядные
3) Трехмерные структуры – линии разной толщины и клиновидные связи: Аденозин Фруктоза 22 Физтех, 1 курс. Осень 2015 Структуры – однозначные и наглядные
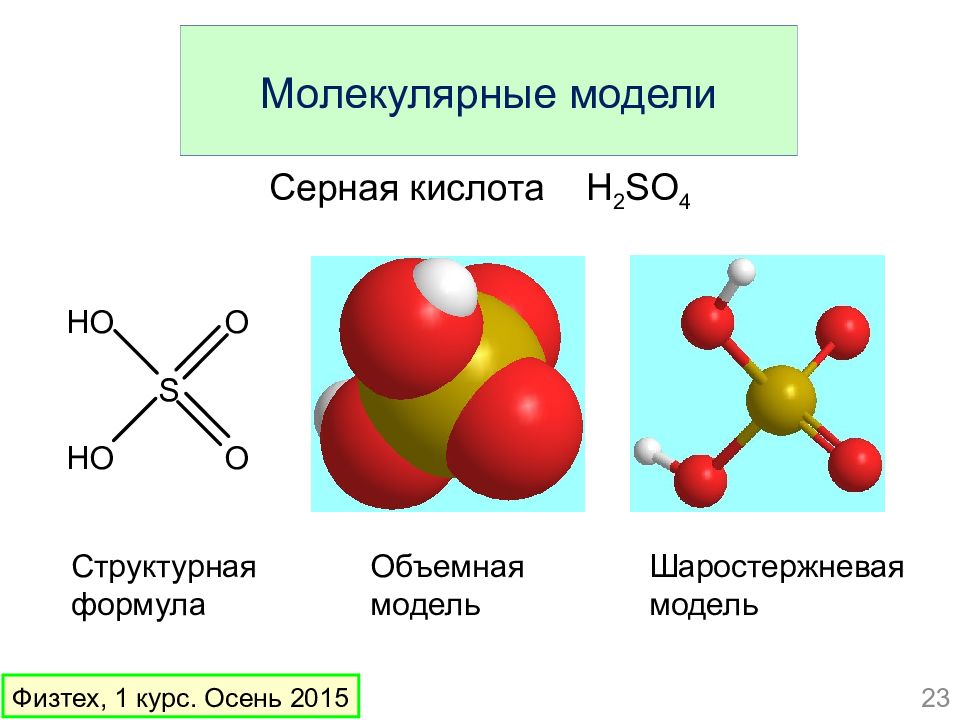
Слайд 23: Молекулярные модели
Структурная формула Объемная модель Шаростержневая модель Серная кислота H 2 SO 4 23 Физтех, 1 курс. Осень 2015
Слайд 24: Названия
По номенклатуре – длинные, предпочитают использовать тривиальные 2-Гидроксипропан-1,2,3-трикарбоновая кислота (лимонная кислота) 24 Физтех, 1 курс. Осень 2015
Слайд 25: Вещества
Индивидуальные (чистые) Смеси Простые Сложные (химические соединения) а) постоянного состава – CO 2 б) переменного состава – TiO x (широкая область гомогенности, x = 0.65-1.25 ) Вещество – любая совокупность атомов, молекул, ионов 25 Физтех, 1 курс. Осень 2015
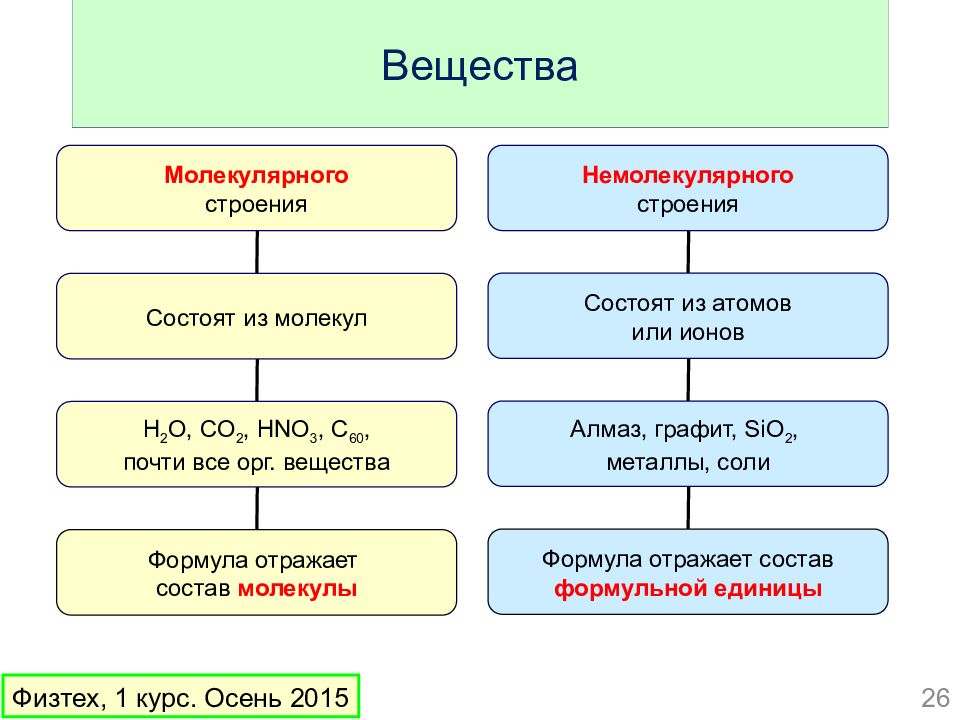
Слайд 26: Вещества
Молекулярного строения Состоят из молекул H 2 O, CO 2, HNO 3, C 60, почти все орг. вещества Формула отражает состав молекулы Немолекулярного строения Состоят из атомов или ионов Алмаз, графит, SiO 2, металлы, соли Формула отражает состав формульной единицы Вещества 26 Физтех, 1 курс. Осень 2015
Слайд 27: Количество вещества
1 моль – 6.0221 x10 23 частиц N A = 6.0221 x10 23 моль –1 – постоянная Авогадро 27 Физтех, 1 курс. Осень 2015 F – любое аддитивное (экстенсивное) свойство: масса, объем, число частиц, заряд
Слайд 28: Молярные (мольные) величины
– молярная масса. [ M ] = г / моль Численно равна массе молекулы в а.е.м. M (CO 2 ) = 44 г / моль, m ( молек. CO 2 ) = 44 а.е.м. – молярный объем. [ V m ] = л / моль Для твердых веществ и жидкостей – практически постоянный. Для газов – зависит от T и P : V m = RT / P – постоянная Фарадея Равна заряду одного моля электронов 28 Физтех, 1 курс. Осень 2015
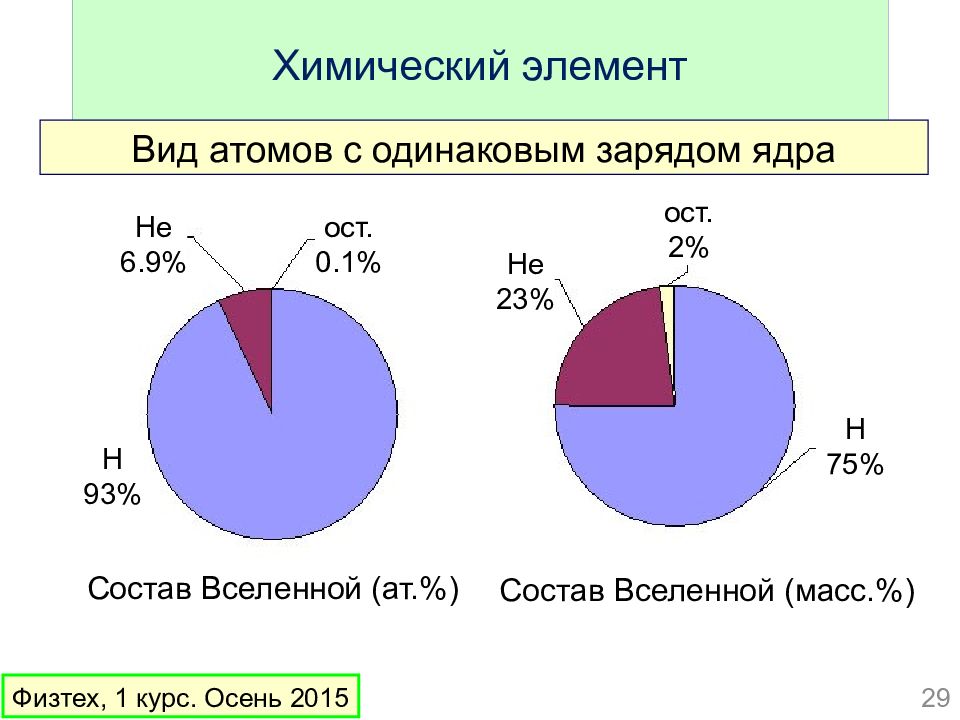
Слайд 29: Химический элемент
Вид атомов с одинаковым зарядом ядра 29 Физтех, 1 курс. Осень 2015 Состав Вселенной (ат.%) Состав Вселенной (масс.%) H 93% He 6.9% ост. 0. 1 % He 23 % ост. 2 % H 75 %
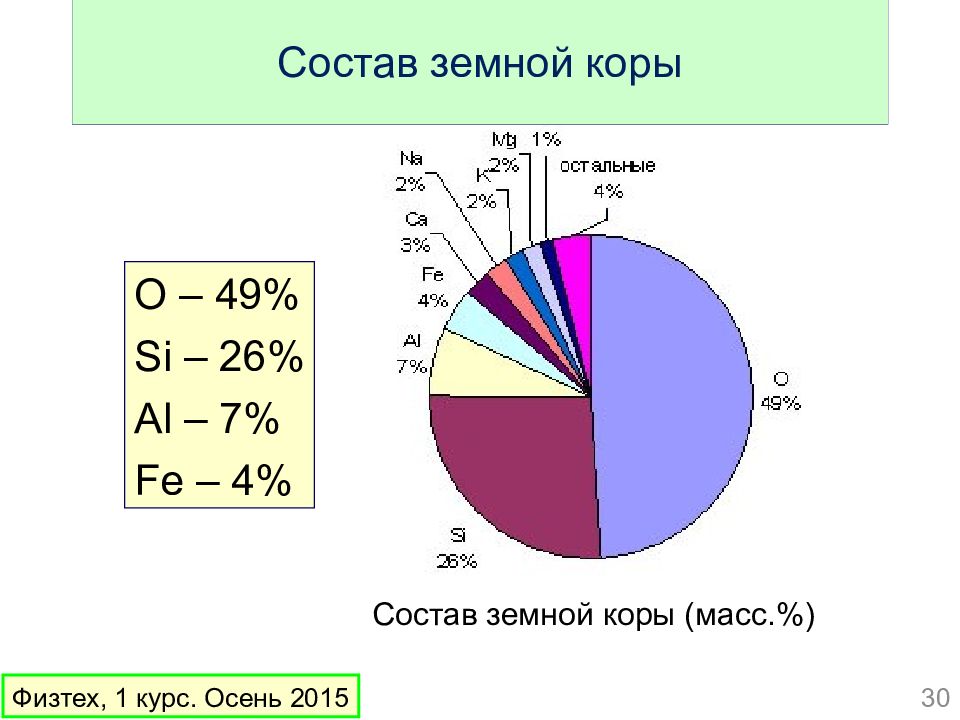
Слайд 30: Состав земной коры
O – 49% Si – 26% Al – 7% Fe – 4% Состав земной коры 30 Физтех, 1 курс. Осень 2015 Состав земной коры (масс.%)
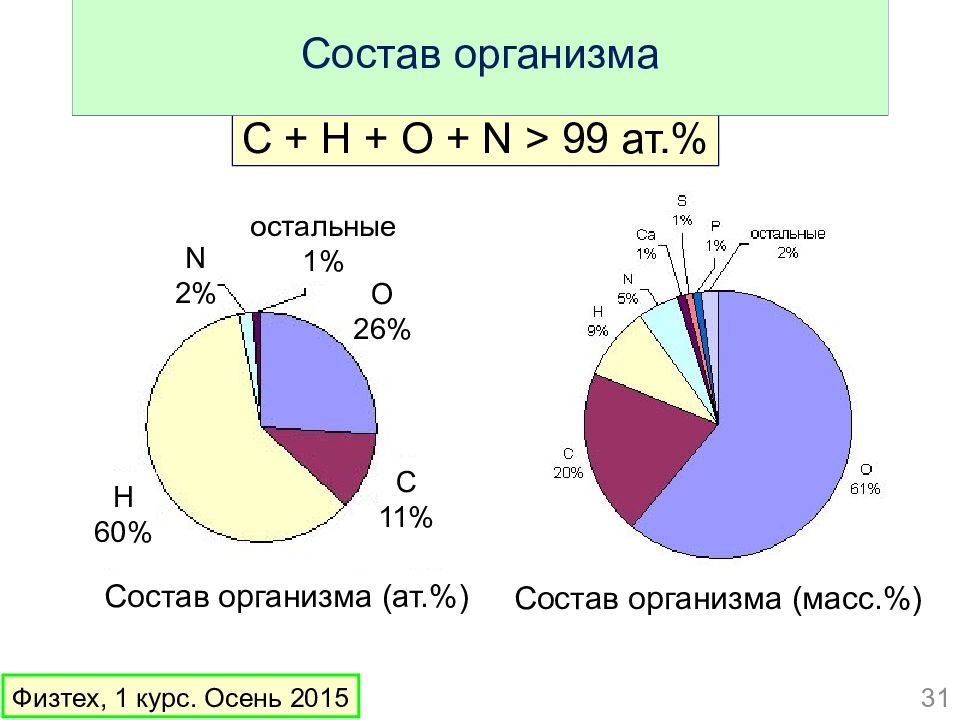
Слайд 31: Состав организма
C + H + O + N > 99 ат.% Состав организма Состав организма (ат.%) Состав организма (масс.%) 31 Физтех, 1 курс. Осень 2015 С 11 % O 26% H 60% N 2% остальные 1 %
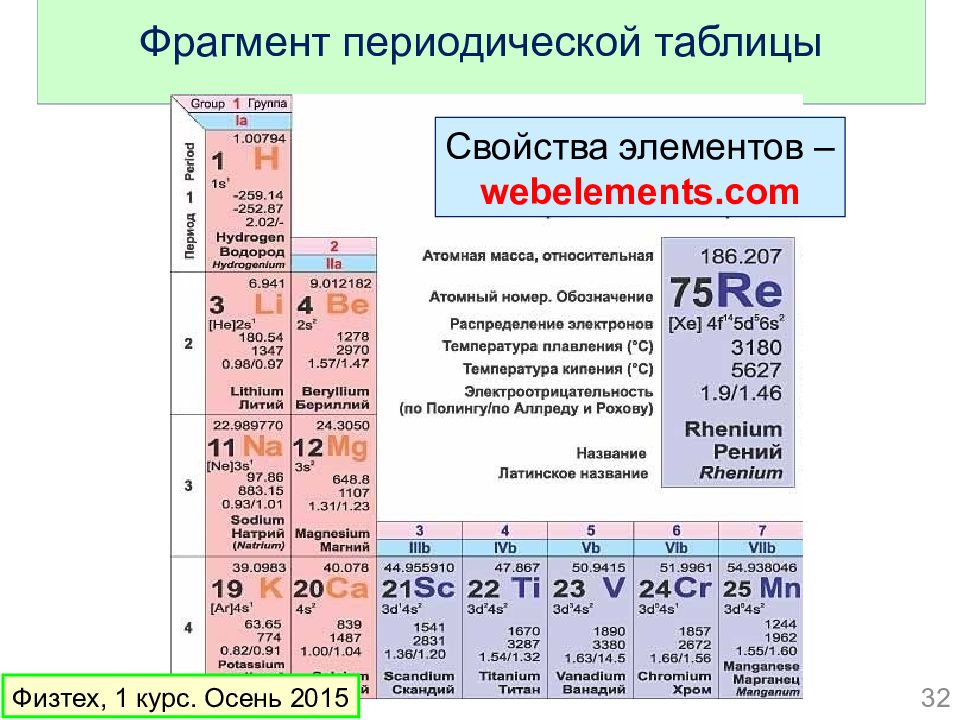
Слайд 32: Фрагмент периодической таблицы
32 Физтех, 1 курс. Осень 2015 Свойства элементов – webelements.com
Слайд 33: Периодическая система. Длинный вариант
55 87 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H 1 s 1 2 He 1 s 2 3 Li 2 s 1 4 Be 2 s 2 5 B 2 s 2 2 p 1 6 C 2 s 2 2 p 2 7 N 2 s 2 2 p 3 8 O 2 s 2 2 p 4 9 F 2 s 2 2 p 5 10 Ne 2 s 2 2 p 6 11 Na 3 s 1 12 Mg 3 s 2 13 Al 3 s 2 3 p 1 14 Si 3 s 2 3 p 2 15 P 3 s 2 3 p 3 16 S 3 s 2 3 p 4 17 Cl 3 s 2 3 p 5 18 Ar 3 s 2 3 p 6 19 K 4 s 1 20 Ca 4 s 2 21 Sc 3 d 1 4 s 2 22 Ti 3 d 2 4 s 2 23 V 3 d 3 4 s 2 24 Cr 3 d 5 4 s 1 25 Mn 3 d 5 4 s 2 26 Fe 3 d 6 4 s 2 27 Co 3 d 7 4 s 2 28 Ni 3 d 8 4 s 2 29 Cu 3 d 10 4 s 1 30 Zn 3 d 10 4 s 2 31 Ga 4 s 2 4 p 1 32 Ge 4 s 2 4 p 2 33 As 4 s 2 4 p 3 34 Se 4 s 2 4 p 4 35 Br 4 s 2 4 p 5 36 Kr 4 s 2 4 p 6 37 Rb 5 s 1 38 Sr 5 s 2 39 Y 4 d 1 5 s 2 40 Zr 4 d 2 5 s 2 41 Nb 4 d 4 4 s 1 42 Mo 4 d 5 5 s 1 43 Tc 4 d 5 5 s 2 44 Ru 4 d 7 5 s 1 45 Rh 4 d 8 4 s 1 46 Pd 4 d 10 5 s 0 47 Ag 4 d 10 5 s 1 48 Cd 4 d 10 5 s 2 49 In 5 s 2 5 p 1 50 Sn 5 s 2 5 p 2 51 Sb 5 s 2 5 p 3 52 Te 5 s 2 5 p 4 53 I 5 s 2 5 p 5 54 Xe 5 s 2 5 p 6 Cs 6 s 1 56 Ba 6 s 2 57 La 5 d 1 6 s 2 7 2 Hf 5 d 2 6 s 2 7 3 Ta 5 d 3 6 s 2 7 4 W 5 d 4 6 s 2 7 5 Re 5 d 5 6 s 2 7 6 Os 5 d 6 6 s 2 7 7 Ir 5 d 7 6 s 2 78 Pt 5 d 9 6 s 1 7 9 Au 5 d 10 6 s 1 8 0 Hg 5 d 10 6 s 2 81 Tl 6 s 2 6 p 1 82 Pb 6 s 2 6 p 2 83 Bi 6 s 2 6 p 3 84 Po 6 s 2 6 p 4 85 At 6 s 2 6 p 5 86 Rn 6 s 2 6 p 6 Fr 7 s 1 88 Ra 7 s 2 89 Ac 6 d 1 7 s 2 s - блок d - блок p - блок 58 Ce 4 f 1 5 d 1 6 s 2 59 Pr 4 f 3 5 d 0 6 s 2 60 Nd 4 f 4 5 d 0 6 s 2 61 Pm 4 f 5 5 d 0 6 s 2 62 Sm 4 f 6 5 d 0 6 s 2 63 Eu 4 f 7 5 d 0 6 s 2 64 Gd 4 f 7 5 d 1 6 s 2 65 Tb 4 f 9 5 d 0 6 s 2 66 Dy 4 f 10 5 d 0 6 s 2 67 Ho 4 f 11 5 d 0 6 s 2 68 Er 4 f 12 5 d 0 6 s 2 69 Tm 4 f 13 5 d 0 6 s 2 70 Yb 4 f 14 5 d 0 6 s 2 71 Lu 4 f 0 5 d 1 6 s 2 90 Th 5 f 0 6 d 2 7 s 2 91 Pa 5 f 2 6 d 1 7 s 2 92 U 5 f 3 6 d 1 7 s 2 93 Np 5 f 4 6 d 1 7 s 2 94 Pu 5 f 6 6 d 0 7 s 2 95 Am 5 f 7 6 d 0 7 s 2 96 Cm 5 f 7 6 d 1 7 s 2 97 Bk 5 f 9 6 d 0 7 s 2 98 Cf 5 f 10 6 d 0 7 s 2 99 Es 5 f 11 6 d 0 7 s 2 100 Fm 5 f 12 6 d 0 7 s 2 101 Md 5 f 13 6 d 0 7 s 2 102 No 5 f 14 6 d 0 7 s 2 103 Lr 5 f 14 6 d 1 7 s 2 f - блок 55 87 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H 1 s 1 2 He 1 s 2 3 Li 2 s 1 4 Be 2 s 2 5 B 2 s 2 2 p 1 6 C 2 s 2 2 p 2 7 N 2 s 2 2 p 3 8 O 2 s 2 2 p 4 9 F 2 s 2 2 p 5 10 Ne 2 s 2 2 p 6 11 Na 3 s 1 12 Mg 3 s 2 13 Al 3 s 2 3 p 1 14 Si 3 s 2 3 p 2 15 P 3 s 2 3 p 3 16 S 3 s 2 3 p 4 17 Cl 3 s 2 3 p 5 18 Ar 3 s 2 3 p 6 19 K 4 s 1 20 Ca 4 s 2 21 Sc 3 d 1 4 s 2 22 Ti 3 d 2 4 s 2 23 V 3 d 3 4 s 2 24 Cr 3 d 5 4 s 1 25 Mn 3 d 5 4 s 2 26 Fe 3 d 6 4 s 2 27 Co 3 d 7 4 s 2 28 Ni 3 d 8 4 s 2 29 Cu 3 d 10 4 s 1 30 Zn 3 d 10 4 s 2 31 Ga 4 s 2 4 p 1 32 Ge 4 s 2 4 p 2 33 As 4 s 2 4 p 3 34 Se 4 s 2 4 p 4 35 Br 4 s 2 4 p 5 36 Kr 4 s 2 4 p 6 37 Rb 5 s 1 38 Sr 5 s 2 39 Y 4 d 1 5 s 2 40 Zr 4 d 2 5 s 2 41 Nb 4 d 4 4 s 1 42 Mo 4 d 5 5 s 1 43 Tc 4 d 5 5 s 2 44 Ru 4 d 7 5 s 1 45 Rh 4 d 8 4 s 1 46 Pd 4 d 10 5 s 0 47 Ag 4 d 10 5 s 1 48 Cd 4 d 10 5 s 2 49 In 5 s 2 5 p 1 50 Sn 5 s 2 5 p 2 51 Sb 5 s 2 5 p 3 52 Te 5 s 2 5 p 4 53 I 5 s 2 5 p 5 54 Xe 5 s 2 5 p 6 Cs 6 s 1 56 Ba 6 s 2 57 La 5 d 1 6 s 2 7 2 Hf 5 d 2 6 s 2 7 3 Ta 5 d 3 6 s 2 7 4 W 5 d 4 6 s 2 7 5 Re 5 d 5 6 s 2 7 6 Os 5 d 6 6 s 2 7 7 Ir 5 d 7 6 s 2 78 Pt 5 d 9 6 s 1 7 9 Au 5 d 10 6 s 1 8 0 Hg 5 d 10 6 s 2 81 Tl 6 s 2 6 p 1 82 Pb 6 s 2 6 p 2 83 Bi 6 s 2 6 p 3 84 Po 6 s 2 6 p 4 85 At 6 s 2 6 p 5 86 Rn 6 s 2 6 p 6 Fr 7 s 1 88 Ra 7 s 2 89 Ac 6 d 1 7 s 2 s - блок d - блок p - блок 58 Ce 4 f 1 5 d 1 6 s 2 59 Pr 4 f 3 5 d 0 6 s 2 60 Nd 4 f 4 5 d 0 6 s 2 61 Pm 4 f 5 5 d 0 6 s 2 62 Sm 4 f 6 5 d 0 6 s 2 63 Eu 4 f 7 5 d 0 6 s 2 64 Gd 4 f 7 5 d 1 6 s 2 65 Tb 4 f 9 5 d 0 6 s 2 66 Dy 4 f 10 5 d 0 6 s 2 67 Ho 4 f 11 5 d 0 6 s 2 68 Er 4 f 12 5 d 0 6 s 2 69 Tm 4 f 13 5 d 0 6 s 2 70 Yb 4 f 14 5 d 0 6 s 2 71 Lu 4 f 0 5 d 1 6 s 2 90 Th 5 f 0 6 d 2 7 s 2 91 Pa 5 f 2 6 d 1 7 s 2 92 U 5 f 3 6 d 1 7 s 2 93 Np 5 f 4 6 d 1 7 s 2 94 Pu 5 f 6 6 d 0 7 s 2 95 Am 5 f 7 6 d 0 7 s 2 96 Cm 5 f 7 6 d 1 7 s 2 97 Bk 5 f 9 6 d 0 7 s 2 98 Cf 5 f 10 6 d 0 7 s 2 99 Es 5 f 11 6 d 0 7 s 2 100 Fm 5 f 12 6 d 0 7 s 2 101 Md 5 f 13 6 d 0 7 s 2 102 No 5 f 14 6 d 0 7 s 2 103 Lr 5 f 14 6 d 1 7 s 2 f - блок 55 87 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H 1 s 1 2 He 1 s 2 3 Li 2 s 1 4 Be 2 s 2 5 B 2 s 2 2 p 1 6 C 2 s 2 2 p 2 7 N 2 s 2 2 p 3 8 O 2 s 2 2 p 4 9 F 2 s 2 2 p 5 10 Ne 2 s 2 2 p 6 11 Na 3 s 1 12 Mg 3 s 2 13 Al 3 s 2 3 p 1 14 Si 3 s 2 3 p 2 15 P 3 s 2 3 p 3 16 S 3 s 2 3 p 4 17 Cl 3 s 2 3 p 5 18 Ar 3 s 2 3 p 6 19 K 4 s 1 20 Ca 4 s 2 21 Sc 3 d 1 4 s 2 22 Ti 3 d 2 4 s 2 23 V 3 d 3 4 s 2 24 Cr 3 d 5 4 s 1 25 Mn 3 d 5 4 s 2 26 Fe 3 d 6 4 s 2 27 Co 3 d 7 4 s 2 28 Ni 3 d 8 4 s 2 29 Cu 3 d 10 4 s 1 30 Zn 3 d 10 4 s 2 31 Ga 4 s 2 4 p 1 32 Ge 4 s 2 4 p 2 33 As 4 s 2 4 p 3 34 Se 4 s 2 4 p 4 35 Br 4 s 2 4 p 5 36 Kr 4 s 2 4 p 6 37 Rb 5 s 1 38 Sr 5 s 2 39 Y 4 d 1 5 s 2 40 Zr 4 d 2 5 s 2 41 Nb 4 d 4 4 s 1 42 Mo 4 d 5 5 s 1 43 Tc 4 d 5 5 s 2 44 Ru 4 d 7 5 s 1 45 Rh 4 d 8 4 s 1 46 Pd 4 d 10 5 s 0 47 Ag 4 d 10 5 s 1 48 Cd 4 d 10 5 s 2 49 In 5 s 2 5 p 1 50 Sn 5 s 2 5 p 2 51 Sb 5 s 2 5 p 3 52 Te 5 s 2 5 p 4 53 I 5 s 2 5 p 5 54 Xe 5 s 2 5 p 6 Cs 6 s 1 56 Ba 6 s 2 57 La 5 d 1 6 s 2 72 Hf 5 d 2 6 s 2 73 Ta 5 d 3 6 s 2 74 W 5 d 4 6 s 2 75 Re 5 d 5 6 s 2 76 Os 5 d 6 6 s 2 77 Ir 5 d 7 6 s 2 78 Pt 5 d 9 6 s 1 79 Au 5 d 10 6 s 1 80 Hg 5 d 10 6 s 2 81 Tl 6 s 2 6 p 1 82 Pb 6 s 2 6 p 2 83 Bi 6 s 2 6 p 3 84 Po 6 s 2 6 p 4 85 At 6 s 2 6 p 5 86 Rn 6 s 2 6 p 6 Fr 7 s 1 88 Ra 7 s 2 89 Ac 6 d 1 7 s 2 s - блок d - блок p - блок 58 Ce 4 f 1 5 d 1 6 s 2 59 Pr 4 f 3 5 d 0 6 s 2 60 Nd 4 f 4 5 d 0 6 s 2 61 Pm 4 f 5 5 d 0 6 s 2 62 Sm 4 f 6 5 d 0 6 s 2 63 Eu 4 f 7 5 d 0 6 s 2 64 Gd 4 f 7 5 d 1 6 s 2 65 Tb 4 f 9 5 d 0 6 s 2 66 Dy 4 f 10 5 d 0 6 s 2 67 Ho 4 f 11 5 d 0 6 s 2 68 Er 4 f 12 5 d 0 6 s 2 69 Tm 4 f 13 5 d 0 6 s 2 70 Yb 4 f 14 5 d 0 6 s 2 71 Lu 4 f 0 5 d 1 6 s 2 90 Th 5 f 0 6 d 2 7 s 2 91 Pa 5 f 2 6 d 1 7 s 2 92 U 5 f 3 6 d 1 7 s 2 93 Np 5 f 4 6 d 1 7 s 2 94 Pu 5 f 6 6 d 0 7 s 2 95 Am 5 f 7 6 d 0 7 s 2 96 Cm 5 f 7 6 d 1 7 s 2 97 Bk 5 f 9 6 d 0 7 s 2 98 Cf 5 f 10 6 d 0 7 s 2 99 Es 5 f 11 6 d 0 7 s 2 100 Fm 5 f 12 6 d 0 7 s 2 101 Md 5 f 13 6 d 0 7 s 2 102 No 5 f 14 6 d 0 7 s 2 103 Lr 5 f 14 6 d 1 7 s 2 f - блок 55 87 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H 1 s 1 2 He 1 s 2 3 Li 2 s 1 4 Be 2 s 2 5 B 2 s 2 2 p 1 6 C 2 s 2 2 p 2 7 N 2 s 2 2 p 3 8 O 2 s 2 2 p 4 9 F 2 s 2 2 p 5 10 Ne 2 s 2 2 p 6 11 Na 3 s 1 12 Mg 3 s 2 13 Al 3 s 2 3 p 1 14 Si 3 s 2 3 p 2 15 P 3 s 2 3 p 3 16 S 3 s 2 3 p 4 17 Cl 3 s 2 3 p 5 18 Ar 3 s 2 3 p 6 19 K 4 s 1 20 Ca 4 s 2 21 Sc 3 d 1 4 s 2 22 Ti 3 d 2 4 s 2 23 V 3 d 3 4 s 2 24 Cr 3 d 5 4 s 1 25 Mn 3 d 5 4 s 2 26 Fe 3 d 6 4 s 2 27 Co 3 d 7 4 s 2 28 Ni 3 d 8 4 s 2 29 Cu 3 d 10 4 s 1 30 Zn 3 d 10 4 s 2 31 Ga 4 s 2 4 p 1 32 Ge 4 s 2 4 p 2 33 As 4 s 2 4 p 3 34 Se 4 s 2 4 p 4 35 Br 4 s 2 4 p 5 36 Kr 4 s 2 4 p 6 37 Rb 5 s 1 38 Sr 5 s 2 39 Y 4 d 1 5 s 2 40 Zr 4 d 2 5 s 2 41 Nb 4 d 4 4 s 1 42 Mo 4 d 5 5 s 1 43 Tc 4 d 5 5 s 2 44 Ru 4 d 7 5 s 1 45 Rh 4 d 8 4 s 1 46 Pd 4 d 10 5 s 0 47 Ag 4 d 10 5 s 1 48 Cd 4 d 10 5 s 2 49 In 5 s 2 5 p 1 50 Sn 5 s 2 5 p 2 51 Sb 5 s 2 5 p 3 52 Te 5 s 2 5 p 4 53 I 5 s 2 5 p 5 54 Xe 5 s 2 5 p 6 Cs 6 s 1 56 Ba 6 s 2 57 La 5 d 1 6 s 2 72 Hf 5 d 2 6 s 2 73 Ta 5 d 3 6 s 2 74 W 5 d 4 6 s 2 75 Re 5 d 5 6 s 2 76 Os 5 d 6 6 s 2 77 Ir 5 d 7 6 s 2 78 Pt 5 d 9 6 s 1 79 Au 5 d 10 6 s 1 80 Hg 5 d 10 6 s 2 81 Tl 6 s 2 6 p 1 82 Pb 6 s 2 6 p 2 83 Bi 6 s 2 6 p 3 84 Po 6 s 2 6 p 4 85 At 6 s 2 6 p 5 86 Rn 6 s 2 6 p 6 Fr 7 s 1 88 Ra 7 s 2 89 Ac 6 d 1 7 s 2 s - блок d - блок p - блок 58 Ce 4 f 1 5 d 1 6 s 2 59 Pr 4 f 3 5 d 0 6 s 2 60 Nd 4 f 4 5 d 0 6 s 2 61 Pm 4 f 5 5 d 0 6 s 2 62 Sm 4 f 6 5 d 0 6 s 2 63 Eu 4 f 7 5 d 0 6 s 2 64 Gd 4 f 7 5 d 1 6 s 2 65 Tb 4 f 9 5 d 0 6 s 2 66 Dy 4 f 10 5 d 0 6 s 2 67 Ho 4 f 11 5 d 0 6 s 2 68 Er 4 f 12 5 d 0 6 s 2 69 Tm 4 f 13 5 d 0 6 s 2 70 Yb 4 f 14 5 d 0 6 s 2 71 Lu 4 f 0 5 d 1 6 s 2 90 Th 5 f 0 6 d 2 7 s 2 91 Pa 5 f 2 6 d 1 7 s 2 92 U 5 f 3 6 d 1 7 s 2 93 Np 5 f 4 6 d 1 7 s 2 94 Pu 5 f 6 6 d 0 7 s 2 95 Am 5 f 7 6 d 0 7 s 2 96 Cm 5 f 7 6 d 1 7 s 2 97 Bk 5 f 9 6 d 0 7 s 2 98 Cf 5 f 10 6 d 0 7 s 2 99 Es 5 f 11 6 d 0 7 s 2 100 Fm 5 f 12 6 d 0 7 s 2 101 Md 5 f 13 6 d 0 7 s 2 102 No 5 f 14 6 d 0 7 s 2 103 Lr 5 f 14 6 d 1 7 s 2 f - блок 55 87 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H 1 s 1 2 He 1 s 2 3 Li 2 s 1 4 Be 2 s 2 5 B 2 s 2 2 p 1 6 C 2 s 2 2 p 2 7 N 2 s 2 2 p 3 8 O 2 s 2 2 p 4 9 F 2 s 2 2 p 5 10 Ne 2 s 2 2 p 6 11 Na 3 s 1 12 Mg 3 s 2 13 Al 3 s 2 3 p 1 14 Si 3 s 2 3 p 2 15 P 3 s 2 3 p 3 16 S 3 s 2 3 p 4 17 Cl 3 s 2 3 p 5 18 Ar 3 s 2 3 p 6 19 K 4 s 1 20 Ca 4 s 2 21 Sc 3 d 1 4 s 2 22 Ti 3 d 2 4 s 2 23 V 3 d 3 4 s 2 24 Cr 3 d 5 4 s 1 25 Mn 3 d 5 4 s 2 26 Fe 3 d 6 4 s 2 27 Co 3 d 7 4 s 2 28 Ni 3 d 8 4 s 2 29 Cu 3 d 10 4 s 1 30 Zn 3 d 10 4 s 2 31 Ga 4 s 2 4 p 1 32 Ge 4 s 2 4 p 2 33 As 4 s 2 4 p 3 34 Se 4 s 2 4 p 4 35 Br 4 s 2 4 p 5 36 Kr 4 s 2 4 p 6 37 Rb 5 s 1 38 Sr 5 s 2 39 Y 4 d 1 5 s 2 40 Zr 4 d 2 5 s 2 41 Nb 4 d 4 4 s 1 42 Mo 4 d 5 5 s 1 43 Tc 4 d 5 5 s 2 44 Ru 4 d 7 5 s 1 45 Rh 4 d 8 4 s 1 46 Pd 4 d 10 5 s 0 47 Ag 4 d 10 5 s 1 48 Cd 4 d 10 5 s 2 49 In 5 s 2 5 p 1 50 Sn 5 s 2 5 p 2 51 Sb 5 s 2 5 p 3 52 Te 5 s 2 5 p 4 53 I 5 s 2 5 p 5 54 Xe 5 s 2 5 p 6 Cs 6 s 1 56 Ba 6 s 2 57 La 5 d 1 6 s 2 72 Hf 5 d 2 6 s 2 73 Ta 5 d 3 6 s 2 74 W 5 d 4 6 s 2 75 Re 5 d 5 6 s 2 76 Os 5 d 6 6 s 2 77 Ir 5 d 7 6 s 2 78 Pt 5 d 9 6 s 1 79 Au 5 d 10 6 s 1 80 Hg 5 d 10 6 s 2 81 Tl 6 s 2 6 p 1 82 Pb 6 s 2 6 p 2 83 Bi 6 s 2 6 p 3 84 Po 6 s 2 6 p 4 85 At 6 s 2 6 p 5 86 Rn 6 s 2 6 p 6 Fr 7 s 1 88 Ra 7 s 2 89 Ac 6 d 1 7 s 2 s - блок d - блок p - блок 58 Ce 4 f 1 5 d 1 6 s 2 59 Pr 4 f 3 5 d 0 6 s 2 60 Nd 4 f 4 5 d 0 6 s 2 61 Pm 4 f 5 5 d 0 6 s 2 62 Sm 4 f 6 5 d 0 6 s 2 63 Eu 4 f 7 5 d 0 6 s 2 64 Gd 4 f 7 5 d 1 6 s 2 65 Tb 4 f 9 5 d 0 6 s 2 66 Dy 4 f 10 5 d 0 6 s 2 67 Ho 4 f 11 5 d 0 6 s 2 68 Er 4 f 12 5 d 0 6 s 2 69 Tm 4 f 13 5 d 0 6 s 2 70 Yb 4 f 14 5 d 0 6 s 2 71 Lu 4 f 0 5 d 1 6 s 2 90 Th 5 f 0 6 d 2 7 s 2 91 Pa 5 f 2 6 d 1 7 s 2 92 U 5 f 3 6 d 1 7 s 2 93 Np 5 f 4 6 d 1 7 s 2 94 Pu 5 f 6 6 d 0 7 s 2 95 Am 5 f 7 6 d 0 7 s 2 96 Cm 5 f 7 6 d 1 7 s 2 97 Bk 5 f 9 6 d 0 7 s 2 98 Cf 5 f 10 6 d 0 7 s 2 99 Es 5 f 11 6 d 0 7 s 2 100 Fm 5 f 12 6 d 0 7 s 2 101 Md 5 f 13 6 d 0 7 s 2 102 No 5 f 14 6 d 0 7 s 2 103 Lr 5 f 14 6 d 1 7 s 2 f - блок 55 87 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H 1 s 1 2 He 1 s 2 3 Li 2 s 1 4 Be 2 s 2 5 B 2 s 2 2 p 1 6 C 2 s 2 2 p 2 7 N 2 s 2 2 p 3 8 O 2 s 2 2 p 4 9 F 2 s 2 2 p 5 10 Ne 2 s 2 2 p 6 11 Na 3 s 1 12 Mg 3 s 2 13 Al 3 s 2 3 p 1 14 Si 3 s 2 3 p 2 15 P 3 s 2 3 p 3 16 S 3 s 2 3 p 4 17 Cl 3 s 2 3 p 5 18 Ar 3 s 2 3 p 6 19 K 4 s 1 20 Ca 4 s 2 21 Sc 3 d 1 4 s 2 22 Ti 3 d 2 4 s 2 23 V 3 d 3 4 s 2 24 Cr 3 d 5 4 s 1 25 Mn 3 d 5 4 s 2 26 Fe 3 d 6 4 s 2 27 Co 3 d 7 4 s 2 28 Ni 3 d 8 4 s 2 29 Cu 3 d 10 4 s 1 30 Zn 3 d 10 4 s 2 31 Ga 4 s 2 4 p 1 32 Ge 4 s 2 4 p 2 33 As 4 s 2 4 p 3 34 Se 4 s 2 4 p 4 35 Br 4 s 2 4 p 5 36 Kr 4 s 2 4 p 6 37 Rb 5 s 1 38 Sr 5 s 2 39 Y 4 d 1 5 s 2 40 Zr 4 d 2 5 s 2 41 Nb 4 d 4 4 s 1 42 Mo 4 d 5 5 s 1 43 Tc 4 d 5 5 s 2 44 Ru 4 d 7 5 s 1 45 Rh 4 d 8 4 s 1 46 Pd 4 d 10 5 s 0 47 Ag 4 d 10 5 s 1 48 Cd 4 d 10 5 s 2 49 In 5 s 2 5 p 1 50 Sn 5 s 2 5 p 2 51 Sb 5 s 2 5 p 3 52 Te 5 s 2 5 p 4 53 I 5 s 2 5 p 5 54 Xe 5 s 2 5 p 6 Cs 6 s 1 56 Ba 6 s 2 57 La 5 d 1 6 s 2 72 Hf 5 d 2 6 s 2 73 Ta 5 d 3 6 s 2 74 W 5 d 4 6 s 2 75 Re 5 d 5 6 s 2 76 Os 5 d 6 6 s 2 77 Ir 5 d 7 6 s 2 78 Pt 5 d 9 6 s 1 79 Au 5 d 10 6 s 1 80 Hg 5 d 10 6 s 2 81 Tl 6 s 2 6 p 1 82 Pb 6 s 2 6 p 2 83 Bi 6 s 2 6 p 3 84 Po 6 s 2 6 p 4 85 At 6 s 2 6 p 5 86 Rn 6 s 2 6 p 6 Fr 7 s 1 88 Ra 7 s 2 89 Ac 6 d 1 7 s 2 s - блок d - блок p - блок 58 Ce 4 f 1 5 d 1 6 s 2 59 Pr 4 f 3 5 d 0 6 s 2 60 Nd 4 f 4 5 d 0 6 s 2 61 Pm 4 f 5 5 d 0 6 s 2 62 Sm 4 f 6 5 d 0 6 s 2 63 Eu 4 f 7 5 d 0 6 s 2 64 Gd 4 f 7 5 d 1 6 s 2 65 Tb 4 f 9 5 d 0 6 s 2 66 Dy 4 f 10 5 d 0 6 s 2 67 Ho 4 f 11 5 d 0 6 s 2 68 Er 4 f 12 5 d 0 6 s 2 69 Tm 4 f 13 5 d 0 6 s 2 70 Yb 4 f 14 5 d 0 6 s 2 71 Lu 4 f 0 5 d 1 6 s 2 90 Th 5 f 0 6 d 2 7 s 2 91 Pa 5 f 2 6 d 1 7 s 2 92 U 5 f 3 6 d 1 7 s 2 93 Np 5 f 4 6 d 1 7 s 2 94 Pu 5 f 6 6 d 0 7 s 2 95 Am 5 f 7 6 d 0 7 s 2 96 Cm 5 f 7 6 d 1 7 s 2 97 Bk 5 f 9 6 d 0 7 s 2 98 Cf 5 f 10 6 d 0 7 s 2 99 Es 5 f 11 6 d 0 7 s 2 100 Fm 5 f 12 6 d 0 7 s 2 101 Md 5 f 13 6 d 0 7 s 2 102 No 5 f 14 6 d 0 7 s 2 103 Lr 5 f 14 6 d 1 7 s 2 f - блок 33 Физтех, 1 курс. Осень 2015
Слайд 34: Атомная масса элемента
Рассчитывается с учетом распространенности изотопов элемента (ат.%) в земной коре 34 Физтех, 1 курс. Осень 2015
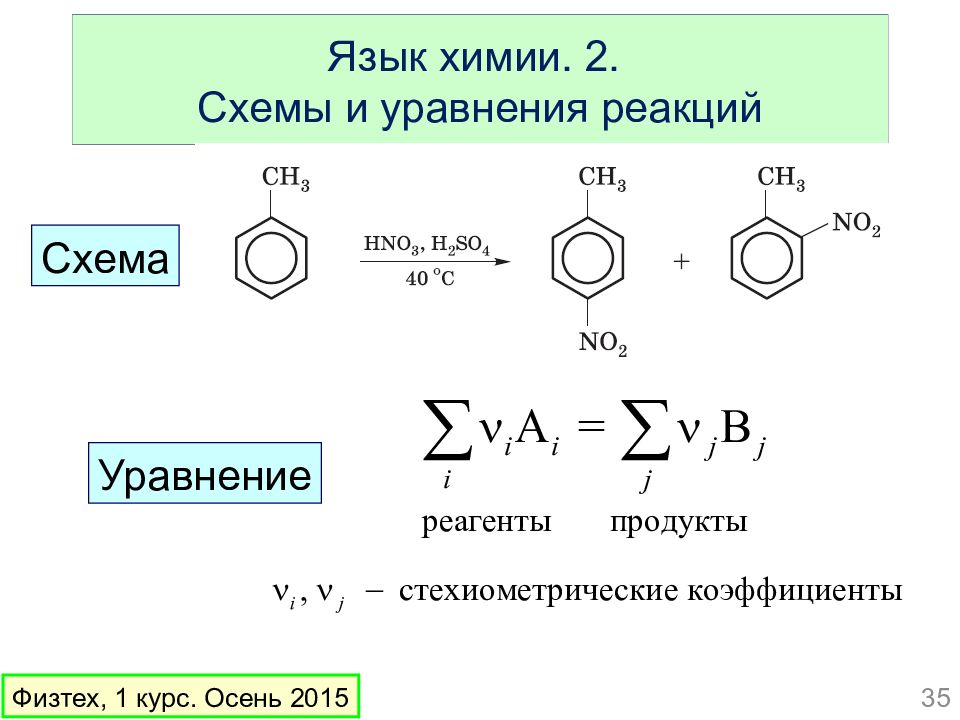
Слайд 35: Язык химии. 2. Схемы и уравнения реакций
Уравнение 35 Физтех, 1 курс. Осень 2015 Схема
Слайд 36: Химическая переменная
пропорция химическая переменная количества веществ 36 Физтех, 1 курс. Осень 2015
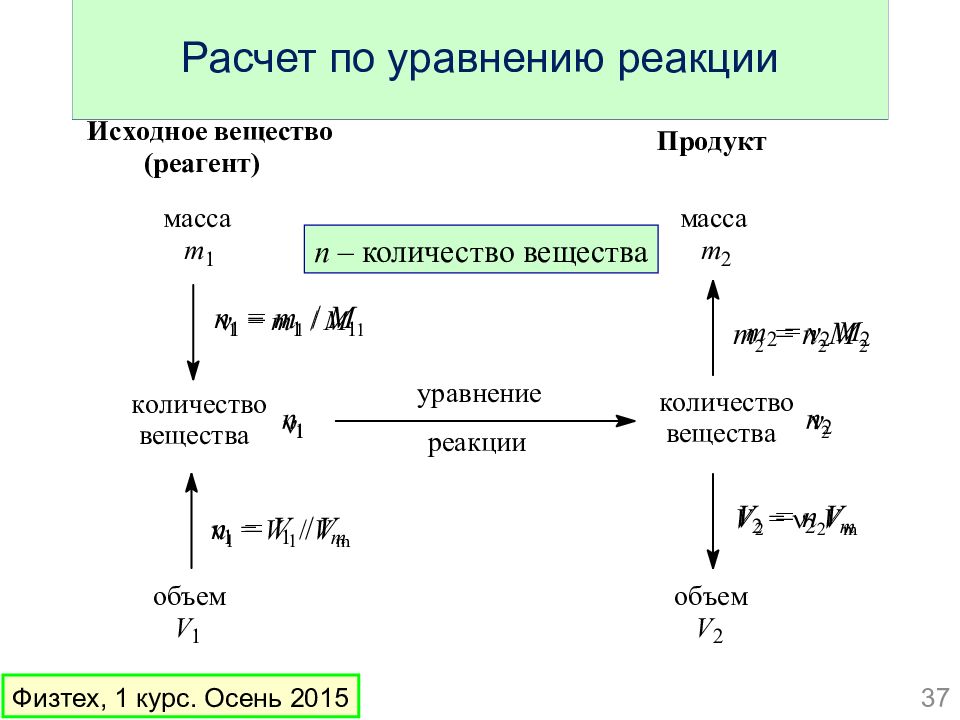
Слайд 37: Расчет по уравнению реакции
n – количество вещества 37 Физтех, 1 курс. Осень 2015
Слайд 38: Примеры задач на химическую стехиометрию
Определите простейшую формулу гексогена: 16.2% С, 2.7% H, 37.8% N. (CH 2 N 2 O 2 ) Определите молекулярную формулу гексогена, если при детонации 1 моля образуется 100 л газов (при 163 кПа и 54 о С). (C 3 H 6 N 6 O 6 ) Определите формулу углеводорода, если при сгорании 10 л этого вещества образовалось 30 л углекислого газа и 40 л паров воды. (C 3 H 8 ) Сколько азотной кислоты можно получить из 1 кубометра воздуха? Сколько для этого потребуется воды? (5 кг HNO 3, 750 г H 2 O) При прокаливании 29 г гидроксида магния выделилось 7,2 г воды. Какая часть гидроксида разложилась? (80%) 38 Физтех, 1 курс. Осень 2015
Слайд 39: Важнейшие формулы
Количество вещества Определение брутто-формулы Расчет по уравнению реакции 39 Физтех, 1 курс. Осень 2015
Слайд 40: Коротко о главном
Химия – часть естествознания. Это – наука о веществах, их строении, свойствах и превращениях. Главная задача химии – получение веществ с полезными свойствами. Основные понятия химии – вещество и реакция. Вещества описываются химическими формулами, реакции – схемами и химическими уравнениями. Информация обо всех известных веществах и реакциях содержится в химических базах данных. Расчеты по химическим формулам и уравнениями основаны на стехиометрических соотношениях ( пропорциях ) и использовании понятия « моль ». Вещество – любая совокупность атомов, молекул или ионов. Химический элемент – вид атомов с одинаковым зарядом ядра. Свойства элементов периодически изменяются с увеличением заряда ядра. 40 Физтех, 1 курс. Осень 2015
Слайд 41: Основные понятия
Наука Вещество Химическая реакция Химический элемент Химическая формула - простейшая (брутто) - молекулярная - структурная Стехиометрия Схема реакции, уравнение реакции Стехиометрические коэффициенты Химическая переменная Моль, молярная масса, молярный объем 41 Физтех, 1 курс. Осень 2015
Слайд 42
Лекция 2 Электронное строение и периодические свойства атомов Физтех, 1 курс. Осень 2015
Слайд 43: План лекции
Теория Бора атома водорода. Основные понятия и принципы квантовой механики. Водородоподобные атомы и ионы. Квантовые числа и волновые функции электрона. Многоэлектронные атомы. Электронные конфигурации и атомные термы. История открытия Периодического закона. Периодические свойства элементов. Физтех, 1 курс. Осень 2015 43
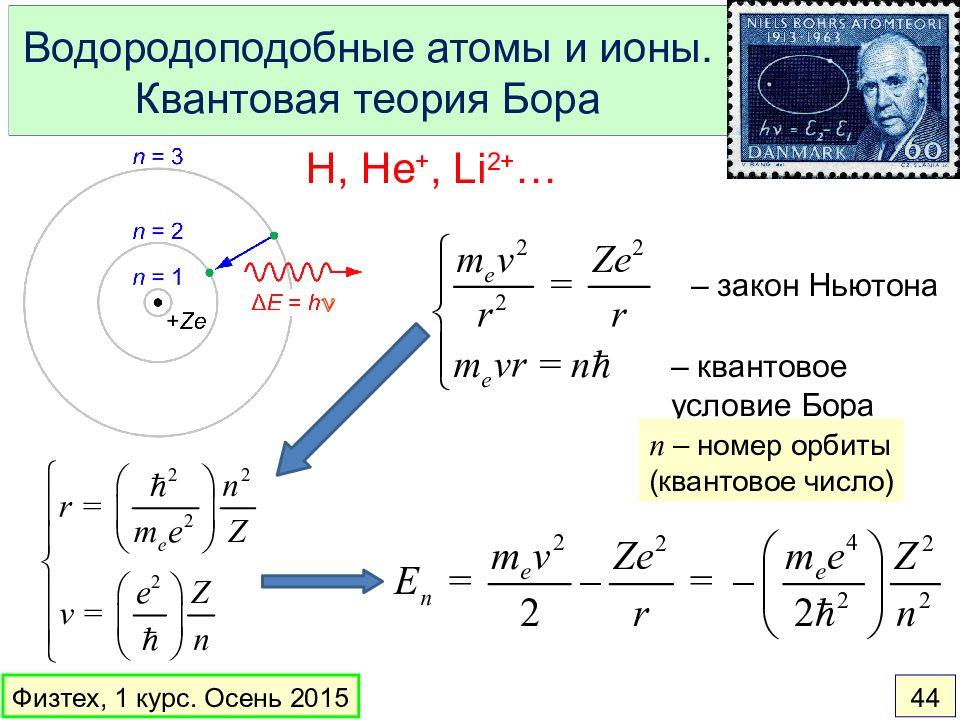
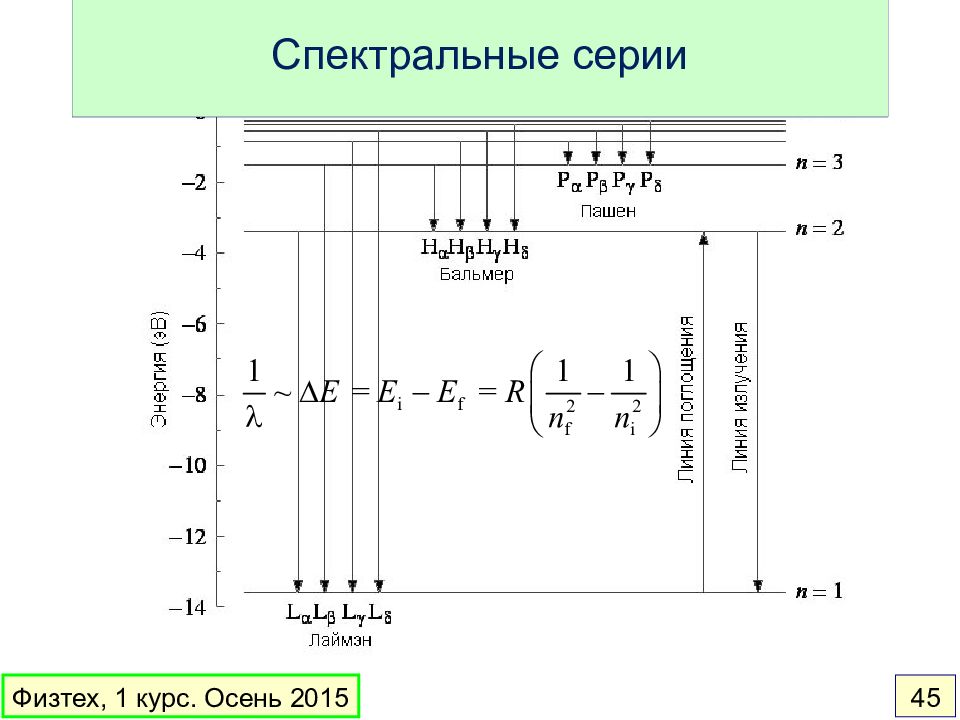
Слайд 44: Водородоподобные атомы и ионы. Квантовая теория Бора
H, He +, Li 2+ … Физтех, 1 курс. Осень 2015 44 n – закон Ньютона – квантовое условие Бора n – номер орбиты (квантовое число)
Слайд 46: Квантовая механика. Основные принципы
«Квантовую механику не понимает никто.» Р. Фейнман «Если у человека при первом знакомстве с квантовой механикой голова не идет кругом, то он не понимает в ней ничего.» Н. Бор Принцип неопределенности Принцип суперпозиции Физтех, 1 курс. Осень 2015 46
Слайд 47: Принцип неопределенности
Наблюдаемые величины – результат процесса измерения – взаимодействия системы с телом («прибором»), с достаточной точностью подчиняющимся классической механике. Процесс измерения в общем случае изменяет состояние квантовой системы и этого влияния принципиально невозможно избежать. Не все физические величины измеримы одновременно. Принцип неопределенности Физтех, 1 курс. Осень 2015 47
Слайд 48: Волновая функция
n i - квантовые числа, нумерующие собственные значения физических величин из полного набора Волновая функция представляет состояние, описанное наиболее полным образом 1 ( q, t ) чистое состояние, в котором физическая величина f имеет определенное значение f 1 2 ( q, t ) чистое состояние, в котором физическая величина f имеет определенное значение f 2 c 1 1 ( q, t ) + c 2 2 ( q, t ) смешанное состояние, в котором измерение величины f даст либо результат f 1, либо f 2. Принцип суперпозиции состояний: вероятность найти систему в заданном интервале координат нормировка Волновая функция Вероятность того, что измерение даст значение f i, пропорциональна | c i | 2 Физтех, 1 курс. Осень 2015 48
Слайд 49: Операторы и средние значения
Каждой физической величине ставится в соответствие математический оператор. Если в результате действия оператора функция не меняется с точностью до постоянного множителя, то говорят, что n собственная функция данного оператора, а f n – собственное значение величины f. Необходимым и достаточным условием одновременной измеримости величин f и g является коммутативность соответствующих операторов: Среднее значение физической величины за большое число измерений равно среднему значению соответствующего оператора. Оператор координаты Оператор компоненты импульса Оператор компоненты момента импульса Оператор энергии (гамильтониан) Операторы и средние значения Физтех, 1 курс. Осень 2015 49
Слайд 50: Уравнение Шрёдингера
Изменение квантового состояния во времени описывается уравнением Шрёдингера У системы в стационарном состоянии энергия сохраняется. Волновая функция стационарного состояния является собственной для оператора Гамильтона и разбивается на координатный и временной множители. Возможные значения энергии системы ( спектр энергий ) определяются собственными значениями оператора Гамильтона Одному и тому же значению (уровню) энергии может соответствовать несколько различных состояний ( вырождение уровня ). Если оператор физической величины f коммутирует с гамильтонианом, то эта величина в данном стационарном состоянии сохраняется и измерима одновременно с энергией. Уравнение Шрёдингера Физтех, 1 курс. Осень 2015 50
Слайд 51: Водородоподобные атомы и ионы
H, He +, Li 2+ … В сферически симметричном поле ядра U ( r ) для электрона сохраняются следующие величины: Энергия n главное Момент импульса l орбитальное Проекция момента импульса на выделенную ось z m l магнитное Спин электрона s спиновое Проекция спина на ось z m s магнитное спиновое Физтех, 1 курс. Осень 2015 51
Слайд 52: Водородоподобные атомы. Уровни энергии
Квантовые числа l 0 1 2 3 4 s p d f g Кратность вырождения: 32 18 8 2 R зависит от массы ядра Физтех, 1 курс. Осень 2015 52
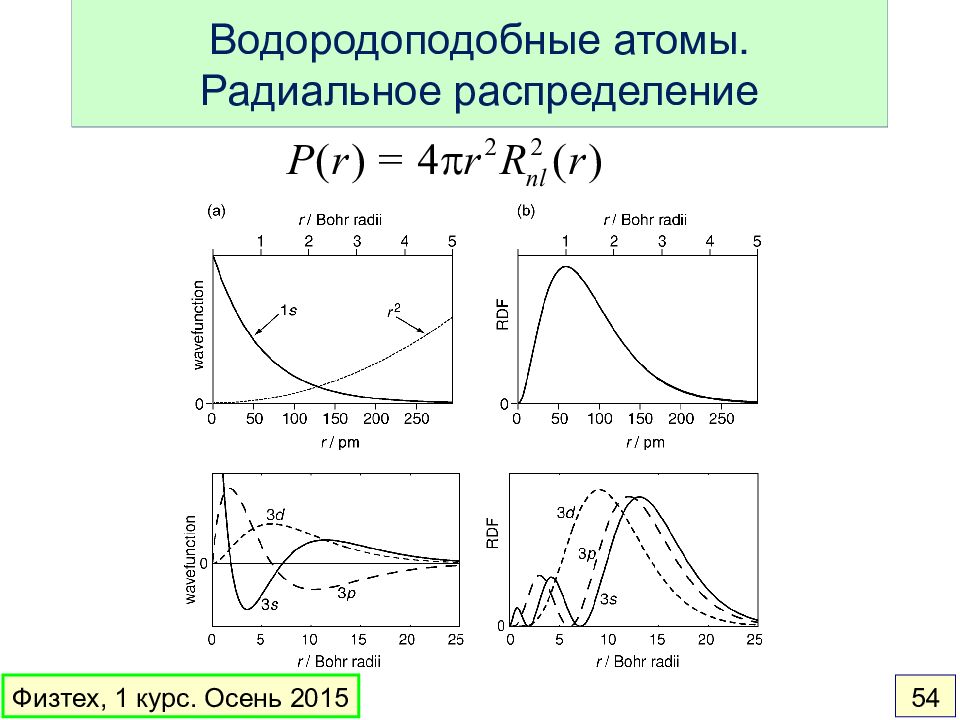
Слайд 54: Водородоподобные атомы. Радиальное распределение
Физтех, 1 курс. Осень 2015 54
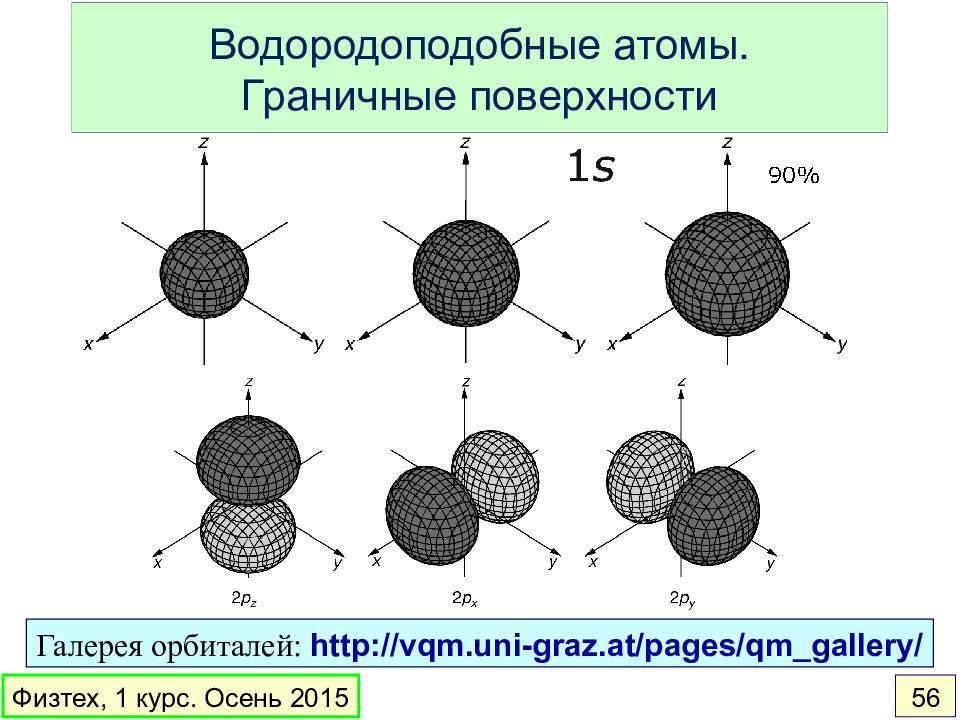
Слайд 56: Водородоподобные атомы. Граничные поверхности
Галерея орбиталей: http://vqm.uni-graz.at/pages/qm_gallery/ Водородоподобные атомы. Граничные поверхности Физтех, 1 курс. Осень 2015 56
Слайд 57: Водородоподобные атомы. Граничные поверхности
Физтех, 1 курс. Осень 2015 57
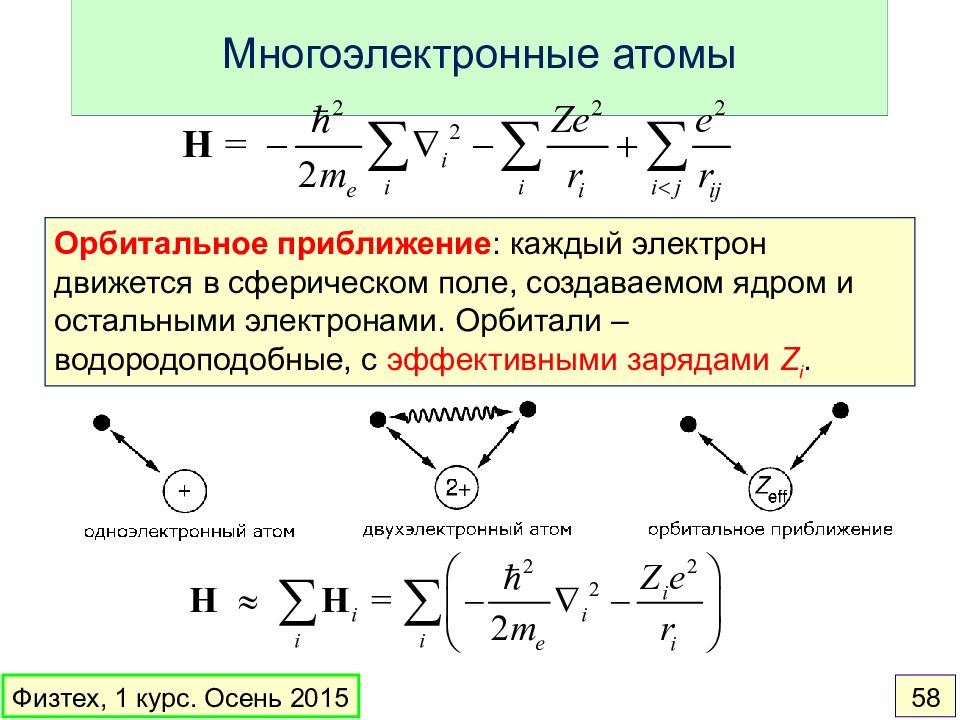
Слайд 58: Многоэлектронные атомы
Орбитальное приближение : каждый электрон движется в сферическом поле, создаваемом ядром и остальными электронами. Орбитали – водородоподобные, с эффективными зарядами Z i. Физтех, 1 курс. Осень 2015 58
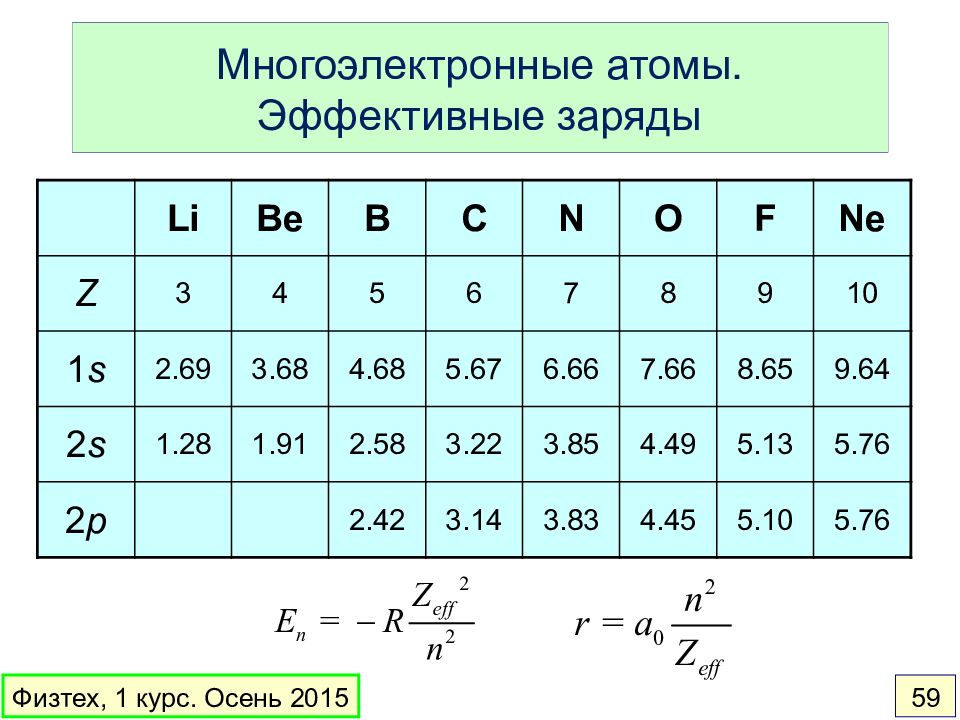
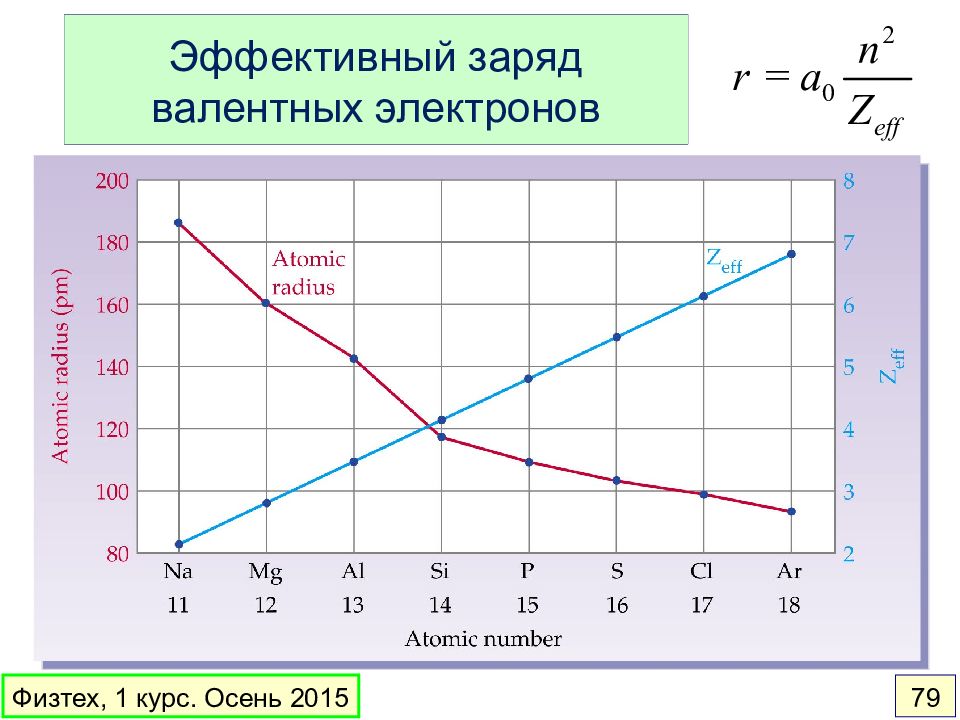
Слайд 59: Многоэлектронные атомы. Эффективные заряды
Li Be B C N O F Ne Z 3 4 5 6 7 8 9 10 1 s 2.69 3.68 4.68 5.67 6.66 7.66 8.65 9.64 2 s 1.28 1.91 2.58 3.22 3.85 4.49 5.13 5.76 2 p 2.42 3.14 3.83 4.45 5.10 5.76 Физтех, 1 курс. Осень 2015 59
Слайд 60: Многоэлектронные атомы. Энергия орбиталей
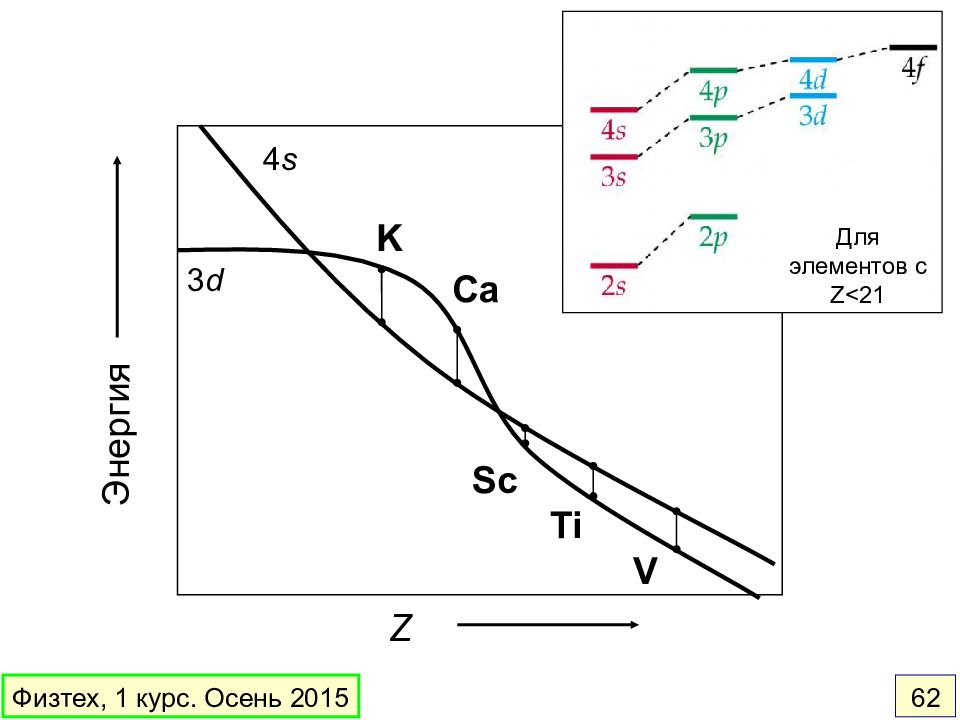
3 s 2 s 1 s 4 s 3 p 2 p 3 d Э н е р г и я 4 p 4 d 4 f Снятие вырождения по орбитальному моменту l 1 s < 2 s < 2 p < 3 s < 3 p < 4 s < 3 d < 4 p … Энергия орбиталей возрастает в ряду: Обратный порядок энергий является причиной появления 1-ого ряда переходных элементов Порядок энергий орбиталей может быть разным для атомов и ионов Пример : Ti 4 s 2 3 d 2 Ti 3+ 3 d Оставшийся после ионизации валентный электрон занимает 3 d - а не 4 s - орбиталь. Многоэлектронные атомы. Энергия орбиталей Физтех, 1 курс. Осень 2015 60
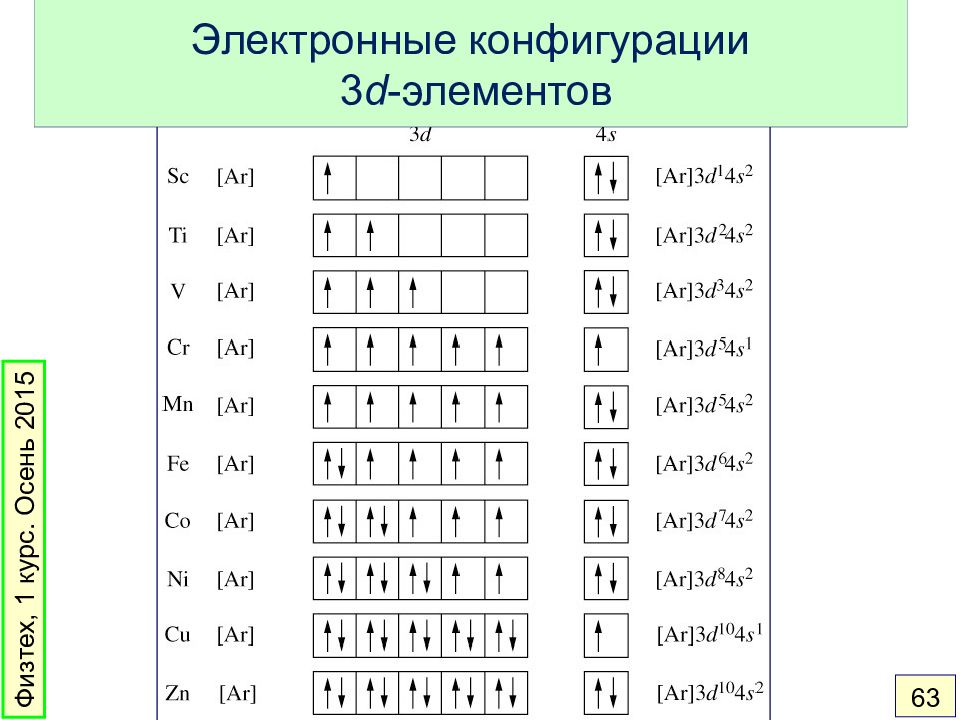
Слайд 61: Многоэлектронные атомы. Принципы заполнения
1. Порядок заполнения орбиталей определяется главным квантовым числом и эффективным зарядом: 1 s < 2 s < 2 p < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 4 f < 5 d < 6 p 2. На каждой орбитали – не более 2 электронов. 3. Правило Хунда: основное состояние имеет максимальную мультиплетность (максимальное число неспаренных электронов в пределах одного подуровня). Физтех, 1 курс. Осень 2015 61
Слайд 62
3 d 4 s K Ca Sc Ti V Z Энергия Для элементов с Z<21 Физтех, 1 курс. Осень 2015 62
Слайд 64
Стационарные состояния атома как целого В центрально-симметричном поле ядра имеют место следующие точные законы сохранения : Энергии E. Полного момента импульса J. Чётности состояния P. В нерелятивистском приближении отдельно сохраняются : Полный орбитальный момент L. Полный спин S. При заданных L и S число состояний с различными J равно: 2 S + 1 при L > S 2 L + 1 при L < S Без учета взаимодействия «спин-орбита» состояния с заданными L и S имеют одинаковую энергию: вырождение кратности (2 L + 1)(2 S + 1). С учетом спин-орбитального взаимодействия (релятивистский эффект) уровни расщепляются (тонкая структура или мультиплетное расщепление) Обозначения : L = 0 1 2 3 4 S P D F G Физтех, 1 курс. Осень 2015 64
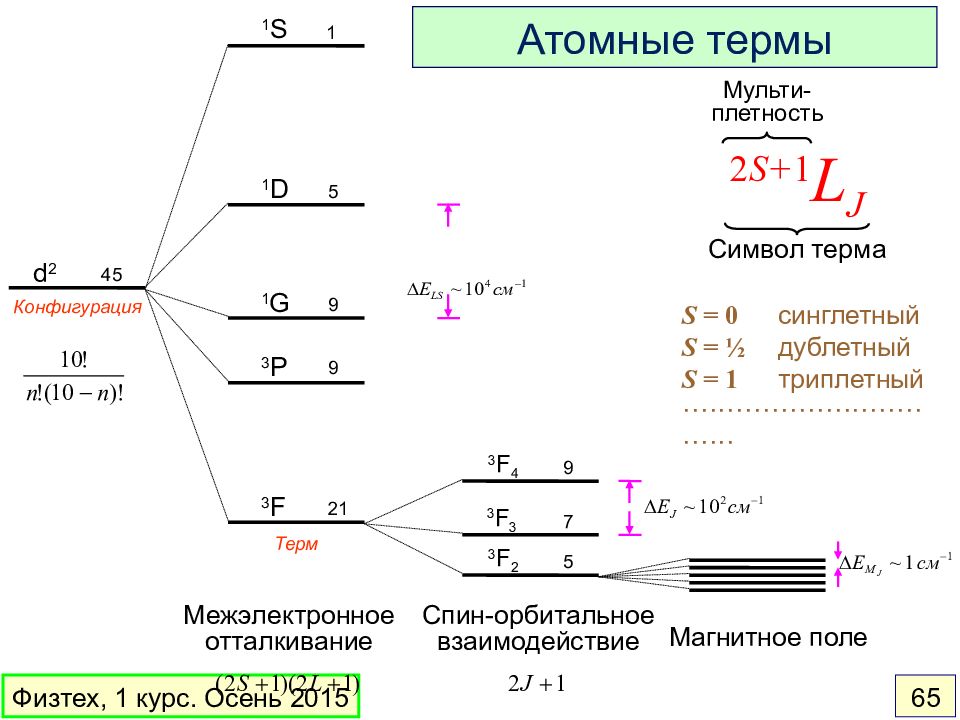
Слайд 65
d 2 1 D 1 S 3 P 1 G 3 F 3 F 4 3 F 3 3 F 2 Конфигурация Межэлектронное отталкивание Терм Магнитное поле 45 9 9 5 1 2 1 9 7 5 Спин-орбитальное взаимодействие 2 S+ 1 L J Символ терма Мульти- плетность Атомные термы S = 0 синглетный S = ½ дублетный S = 1 триплетный ··········· ···················· ·· Физтех, 1 курс. Осень 2015 65
Слайд 66
Основное состояние атома Из всех термов, отвечающих заданной электронной конфигурации наименьшей энергией обладает терм с максимальной мультиплетностью (спином S ). Для термов с одинаковой мультиплетностью наименьшей энергией обладает терм с наибольшим орбитальным моментом L. Правила Хунда: Cr 2+, Mn 3+ : конфигурация валентных электронов d 4 S = 0 S = 1 S = 2 Физтех, 1 курс. Осень 2015 66
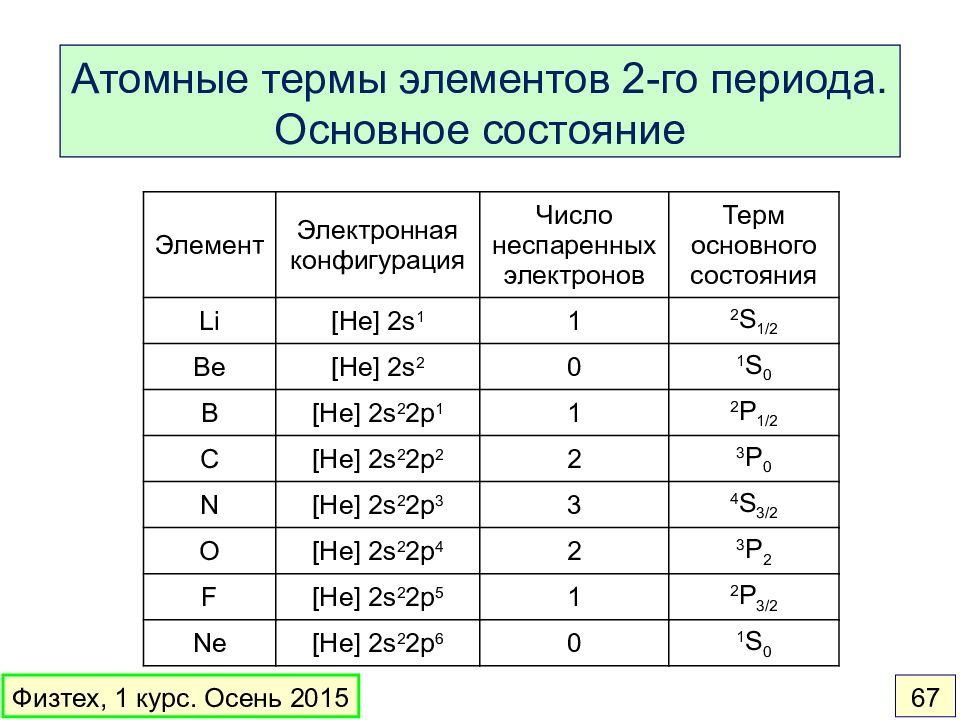
Слайд 67
Атомные термы элементов 2-го периода. Основное состояние Физтех, 1 курс. Осень 2015 67 Элемент Электронная конфигурация Число неспаренных электронов Терм основного состояния Li [He] 2s 1 1 2 S 1/2 Be [He] 2s 2 0 1 S 0 B [He] 2s 2 2p 1 1 2 P 1/2 C [He] 2s 2 2p 2 2 3 P 0 N [He] 2s 2 2p 3 3 4 S 3/2 O [He] 2s 2 2p 4 2 3 P 2 F [He] 2s 2 2p 5 1 2 P 3/2 Ne [He] 2s 2 2p 6 0 1 S 0
Слайд 68: Периодический закон. История открытия
1869 – Д.И. Менделеев (Россия). Периодический закон: Элементы, расположенные по величине атомного веса, представляют явственную периодичность свойств. Должно ожидать открытия еще многих неизвестных простых тел, например, сходных с Al и Si элементов с атомным весом 65–75. Величина атомного веса элемента иногда может быть исправлена, зная его аналогии. Некоторые аналогии элементов открываются по величине веса их атомов. Физтех, 1 курс. Осень 2015 68
Слайд 69: Как был открыт Периодический закон
«Невольно зародилась мысль о том, что между массой и химическими свойствами необходимо должна быть связь. А так как масса вещества … выражается окончательно в виде весов атомов, то надо искать функциональное соответствие между индивидуальными свойствами элементов и их атомными весами. Искать же что-либо, хотя бы грибы или какую-нибудь зависимость, нельзя иначе, как смотря и пробуя. Вот я и стал подбирать, написав на отдельных карточках элемен-ты с их атомными весами и коренными свойствами, сходные эле-менты и близкие атомные веса, что быстро и привело к тому за-ключению, что свойства элементов стоят в периодической зави-симости от их атомного веса, причем, сомневаясь во многих неясностях, я ни минуты не сомневался в общности сделан-ного вывода, так как случайность допустить было невозможно» Физтех, 1 курс. Осень 2015 69
Слайд 72: Периодическая таблица. Самая первая (1869)
Физтех, 1 курс. Осень 2015 72 Д.И. Менделеев, портрет 1869 г.
Слайд 73: Предсказания на основе Периодического закона
Предсказания Д.И. Менделеева: 1) Экабор (скандий, Sc ) – открыт в 1879 г. 2) Экаалюминий (галлий, Ga ) – открыт в 1875 г. 3) Экасилиций (германий, Ge ) – открыт в 18 86 г. 4) Экамарганец (Технеций, Tc) – синтезирован в 1937. Свойства 118-го элемента: Открыт: в 2005 г. (Россия, США) в количестве 3 атомов Положение в Периодической системе: группа VIIIA ( инертный газ) Электронная конфигурация: [Rn] 5f 14 6d 10 7s 2 7p 6. Температура плавления: –10 о С. Температура кипения: –6 о С Высший оксид: RO 4 Физтех, 1 курс. Осень 2015 73
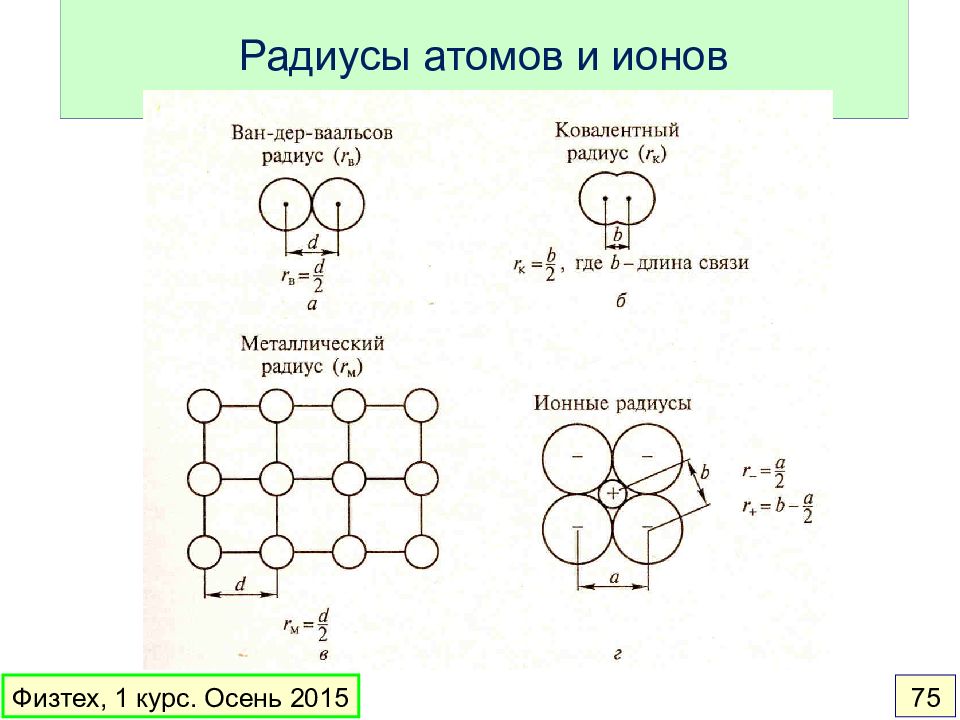
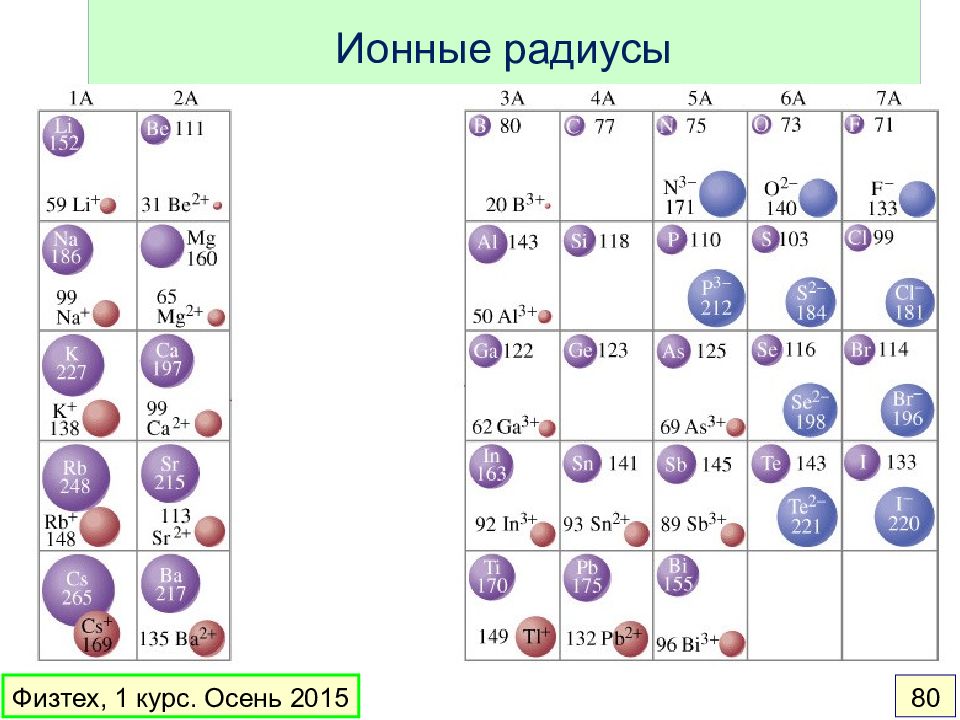
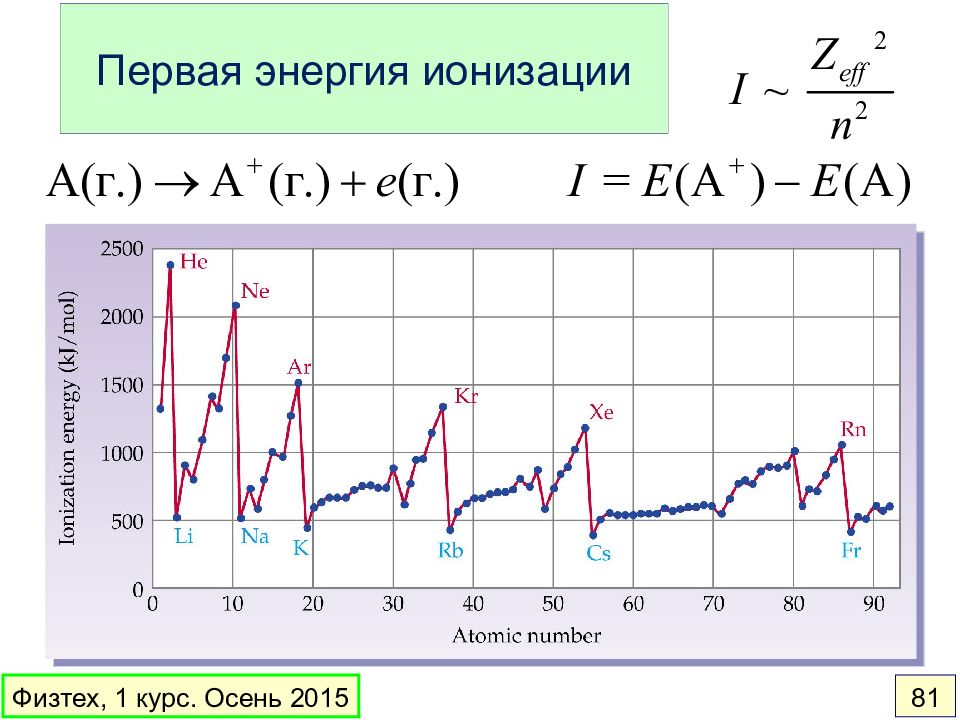
Слайд 74: Периодические свойства элементов
Радиус атома Энергия ионизации Сродство к электрону Электроотрицательность www.webelements.com Физтех, 1 курс. Осень 2015 74
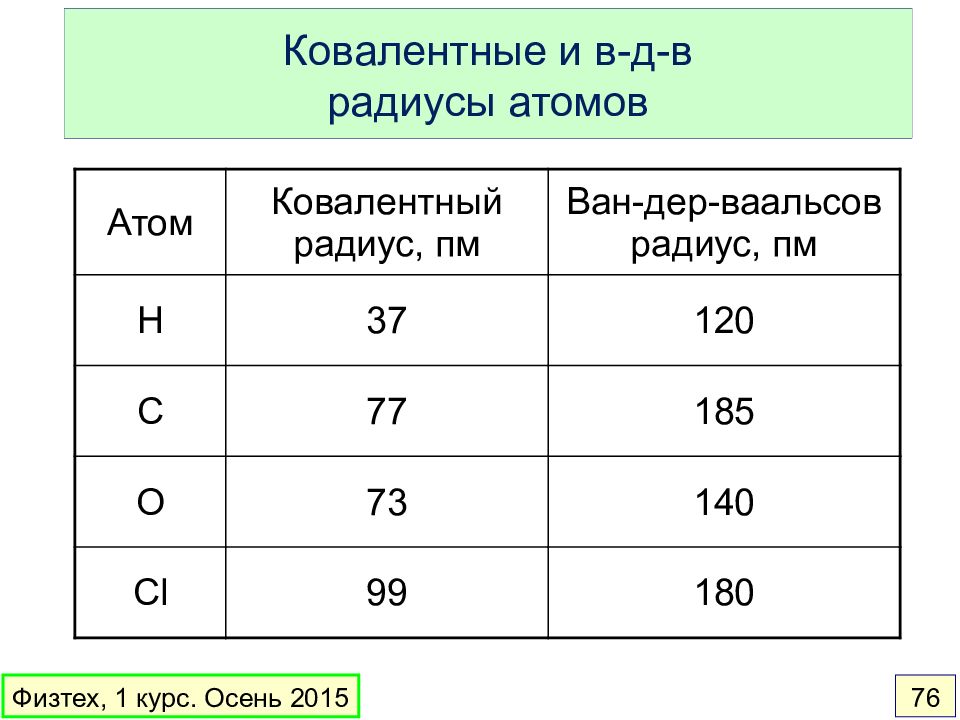
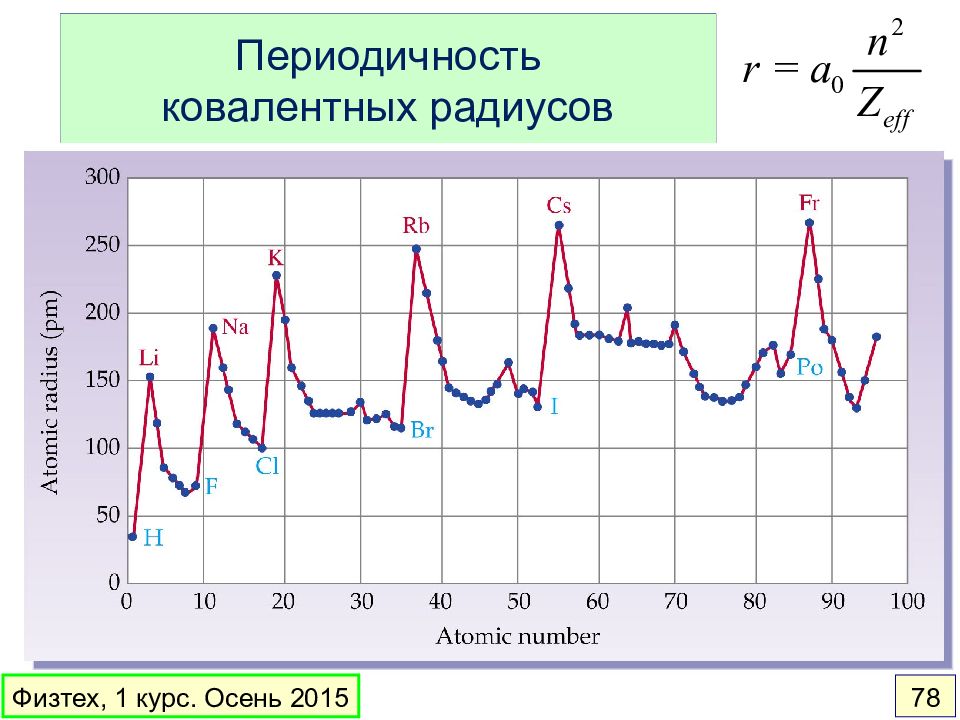
Слайд 76: Ковалентные и в-д-в радиусы атомов
Атом Ковалентный радиус, пм Ван-дер-ваальсов радиус, пм H 37 120 C 77 185 O 73 140 Cl 99 180 Физтех, 1 курс. Осень 2015 76
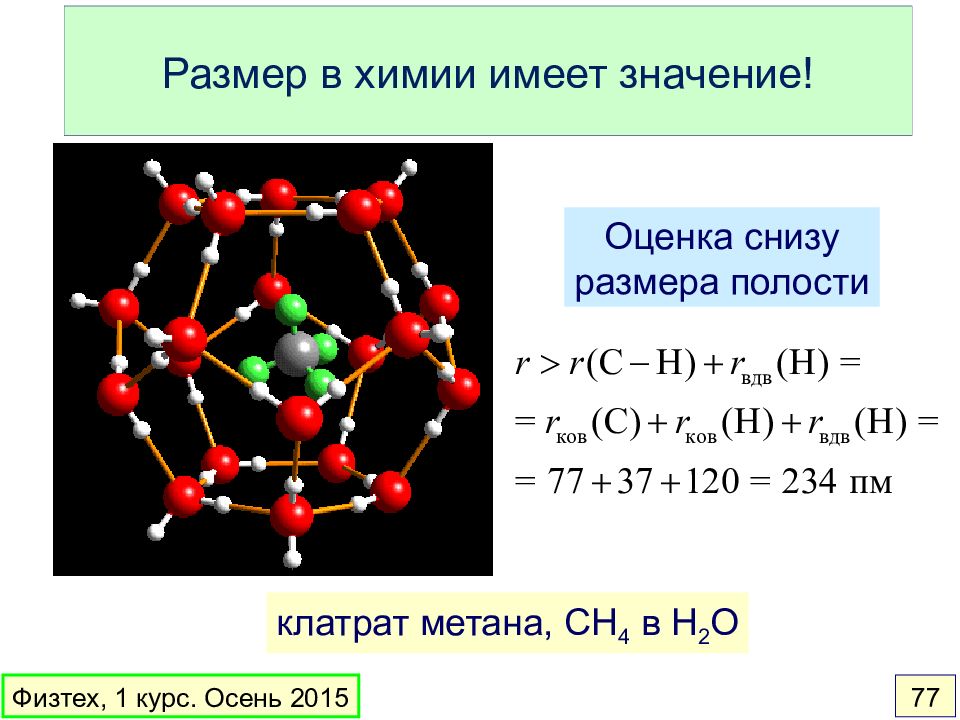
Слайд 77: Размер в химии имеет значение!
клатрат метана, CH 4 в H 2 O Физтех, 1 курс. Осень 2015 77 Оценка снизу размера полости
Слайд 82: Электроотрицательность
Способность атома притягивать электроны химической связи в составе химического соединения Малликен Полинг Физтех, 1 курс. Осень 2015 82
Слайд 84: Коротко о главном
Основные принципы квантовой механики – принцип неопределен-ности и принцип суперпозиции. Физические величины описываются операторами, а состояния систем – волновыми функциями. Состояния электрона в водородоподобном атоме описываются орбиталями. Орбиталь характеризуется тремя квантовыми числами, а состояние электрона – пятью, из которых одно постоянное (спин s = ½), а четыре ( n, l, m l, m s ) могут изменяться. В многоэлектронных атомах электронная конфигурация характеризует распределение электронов по одноэлектронным орбиталям. Орбитали заполняются электронами в порядке увеличения их энергии. На каждой орбитали может быть не больше 2 электронов. Состояние атома как целого ( терм ) характеризуется полным орбитальным L и спиновым S моментами. Периодические свойства элементов – радиус атома, энергия ионизации, электроотрицательность. Физтех, 1 курс. Осень 2015 84 Коротко о главном
Слайд 85: Важнейшие формулы
Соотношение неопределенностей: Среднее значение измеряемой физической величины f Энергия и радиус орбиты электрона на n - ом уровне Порядок заполнения орбиталей: 1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p Уравнения Шрёдингера временное стационарное Физтех, 1 курс. Осень 2015 85
Слайд 86: Основные понятия
Оператор, волновая функция, уровень энергии Водородоподобный атом (ион) Квантовое число: главное, орбитальное, магнитное, магнитное спиновое Орбиталь Радиальная и угловая часть волновой функции Орбитальное приближение, эффективный заряд Электронная конфигурация атома (иона) Правило Хунда Атомный терм, мультиплетность Радиус атома (ковалентный, металлический) Энергия ионизации Электроотрицательность Физтех, 1 курс. Осень 2015 86
Слайд 87: Литература
Еремин, Борщевский. Общая и неорганическая химия. – Гл. 12. (Очень подробно, подход физический, для углубленного уровня). Глинка. Общая химия. – Глава 2, §§ 2.2-2.6. (Химический подход, просто и понятно, но длинно). Глава 3, §§ 3.1-3.4 – периодичность. Шрайвер, Эткинс. Неорганическая химия. – Том 1, глава 1, §§ 1.3-1.8. (Формул мало, изложение основано на качественном химическом подходе. Упражнения хорошие для углубленного уровня). Ахметов. Общая и неорганическая химия. – Часть 1, раздел I, главы 2-4. (Химический подход, физика упрощенная). Физтех, 1 курс. Осень 2015 87
Слайд 89: План лекции
Молекула. Образование химической связи между атомами Типы химической связи Ковалентная связь. Правило октета. Структуры Льюиса. Резонансные структуры Характеристики химической связи – длина, энергия, полярность Геометрия молекул. Модель ОЭПВО Физтех, 1 курс. Осень 2015 89
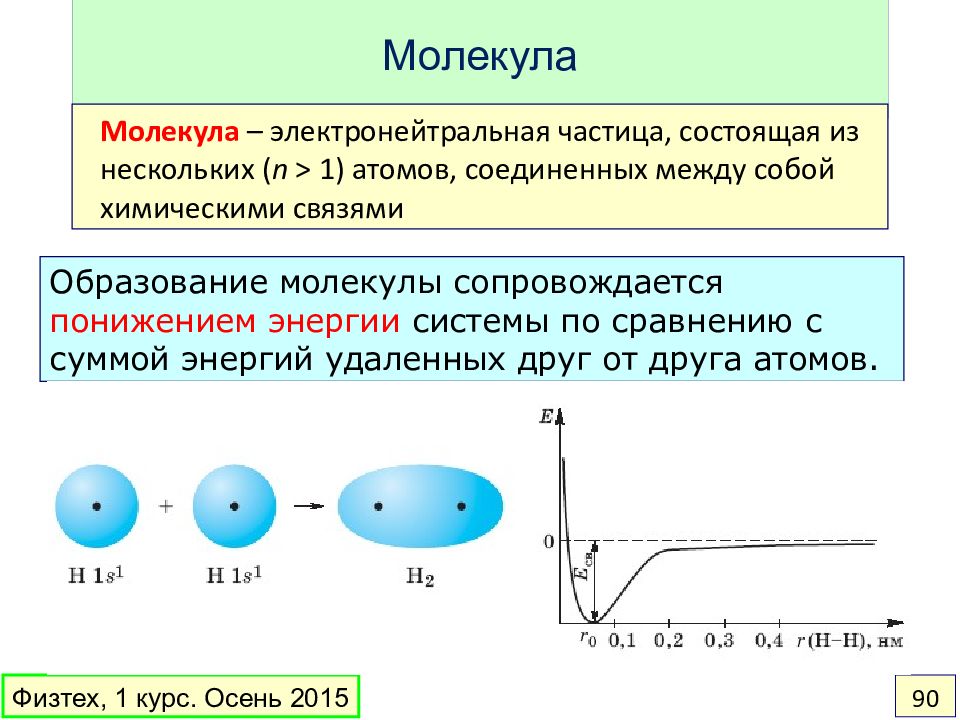
Слайд 90: Молекула
Образование молекулы сопровождается понижением энергии системы по сравнению с суммой энергий удаленных друг от друга атомов. Молекула – электронейтральная частица, состоящая из нескольких ( n > 1) атомов, соединенных между собой химическими связями Физтех, 1 курс. Осень 2015 90
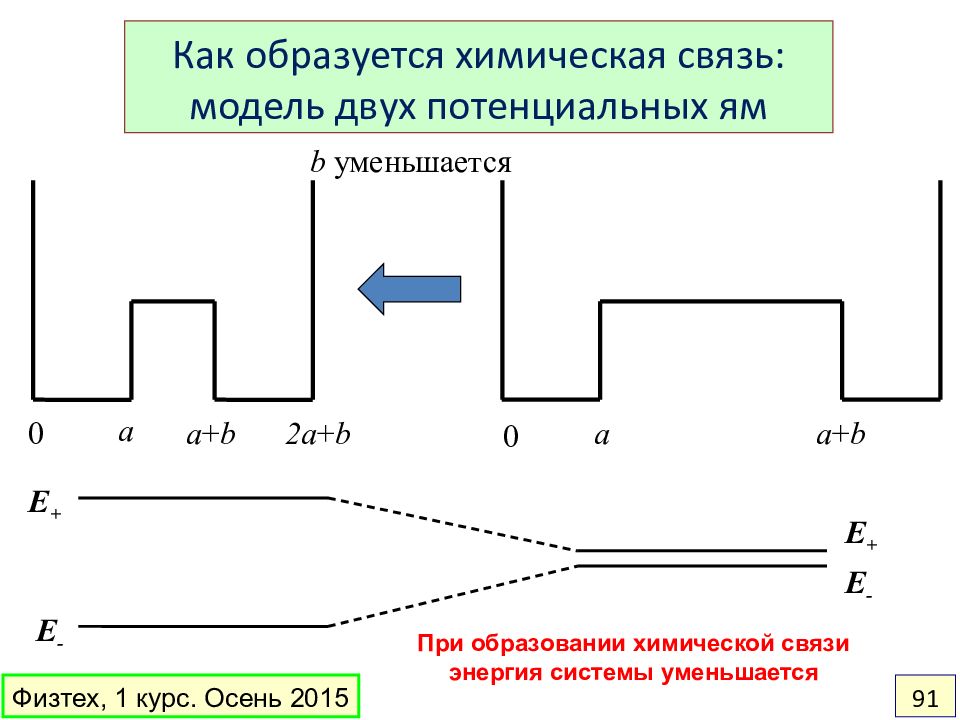
Слайд 91
0 a a + b 2a + b 0 a a + b b уменьшается E + E - E + E - Как образуется химическая связь: модель двух потенциальных ям При образовании химической связи энергия системы уменьшается Физтех, 1 курс. Осень 2015 91
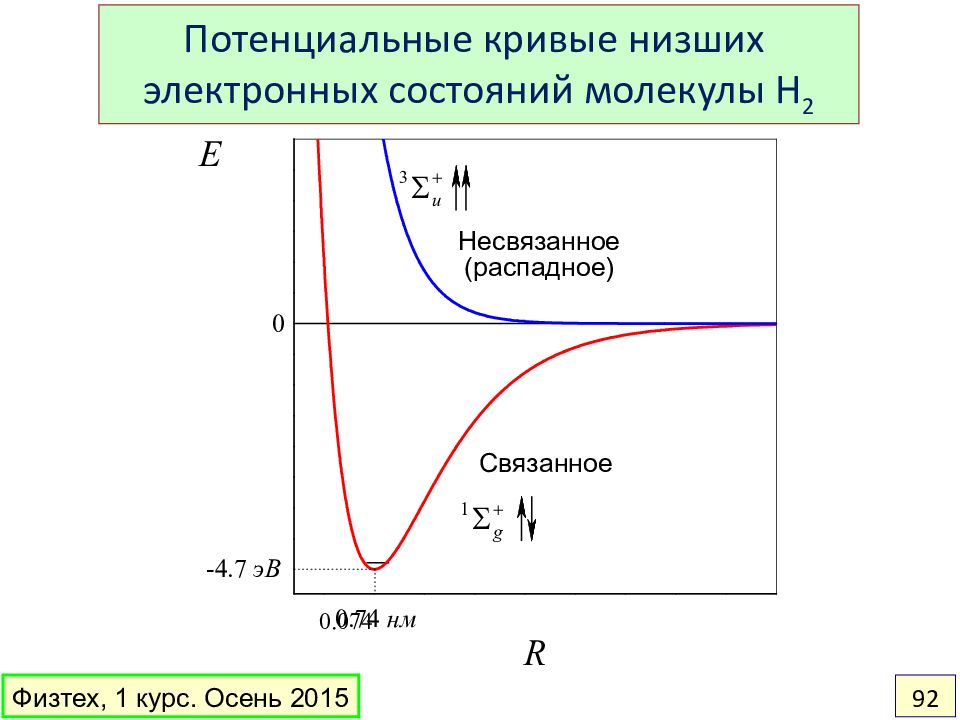
Слайд 92
0.074 Потенциальные кривые низших электронных состояний молекулы H 2 Связанное Несвязанное (распадное) Физтех, 1 курс. Осень 2015 92
Слайд 93: Химическая связь
Химическая связь – взаимодействие между атомами, приводящее к понижению общей энергии системы. Взаимодействие имеет преимущественно электростатический характер (обобществление электронов, переход электрона, кулоновское притяжение). Физтех, 1 курс. Осень 2015 93
Слайд 94: Виды химической связи
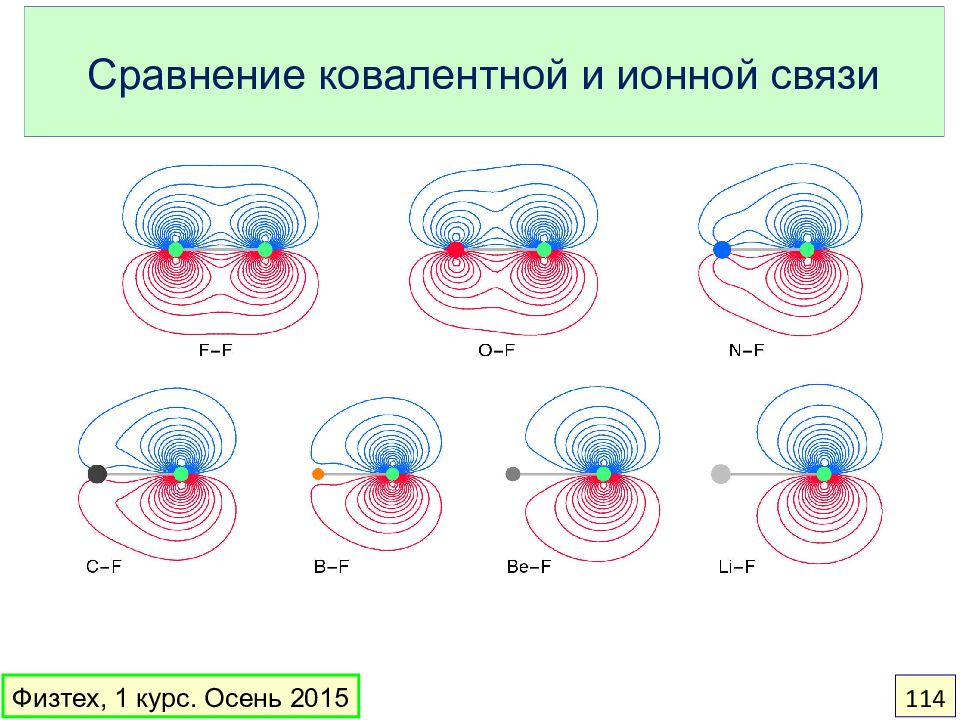
Ковалентная – внутримолекулярная связь между атомами, осуществляемая за счет общих пар электронов. Ионная – связь между ионами, образовавшимися при переходе электрона от одного атома к другому. Металлическая – связь между атомами металлов в твердой фазе Водородная – межмолекулярная связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом неметалла другой молекулы Ван-дер-ваальсова – межмолекулярная связь, притяжение дипольных моментов молекул (постоянных или индуцированных). Физтех, 1 курс. Осень 2015 94
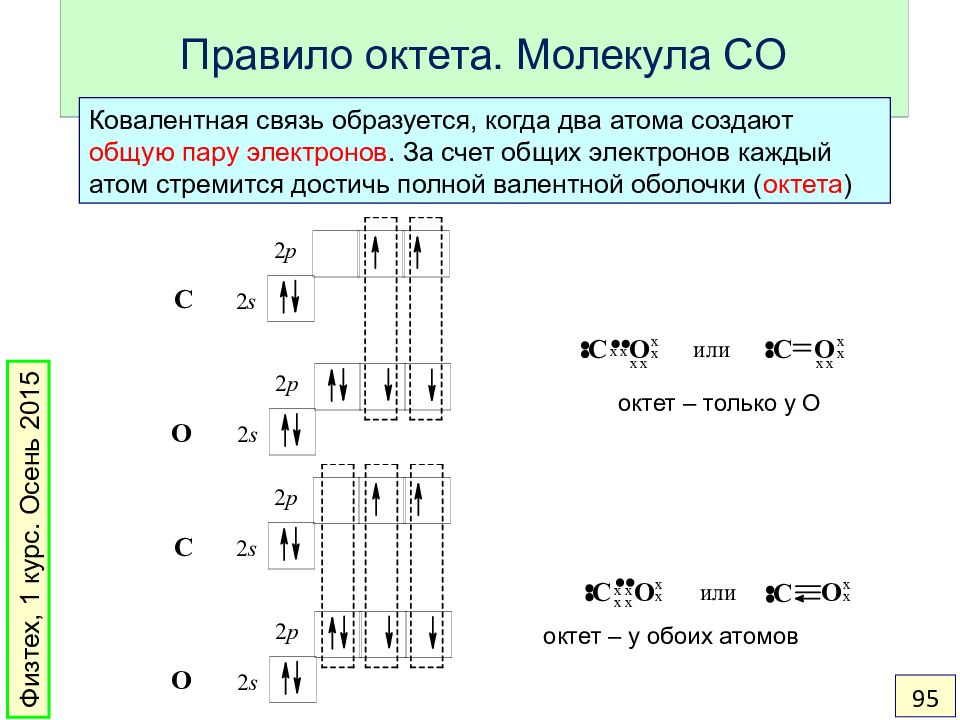
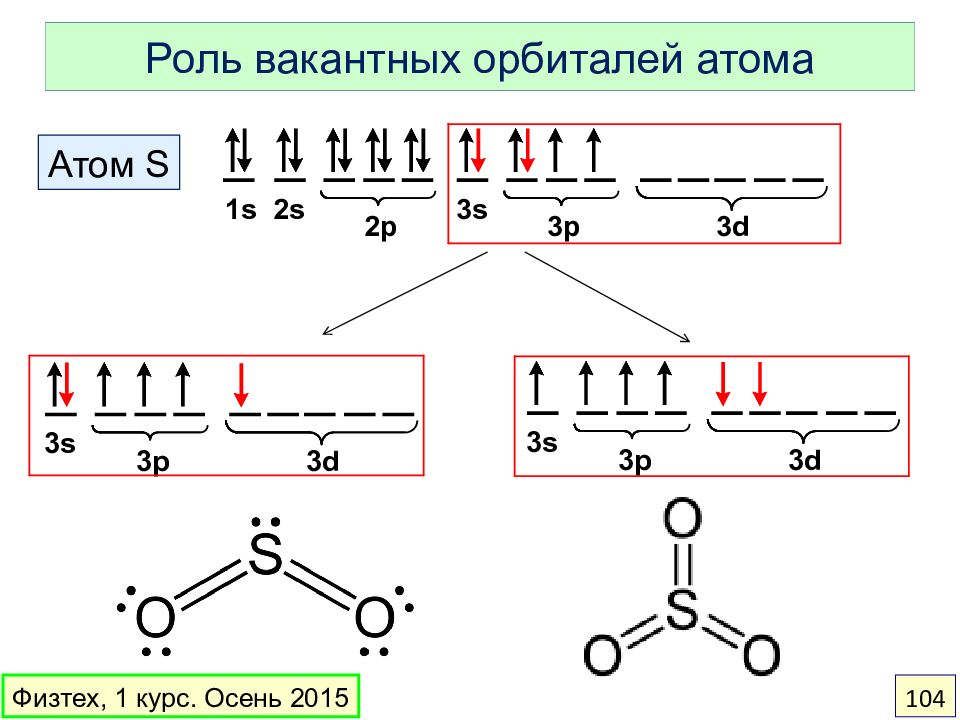
Слайд 95: Правило октета. Молекула CO
Ковалентная связь образуется, когда два атома создают общую пару электронов. За счет общих электронов каждый атом стремится достичь полной валентной оболочки ( октета ) Физтех, 1 курс. Осень 2015 95 октет – только у O октет – у обоих атомов
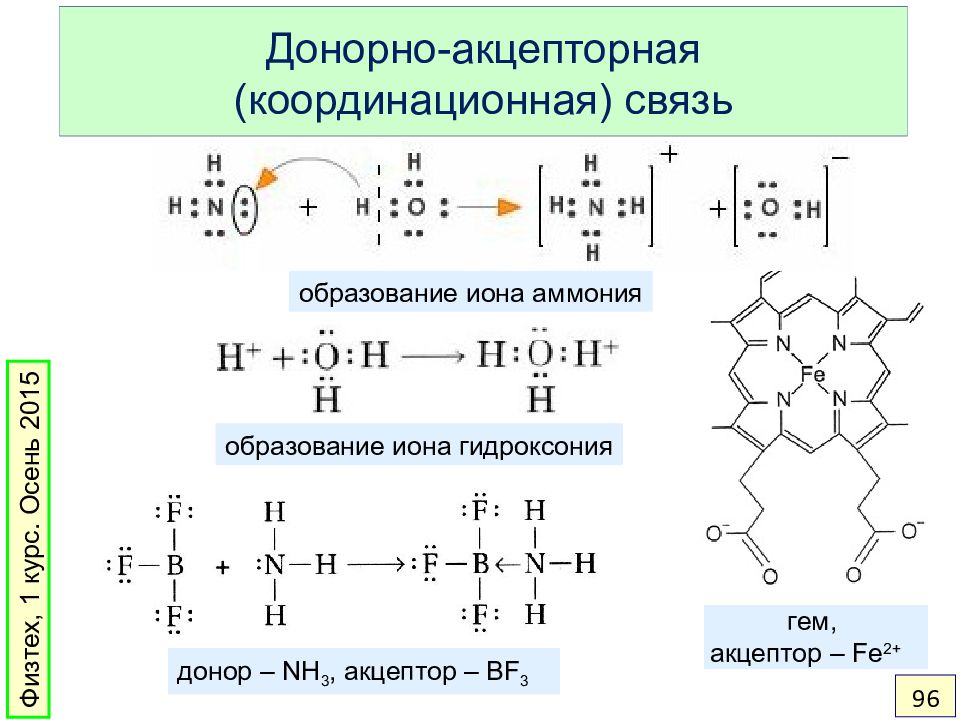
Слайд 96: Донорно-акцепторная (координационная) связь
образование иона гидроксония донор – NH 3, акцептор – BF 3 образование иона аммония гем, акцептор – Fe 2+ Физтех, 1 курс. Осень 2015 96
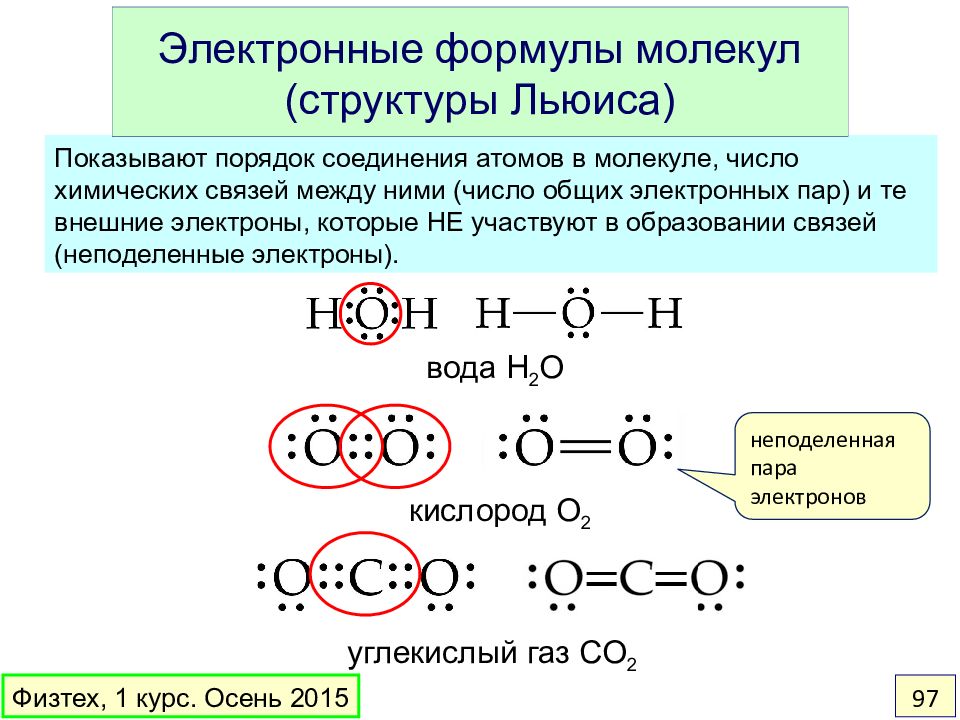
Слайд 97: Электронные формулы молекул (структуры Льюиса)
Показывают порядок соединения атомов в молекуле, число химических связей между ними (число общих электронных пар) и те внешние электроны, которые НЕ участвуют в образовании связей (неподеленные электроны). Электронные формулы молекул (структуры Льюиса) вода H 2 O кислород O 2 углекислый газ CO 2 неподеленная пара электронов Физтех, 1 курс. Осень 2015 97
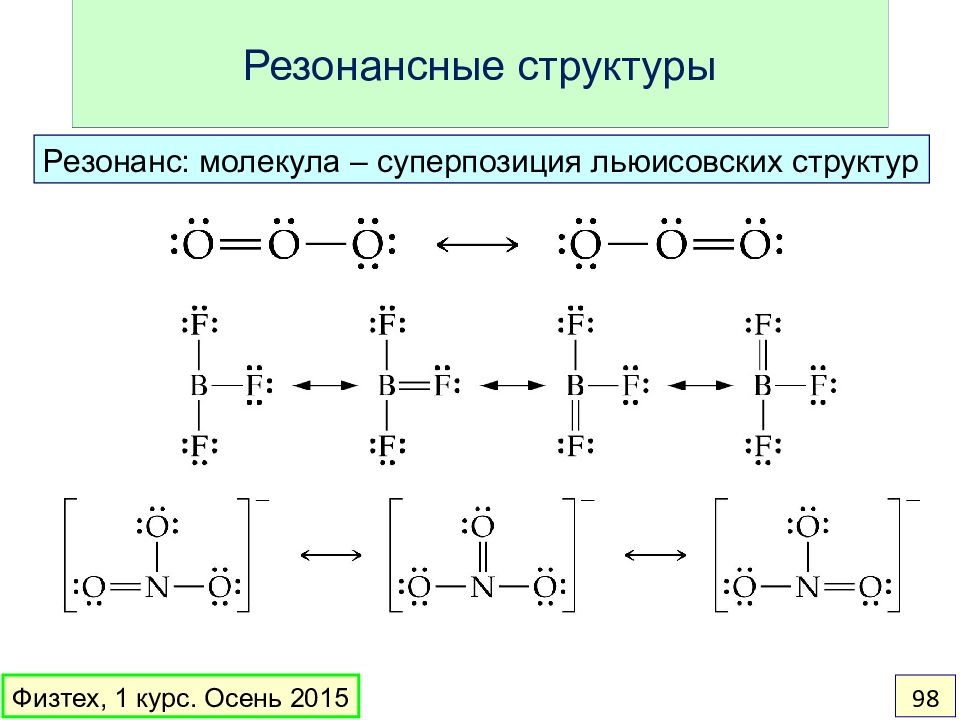
Слайд 98: Резонансные структуры
Резонанс: молекула – суперпозиция льюисовских структур Физтех, 1 курс. Осень 2015 98
Слайд 99: Валентность – одно из основных понятий в химии
Валентность – число ковалентных химических связей (общих электронных пар), которые данный атом образует с другими атомами в молекуле или ионе. Пример – оксид азота (I) N 2 O Атомы азота: средняя степень окисления +1, валентность центрального атома – IV, крайнего – средняя между II или III Физтех, 1 курс. Осень 2015 99
Слайд 100: Более общее определение валентности (ИЮПАК)
Валентность - число одновалентных атомов (групп атомов), с которыми может соединиться данный атом или которые он может заместить. Пример: H – одновалентен H–Cl следовательно Cl одновалентен NaCl следовательно Na одновалентен H 2 SO 4 следовательно сульфат SO 4 двухвалентен Для молекулярных соединений эти два определения совпадают. У ионных соединений валентность элементов определена только по ИЮПАК. Физтех, 1 курс. Осень 2015 100
Слайд 101: Химические ошибки в физических статьях (найдите две)
Физтех, 1 курс. Осень 2015 101
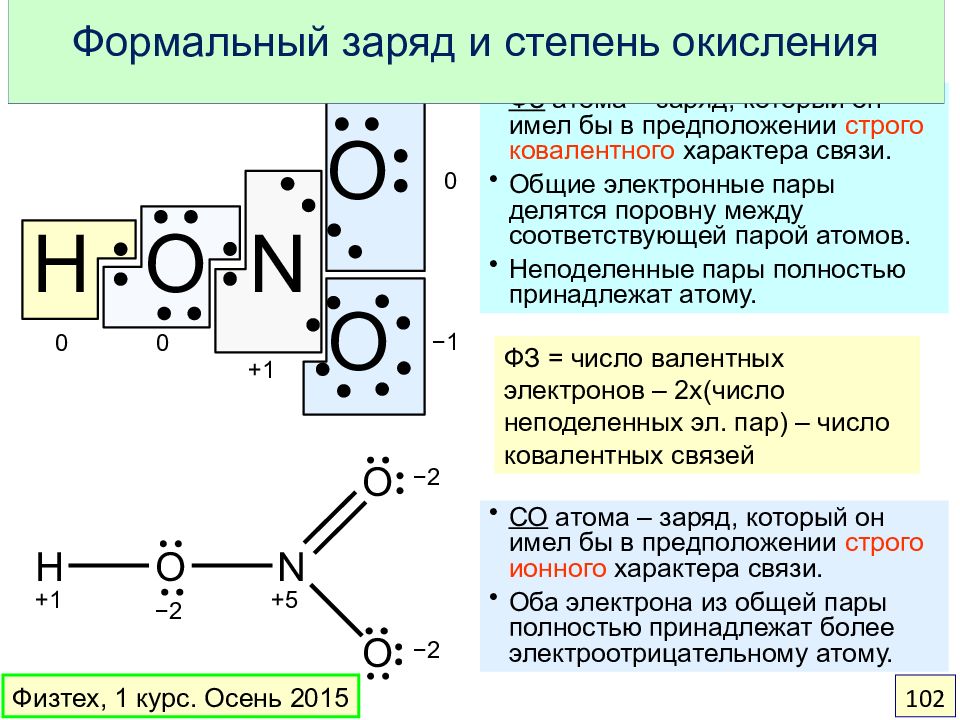
Слайд 102: Формальный заряд и степень окисления
0 0 +1 0 − 1 +1 − 2 − 2 − 2 +5 ФЗ атома – заряд, который он имел бы в предположении строго ковалентного характера связи. Общие электронные пары делятся поровну между соответствующей парой атомов. Неподеленные пары полностью принадлежат атому. СО атома – заряд, который он имел бы в предположении строго ионного характера связи. Оба электрона из общей пары полностью принадлежат более электроотрицательному атому. Формальный заряд и степень окисления ФЗ = число валентных электронов – 2 x (число неподеленных эл. пар) – число ковалентных связей Физтех, 1 курс. Осень 2015 102
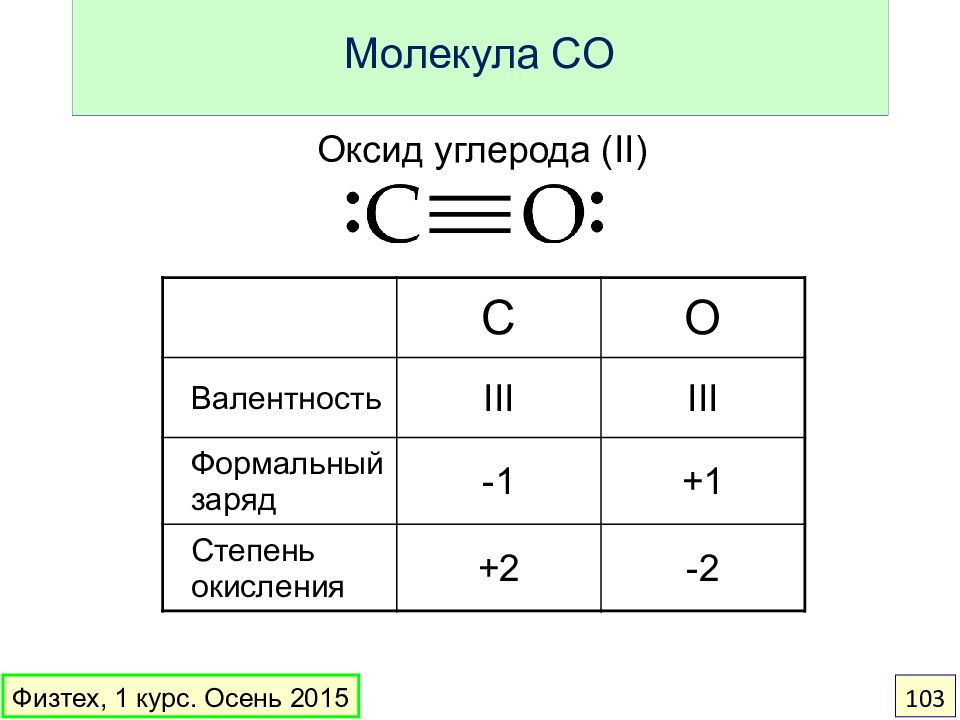
Слайд 103: Молекула CO
Оксид углерода (II) C O Валентность III III Формальный заряд -1 +1 Степень окисления +2 -2 Физтех, 1 курс. Осень 2015 103
Слайд 105: Основные характеристики ковалентной связи
Кратность (порядок связи) – число электронных пар Длина связи – расстояние между ядрами, при котором энергия молекулы – наименьшая Энергия связи – выигрыш в энергии при образовании связи из разъединённых фрагментов (атомов) Полярность связи – характеризует степень смещения электронной плотности к одному из двух атомов, образующих связь Физтех, 1 курс. Осень 2015 105
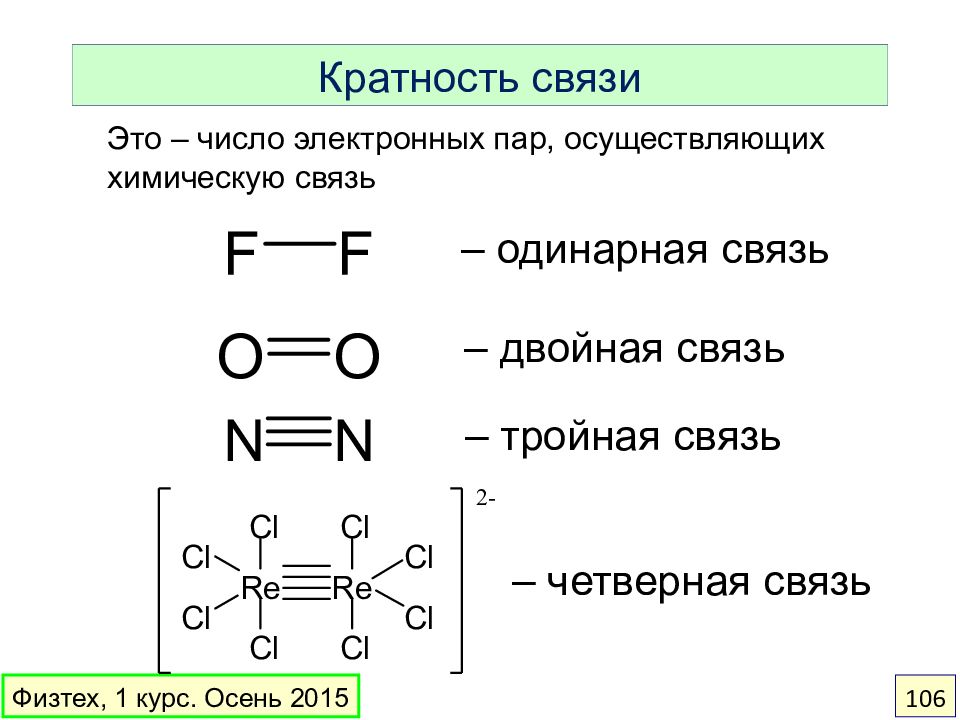
Слайд 106
Кратность связи – одинарная связь – двойная связь – тройная связь – четверная связь Это – число электронных пар, осуществляющих химическую связь Физтех, 1 курс. Осень 2015 106
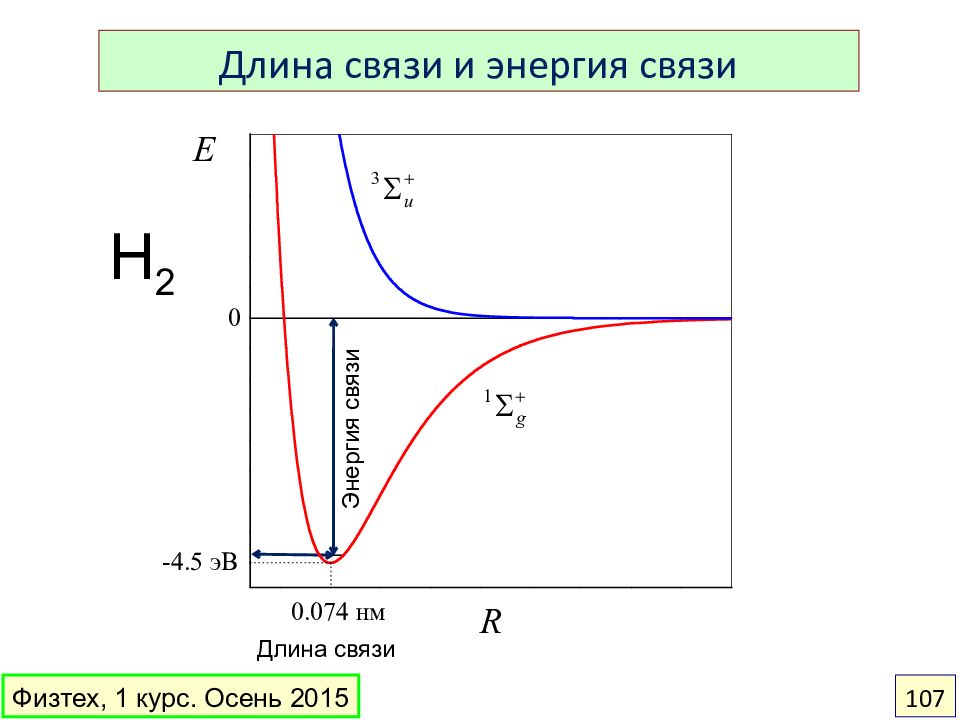
Слайд 107
Длина связи и энергия связи Физтех, 1 курс. Осень 2015 107 H 2 Энергия связи Длина связи
Слайд 108: Длина связи
Длина связи – расстояние между ядрами связанных атомов. Измеряют в нанометрах. Самая короткая связь: H–H (0,074 нм) Самая длинная связь: I–I (0, 267 нм) 4 Физтех, 1 курс. Осень 2015 108
Слайд 109: Энергия связи
Энергия связи – энергия, необходимая для разрыва химической связи и разделения полученных фрагментов на бесконечное расстояние E (H–H) = 436 кДж / моль. H 2 (г) = H (г) + H( г) – 436 кДж / моль H( г) + H( г) = H 2 ( г) + 436 кДж / моль Физтех, 1 курс. Осень 2015 109 Самая прочная ковалентная связь: C O ( 1076 кДж / моль) Самая слабая ковалентная связь: N–N в N 2 O 3 ( 41 кДж / моль)
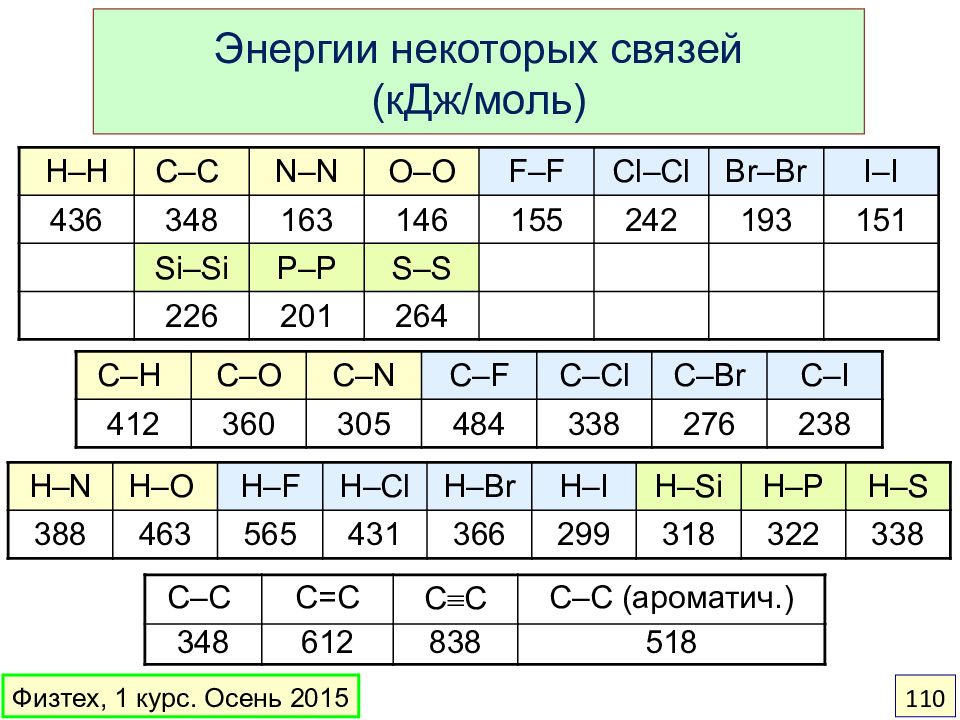
Слайд 110
Энергии некоторых связей (кДж / моль) H – H C – C N – N O – O F – F Cl – Cl Br – Br I – I 436 34 8 163 146 155 242 193 151 Si – Si P – P S – S 226 201 264 C – H C – O C – N C – F C – Cl C – Br C – I 412 360 305 484 338 276 238 C – C C=C C C C – C ( ароматич.) 348 612 838 518 H – N H – O H – F H – Cl H – Br H – I H – Si H – P H – S 388 463 565 431 366 299 318 322 338 Физтех, 1 курс. Осень 2015 110
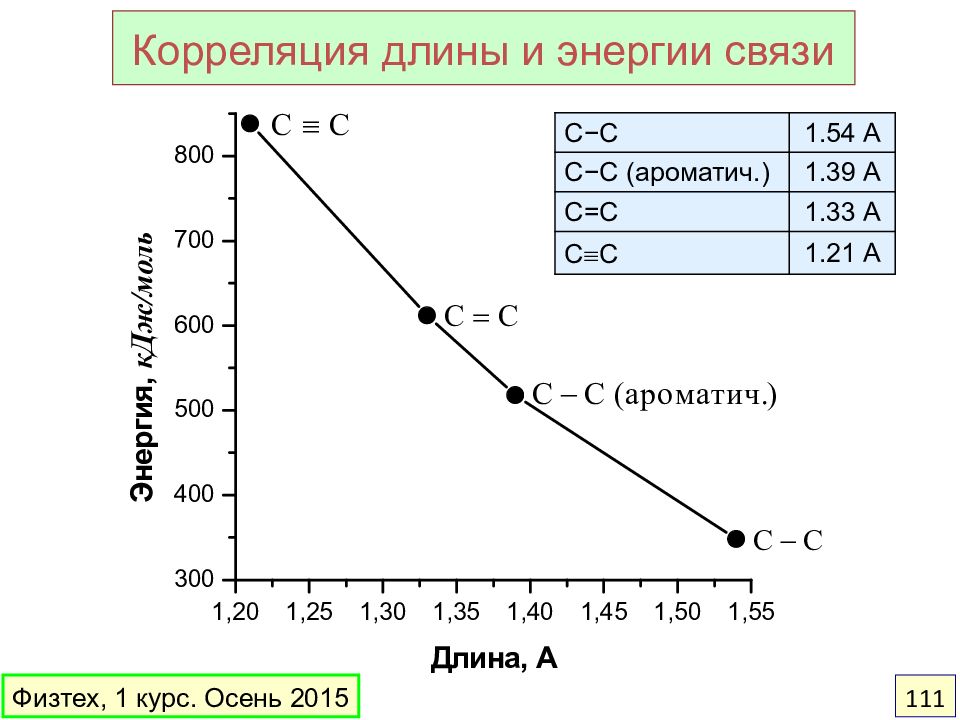
Слайд 111
С −С 1.54 А С − С (ароматич.) 1.39 А С=С 1.33 А С С 1.21 А Корреляция длины и энергии связи Физтех, 1 курс. Осень 2015 111
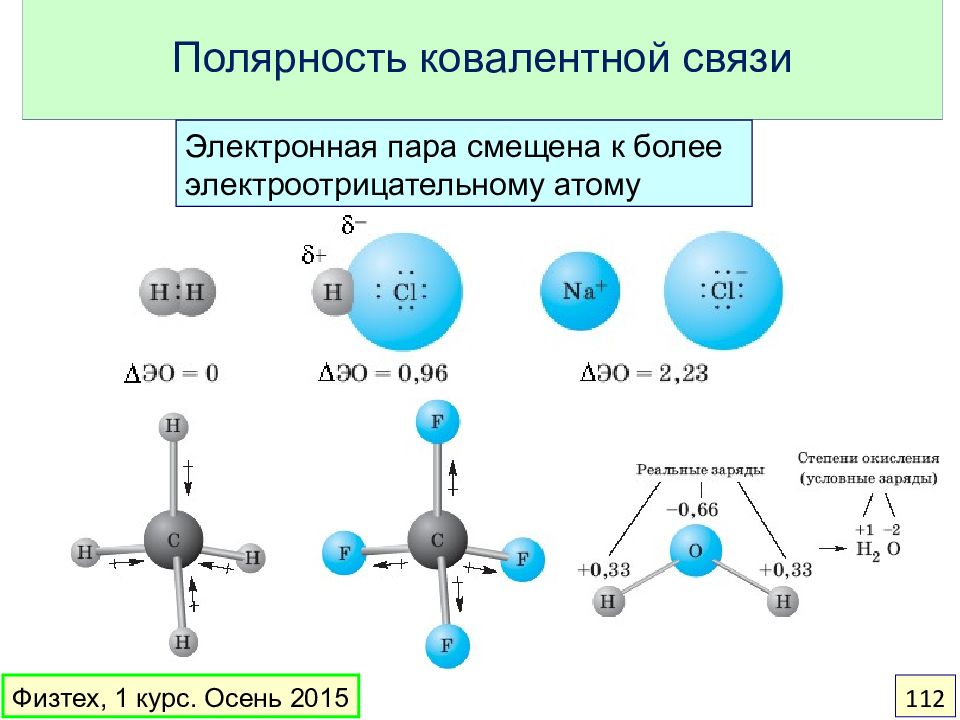
Слайд 112: Полярность ковалентной связи
Электронная пара смещена к более электроотрицательному атому Физтех, 1 курс. Осень 2015 112
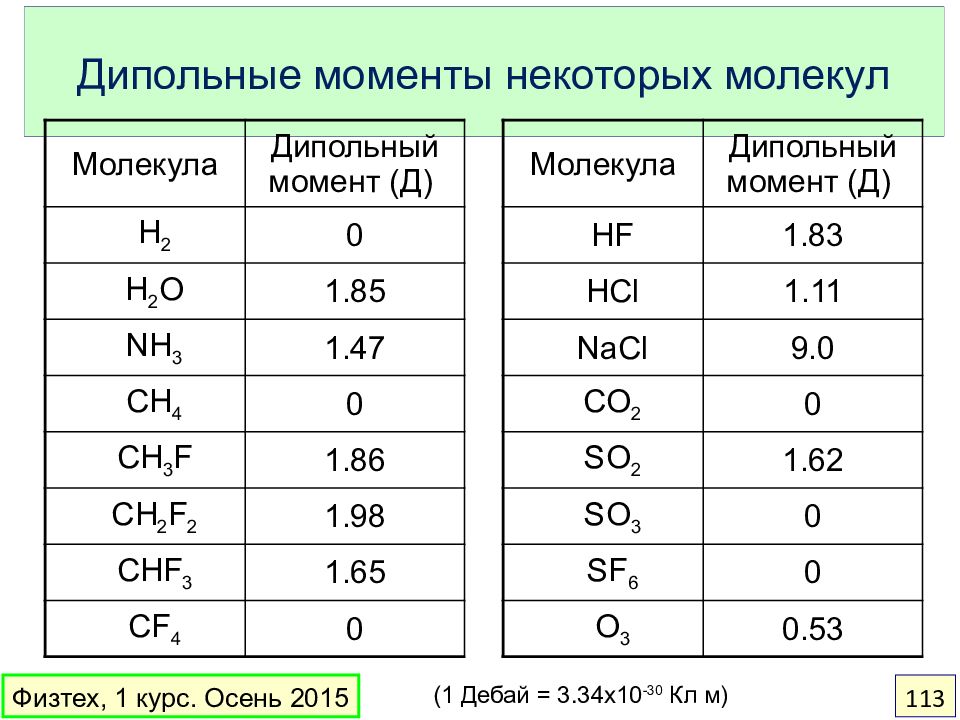
Слайд 113: Дипольные моменты некоторых молекул
Физтех, 1 курс. Осень 2015 113 Молекула Дипольный момент (Д) H 2 0 H 2 O 1.85 NH 3 1.4 7 CH 4 0 CH 3 F 1.86 CH 2 F 2 1.98 CHF 3 1.65 CF 4 0 (1 Дебай = 3.34х10 -30 Кл м) Молекула Дипольный момент (Д) HF 1.83 HCl 1.11 NaCl 9.0 CO 2 0 SO 2 1.62 SO 3 0 SF 6 0 O 3 0.53
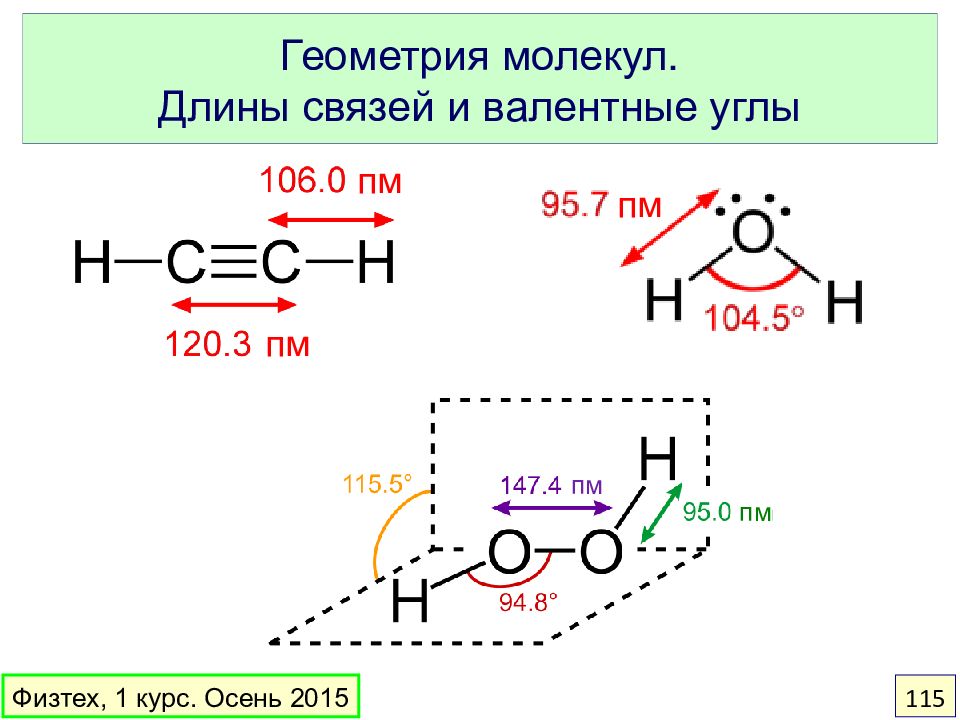
Слайд 115: Геометрия молекул. Длины связей и валентные углы
пм пм пм пм пм Физтех, 1 курс. Осень 2015 115
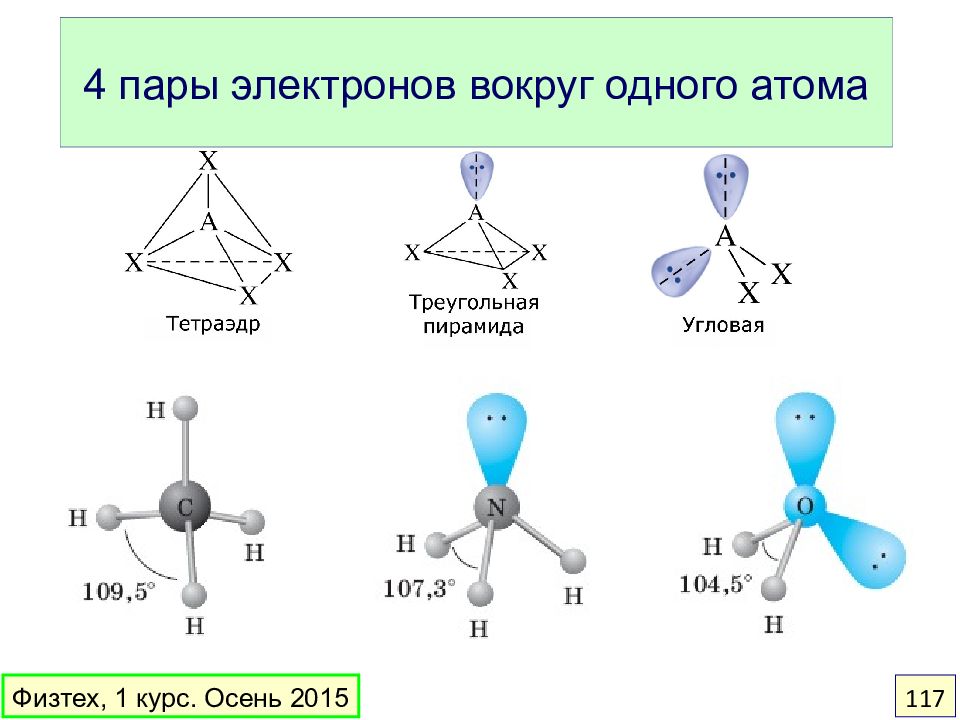
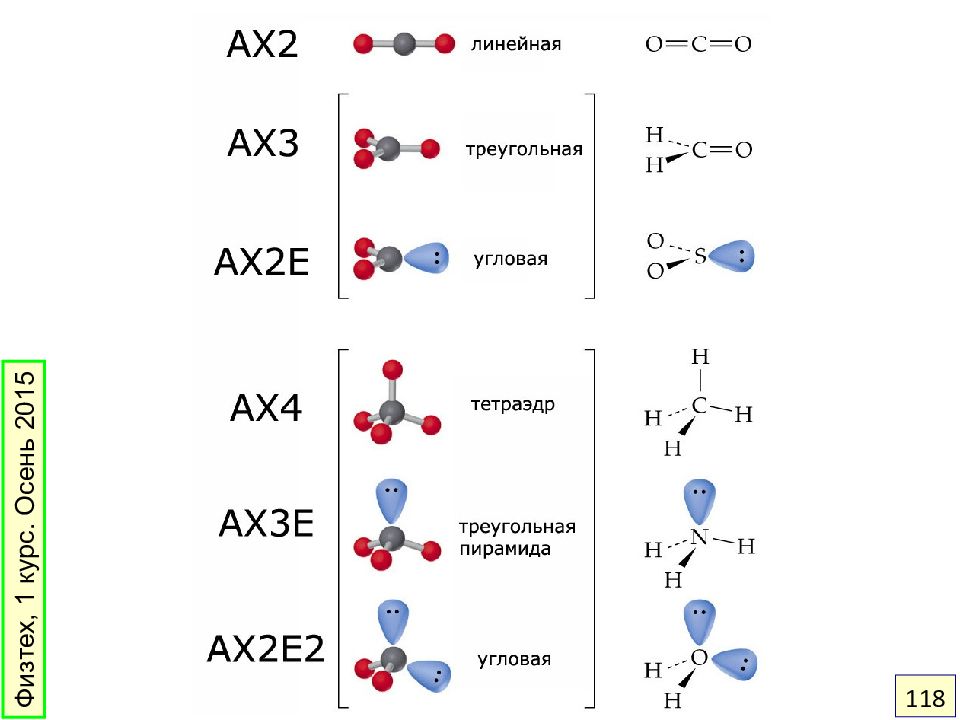
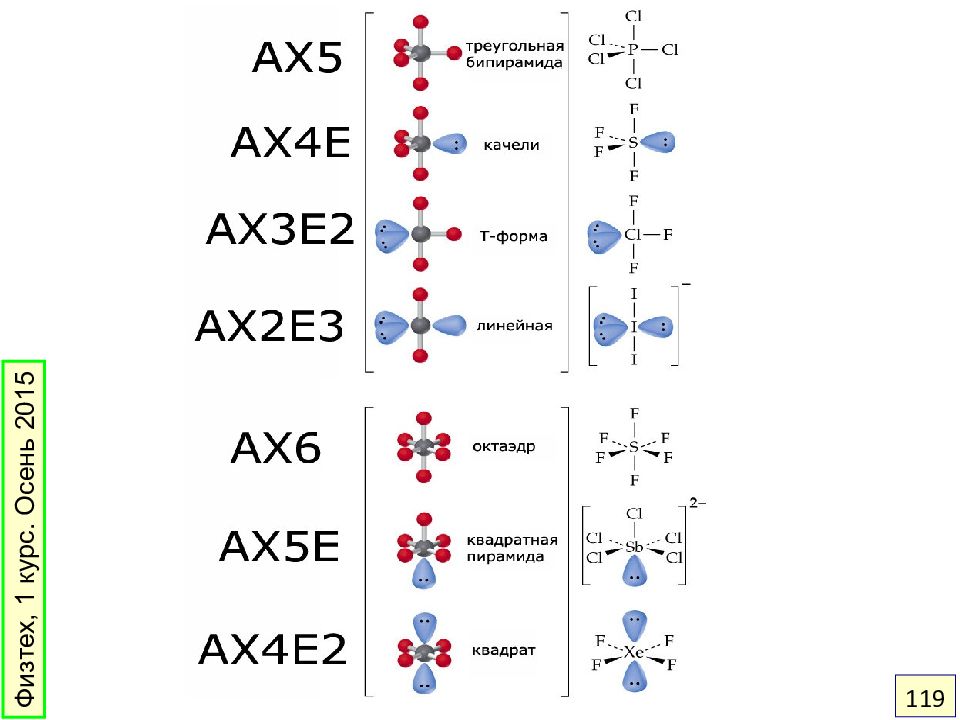
Слайд 116: Как предсказать геометрию? Модель ОЭПВО
Области повышенной электронной плотности – электронные пары связей и неподеленные пары – располагаются на максимальном удалении друг от друга. Физтех, 1 курс. Осень 2015 116
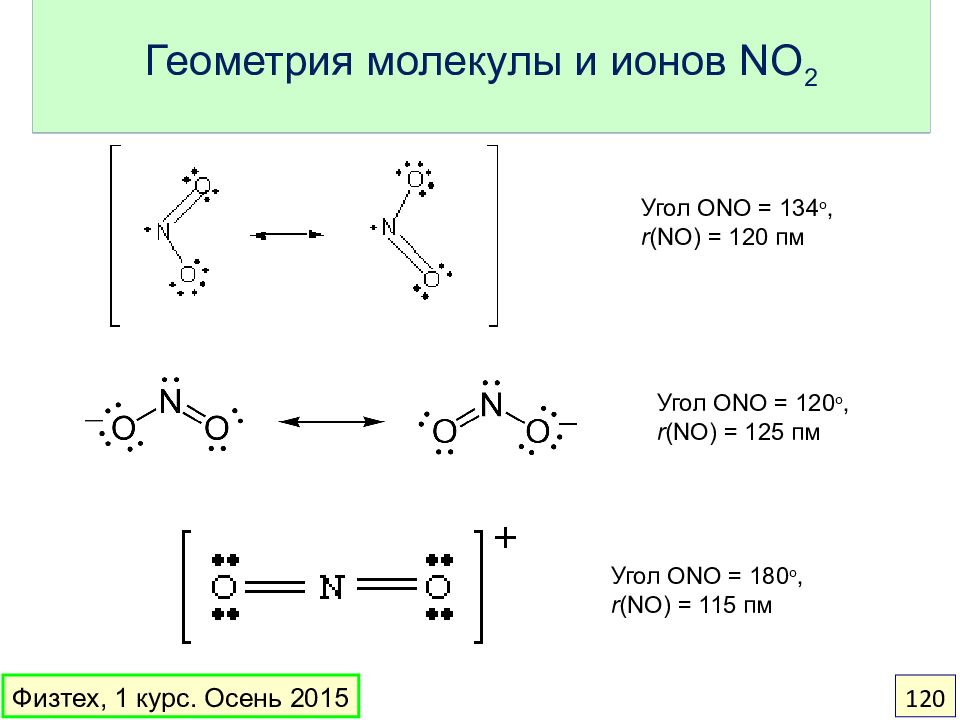
Слайд 120: Геометрия молекулы и ионов NO 2
Угол ONO = 134 o, r (NO) = 120 пм Угол ONO = 1 20 o, r (NO) = 12 5 пм Угол ONO = 1 80 o, r (NO) = 1 15 пм Физтех, 1 курс. Осень 2015 120
Слайд 121: Коротко о главном
Химическая связь – взаимодействие атомов, которое приводит к уменьшению энергии системы, в частности – к образованию молекул. Ковалентная связь образуется, когда два атома создают общую пару электронов с тем, чтобы достичь полной валентной оболочки. Основные характеристики химической связи: порядок (кратность), длина, энергия. С увеличением порядка длина связи уменьшается, а энергия увеличивается. Геометрия молекул (валентные углы) определяется отталкиванием электронных пар химических связей и неподеленных электронных пар. Физтех, 1 курс. Осень 2015 121
Слайд 122: Основные понятия
Молекула Химическая связь Ковалентная связь. Правило октета Валентность, степень окисления Структура Льюиса Характеристики химической связи: - кратность связи - длина связи - энергия связи - полярность, дипольный момент Геометрия молекул: длины связей, валентные углы Модель отталкивания электронных пар Физтех, 1 курс. Осень 2015 122
Слайд 123: Типичные задачи
Изобразите льюисову структуру молекулы озона ( CO, CO 2, N 2 O, NH 3, H 2 SO 4, SO 4 2- ). Определите степени окисления и формальные заряды на атомах. Предскажите геометрическую форму молекулы CO 2 ( SO 2, NH 3, COCl 2, PCl 5, POCl 3 ). Установите, полярна данная молекула или нет. Физтех, 1 курс. Осень 2015 123
Слайд 124: Литература
Еремин, Борщевский. Общая и неорганическая химия. – Гл. 13, §§ 13.2-13.4. Шрайвер, Эткинс. Неорганическая химия. – Том 1, глава 3, §§ 3.1-3.3. (По этой теме – проще всего). Еремин. Теоретическая и математическая химия. – Гл. 2. § 5. Глинка. Общая химия. – Глава 4. (Сложновато и слишком длинно для первого чтения, упор сделан на теорию МО) Полинг. Природа химической связи. – М., 1947. (Совершенная классика! Только для дополнительного чтения) Физтех, 1 курс. Осень 2015 124
Слайд 125
Лекция 4 Электронные состояния молекул. Межмолекулярные связи Физтех, 1 курс. Осень 2015 125
Слайд 126: План лекции
Разделение движения ядер и электронов. Адиабатическое приближение. Электронные состояния молекул Метод валентных связей. Гибридизация АО Молекулярные орбитали. Метод МО-ЛКАО Межмолекулярные взаимодействия: а) ван-дер-ваальсова связь б) водородная связь Физтех, 1 курс. Осень 2015 126
Слайд 127: Что может квантовая механика
Рассчитать уровни энергии и волновые функции молекулы. Определить геометрию молекулы – расстояния между ядрами, при которых энергия имеет глобальный минимум. Рассчитать свойства молекулы : заряды на атомах, дипольный момент, порядки связей Квантовая механика в состоянии адекватно объяснить : Спектры молекул. Соединение атомов в молекулу, ее устойчивость или неустойчивость. Порядок образования и свойства химических связей. Физтех, 1 курс. Осень 2015 127
Слайд 128: Молекулы. Адиабатическое приближение
Полный электронно-ядерный гамильтониан Разделение электронного и ядерного движений Электронное УШ Ядерное УШ (приближенное) r – координаты электронов, R – координаты ядер Физтех, 1 курс. Осень 2015 128 Медленное движение ядер в потенциальном поле, создаваемом электронами
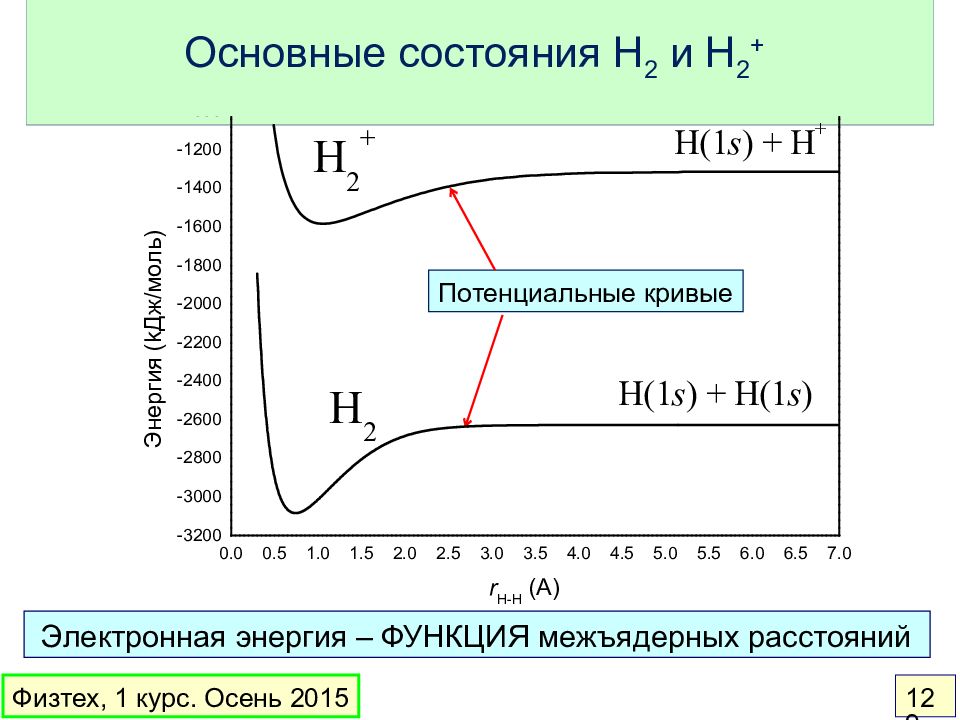
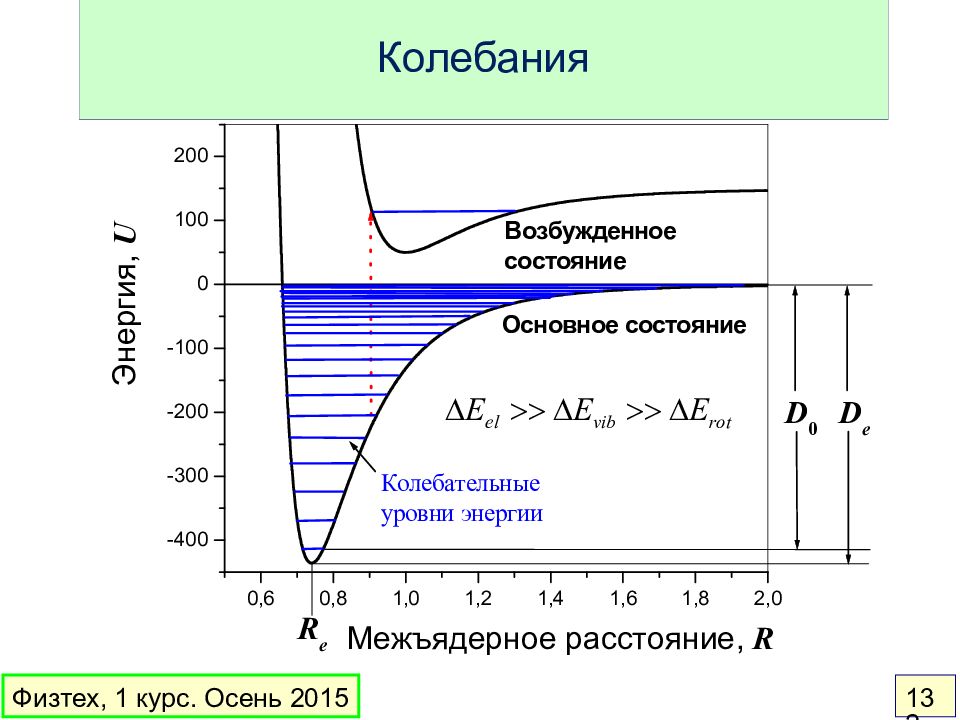
Слайд 129: Основные состояния H 2 и H 2 +
Электронная энергия – ФУНКЦИЯ межъядерных расстояний Физтех, 1 курс. Осень 2015 129 Потенциальные кривые
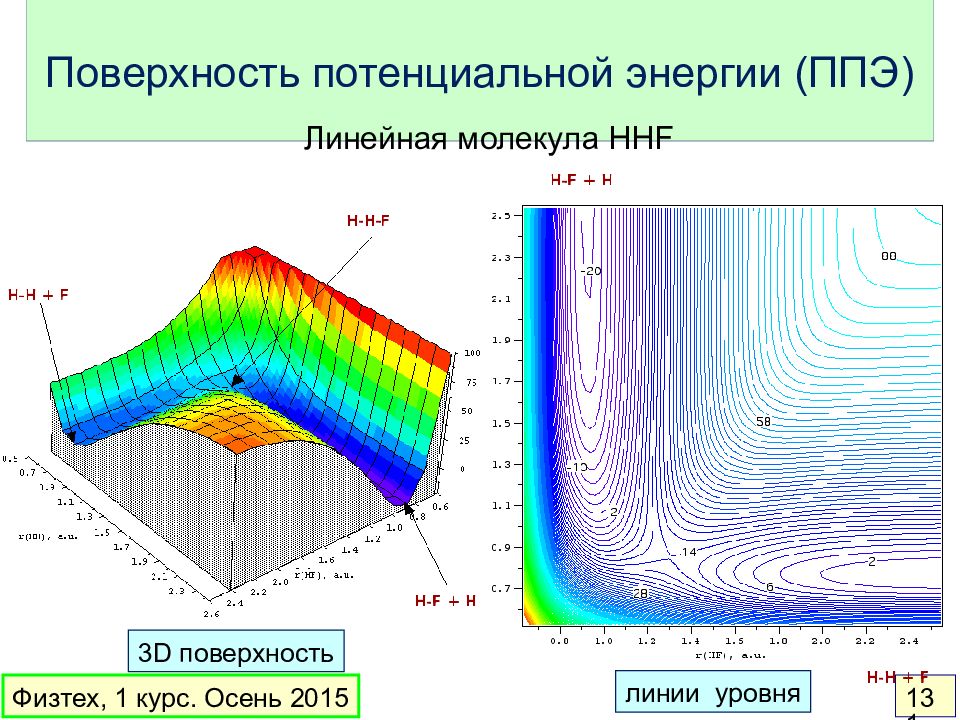
Слайд 131: Поверхность потенциальной энергии (ППЭ)
Физтех, 1 курс. Осень 2015 131 Линейная молекула HHF 3D поверхность линии уровня
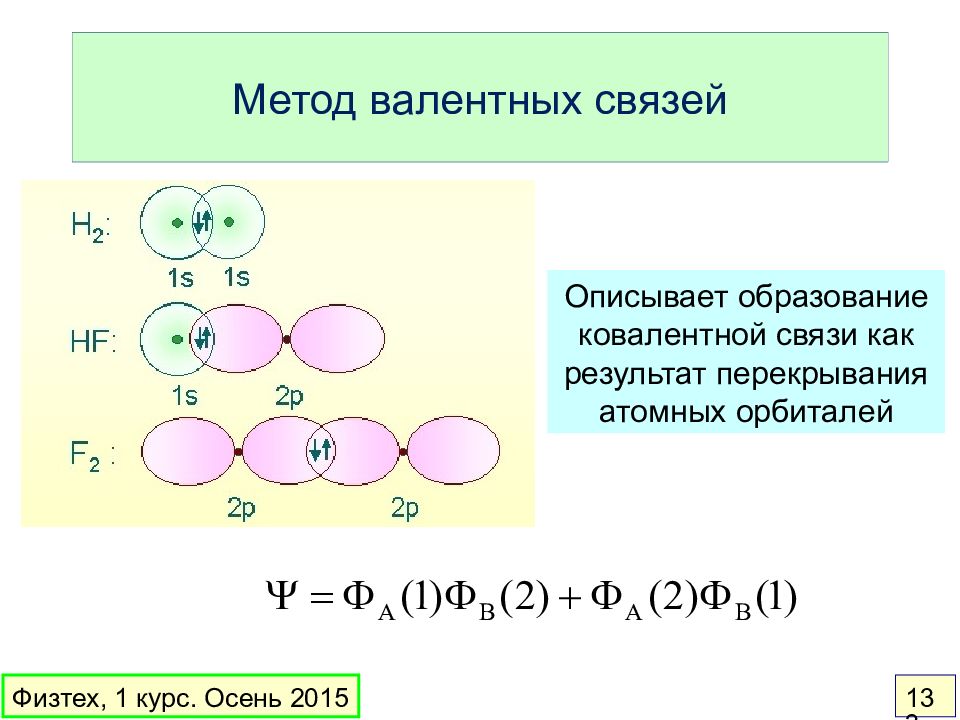
Слайд 133: Метод валентных связей
Описывает образование ковалентной связи как результат перекрывания атомных орбиталей Физтех, 1 курс. Осень 2015 133
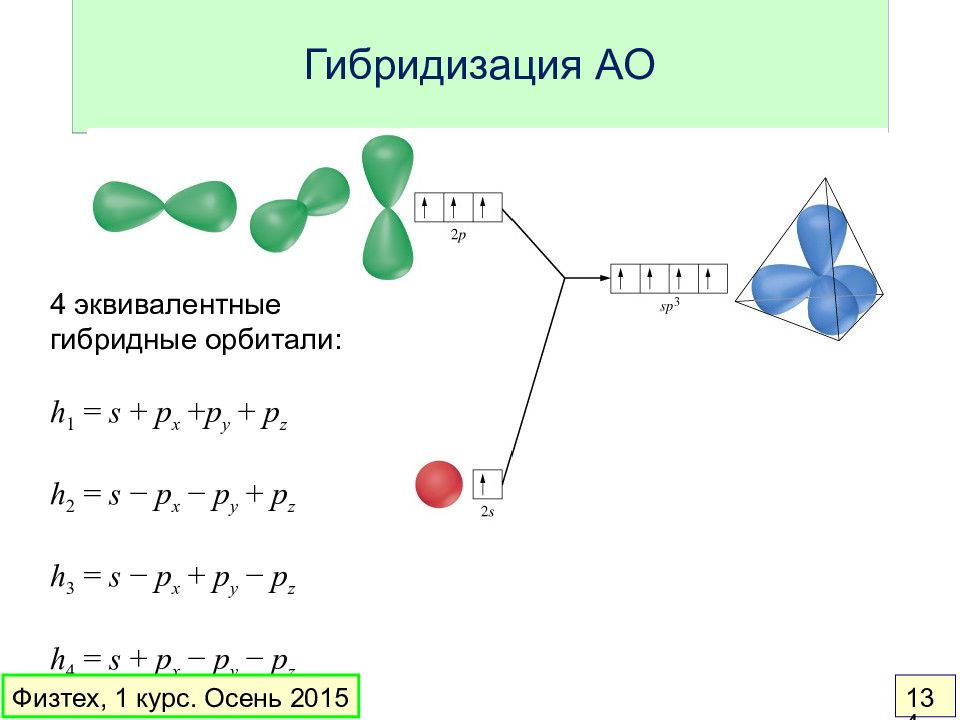
Слайд 134: Гибридизация АО
4 эквивалентные гибридные орбитали: h 1 = s + p x + p y + p z h 2 = s − p x − p y + p z h 3 = s − p x + p y − p z h 4 = s + p x − p y − p z Физтех, 1 курс. Осень 2015 134
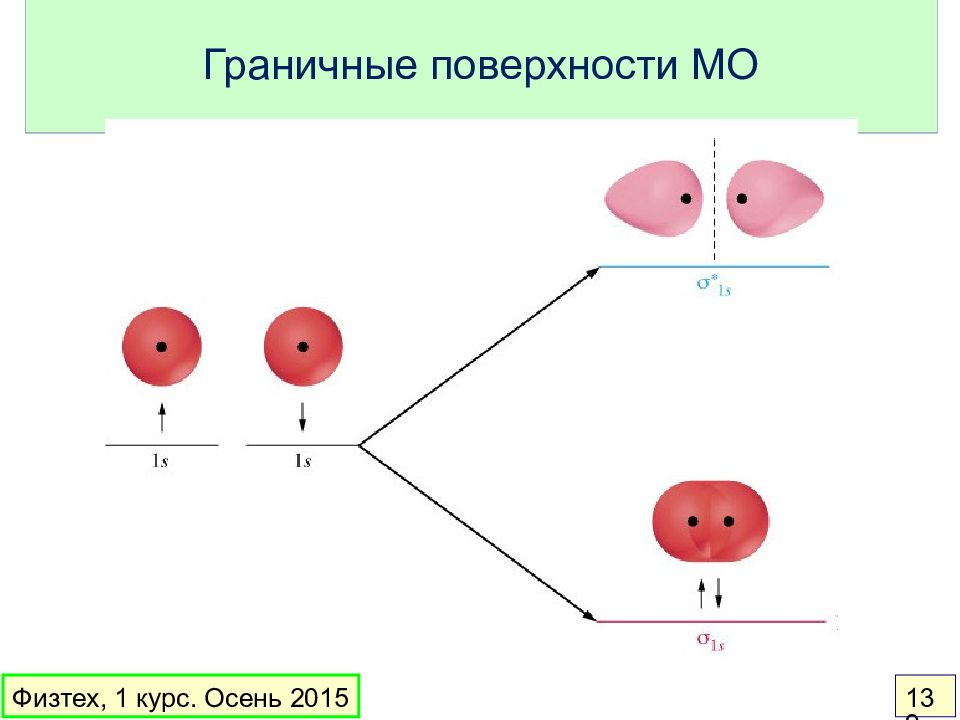
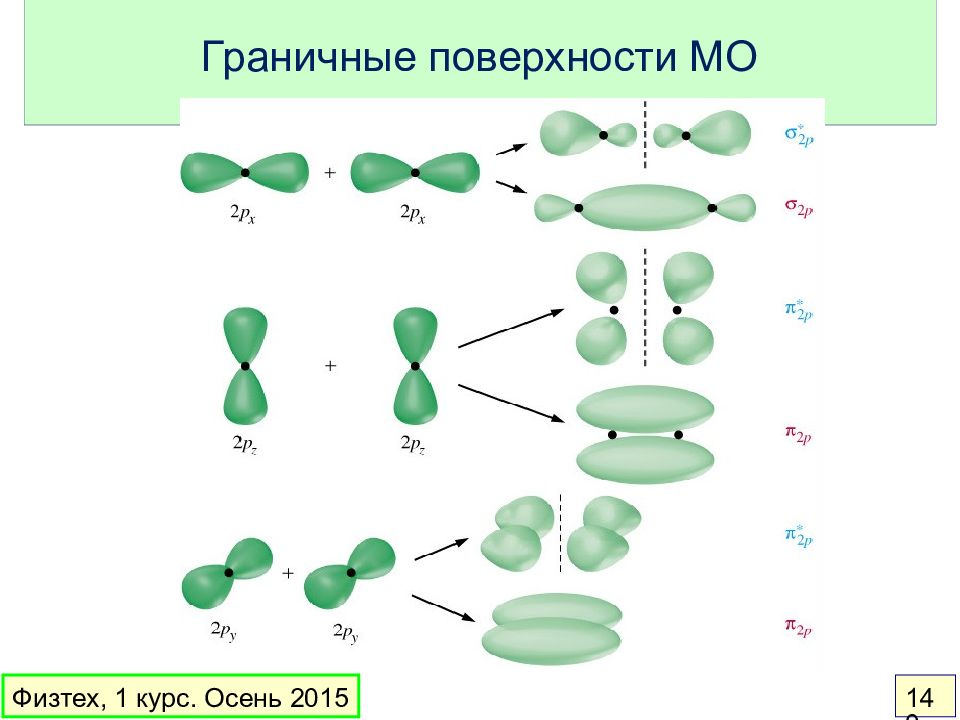
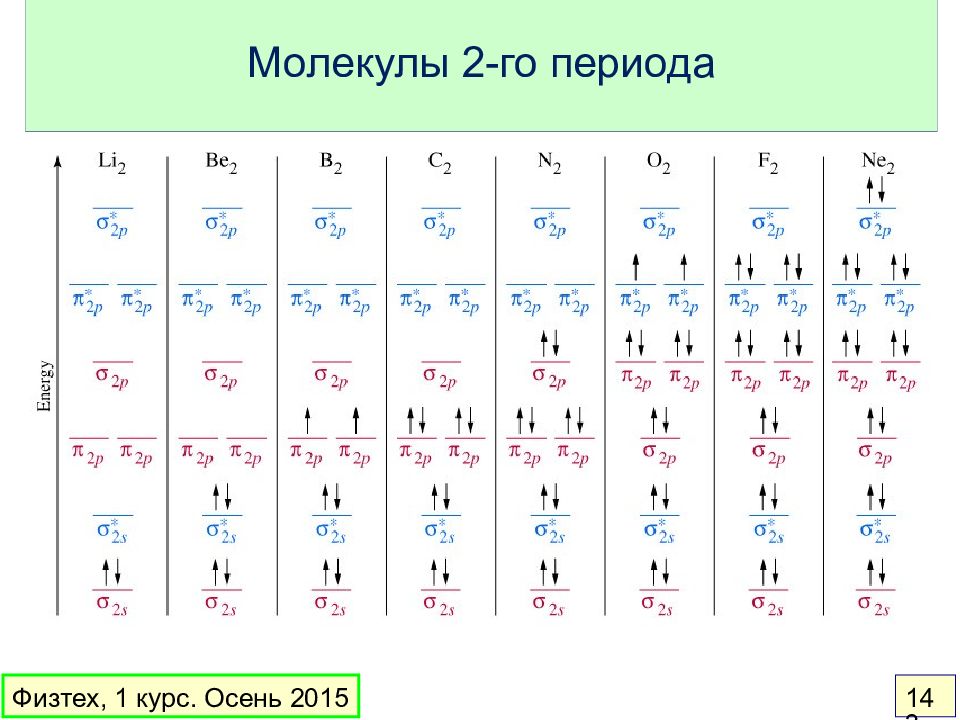
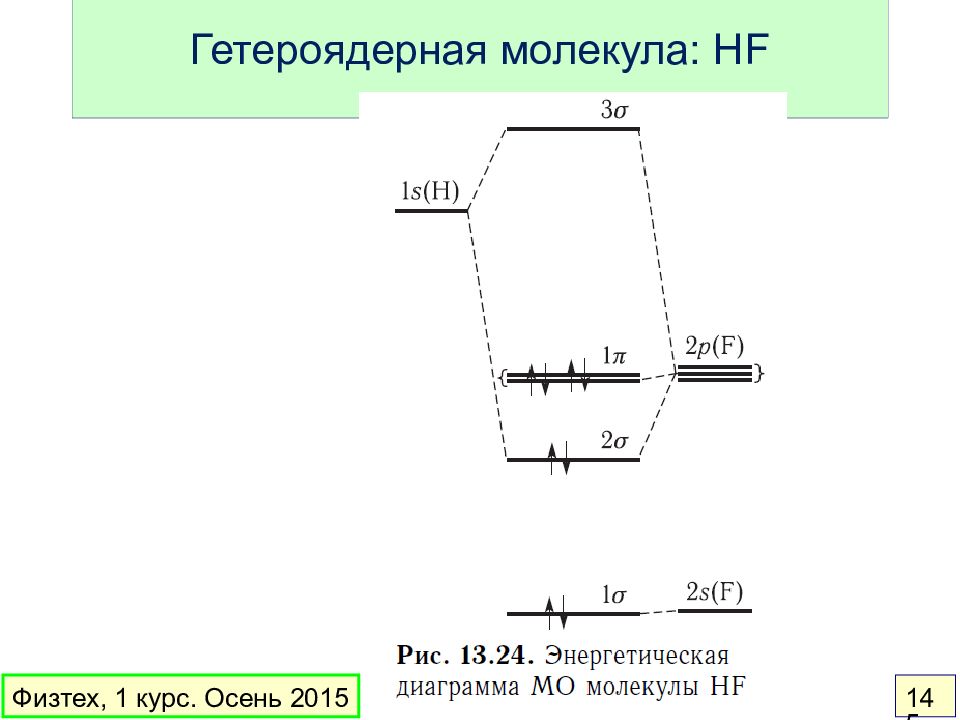
Слайд 136: Теория МО
Орбитальное приближение : электронная волновая функция молекулы составляется из одноэлектронных волновых функций ( МО ) МО – линейная комбинация АО: Вклад в МО дают перекрывающиеся АО с близкой энергией Основные идеи: Физтех, 1 курс. Осень 2015 136
Слайд 137: Простейшие понятия
Связывающая МО – энергия меньше, чем у АО Разрыхляющая МО – энергия больше, чем у АО Несвязывающая МО – энергия такая же, как у АО Порядок связи = ½ ( число электронов на связывающих МО – число электронов на разрыхляющих МО) Физтех, 1 курс. Осень 2015 137
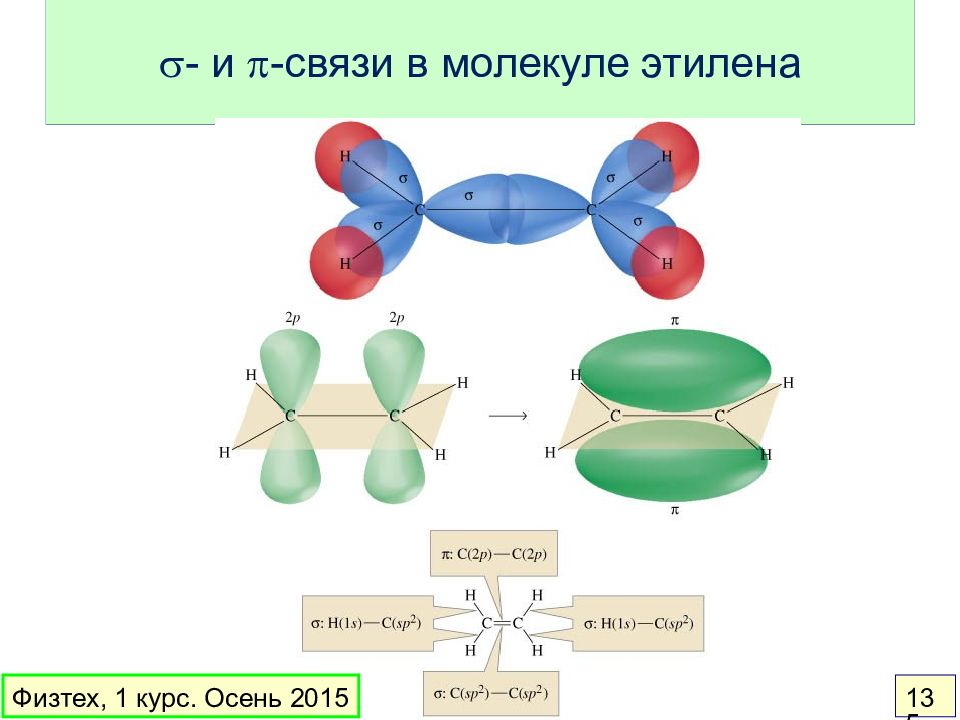
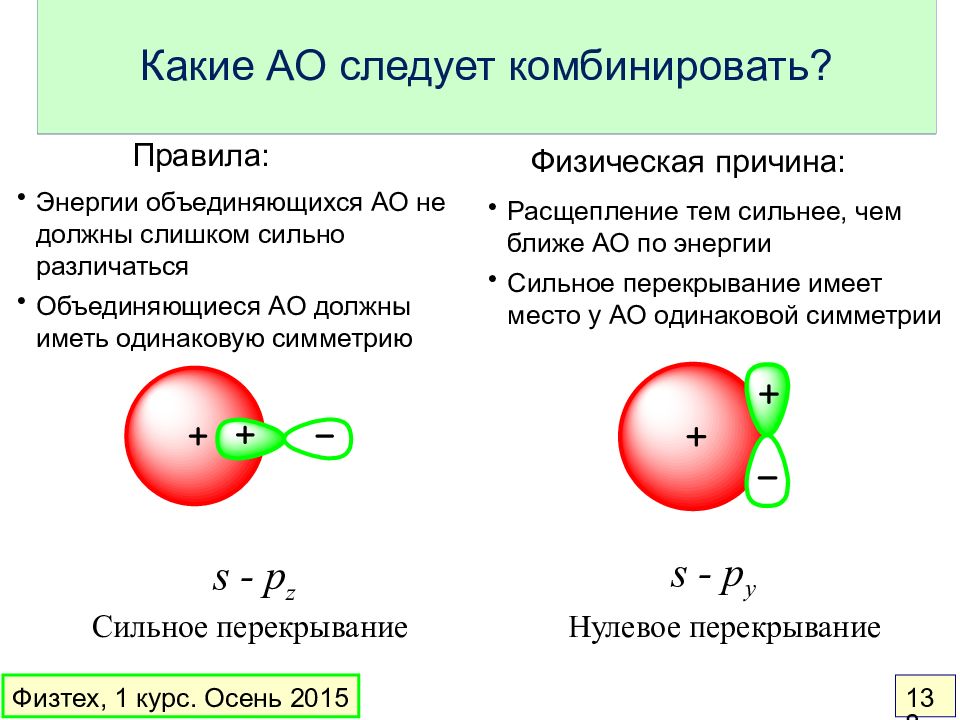
Слайд 138: Какие АО следует комбинировать?
Расщепление тем сильнее, чем ближе АО по энергии Сильное перекрывание имеет место у АО одинаковой симметрии Энергии объединяющихся АО не должны слишком сильно различаться Объединяющиеся АО должны иметь одинаковую симметрию Физическая причина: Правила: s - p z s - p y Какие АО следует комбинировать? Сильное перекрывание Нулевое перекрывание Физтех, 1 курс. Осень 2015 138
Слайд 141: Молекула H 2
АО МО Полная электронная ВФ молекулы (детерминант Слэтера): спин-орбиталь Физтех, 1 курс. Осень 2015 141
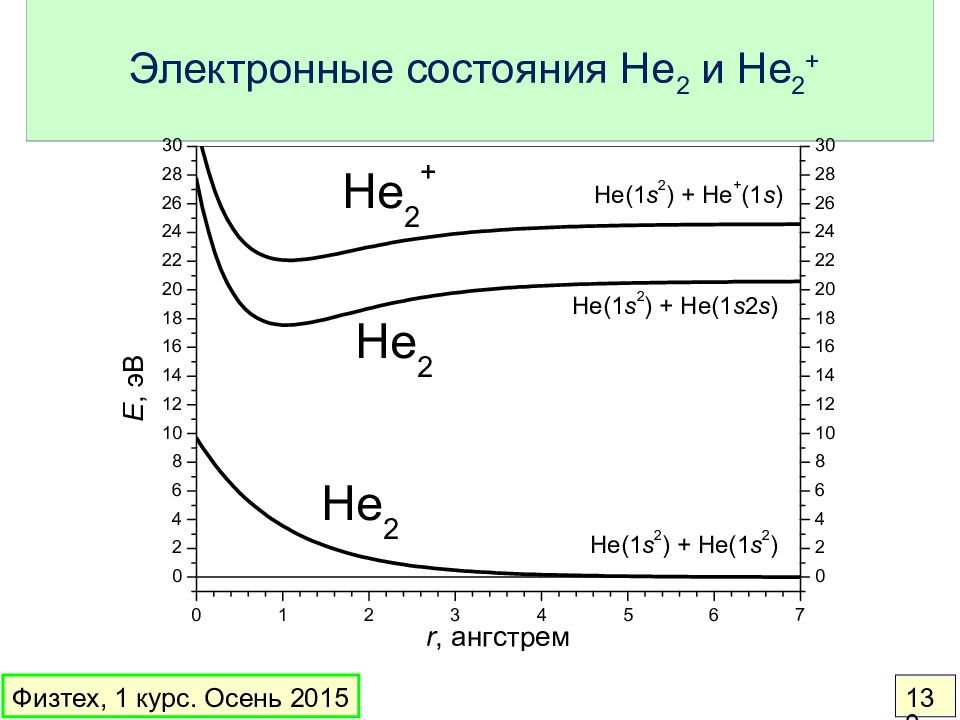
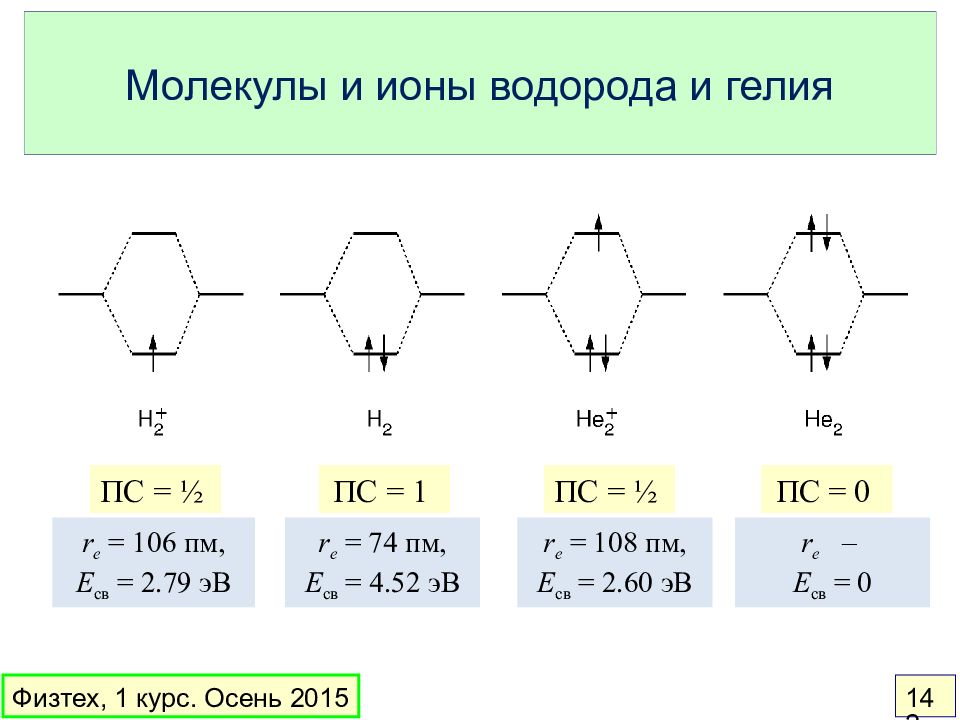
Слайд 142: Молекулы и ионы водорода и гелия
ПС = ½ ПС = 1 ПС = ½ ПС = 0 r e = 106 пм, E св = 2.79 эВ r e = 74 пм, E св = 4.52 эВ r e = 108 пм, E св = 2.60 эВ r e – E св = 0 Физтех, 1 курс. Осень 2015 142
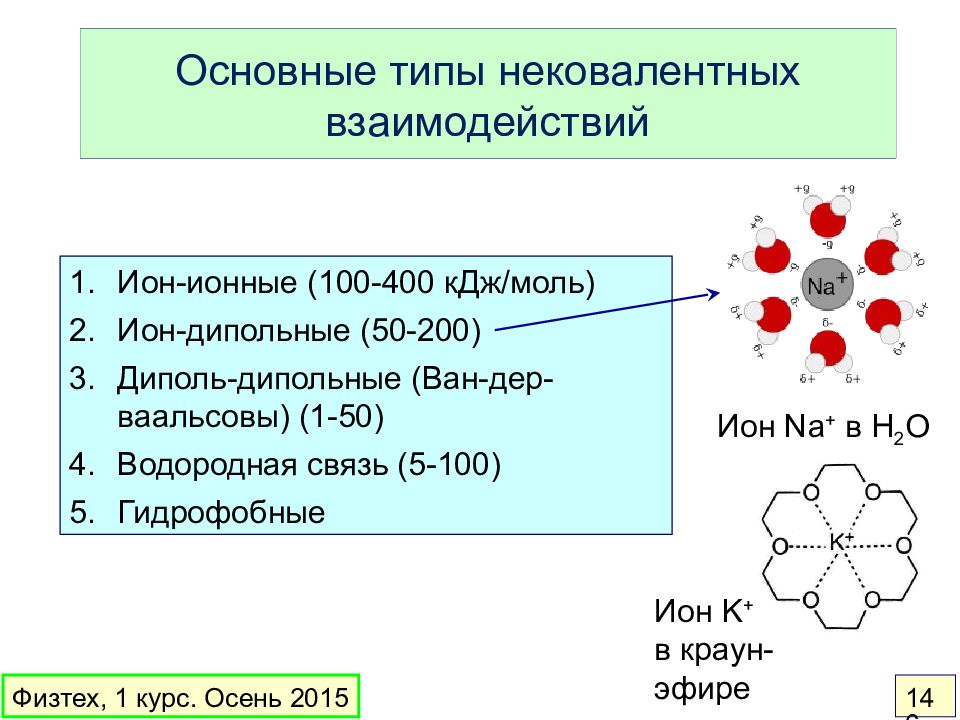
Слайд 146: Основные типы нековалентных взаимодействий
Ион-ионные (100-400 кДж / моль) Ион-дипольные (50-200) Диполь-дипольные (Ван-дер-ваальсовы) (1-50) Водородная связь (5-100) Гидрофобные Ион Na + в H 2 O Ион K + в краун-эфире Физтех, 1 курс. Осень 2015 146
Слайд 147: Ван-дер-ваальсовы межмолекулярные взаимодействия
Взаимодействие между диполями: Ориентационное – между полярными молекулами (диполь-дипольное, например HCl – HCl ) Индукционное – между полярной и неполярной молекулами (постоянный диполь – наведенный диполь, Br 2 – H 2 O ) Дисперсионное – между неполярными молекулами (наведенный диполь – наведенный диполь, Cl 2 – Cl 2 ) Физтех, 1 курс. Осень 2015 147
Слайд 148
В-д-в притяжение тем сильнее, чем больше: 1) полярность; 2) размер молекул. Пример: метан ( CH 4 ) – газ, гексан ( C 6 H 14 ) – жидкость Одна из самых слабых в-д-в связей – между молекулами H 2 ( т. пл. –259 о С, т. кип. –253 о С). Взаимодействие между молекулами во много раз слабее связи между атомами: E ков (Cl – Cl) = 244 кДж / моль, E вдв (Cl 2 – Cl 2 ) = 2 5 кДж / моль но именно оно обеспечивает существование жидкого и твердого состояния вещества Межмолекулярные взаимодействия слабы индивидуально, но сильны коллективно Ван-дер-ваальсовы межмолекулярные взаимодействия Физтех, 1 курс. Осень 2015 148
Слайд 149
Ориентационное – между полярными молекулами (диполь-диполь) Индукционное – между полярной и неполярной молекулами (постоянный диполь – наведенный диполь) Дисперсионное – между неполярными молекулами (наведенный диполь – наведенный диполь) Взаимодействие тем сильнее, чем больше: 1) полярность; 2) поляризуемость молекул. Пример: CH 4 – газ, C 6 H 14 – жидкость E ков. (Cl-Cl) = 244 кДж / моль E вдв. (Cl 2 -Cl 2 ) = 2 5 кДж / моль Ван-дер-ваальсовы взаимодействия Физтех, 1 курс. Осень 2015 149
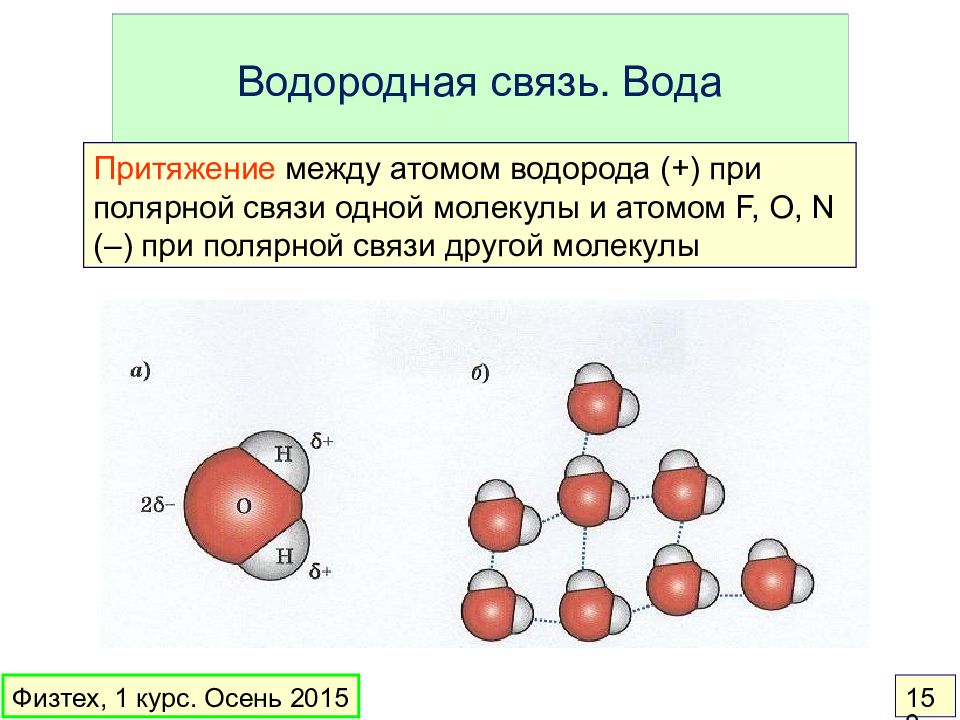
Слайд 150: Водородная связь. Вода
Притяжение между атомом водорода (+) при полярной связи одной молекулы и атомом F, O, N (–) при полярной связи другой молекулы Физтех, 1 курс. Осень 2015 150
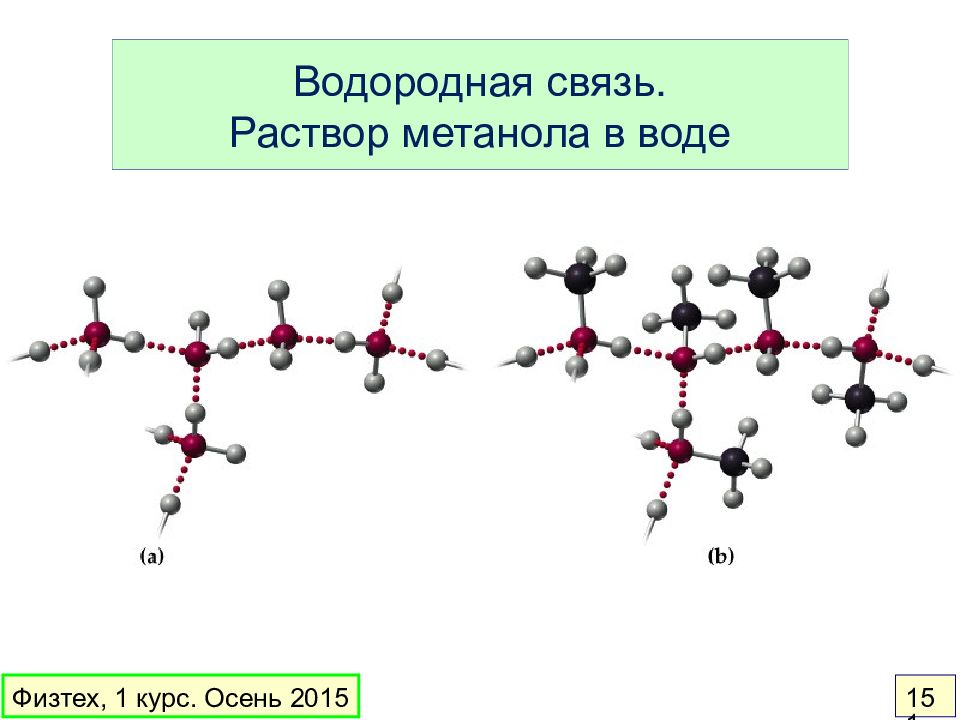
Слайд 151: Водородная связь. Раствор метанола в воде
Физтех, 1 курс. Осень 2015 151
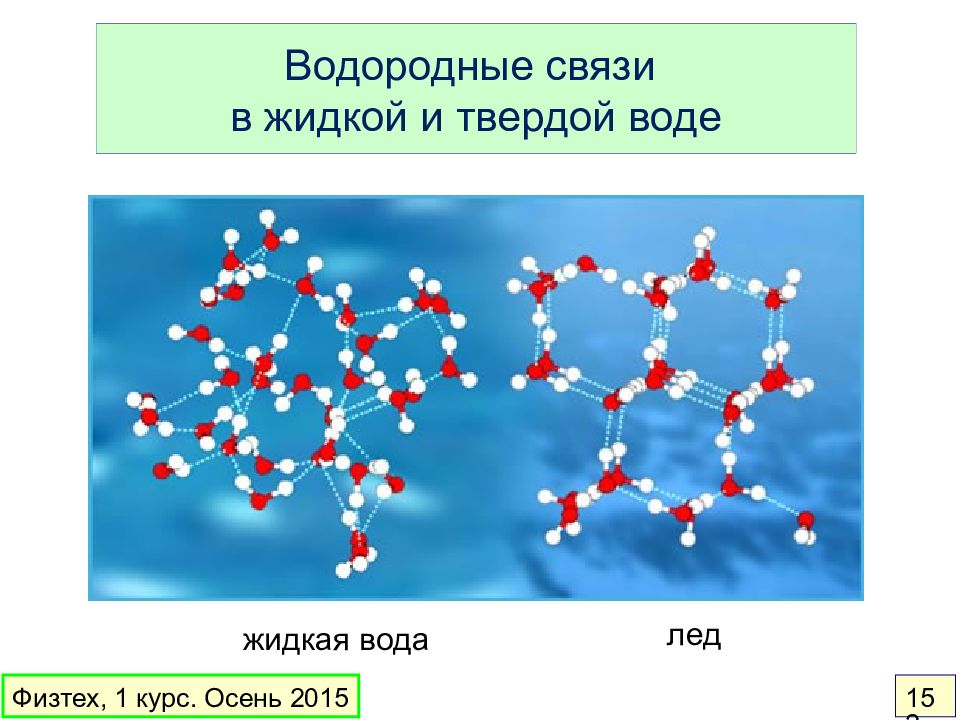
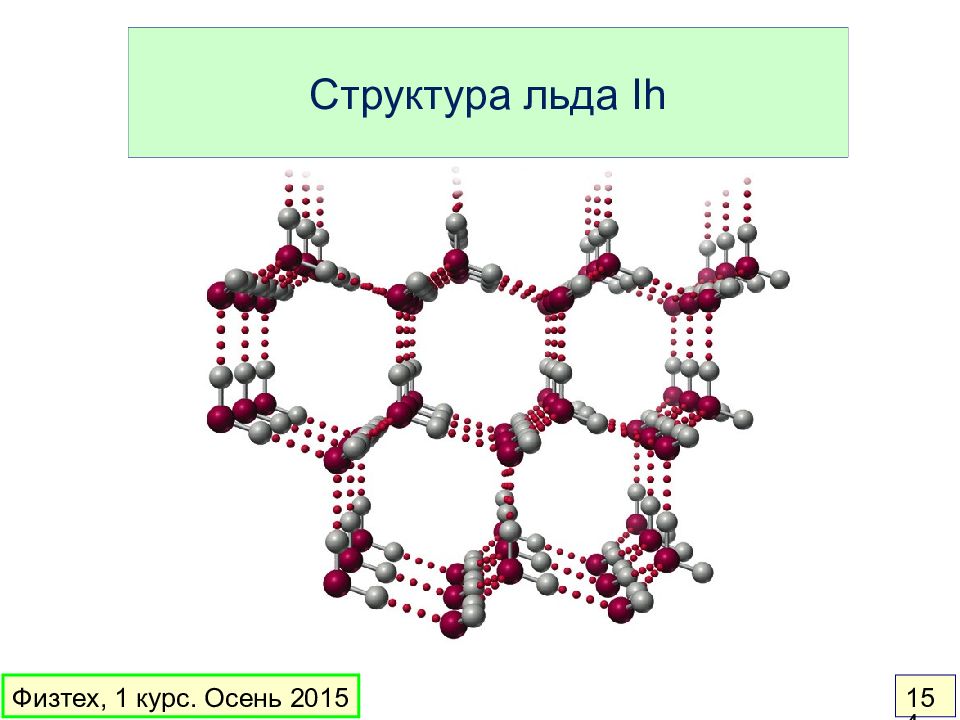
Слайд 152: Водородные связи в жидкой и твердой воде
жидкая вода лед Физтех, 1 курс. Осень 2015 152
Слайд 153: Ложные слухи о воде
Утверждения о том, что вода якобы «запоминает» то, что с ней делали – нагревали или замораживали, «омагничивали» или «диспергировали», - основаны на плохих опытах и не имеют отношения к науке. Равно как и сообщения о «живой» и «мертвой» воде, получаемой посредством электролиза. К выдумкам относятся и особые свойства талой воды или воды, «термически активированной» (М.В. Волькенштейн, «Биофизика») Физтех, 1 курс. Осень 2015 153
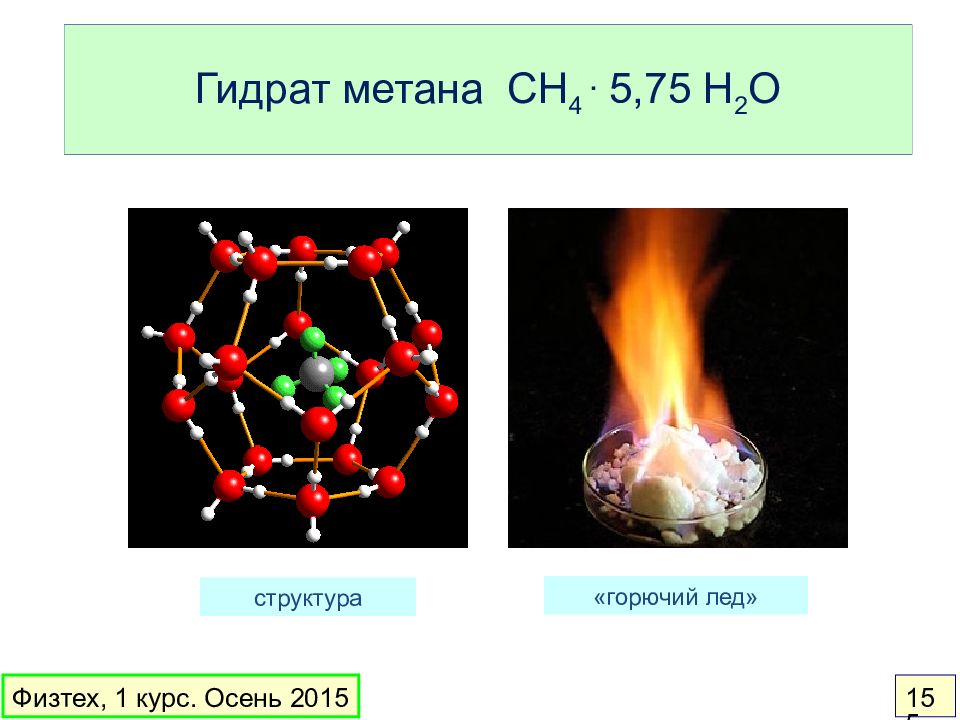
Слайд 155: Гидрат метана CH 4. 5,75 H 2 O
структура «горючий лед» Физтех, 1 курс. Осень 2015 155
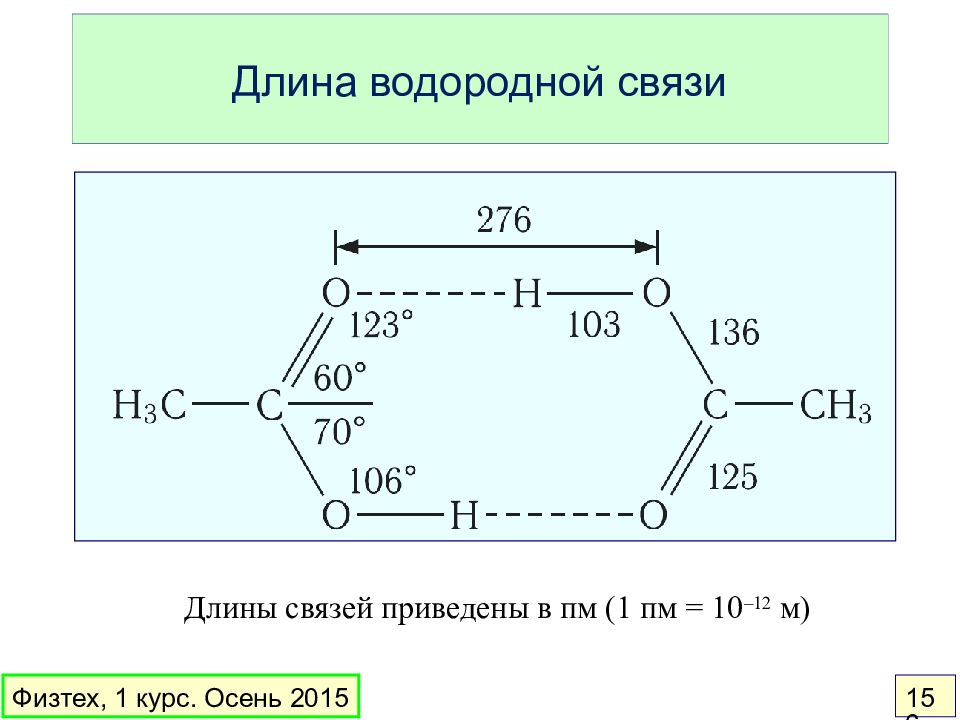
Слайд 156: Длина водородной связи
Длины связей приведены в пм (1 пм = 10 –12 м) Физтех, 1 курс. Осень 2015 156
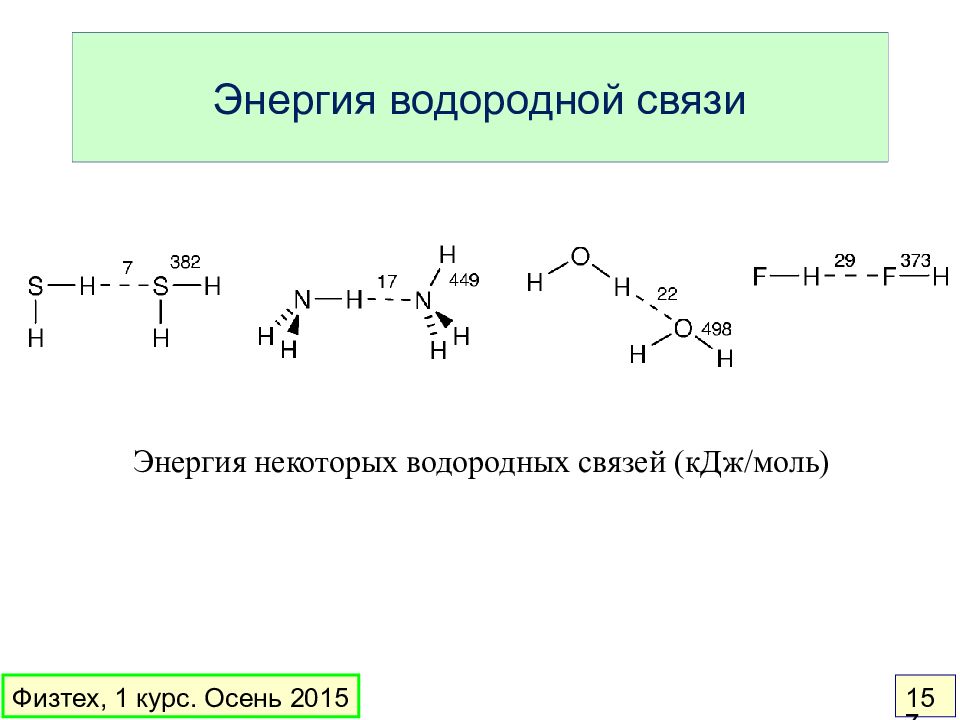
Слайд 157: Энергия водородной связи
Энергия некоторых водородных связей ( кДж / моль) Физтех, 1 курс. Осень 2015 157
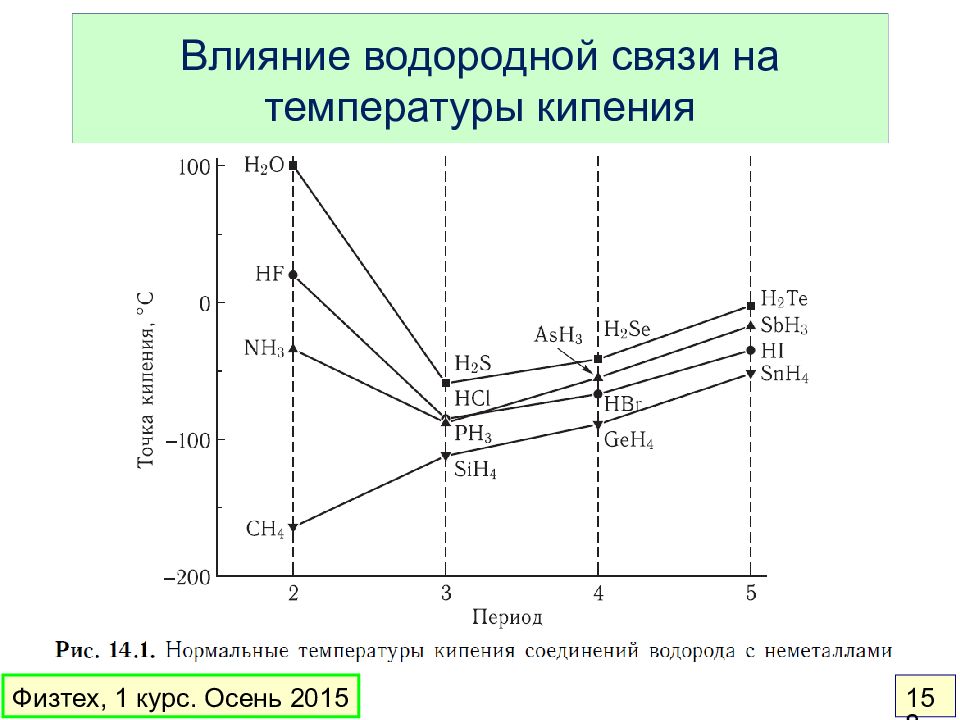
Слайд 158: Влияние водородной связи на температуры кипения
Физтех, 1 курс. Осень 2015 158
Слайд 159: Коротко о главном
Благодаря разной массе ядер и электронов возможно разделить электронное и ядерное движения в молекулах. Электронная энергия молекулы – функция межъядерных расстояний. В связанных электронных состояниях эта функция имеет минимум. В теории молекулярных орбиталей (МО) одноэлектронная волновая функция составляется как линейная комбинация атомных орбиталей (АО). Все молекулы способны взаимодействовать между собой. Межмолекулярные взаимодействия обеспечивают устойчивость веществ в конденсированном (жидком и твердом) состоянии. Энергия этих взаимодействий на порядок меньше энергии ковалентной связи – они слабы индивидуально, но сильны коллективно. Длина межмолекулярных связей в несколько раз больше длины ковалентных связей. Основные виды межмолекулярных взаимодействий – водородная связь и диполь-дипольное ( ван-дер-ваальсово ) взаимодействие. Физтех, 1 курс. Осень 2015 159
Слайд 160: Основные понятия
Адиабатическое приближение Электронное состояние молекулы. Потенциальная кривая (поверхность потенциальной энергии – ППЭ) Гибридизация орбиталей. Сигма- и пи-связи Молекулярные орбитали - связывающие - разрыхляющие - несвязывающие Порядок связи Межмолекулярные взаимодействия: - водородная связь - ван-дер-ваальсово (дипольное) взаимодействие Энергия связи. Длина связи Физтех, 1 курс. Осень 2015 160
Слайд 161: Типичные задачи
В рамках теории МО изобразите электронную конфигурацию основного состояния молекулы H 2 ( N 2, O 2 ) или иона H 2 + (H 2 -, He 2 +, O 2 2+ ). Определите порядок связи между атомами. На графике (например, слайд 6) изображены потенциальные кривые нескольких электронных состояний двухатомной молекулы. 1) Укажите связанные и несвязанные состояния. 2) Определите, каким электронным состояниям атомов соответствуют эти кривые. 3) Оцените длину и энергию связи в основном состоянии. Теплота плавления льда равна 6 кДж / моль, а теплота испарения воды – 44 кДж / моль. Определите среднюю энергию водородной связи в твердой H 2 O (в кДж/моль), если известно, что каждая молекула в кристалле льда участвует в 4 водородных связях, а в газовой фазе молекулы друг с другом не взаимодействуют. Физтех, 1 курс. Осень 2015 161
Слайд 162: Литература
Еремин, Борщевский. Общая и неорганическая химия. – Глава 13, § 13.5; глава 14. Шрайвер, Эткинс. Неорганическая химия. – Том 1, глава 3, §§ 3.4-3.10. Глинка. Общая химия. – Глава 4. Еремин. Теоретическая и математическая химия. – Глава 2. § 5. Физтех, 1 курс. Осень 2015 162
Слайд 164: План лекции
Кристаллы, их классификация по типу связи. Элементарная ячейка кристаллической решетки. Атомные и молекулярные кристаллы. Плотнейшие шаровые упаковки. Основные типы кристаллических решеток металлов. Ионные соединения. Важнейшие типы кристаллических решеток ионных соединений. Ионные радиусы и их определение. Энергия кристаллической решетки. Цикл Борна-Габера. Физтех, 1 курс. Осень 2015 164
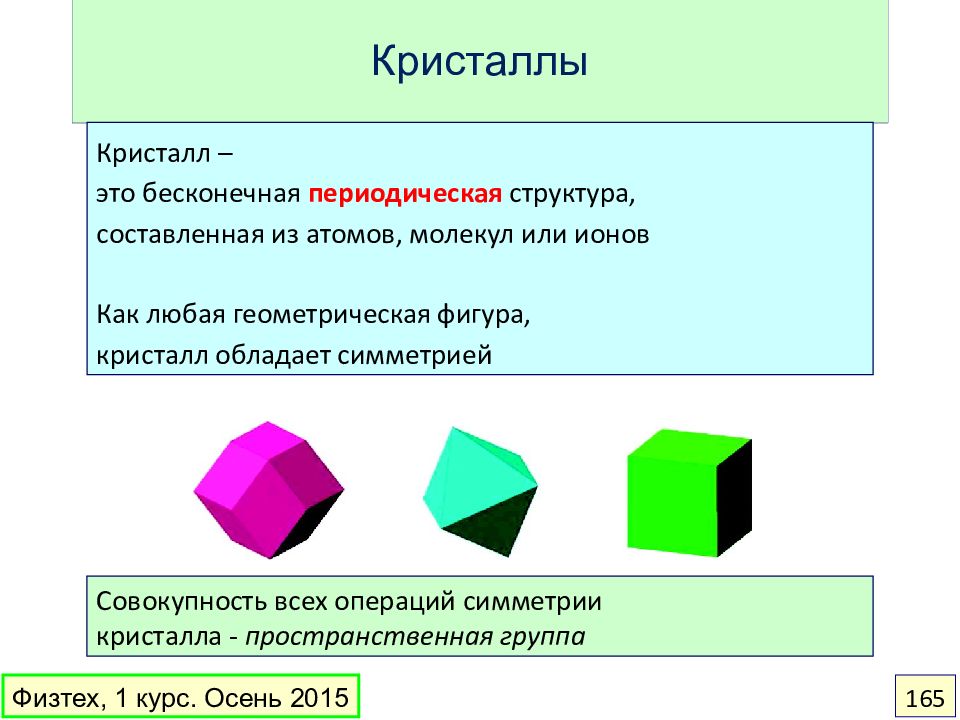
Слайд 165: Кристаллы
Кристалл – это бесконечная периодическая структура, составленная из атомов, молекул или ионов Как любая геометрическая фигура, кристалл обладает симметрией Совокупность всех операций симметрии кристалла - пространственная группа Физтех, 1 курс. Осень 2015 165
Слайд 166: Древние кристаллы (музей естествознания, Оксфорд)
Кварц (1.1 млрд. лет) Fe-Ni ( 4. 5 млрд. лет) Физтех, 1 курс. Осень 2015 166
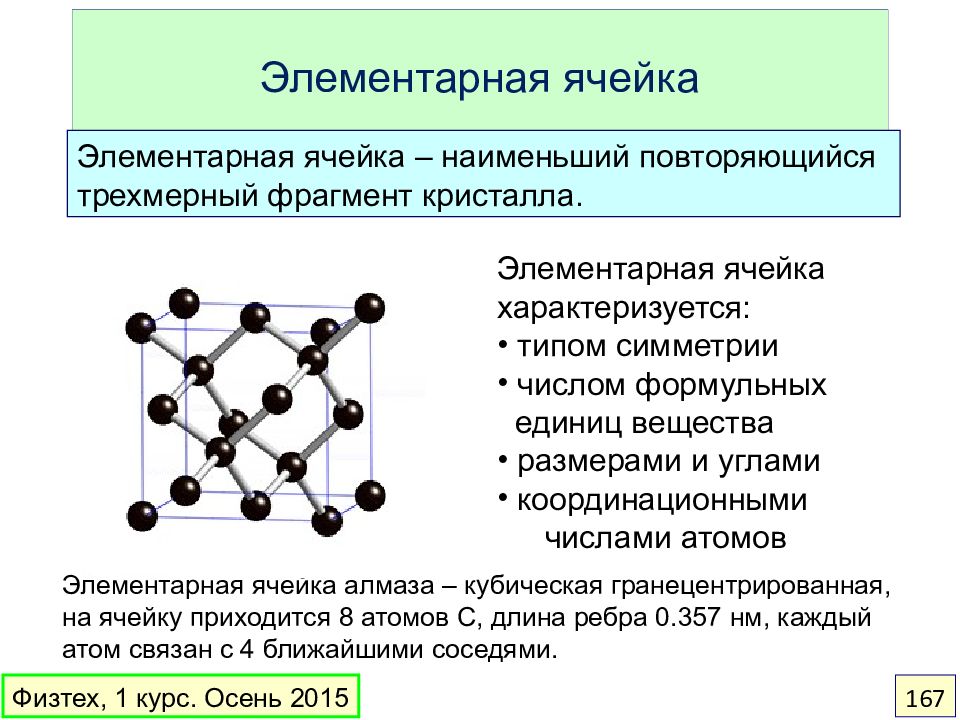
Слайд 167: Элементарная ячейка
Элементарная ячейка алмаза – кубическая гранецентрированная, на ячейку приходится 8 атомов C, длина ребра 0.357 нм, каждый атом связан с 4 ближайшими соседями. Элементарная ячейка характеризуется: типом симметрии числом формульных единиц вещества размерами и углами координационными числами атомов Элементарная ячейка – наименьший повторяющийся трехмерный фрагмент кристалла. Физтех, 1 курс. Осень 2015 167
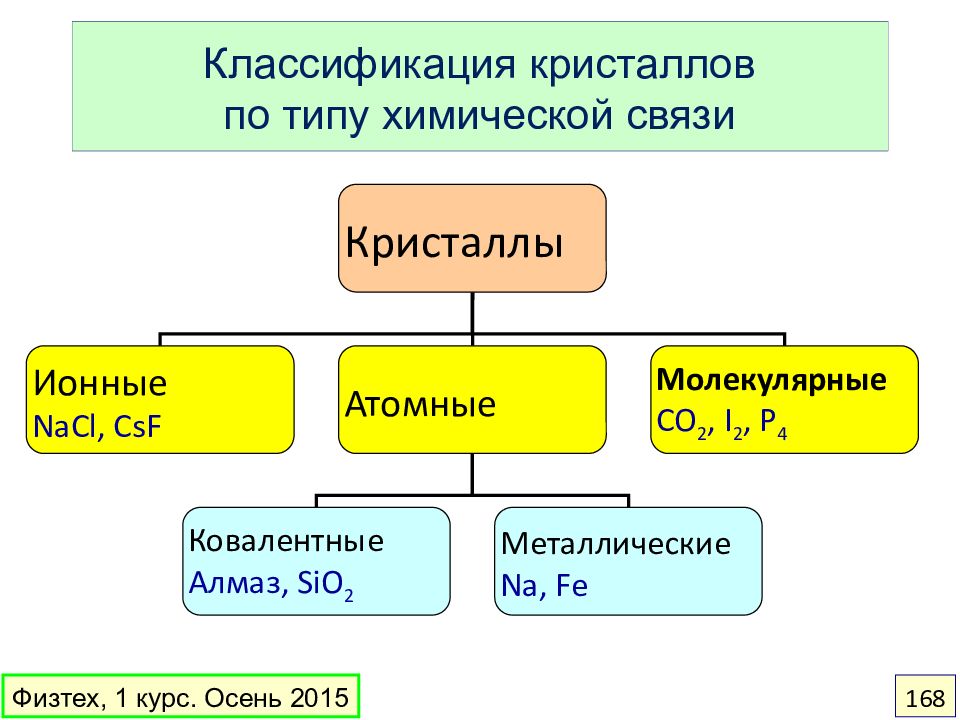
Слайд 168: Классификация кристаллов по типу химической связи
Кристаллы Ионные NaCl, CsF Атомные Молекулярные CO 2, I 2, P 4 Ковалентные Алмаз, SiO 2 Металлические Na, Fe Физтех, 1 курс. Осень 2015 168
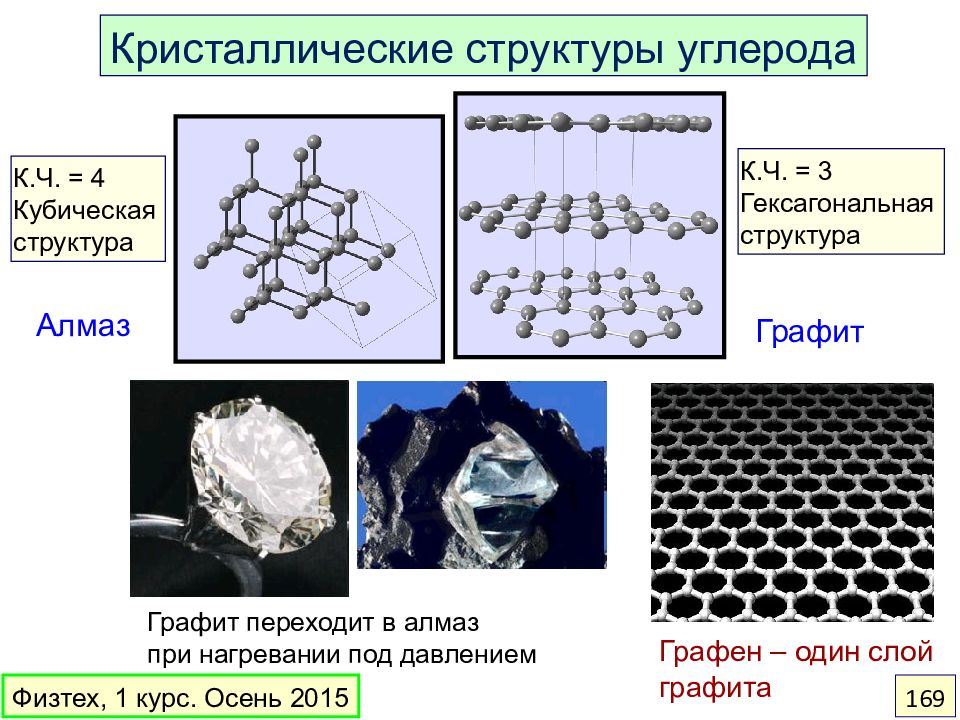
Слайд 169
Кристаллические структуры углерода Алмаз Графит Графит переходит в алмаз при нагревании под давлением К.Ч. = 4 Кубическая структура К.Ч. = 3 Гексагональная структура Графен – один слой графита Физтех, 1 курс. Осень 2015 169
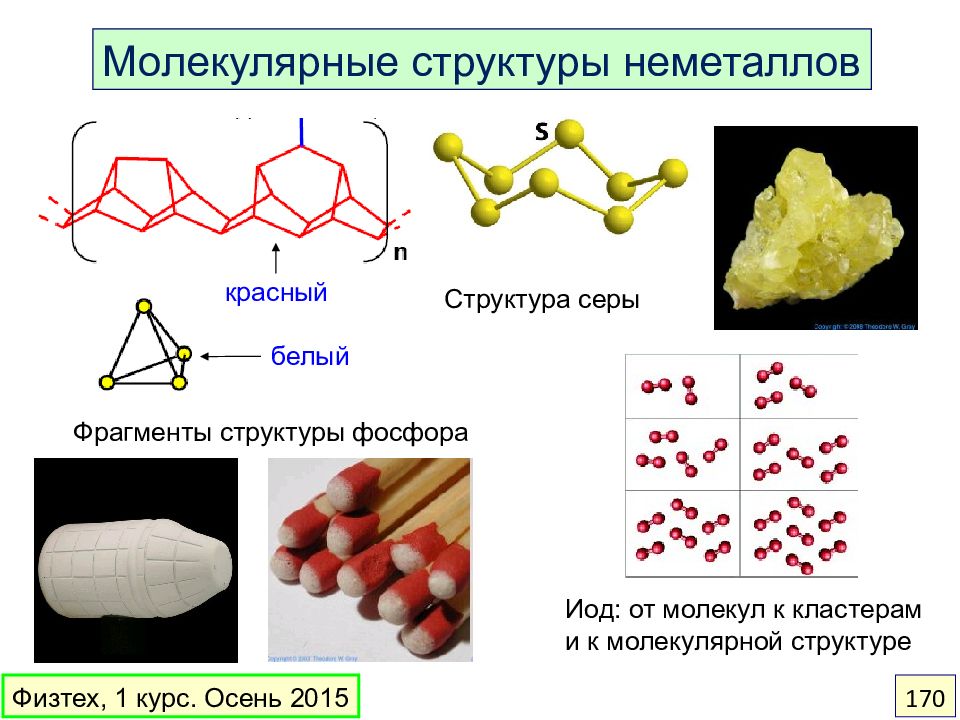
Слайд 170
Фрагменты структуры фосфора белый красный Структура серы Молекулярные структуры неметаллов Иод: от молекул к кластерам и к молекулярной структуре Физтех, 1 курс. Осень 2015 170
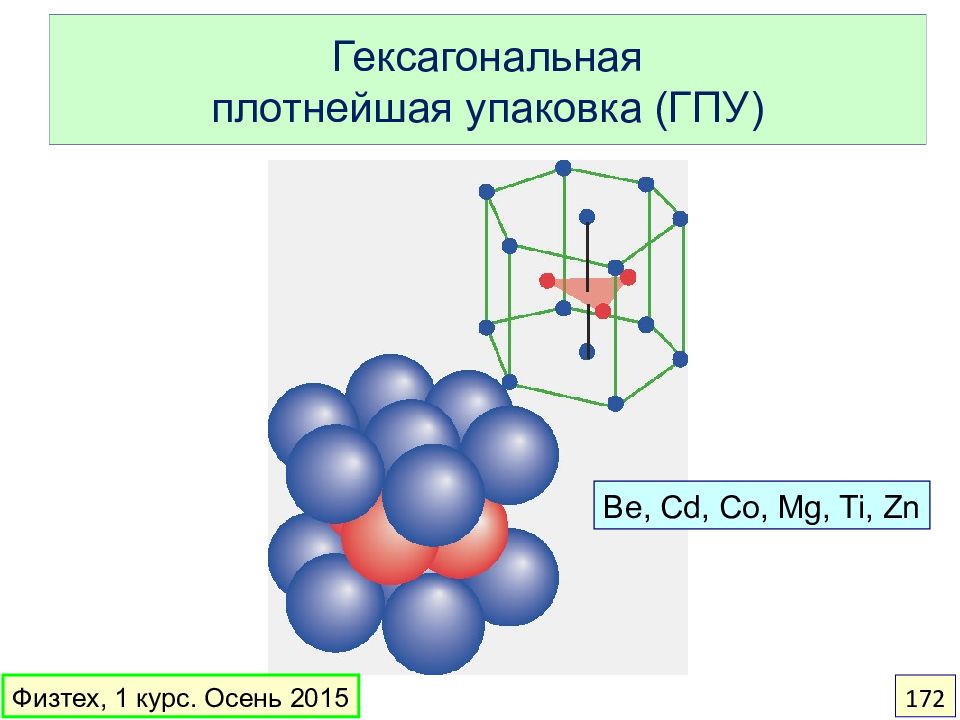
Слайд 172: Гексагональная плотнейшая упаковка (ГПУ)
Be, Cd, Co, Mg, Ti, Zn Физтех, 1 курс. Осень 2015 172
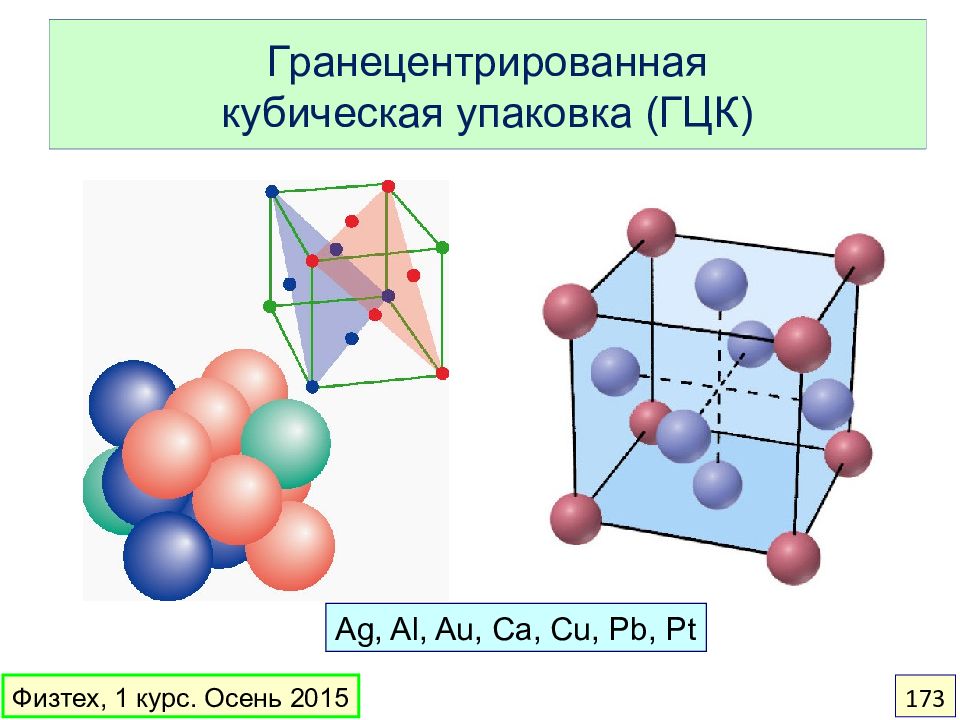
Слайд 173: Гранецентрированная кубическая упаковка (ГЦК)
Ag, Al, Au, Ca, Cu, Pb, Pt Физтех, 1 курс. Осень 2015 173
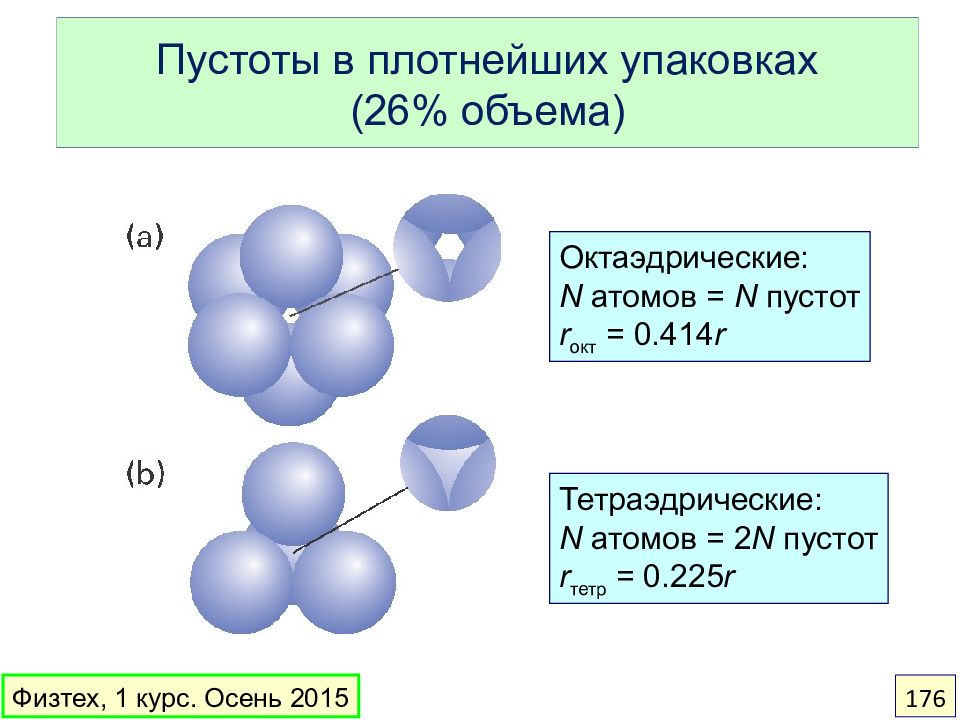
Слайд 176: Пустоты в плотнейших упаковках (26% объема)
Октаэдрические: N атомов = N пустот r окт = 0. 414 r Тетраэдрические: N атомов = 2 N пустот r тетр = 0. 225 r Физтех, 1 курс. Осень 2015 176
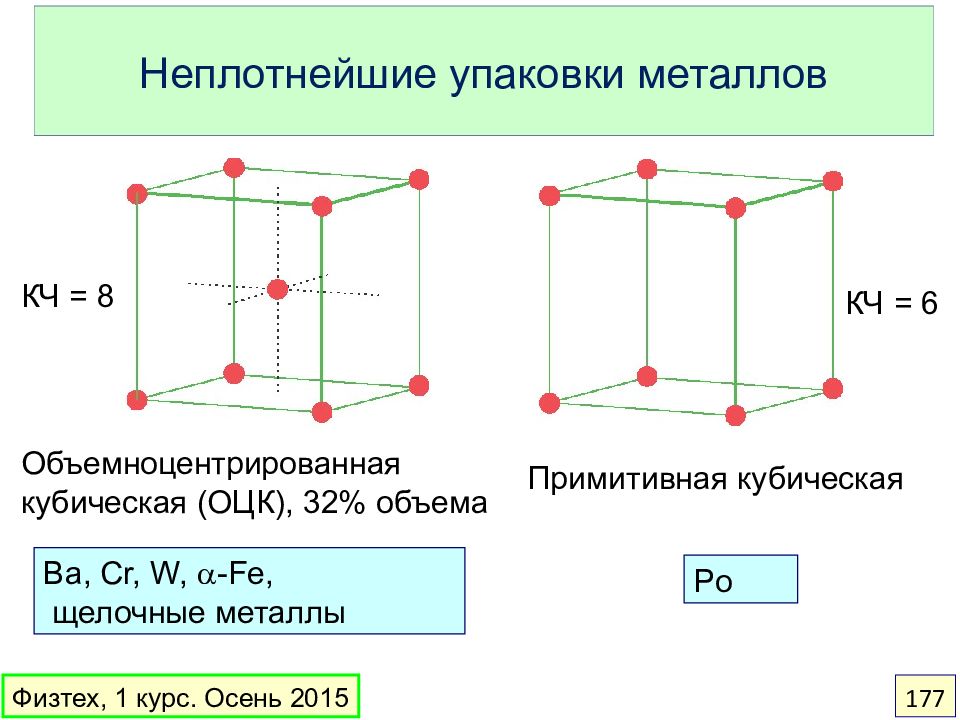
Слайд 177: Неплотнейшие упаковки металлов
Ba, Cr, W, a -Fe, щелочные металлы Объемноцентрированная кубическая (ОЦК), 32% объема КЧ = 8 КЧ = 6 Примитивная кубическая Po Физтех, 1 курс. Осень 2015 177
Слайд 178: Полиморфизм металлов
Железо a - Fe: ОЦК, t < 906 o C, t > 1401 o C g - Fe: ГЦК, 906 o C < t < 1401 o C b - Fe: ГПУ высокое давление Олово b - Sn: t > 14 o C r = 7.31 г / см 3 a - Sn: t < 14 o C r = 5.75 г / см 3 Способность образовывать разные кристаллические формы при различных условиях ( p, T ) Физтех, 1 курс. Осень 2015 178
Слайд 179: Ионные кристаллы
Структура состоит из противоположно заряженных ионов, соединенных ионной связью Ионы считаются твердыми шарами Ионы расположены так, что общая энергия - минимальна Положительные ионы занимают пустоты в решетке, образованной отрицательными ионами Высокие температуры плавления Низкая электропроводность в твердом состоянии Высокая электропроводность в расплаве Физтех, 1 курс. Осень 2015 179
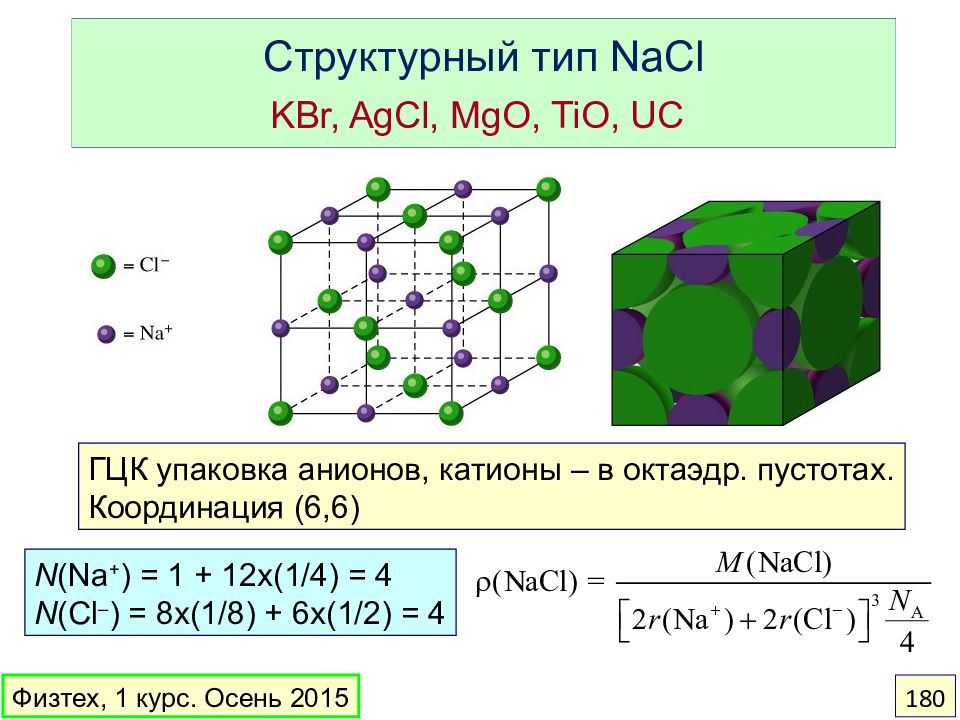
Слайд 180: Структурный тип NaCl KBr, AgCl, MgO, TiO, UC
ГЦК упаковка анионов, катионы – в октаэдр. пустотах. Координация (6,6) N (Na + ) = 1 + 12x(1/4) = 4 N (Cl – ) = 8x(1/8) + 6x(1/2) = 4 Физтех, 1 курс. Осень 2015 180
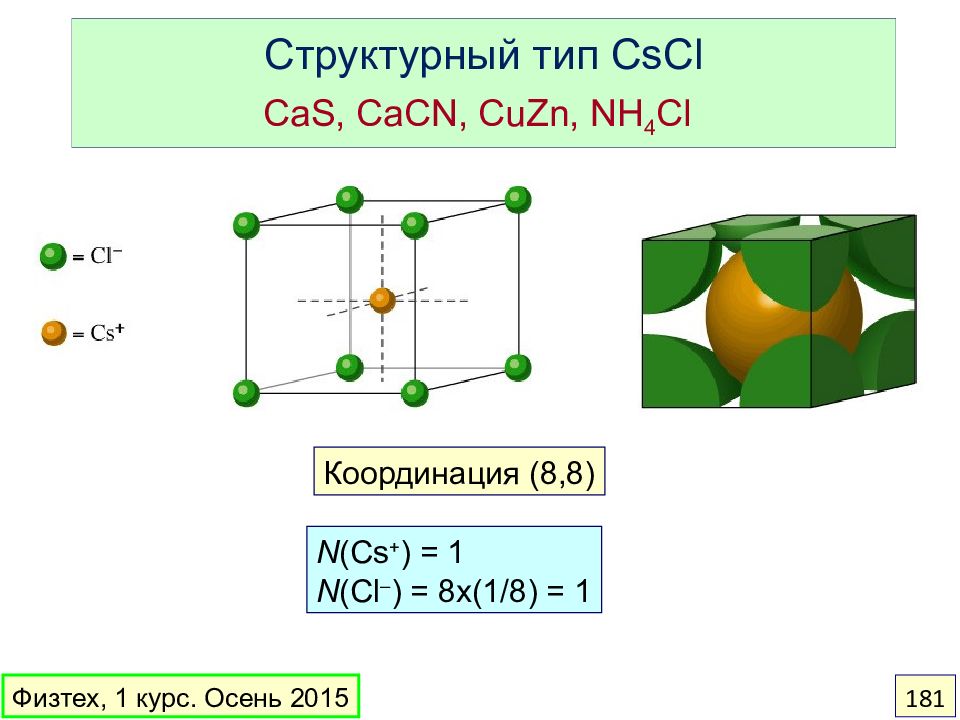
Слайд 181: Структурный тип CsCl CaS, CaCN, CuZn, NH 4 Cl
Координация ( 8, 8 ) N (Cs + ) = 1 N (Cl – ) = 8x(1/8) = 1 Физтех, 1 курс. Осень 2015 181
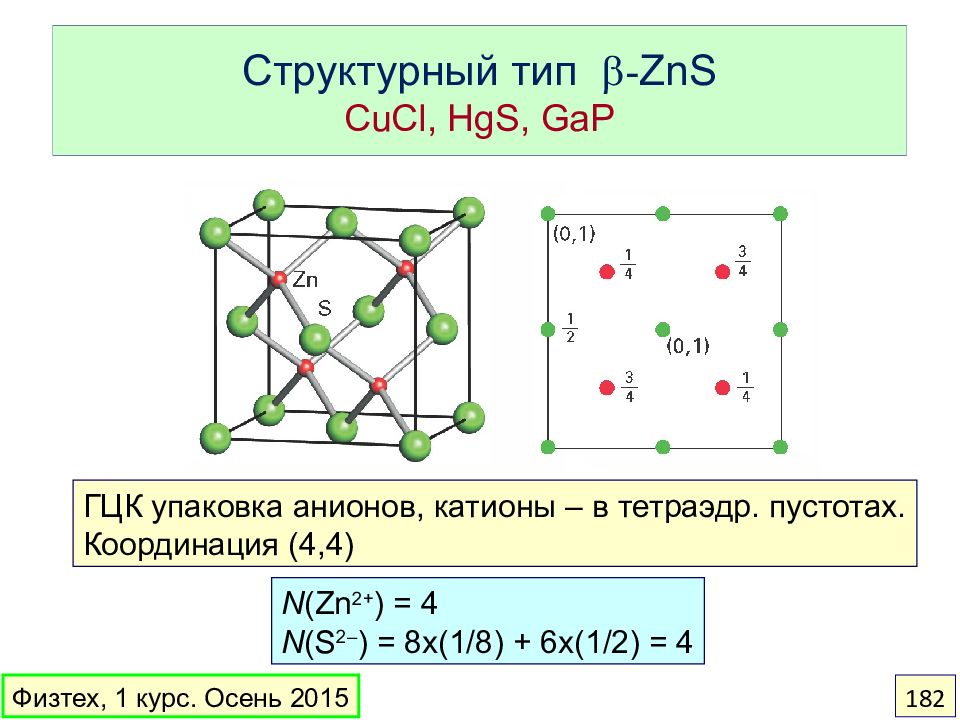
Слайд 182: Структурный тип - ZnS CuCl, HgS, GaP
N (Zn 2+ ) = 4 N (S 2– ) = 8x(1/8) + 6x(1/2) = 4 ГЦК упаковка анионов, катионы – в тетраэдр. пустотах. Координация ( 4,4) Физтех, 1 курс. Осень 2015 182
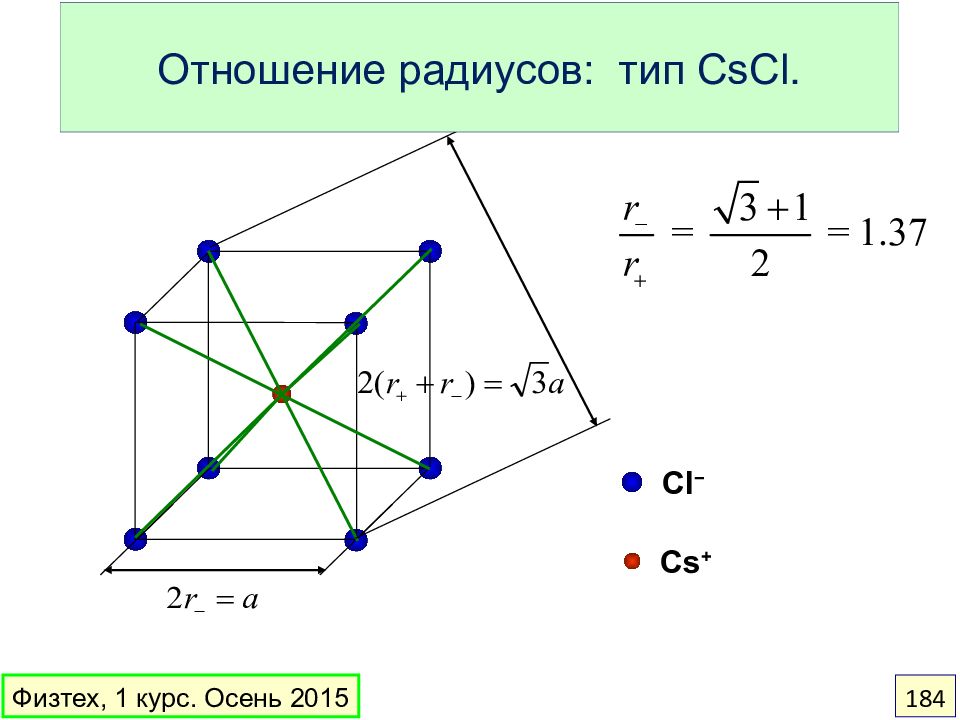
Слайд 184: Отношение радиусов : тип CsCl
Cl − Cs + Отношение радиусов : тип CsCl. Физтех, 1 курс. Осень 2015 184
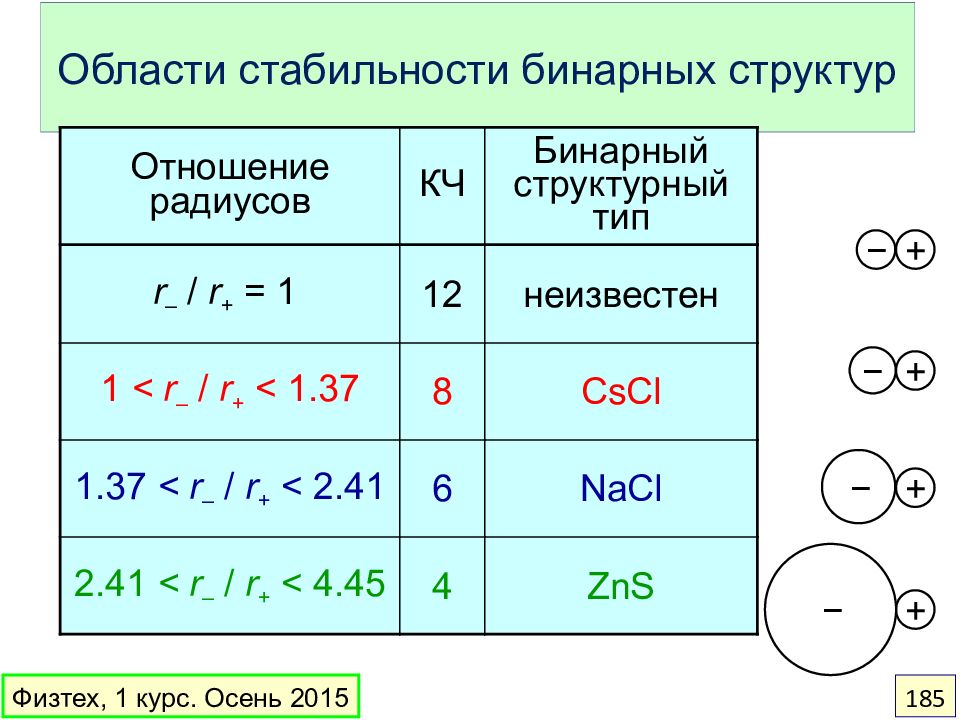
Слайд 185: Области стабильности бинарных структур
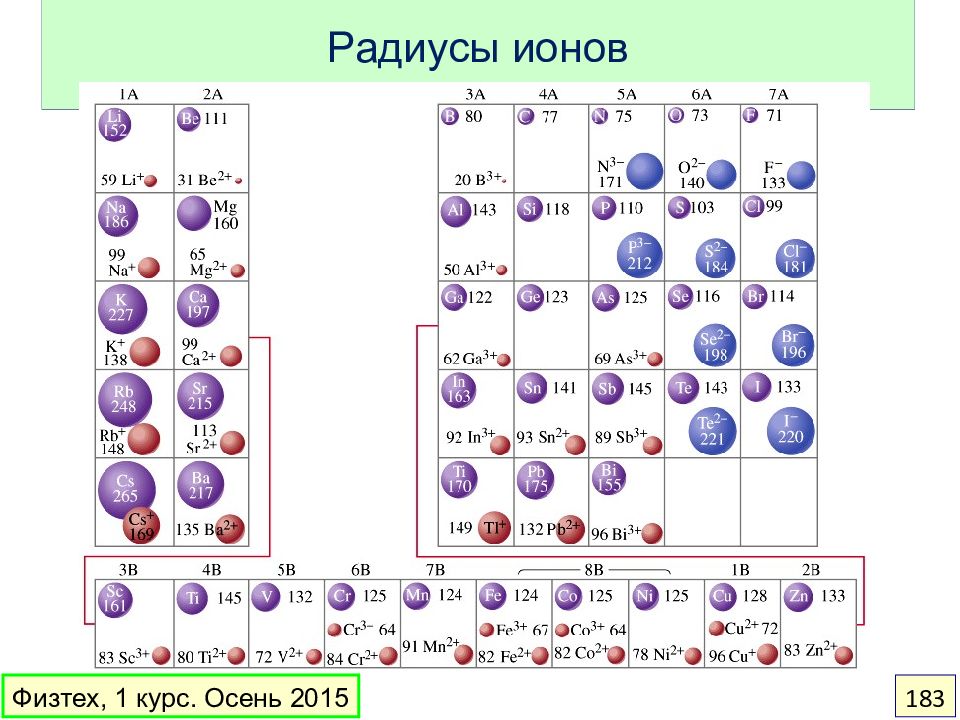
Отношение радиусов КЧ Бинарный структурный тип r – / r + = 1 12 неизвестен 1 < r – / r + < 1.37 8 CsCl 1.37 < r – / r + < 2.41 6 NaCl 2.41 < r – / r + < 4.45 4 ZnS − + − + − + − + Физтех, 1 курс. Осень 2015 185
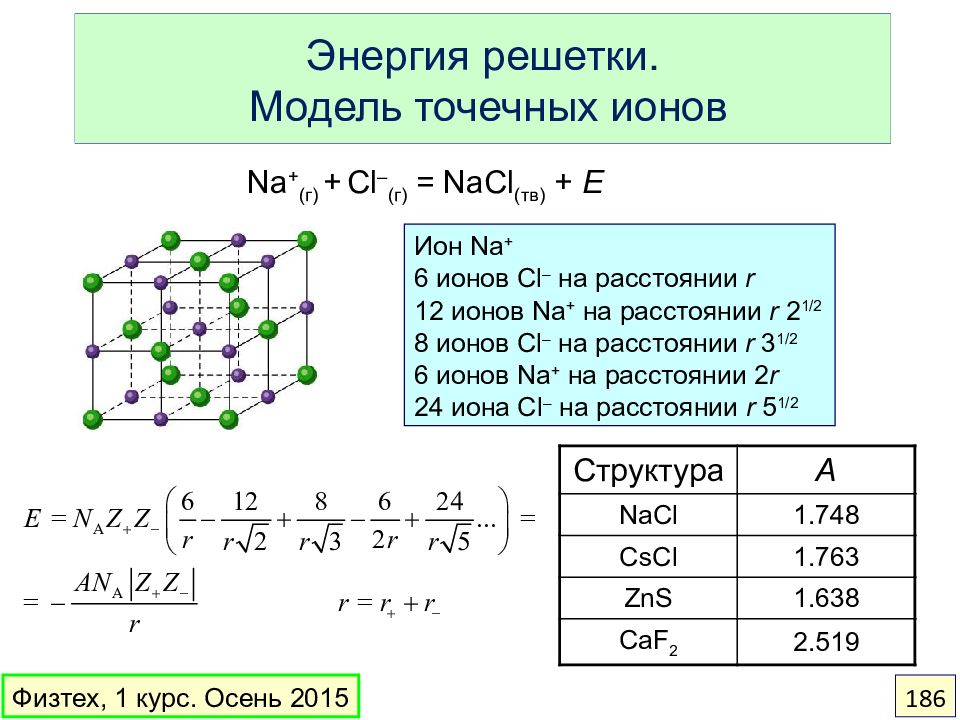
Слайд 186: Энергия решетки. Модель точечных ионов
Ион Na + 6 ионов Cl – на расстоянии r 12 ионов Na + на расстоянии r 2 1/2 8 ионов Cl – на расстоянии r 3 1/2 6 ионов Na + на расстоянии 2 r 24 иона Cl – на расстоянии r 5 1/2 Na + (г) + Cl – (г) = NaCl (тв) + E Структура A NaCl 1.748 CsCl 1.763 ZnS 1.638 CaF 2 2.519 Физтех, 1 курс. Осень 2015 186
Слайд 187: Цикл Борна-Габера
KCl (тв) = K + (г) + Cl – (г) D H L Физтех, 1 курс. Осень 2015 187
Слайд 188: Влияние размеров ионов на растворимость в воде
Соли с ионами близкого размера, как правило, хуже растворимы в воде, чем те, у которых размеры ионов сильно различаются MX (тв) = M + ( aq ) + X – ( aq ) D H ~ D H L + D hydr H Mg(OH) 2 < Ca(OH) 2 < Sr(OH) 2 < Ba(OH) 2 MgSO 4 > CaSO 4 > SrSO 4 > BaSO 4 Физтех, 1 курс. Осень 2015 188
Слайд 189
Большинство твердых веществ находится в кристаллическом состоянии. Кристалл – структура с пространственной периодичностью. В основе структуры кристалла – элементарная ячейка. В простейшей модели кристалла атомы или ионы представляют собой твердые сферы. Основные типы шаровых упаковок металлов – ГПУ (КЧ=12), ГЦК (КЧ=12), ОЦК (КЧ=8). Первые две относятся к плотнейшим упаковкам. В ионной модели твердое вещество представляется совокупностью противоположно заряженных сфер. Ионные кристаллы можно рассматривать как совокупность противоположно заряженных шаров. Катионы в них занимают пустоты в упаковках, образованных анионами. Соотношение радиусов ионов определяет тип решетки. Энергия кристаллической решетки – это разность между энергиями кристалла и изолированных газообразных ионов. Она определяется зарядами и радиусами ионов, а также типом решетки. Энергия решетки определяет физико-химические свойства кристаллов – их устойчивость к нагреванию и растворимость в воде. Ее можно экспериментально измерить, используя цикл Борна-Габера. Коротко о главном Физтех, 1 курс. Осень 2015 189
Слайд 190: Основные понятия
Кристалл Элементарная ячейка Координационное число атома (иона) Шаровые упаковки (плотнейшие), пустоты Структуры ГПУ, ГЦК, ОЦК Ионные кристаллы, катионы, анионы Радиус иона Структурный тип NaCl Энергия кристаллической решетки Цикл Борна-Габера Физтех, 1 курс. Осень 2015 190
Слайд 191: Типовые задачи
Рассчитайте долю свободного пространства в объемно-центрированной решетке. Рассчитайте число атомов в элементарной ячейке: ГПУ, ГЦК, ОЦК. По плотности металла и типу кристаллической решетки рассчитайте длину ребра ячейки и металлический радиус атома. Пример: Fe – ОЦК, = 7.87 г/см 3. Рассчитайте энергию кристаллической решетки бромида магния, используя следующие данные: Физтех, 1 курс. Осень 2015 191 Стадия Δ H , кДж / моль Сублимация Mg( тв. ) 148 Ионизация Mg (г.) до Mg 2+ (г.) 2187 Испарение Br 2 ( ж. ) 31 Диссоциация Br 2 ( г. ) 193 Присоединение электрона к Br (г.) 331 Образование MgBr 2 ( тв. ) 524
Последний слайд презентации: Лекция 1 Основные понятия и законы химии Еремин Вадим Владимирович, Химический: Литература
Еремин, Борщевский. Общая и неорганическая химия. – Главы 15, 16. Шрайвер, Эткинс. Неорганическая химия. – Т. 1, глава 2 (проще всего и ближе всего к материалу лекции). Глинка. Общая химия. – Глава 5, § 5.1. Физтех, 1 курс. Осень 2015 192