Первый слайд презентации
1 Лекция 1-2 «Основные характеристики атома. Электроотрицательность. Шкала Полинга. Закономерности изменения химических свойств элементов в ПСЭ.»
Слайд 5
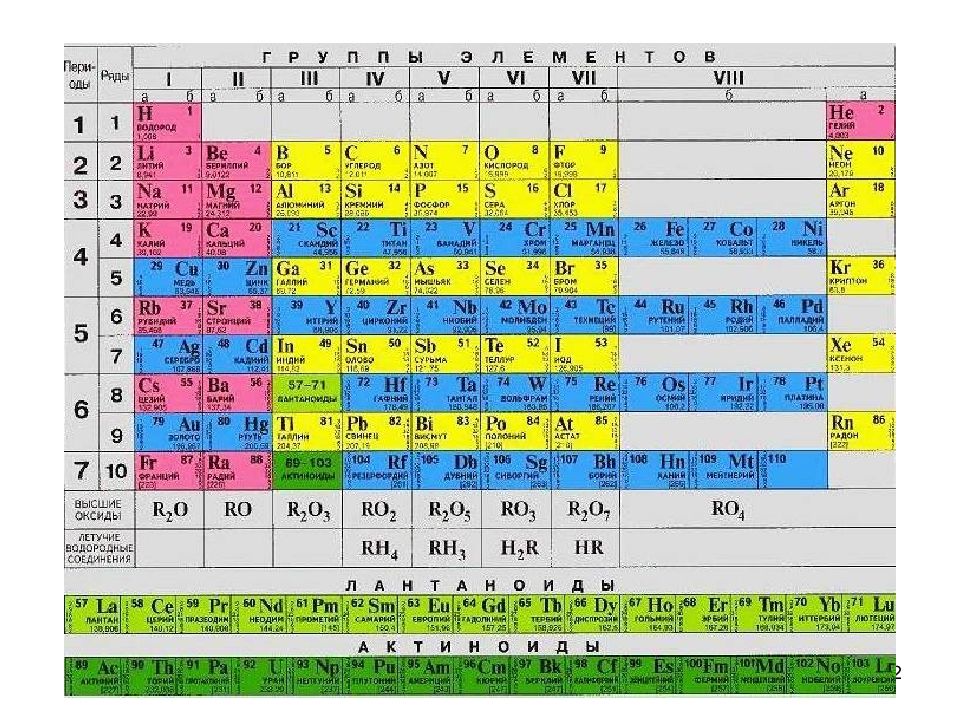
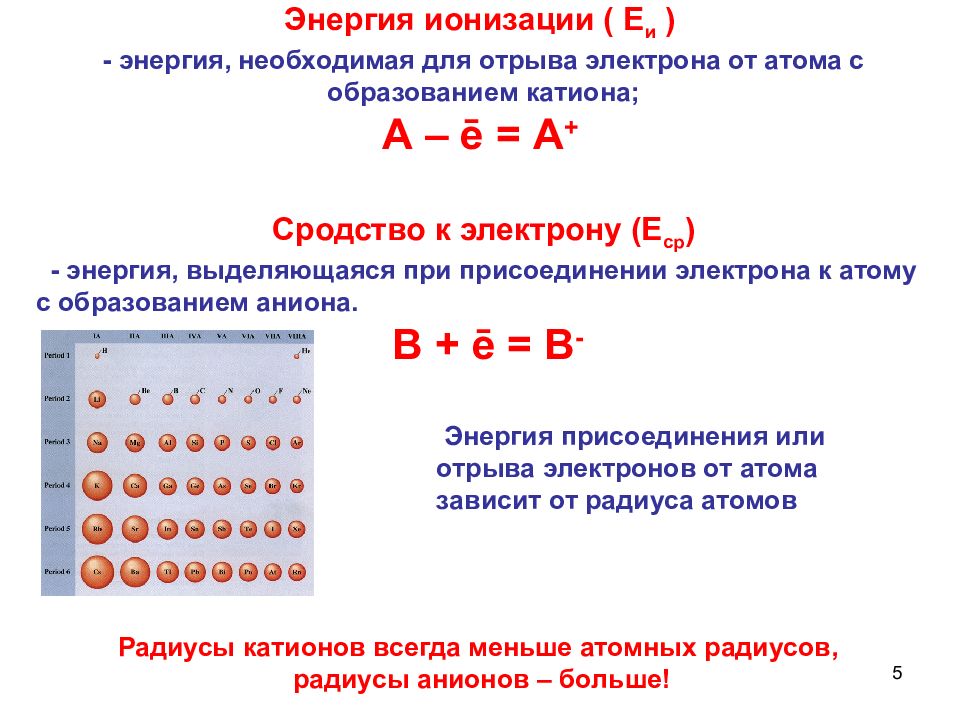
5 Энергия присоединения или отрыва электронов от атома зависит от радиуса атомов Энергия ионизации ( Е и ) - энергия, необходимая для отрыва электрона от атома с образованием катиона; А – ē = А + Сродство к электрону (Е ср ) - энергия, выделяющаяся при присоединении электрона к атому с образованием аниона. В + ē = В - Радиусы катионов всегда меньше атомных радиусов, радиусы анионов – больше!
Слайд 6
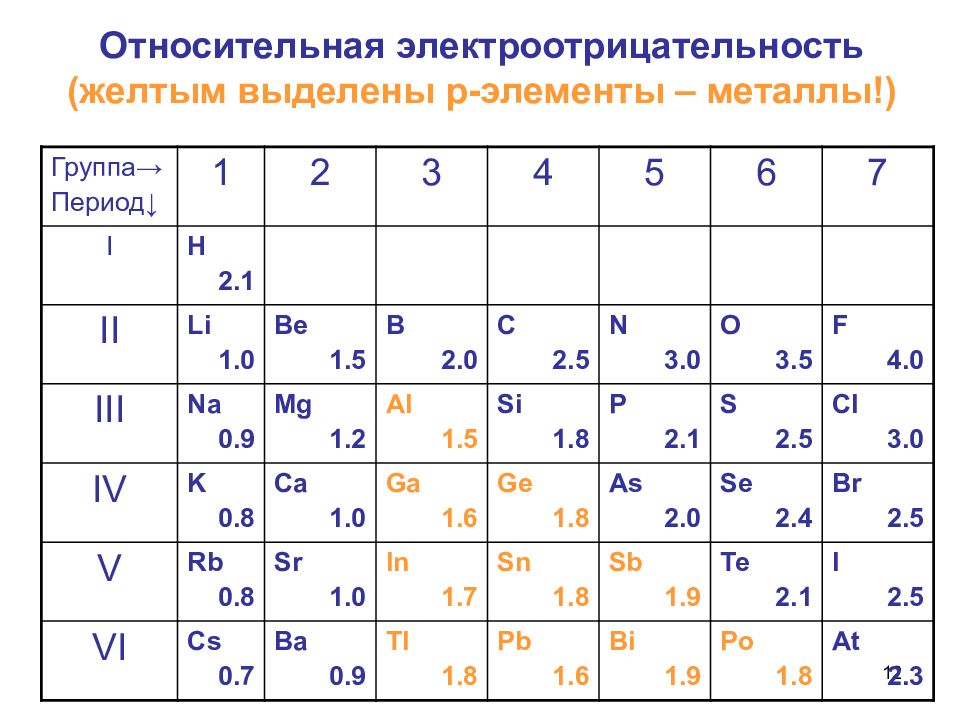
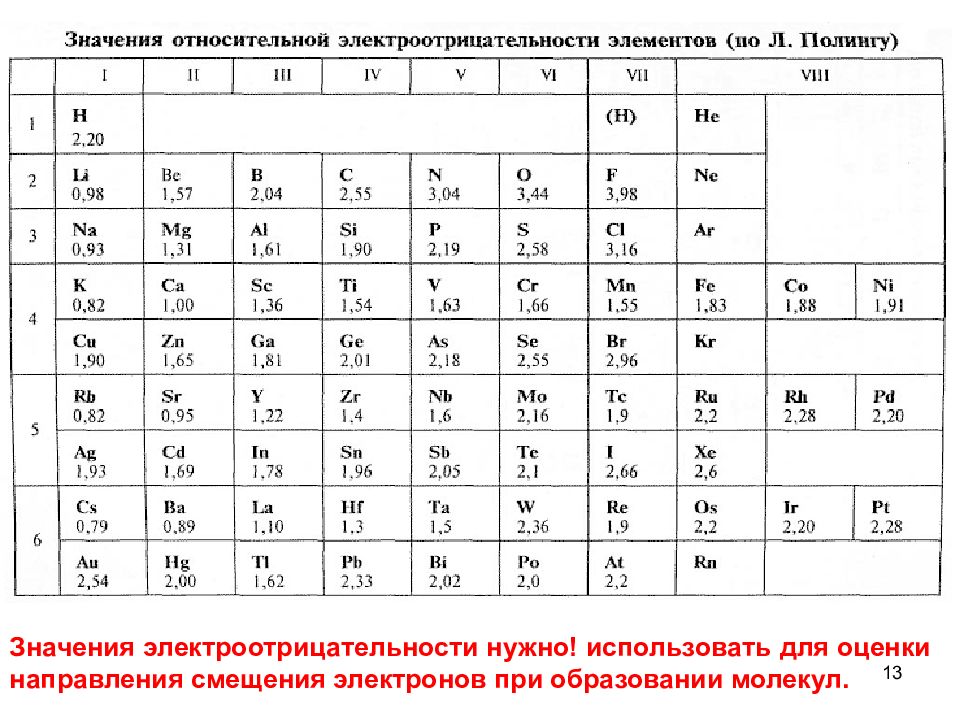
6 Относительная электроотрицательность (ОЭО) атомов характеризует способность атома притягивать к себе общие электроны в молекуле Полинг принял: ОЭО для Li = 1 ОЭО для F = 4
7 Относительная электроотрицательность (шкала Полинга) Группа → Период↓ 1 2 3 4 5 6 7 I Н 2.1 II Li 1.00 Be 1.5 B 2.0 C 2.5 N 3.0 7 O 3.5 F 4.0 III Na 0.9 3 Mg 1.2 Al 1.5 Si 1.8 P 2. 2 S 2. 6 Cl 3.0 IV K 0.91 Ca 1.0 4 Ga 1. 8 Ge 1.8 As 2. 1 Se 2. 5 Br 2. 8 V Rb 0.8 9 Sr 0.99 In 1. 5 Sn 1.8 Sb 1. 8 Te 2.1 I 2. 6 VI Cs 0.7 Ba 0.9 Tl 1.8 Pb 1.6 Bi 1.9 Po 1.8 At 2.3
Слайд 10
10 Химические свойства элемента зависят от способности атома отдавать (металлические свойства) или присоединять (неметаллические свойства) электроны, что зависит от: 1) заряда ядра 2) радиуса атома 3) электронной конфигурации внешнего и предвнешнего уровней За металлические и неметаллические свойства борются две тенденции: - при росте заряда ядра сила притяжения электронов растет - но с увеличением числа электронов (от 4 до 7) идет приближение к устойчивой конфигурации ns 2 np 6 и атом активнее присоединяет электроны
12 Относительная электроотрицательность (желтым выделены р-элементы – металлы!) Группа → Период↓ 1 2 3 4 5 6 7 I Н 2.1 II Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0 III Na 0.9 Mg 1.2 Al 1.5 Si 1.8 P 2.1 S 2.5 Cl 3.0 IV K 0.8 Ca 1.0 Ga 1.6 Ge 1.8 As 2.0 Se 2.4 Br 2.5 V Rb 0.8 Sr 1.0 In 1.7 Sn 1.8 Sb 1.9 Te 2.1 I 2.5 VI Cs 0.7 Ba 0.9 Tl 1.8 Pb 1.6 Bi 1.9 Po 1.8 At 2.3
Слайд 13
13 Значения электроотрицательности нужно! использовать для оценки направления смещения электронов при образовании молекул.
Слайд 14
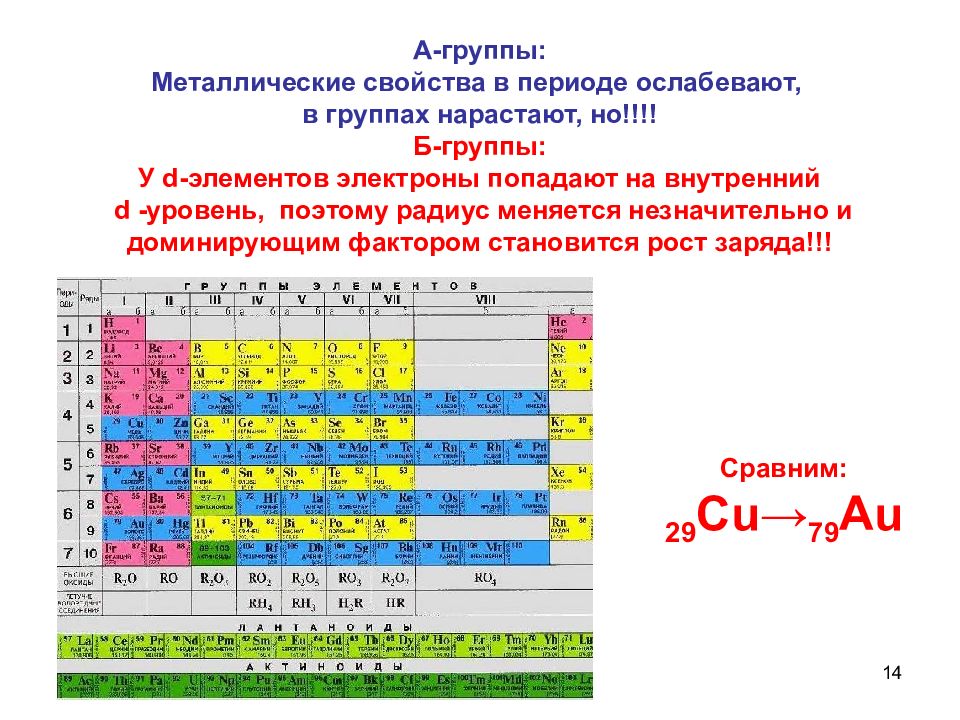
14 А-группы: Металлические свойства в периоде ослабевают, в группах нарастают, но!!!! Б-группы: У d -элементов электроны попадают на внутренний d -уровень, поэтому радиус меняется незначительно и доминирующим фактором становится рост заряда!!! Сравним: 29 Cu → 79 Au
Слайд 15
15 Атомы металлов всегда отдают электроны и степень окисления у них только положительная! Атомы неметаллов могут иметь и положительную степень окисления и отрицательную (исключение составляет фтор - F). Максимальная отрицательная степень окисления рассчитывается как разность числа 8 и номера группы.
Слайд 16
16 Атомы металлов – только восстановители! Атомы неметаллов, как правило, – окислители, но в реакциях с более сильными окислителями проявляют восстановительные свойства. 2Р+3Н 2 →2РН 3 4Р+5О 2 →2Р 2 О 5
Слайд 17
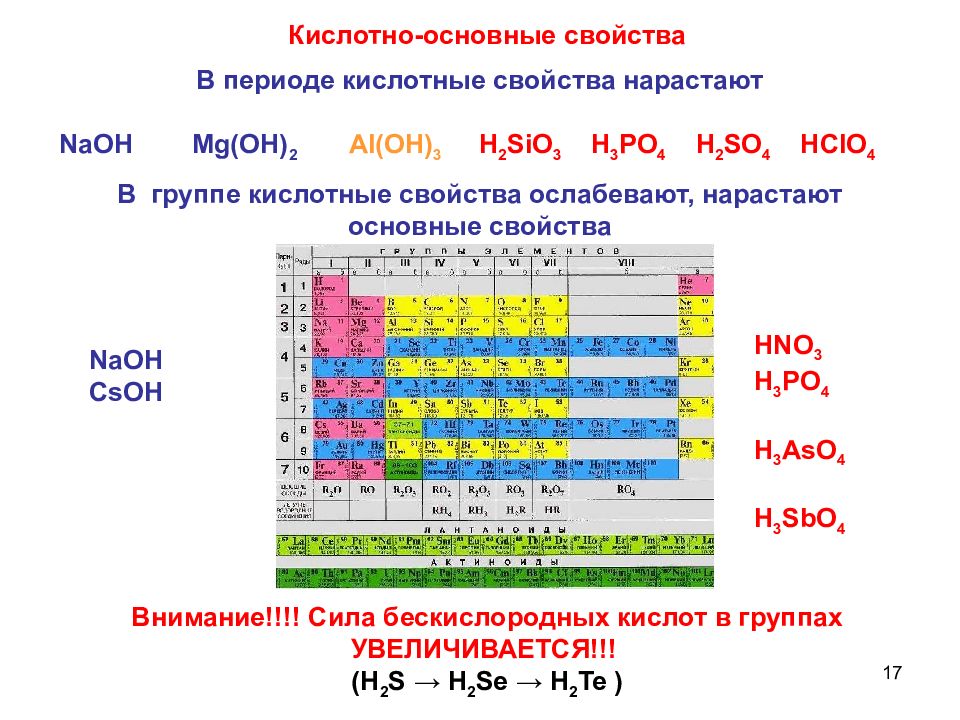
17 Кислотно-основные свойства В периоде кислотные свойства нарастают NaOH Mg(OH) 2 AI(OH) 3 H 2 SiO 3 H 3 PO 4 H 2 SO 4 HCIO 4 В группе кислотные свойства ослабевают, нарастают основные свойства NaOH CsOH HNO 3 H 3 PO 4 H 3 AsO 4 H 3 SbO 4 Внимание!!!! Сила бескислородных кислот в группах УВЕЛИЧИВАЕТСЯ!!! ( H 2 S → H 2 Se → H 2 Te )
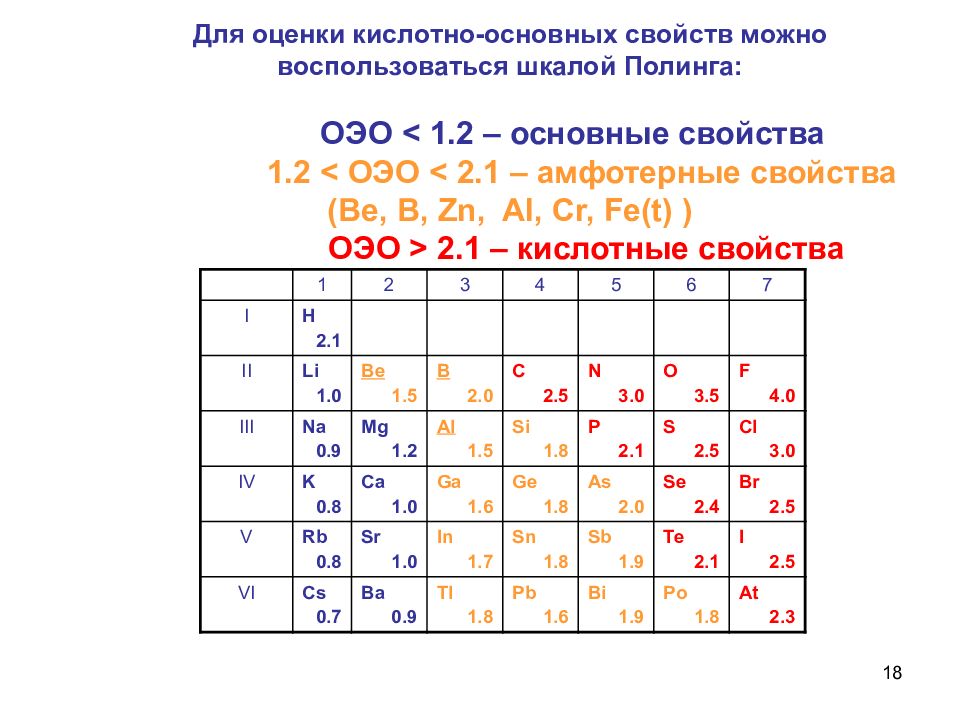
Слайд 18: Для оценки кислотно-основных свойств можно воспользоваться шкалой Полинга: ОЭО < 1.2 – основные свойства 1.2 < ОЭО < 2.1 – амфотерные свойства (Ве, В, Zn, AI, Cr, Fe(t) ) ОЭО > 2.1 – кислотные свойства
18 Для оценки кислотно-основных свойств можно воспользоваться шкалой Полинга: ОЭО < 1.2 – основные свойства 1.2 < ОЭО < 2.1 – амфотерные свойства (Ве, В, Zn, AI, Cr, Fe(t) ) ОЭО > 2.1 – кислотные свойства 1 2 3 4 5 6 7 I Н 2.1 II Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0 III Na 0.9 Mg 1.2 Al 1.5 Si 1.8 P 2.1 S 2.5 Cl 3.0 IV K 0.8 Ca 1.0 Ga 1.6 Ge 1.8 As 2.0 Se 2.4 Br 2.5 V Rb 0.8 Sr 1.0 In 1.7 Sn 1.8 Sb 1.9 Te 2.1 I 2.5 VI Cs 0.7 Ba 0.9 Tl 1.8 Pb 1.6 Bi 1.9 Po 1.8 At 2.3
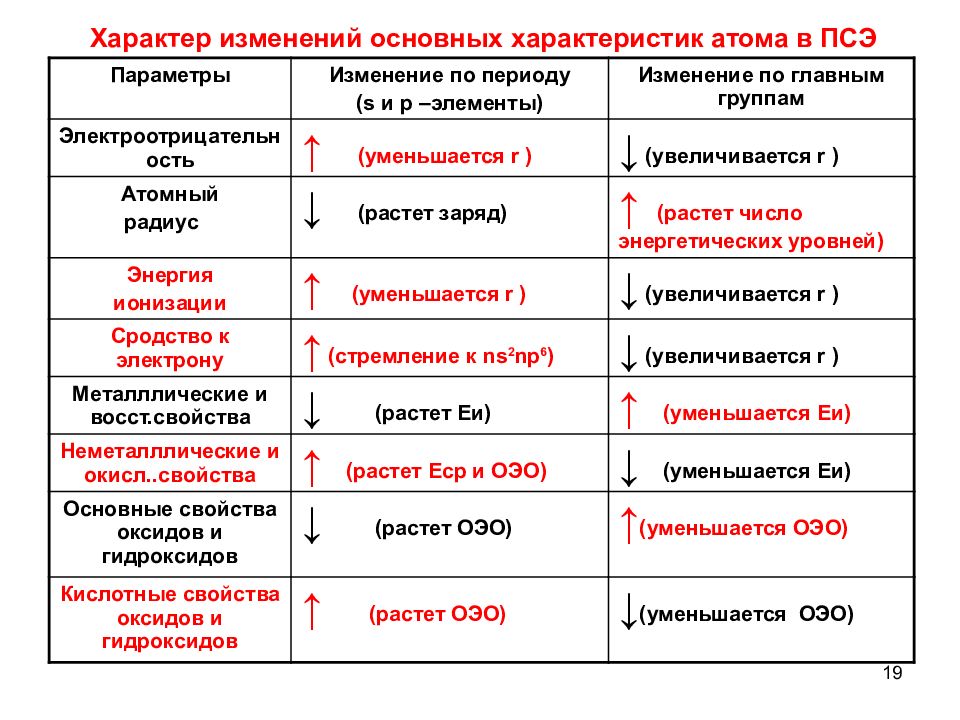
19 Характер изменений основных характеристик атома в ПСЭ Параметры Изменение по периоду ( s и р –элементы) Изменение по главным группам Электроотрицательность ↑ (уменьшается r ) ↓ (увеличивается r ) Атомный радиус ↓ (растет заряд) ↑ (растет число энергетических уровней) Энергия ионизации ↑ (уменьшается r ) ↓ (увеличивается r ) Сродство к электрону ↑ (стремление к ns 2 np 6 ) ↓ (увеличивается r ) Металллические и восст.свойства ↓ (растет Еи) ↑ (уменьшается Еи) Неметалллические и окисл..свойства ↑ (растет Еср и ОЭО) ↓ (уменьшается Еи) Основные свойства оксидов и гидроксидов ↓ (растет ОЭО) ↑ (уменьшается ОЭО) Кислотные свойства оксидов и гидроксидов ↑ (растет ОЭО) ↓ (уменьшается ОЭО)
21 Тест №4 Основные характеристики атома (один вариант ответа)
Слайд 22: 1. Химические элементы расположены в порядке возрастания их атомного радиуса в ряду:
22 1. Химические элементы расположены в порядке возрастания их атомного радиуса в ряду: 1) Be,B,C,N 2) Rb,K,Na,Li 3) O,S,Se,Te 4) Mg,Al,Si,P
Слайд 23: 2. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
23 2. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса? 1) Na,Mg,Al,Si 2) Li, Be, B, C 3) P,S, Cl,Ar 4) F,O,N,C
Слайд 24: 3. Наибольший радиус имеют атомы:
24 3. Наибольший радиус имеют атомы: 1) азота 2) висмута 3) сурьмы 4) мышьяка
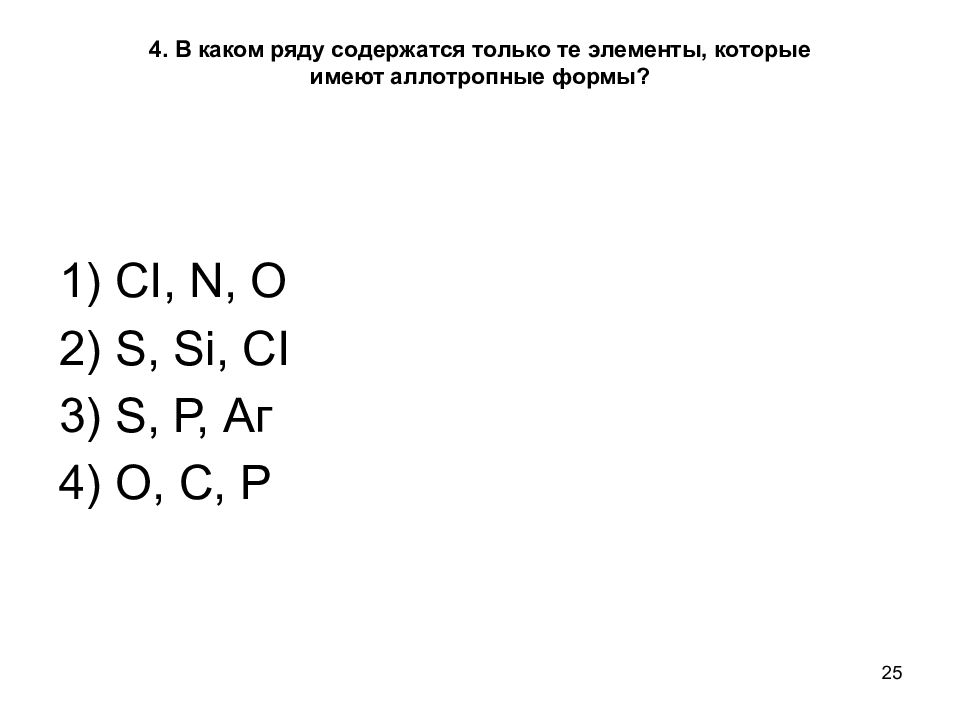
Слайд 25: 4. В каком ряду содержатся только те элементы, которые имеют аллотропные формы?
25 4. В каком ряду содержатся только те элементы, которые имеют аллотропные формы? 1) CI, N, О 2) S, Si, CI 3) S, Р, Аг 4) О, С, Р
Слайд 26: 5. Аллотропными модификациями являются:
26 5. Аллотропными модификациями являются: 1)азот и фосфор 2)кислород и озон 3) сера и селен 4) уран-235 и уран-238
Слайд 27: 6. Графит и алмаз — это:
27 6. Графит и алмаз — это: 1)разные химические элементы 2)одно и то же вещество 3)аллотропные видоизменения одного химического элемента 4)разные агрегатные состояния одного вещества.
Слайд 28: 7. Какие из перечисленных веществ являются различными аллотропными видоизменениями одного элемента?
28 7. Какие из перечисленных веществ являются различными аллотропными видоизменениями одного элемента? 1) кремний и кремнезем 2) сажа и графит 3) белое золото и золото 4) белый фосфор и черный фосфор
Слайд 29: 8.Какой химический элемент не образует аллотропных модификаций?
29 8.Какой химический элемент не образует аллотропных модификаций? 1) Сера 2) Углерод 3) Фосфор 4) Азот
Слайд 30: 9. Свойство химического элемента образовывать несколько простых веществ называют:
30 9. Свойство химического элемента образовывать несколько простых веществ называют: 1)поливалентностью 2)гетерогенностью 3)аллотропией 4) изоморфизмом
Слайд 31
31 10. В порядке возрастания атомного радиуса химические элементы расположены в ряду: 1) N, Be, В, С 2) Rb, Na, К, Li 3) О, S, Se, Те 4) Al, Mg, Si, P
Слайд 32
32 11. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса? 1) Al, Na, Si, Mg 2) Be, Li, В, С 3) S, P, Ar, CI 4) F, O, N, С
Слайд 33
33 12. В ряду элементов: азот → кислород → фтор увеличивается: 1) атомный радиус 2) число неспаренных электронов в атоме 3) число s -электронов в атоме 4) электроотрицательность
Слайд 34
34 13. Наименьшей электроотрицательностью обладает элемент: Be В 3) С 4) N
Слайд 35
35 14. Наибольшей электроотрицательностью обладает элемент: 1) Si 2) P 3) S 4) CI
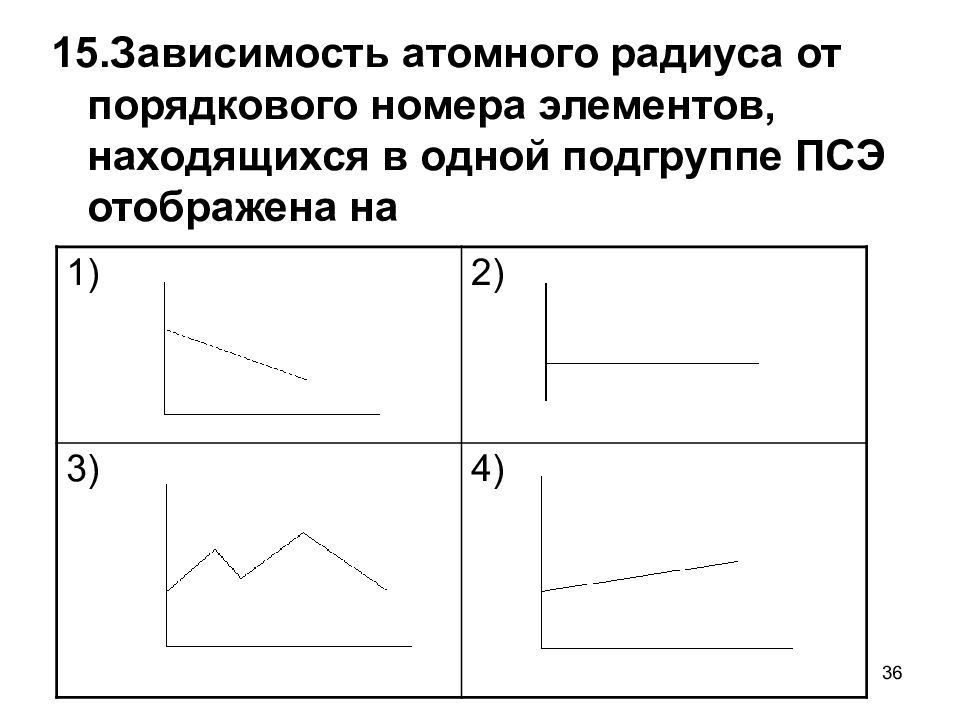
Слайд 36
36 15.Зависимость атомного радиуса от порядкового номера элементов, находящихся в одной подгруппе ПСЭ отображена на 1) 2) 3) 4)
Слайд 37
37 16. Изменение электроотрицательности атомов элементов одного периода с увеличением порядкового номера элемента изображено на графике 1) 2) 3) 4)
Слайд 38
38 17. Увеличение электроотрицательности элементов, расположенных в одной группе, с уменьшением их порядковых номеров обусловлено 1 ) уменьшением заряда ядря 2) уменьшением атомного радиуса 3) уменьшением общего числа электронов 4) уменьшением атомной массы элемента
Слайд 39
39 18. Состав ядер изотопов 12 С и 13 С соответственно равен: 1) 12р+6n и 13p+7n 2) 12p+12n и 13р+13n 3) 6p+12n и 6p+13n 4) 6p+6n и 6p+7n
Слайд 40
40 19. Элементы расположены в порядке уменьшения их атомного радиуса 1) F → Br → H → Cl 2) H → F → Cl → Br 3) Br → Cl → F → H 4) H → Cl → Br → F
Слайд 41: 20. Наименьший радиус имеет атом:
41 20. Наименьший радиус имеет атом: 1) S 2) Al 3) Cl 4) Ar
Слайд 42
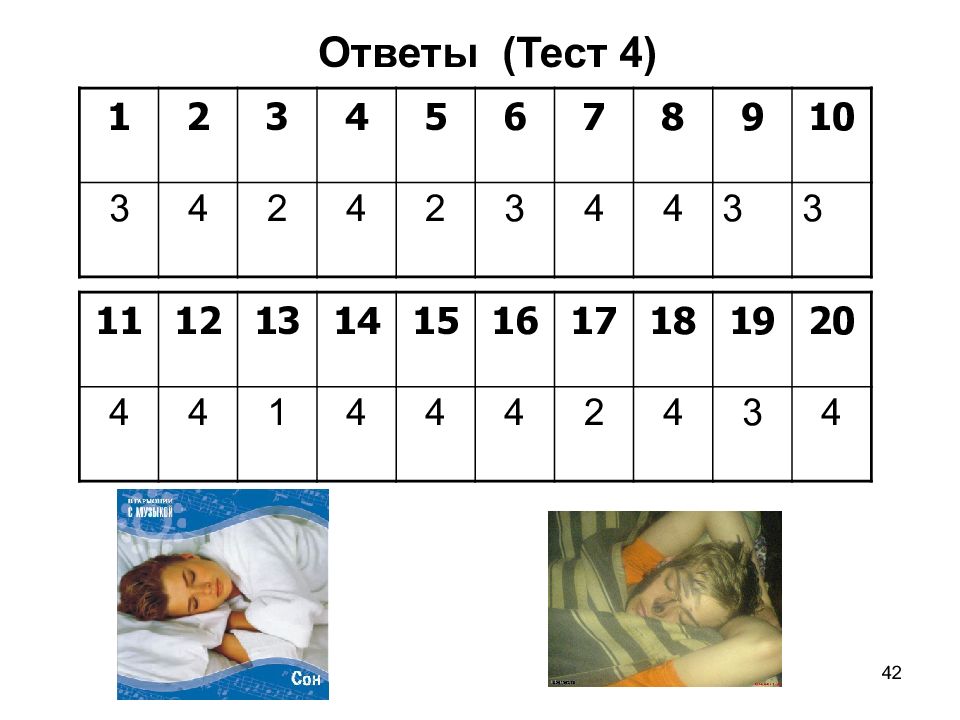
42 1 2 3 4 5 6 7 8 9 10 3 4 2 4 2 3 4 4 3 3 Ответы (Тест 4) 11 12 13 14 15 16 17 18 19 20 4 4 1 4 4 4 2 4 3 4
Слайд 43
43 Тест 5 Изменение свойств элементов и их соединений в периодах и группах (несколько вариантов ответов)
Слайд 45: В малых периодах расположены элементы (2 варианта ответа)
45 В малых периодах расположены элементы (2 варианта ответа) только металлы только s - и р-семейств только групп А как главных, так и побочных групп
Слайд 46: 2. Укажите физический смысл номера группы в периодической системе (2 варианта ответа) :
46 2. Укажите физический смысл номера группы в периодической системе (2 варианта ответа) : равен числу электронных слоев в атоме как правило, равен числу валентных электронов в атоме для элементов групп А равен числу электронов внешнем электронном слое равен общему числу электронов в атоме
Слайд 47: 3. Неметаллические свойства атомов элементов постепенно нарастают в ряду:
47 3. Неметаллические свойства атомов элементов постепенно нарастают в ряду: В, С, Si Si, C, B Si, C, N C, Si, N
Слайд 48: 4. В одном периоде находятся элементы:
48 4. В одном периоде находятся элементы: с подобными химическими свойствами атомов; с одинаковым числом валентных электронов в атоме; с одинаковым числом электронных слоев в атоме; с одинаковой энергией ионизации атома.
Слайд 49: 5. Общую формулу летучих водородных соединений ЭН 3 имеют элементы группы:
49 5. Общую формулу летучих водородных соединений ЭН 3 имеют элементы группы: II А III А IV А V А
Слайд 50: 6. Какова общая формула летучих водородных соединений элементов VIА группы?
50 6. Какова общая формула летучих водородных соединений элементов VIА группы? НЭ Н 2 Э ЭН 3 ЭН 4
Слайд 51: 7. Укажите общую формулу высших оксидов элементов IV А группы :
51 7. Укажите общую формулу высших оксидов элементов IV А группы : ЭО Э 2 О 3 ЭО 2 Э 2 О 5
Слайд 52: 8. Общую формулу высших оксидов Э 2 О 7 имеют элементы группы:
52 8. Общую формулу высших оксидов Э 2 О 7 имеют элементы группы: III А IVA VA VII А
Слайд 53: 9. Укажите символы элементов, формула высших оксидов которых Э 2 О 3 (2 варианта ответа) :
53 9. Укажите символы элементов, формула высших оксидов которых Э 2 О 3 (2 варианта ответа) : Ca B Sc S
Слайд 54: 10. В больших периодах расположены элементы (2 варианта ответа) :
54 10. В больших периодах расположены элементы (2 варианта ответа) : только d- и f -семейств элементы s-, р., d- и f -семейств только А групп как А, так и В групп
Слайд 55: Ответы (Тест 5)
55 Ответы (Тест 5) 1 2 3 4 5 6 7 8 9 10 2,3 2,3 3 3 4 2 3 4 2,3 2,4
Слайд 56
56 Тест 6 Изменение свойств элементов и их соединений в периодах и группах (один вариант ответа)
Слайд 57: Укажите атомный номер элемента, образующего высший оксид и летучее водородное соединение состава Э 2 О 5, ЭН 3 :
57 Укажите атомный номер элемента, образующего высший оксид и летучее водородное соединение состава Э 2 О 5, ЭН 3 : 1 14 15 23
Слайд 58: 2. Электроотрицательность последовательно возрастает в ряду атомов, символы которых:
58 2. Электроотрицательность последовательно возрастает в ряду атомов, символы которых: C, N, Si C, Si, N N, C, Si Si, C, N
Слайд 59: 3. Укажите ряд, в котором символы элементов указаны в порядке возрастания энергии ионизации атомов:
59 3. Укажите ряд, в котором символы элементов указаны в порядке возрастания энергии ионизации атомов: N, С, Si Si, C, N C, Si, N C, N, Si
Слайд 60: 4. С последовательным возрастанием неметаллических свойств атомов химических элементов электроотрицательность:
60 4. С последовательным возрастанием неметаллических свойств атомов химических элементов электроотрицательность: уменьшается не изменяется увеличивается изменяется периодически
Слайд 61: 5. Укажите электронную конфигурацию атома элемента с наиболее выраженными металлическими свойствами ( n > 1):
61 5. Укажите электронную конфигурацию атома элемента с наиболее выраженными металлическими свойствами ( n > 1): ns 2 ns 2 np 2 ns 2 np 4 ns 2 np 5
Слайд 62: 6. Укажите электронную конфигурацию атома элемента с наиболее выраженными неметаллическими свойствами ( n > 1):
62 6. Укажите электронную конфигурацию атома элемента с наиболее выраженными неметаллическими свойствами ( n > 1): ns 2 np 5 ns 2 np 4 ns 2 np 2 ns 2
Слайд 63: 7. Энергия сродства к электрону наибольшая у атомов химического элемента:
63 7. Энергия сродства к электрону наибольшая у атомов химического элемента: Ве С N F
Слайд 64: 8. Энергия сродства к электрону последовательно возрастает в ряду атомов элементов), химические символы которых:
64 8. Энергия сродства к электрону последовательно возрастает в ряду атомов элементов), химические символы которых: Р, S, С l Р, Cl, S С l, S, Р S, Р, С l
Слайд 65: 9. Укажите электронную конфигурацию атома элемента с наиболее выраженными металлическими свойствами:
65 9. Укажите электронную конфигурацию атома элемента с наиболее выраженными металлическими свойствами: 1 s 2 2 s 2 2 p 6 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 3 4 s 2 1 s 2 2 s 2 2 p 5 1 s 2 2 s 2 2 p 6 3 s 2 3 p 4
Слайд 66: 10. Укажите электронную конфигурацию атома элемент с наиболее выраженными неметаллическими свойствам
66 10. Укажите электронную конфигурацию атома элемент с наиболее выраженными неметаллическими свойствам [Ne] 3s 2 3p 5 [Ne] 3s 2 3 р 2 [Ne]3s 2 3p 4 [Ne] 3s 2 3p 3
Слайд 67: Ответы (Тест 6)
67 Ответы (Тест 6) 1 2 3 4 5 6 7 8 9 10 3 4 2 3 1 1 4 1 2 1