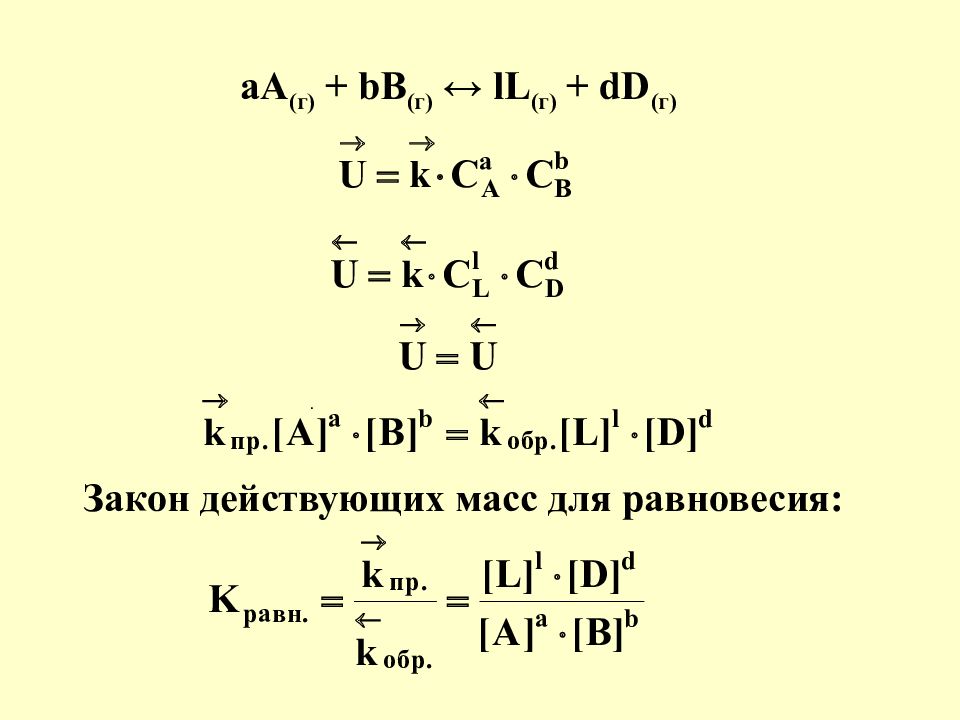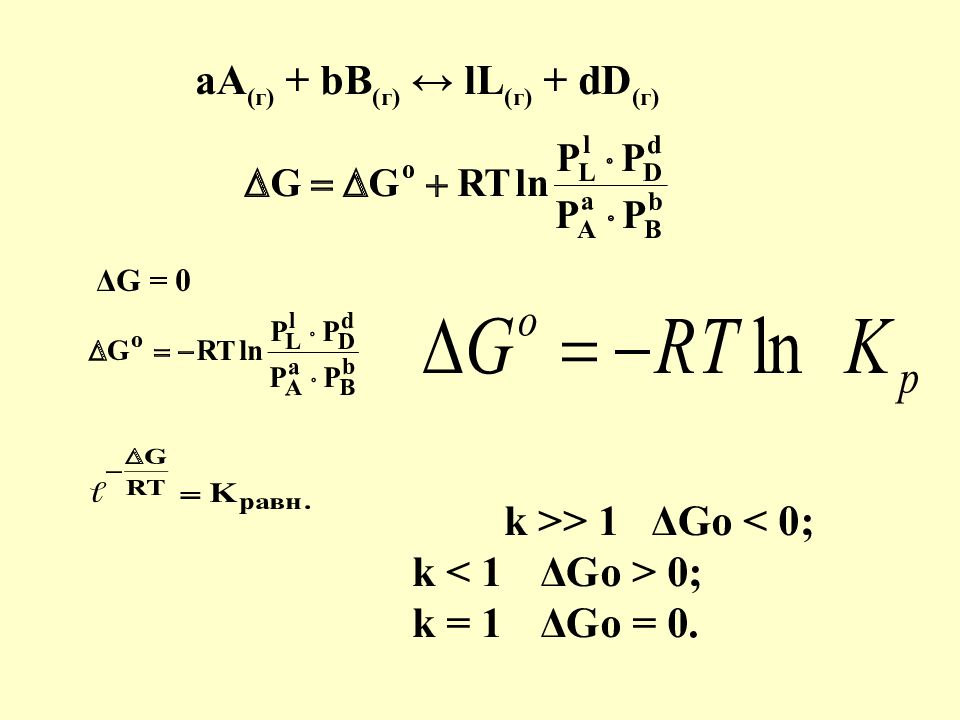Первый слайд презентации: Обзорная лекция и анкетирование
Слайд 2: ИСТОРИЧЕСКАЯ СПРАВКА
XX в - немецкий бактериолог П.Эрлих(1854-1915) впервые синтезировал соединения в качестве лекарственных средств и применил в области химиотерапии, за что ему присудили в 1908г.Нобелевскую премию «Медик без довольного познания химии совершенен быть не может !» М.В.Ломоносов XV - XVI в – швейцарский врач Парацельс Т.(1493-1591) впервые стал успешно применять неорганические вещества для лечения больных и был убежден, что цель химии –изготовление лекарств, а не золота и серебра. XVI - XVIII вв химия практически развивалась врачами, отделяясь от алхимии. XVIII в – шведский фармацевт Шееле(1742-1786), будучи помошником аптекаря, открыл кислоты растительного и животного происхождения – винную, лимонную, яблочную, молочную, мочевую. Наиболее важные его открытия – кислород и азот. врач Майер(1814-1878) и английский ученый Д.Джоуль( 1818 – 1889) стали основоположниками I начала термодинамики. XIX в - русский врач И.М.Сеченов (1829-1905) стал основоположником внедрения физической химии в медицину М.В.Ломоносов (1711- 1765 )
– наука о взаимных превращениях одних форм энергии в другие.
Слайд 5: Основные понятия термодинамики:
Процесс ( обратимый, необратимый) : изохорный ( V=const, Δ V=0), изобарный ( P=const, Δ P=0), изотермический ( T=const, Δ T=0) Состояние системы определяется: параметрами : m (г,кг, моль), V (дм 3, м 3 ), Т ( 0 К), Р (атм, мм.рт.ст, Па, кПа), Основные понятия термодинамики: и характеризуется функциями состояния : U (Дж/моль, кДж/моль)- внутренняя энергия, H (Дж/моль, кДж/моль)- энтальпия, S (Дж/моль)* K, кДж/моль* K )- энтропия, G (Дж/моль, кДж/моль)- энергия Гиббса
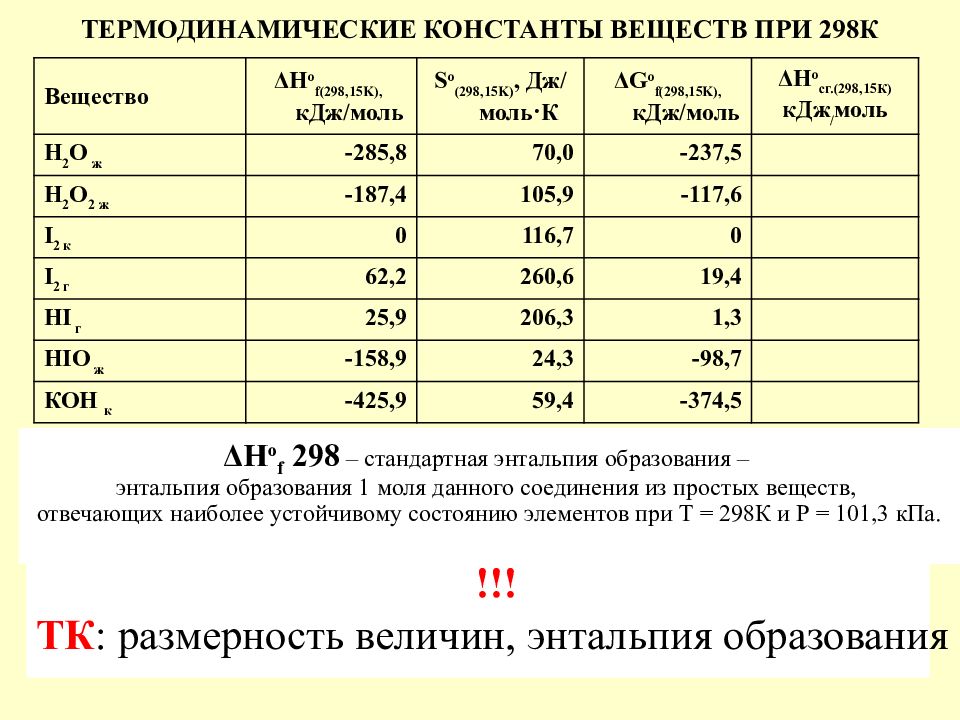
Слайд 6: ТЕРМОДИНАМИЧЕСКИЕ КОНСТАНТЫ ВЕЩЕСТВ ПРИ 298К
Вещество ΔН о f(298,15K), кДж/моль S o (298,15 K ), Дж/моль · К ΔG o f(298,15K), кДж/моль ΔН о сг.(298,15К) кДж / моль Н 2 О ж -285,8 70,0 -237,5 Н 2 О 2 ж -187,4 105,9 -117,6 I 2 к 0 116,7 0 I 2 г 62,2 260,6 19,4 HI г 25,9 206,3 1,3 HIO ж -158,9 24,3 -98,7 КОН к -425,9 59,4 -374,5 ΔН о f 298 – стандартная энтальпия образования – энтальпия образования 1 моля данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию элементов при Т = 298К и Р = 101,3 кПа. !!! ТК : размерность величин, энтальпия образования
Слайд 7: 1) количественные расчеты, характеризующие взаимодействия веществ : тепловой эффект, изменение энтальпии, энтропии, энергии Гиббса ( !!!Д.З : учет коэффициентов, правильность написания уравнений….), 2) определение направления химической реакции при определенных условиях, 3) рассчитать условия равновесного состояния в системе
Типы задач:
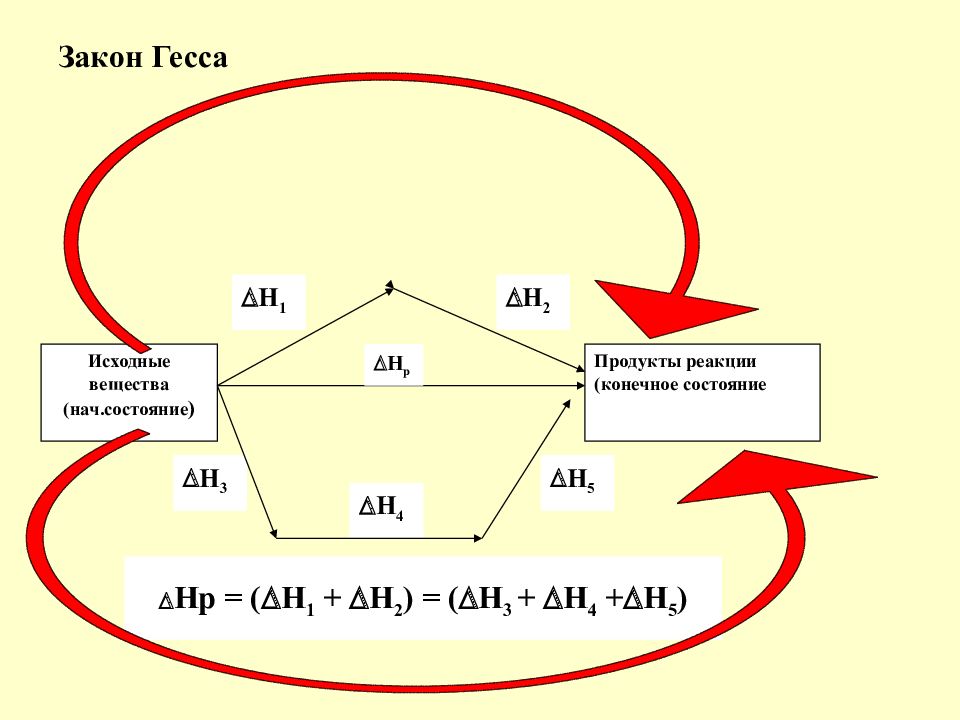
Слайд 8: Закон Гесса
Исходные вещества (нач.состояние ) Продукты реакции (конечное состояние Н р Н 1 Н 5 Н 4 Н 3 Н 2 Нр = ( Н 1 + Н 2 ) = ( Н 3 + Н 4 + Н 5 )
Слайд 9: Следствия из закона Гесса:
1-ое следствие - Закон Лавуазье-Лапласа: ΔН о разл = - ΔН о обр. 2-ое следствие: стандартная энтальпия реакции равна разности между суммой стандартных энтальпий образования продуктов реакции и суммой стандартных энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов): !!! Δ S р o, ΔG р o ΔН о р-и = ∑ ν i ΔН о f 298 прод. - ∑ ν i ΔН о f 298 исх. 3-ье следствие: стандартная : энтальпия реакции равна разности между суммой стандартных энтальпий сгорания исходных веществ и суммой стандартных энтальпий сгорания продуктов реакции (с учетом стехиометрических коэффициентов). !!! См.табл. ΔН о 298 р-и = ∑ ν i ΔН о сг. 298 (исх.в-в) - ∑ ν i ΔН о сг. 298 (прод.р-и). Задача : По какому следствию можно рассчитать изменение энтальпии реакции: С 2 Н 4 + 3О 2 = 2СО 2 +2Н 2 О
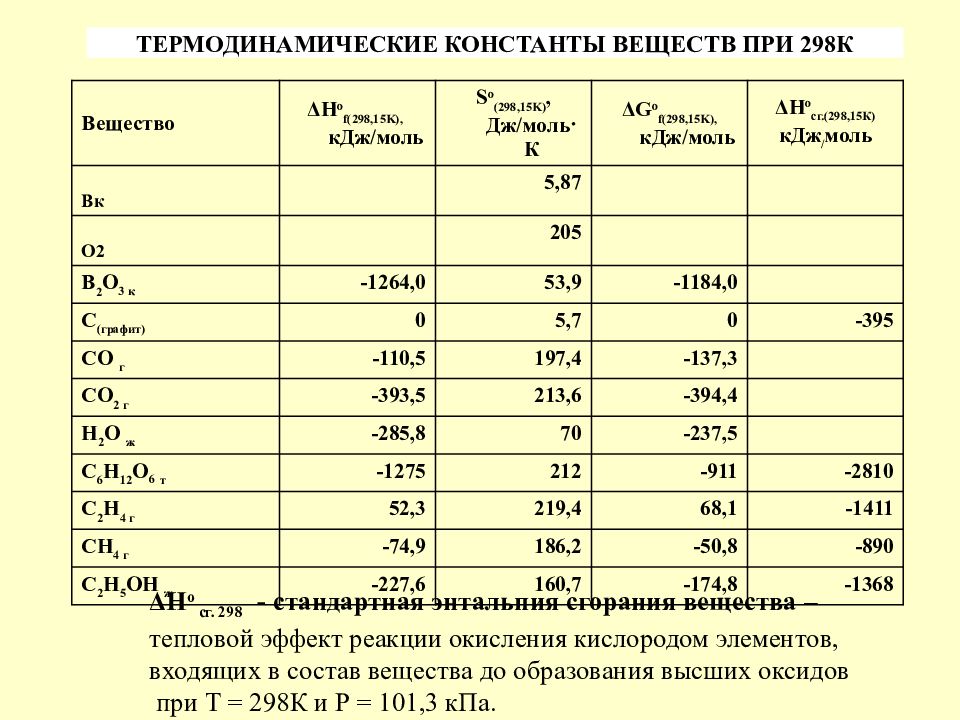
Слайд 10
Вещество ΔН о f(298,15K), кДж/моль S o (298,15 K ), Дж/моль · К ΔG o f(298,15K), кДж/моль ΔН о сг.(298,15К) кДж / моль Вк 5,87 О2 205 В 2 О 3 к - 1264,0 53,9 -1184,0 С (графит) 0 5,7 0 -395 СО г -110,5 197,4 -137,3 СО 2 г -393,5 213,6 -394,4 Н 2 О ж -285,8 70 -237,5 С 6 Н 12 О 6 т -1275 212 -911 -2810 С 2 Н 4 г 52,3 219,4 68,1 -1411 СН 4 г -74,9 186,2 -50,8 -890 С 2 Н 5 ОН ж -227,6 160,7 -174,8 -1368 ТЕРМОДИНАМИЧЕСКИЕ КОНСТАНТЫ ВЕЩЕСТВ ПРИ 298К ΔН о сг. 298 - стандартная энтальпия сгорания вещества – тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества до образования высших оксидов при Т = 298К и Р = 101,3 кПа.
Слайд 11: Алгоритм решения задач 1 и 2 типа:
Правильно списать справочные данные Выбрать метод решения: алгебраический, графический Написать уравнение процесса Обосновать расчет: указать закон или следствие, на основании которого выполняется Подставить в формулу данные с учетом коэффициентов и выполнить расчет Выводы
Слайд 12: Задачи:
1)Вычислите энтальпию образования В 2 О 3, если известно: 2В (к) + N 2( к) = 2 BN (к) + 507,5 кДж 2 BN (к) + 3/2 О 2 = В 2 О 3 (к) + N 2 ( Г) + 754 кДж 2)Возможна ли реакция при 298К : 2 B (к) + 3/2 О 2 = В 2 О 3 (к) 3) Возможно ли состояние равновесия в системе 2 B (к) + 3/2 О 2 = В 2 О 3 (к)
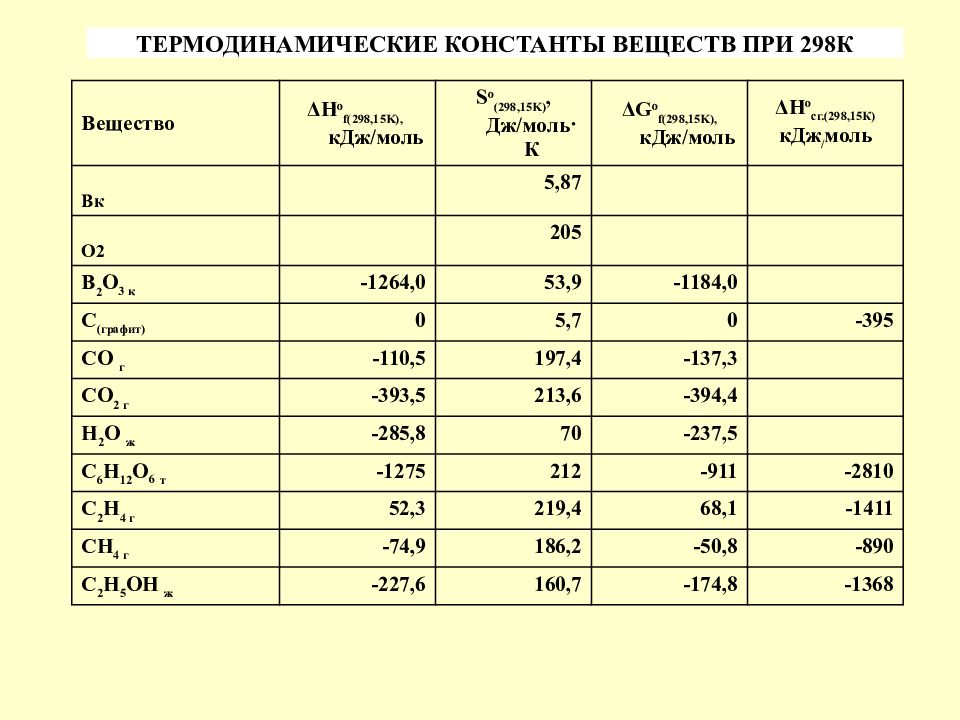
Слайд 13
Вещество ΔН о f(298,15K), кДж/моль S o (298,15 K ), Дж/моль · К ΔG o f(298,15K), кДж/моль ΔН о сг.(298,15К) кДж / моль Вк 5,87 О2 205 В 2 О 3 к - 1264,0 53,9 -1184,0 С (графит) 0 5,7 0 -395 СО г -110,5 197,4 -137,3 СО 2 г -393,5 213,6 -394,4 Н 2 О ж -285,8 70 -237,5 С 6 Н 12 О 6 т -1275 212 -911 -2810 С 2 Н 4 г 52,3 219,4 68,1 -1411 СН 4 г -74,9 186,2 -50,8 -890 С 2 Н 5 ОН ж -227,6 160,7 -174,8 -1368 ТЕРМОДИНАМИЧЕСКИЕ КОНСТАНТЫ ВЕЩЕСТВ ПРИ 298К
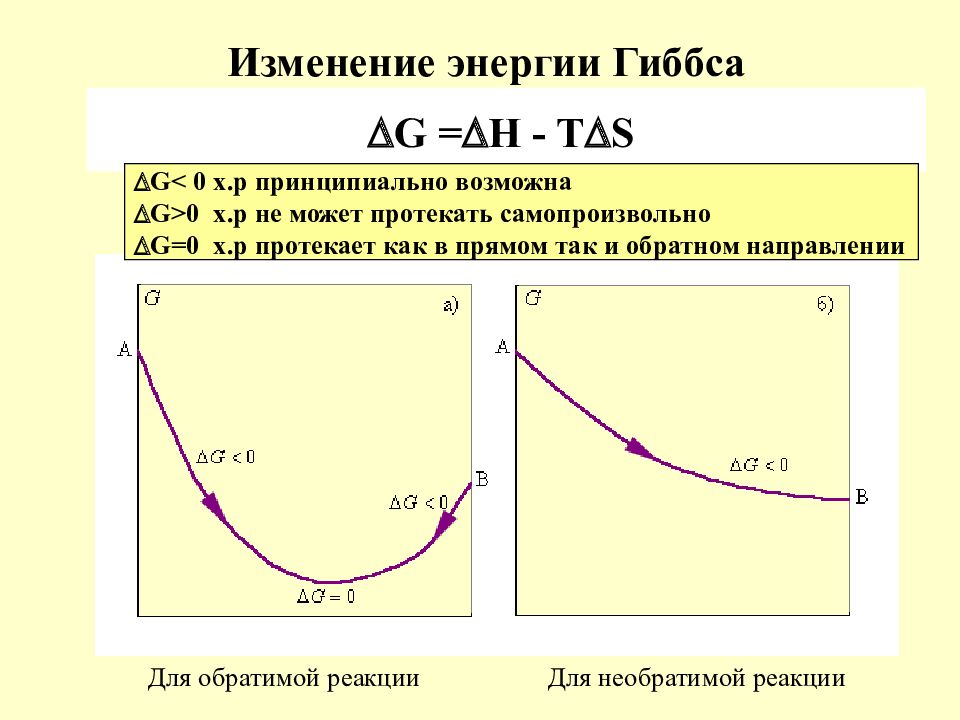
Слайд 14: Изменение энергии Гиббса
Для обратимой реакции Для необратимой реакции G = H - T S G < 0 х.р принципиально возможна G >0 х.р не может протекать самопроизвольно G =0 х.р протекает как в прямом так и обратном направлении
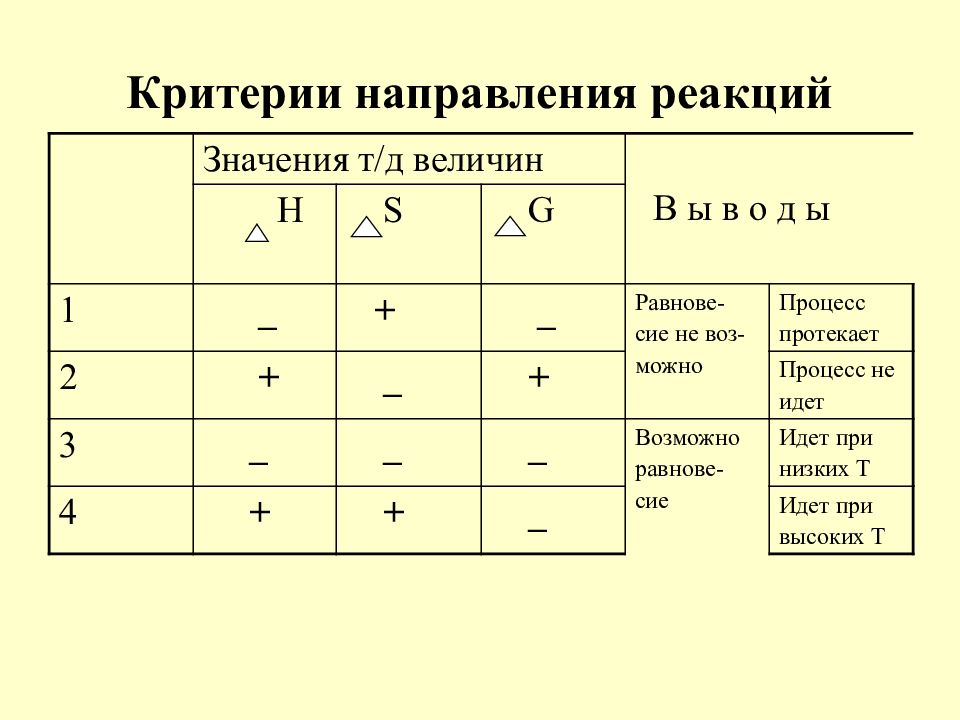
Слайд 15: Критерии направления реакций
Значения т / д величин В ы в о д ы Н S G 1 _ + _ Равнове- сие не воз- можно Процесс протекает 2 + _ + Процесс не идет 3 _ _ _ Возможно равнове- сие Идет при низких Т 4 + + _ Идет при высоких Т
Слайд 16: УРОВЕНЬ теоретического ПОНИМАНИЯ МАТЕРИАЛА: 2.1.Химическая термодинамика
1. не слушал(а) 2. не успевал(а) вникать. Только запись 3. понимаю меньше половины 4. все понятно
Слайд 17: 2.2. Химическая кинетика - Равновесие
Химическая кинетика - учение о скорости химических реакций и о зависимости ее от различных факторов !!! Закон действующих масс Закон Вант-Гоффа Принцип Ле-Шателье
Слайд 18
аА (г) + bB (г) ↔ lL (г) + dD (г) Закон действующих масс для равновесия: .
Слайд 19
аА (г) + bB (г) ↔ lL (г) + dD (г) Δ G = 0 k >> 1 ΔGo < 0; k < 1 ΔGo > 0; k = 1 ΔGo = 0.
Слайд 21: Задачи:
На сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 16 раз. Температурный коэффициент равен 2. 2) При 100 0 С реакция заканчивается за 32 минуты. Определить время реакции при температуре 150 0 С. Температурный коэффициент равен 2.
Слайд 22
Принцип Ле-Шателье : если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
Слайд 23: 1)Определить направление смещения равновесия в системе : 2 SO 2 + O 2 2SO 3 + 192, 7 кДж при повышении температуры, увеличении давления и содержания кислорода 2) Как изменится скорость прямой и обратной реакции. Куда сместится равновесие ?
3) Реакции в растворах электролитов : изменится ли значение рН раствора при добавлении солей N а CI или СН 3 СОО Na к раствору уксусной кислоты СН 3 СООН СН 3 СОО - + Н + 4) Гетерогенные равновесия: выпадет ли осадок, если: дана концентрация ионов в растворе, объемы и концентрация растворов, которые смешиваются и т.д. концентрация ионов в насыщенном растворе трудно растворимого соединения составляет….. Растворится ли осадок, если к нему добавить…. 1)Определить направление смещения равновесия в системе : 2 SO 2 + O 2 2SO 3 + 192, 7 кДж при повышении температуры, увеличении давления и содержания кислорода 2) Как изменится скорость прямой и обратной реакции. Куда сместится равновесие ? Задачи:
Слайд 24: УРОВЕНЬ ПОНИМАНИЯ теоретического МАТЕРИАЛА: 2.2. Химическая кинетика. Равновесие
1. не слушал(а) 2. не успевал(а) вникать. Только запись 3. понимаю меньше половины 4. все понятно
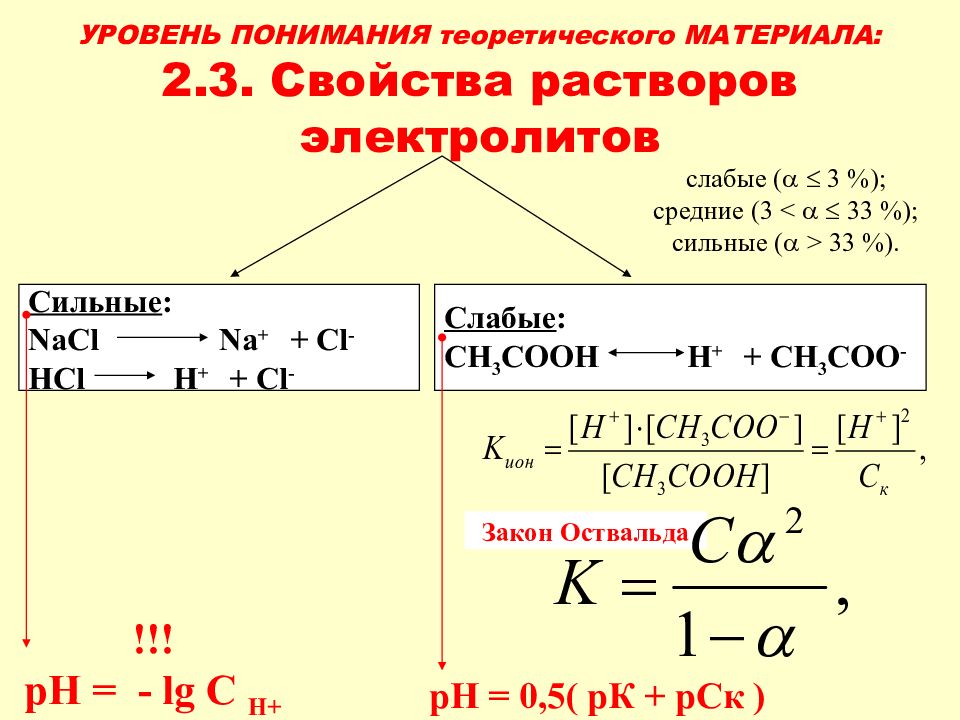
Слайд 25: УРОВЕНЬ ПОНИМАНИЯ теоретического МАТЕРИАЛА: 2.3. Свойства растворов электролитов
Закон Оствальда Сильные : NaCl Na + + Cl - HCl H + + Cl - Слабые : C Н 3 СООН Н + + C Н 3 СОО - слабые ( 3 %); средние (3 < 3 3 %); сильные ( > 3 3 %). !!! рН = - lg C H+ рН = 0,5( рК + рСк )
Слайд 26: Типы задач
Рассчитайте С Н+ и рН следующих растворов: а) 0,01 М НС1; б) 0,01 М СН 3 СООН. Как изменится рН при 100 кратном разбавлении?, рК = 4,76. Решение: а) НС1 → Н + + С1 - (кислота сильная), = 1 рН 1 = рС к = - lg 0,01 = 2 При разбавлении раствора в 100 раз С к в 100 раз уменьшается. рН 2 = рСк = - lg 10 -4 = 4 Ответ : рН увеличится на 2 единицы. б) СН 3 СООН ↔ Н + + СН3СОО - С Н+ = ∙Ск рН 1 =1/2( рК + рС к ) = 1/2 (4,76 + lg 0,01) = 3,4 рН 2 = 1/2(4,76 + lg 10 -4) = 4,4 При разбавлении в 100 раз С к в 100 раз уменьшится. Ответ : рН увеличится на единицу.
Слайд 27: 2.3. Свойства растворов электролитов
1. не слушал(а) 2. не успевал(а) вникать. Только запись 3. понимаю меньше половины 4. все понятно
Слайд 28: КОС
к ислотно- о сновное с остояние определяет соотношение кислоты и щелочи в каком-либо растворе и характеризуется показателем рН
Слайд 31: 2.4. Буферные системы
1. не слушал(а) 2. не успевал(а) вникать. Только запись 3. понимаю меньше половины 4. все понятно
Слайд 32: Буферные системы
1 типа: слабая кислота+соль сл.к-ты. 2 типа: слабое основание+соль сл.осн.
Слайд 33
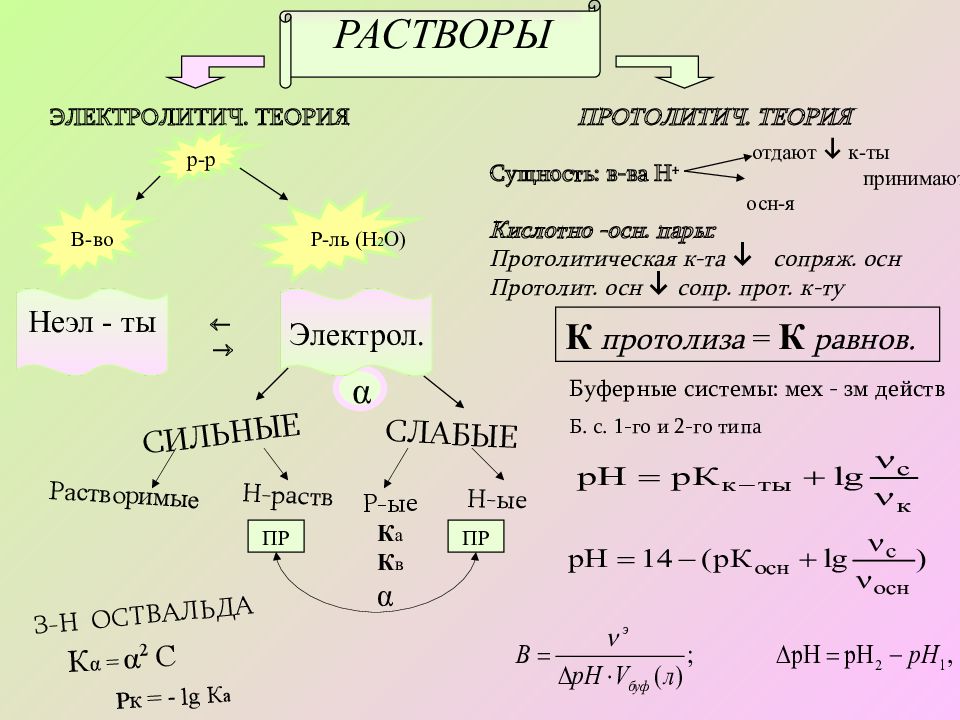
ЭЛЕКТРОЛИТИЧ. ТЕОРИЯ ПРОТОЛИТИЧ. ТЕОРИЯ р-р В-во Р-ль ( H 2 O) α ПР ПР К а К в α Сущность: в-ва Н + отдают к-ты принимают осн-я Кислотно -осн. пары: Протолитическая к-та сопряж. осн Протолит. осн сопр. прот. к-ту К протолиза = К равнов. Буферные системы: мех - зм действ Б. с. 1-го и 2-го типа РАСТВОРЫ Неэл - ты Электрол. СЛАБЫЕ СИЛЬНЫЕ К α = α 2 С Р к = - lg К а Растворимые Н-раств Р-ые Н-ые З-Н ОСТВАЛЬДА
Слайд 34: УРОВЕНЬ теоретического ПОНИМАНИЯ МАТЕРИАЛА: 2.5. Поверхностные явления. Адсорбция
(2 семестр)
Слайд 35
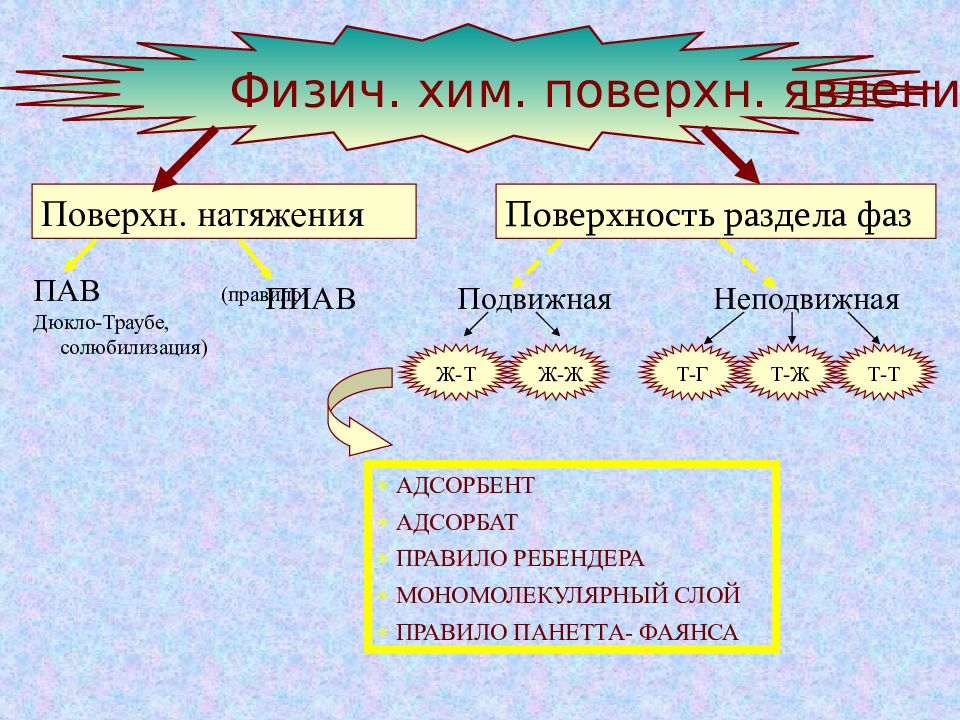
Физич. хим. поверхн. явлений Поверхн. натяжения ПАВ (правило Дюкло-Траубе, солюбилизация) ПИАВ Поверхность раздела фаз Подвижная Неподвижная Ж-Т Ж-Ж Т-Г Т-Ж Т-Т АДСОРБЕНТ АДСОРБАТ ПРАВИЛО РЕБЕНДЕРА МОНОМОЛЕКУЛЯРНЫЙ СЛОЙ ПРАВИЛО ПАНЕТТА- ФАЯНСА
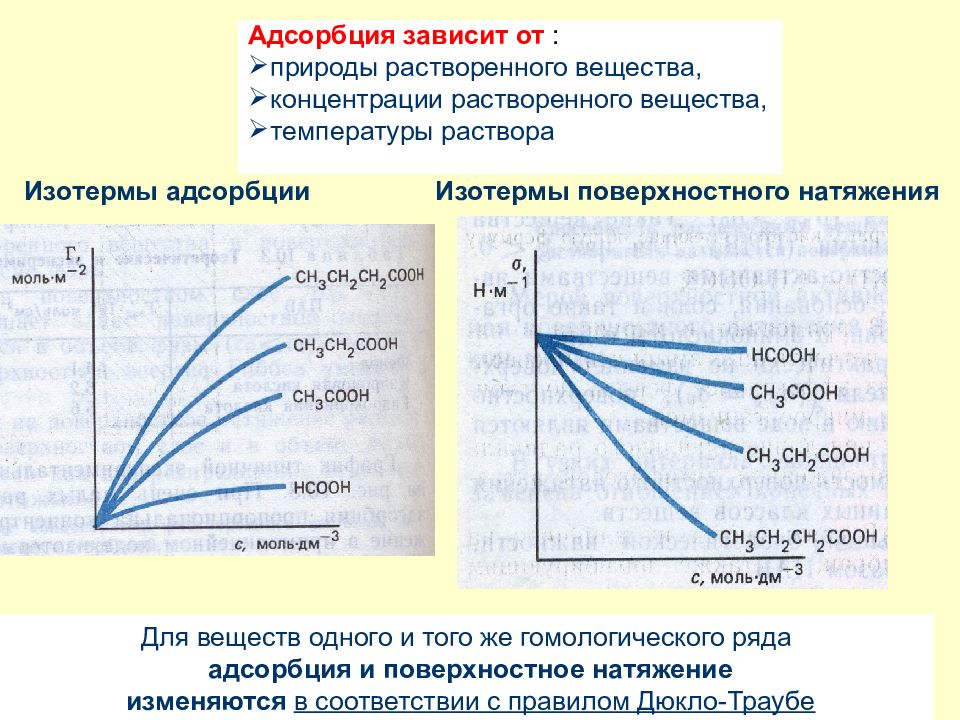
Слайд 36: Изотермы адсорбции Изотермы поверхностного натяжения
Адсорбция зависит от : природы растворенного вещества, концентрации растворенного вещества, температуры раствора Для веществ одного и того же гомологического ряда адсорбция и поверхностное натяжение изменяются в соответствии с правилом Дюкло-Траубе
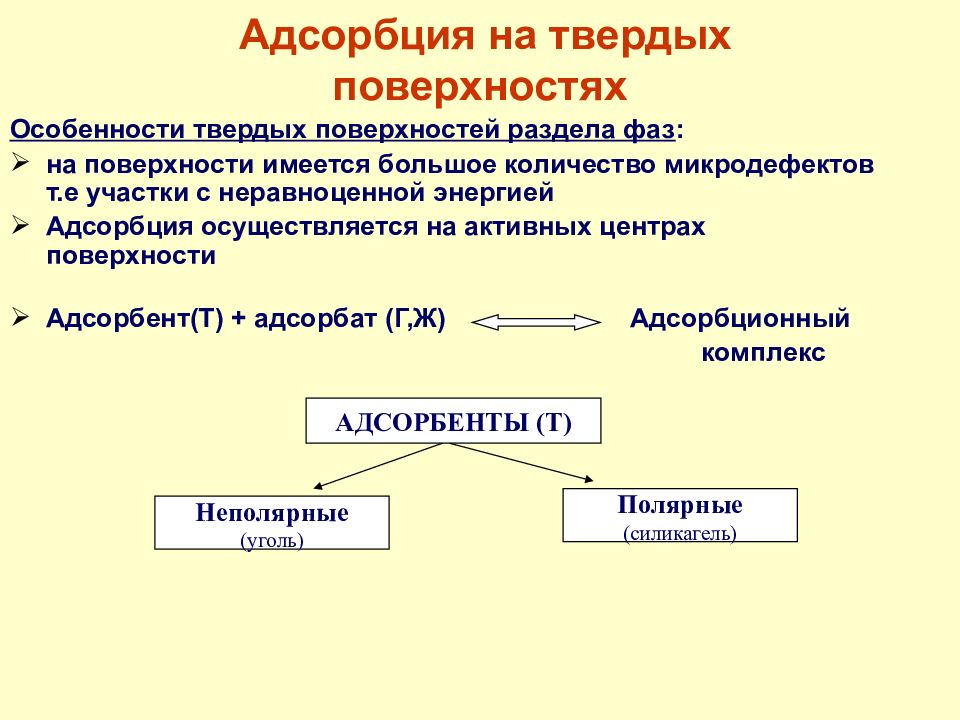
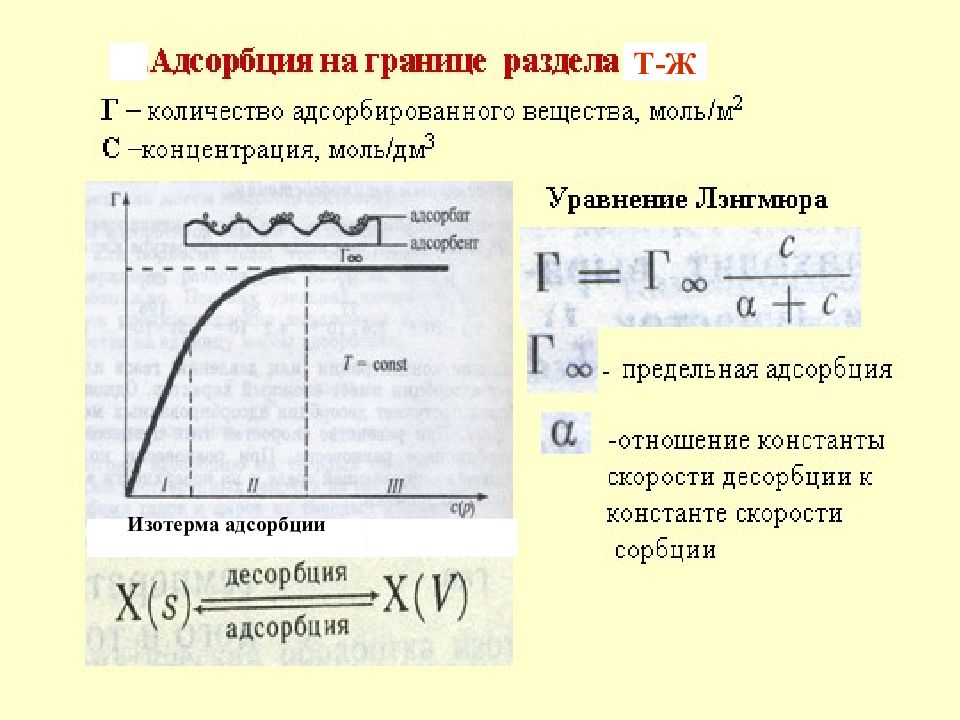
Слайд 38: Адсорбция на твердых поверхностях
Особенности твердых поверхностей раздела фаз : на поверхности имеется большое количество микродефектов т.е участки с неравноценной энергией Адсорбция осуществляется на активных центрах поверхности Адсорбент(Т) + адсорбат (Г,Ж) Адсорбционный комплекс Адсорбция на твердых поверхностях АДСОРБЕНТЫ (Т) Неполярные (уголь) Полярные (силикагель)
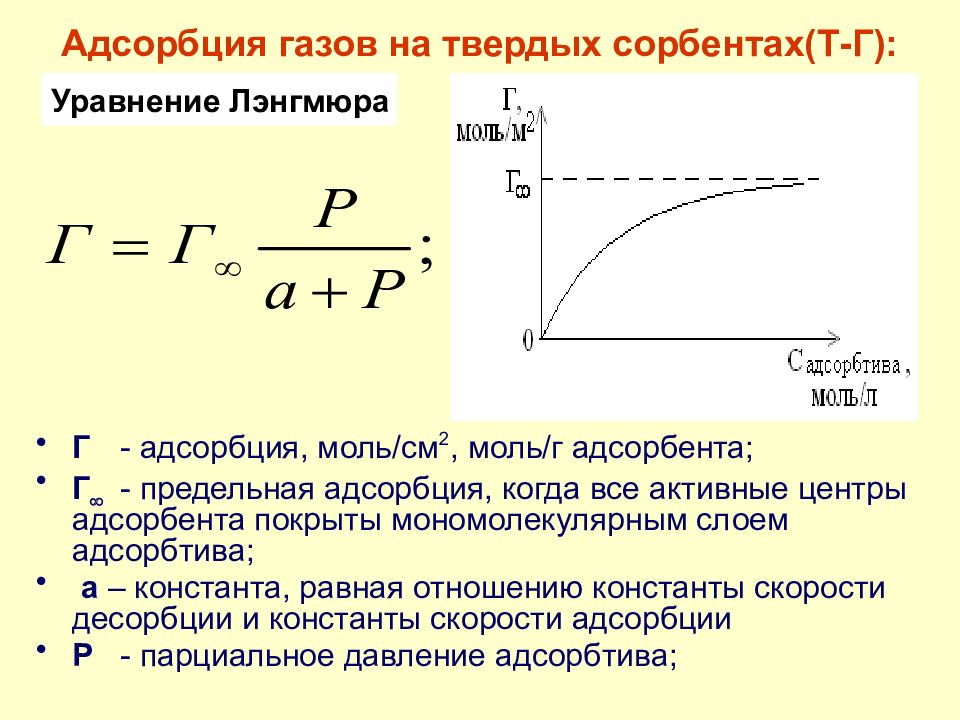
Слайд 39: Адсорбция газов на твердых сорбентах(Т-Г):
Г - адсорбция, моль/см 2, моль/г адсорбента; Г - предельная адсорбция, когда все активные центры адсорбента покрыты мономолекулярным слоем адсорбтива; а – константа, равная отношению константы скорости десорбции и константы скорости адсорбции Р - парциальное давление адсорбтива; Уравнение Лэнгмюра
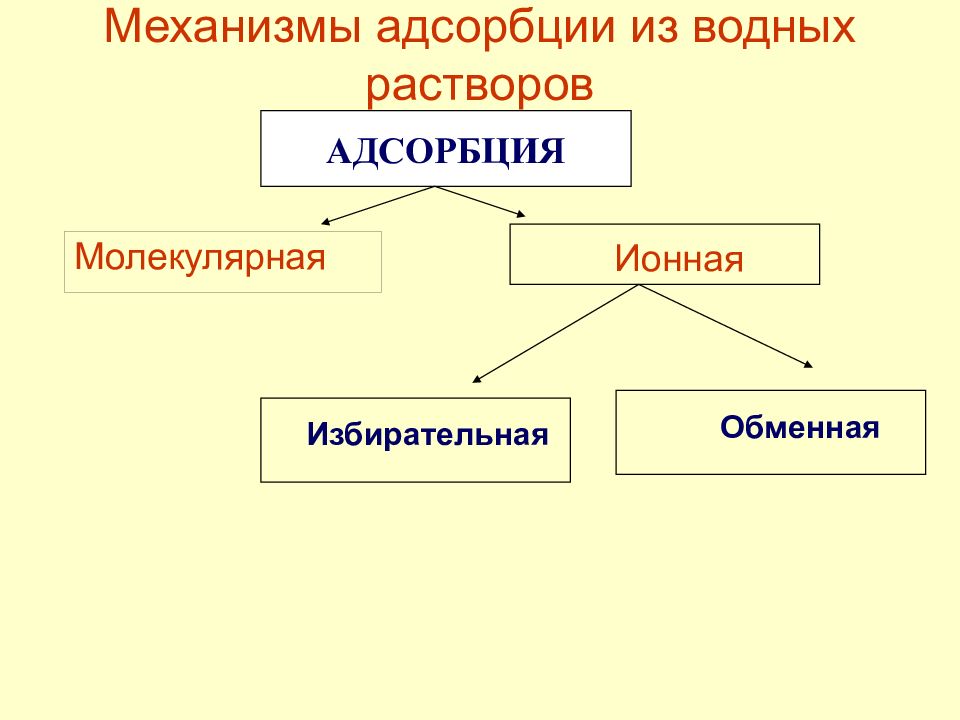
Слайд 41: Механизмы адсорбции из водных растворов
Молекулярная Ионная Обменная Избирательная АДСОРБЦИЯ
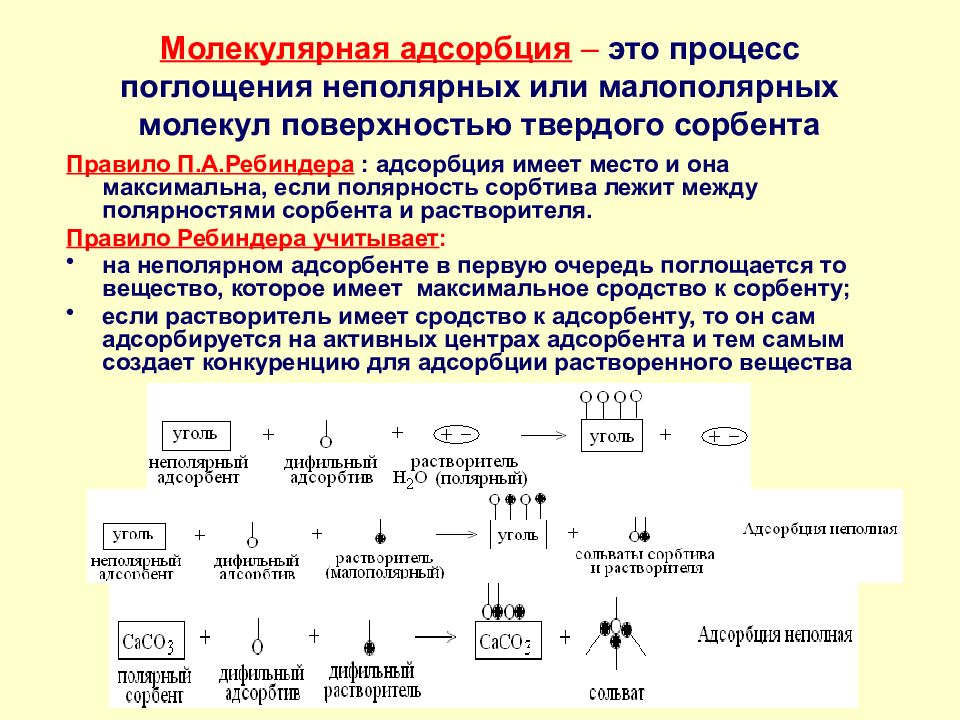
Слайд 42: Молекулярная адсорбция – это процесс поглощения неполярных или малополярных молекул поверхностью твердого сорбента
Правило П.А.Ребиндера : адсорбция имеет место и она максимальна, если полярность сорбтива лежит между полярностями сорбента и растворителя. Правило Ребиндера учитывает : на неполярном адсорбенте в первую очередь поглощается то вещество, которое имеет максимальное сродство к сорбенту; если растворитель имеет сродство к адсорбенту, то он сам адсорбируется на активных центрах адсорбента и тем самым создает конкуренцию для адсорбции растворенного вещества
Слайд 43: Ионная адсорбция – это процесс поглощения ионов электролитов на полярных адсорбентах
Избирательная - характерна для сильных электролитов и наблюдается тогда, когда адсорбция какого-либо вещества значительно превосходит адсорбцию других данным сорбентом. Избирательная адсорбция подчиняется правилу Панета-Фаянса : на поверхности твердого полярного сорбента преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки адсорбента или близкие к ним по природе и свойствам; на заряженной поверхности сорбента могут дополнительно поглощаться противоположные по знаку ионы. Схема адсорбции: Ионообменная – ионы растворенного вещества эквивалентно обмениваются на ионы того же знака из сорбента: R OH + Cl - ↔ R Cl + OH - 2 R Na + Ca 2+ ↔ R 2 Ca + 2 Na +
Слайд 44: УРОВЕНЬ теоретического ПОНИМАНИЯ МАТЕРИАЛА: 2.5. Поверхностные явления. Адсорбция
1. не слушал(а) 2. не успевал(а) вникать. Только запись 3. понимаю меньше половины 4. все понятно
Слайд 45: УРОВЕНЬ теоретического ПОНИМАНИЯ МАТЕРИАЛА: 2.6. Дисперсные системы. Физико-химические свойства
Слайд 46: Дисперсная система – это система, состоящая из дисперсной фазы ( ДФ ) дисперсионной среды ( ДС ): ДФ + ДС
Классификация дисперсных систем ДФ : Размер частиц : ГДС: > 10 -7 м, КДС: 10 -7 – 10 -9 м Истинные растворы НМС(М < 5000г/моль): 10 -10 – 10 -12 м ; ВМС(М > 5000г/моль): 10 -7 – 10 -9 м Структурные свойства : ДФ-подвижна (свободнодисперсные системы): суспензии,эмульсии, кровь, аэрозоли(туман, дым, пыль) ДФ-неподвижна (связанодисперсные): студни, волокнистые и пористые капиллярные системы, костная ткань, биологические мембраны, вещество мозга, мышцы. ДФ+ДС: Характер взаимодействия : Лиофобные (греч. «лиос» -жидкость, «фобио»-ненавижу)- слабое взаимодействие (термодинамически неустойчивы, требуется стабилизатор), Лиофильные (греч. «филио»-люблю) - сильное взаимодействие, образуются самопроизвольно, термодинамически устойчивы, стабилизатор не требуется (растворы белков, полинуклеиновых кислот) Агрегатное состояние ДФ / ДС: Т/ Т,Ж,Г, Ж/ Т,Ж,Г Г/ Т,Ж Истинные растворы – это однофазные гомогенные системы, состоящие из двух и более компонентов
Слайд 47: Факторы, влияющие на набухание:
Природа ВМС: плохо набухают полимеры с небольшой молекулярной массой и сферическими молекулами Температура: на 1ст. – выделяется тепло, поэтому процесс лучше идет при низких температурах, 2 ст. – повышение температуры способствует набуханию рН: минимальное набухание в ИЭТ Электролиты: если ионы электролитов, связывающие «свободную» воду в собственных гидратных оболочках, не адсорбируются на макромолекулах, например, F - или Li +, то они уменьшают набухание или даже дегидратируют макромолекулы. Напротив, слабо гидратирующиеся и адсорбирующиеся вместе со своими гидратными оболочками ионы, такие как I - и CNS -, увеличивают гидратацию макромолекул и благоприятствуют набуханию
Слайд 48: Физико-химические свойства студней(гелей):
Тиксотропия - способность разжижаться при механическом воздействии и самопроизвольно восстанавливать свои свойства в состоянии покоя (сотрясение мозга) Синерезис – необратимый процесс старения, который сопровождается сжатием сетки и выделением из нее растворителя (мясо старых животных плотнее) Периодические реакции- обусловлены наличием пространственной сетки, которая препятствует перемешиванию, поэтому Если образуются нерастворимые соли, то они Располагаются в виде колец(кольца Лизеганга) (слоистые камни в почках, печени и.т.д.)
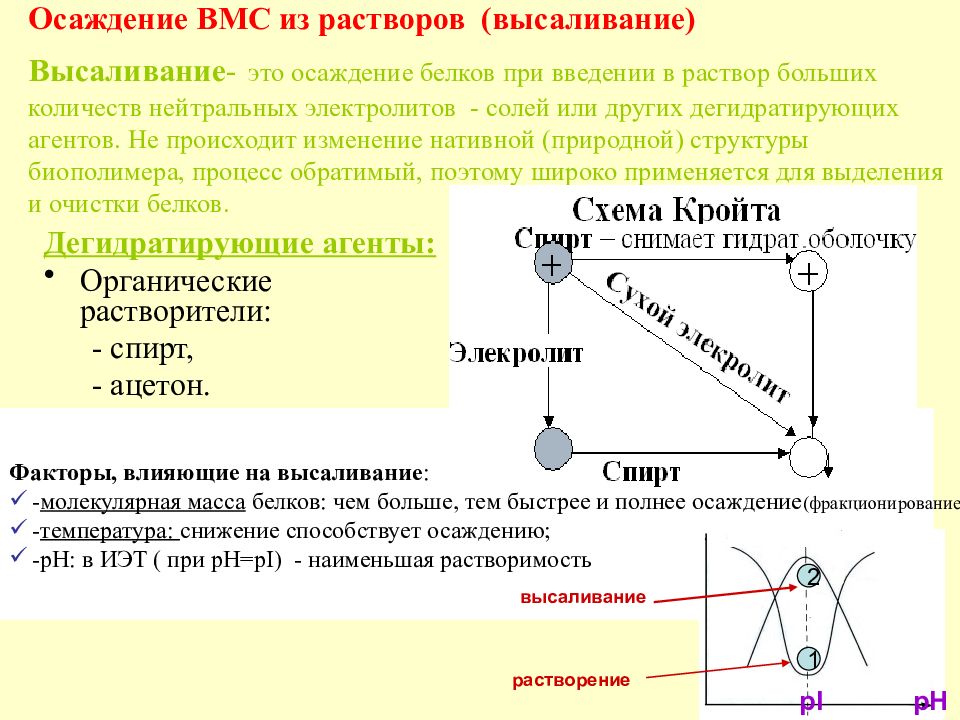
Слайд 49: Осаждение ВМС из растворов (высаливание) Высаливание - это осаждение белков при введении в раствор больших количеств нейтральных электролитов - солей или других дегидратирующих агентов. Не происходит изменение нативной (природной) структуры биополимера, процесс обратимый, поэтому широко применяется для выделения и очистки белков
Дегидратирующие агенты: Органические растворители: - спирт, - ацетон. Растворы солей Факторы, влияющие на высаливание : - молекулярная масса белков: чем больше, тем быстрее и полнее осаждение (фракционирование ) ; - температура: снижение способствует осаждению ; -рН: в ИЭТ ( при рН=р I ) - наименьшая растворимость 1 2 растворение высаливание pl pH
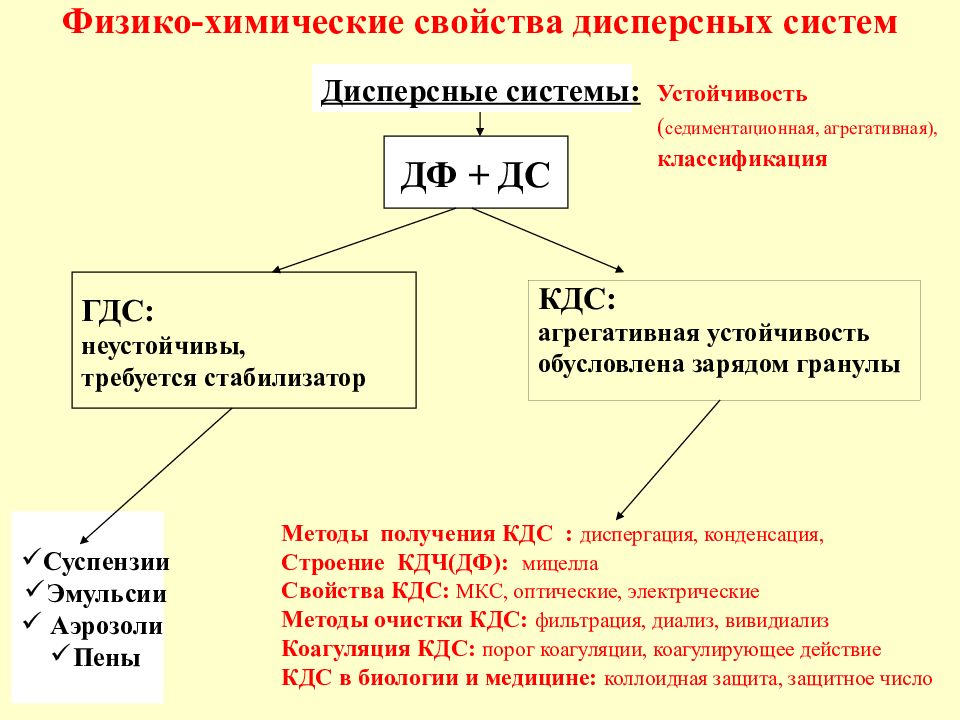
Слайд 50: Физико-химические свойства дисперсных систем
КДС: агрегативная устойчивость обусловлена зарядом гранулы ГДС: неустойчивы, требуется стабилизатор ДФ + ДС Методы получения КДС : диспергация, конденсация, Строение КДЧ(ДФ): мицелла Свойства КДС: МКС, оптические, электрические Методы очистки КДС: фильтрация, диализ, вивидиализ Коагуляция КДС: порог коагуляции, коагулирующее действие КДС в биологии и медицине: коллоидная защита, защитное число Устойчивость ( седиментационная, агрегативная), классификация Дисперсные системы: Суспензии Эмульсии Аэрозоли Пены
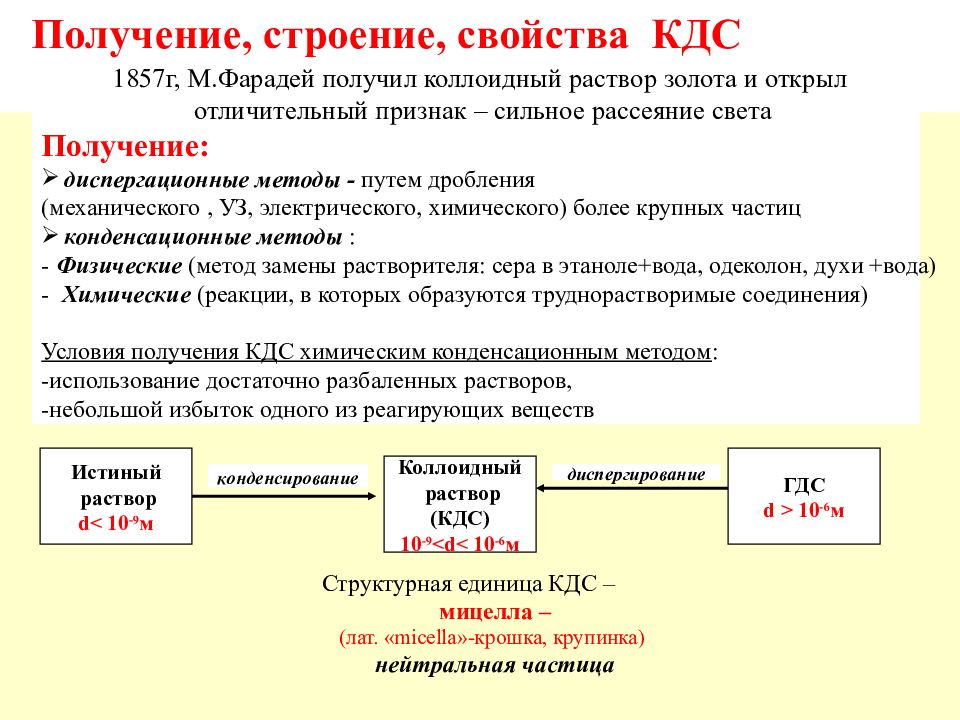
Слайд 51: Получение, строение, свойства КДС
Структурная единица КДС – мицелла – (лат. « micella »-крошка, крупинка) нейтральная частица Получение, строение, свойства КДС Получение: диспергационные методы - путем дробления (механического, УЗ, электрического, химического) более крупных частиц конденсационные методы : - Физические (метод замены растворителя: сера в этаноле+вода, одеколон, духи +вода) - Химические (реакции, в которых образуются труднорастворимые соединения) Условия получения КДС химическим конденсационным методом : -использование достаточно разбаленных растворов, -небольшой избыток одного из реагирующих веществ Истиный раствор d< 10 -9 м Коллоидный раствор (КДС) 10 -9 <d< 10 - 6 м ГДС d > 10 -6 м конденсирование диспергирование 1857г, М.Фарадей получил коллоидный раствор золота и открыл отличительный признак – сильное рассеяние света
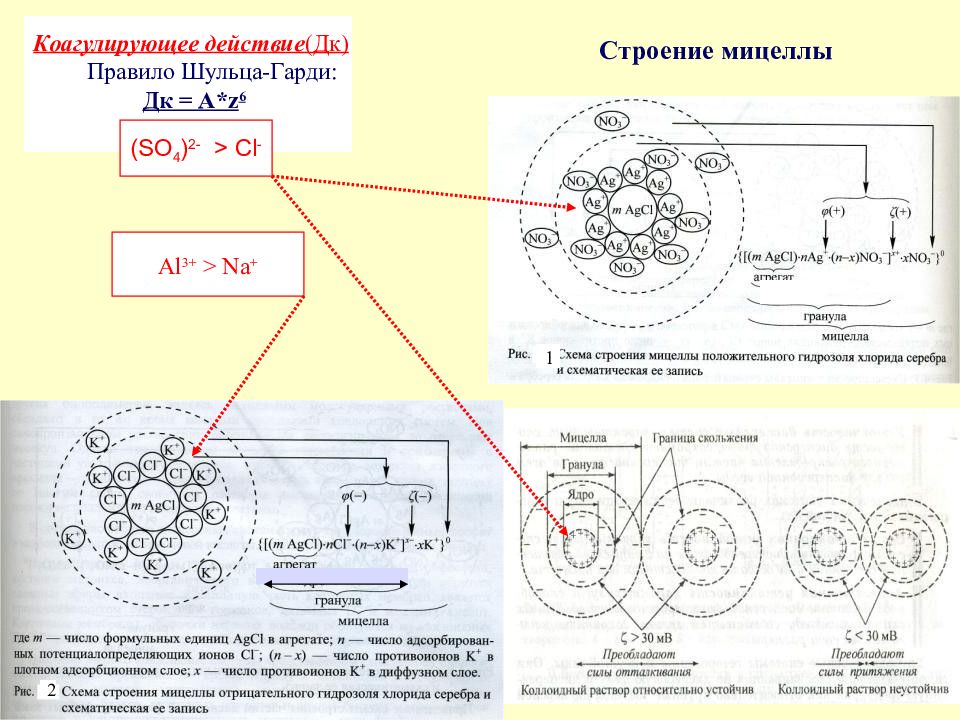
Слайд 52: Строение мицеллы
2 Коагулирующее действие (Дк) Правило Шульца-Гарди: Дк = А* z 6 (SO 4 ) 2- > Cl - Al 3+ > Na + 1
Слайд 53: Физико-химические свойства дисперсных систем
Коллигативные свойства – это свойства дисперсных систем, которые зависят от концентрации, величины и формы частиц, но не зависят от природы частиц дисперсной фазы
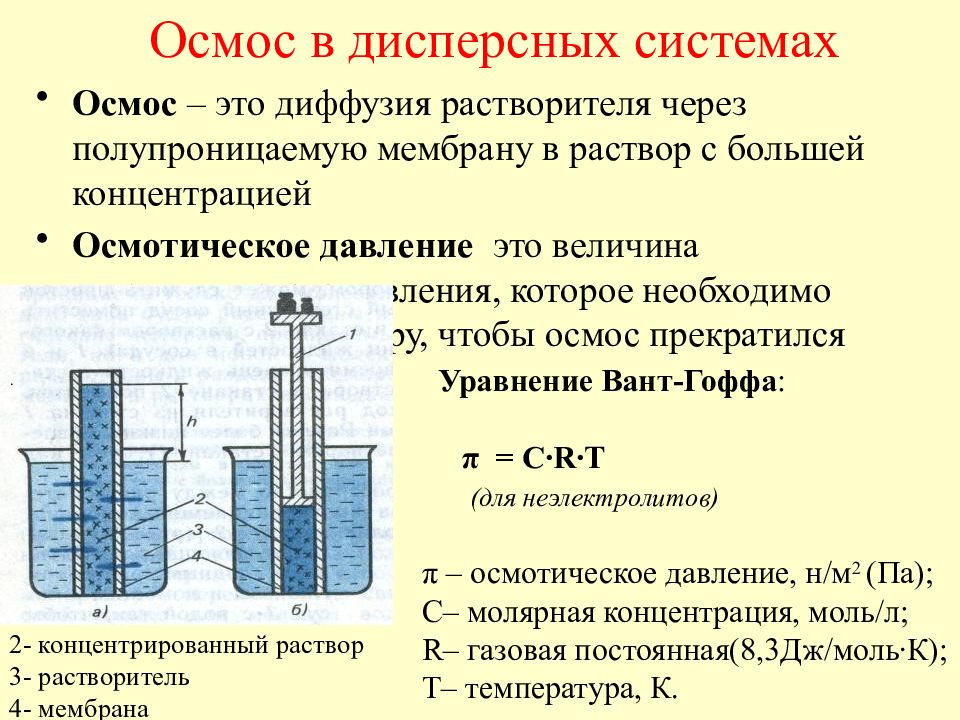
Слайд 54: Осмос в дисперсных системах
Осмос – это диффузия растворителя через полупроницаемую мембрану в раствор с большей концентрацией Осмотическое давление это величина гидравлического давления, которое необходимо приложить к раствору, чтобы осмос прекратился Осмос в дисперсных системах 2- концентрированный раствор 3- растворитель 4- мембрана Уравнение Вант-Гоффа : π = C ∙R∙T (для неэлектролитов) π – осмотическое давление, н/м 2 (Па); С– молярная концентрация, моль/л; R – газовая постоянная(8,3Дж/моль∙К); Т– температура, К. . .
Слайд 55
π = i ∙C∙R∙T i = 1 + α ( n – 1) i - изотонический коэффициент α – степень ионизации электролита n – число частиц, которые образуются при ионизации Для электролитов:
Слайд 56: Закон Рауля : относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества
Кипение и замерзание растворов. Закон Рауля. Следствия из закона Рауля ΔР = Ро - Р Ро > Р
Слайд 57: Следствия из закона Рауля :
Второе Для неэлектролитов: Δ t зам. = Ккр. ∙ b, для электролитов: Δ t зам. = i ∙Kкр. ∙ b, Δ t зам. – понижение температуры замерзания (иногда называют депрессией); i – изотонический коэффициент; Ккр. – криоскопическая константа, К∙кг∙моль-1 Первое Для неэлектролитов: Δ t кип. = Кэб∙ b, для электролитов: Δ t кип. = i K эб.∙ b, b – моляльная концентрация растворенного вещества, моль/кг; i – изотонический коэффициент, K эб. – эбулиоскопическая константа,К∙кг∙моль-1
Слайд 58: УРОВЕНЬ ПОНИМАНИЯ теоретического МАТЕРИАЛА: 2.6. Дисперсные системы. Физико-химические свойства
1. не слушал(а) 2. не успевал(а) вникать. Только запись 3. понимаю меньше половины 4. все понятно
Слайд 59: УРОВЕНЬ теоретического ПОНИМАНИЯ МАТЕРИАЛА: 2.7. Электрохимические методы исследования в медицине и санитарии
Электрохимические методы исследования : потенциометрия и кондуктометрия. Эти методы используются в медицине для определения различных метаболитов, рН биологических жидкостей, в санитарии – для токсикологического контроля и анализа воды (питьевой, для инъекций, очищенной).
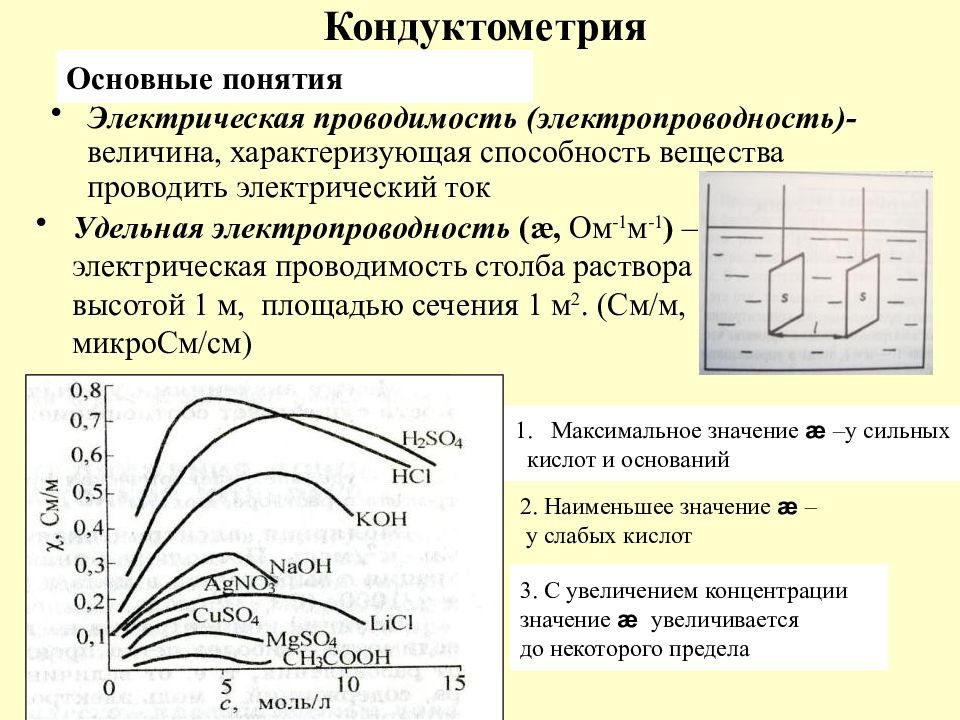
Слайд 60: Кондуктометрия
Электрическая проводимость (электропроводность)- величина, характеризующая способность вещества проводить электрический ток Основные понятия Удельная электропроводность (æ, Ом -1 м -1 ) – электрическая проводимость столба раствора высотой 1 м, площадью сечения 1 м 2. (См/м, микроСм/см) Максимальное значение æ –у сильных кислот и оснований 2. Наименьшее значение æ – у слабых кислот 3. С увеличением концентрации значение æ увеличивается до некоторого предела
Слайд 61
Предельная молярная электрическая проводимость иона – это количество электричества, перенесенное 1 моль ионов данного типа в бесконечно разбавленном растворе в однородном электрическом поле напряженностью 1В/м через поперечное сечение раствора площадью 1м 2 за 1 с. λ К = u к *z*q*N a = u к *z*F = 96500*u к *z U – предельная подвижность иона, м 2 /(В с) ; Z - заряд иона ; q= 1,6 *10 -19 Кл – величина элементарного заряда ; Na = 6,02*10 23 моль -1 число Авогадро ; F= 96 500 Кл/моль – число Фарадея Закон Кольрауша: предельная молярная электрическая проводимость данного электролита равна сумме предельных молярных проводимостей ионов, входящих в его состав λ ∞ = λ К + λ А
Слайд 63: Потенциометрия- физико-химический метод анализа, позволяющий определять активности(концентрации) ионов на основании измерения э.д.с. гальваническо цепи, состоящей из электрода сравнения и электрода определения, опущенных в исследуемый раствор
Классификация электродов по назначению: Стандартные или электроды сравнения Индикаторные или электроды определения
Слайд 64: Механизмы возникновения потенциалов
Электродный Окислительно-восстановительный (редокс - потенциал) Диффузионный Мембранный Электрические явления при химических реакциях. Потенциометрия
Слайд 66: УРОВЕНЬ ПОНИМАНИЯ теоретического МАТЕРИАЛА: 2.7. Электрохимические методы исследования в медицине и санитарии
1. не слушал(а) 2. не успевал(а) вникать. Только запись 3. понимаю меньше половины 4. все понятно
Слайд 67: 3. СЧИТАЕТЕ ЛИ ВЫ НЕОБХОДИМЫМ ПРИМЕНЕНИЕ МУЛЬТИМЕДИЙНЫХ СРЕДСТВ В ЛЕКЦИЯХ:
1. да, лекция должна быть полностью в виде презентации 2. нет, традиционная форма «мел-доска» лучше 3. сочетание: слайды и традиционная форма «мел-доска»