Первый слайд презентации: Растворы и их свойства
твердые (сплавы), жидкие (раствор сахара в воде), газообразные (воздух). Классификация растворов по размерам растворенных частиц: истинный растворы (~ 1 нм), Колойдные растворы (1-100 нм), Грубодисперсные (>100 нм).
Слайд 3: Образование растворов
Процесс растворения – обратимый процесс раствор называется насыщенным – скорость кристаллизации равна скорости растворения, Концентрация насыщенного раствора – мера растворимости (определяется в граммах растворенного вещества в ста граммах растворителя). Не существует абсолютно нерастворимых веществ.
Слайд 4: Растворители:
Вода универсальный и самый распространенный растворитель в неорганической химии; Также используют безводные жидкий NH 3, HF, SO 2, CS 2, H 2 SO 4, HCl.
Слайд 5: Правило:
Подобное растворяется в подобном. Минимальная (наименьшая) растворимость солей наблюдается при отношении радиусов катиона и аниона соли раной 0,7 – 1,1
Слайд 6: Закон Генри
Согласно Генри У. (1803 г.) растворимость газа: где K – коэффициент пропорциональности зависящий от природы газа, растворителя и температуры.
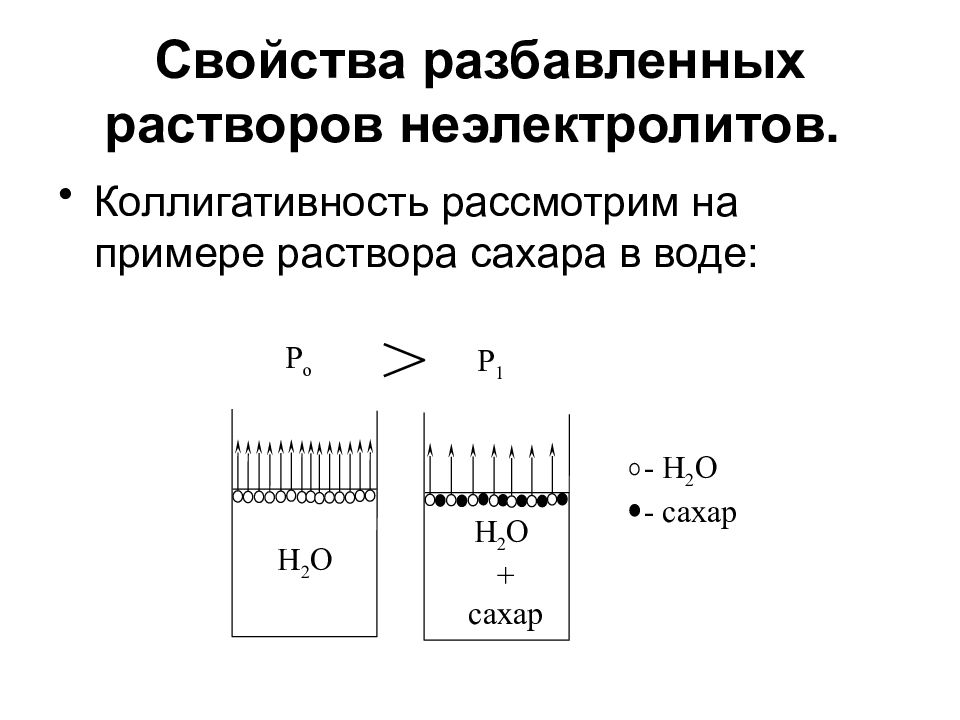
Слайд 7: Свойства разбавленных растворов неэлектролитов
Коллигативность рассмотрим на примере раствора сахара в воде: H 2 O P o H 2 O + сахар P 1 - H 2 O - сахар
Слайд 8: Обозначения:
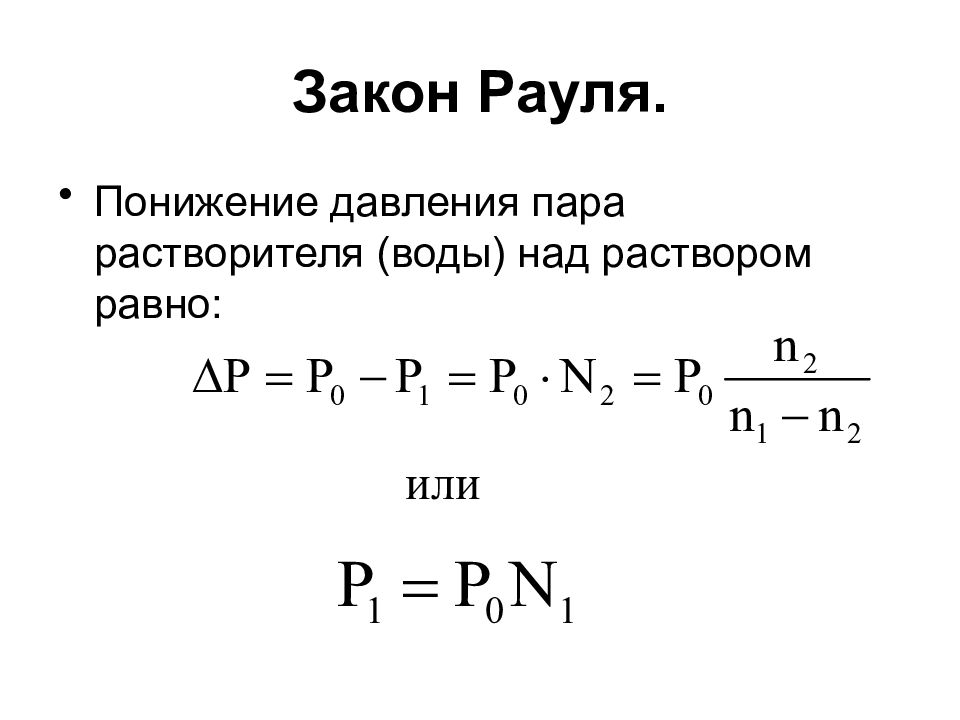
P 1 - парциальное (индивидуальное) давление насыщенного пара над раствором, P o – давление насыщенного пара над чистым растворителем. N 1 – мольная доля растворителя ( H 2 O ), N 2 – мольная доля растворенного вещества (сахара), n 1 – масса растворителя в граммах, n 2 – масса растворенного вещества в граммах.
Слайд 9: Закон Рауля
Понижение давления пара растворителя (воды) над раствором равно: или
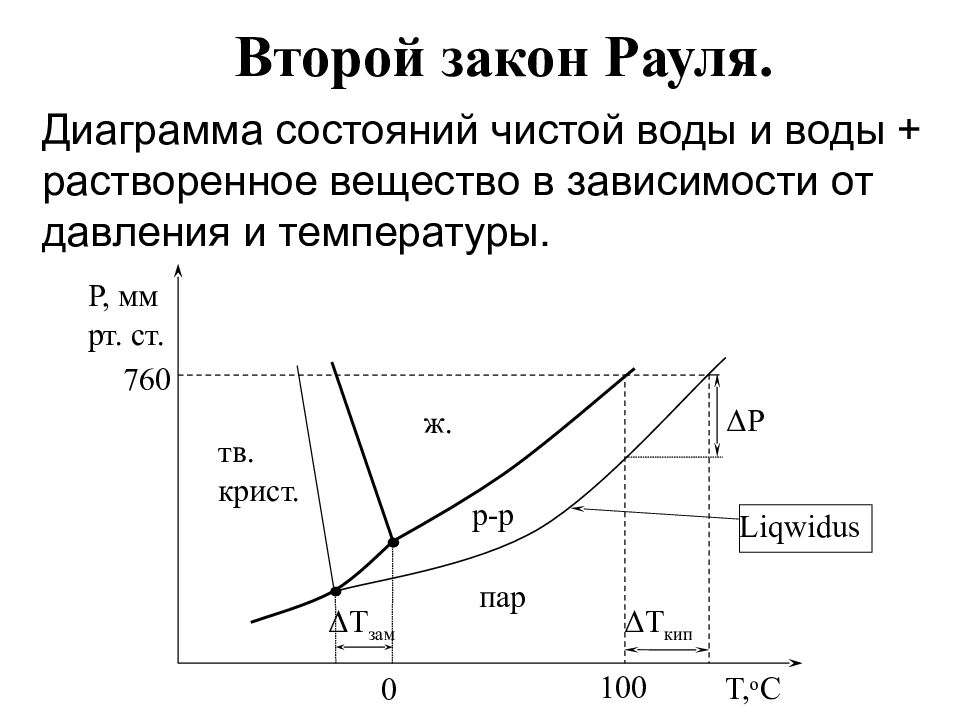
Слайд 10: Второй закон Рауля
Диаграмма состояний чистой воды и воды + растворенное вещество в зависимости от давления и температуры. Δ T зам Δ T кип T, о С 100 0 Δ P тв. крист. 760 P, мм рт. ст. ж. пар Liqwidus р-р
Слайд 11: Второй закон Рауля
Второй закон Рауля для процесса кипения выражается формулой: где E – эбуллиоскопическая константа растворителя, C m – моляльная концентрация растворенного вещества. Второй закон Рауля.
Слайд 12: Второй закон Рауля
Понижение температуры замерзания (кристаллизации) раствора определяется формулой: Второй закон Рауля. где K – криоскопическая постоянная растворителя, где g 1, g 2 – масса растворителя и вещества соответственно в граммах, M 2 – молекулярная масса растворенного вещества.
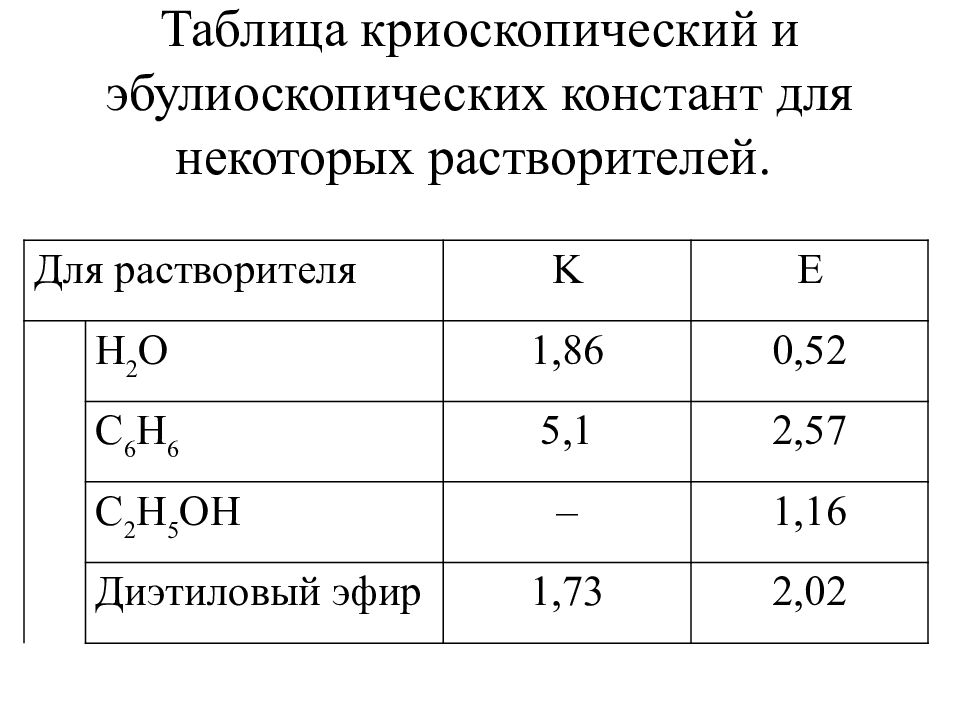
Слайд 13: Таблица криоскопический и эбулиоскопических констант для некоторых растворителей
Для растворителя K E H 2 O 1, 86 0,52 C 6 H 6 5,1 2,57 C 2 H 5 OH – 1,16 Диэтиловый эфир 1,73 2,02
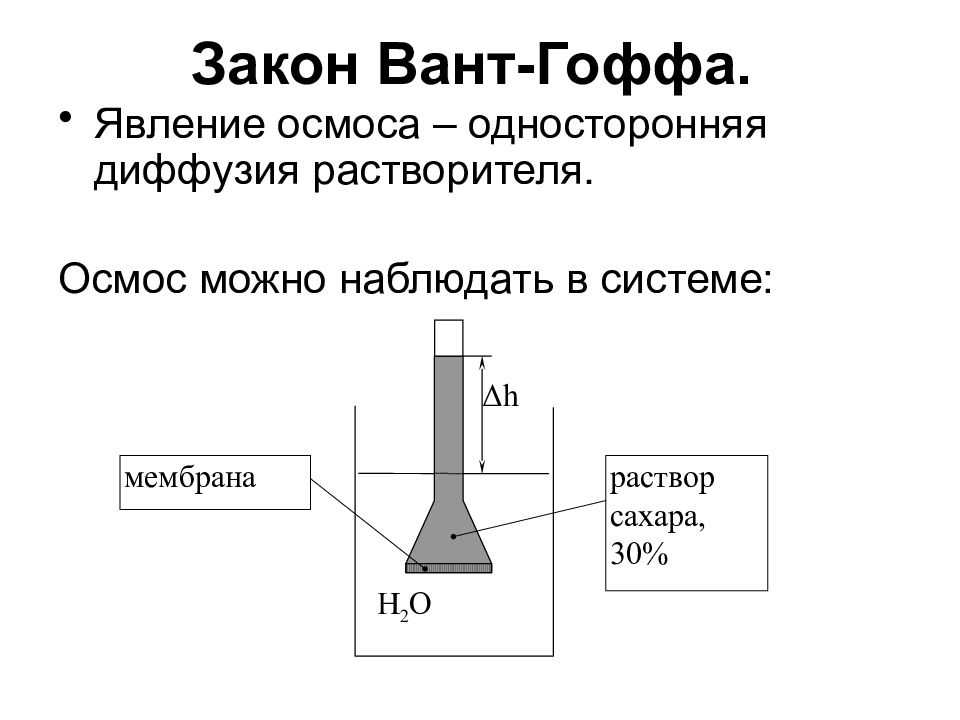
Слайд 14: Закон Вант-Гоффа
Явление осмоса – односторонняя диффузия растворителя. Осмос можно наблюдать в системе: H 2 O Δ h мембрана раствор сахара, 30%
Слайд 15
Закон для идеальных газов: Вант-Гофф преобразовал в уравнение: где π – осмотическое давление, C M – молярная концентрация, R = 8,31 Дж/моль·К, T – температура К, n – число молей растворенного вещества, V – объем раствора.
Слайд 16
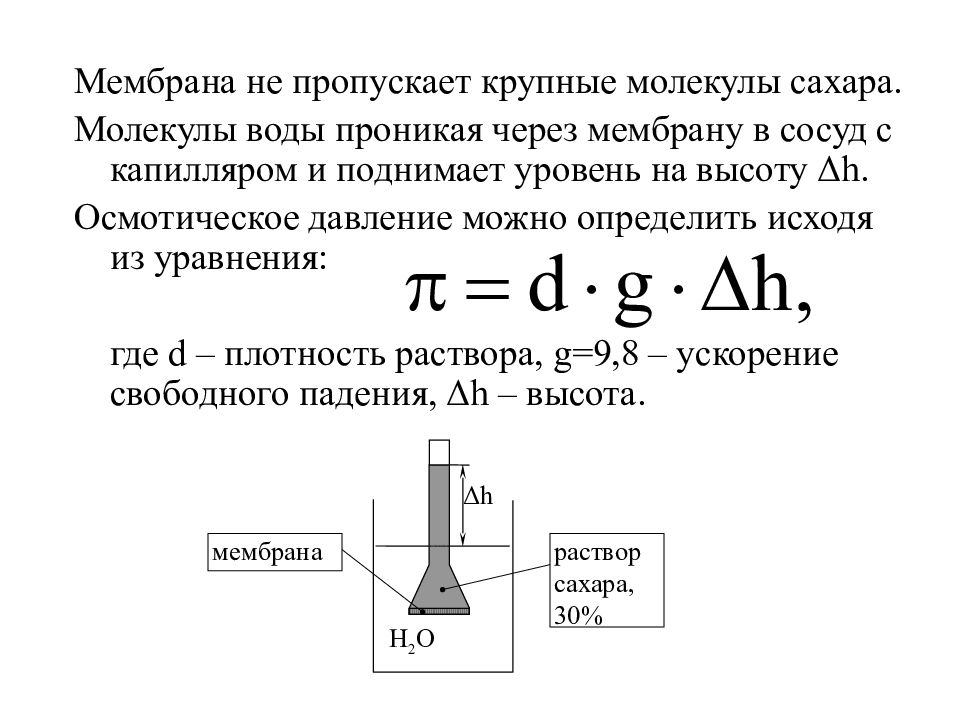
Мембрана не пропускает крупные молекулы сахара. Молекулы воды проникая через мембрану в сосуд с капилляром и поднимает уровень на высоту Δ h. Осмотическое давление можно определить исходя из уравнения: где d – плотность раствора, g =9,8 – ускорение свободного падения, Δ h – высота. H 2 O Δ h мембрана раствор сахара, 30%
Слайд 17: Электролитическая диссоциация
Электролиты — вещества, которые в водном растворе или расплаве существуют в виде ионов: катионов и анионов. Растворы и расплавы электролитов проводят электрический ток. К электролитам относятся кислоты, щелочи и соли. Распад электролитов на ионы при растворении в воде или расплавлении называется электролитической диссоциацией.
Слайд 18: Теория электролитической диссоциации создана великим шведским ученым Сванте Аррениусом (1887)
Согласно этой теории электролиты при растворении в воде (или расплавлении) распадаются на ионы:
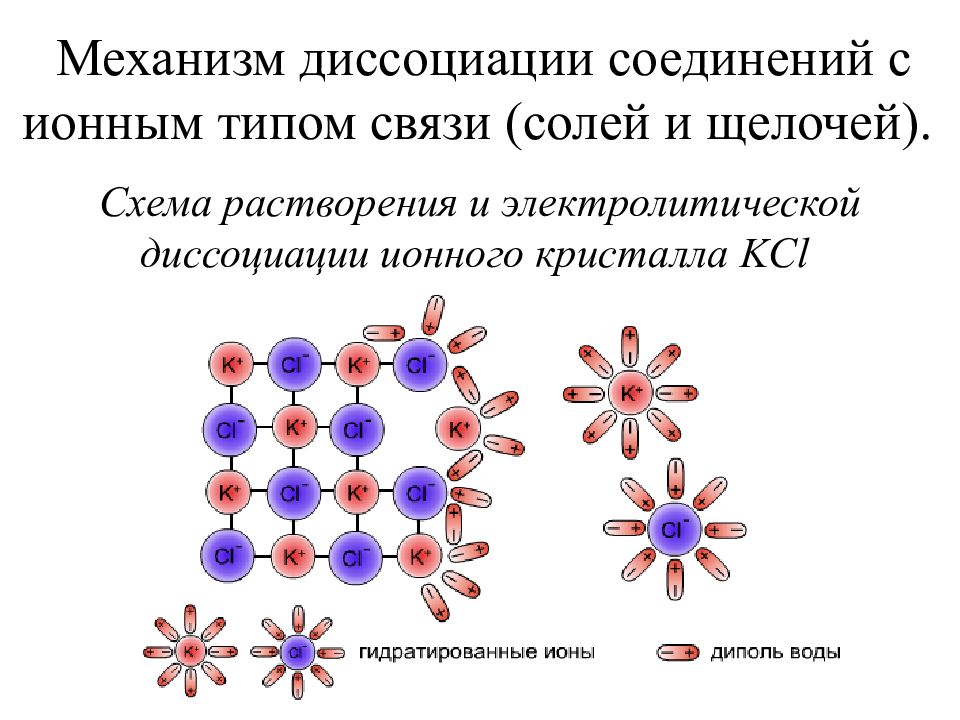
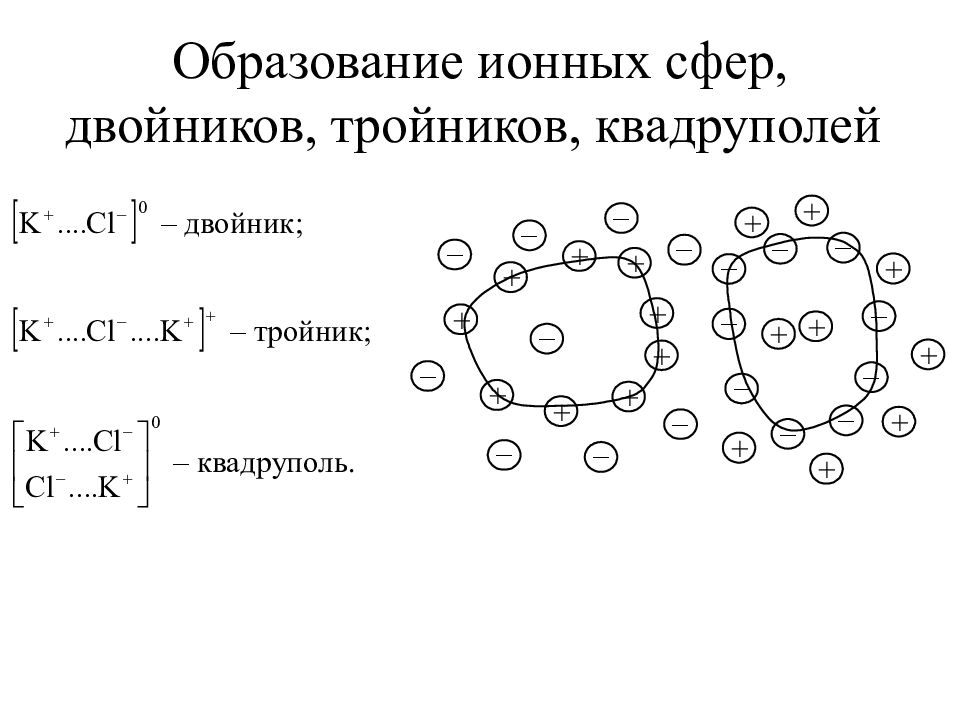
Слайд 19: Механизм диссоциации соединений с ионным типом связи (солей и щелочей)
Схема растворения и электролитической диссоциации ионного кристалла KCl
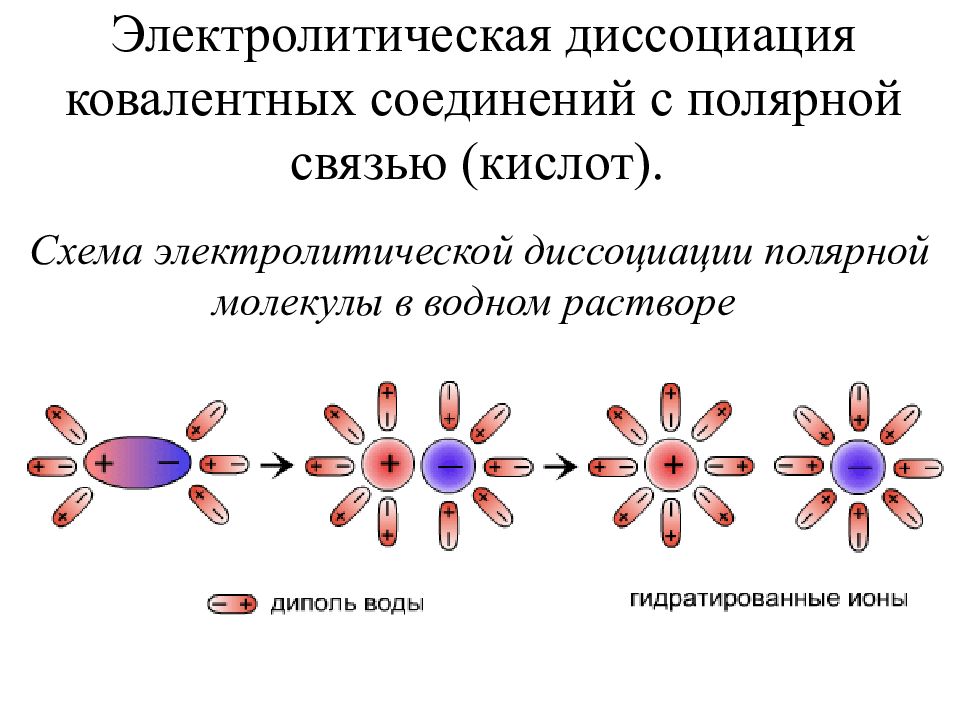
Слайд 20: Электролитическая диссоциация ковалентных соединений с полярной связью (кислот)
Схема электролитической диссоциации полярной молекулы в водном растворе
Слайд 21
Вант-Гофф 1877 г. установил, что при измерении осматического давления, температуры замерзания и кипения электролитов не совпадает с расчетными выше указанными уравнениями. Вант-Гофф ввел поправочный коэффициент – i и назвал его изотонический коэффициент.
Слайд 22: Законы, описывающие общие физические свойства растворов неэлектролитов и электролитов
Слайд 23: При полной диссоциации электролитов изотонический коэффициент приближается к значению равному числу ионов в молекуле:
Слайд 24: Исследования коэффициента i
при сильном разбавлении для KCl i =1,85 ≠ 2 SrCl 2 i =2,5 ≠ 3 CH 3 COOH i =1,05 ≠ 2
Слайд 25: Недостаток теории Аррениуса
Аррениус рассматривал раствор электролита как механическую смесь из молекул растворителя, ионов и молекул электролита, не учитывалось взаимодействие между частицами. Дальнейшее развитие теории электролитической диссоциации отражено в работах И. А. Каблукова, Нернста, Хюккеля и др.
Слайд 27: Сильные и слабые электролиты
Электролиты условно делят на две группы: сильные и слабые, средней силы. Сильные электролиты: почти все соли, щелочи, некоторые кислоты (HCl, HBr, HI, HNO 3, H 2 SO 4, HClO 4 и др.) Слабые и средние электролиты: HF, HCN, HClO, H 2 S, CH 3 COOH, раствор аммиака NH 3 и др.
Слайд 28: Количественная характеристика силы электролита - степень электролитической диссоциации ( α )
N дис - число молекул распавшихся на ионы N о - общее число молекул введенных в раствор (или расплав).
Слайд 29
Для неэлектролитов диссоциация полностью отсутствует, α = 0. К сильным электролитам относятся электролиты, где α>30%, к слабым α<5% и к средним 5%<α<30%. Пример: для CH 3 COOH α=1,4%. Это значит что из 1000 молекул уксусной кислоты 14 распалось на ионы. CH 3 COOH ↔ CH 3 COO – + H + Степень электролитической диссоциации зависит от природы электролита, его концентрации и температуры раствора. С разбавлением раствора и ростом температуры увеличивается степень электролитической диссоциации.
Слайд 30
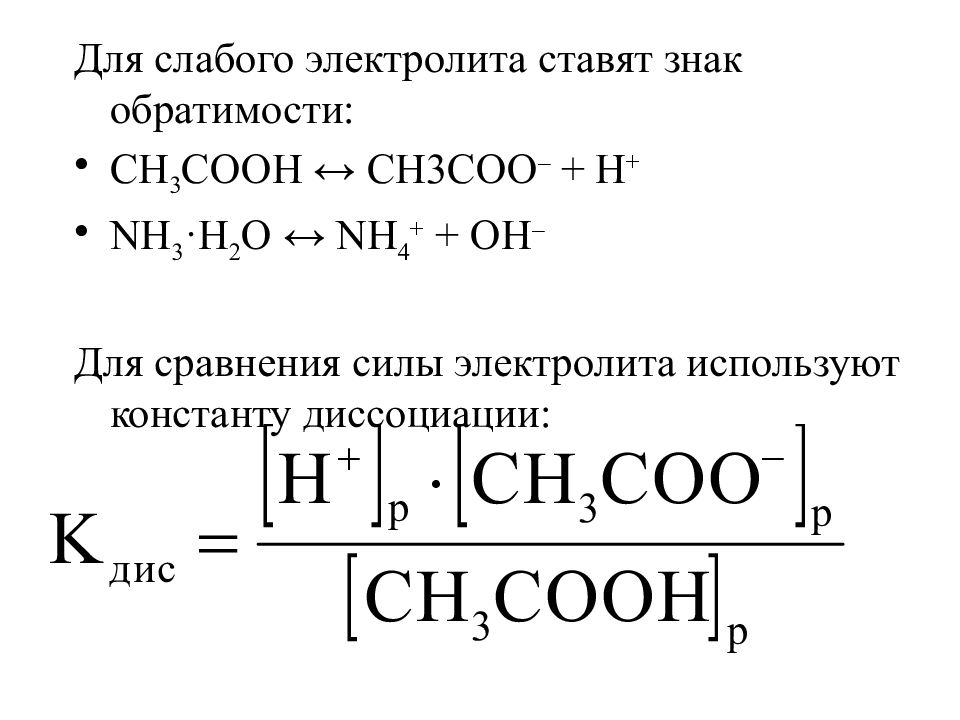
Для слабого электролита ставят знак обратимости: CH 3 COOH ↔ CH3COO – + H + NH 3 ·H 2 O ↔ NH 4 + + OH – Для сравнения силы электролита используют константу диссоциации:
Слайд 31
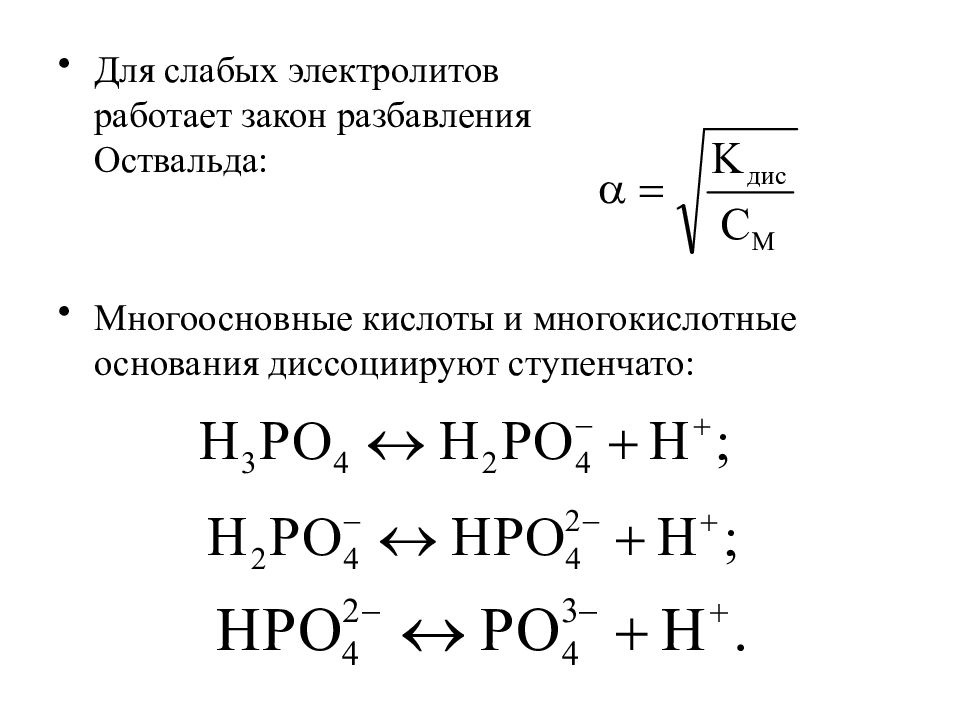
Для слабых электролитов работает закон разбавления Оствальда: Многоосновные кислоты и многокислотные основания диссоциируют ступенчато:
Слайд 32: Сильные электролиты
Сильные электролиты диссоциируют теоретически на 100%. Для записи процесса диссоциации сильного электролита в уравнении обычно ставят одну стрелку:
Слайд 33: Константа диссоциации для сильных электролитов выражается через активность
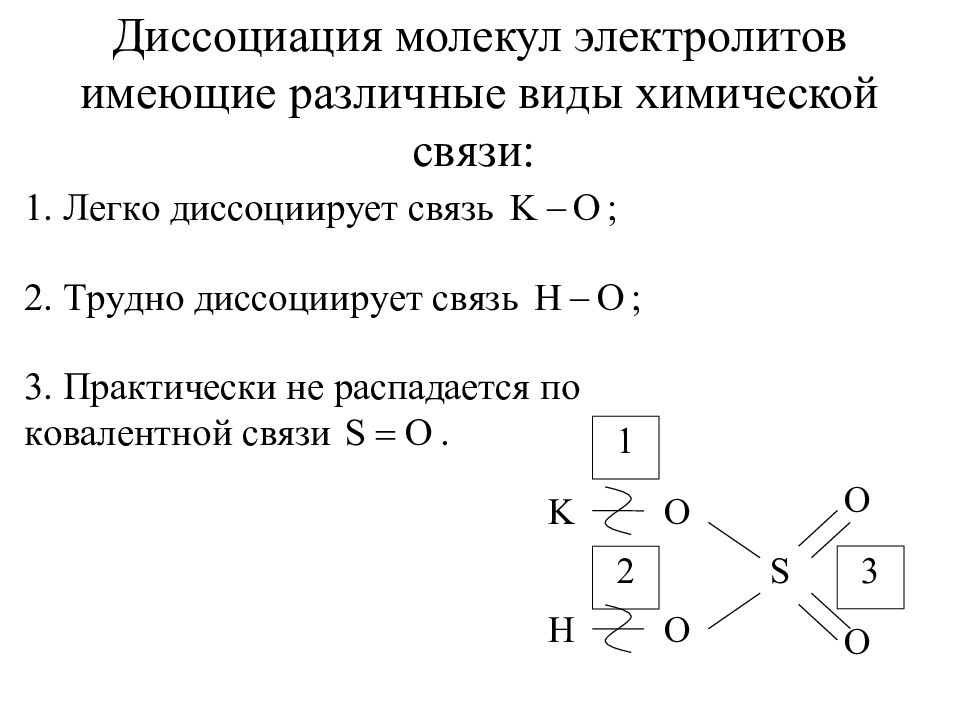
Слайд 35: Диссоциация молекул электролитов имеющие различные виды химической связи:
S K H O O O O 1 2 3
Слайд 36: Влияние диэлектрической проницаемости растворителя на распределение ионов в растворе:
вода – этиловый спирт – По закону Кулона: распределение ионов в воде и следовательно диссоциация в воде будет сильнее, чем в спирте.