Первый слайд презентации: Растворы. Теория электролитической диссоциации
Слайд 2: Растворы (дисперсные системы )
Раствор – это однофазная система переменного, или гетерогенного, состава, состоящая из двух или более компонентов.
Слайд 3: Растворение
Растворение — переход молекул вещества из одной фазы в другую. Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества.
Слайд 4: Растворение
При растворении межфазная граница исчезает, при этом меняются физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие).
Слайд 5: Дисперсная система, фаза, среда
Дисперсная система - гетерогенные системы, в которых одна из фаз находится в дисперсном (раздробленном состоянии). Дисперсной фазой, называется растворенное вещество Дисперсионной средой (растворитель) - вещество, в котором распределена дисперсная фаза.
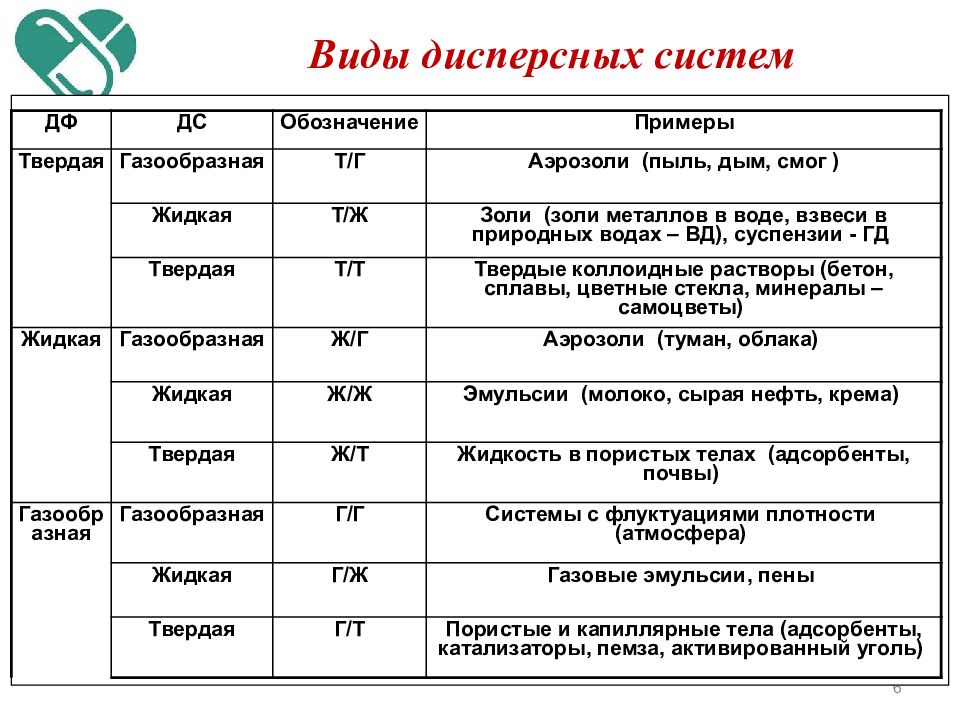
Слайд 6
6 Виды дисперсных систем ДФ ДС Обозначение Примеры Твердая Газообразная Т/Г Аэрозоли (пыль, дым, смог ) Жидкая Т/Ж Золи (золи металлов в воде, взвеси в природных водах – ВД), суспензии - ГД Твердая Т/Т Твердые коллоидные растворы (бетон, сплавы, цветные стекла, минералы – самоцветы) Жидкая Газообразная Ж/Г Аэрозоли (туман, облака) Жидкая Ж/Ж Эмульсии (молоко, сырая нефть, крема) Твердая Ж/Т Жидкость в пористых телах (адсорбенты, почвы) Газообразная Газообразная Г/Г Системы с флуктуациями плотности (атмосфера) Жидкая Г/Ж Газовые эмульсии, пены Твердая Г/Т Пористые и капиллярные тела (адсорбенты, катализаторы, пемза, активированный уголь)
Слайд 7: По величине частиц дисперсной фазы растворы разделяют на:
Грубодисперсные системы(взвеси) – это гетерогенные системы (неоднородные). Размеры частиц этой фазы от 10⁻⁵ до 10⁻⁷м. Не устойчивы и видны невооруженным глазом (суспензии, эмульсии, пены, порошки).
Слайд 8: По величине частиц дисперсной фазы растворы разделяют на:
Коллоидные растворы (тонкодисперсные системы или золи) – это микрогетерогенные системы. Размер частиц от 10⁻⁷ до 10⁻⁹м. Частицы уже не видны невооруженным глазом, система не устойчивая. В зависимости от природы дисперсионной среды золи называют гидрозолями – дисперсионная среда – жидкость, аэрозолями – дисперсионная среда воздух.
Слайд 9: По величине частиц дисперсной фазы растворы разделяют на:
Истинные растворы. Размеры частиц составляют 10ˉ 8 см (менее 1 нм), т.е. равны размерам молекул и ионов. Они не видны невооруженным глазом. Системы - гомогенные. (растворы сахара, спирта, неэлектролитов, электролитов и слабых электролитов).
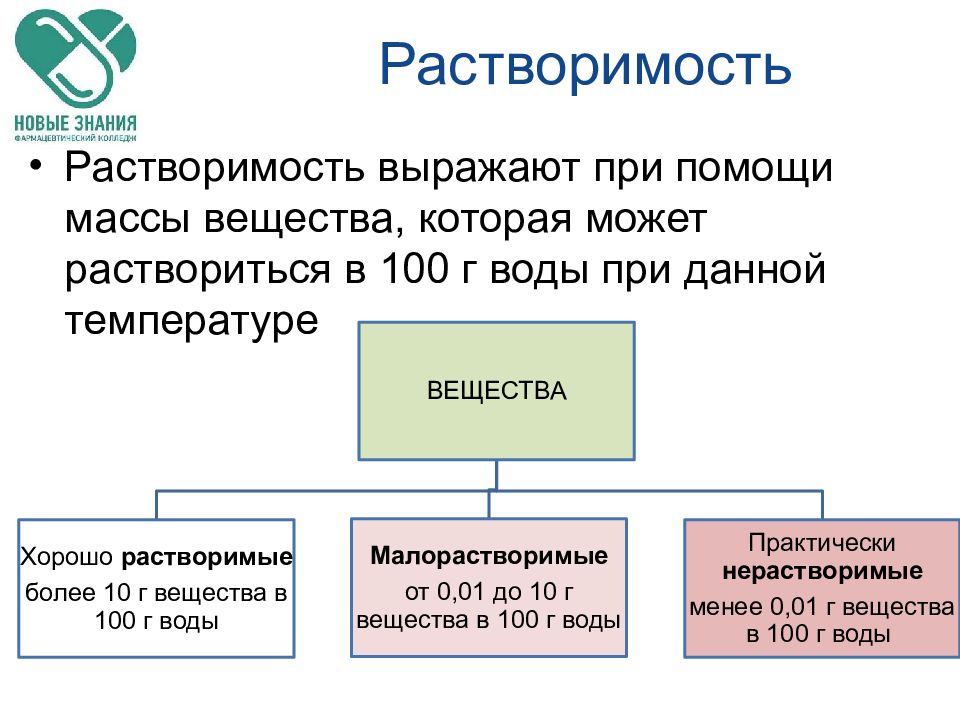
Слайд 10: Растворимость
Растворимость выражают при помощи массы вещества, которая может раствориться в 100 г воды при данной температуре
Слайд 11: Растворимость
Если молекулы растворителя неполярны или малополярны, то этот растворитель будет хорошо растворять вещества с неполярными молекулами. Хуже будет растворять с большей полярностью. И практически не будет с ионным типом связи.
Слайд 12: Растворители
К полярным растворителям относят воду и глицерин. К малополярным спирт и ацетон. К неполярным хлороформ, эфир, жиры, масла.
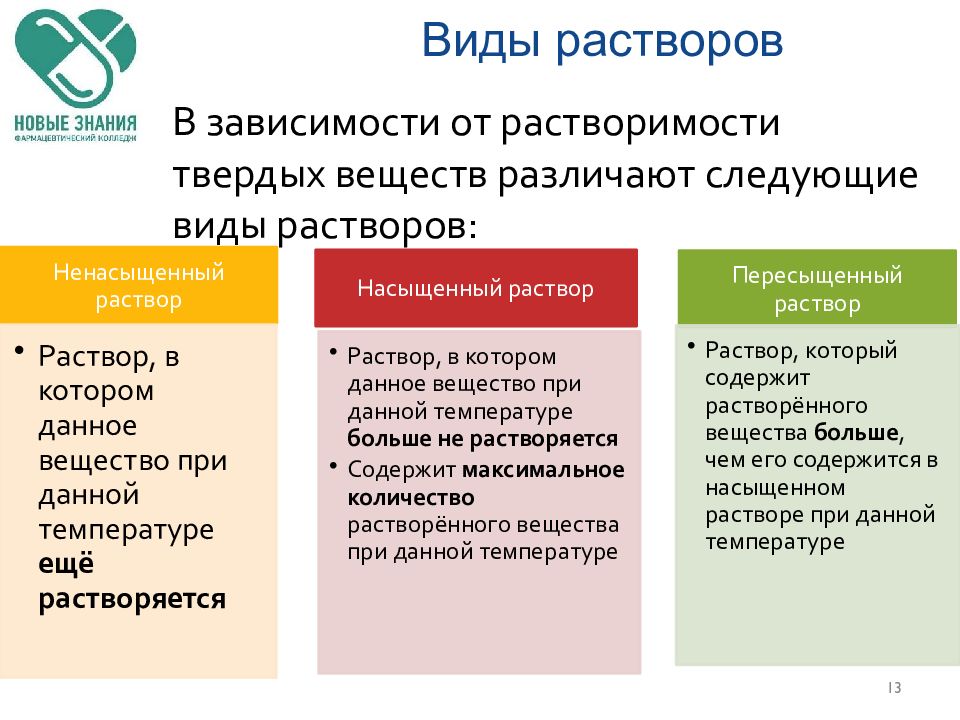
Слайд 13: Виды растворов
13 В зависимости от растворимости твердых веществ различают следующие виды растворов:
Слайд 15
Д а н о: m(р-ра) = 100 г; m(ВаСl 2 ) = 20 г. Найти: w%(ВаСl 2 ) Решение: w(BaCl2)=m(ВаСl 2 )/m(р-ра)=20г/100г=0,2 или 20% Ответ: w%(ВаСl 2 )=0,2 или 20% Типовая задача № 1. В растворе массой 100 г содержится хлорид бария массой 20 г. Какова массовая доля хлорида бария в растворе?
Слайд 16
Д а н о: m(H 2 O) = 20 г; m(сахара) = 5 г. Найти: w%(сахара) Решение: 1. m(р-ра)=m(сахара)+m(H 2 O)=20г+5г=25г 2. w(сахара)=m(сахара)/m(р-ра)=5г/25г=0,2 или 20% Ответ: w%(сахара)=0,2 или 20% Типовая задача № 2. Сахар массой 5 г растворили в воде массой 20 г. Какова массовая доля (%) сахара в растворе?
Слайд 17: Гидратная теория Менделеева
Сольватация – процесс взаимодействия молекул растворителя и растворяемого вещества. Сольватация в водных растворах называется гидратацией. В результате чего образуются молекулярные агрегаты - гидраты.
Слайд 19: Кристаллогидраты
Молекулы воды из гидратной оболочки иногда могут вступать в химическую реакцию с растворенным веществом, образуя уже настоящее химическое соединение с постоянным составом, которые можно выделить из раствора, осторожно упаривая воду. Эти соединения называются кристаллогидратами. 19
Слайд 20: Кристаллогидраты солей
20 – твердые соли, в состав ионных кристаллов которых входят молекулы воды Кристалл CuSO 4 •5H 2 O Глауберова соль Na 2 SO 4 • 10 H 2 O Кристаллогидраты солей
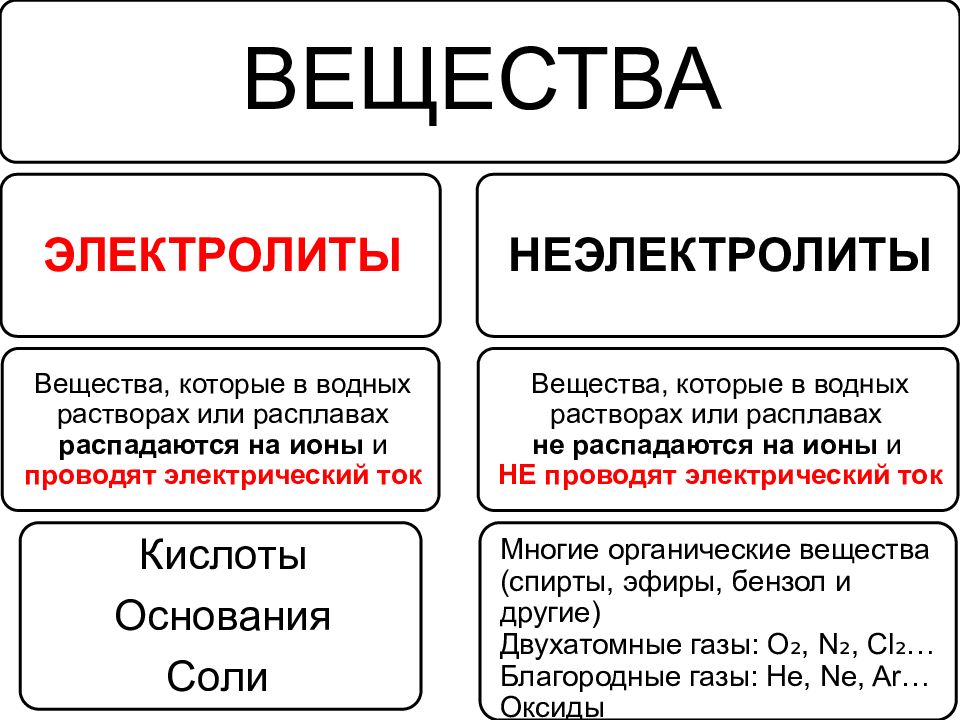
Слайд 22: Электролиты. Неэлектролиты
По способности проводить электрический ток в водном растворе или в расплаве все вещества можно разделить на электролиты и неэлектролиты.
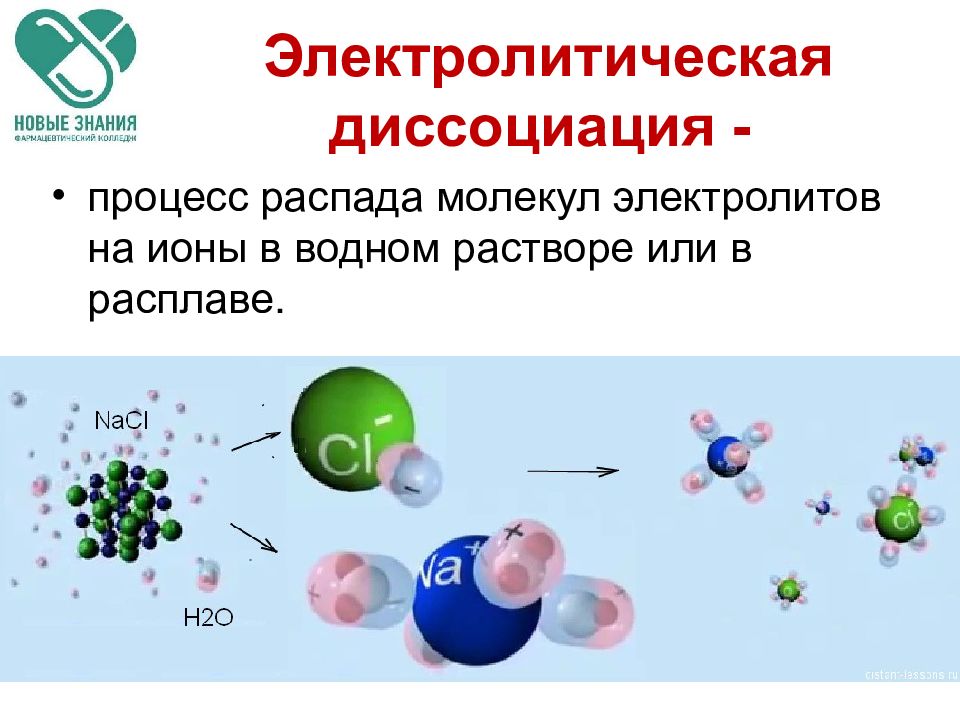
Слайд 24: Электролитическая диссоциация -
процесс распада молекул электролитов на ионы в водном растворе или в расплаве.
Слайд 25: Основные положения ТЭД
1. Молекулы электролитов диссоциируют на положительно заряженные ионы ( катионы ) и отрицательно заряженные ионы ( анионы ). NaOH = Na + + OH - катион анион Молекула
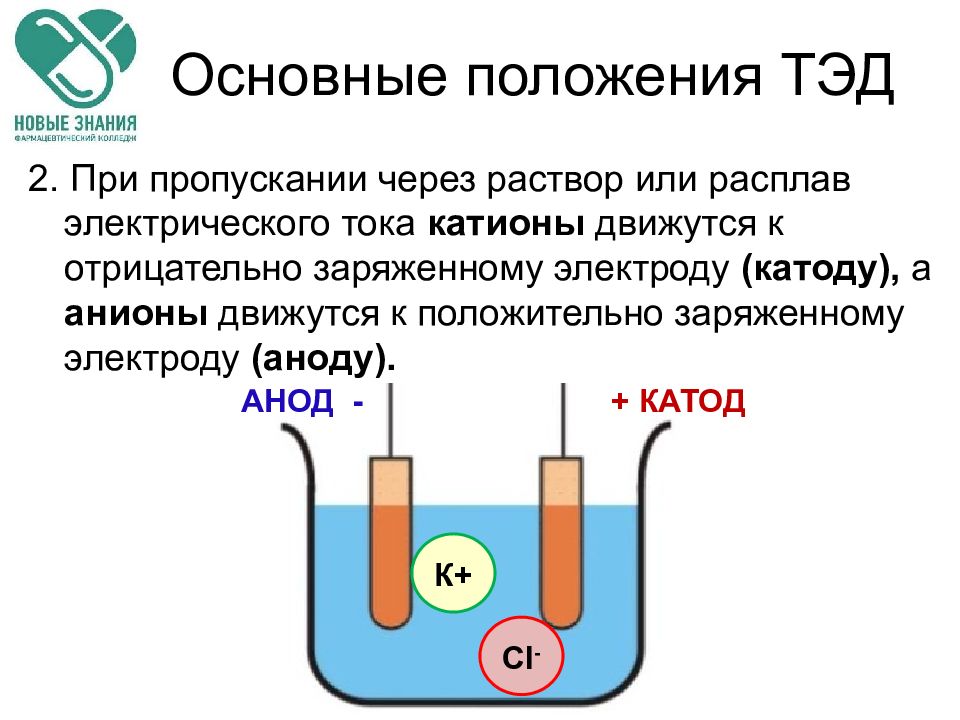
Слайд 26: Основные положения ТЭД
2. При пропускании через раствор или расплав электрического тока катионы движутся к отрицательно заряженному электроду (катоду), а анионы движутся к положительно заряженному электроду (аноду). АНОД - + КАТОД Cl - К+
Слайд 27: Основные положения ТЭД
Диссоциация многих электролитов — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация или диссоциация) и соединение ионов в молекулы (ассоциация или моляризация ).
Слайд 28: Уравнение диссоциации
Диссоциацию молекул электролитов выражают уравнениями, в которых ставят знак обратимости ( ). Пример, уравнение диссоциации азотистой кислоты HNO 2 записывается таким образом: ионизация (диссоциация) Н NO 2 H + + NO 2 - моляризация (ассоциация)
Слайд 29: Уравнение диссоциации
Общая сумма зарядов катионов равна общей сумме зарядов анионов, так как растворы и расплавы электронейтральны. NaOH = Na + + OH - CaCl 2 = Ca 2+ + 2Cl -
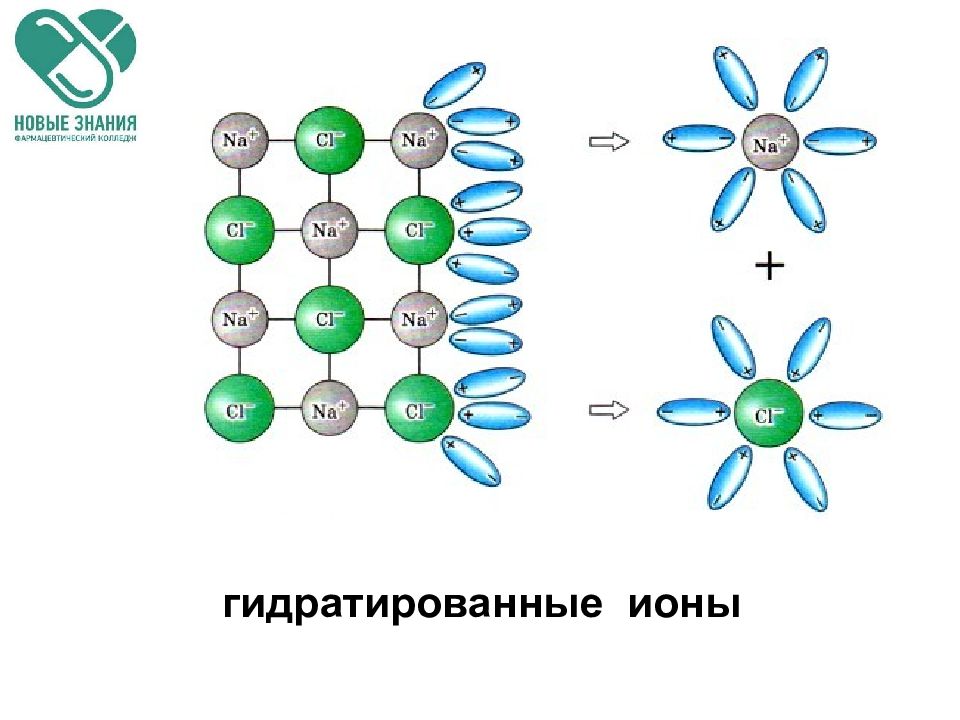
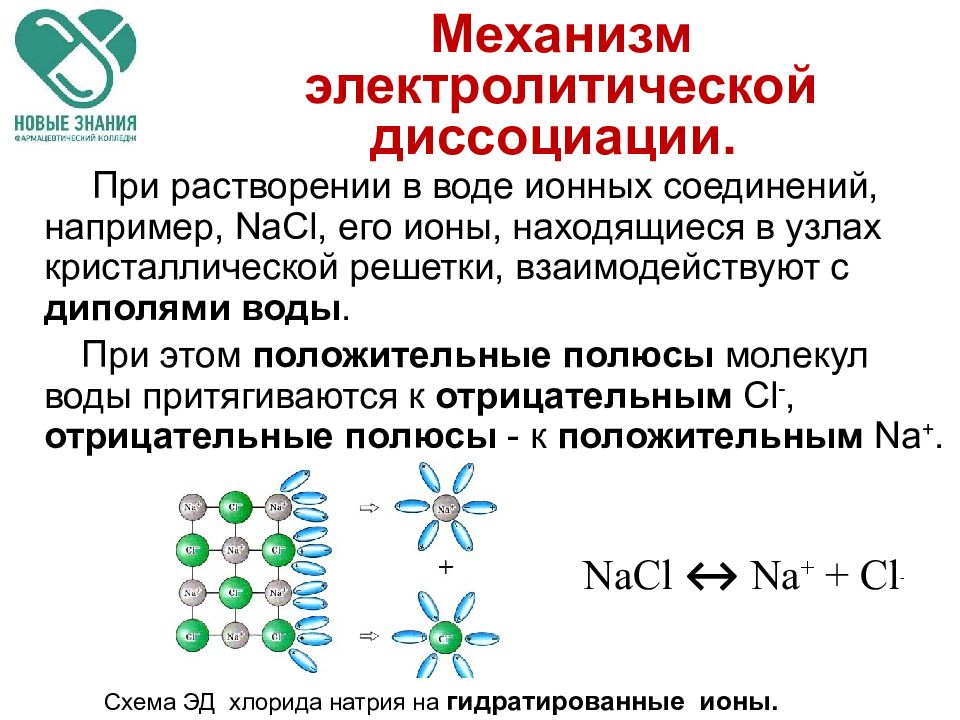
Слайд 30: Механизм электролитической диссоциации
При растворении в воде ионных соединений, например, NaCl, его ионы, находящиеся в узлах кристаллической решетки, взаимодействуют с диполями воды. При этом положительные полюсы молекул воды притягиваются к отрицательным С l -, отрицательные полюсы - к положительным Na +. NaCl ↔ Na + + Cl - Схема ЭД хлорида натрия на гидратированные ионы.
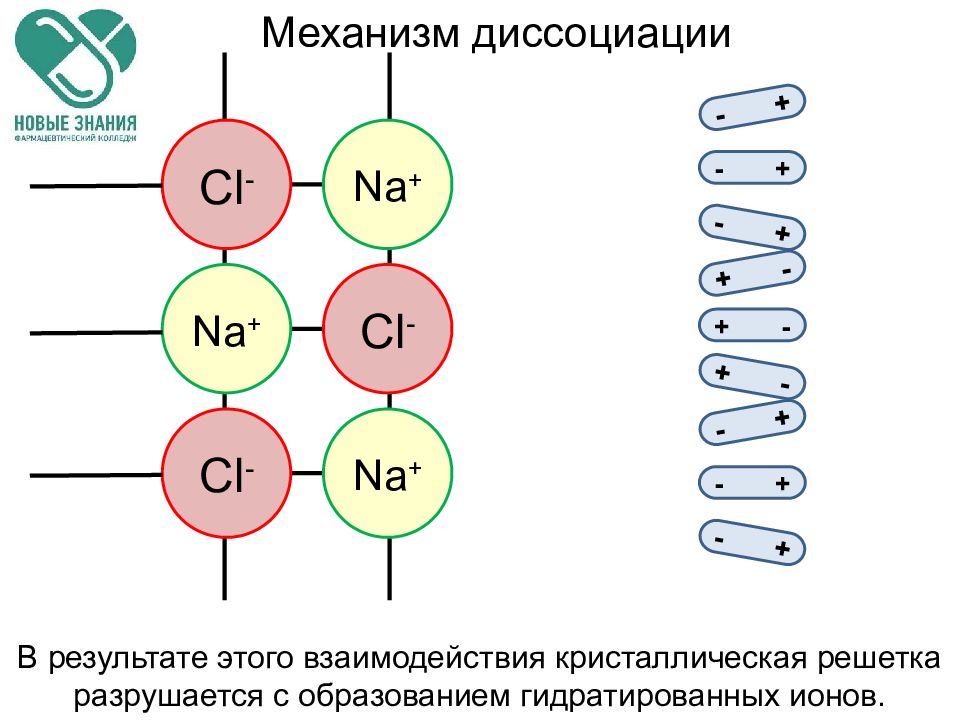
Слайд 31
Cl - Cl - Cl - Na + Na + Na + - + - + - + + - + - + - - + - + - + Механизм диссоциации В результате этого взаимодействия кристаллическая решетка разрушается с образованием гидратированных ионов.
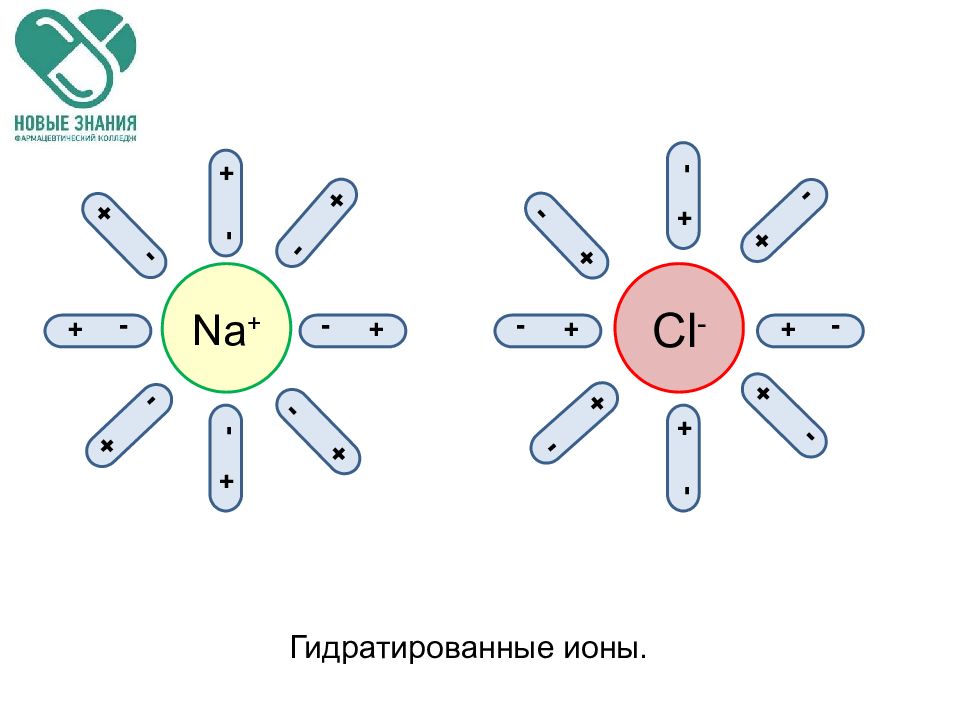
Слайд 32
Na + Cl - - + - + + - + - + - + - - + - + - + - + - + - + - + - + - + - + Гидратированные ионы.
Слайд 33: Степень диссоциации (ионизации)
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично. Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита используют понятие «степень электролитической диссоциации».
Слайд 34: Степень диссоциации (ионизации)
Степень электролитической диссоциации равна отношению числа молекул, которые распались на ионы, к общему числу растворенных молекул электролита: где n - число молекул, распавшихся на ионы; N - общее число растворенных молекул. ά = n * 100% N
Слайд 35: Степень диссоциации (ионизации)
Степень диссоциации зависит от природы растворителя природы растворенного вещества. Например, молекулы серной кислоты H 2 SO 4 хорошо диссоциируют в воде, слабее в этаноле и совсем не диссоциируют в бензоле.
Слайд 36
Сильные электролиты — это такие электролиты, для которых степень диссоциации в водных растворах равна = 1 (100%). К сильным электролитам относятся: Практически все соли; 2. Кислоты - HNO 3, H 2 SO 4, HMnO 4, H 2 Cr 2 О 7, HI, HBr, НС l, H 2 Cr О 4 ; 3. Щелочи- L iOH, NaOH, KOH, CsOH, RbOH, Ca ( OH ) 2, Sr ( OH ) 2, Ba ( OH ) 2. Электролиты
Слайд 37
Слабые электролиты — это такие электролиты, для которых степень диссоциации в водных растворах меньше << 1 (100 %). К слабым электролитам относятся: 1. Слабые кислоты - HNO 2, H 2 CO 3, H 2 Si О 3, H 3 PO 4 2. Слабые малорастворимые в воде основания и амфотерные гидроксиды : Fe ( OH ) 2 Fe ( OH ) 3 Cu ( OH ) 2 Pb ( OH ) 2, A 1( OH ) 3 ; 3. Вода Н 2 О. 4. NH 4 OH. 5. Большинство органических кислот Электролиты
Слайд 38: Диссоциация электролитов
Диссоциация сильных электролитов – необратимый процесс Диссоциация слабых электролитов -обратимый процесс H 3 PO 4 H + +H 2 PO 4 - ( 1 ступень) LiOH = Li + + OH -
Слайд 39: Диссоциация оснований
Применим o только к водным растворам!!! Основание - электролит, который диссоциирует в водном растворе с образованием гидроксид-иона и катиона металла основание ↔ катион металла+ гидроксид-ион Свойства оснований определяет гидроксид-ион OH⁻ 39 NaOH = Na + + OH - KOH = К + + OH -
Слайд 40: Диссоциация кислот
Применим o только к водным растворам!!! Кислота – электролит, который диссоциирует в водном растворе с образованием катиона водорода и аниона кислотного остатка: кислота ↔ катион водорода + анион кислотного остатка Свойства кислот определяет ион водорода H ⁺ 40 HCl = H + +Cl - H 2 SO 4 = 2 H + + SO 4 2-
Слайд 41: Диссоциация солей
Соли - это электролиты, диссоциирующие в водном растворе на катион металла и анион кислотного остатка. кислота ↔ катион металла + анион кислотного остатка Средние соли диссоциируют в одну ступень. Ca(NO 3 ) 2 → Ca 2+ + 2NO 3 – Кислые и основные соли диссоциируют ступенчато: KHCO 3 ↔ K + + HCO 3 – (первая ступень) HCO 3 – ↔ H + + CO 3 2– (вторая ступень). ( ZnOH) 2 SO 4 ↔ 2ZnOH + + SO 4 2– ( первая ступень); ZnOH + ↔ Zn 2+ + OH – ( вторая ступень). 41
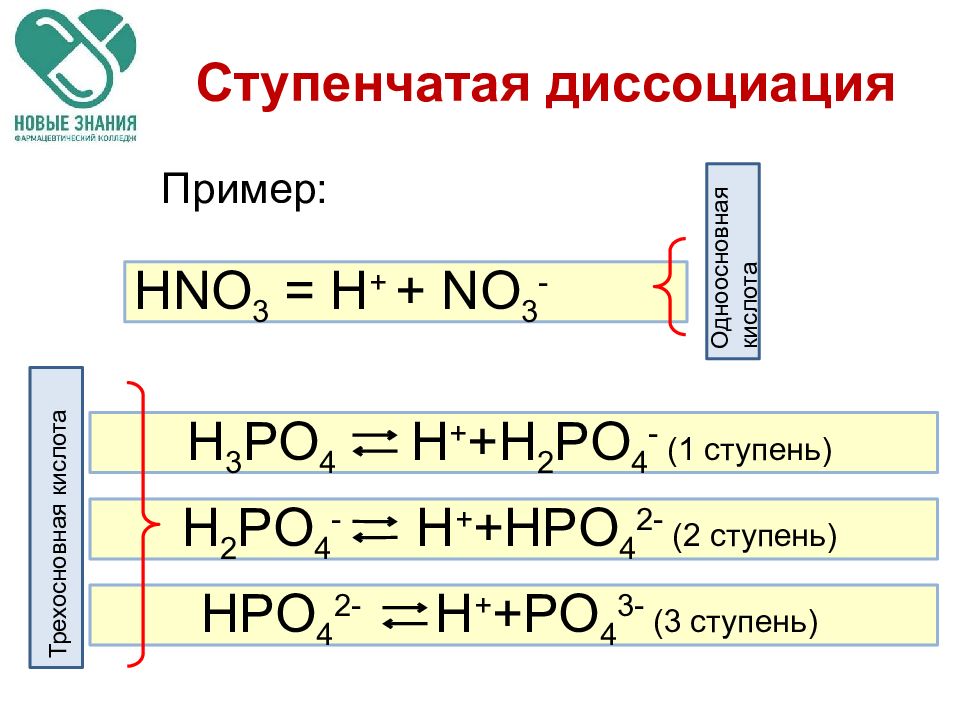
Слайд 42
HNO 3 = H + + NO 3 - Ступенчатая диссоциация Пример: H 3 PO 4 H + +H 2 PO 4 - ( 1 ступень) H 2 PO 4 - H + +HPO 4 2 - ( 2 ступень) HPO 4 2- H + +PO 4 3 - ( 3 ступень) Одноосновная кислота Трехосновная кислота
Слайд 43: Реакции ионного обмена
- Реакции, протекающие в растворах электролитов и не сопровождающиеся изменением степеней окисления элементов.
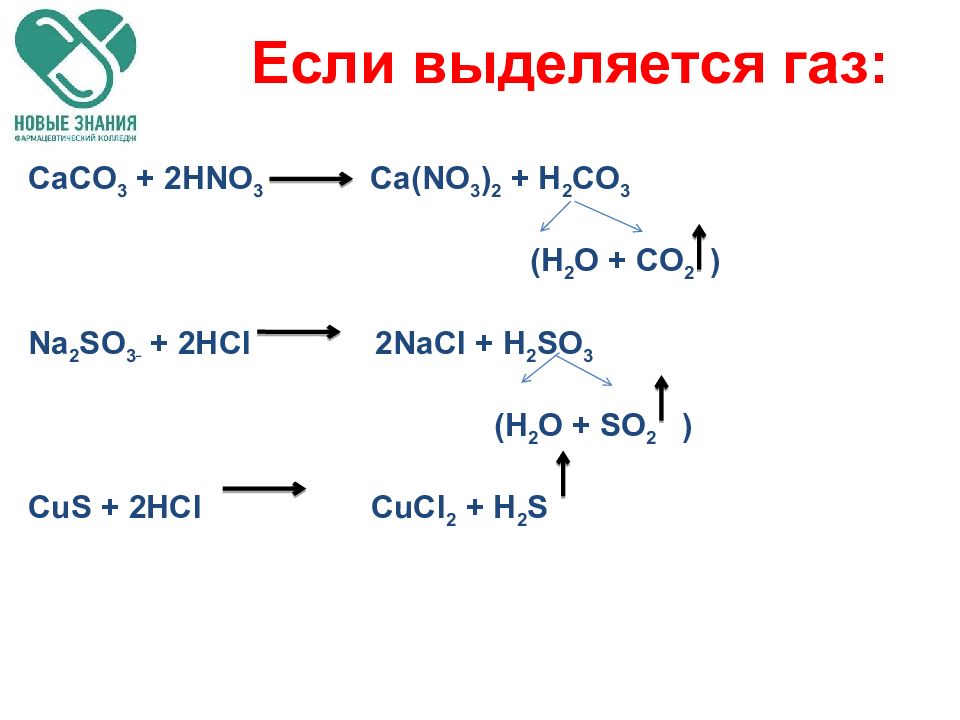
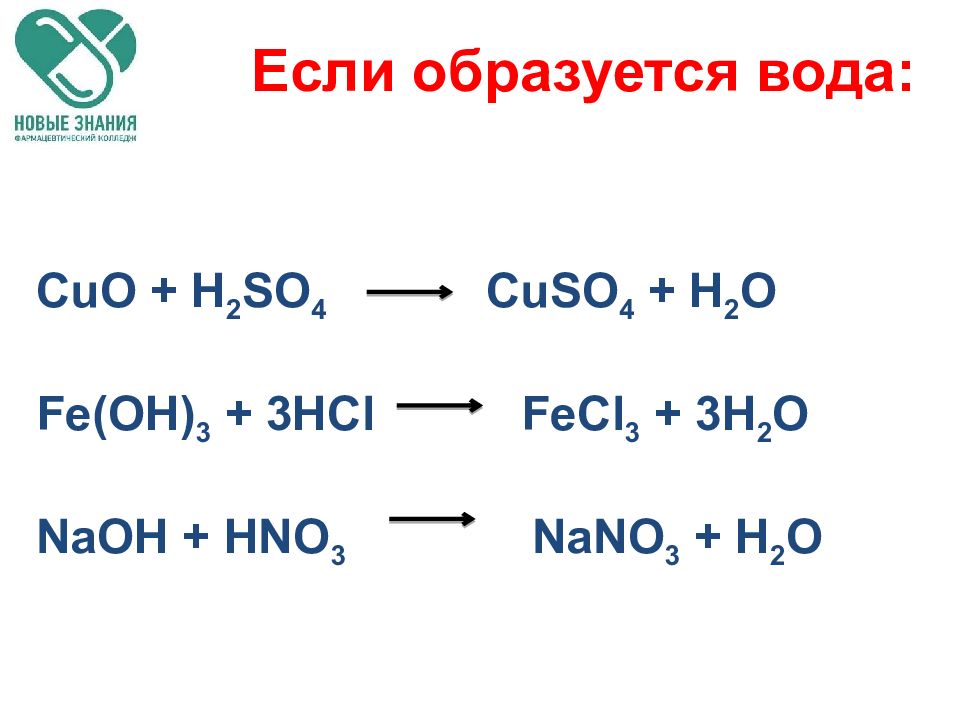
Слайд 44: Реакции ионного обмена
Если образуется осадок Если выделяется газ Если образуется вода *** В остальных случаях реакции обмена являются обратимыми Реакции ионного обмена
Слайд 45
Если образуется осадок: CuSO 4 + 2NaOH Na 2 SO 4 + Cu(OH) 2 2AgNO 3 + CaCl 2 Ca(NO 3 ) 2 + 2AgCl Na 2 CO 3 + Ca(NO 3 ) 2 2NaNO 3 + CaCO 3 BaCl 2 + K 2 SO 4 2KCl + BaSO 4
Слайд 46
Если выделяется газ: CaCO 3 + 2HNO 3 Ca (NO 3 ) 2 + H 2 CO 3 (H 2 O + CO 2 ) Na 2 SO 3 + 2HCl 2NaCl + H 2 SO 3 (H 2 O + SO 2 ) CuS + 2HCl CuCl 2 + H 2 S
Слайд 47
Если образуется вода: CuO + H 2 SO 4 CuSO 4 + H 2 O Fe(OH) 3 + 3HCl FeCl 3 + 3H 2 O NaOH + HNO 3 NaNO 3 + H 2 O
Слайд 48
Если НЕ образуются осадок, газ, вода, то реакции обмена обратимы: 2NaNO 3 + CaCl 2 Ca(NO 3 ) 2 + 2NaCl K 3 PO 4 + 3NaCl Na 3 PO 4 + 3KCl CuCl 2 + Na 2 SO 4 CuSO 4 + 2NaCl
Слайд 49
Ионные уравнения Для реакций ионного обмена составляют полные и сокращенные ионные уравнения. При этом на ионы никогда не раскладывают: нерастворимые вещества (см. таблицу растворимости); оксиды; воду; газы
Слайд 50
Реакции ионного обмена Молекулярное уравнение FeCl 3 NaOH Fe(OH) 3 NaCl + + = 3 3
Слайд 51
Реакции ионного обмена Молекулярное уравнение Fe Cl 3 Na OH Fe(OH) 3 Na Cl + + = 3 3
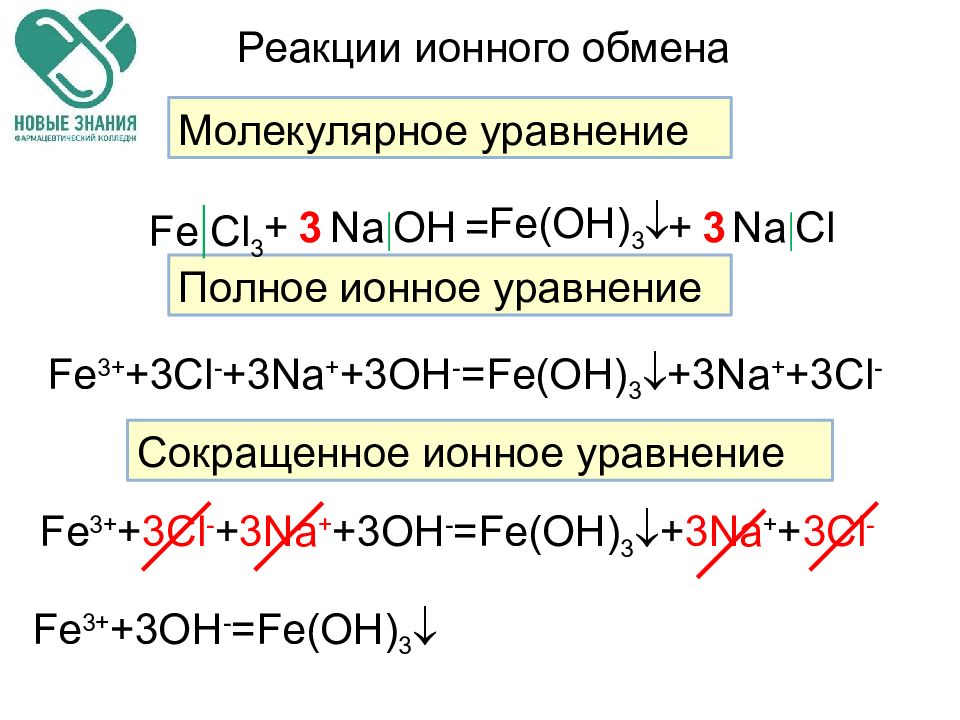
Слайд 52
Реакции ионного обмена Молекулярное уравнение Полное ионное уравнение Сокращенное ионное уравнение Fe Cl 3 Na OH Fe(OH) 3 Na Cl + + = 3 3 Fe 3+ +3Cl - +3Na + +3OH - =Fe(OH) 3 +3Na + +3Cl - Fe 3+ + 3Cl - + 3Na + +3OH - =Fe(OH) 3 + 3Na + + 3Cl - Fe 3+ +3OH - =Fe(OH) 3
Слайд 55
1) Запишем молекулярное уравнение и уравняем его: CuSO 4 + 2NaOH Na 2 SO 4 + Cu(OH) 2 2) Разложим на ионы все, что возможно и затем сократим одинаковые ионы в обоих частях уравнения: Cu +2 + SO 4 -2 + 2Na +1 + 2OH -1 2Na +1 + SO 4 -2 + Cu(OH) 2 (полное ионное уравнение) 3) Запишем то, что получилось: Cu +2 + 2OH -1 Cu(OH) 2 (сокращенное ионное уравнение)
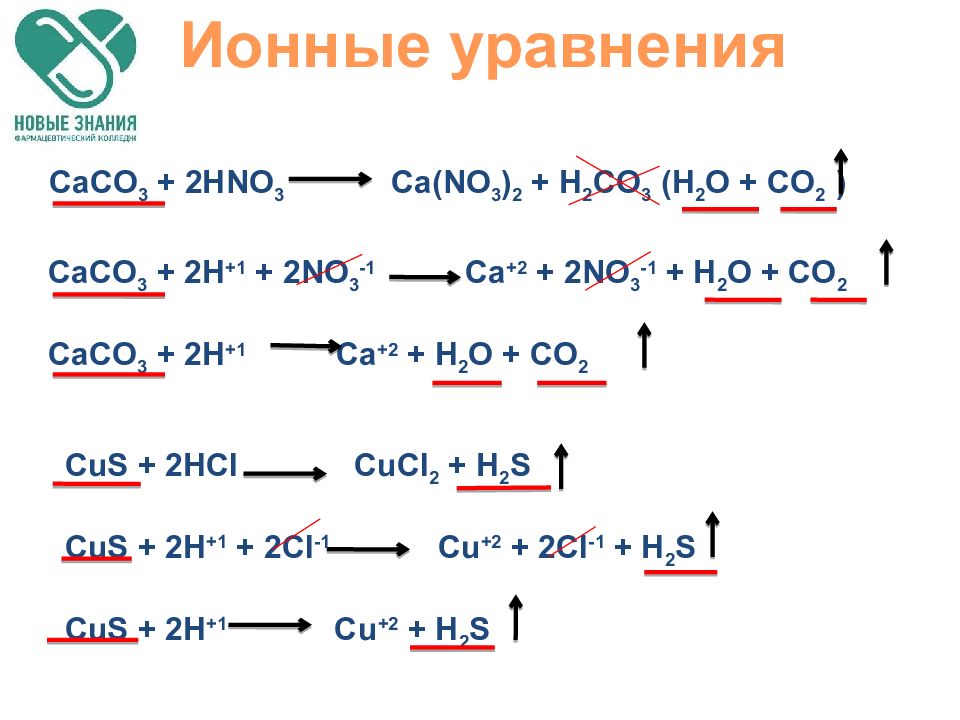
Слайд 56
Ионные уравнения CaCO 3 + 2HNO 3 Ca(NO 3 ) 2 + H 2 CO 3 ( H 2 O + CO 2 ) CaCO 3 + 2H +1 + 2NO 3 -1 Ca +2 + 2NO 3 -1 + H 2 O + CO 2 CaCO 3 + 2H +1 Ca +2 + H 2 O + CO 2 CuS + 2HCl CuCl 2 + H 2 S CuS + 2H +1 + 2Cl -1 Cu +2 + 2Cl -1 + H 2 S CuS + 2H +1 Cu +2 + H 2 S
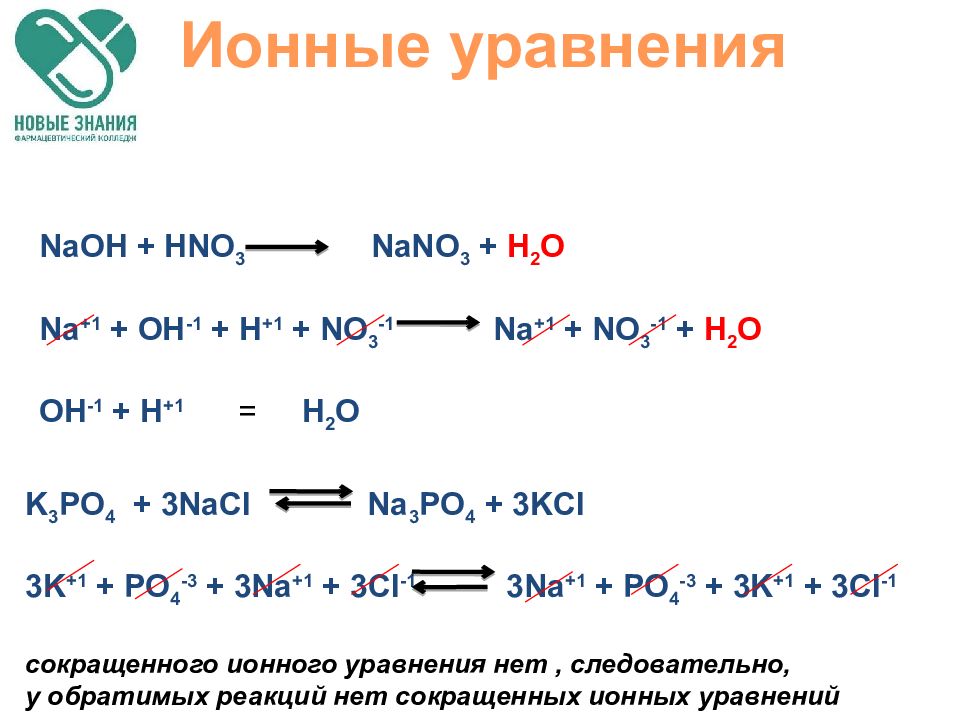
Слайд 57
Ионные уравнения NaOH + HNO 3 NaNO 3 + H 2 O Na +1 + OH -1 + H +1 + NO 3 -1 Na +1 + NO 3 -1 + H 2 O OH -1 + H +1 = H 2 O K 3 PO 4 + 3NaCl Na 3 PO 4 + 3KCl 3K +1 + PO 4 -3 + 3Na +1 + 3Cl -1 3Na +1 + PO 4 -3 + 3K +1 + 3Cl -1 сокращенного ионного уравнения нет, следовательно, у обратимых реакций нет сокращенных ионных уравнений
Слайд 60: Гидролиз солей
При растворении солей в воде происходит не только диссоциация на ионы и гидратация этих ионов, но и взаимодействие молекул воды с ионами, приводящее к разложению молекул воды на Н + и ОН – с присоединением одного из них к иону соли и освобождением другого ( гидролиз ).
Слайд 61: Гидролиз солей
Гидролиз солей – это взаимодействие солей с водой В результате гидролиза соли в растворе появляется некоторое избыточное количество ионов Н⁺ или ОН⁻ При этом изменяется рН раствора. 61
Слайд 62: Гидролизу подвергаются:
Катион слабого основания Al 3+ ; Fe 3+ ; Bi 3+ и др. Анион слабой кислоты CO 3 2- ; SO 3 2– ; NO 2 – ; CN – ; S 2– и др.
Слайд 63: Гидролизу НЕ подвергаются:
Катион сильного основания Na + ; Ca 2+ ; K + и др. Анион сильной кислоты Cl – ; SO 4 2– ; NO 3 – ; и др.
Слайд 64: Закономерности гидролиза разбавленных растворов солей:
Протекает: Гидролиз соли слабого основания и сильной кислоты Гидролиз соли слабой кислоты и сильного основания Гидролиз соли слабой кислоты и слабого основания Не протекает: Гидролиз соли сильного основания и сильной кислоты
Слайд 65: 1) Гидролиз соли слабого основания и сильной кислоты
Проходит по катиону, при этом рН раствора уменьшится. AlCl 3 + H 2 O → Al(OH)Cl 2 + HCl Al 3+ + Н + ОН – → Al ( OH ) 2+ + H + Cl - + H 2 O → не идет среда кислая рН < 7
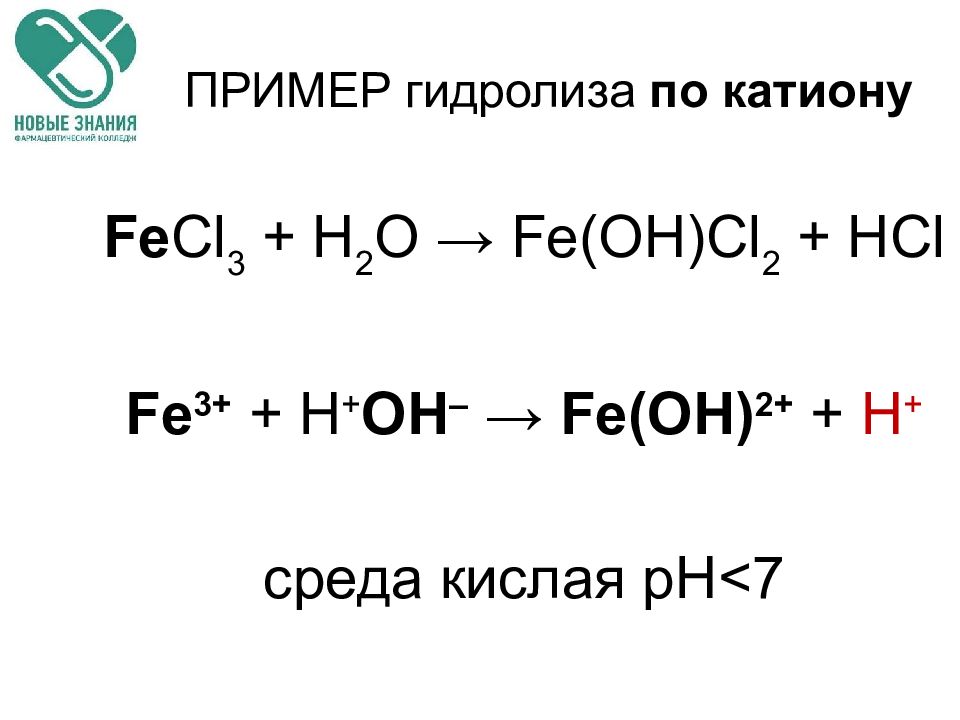
Слайд 66: ПРИМЕР гидролиза по катиону
Fe Cl 3 + H 2 O → Fe(OH)Cl 2 + HCl Fe 3+ + Н + ОН – → Fe ( OH ) 2+ + H + среда кислая рН < 7
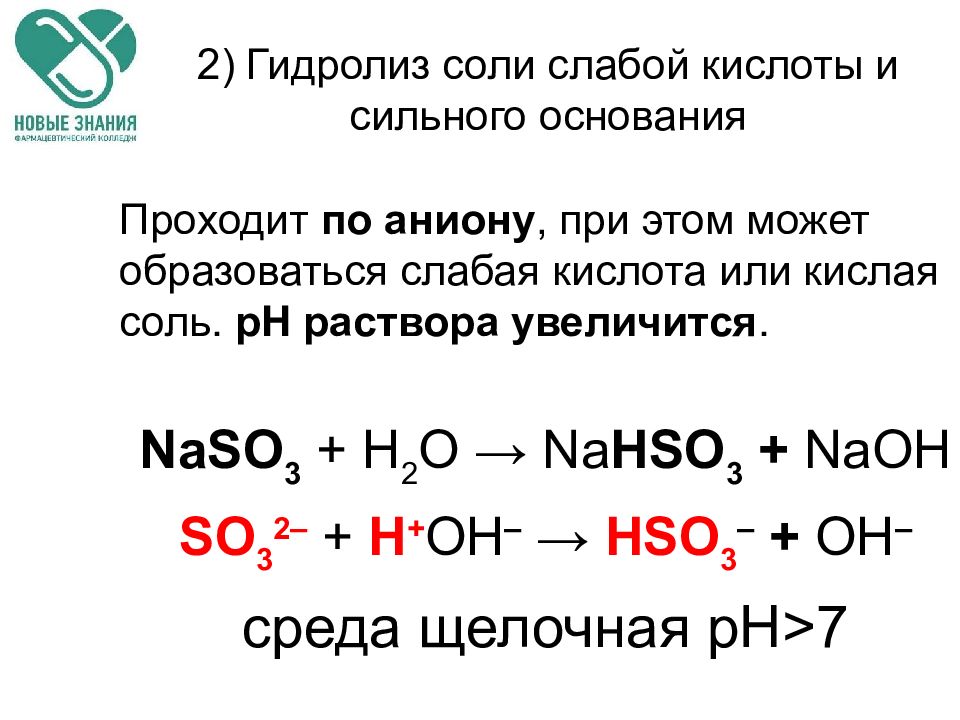
Слайд 67: 2) Гидролиз соли слабой кислоты и сильного основания
Проходит по аниону, при этом может образоваться слабая кислота или кислая соль. рН раствора увеличится. NaSO 3 + H 2 O → Na HSO 3 + Na ОН SO 3 2– + Н + ОН – → HSO 3 – + ОН – среда щелочная рН > 7
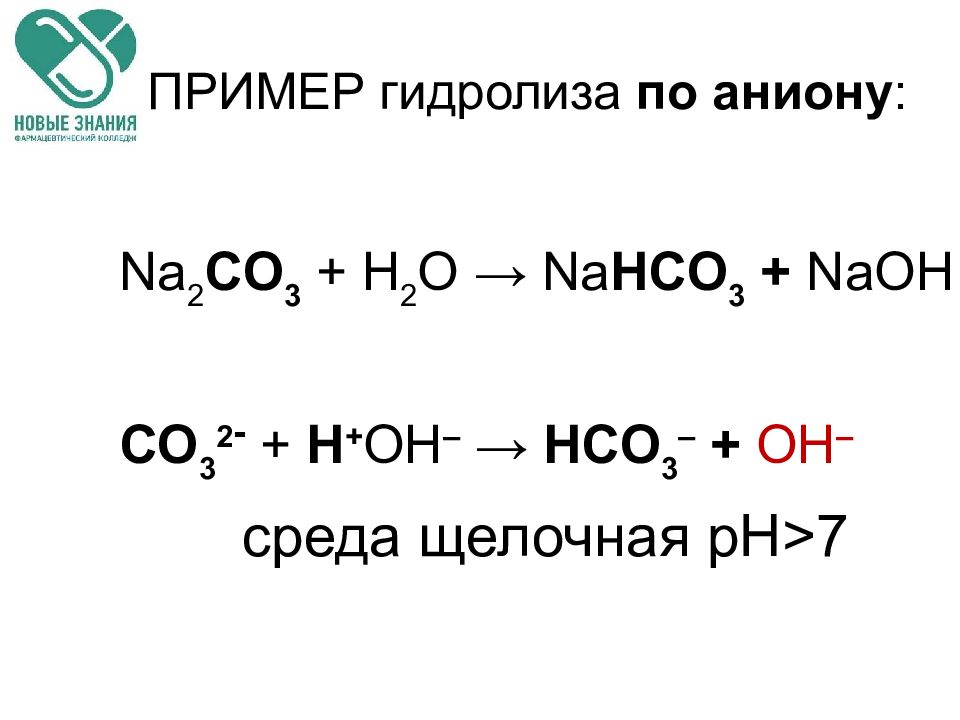
Слайд 68: ПРИМЕР гидролиза по аниону :
Na 2 CO 3 + H 2 O → Na HCO 3 + Na ОН CO 3 2 - + Н + ОН – → HCO 3 – + ОН – среда щелочная рН > 7
Слайд 69: 3) Гидролиз соли слабой кислоты и слабого основания
Проходит полностью ; рН 7 : Al 2 (SO 3 ) 3 + 6H 2 O 2Al(OH) 3 + 3H 2 SO 3 H 2 SO 3 → H 2 O + SO 2 ↑
Слайд 70: Гидролиз соли слабой кислоты и слабого основания
Реакция в этом случае идет до конца, так как при гидролизе катиона образуется Н + : Al 3+ + Н + ОН – → Al ( OH ) 2+ + H + при гидролизе аниона ОН – : SO 3 2– + Н + ОН – → HSO 3 – + ОН – далее происходит образование из них Н 2 О (с выделением энергии), что и смещает равновесие гидролиза вправо.
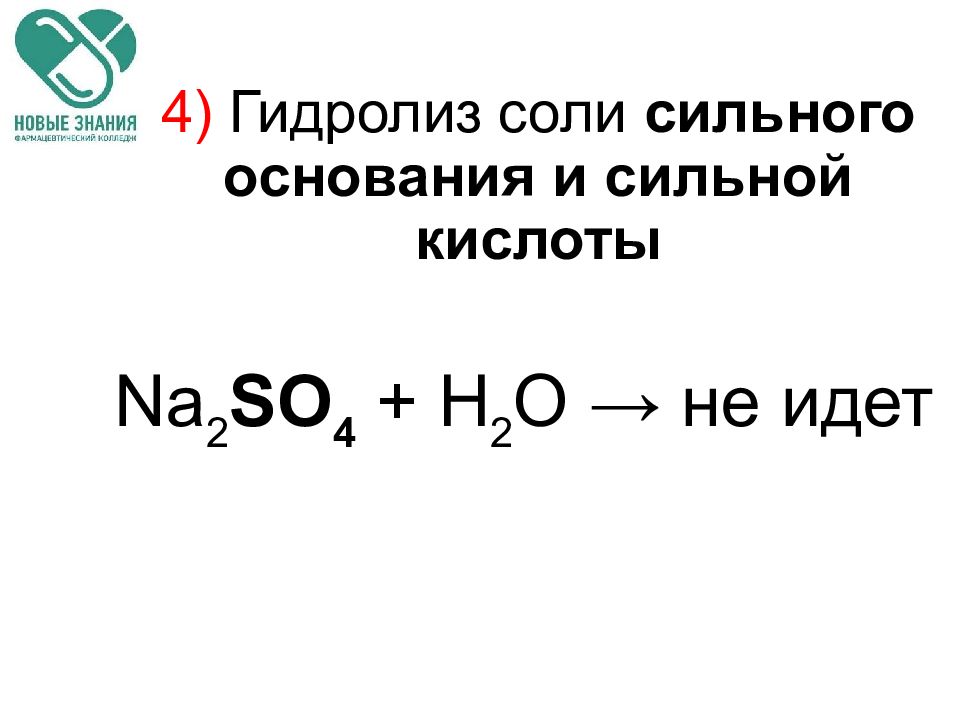
Слайд 71: 4) Гидролиз соли сильного основания и сильной кислоты
Na 2 SO 4 + H 2 O → не идет
Слайд 72: Количественные характеристики гидролиза
Степень гидролиза г (доля гидролизованных единиц) К онстант а гидролиза - К г.