Слайд 2: Аминокислоты и пептиды
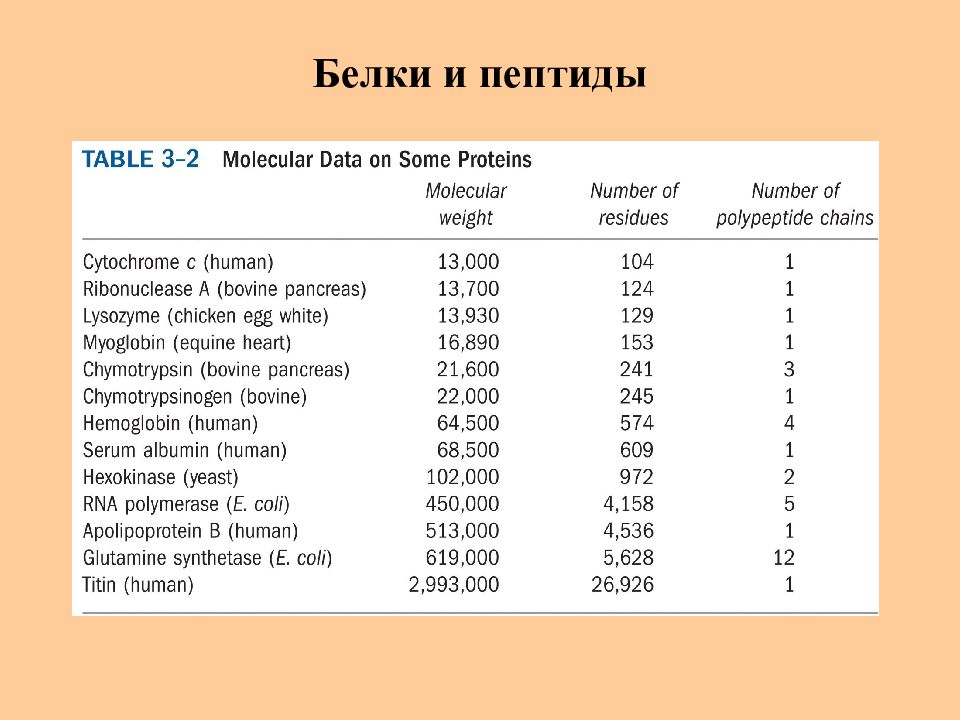
Белки – природные высокомолекулярные полимеры, состоящие из остатков α -аминокарбоновых кислот, связанных амидной (пептидной) связью. Характерны неразветвленные пептидные связи Высокая молекулярная масса (кол-во аминокислотных остатков в белках 50 – 1000 ) Число аминокислот = n Возможное число пептидов = n! 2 2 4 24 10 3 628 800 20 2 · 10 ¹² Всего в природе насчитывается несколько млрд различных белков
2-10 аминокислотных остатков – пептид, 10-100 ─" ─ полипептид, > 100 ─" ─ белок
Слайд 5: Белки и пептиды
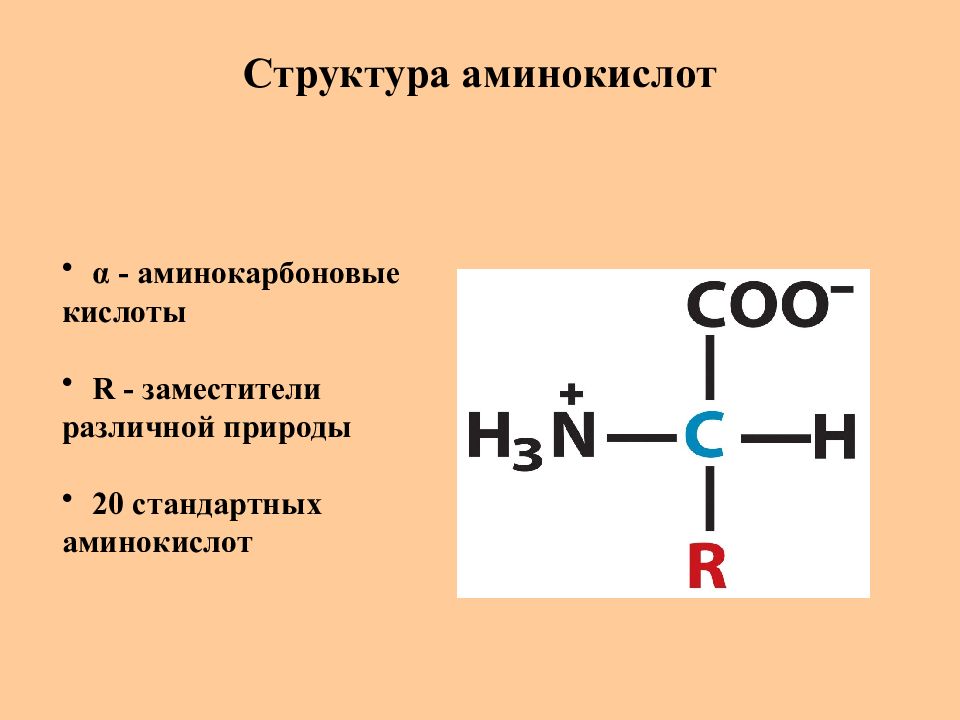
Слайд 6: Структура аминокислот
α - аминокарбоновые кислоты R - заместители различной природы 20 стандартных аминокислот
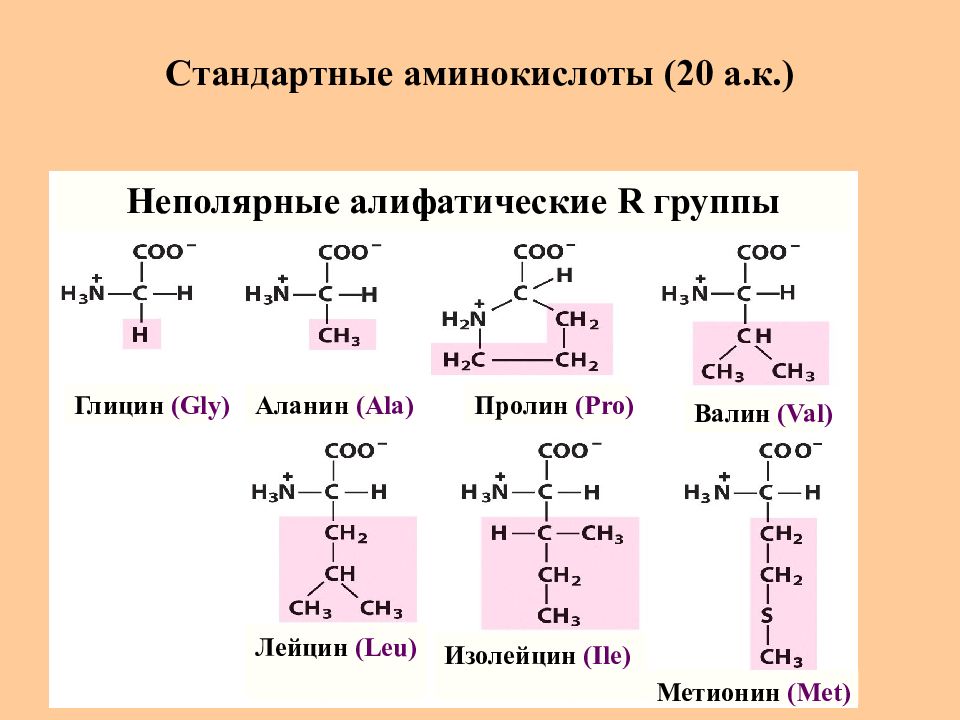
Слайд 7: Стандартные аминокислоты (20 а.к.)
Глицин (Gly) Аланин (Ala) Пролин (Pro) Валин (Val) Метионин (Met) Изолейцин (Ile) Лейцин (Leu) Неполярные алифатические R группы
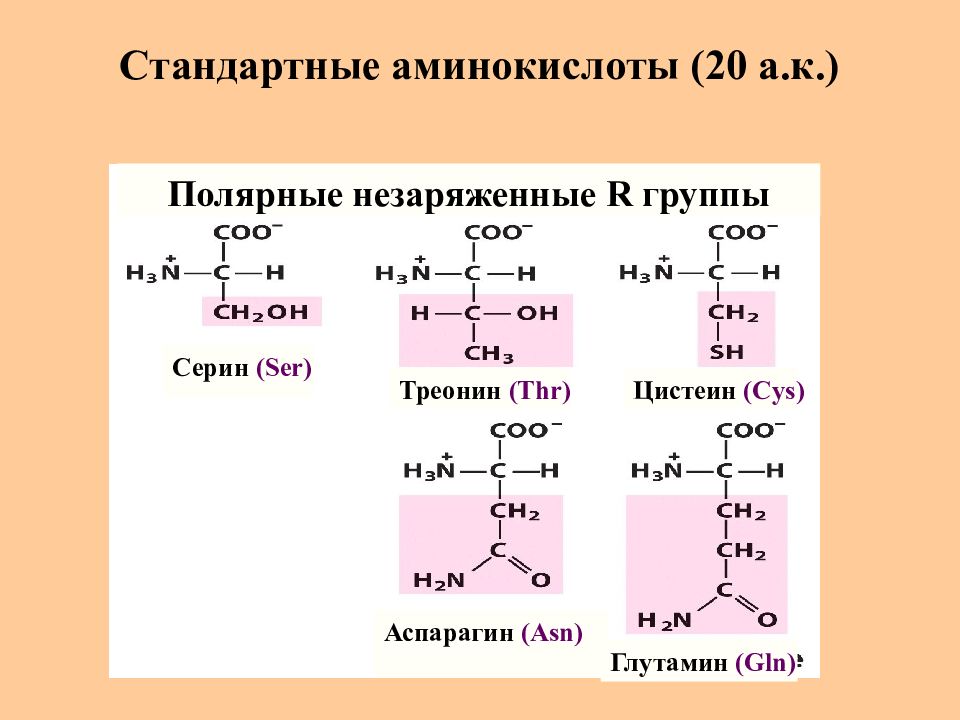
Слайд 8: Стандартные аминокислоты (20 а.к.)
Серин (Ser) Треонин (Thr) Цистеин (Cys) Глутамин (Gln) Аспарагин (Asn) Полярные незаряженные R группы
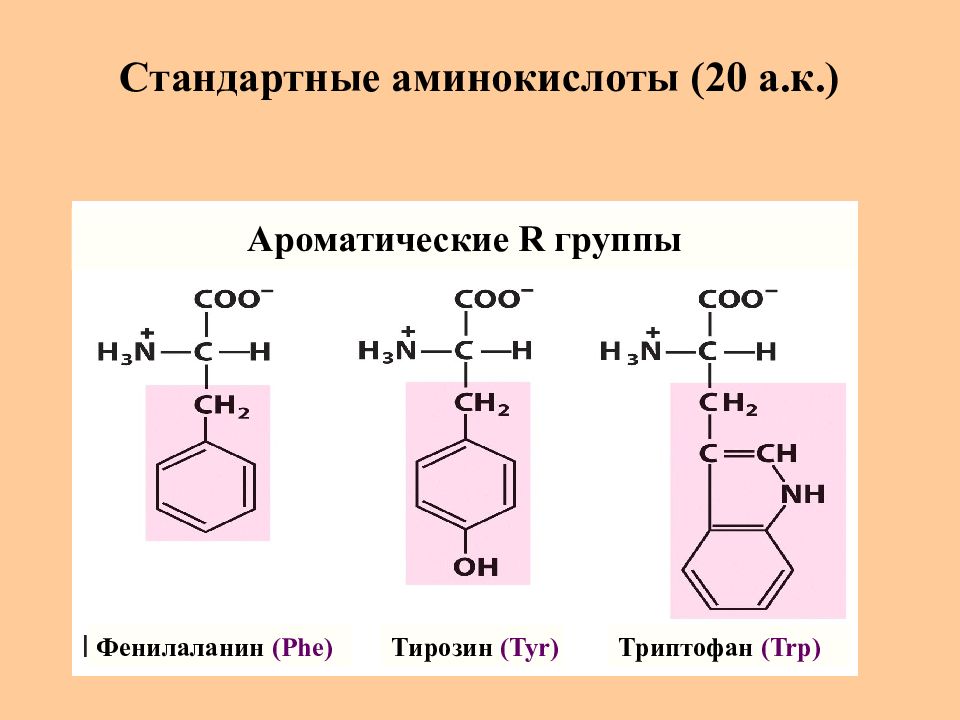
Слайд 9: Стандартные аминокислоты (20 а.к.)
Фенилаланин (Phe) Тирозин (Tyr) Триптофан (Trp) Ароматические R группы
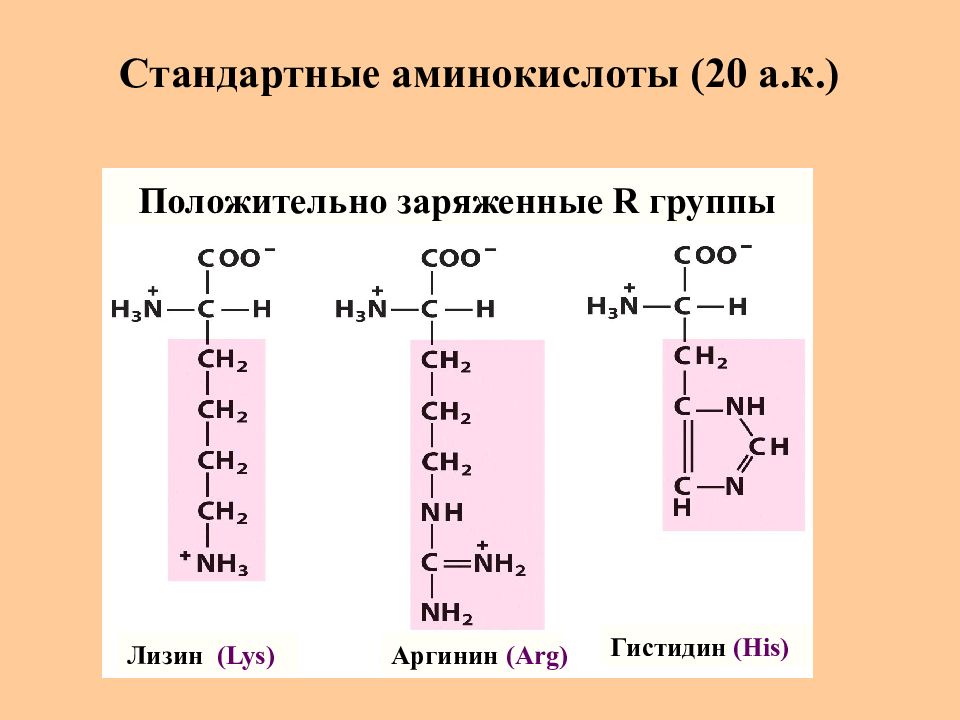
Слайд 10: Стандартные аминокислоты (20 а.к.)
Лизин (Lys) Аргинин (Arg) Гистидин (His) Положительно заряженные R группы
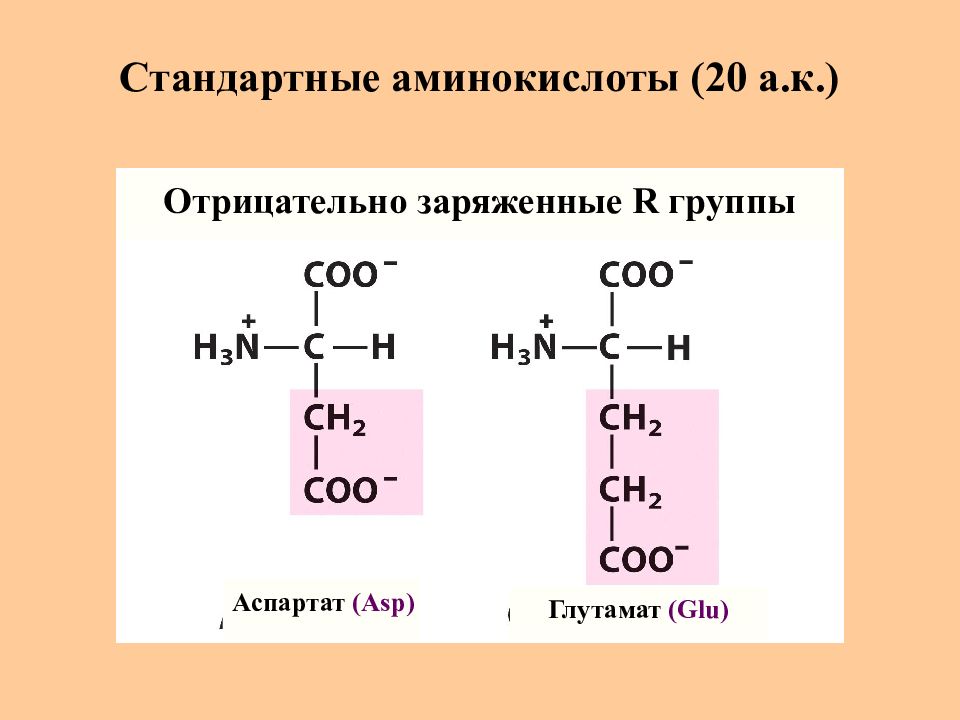
Слайд 11: Стандартные аминокислоты (20 а.к.)
Аспартат (Asp) Глутамат (Glu) Отрицательно заряженные R группы
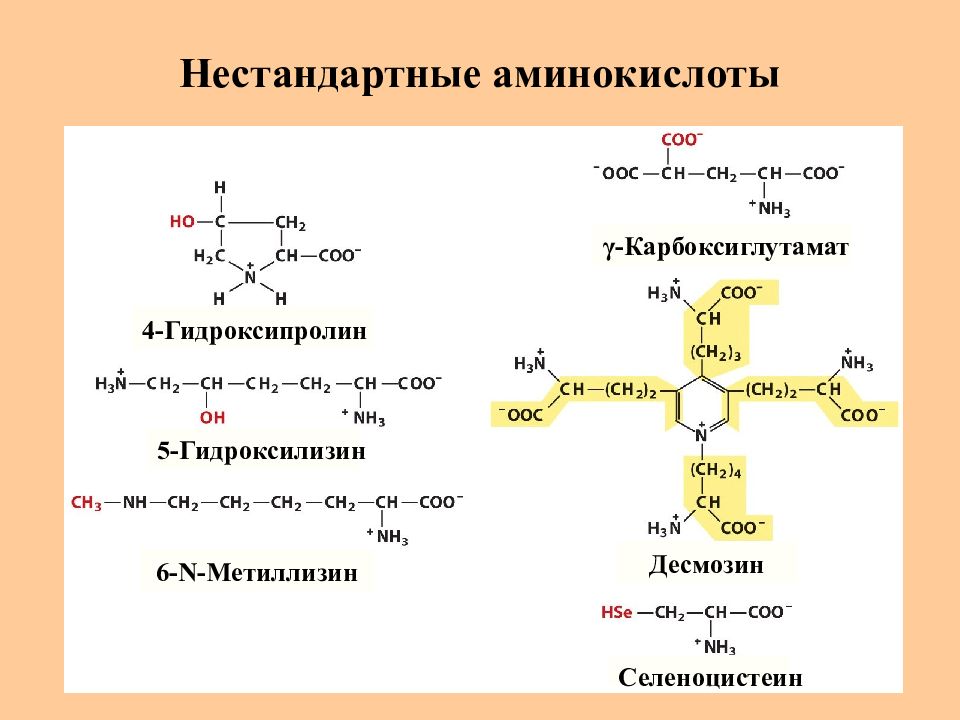
Слайд 12: Нестандартные аминокислоты
4-Гидроксипролин 5-Гидроксилизин 6- N -Метиллизин γ -Карбоксиглутамат Десмозин Селеноцистеин
Слайд 13: Классификация аминокислот
По химической структуре По отношению к воде (гидрофильные и гидрофобные) По кислотно-основным свойствам : Кислые а.к. Asp, Glu (2 ) Основные а.к. Lys, Arg, His (3 ) Нейтральные а.к. (15) 4. По пищевой ценности : Заменимые а.к. (10) (синтезируются в организме) Незаменимые а.к. (10) (должны поступать извне) Val, Leu, Ile, Thr, Met, Phe, Trp, Lys, Arg, His
Слайд 14: Физические свойства аминокислот
Белые кристаллические вещества Имеют высокие и нехарактерные Тпл., разлагаются при Т > 200 ° С Растворимы в воде, растворах кислот и щелочей Не растворяются в неполярных растворителях Обладают либо сладким, либо горьким вкусом
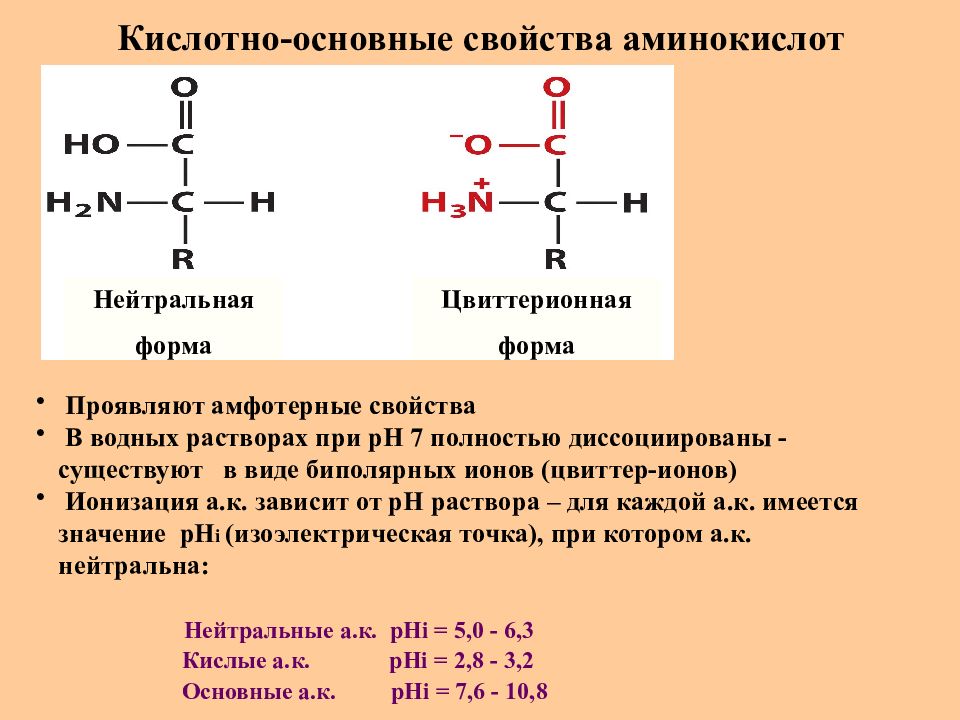
Слайд 15: Кислотно-основные свойства аминокислот
Нейтральная форма Цвиттерионная форма Проявляют амфотерные свойства В водных растворах при рН 7 полностью диссоциированы - существуют в виде биполярных ионов (цвиттер-ионов) Ионизация а.к. зависит от рН раствора – для каждой а.к. имеется значение рН i ( изоэлектрическая точка), при котором а.к. нейтральна : Нейтральные а.к. рН i = 5,0 - 6,3 Кислые а.к. рН i = 2,8 - 3,2 Основные а.к. рН i = 7,6 - 10,8
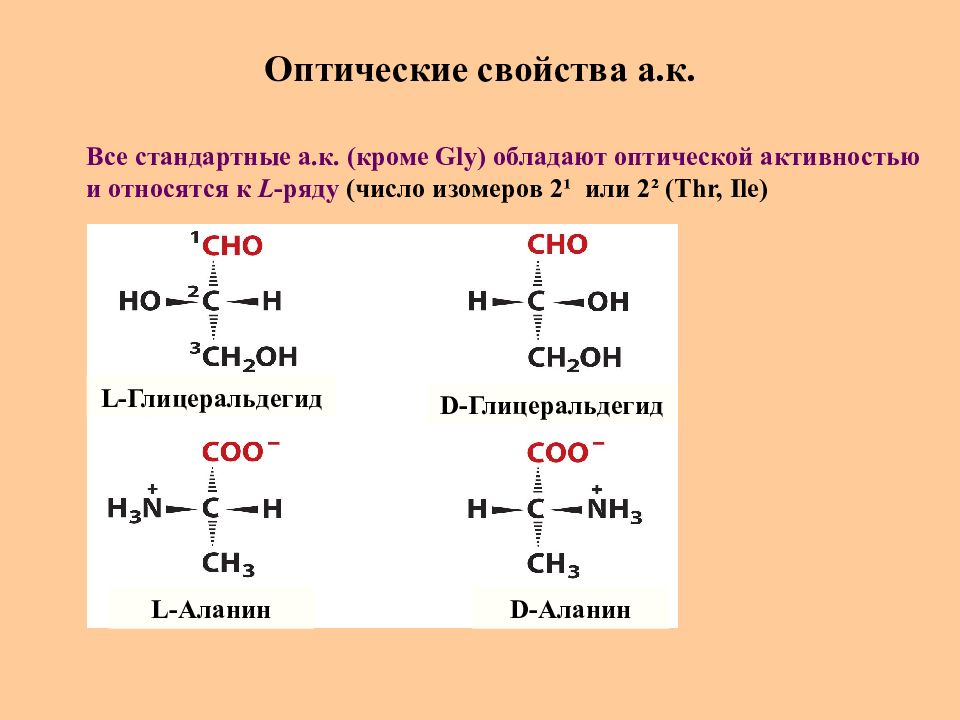
Слайд 16: Оптические свойства а.к
L -Глицеральдегид L -Аланин D -Глицеральдегид D -Аланин Все стандартные а.к. (кроме Gly) обладают оптической активностью и относятся к L -ряду (число изомеров 2 ¹ или 2 ² ( Thr, Ile)
Слайд 17: Особенности Cys
Цистеин Цистеин Цистин В составе белка остатки Cys подвергаются самопроизвольному окислению с образованием дисульфидных мостиков, которые ковалентно связывают участки полипептидных цепей
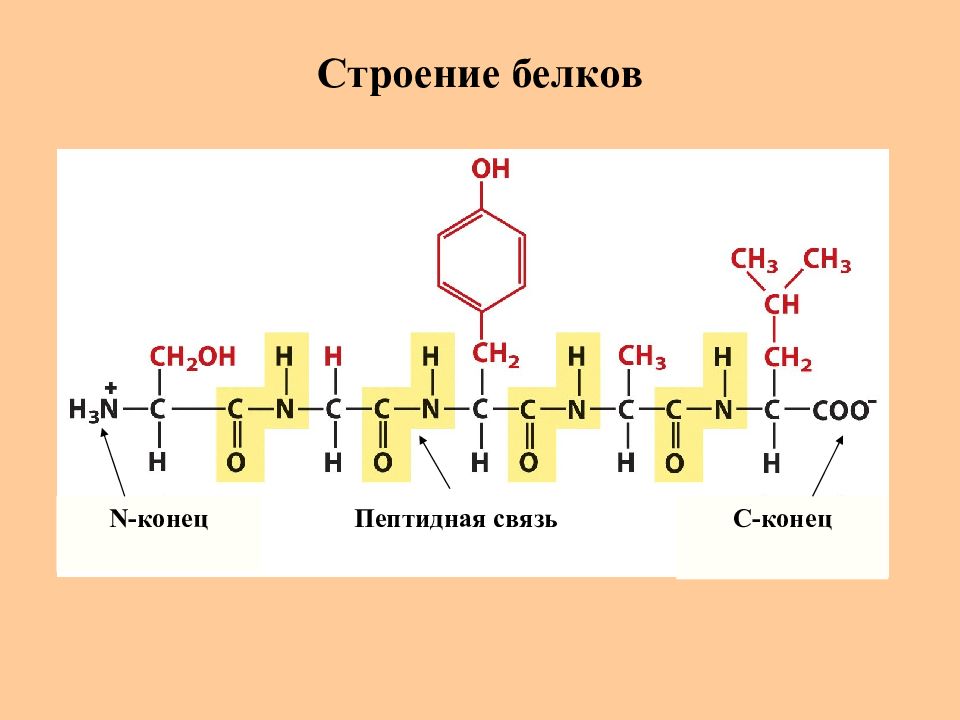
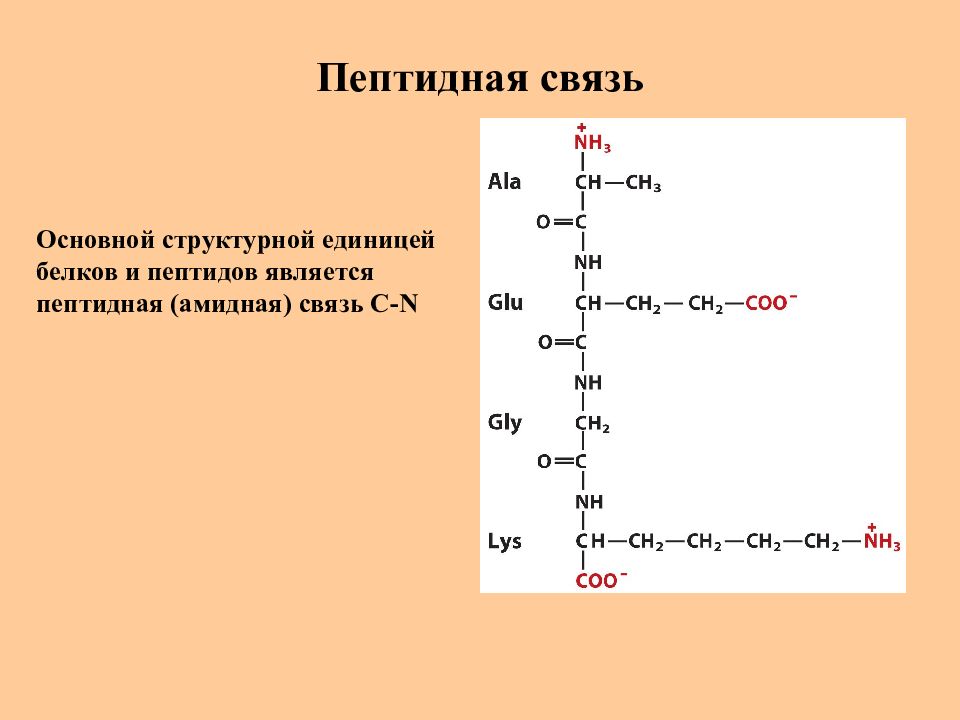
Слайд 18: Пептидная связь
Основной структурной единицей белков и пептидов является пептидная (амидная) связь C-N
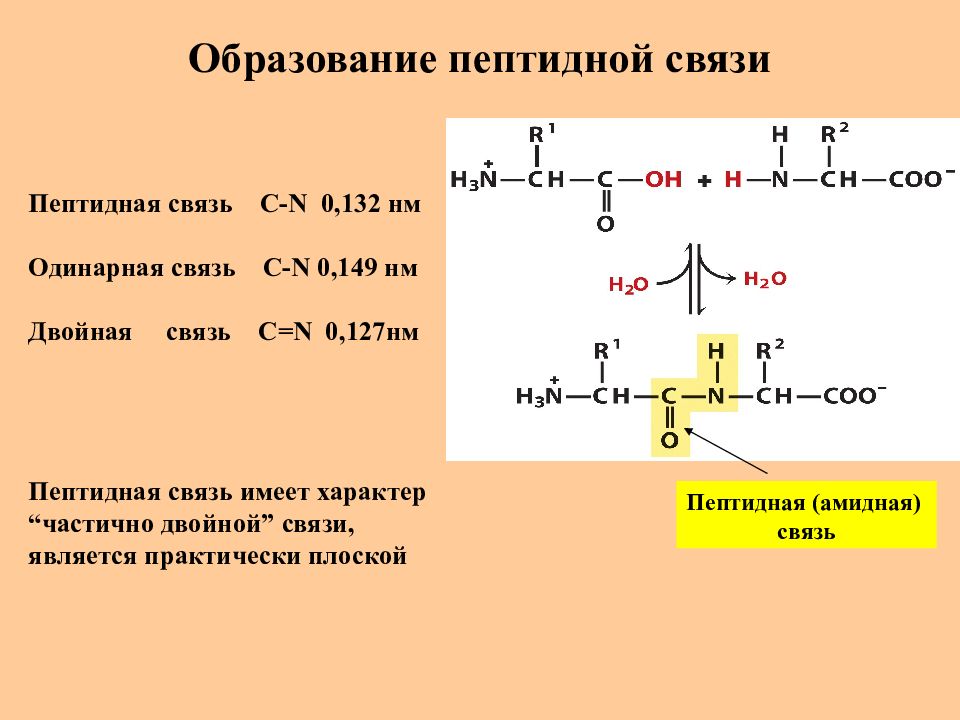
Слайд 19: Образование пептидной связи
Пептидная (амидная) связь Пептидная связь C-N 0,132 нм Одинарная связь C-N 0,149 нм Двойная связь С= N 0,127нм Пептидная связь имеет характер “ частично двойной ” связи, является практически плоской
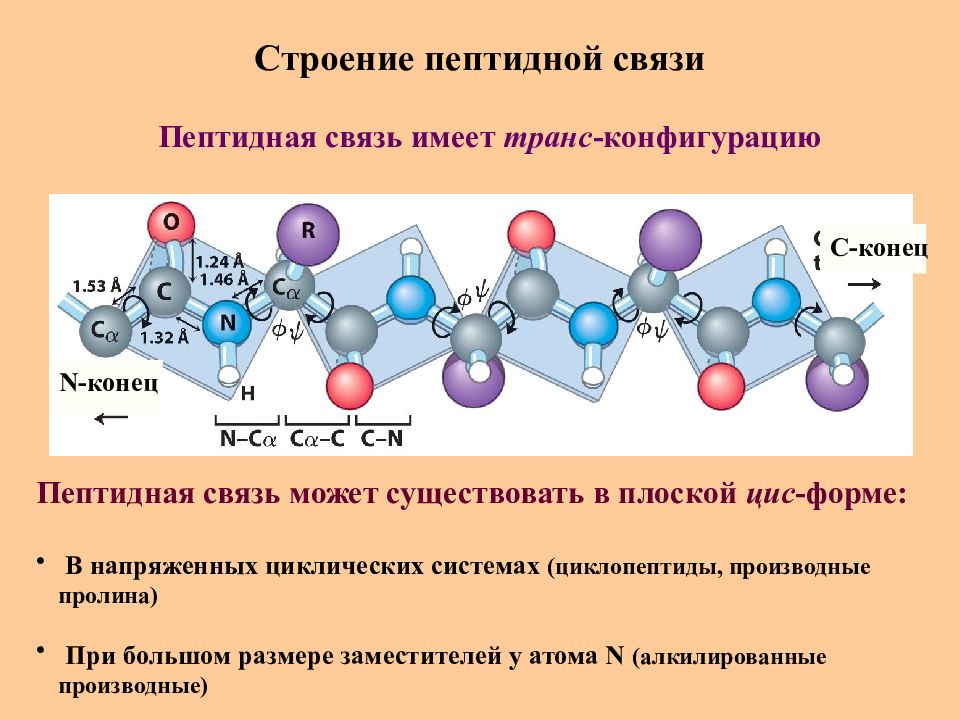
Слайд 20: Строение пептидной связи
N -конец C -конец Пептидная связь имеет транс -конфигурацию Пептидная связь может существовать в плоской цис -форме : В напряженных циклических системах (циклопептиды, производные пролина) При большом размере заместителей у атома N (алкилированные производные)
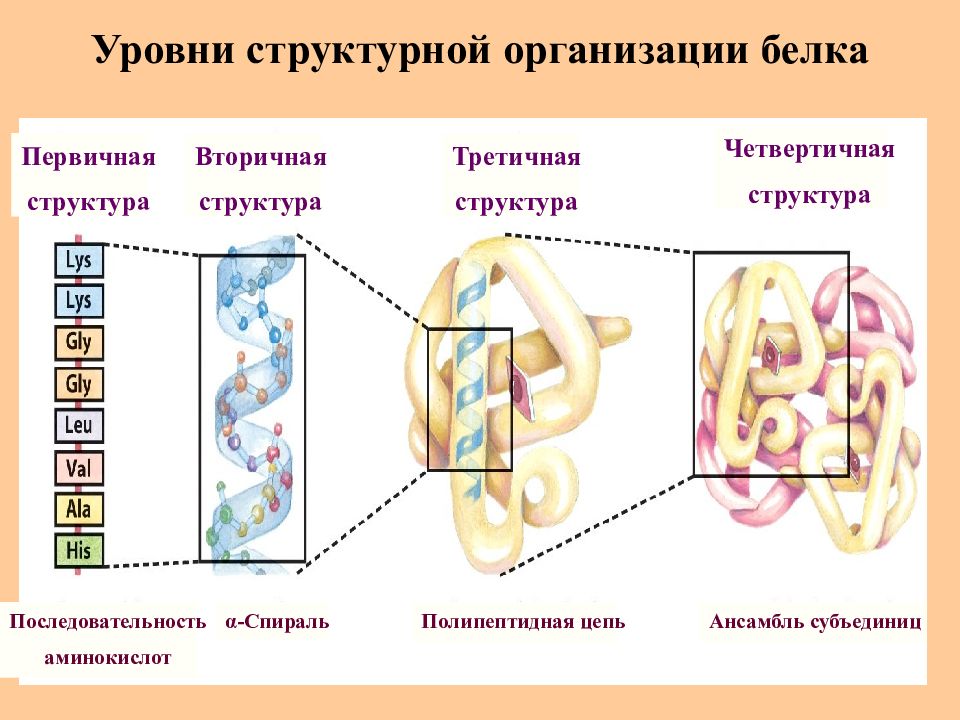
Слайд 21: Уровни структурной организации белка
Первичная структура Последовательность аминокислот α - Спираль Полипептидная цепь Ансамбль субъединиц Вторичная структура Третичная структура Четвертичная структура
Слайд 22: Первичная структура белка
Первичная структура белка – это аминокислотная последовательность белка, т.е. состав и расположение а.к. в полипептидной цепи. Образуется ковалентными пептидными и дисульфидными связями !!!!
Слайд 23: Закономерности первичной стуктуры
1. Чем важнее роль белка в процессах жизнедеятельности, тем разнообразнее его аминокислотный состав (и, наоборот, чем примитивнее функция белка, тем беднее его «аминокислотная корзина»)
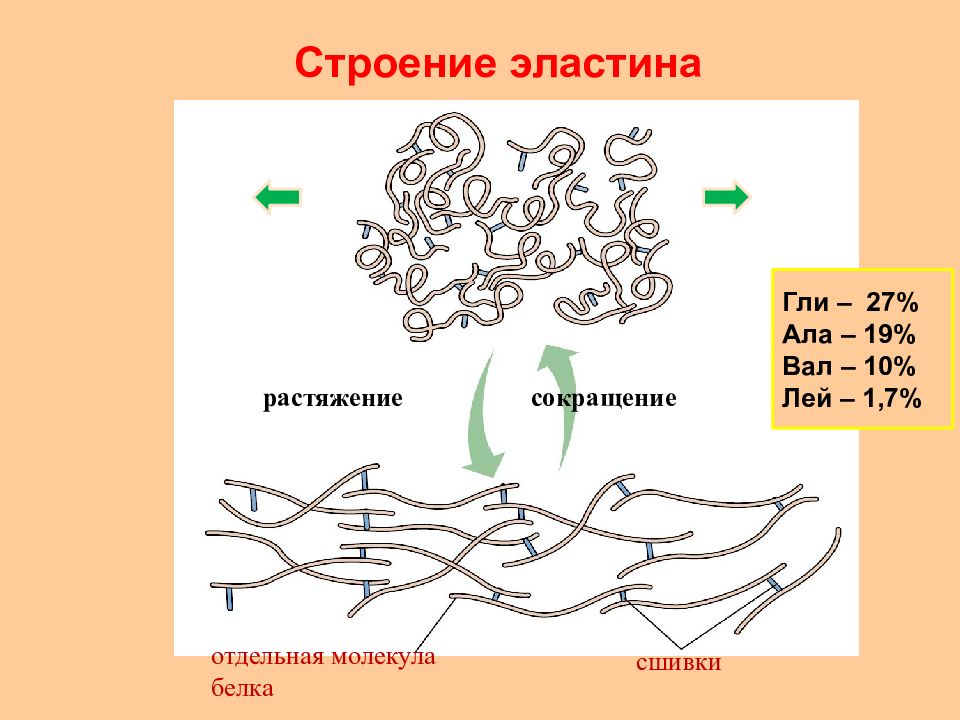
Слайд 26: Строение эластина
растяжение сокращение отдельная молекула белка сшивки Строение эластина Гли – 27% Ала – 19% Вал – 10% Лей – 1,7%
Слайд 27: Закономерности первичной стуктуры
2. Чем ближе расположены виды на эволюционной лестнице, тем больше сходство первичных структур гомологичных белков
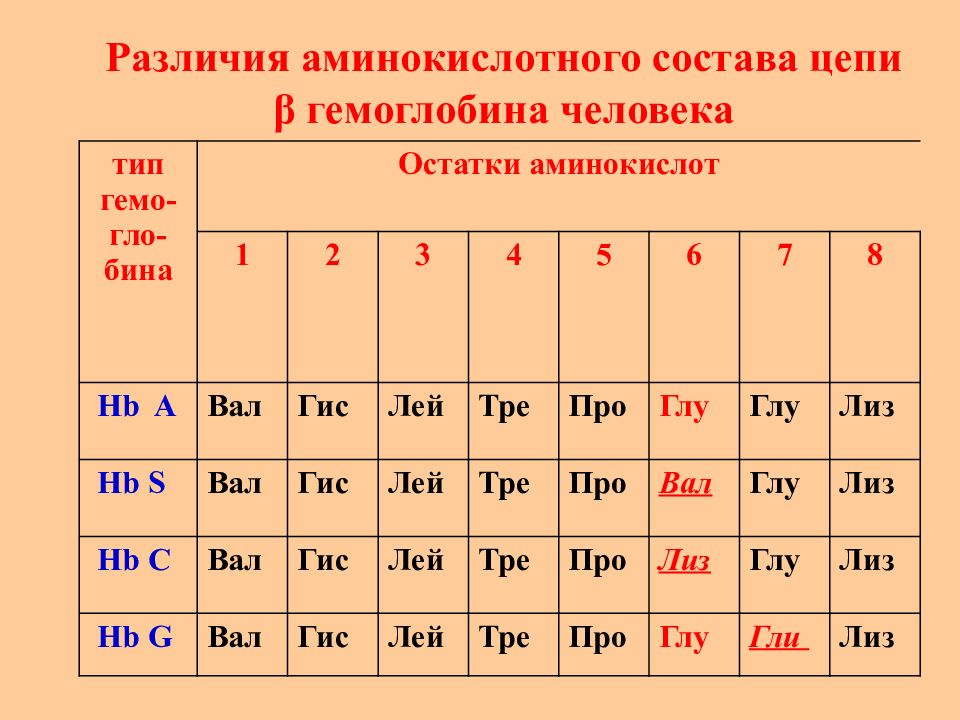
Слайд 28: Различия аминокислотного состава цепи β гемоглобина человека
тип гемо-гло - бина Остатки аминокислот 1 2 3 4 5 6 7 8 Hb A Вал Гис Лей Тре Про Глу Глу Лиз Hb S Вал Гис Лей Тре Про Вал Глу Лиз Hb C Вал Гис Лей Тре Про Лиз Глу Лиз Hb G Вал Гис Лей Тре Про Глу Гли Лиз
Слайд 29: Методы изучения I структуры белка
Методы «меток» – определение концевых аминокислот (методы Сэнджера, Эдмана, Акабори, дансильный) Гидролиз Хроматография Секвенирование
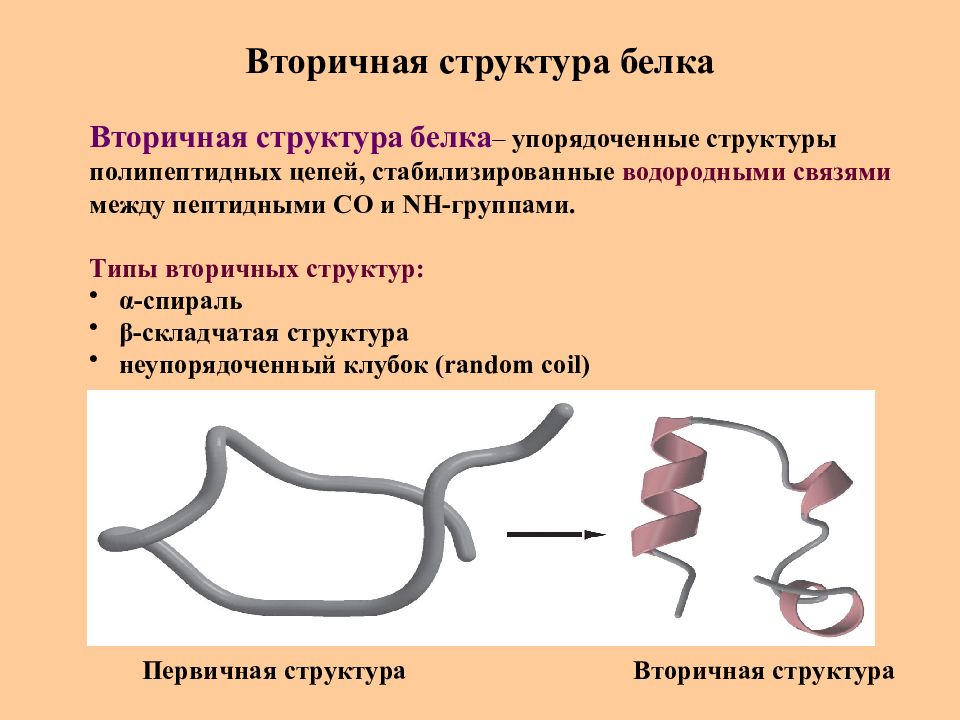
Слайд 30: Вторичная структура белка
Вторичная структура белка – упорядоченные структуры полипептидных цепей, стабилизированные водородными связями между пептидными СО и NH -группами. Типы вторичных структур : α -спираль β -складчатая структура неупорядоченный клубок ( random coil) Первичная структура Вторичная структура
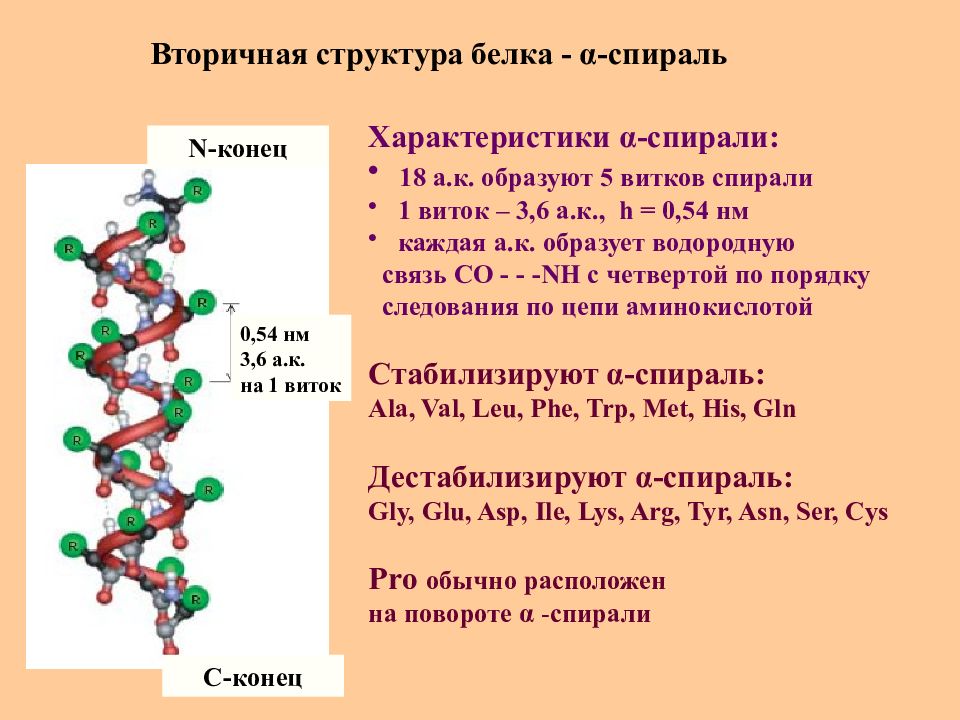
Слайд 31: Вторичная структура белка - α -спираль
N -конец C -конец 0,54 нм 3,6 а.к. на 1 виток Характеристики α -спирали : 18 а.к. образуют 5 витков спирали 1 виток – 3,6 а.к., h = 0,54 нм каждая а.к. образует водородную связь СО - - - NH c четвертой по порядку следования по цепи аминокислотой Стабилизируют α -спираль : Ala, Val, Leu, Phe, Trp, Met, His, Gln Дестабилизируют α -спираль : Gly, Glu, Asp, Ile, Lys, Arg, Tyr, Asn, Ser, Cys Pro обычно расположен на повороте α - спирали
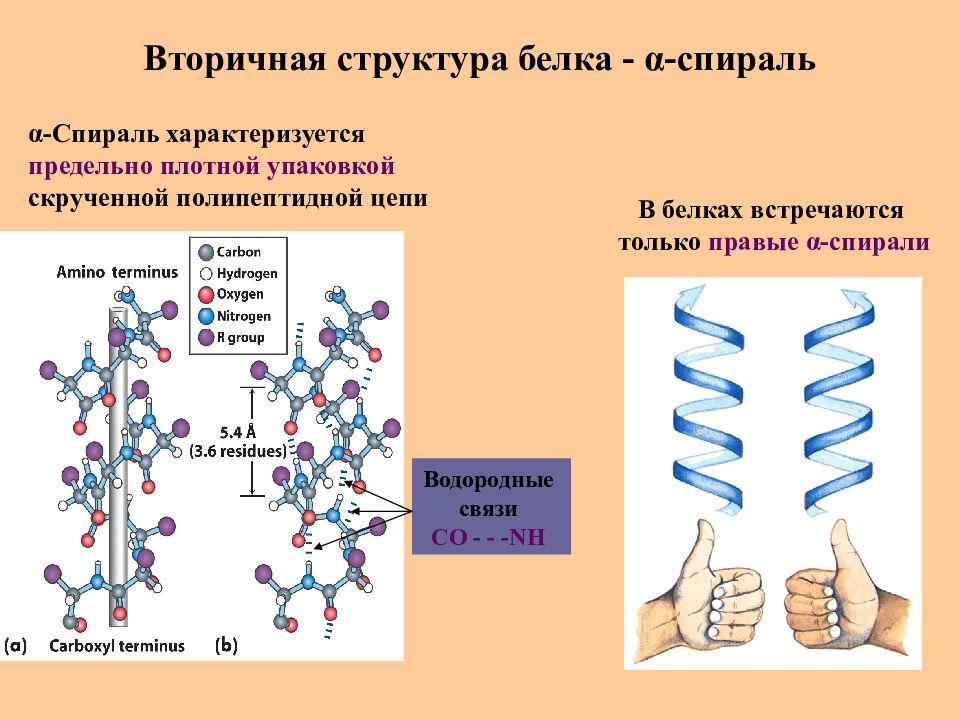
Слайд 32: Вторичная структура белка - α -спираль
В белках встречаются только правые α -спирали α -Спираль характеризуется предельно плотной упаковкой скрученной полипептидной цепи Водородные связи СО - - - NH
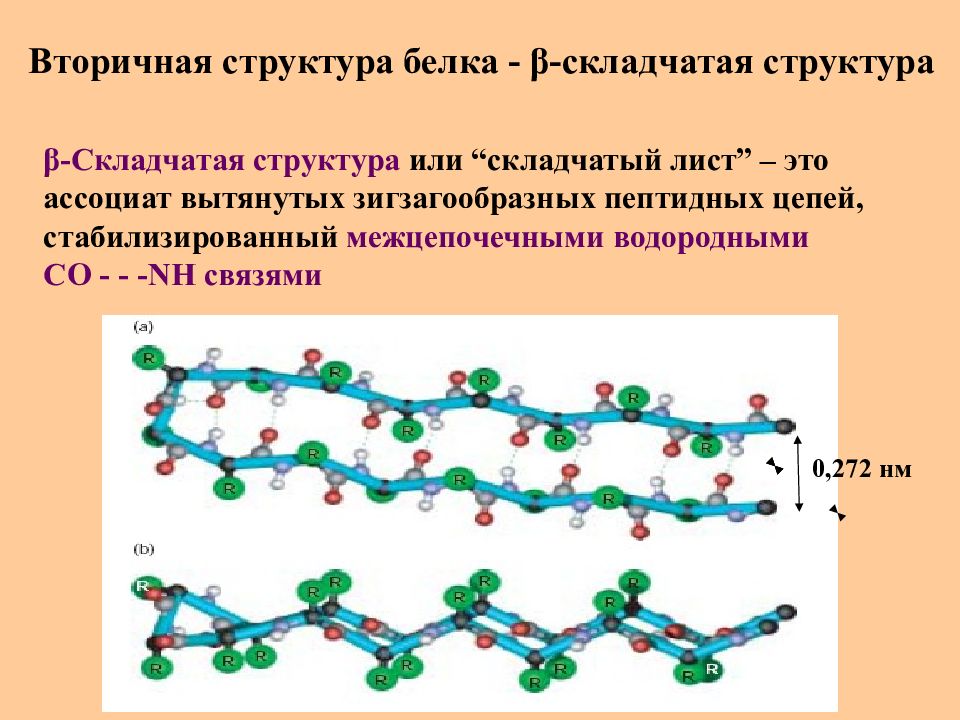
Слайд 33: Вторичная структура белка - β -складчатая структура
β -Складчатая структура или “ складчатый лист ” – это ассоциат вытянутых зигзагообразных пептидных цепей, стабилизированный межцепочечными водородными СО - - - NH связями 0,272 нм
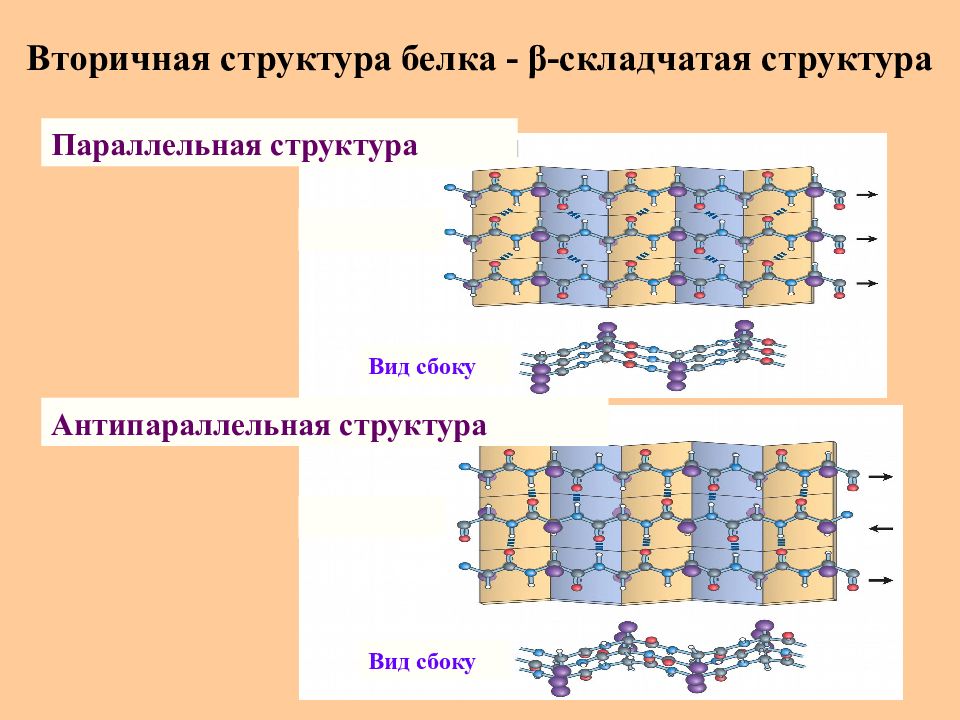
Слайд 34: Вторичная структура белка - β -складчатая структура
Параллельная структура Антипараллельная структура Вид сбоку Вид сбоку
Слайд 35: Сверхвторичная структура белка
Сверхвторичная структура – наличие ансамблей взаимодействующих между собой вторичных структур. Пример – агрегация α -спиралей (суперспирализованная система). ( Белок α -кератин шерсти). Т.о., полипептидная цепь белка содержит определенное число участков вторичной структуры ( α, β ), а также участки неупорядоченной структуры.
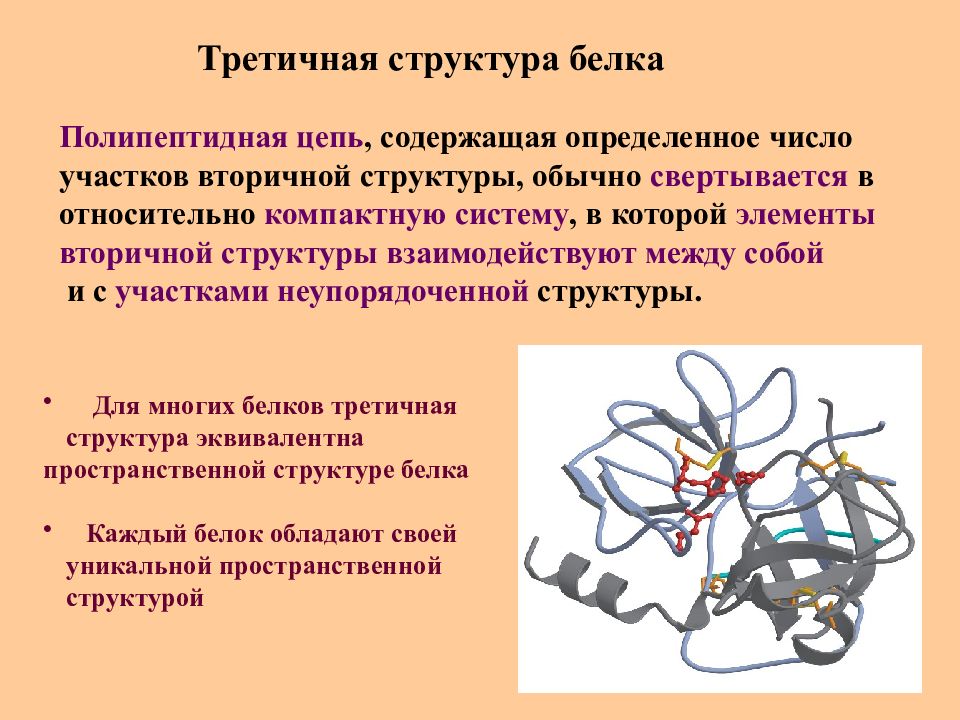
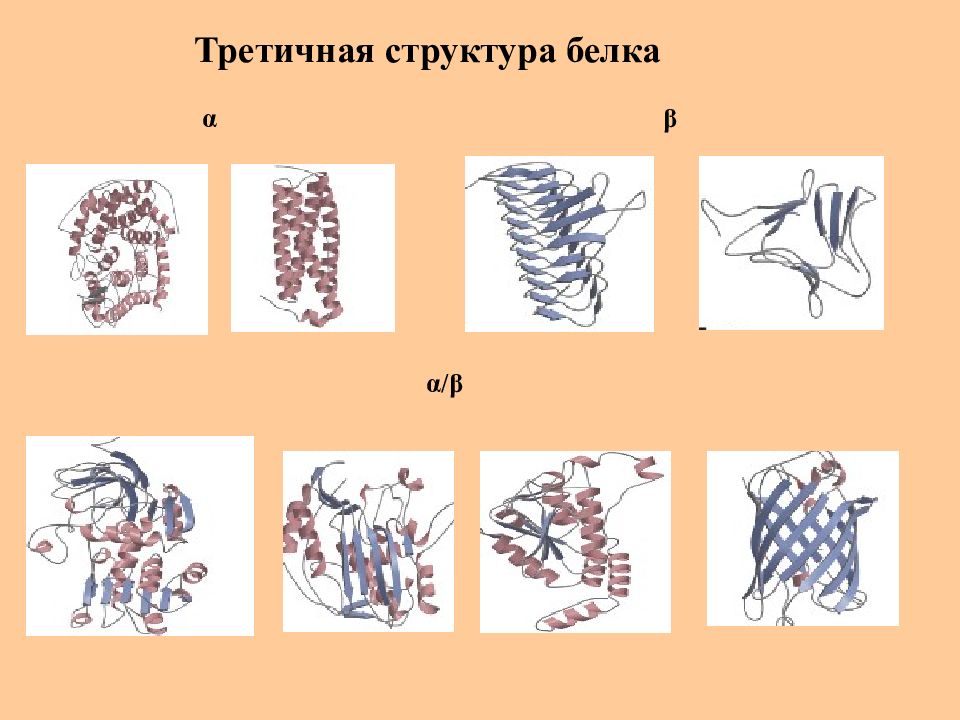
Слайд 36: Третичная структура белка
Полипептидная цепь, содержащая определенное число участков вторичной структуры, обычно свертывается в относительно компактную систему, в которой элементы вторичной структуры взаимодействуют между собой и с участками неупорядоченной структуры. Для многих белков третичная структура эквивалентна пространственной структуре белка Каждый белок обладают своей уникальной пространственной структурой
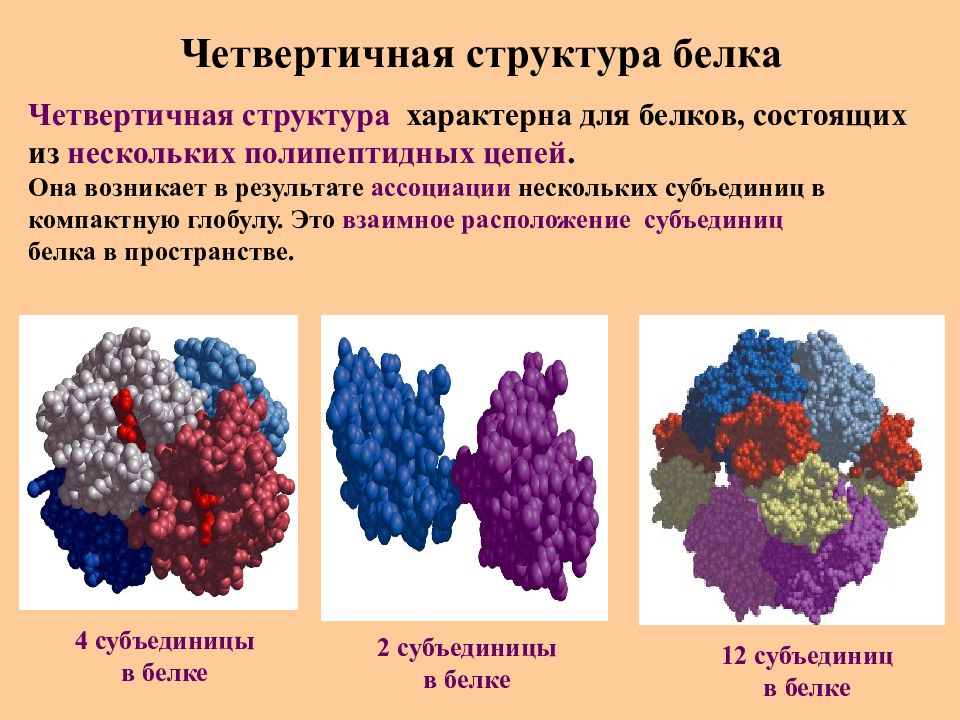
Слайд 38: Четвертичная структура белка
Четвертичная структура характерна для белков, состоящих из нескольких полипептидных цепей. Она возникает в результате ассоциации нескольких субъединиц в компактную глобулу. Это взаимное расположение субъединиц белка в пространстве. 4 субъединицы в белке 2 субъединицы в белке 1 2 субъединиц в белке
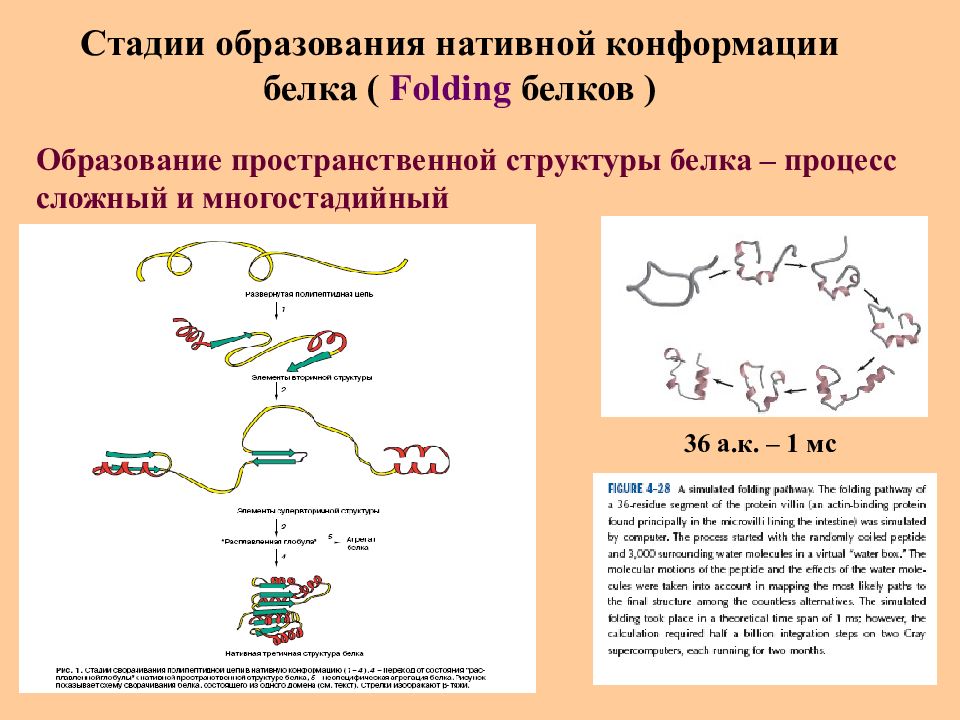
Слайд 39: Стадии образования нативной конформации белка ( Folding белков )
Образование пространственной структуры белка – процесс сложный и многостадийный 36 а.к. – 1 мс
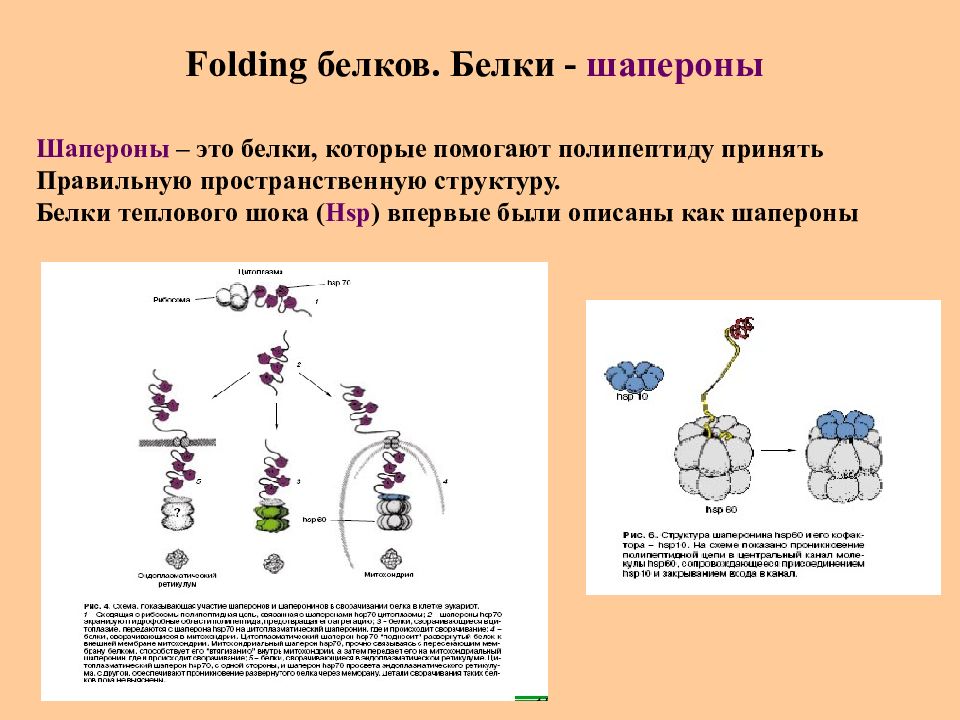
Слайд 40: Folding белков. Белки - шапероны
Шапероны – это белки, которые помогают полипептиду принять Правильную пространственную структуру. Белки теплового шока ( Hsp ) впервые были описаны как шапероны
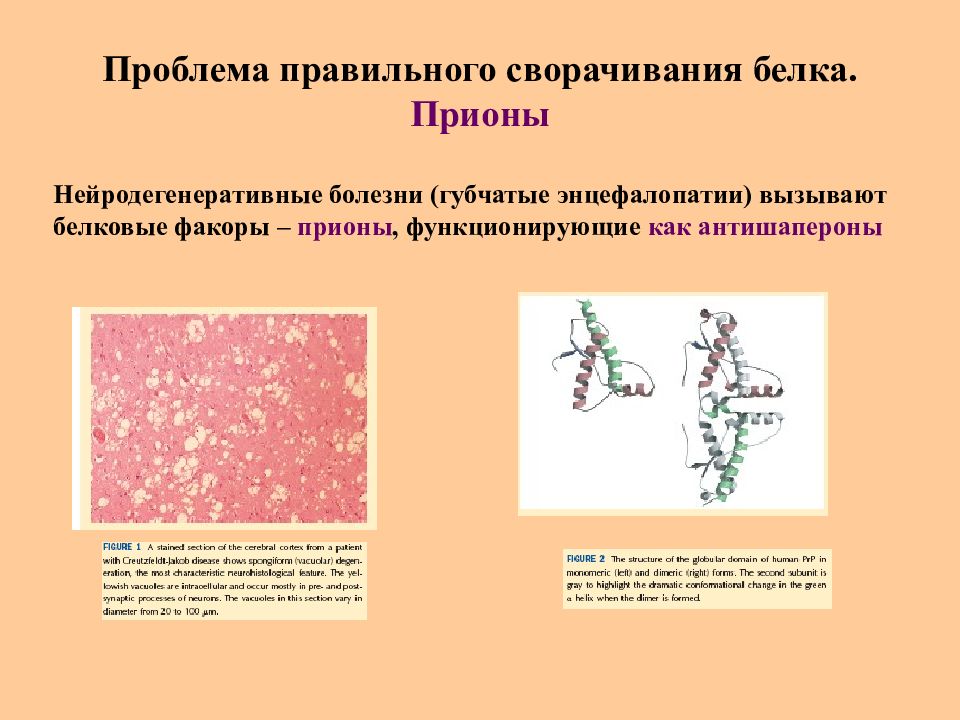
Слайд 41: Проблема правильного сворачивания белка. Прионы
Нейродегенеративные болезни (губчатые энцефалопатии) вызывают белковые факоры – прионы, функционирующие как антишапероны
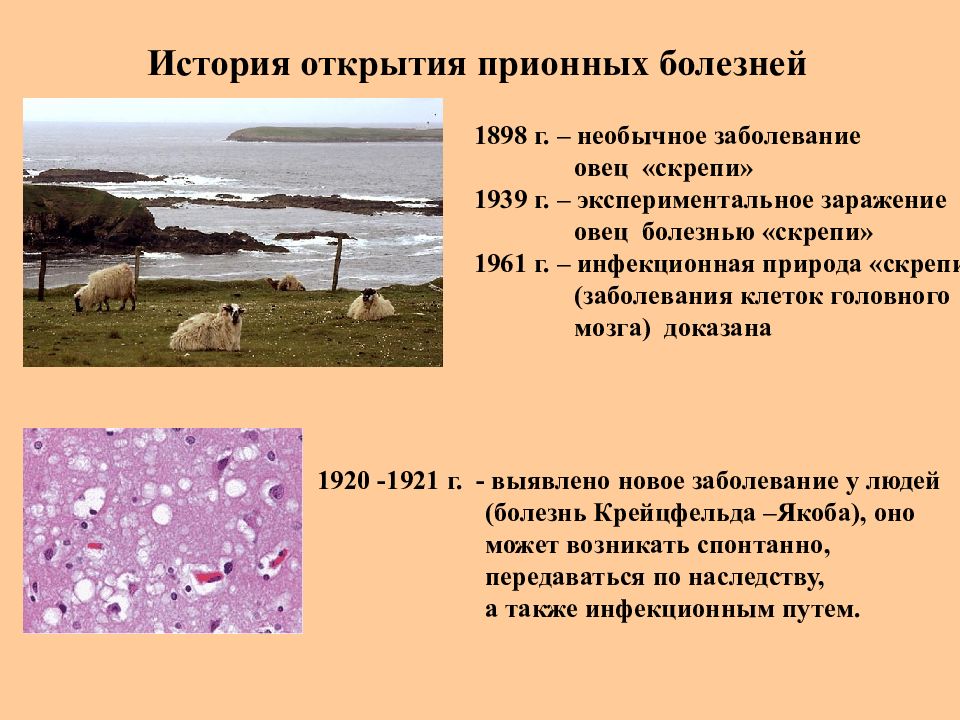
Слайд 42: История открытия прионных болезней
1898 г. – необычное заболевание овец «скрепи» 1939 г. – экспериментальное заражение овец болезнью «скрепи» 1961 г. – инфекционная природа «скрепи» (заболевания клеток головного мозга) доказана 1920 -1921 г. - выявлено новое заболевание у людей (болезнь Крейцфельда –Якоба), оно может возникать спонтанно, передаваться по наследству, а также инфекционным путем.
Слайд 43: История открытия прионных болезней
1955 -1957 гг., Папуа-Новая Гвинея - «куру» («смеющаяся смерть»), новое эндемичное заболевание, по симптомам схожее с болезнью К.-Я. 1992 г., Англия Эпидемия коровьего бешенства, заболело примерно 180000 коров Болезнь передавалась людям, в конце 90-х годов скончалось около 200 чел
Слайд 44: Открытие прионов
1998 г., С.Б. Прузинер - Нобелевская премия за открытие прионов Прионы - это особые белковые молекулы: не содержат ни ДНК, ни РНК; - находятся в тканях здоровых людей и млекопитающих и не наносят вред; - под влиянием некоторых факторов превращаются в маленькие частицы - патогенные; - не подвластны многим воздействиям (выносят кипячение в течение 30 минут, высушивание до 2-х лет, замораживание в 2 раза больше, чем известные вирусы, химической обработке спиртами, кислотами, рентген облучение - не убивает прионы. Только ферменты - трипсин, протеиназа в максимальных дозах денатурируют этот белок. (Иначе говоря, из всего живого прион погибает последним); - накапливаются в мозгу человека или животного и вызывают там необратимые изменения, т.н. губчатые энцефалопатии, размягчение мозга - у людей это БКЯ.
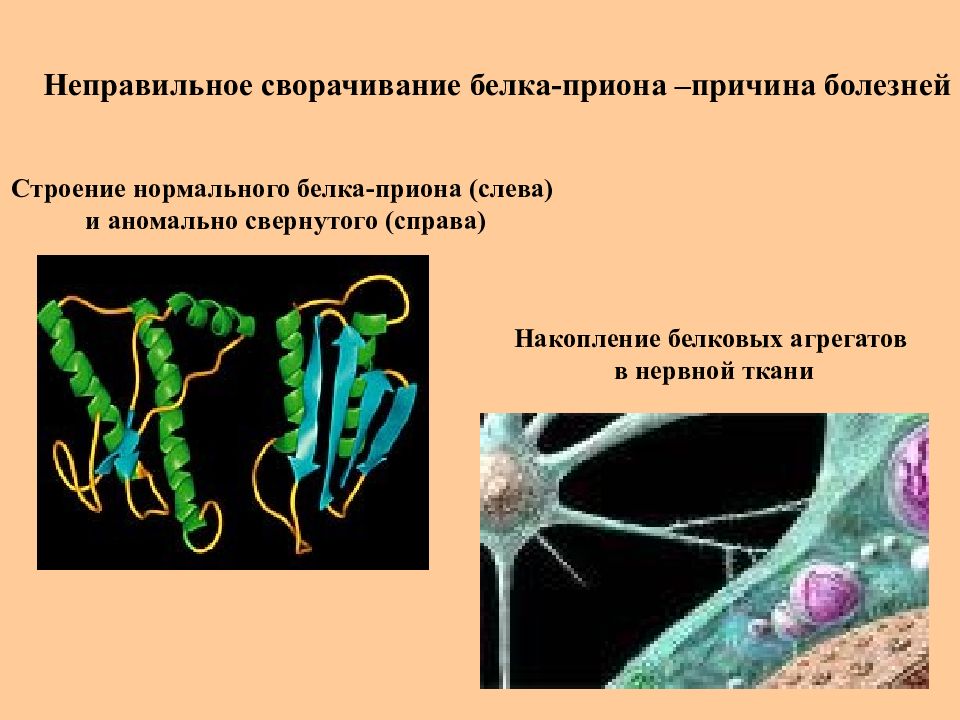
Слайд 46: Неправильное сворачивание белка-приона –причина болезней
Накопление белковых агрегатов в нервной ткани Строение нормального белка-приона (слева) и аномально свернутого (справа)
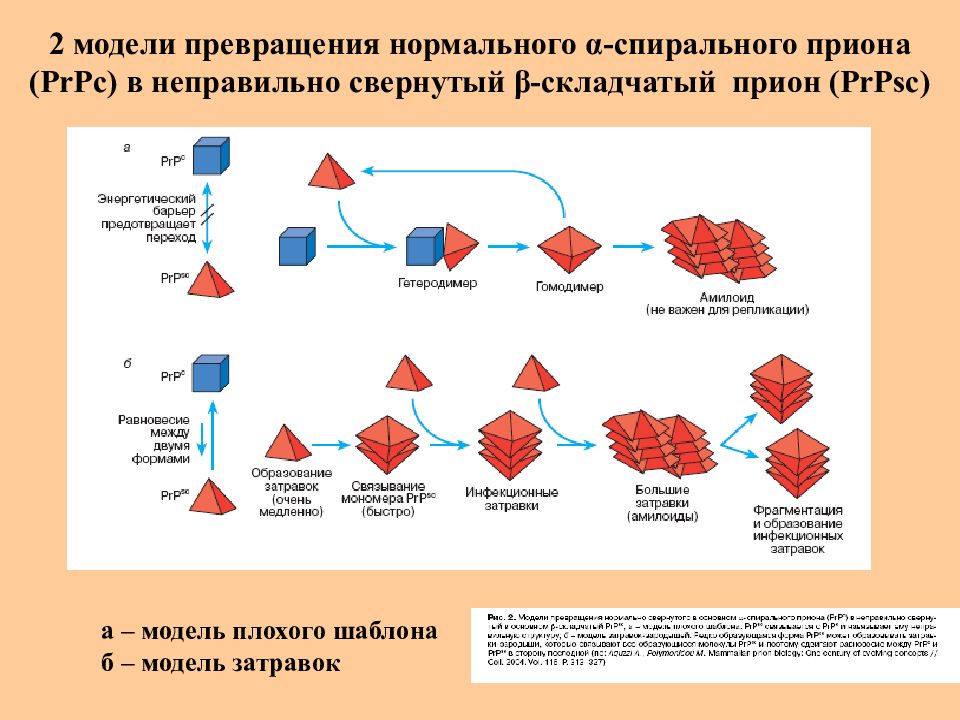
Слайд 47: 2 модели превращения нормального α -спирального приона (Р r Рс) в неправильно свернутый β -складчатый прион (Р rPsc)
а – модель плохого шаблона б – модель затравок
Слайд 48
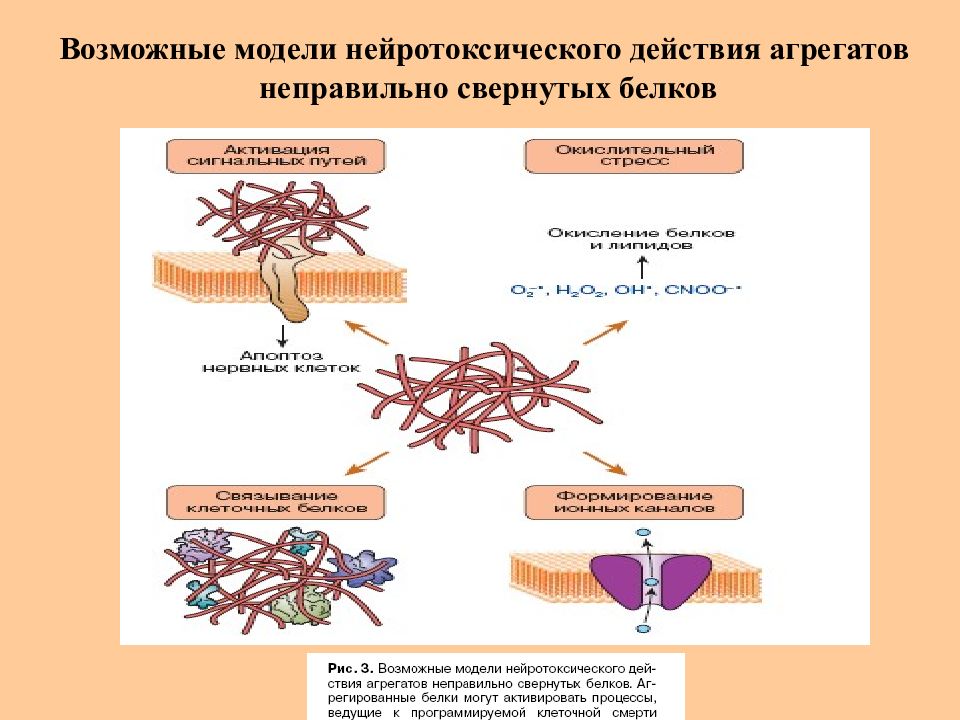
Возможные модели нейротоксического действия агрегатов неправильно свернутых белков
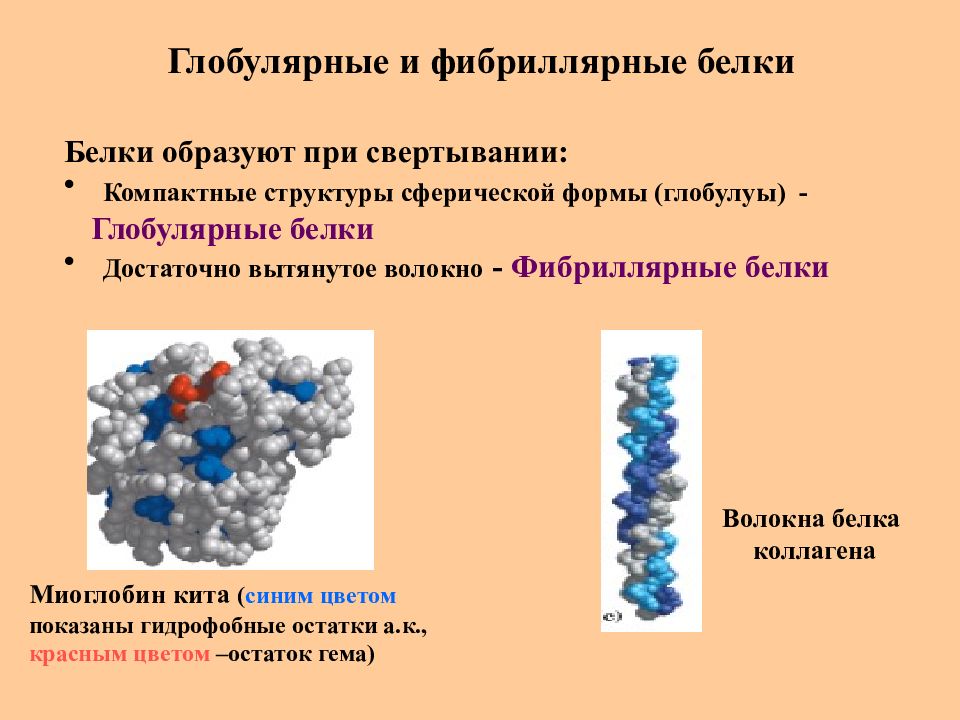
Слайд 49: Глобулярные и фибриллярные белки
Белки образуют при свертывании : Компактные структуры сферической формы (глобулуы) - Глобулярные белки Достаточно вытянутое волокно - Фибриллярные белки Волокна белка коллагена Миоглобин кита ( синим цветом показаны гидрофобные остатки а.к., красным цветом –остаток гема)
Слайд 50: Глобулярные и фибриллярные белки
Глобулярные белки : более сложные по конформации, чем фибриллярные белки способны выполнять самые разные функции в клетках активность этих белков носит динамический характер (ферменты) Свойства глобулярных белков : водорастворимые и амфифильные (мембранные) белки – почти все гидрофобные R - группы скрыты внутри глобулы и экранированы от взаимодействия с Н 2 О, а гидрофильные R - группы находятся на поверхности глобулы в гидратированном состоянии. Фибриллярные белки : представляют собой вытянутые и складчатые структуры выполняют в клетках и тканях структурную функцию нерастворимые в воде, плотные белки Примеры : α -кератин, β -кератин, коллаген, эластин
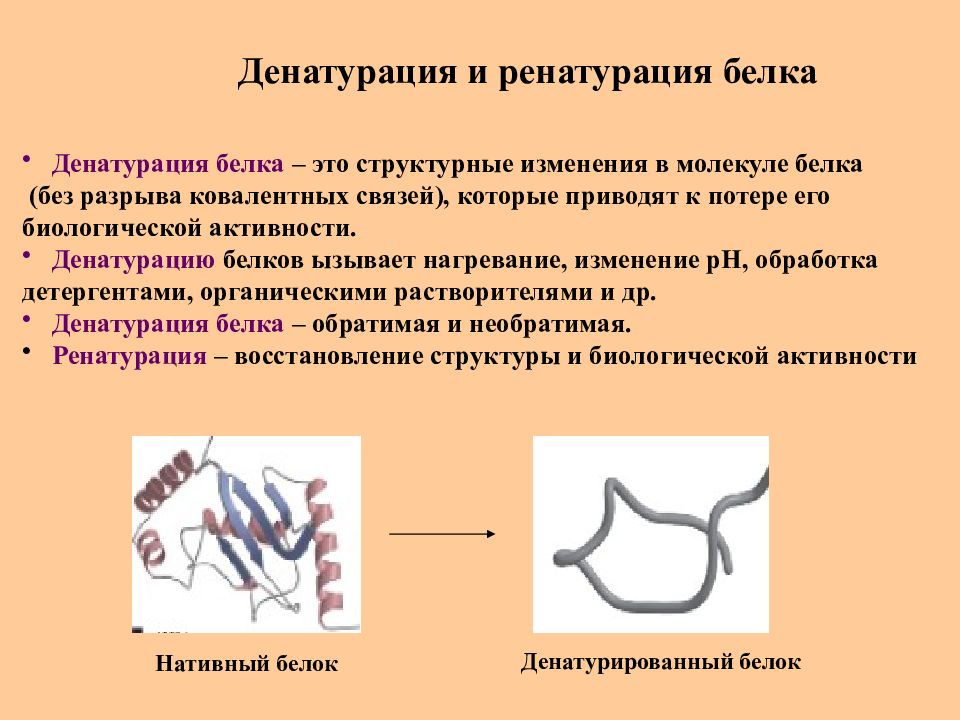
Слайд 51: Денатурация и ренатурация белка
Денатурация белка – это структурные изменения в молекуле белка (без разрыва ковалентных связей), которые приводят к потере его биологической активности. Денатурацию белков ызывает нагревание, изменение рН, обработка детергентами, органическими растворителями и др. Денатурация белка – обратимая и необратимая. Ренатурация – восстановление структуры и биологической активности Нативный белок Денатурированный белок
Слайд 52: Как определить структуру белка
РСА (третичная и четвертичная структура) Методы КД и ДОВ (вторичная структура) ИК- и ЯМР-спектроскопия высокого разрешения (вторичная и третичная структура) Электроно- и нейтронографические методы (третичная и четвертичная структура)
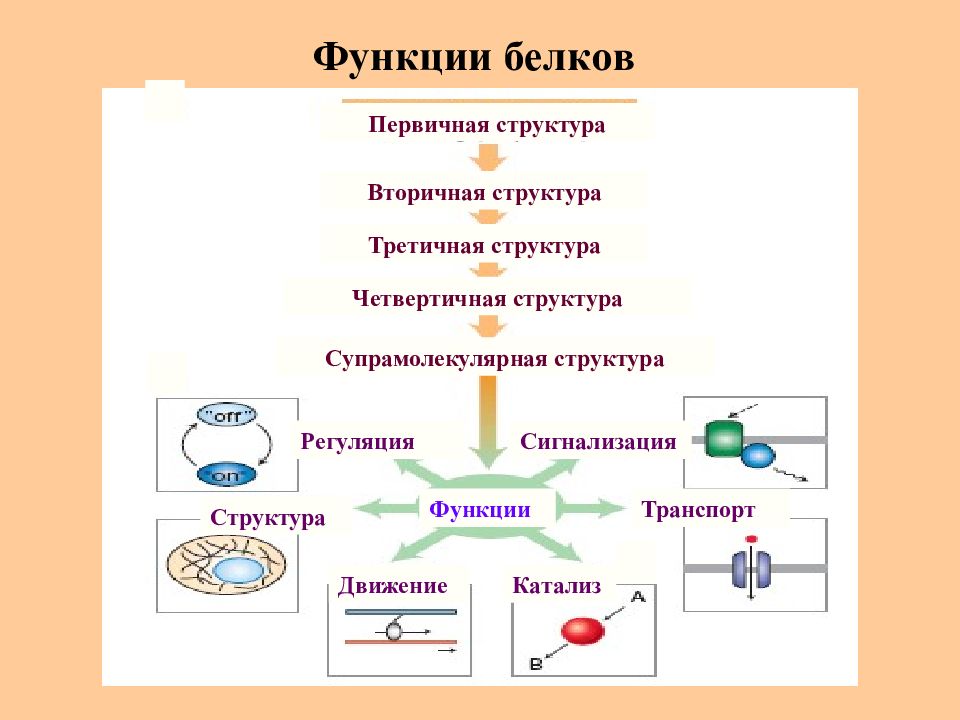
Слайд 53: Функции белков
Регуляция Движение Структура Катализ Транспорт Сигнализация Третичная структура Вторичная структура Первичная структура Четвертичная структура Супрамолекулярная структура Функции
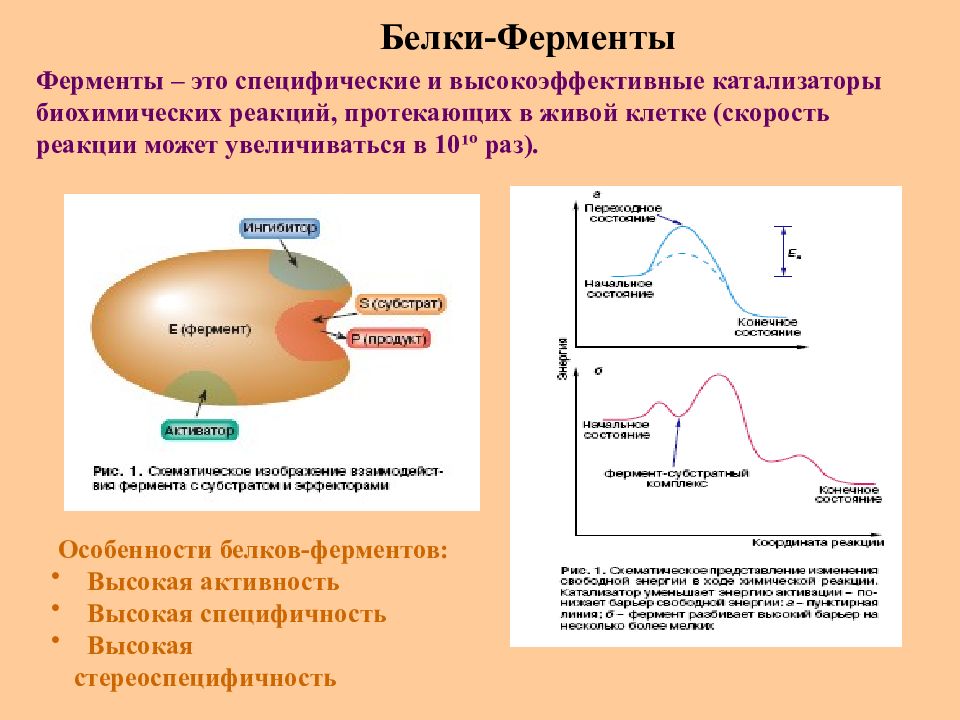
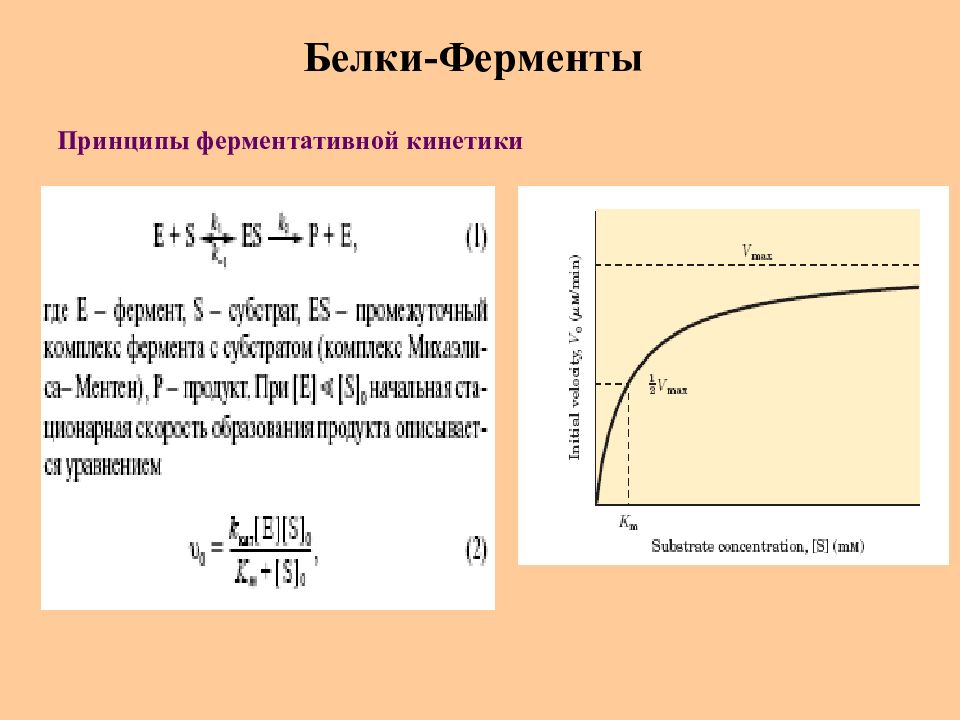
Слайд 54: Белки-Ферменты
Ферменты – это специфические и высокоэффективные катализаторы биохимических реакций, протекающих в живой клетке (скорость реакции может увеличиваться в 10 ¹º раз). Особенности белков-ферментов : Высокая активность Высокая специфичность Высокая стереоспецифичность
Слайд 55
Белки-Ферменты растительного происхождения Фермент бромелин из ананаса Фермент папаин из плодов папайи
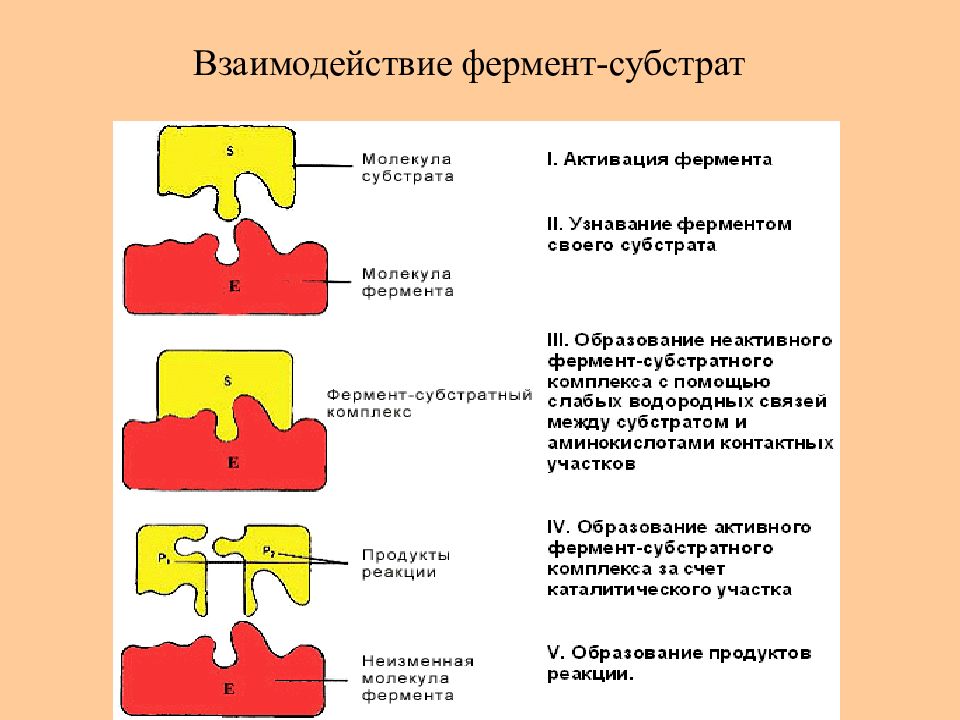
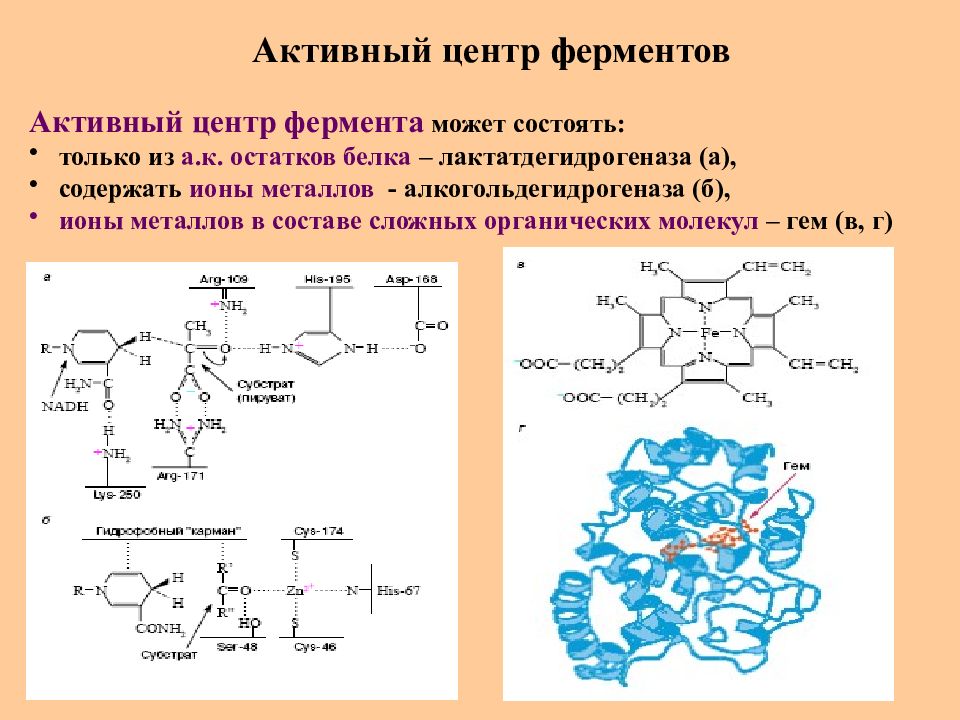
Слайд 58: Активный центр ферментов
Активный центр фермента может состоять : только из а.к. остатков белка – лактатдегидрогеназа (а), содержать ионы металлов - алкогольдегидрогеназа (б), ионы металлов в составе сложных органических молекул – гем (в, г)
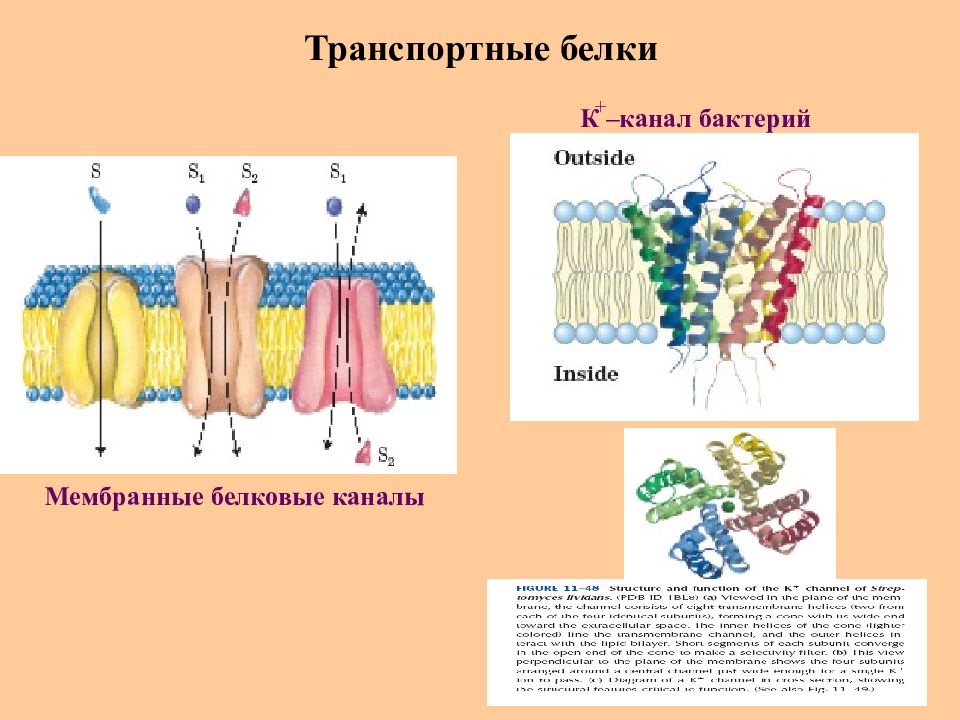
Слайд 59: Транспортные белки
Транспортные белки участвуют в переносе различных веществ и ионов. Примеры : Гемоглобин ( переносит О 2 от легких к тканям ) Миоглобин ( переносит О 2 в мышечной ткани ) Цитохром с (транспорт электронов в дыхательной цепи) Сывороточный альбумин (транспорт жирных кислот в крови) Мембранные белки – каналообразователи (транспорт веществ и ионов через биологические мембраны)
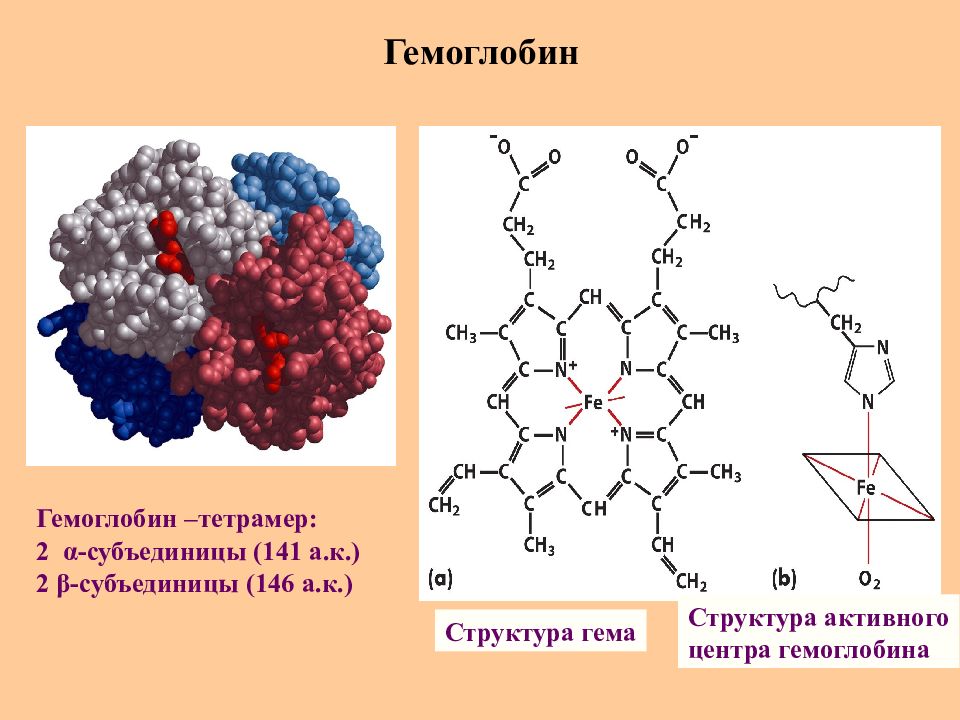
Слайд 60: Гемоглобин
Структура гема Структура активного центра гемоглобина Гемоглобин –тетрамер : 2 α -субъединицы (141 а.к.) 2 β -субъединицы (146 а.к.)
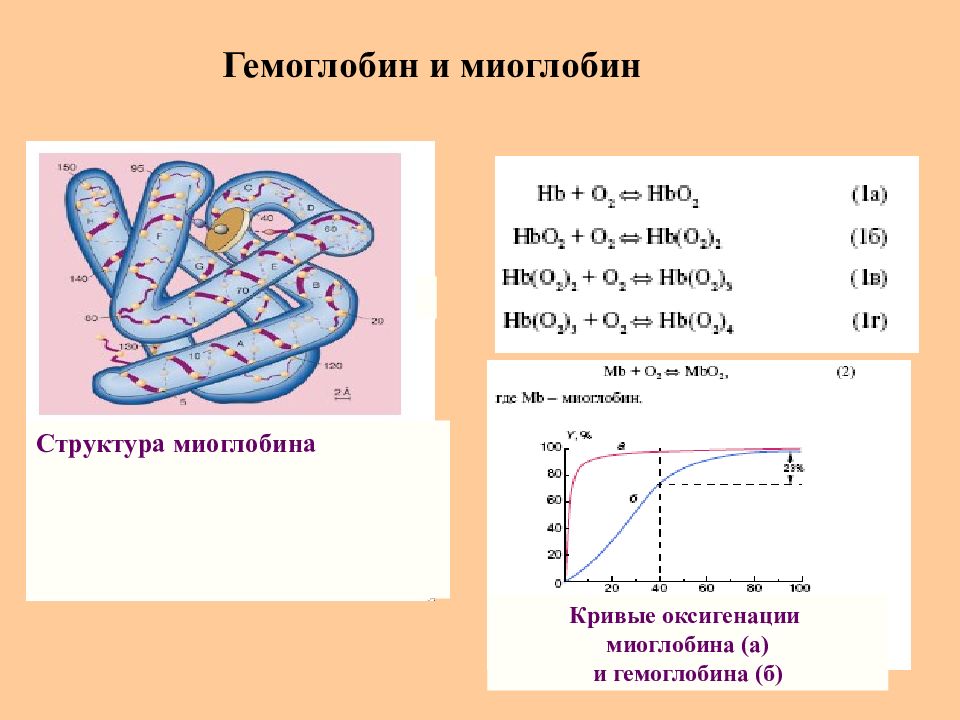
Слайд 61: Гемоглобин и миоглобин
Структура миоглобина Кривые оксигенации миоглобина (а) и гемоглобина (б)
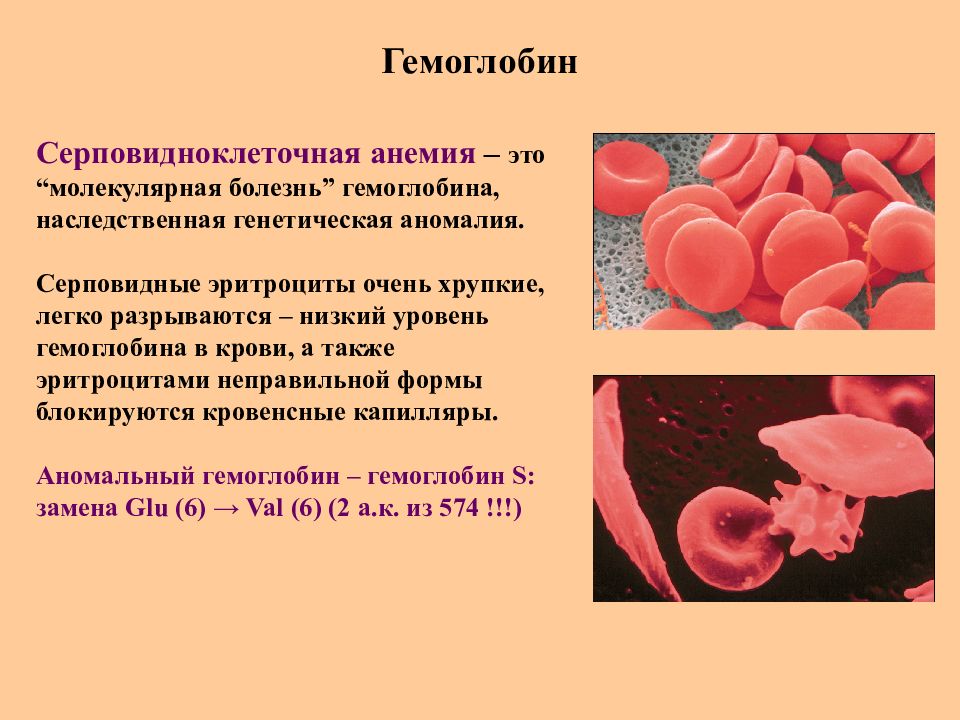
Слайд 62: Гемоглобин
Серповидноклеточная анемия – это “ молекулярная болезнь ” гемоглобина, наследственная генетическая аномалия. Серповидные эритроциты очень хрупкие, легко разрываются – низкий уровень гемоглобина в крови, а также эритроцитами неправильной формы блокируются кровенсные капилляры. Аномальный гемоглобин – гемоглобин S: замена Glu (6) → Val (6) (2 а.к. из 574 !!!)
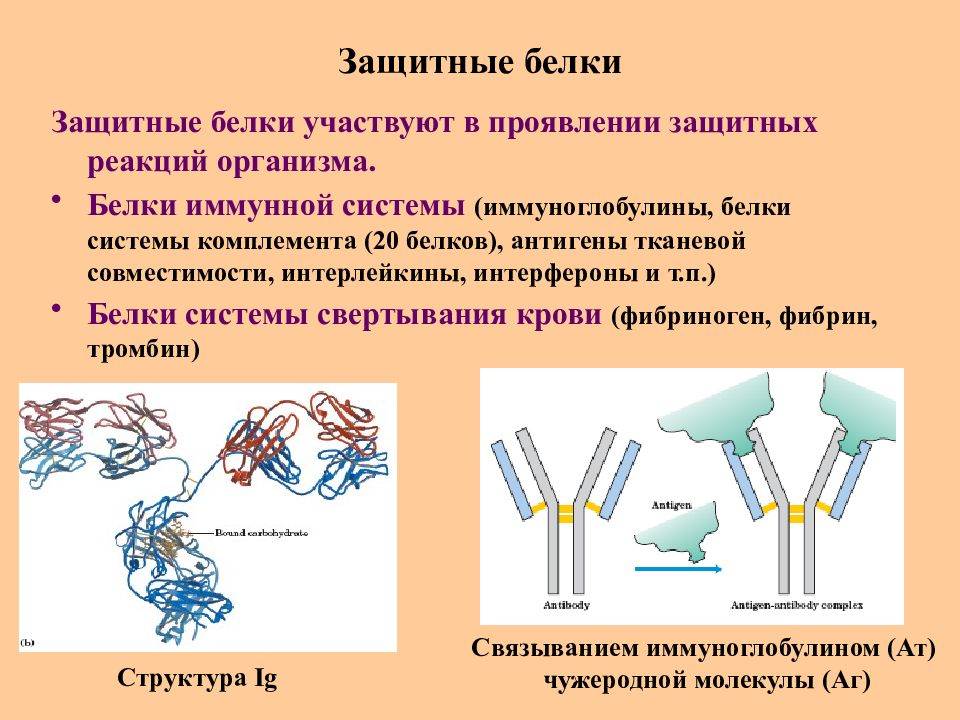
Слайд 64: Защитные белки
Защитные белки участвуют в проявлении защитных реакций организма. Белки иммунной системы (иммуноглобулины, белки системы комплемента (20 белков), антигены тканевой совместимости, интерлейкины, интерфероны и т.п.) Белки системы свертывания крови (фибриноген, фибрин, тромбин) Структура Ig Связыванием иммуноглобулином (Ат) чужеродной молекулы (Аг)
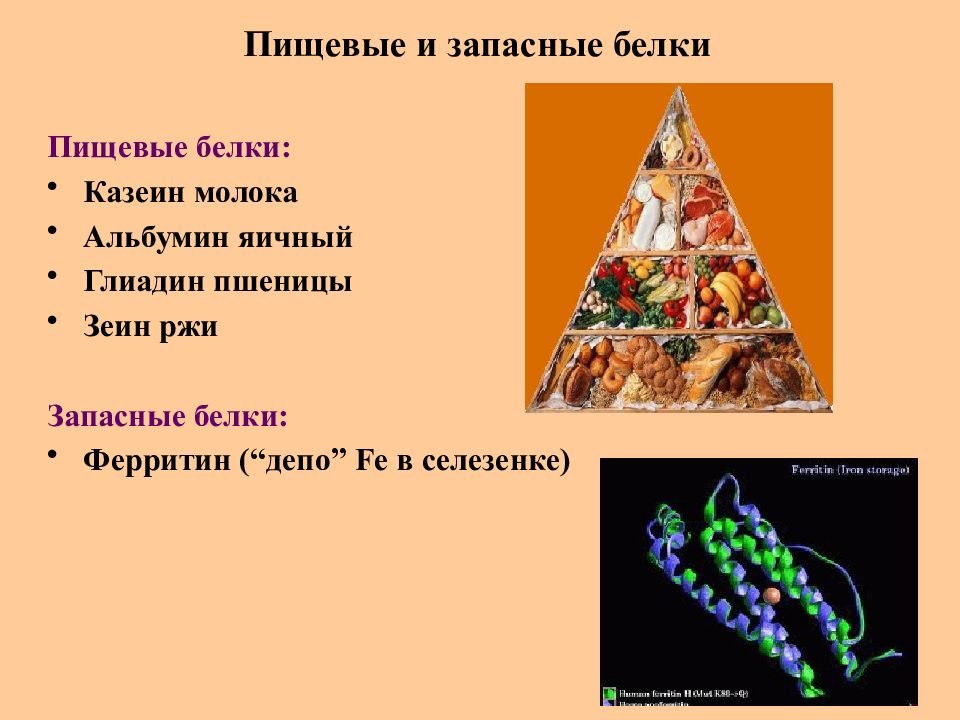
Слайд 65: Пищевые и запасные белки
Пищевые белки : Казеин молока Альбумин яичный Глиадин пшеницы Зеин ржи Запасные белки : Ферритин ( “ депо ” Fe в селезенке)
Слайд 66: Белки-гормоны
Гормоны – биологически активные регуляторы, вырабатываются в эндокринных железах и разносятся по кровяному руслу к клеткам-мишеням. Существует 3 класса гормонов – пептидно-белковые, стероидные, биогенные амины (адреналин). Белковые гормоны – все гормоны гипоталамуса, некоторые гормоны гипофиза и др. (соматотропин, тиротропин, гонадотропин, пролактин, инсулин, паратропин). Пептидные гормоны – окситоцин, вазопрессин, глюкагон, гастрин, кальцитонин, тканевые гормоны брадикинин и ангиотензин.
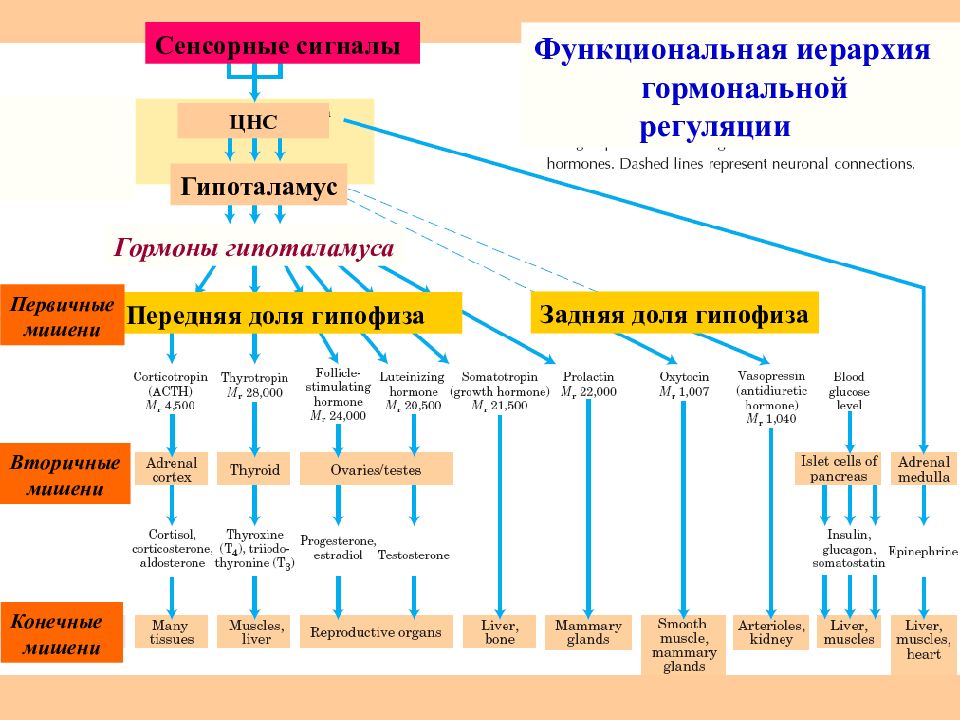
Слайд 67
ЦНС Гипоталамус Гормоны гипоталамуса Передняя доля гипофиза Задняя доля гипофиза Первичные мишени Вторичные мишени Конечные мишени Сенсорные сигналы Функциональная иерархия гормональной регуляции
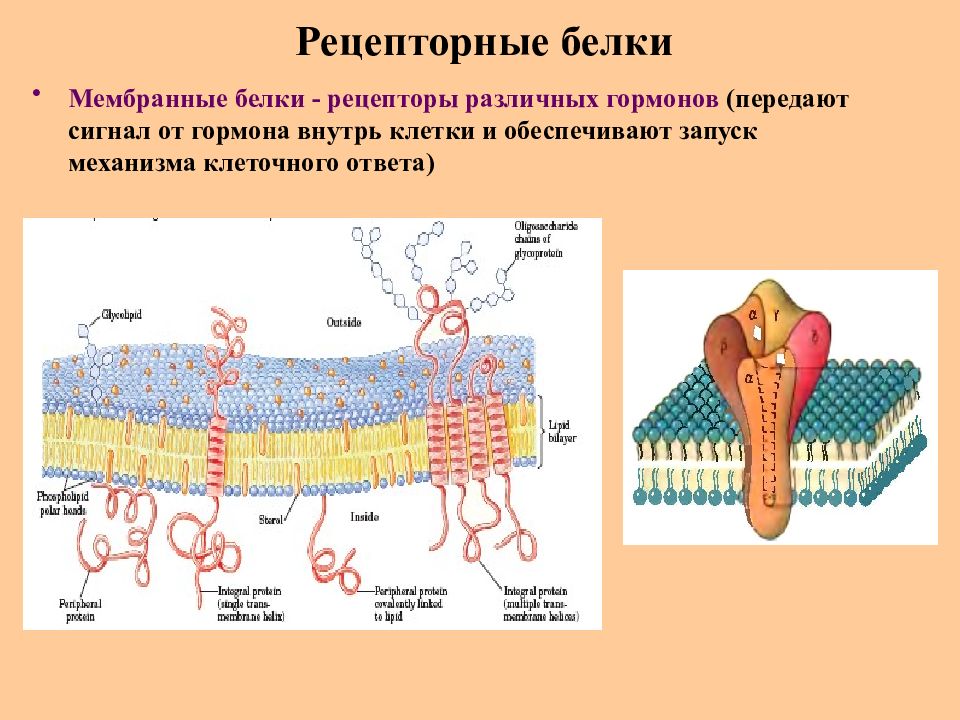
Слайд 68: Рецепторные белки
Рецепторные белки : Родопсин зрительного аппарата животных (восприятие и преобразование световых сигналов) Бактериородопсин галофильных бактерий Мембранные белки - рецепторы различных гормонов (передают сигнал от гормона внутрь клетки и обеспечивают запуск механизма клеточного ответа) Рецепторы клеточной поверхности эритроцитов, лимфоцитов, макрофагов (выработка организмом иммунного ответа) Рецепторы нейропептидов головного мозга (регуляция поведения и высшей нервной деятельности)
Слайд 69: Рецепторные белки
Мембранные белки - рецепторы различных гормонов (передают сигнал от гормона внутрь клетки и обеспечивают запуск механизма клеточного ответа)
Слайд 70: Регуляторные белки и пептиды
Регуляторные белки необходимы для функционирования различных звеньев клеточного метаболизма : Гистоны, репрессоры, рибосомальные факторы инициации транскрипции и т.п. (регулируют активность генов и биосинтез белка). “ Воротные ” белки мембранных каналов (регулируют транспорт через биомембраны).
Слайд 71: Структурные белки
Структурные белки составляют остов многих тканей и органов. Являются фибриллярными белками Это белки соединительной ткани : коллаген (кости, хрящи, кожа, сухожилия) α - и β - кератины (волосы, шерсть, чешуя, панцири и т.д.) эластин (связки, стенки сосудов и др.) фиброин (шелк, паутина) протеогликаны ( клеточные стенки бактерий)
Слайд 72: Структурные белки
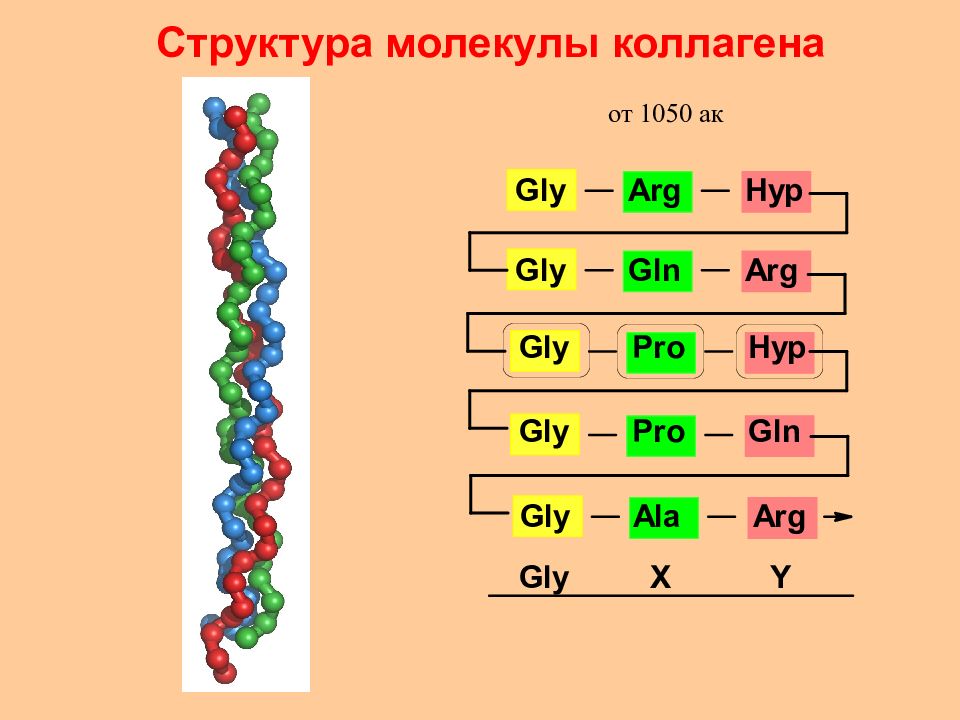
Коллаген образует основу сухожилий, хрящей, кожи, зубов и костей. Структурная единица волокон коллагена – тропоколлаген. Тропоколлаген – это ассоциат из 3-х навитых друг на друга полипептидных цепей ( по 1000 а.к.), каждая из которых образует изломанную спираль особого типа (21% Pro и Гидрокси Pro ). Фибриллы коллагена нерастяжимы и имеют большую прочность на разрыв. Тропоколлаген Фибриллы коллагена Коллаген
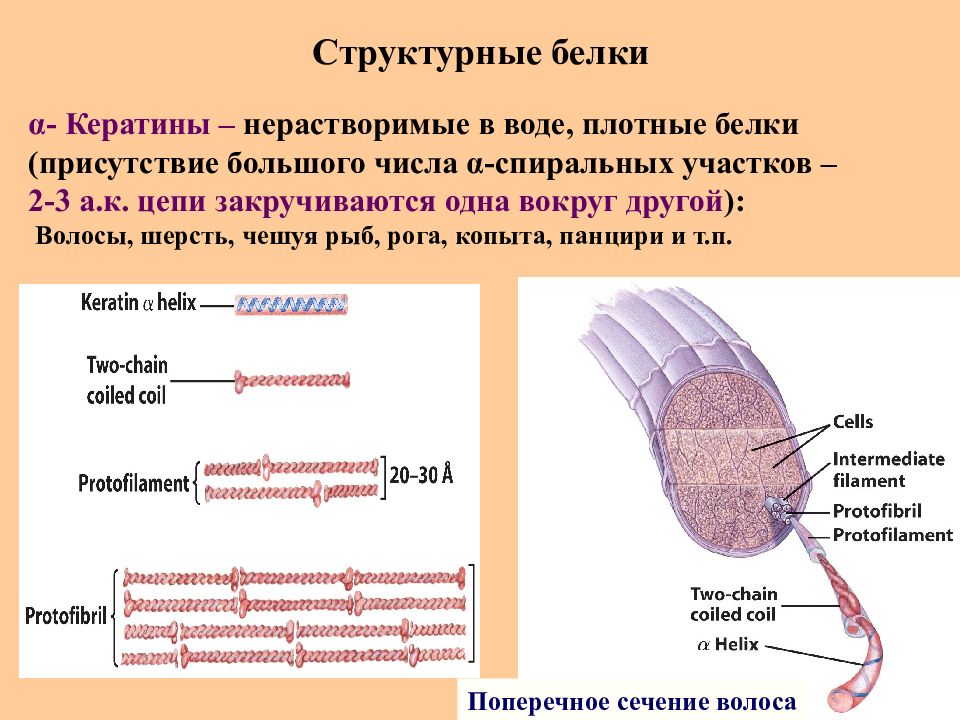
Слайд 73: Структурные белки
Поперечное сечение волоса α - Кератины – нерастворимые в воде, плотные белки (присутствие большого числа α -спиральных участков – 2-3 а.к. цепи закручиваются одна вокруг другой ) : Волосы, шерсть, чешуя рыб, рога, копыта, панцири и т.п.
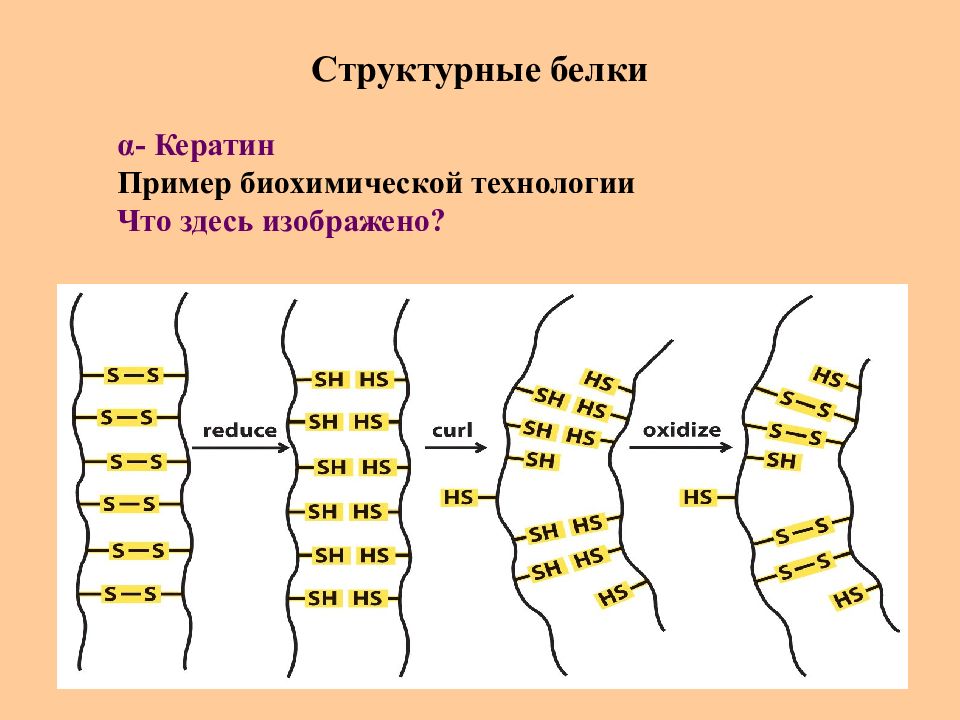
Слайд 74: Структурные белки
α - Кератин Пример биохимической технологии Что здесь изображено ?
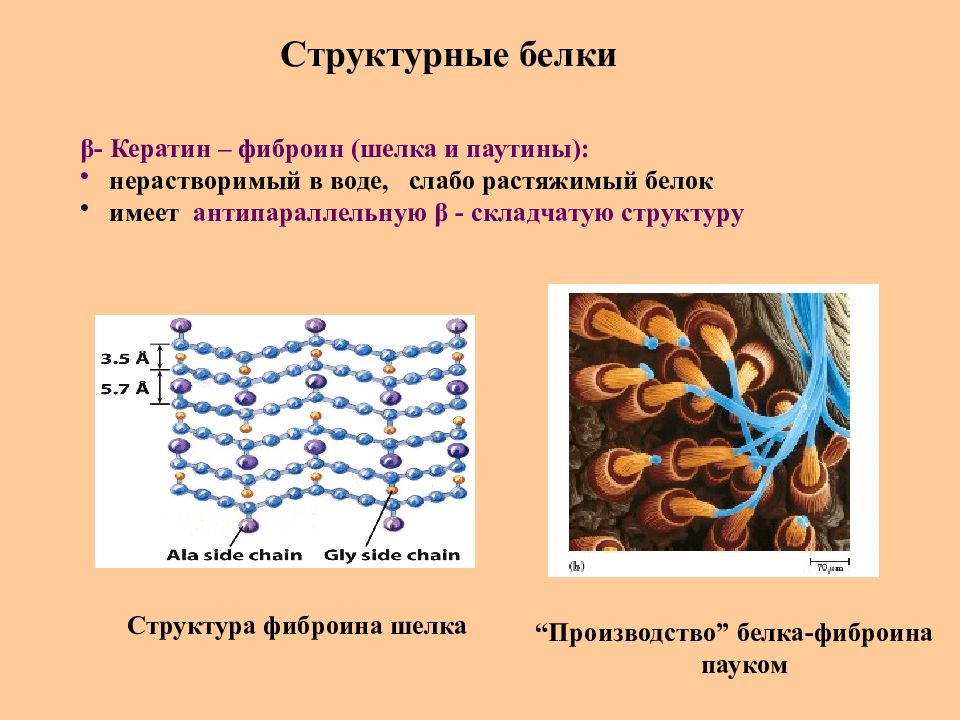
Слайд 75: Структурные белки
β - Кератин – фиброин (шелка и паутины) : нерастворимый в воде, слабо растяжимый белок имеет антипараллельную β - складчатую структуру Структура фиброина шелка “ Производство ” белка-фиброина пауком
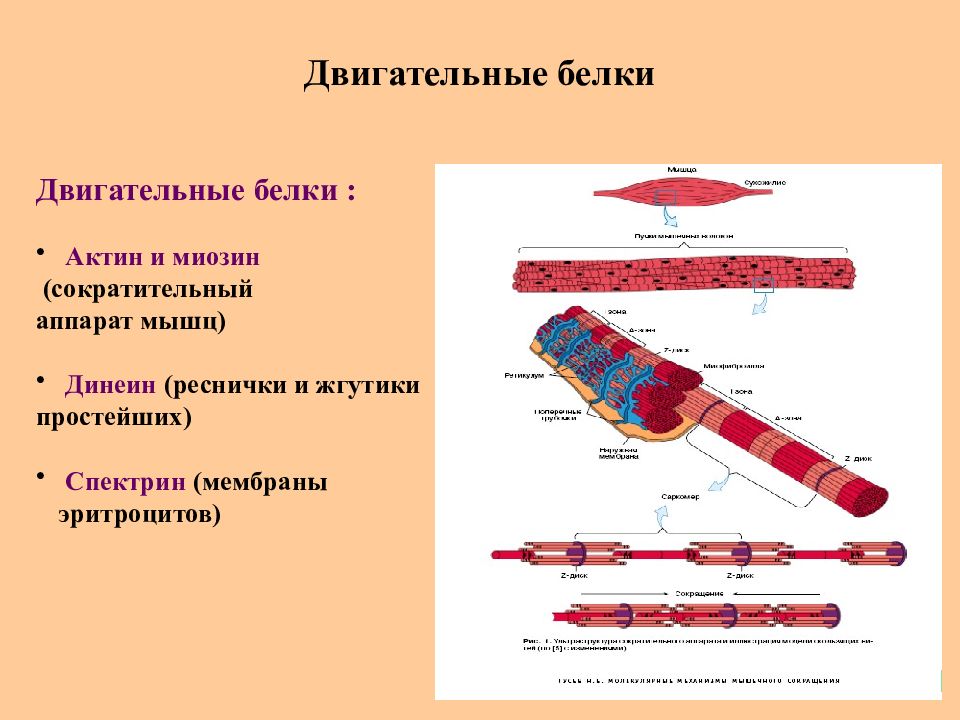
Слайд 76: Двигательные белки
Двигательные белки : Актин и миозин (сократительный аппарат мышц) Динеин (реснички и жгутики простейших) Спектрин (мембраны эритроцитов)
Слайд 77: Антибиотики белково-пептидной природы
Антибиотики – химические агенты, продуцируемые микроорганизмами, обладают прямым и избирательным ингибирующим действием на живые клетки (антибактериальные, противовирусные, противогрибковые, противоопухолевые антибиотики). Пептидные антибиотики : грамицидины А, В, С, S, полимиксины, актиномицины, валиномицин и многие другие. Белковые антибиотики : неокарциностатин, актиноксантин и другие.
Слайд 78: Токсины пептидно-белковой природы
Белками являются самые мощные из известных токсинов микробного происхождения : Ботулинический токсин Столбнячный токсин Дифтерийный токсин Холерный токсин Белки – зоотоксины ( змей, скорпионов, пауков, и др.) Белки – фитотоксины (рицин из клещевины) Пептидные токсины (ядовитых грибов, яда пчел, морских беспозвоночных)
Последний слайд презентации: Аминокислоты. Пептиды. Белки: Пептиды со вкусовыми качествами
Пептиды со вкусовыми качествами : Заменители сахара – аспартам Asp-Phe-OMe ( в 200 раз слаще сахара, низкая калорийность) “ Вкусный пептид ” Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala ( получают при обработке мяса папаином) Белки с интенсивным сладким вкусом – тауматин (207 а.к.) и монеллин (94 а.к.) из плодов африканских растений (слаще сахара в 100 000 раз)