Первый слайд презентации
Лекция «Термодинамика физико-химических процессов." Кафедра химии ВятГГУ
Слайд 3
Термодинамика изучает: соотношение между тепловой и другими формами энергии в химических реакциях; возможность самопроизвольного протекания реакций в данных условиях; условия, при которых химические реакции находятся в состоянии равновесия. Термодинамика - наука о превращении одних веществ в другие
Слайд 4
Системы в термодинамике: Открытые – обмен веществом и энергией Закрытые – обмен только энергией Изолированные – нет обмена ни веществом, ни энергией Равновесные – не происходит видимых изменений Стационарные – видимых изменений нет, но есть обмен веществом и энергией Гомогенные – нет раздела границы фаз Гетерогенные– граница раздела фаз присутствует
Слайд 5
Работа – количественная мера направленного движения молекул в одностороннем направлении.
Слайд 6
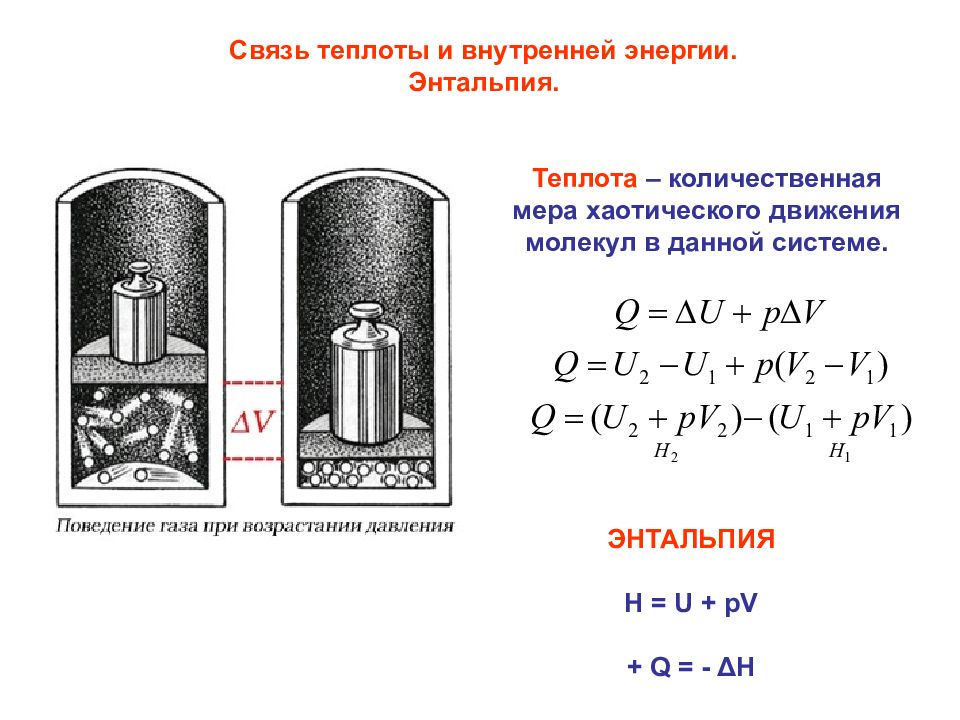
Связь теплоты и внутренней энергии. Энтальпия. Теплота – количественная мера хаотического движения молекул в данной системе. ЭНТАЛЬПИЯ H = U + pV + Q = - Δ H
Слайд 7
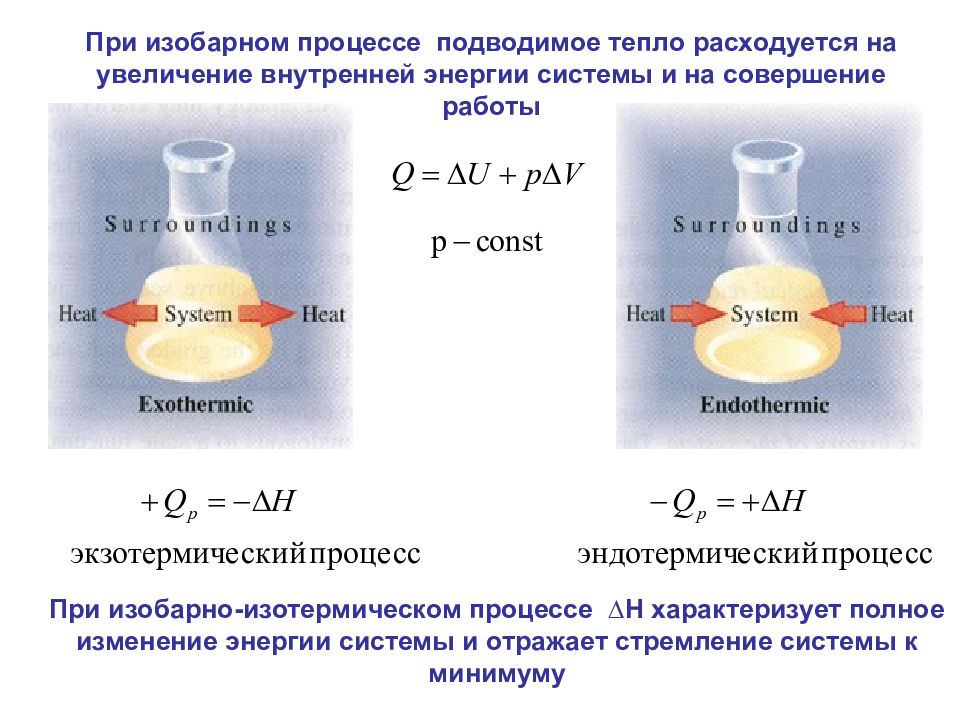
При изобарно-изотермическом процессе ∆Н характеризует полное изменение энергии системы и отражает стремление системы к минимуму При изобарном процессе подводимое тепло расходуется на увеличение внутренней энергии системы и на совершение работы
Слайд 8
При изохорном процессе все подводимое тепло расходуется на увеличение внутренней энергии системы.
Слайд 9
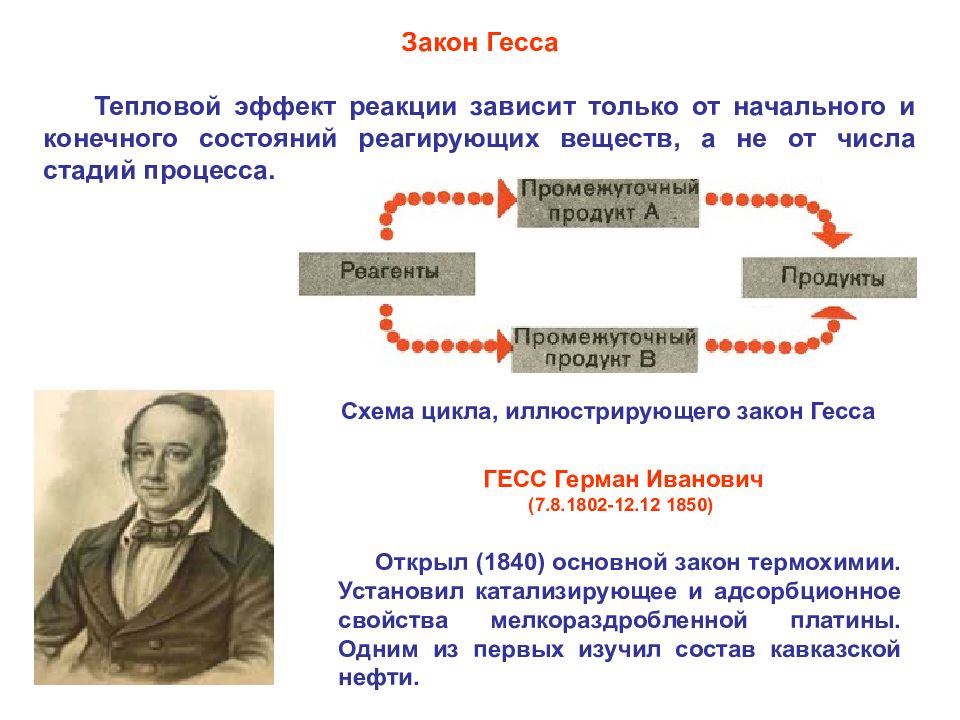
I закон термодинамики: Если к закрытой системе подводить тепло, энергия будет расходоваться на увеличение внутренней энергии и совершение работы: В изолированной системе ∆U = 0; Энергия не исчезает и не возникает из ничего, а только превращается из одной формы в другую в строго эквивалентных количествах ( вечный двигатель создать невозможно!!! ) Следствием I закона термодинамики является закон Гесса
Слайд 10
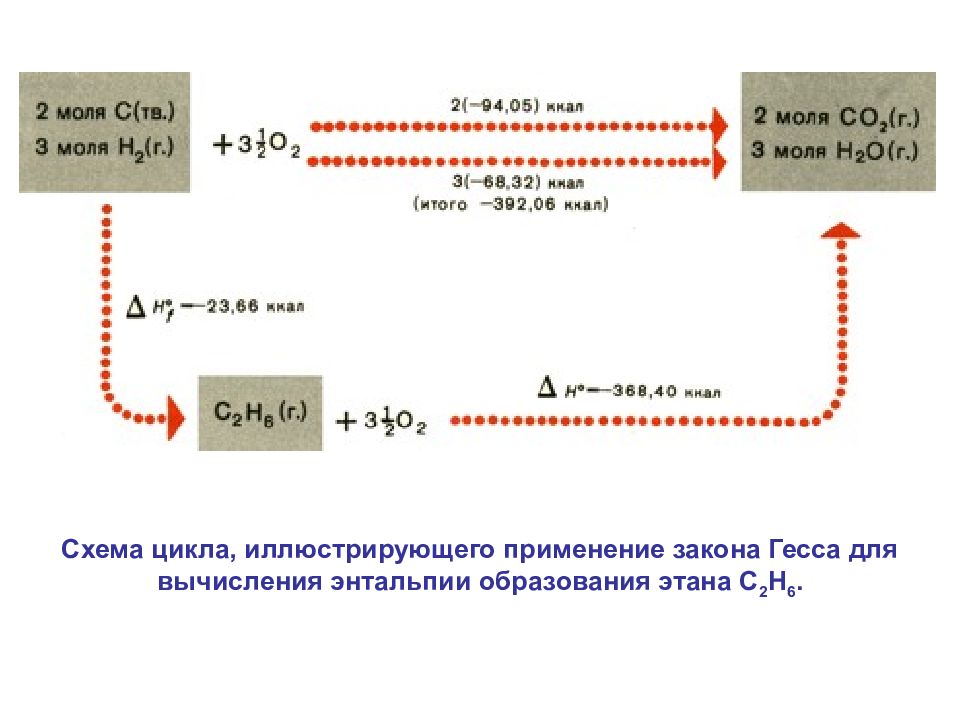
Открыл (1840) основной закон термохимии. Установил катализирующее и адсорбционное свойства мелкораздробленной платины. Одним из первых изучил состав кавказской нефти. ГЕСС Герман Иванович (7.8.1802-12.12 1850) Закон Гесса Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ, а не от числа стадий процесса. Схема цикла, иллюстрирующего закон Гесса
Слайд 12
Следствия из закона Гесса: 1. Тепловой эффект реакции при стандартных условиях равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ, умноженных на соответствующие коэффициенты в реакции
Слайд 13
Схема цикла, иллюстрирующего применение закона Гесса для вычисления энтальпии образования этана С 2 Н 6.
Слайд 14
2. Тепловой эффект реакции при стандартных условиях равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты: Подавляющее большинство органических соединений нельзя синтезировать непосредственно из простых веществ и одновременно определить теплоту образования этих соединений. Поэтому за основу для расчета берут экспериментально легко определяемые теплоты (энтальпии) сгорания.
Слайд 15
Помним, что стандартная теплота образования простых веществ равна нулю ! Стандартная теплота сгорания оксидов также равна нулю !
Слайд 16
Первый закон термодинамики позволяет рассчитать энергетический баланс химического процесса.
Слайд 18
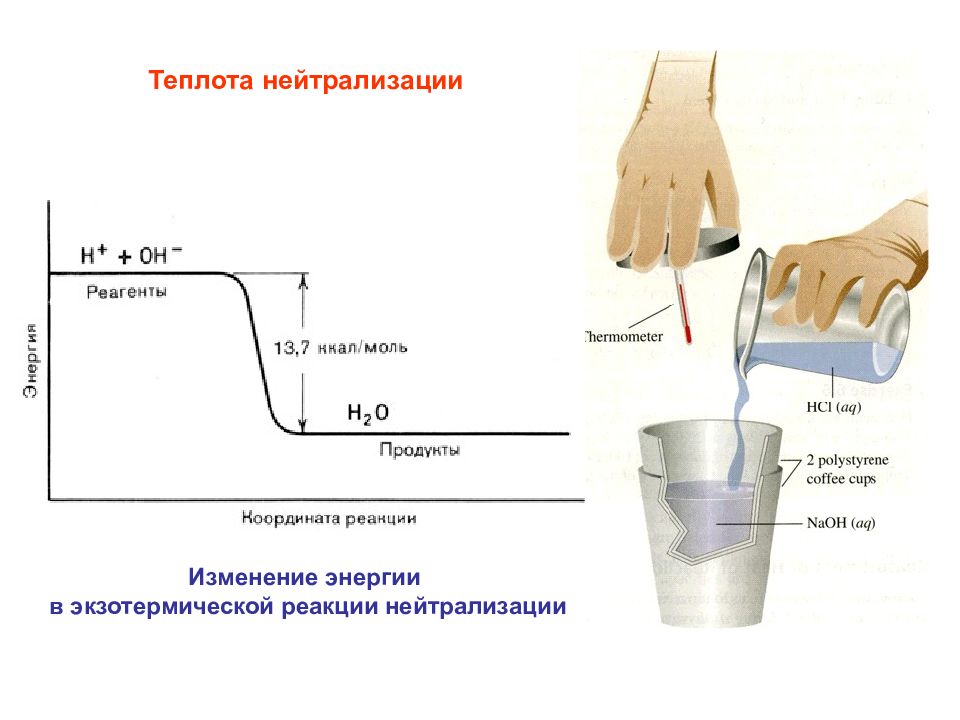
Теплота нейтрализации Изменение энергии в экзотермической реакции нейтрализации
Слайд 19
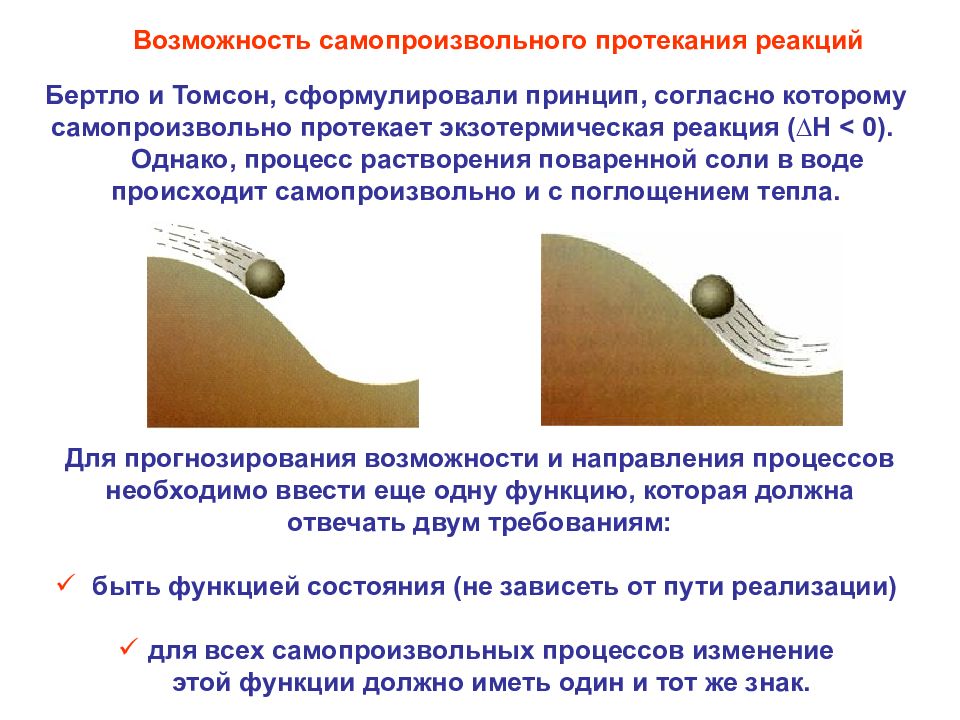
Для прогнозирования возможности и направления процессов необходимо ввести еще одну функцию, которая должна отвечать двум требованиям: быть функцией состояния (не зависеть от пути реализации) для всех самопроизвольных процессов изменение этой функции должно иметь один и тот же знак. Возможность самопроизвольного протекания реакций Бертло и Томсон, сформулировали принцип, согласно которому самопроизвольно протекает экзотермическая реакция (∆Н < 0). Однако, процесс растворения поваренной соли в воде происходит самопроизвольно и с поглощением тепла.
Слайд 20
Энтропия - S 1.Физический смысл Рассмотрим термос с двумя слоями жидкости «сироп - газированная вода». Через некоторое время в термосе получится однородный по цвету и составу коктейль. Поскольку система изолированная, Δ Н=0 и Δ Е=0. Вместе с тем, очевидно, что ее состояние изменилось – произошло перераспределение компонентов внутри системы. Это изменение как раз и характеризуется увеличением энтропии: Δ S> 0.
Слайд 21
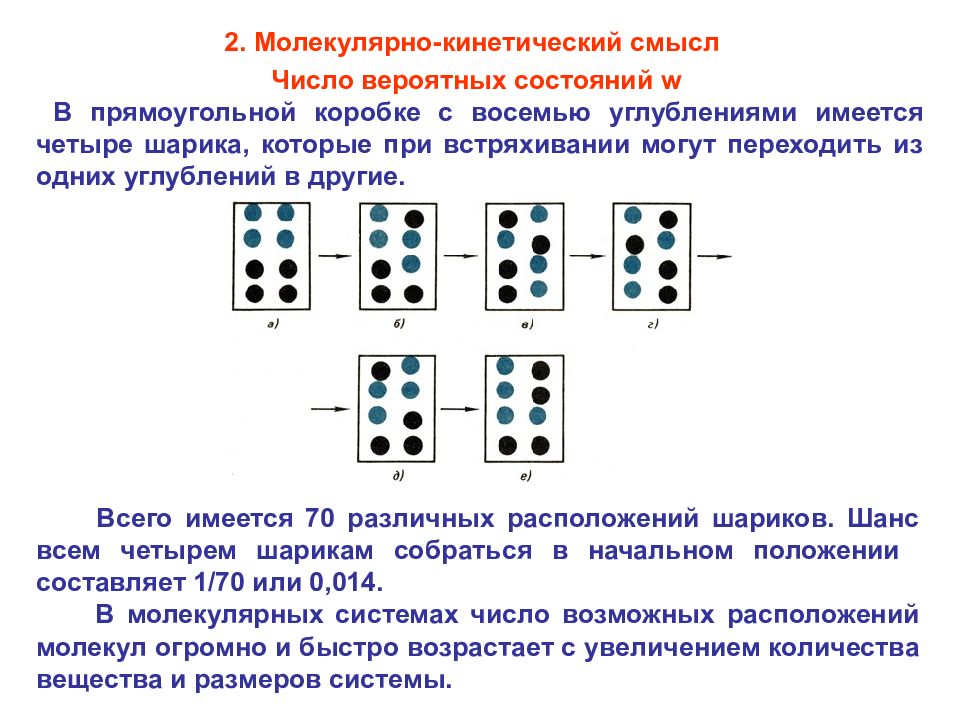
Число вероятных состояний w В прямоугольной коробке с восемью углублениями имеется четыре шарика, которые при встряхивании могут переходить из одних углублений в другие. Всего имеется 70 различных расположений шариков. Шанс всем четырем шарикам собраться в начальном положении составляет 1/70 или 0,014. В молекулярных системах число возможных расположений молекул огромно и быстро возрастает с увеличением количества вещества и размеров системы. 2. Молекулярно-кинетический смысл
Слайд 22
Чем большим числом микрочастиц представлена рассматриваемая макросистема, тем больше вариантов распределения этих частиц, тем выше значение энтропии. Энтропия ( S ) есть мера вероятности пребывания системы в данном состоянии или мера неупорядоченности системы! Без постороннего вмешательства невозможен ни один процесс, результатом которого является повышение порядка, то есть уменьшение энтропии!
Слайд 23
Людвиг Больцман (20.02.1844 – 05.09.1906) Окончил Венский университет в 1867 г. Занимал профессорские должности в университетах Вены, Граца, Мюнхена и Лейпцига. В 1870 году вывел знаменитое выражение для энтропии (меры беспорядка) термодинамической системы через логарифм числа возможных состояний R – универсальная газовая постоянная (8,314 Дж/(моль·К) N a – постоянная Авогадро (6,02·10 23 ) ω - число вероятных состояний системы Уравнение Больцмана ( связь энтропии с числом вероятных состояний ) (формулу он завещал выбить на своей могильной плите).
Слайд 24
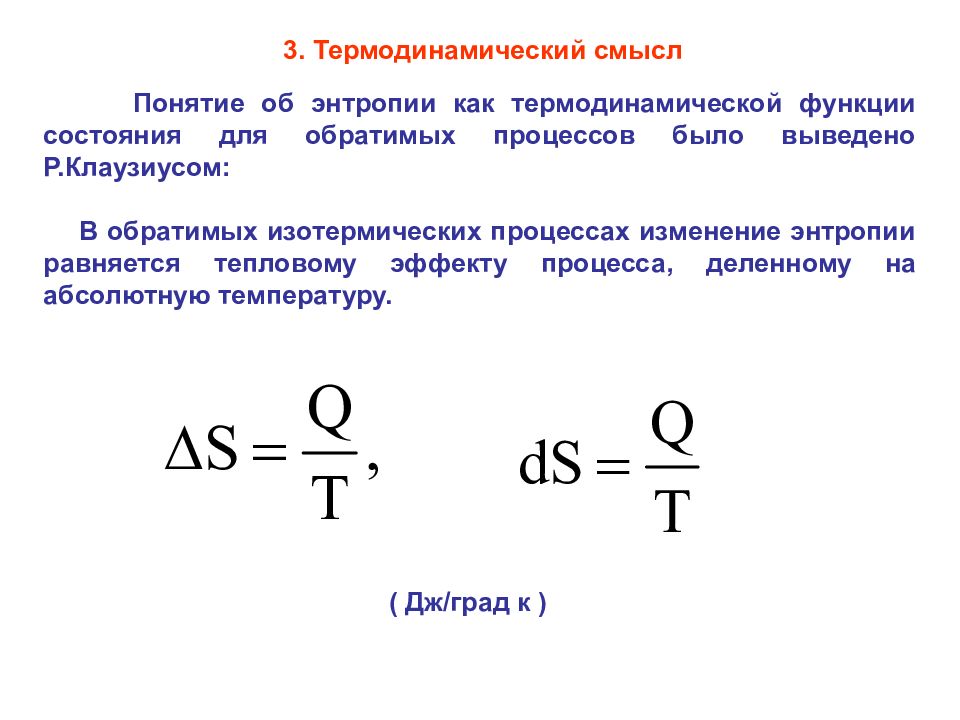
Понятие об энтропии как термодинамической функции состояния для обратимых процессов было выведено Р.Клаузиусом: В обратимых изотермических процессах изменение энтропии равняется тепловому эффекту процесса, деленному на абсолютную температуру. ( Дж/град к ) 3. Термодинамический смысл
Слайд 25
Примером может служить медленное таяние льда в термосе с водой при 273 о К (0 о С), для чего к 18 г льда (1моль) необходимо подвести 6000 Дж теплоты. Энтропия в системе лед - вода возрастет на 6000:273 = 22 Дж/К. Аналогично для образования 1 моль льда придется отвести 6000 Дж теплоты, при этом Δ S = - 22 Дж/К. Изменение энтропии в обратимом изотермическом процессе зависит только от начального и конечного состояний и не зависит от пути перехода, следовательно, энтропия также относится к функциям состояния!
Слайд 26
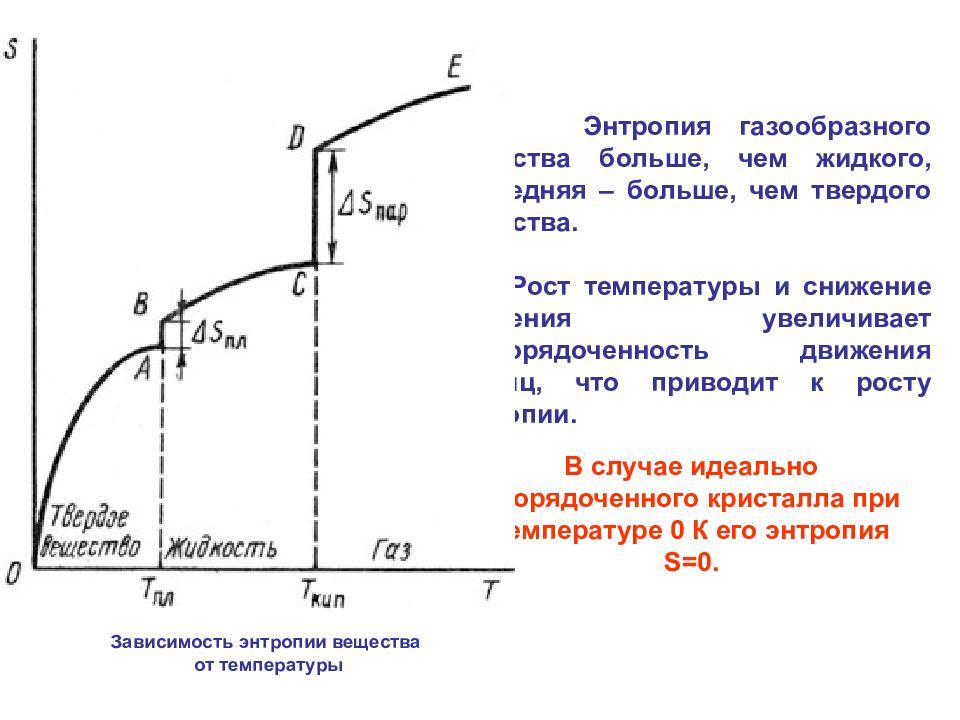
Зависимость энтропии вещества от температуры Энтропия газообразного вещества больше, чем жидкого, последняя – больше, чем твердого вещества. Рост температуры и снижение давления увеличивает неупорядоченность движения частиц, что приводит к росту энтропии. В случае идеально упорядоченного кристалла при температуре 0 К его энтропия S =0.
Слайд 27
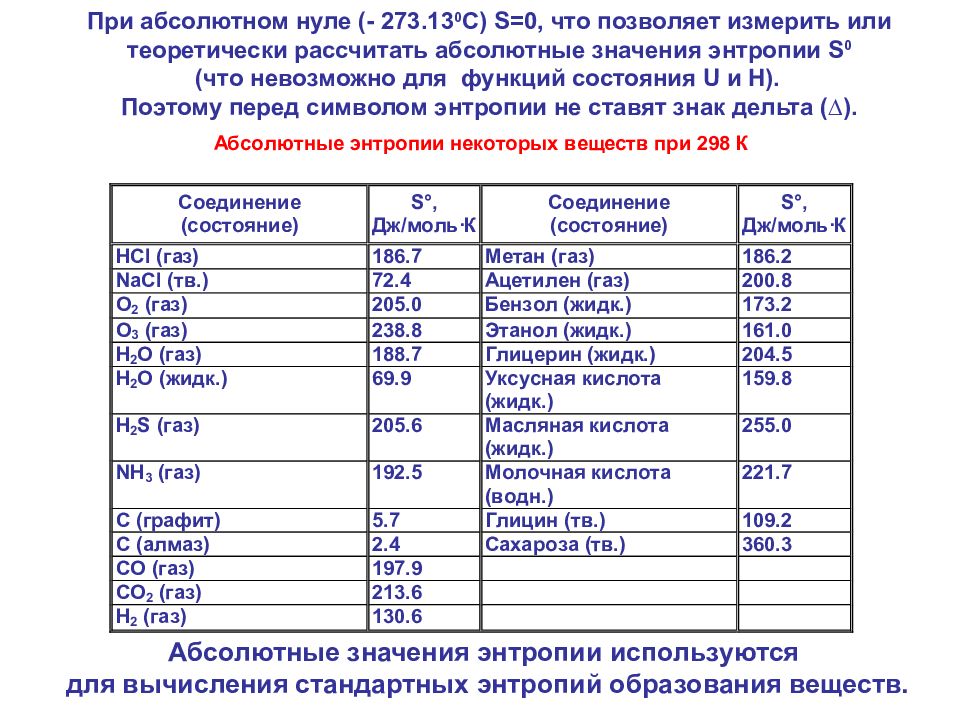
При абсолютном нуле (- 273.13 0 С) S =0, что позволяет измерить или теоретически рассчитать абсолютные значения энтропии S 0 (что невозможно для функций состояния U и Н). Поэтому перед символом энтропии не ставят знак дельта ( ∆). Абсолютные значения энтропии используются для вычисления стандартных энтропий образования веществ.
Слайд 28
Задача Определить энтропию образования этанола из элементов (пользуясь табличными данными). 2С + 3Н 2 + 0.5О 2 С 2 Н 5 ОН. Подстановка значений S о из таблицы дает: ΔS ° образ.. = 161.0‑ ( 2·5.7 + 3·130.6 + 0.5·205.0 ) = – 344.7 Дж/моль·К. Энтропия образования вещества ( ΔS ° образ ) - разность между суммами абсолютных энтропий продуктов реакции ( S ° np. ) и абсолютных энтропий реагирующих веществ ( S ° pear ).
Слайд 29
Критерии самопроизвольного протекания процесса Энтальпийный фактор ( Δ Н) - характеризует стремление системы к упорядочению, поскольку процесс сопровождается уменьшением внутренней энергии. Энтропийный фактор (∆ S ) - отражает тенденцию к разупорядочению, поскольку такое состояние наиболее вероятно. Для того, чтобы действие этих двух факторов было сопоставимым, необходима одинаковая размерность величин !!!, для чего ∆ S, измеряемое в Дж/(моль·К), необходимо умножить на абсолютную температуру.
Слайд 30
T ∆ S – характеризует ту часть энергии, которую нельзя превратить в работу (связанная энергия), и отражает стремление системы к максимуму беспорядка Выражение T ∆ S имеет глубокий смысл, поскольку увеличение и энтропии, и температуры приводит к усилению в системе беспорядка.
Слайд 31
Функцией, учитывающей оба фактора и противоположность в тенденции их изменения является энергия Гиббса G (изобарно-изотермический потенциал): G = H - TS ГИББС Джозайя Уиллард ( 11.02.1839-28.04.1903 ) Один из основоположников термодинамики. Разработал (1875 – 1878) теорию термодинамических потенциалов. Предложил (1878) графическое изображение состояния трехкомпонентной системы (треугольник Гиббса). Заложил основы термодинамики поверхностных явлений и электрохимических процессов, ввел понятие адсорбции.
Слайд 32
Свободная энергия Гиббса (разность между энтальпийным и энтропийным факторами) ∆ G =∆ H – T ∆ S ∆ G – характеризует часть энергии системы, которую можно превратить в работу (свободная энергия) и позволяет судить о возможности самопроизвольного протекания химического процесса в данном направлении. Связь ∆ G и К равновесия При стандартных условиях (298 0 К, [ ] =1моль/л)
Слайд 33
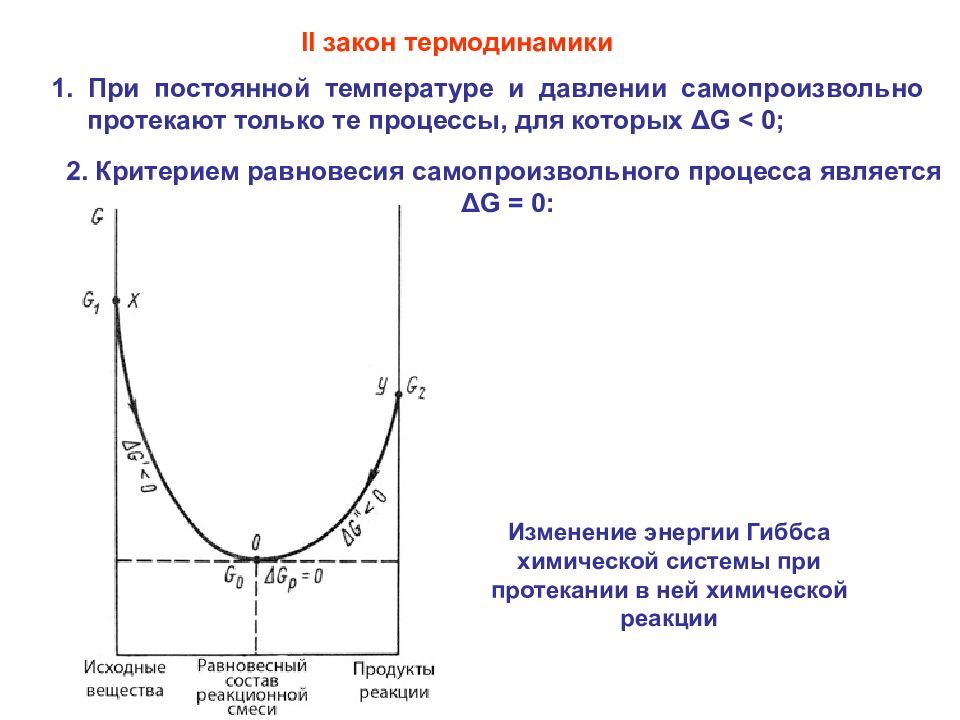
1. При постоянной температуре и давлении самопроизвольно протекают только те процессы, для которых ΔG < 0; II закон термодинамики 2. Критерием равновесия самопроизвольного процесса является ΔG = 0: Изменение энергии Гиббса химической системы при протекании в ней химической реакции
Слайд 35
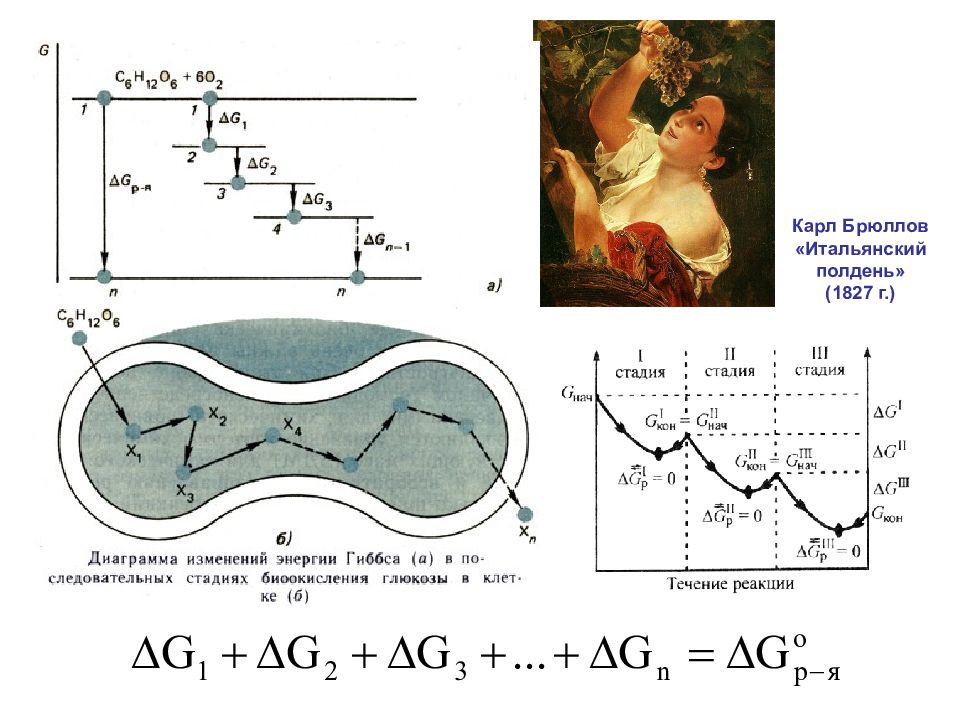
Так как энергия Гиббса есть функция состояния, к ней также применим закон Гесса: Важный пример применения закона Гесса – расчет энергии Гиббса реакции окисления глюкозы кислородом. В клетках организма эта реакция осуществляется через целый ряд последовательных стадий:
Слайд 37
КПД при переходе тепла в работу всегда меньше 1 η = (Т 1 –Т 2 )/Т 1 (часть тепла всегда расходуется на увеличение внутренней энергии); Формулировки II закона термодинамики: В изолированных системах самопроизвольно могут совершаться только такие процессы, в которых энтропия системы возрастает ∆ S >0 Тепло не может переходить от более холодного тела к горячему В любой изолированной системе полная энергия остается постоянной ∆U=0, а полная энтропия только повышается ∆ S >0
Слайд 38
Поскольку при абсолютном нуле поступательное, вращательное и колебательное движение молекул прекращается, число вероятных состояний W=1, Вальтер Нернст – 26.06.1864 - 18.11.1941 Родился в в Польше. С девятнадцати до двадцати трех лет талантливый юноша сменил четыре университета. В Гёттингене Нернст развивал свои исследования по электрохимии и начал заниматься общими вопросами термодинамики. В 1912 году совершил знаменитое научное открытие - сформулировал третий закон термодинамики, который связан с понятием об абсолютном нуле температур. III закон термодинамики:
Слайд 39
2. Абсолютный нуль недостижим ( так называемая «смерть Вселенной») 1. Энтропия идеального кристалла при абсолютном нуле равна нулю. III закон термодинамики:
Слайд 40
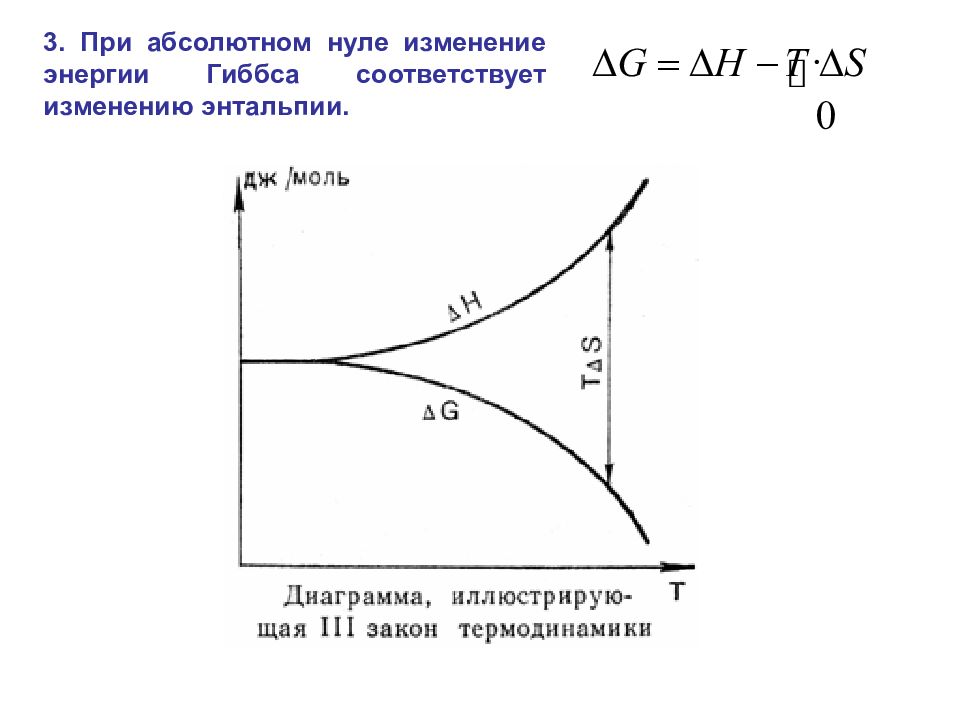
3. При абсолютном нуле изменение энергии Гиббса соответствует изменению энтальпии.
Слайд 41
Гилберт Льюис – 23.10.1875 – 23.03.1946 Предложил новую теорию кислот как акцепторов пары электронов и оснований как доноров пары электронов. Предложил новую формулировку III начала термодинамики, что дало возможность точно определить абсолютную энтропию. Именно поэтому реакции лучше протекают при высоких температурах 4. С повышением Т направление реакции зависит от величины изменения энтропии и, чем выше Т, тем энтропийный фактор значительнее!
Слайд 42
1. Большинство биохимических реакций в организме – обратимы и протекают многостадийно. 2. Биологическое развитие организма возможно только в системе, находящейся в стационарном (постоянство термодинамических величин, скоростей поступления и удаления веществ и энергии), но … далеком от равновесия состоянии!!! Особенности термодинамики биохимических поцессов.
Слайд 43
3. Живые организмы поддерживают присущую им упорядоченность за счет увеличения энтропии внешней среды (поступающие с низким значением энтропии белки, углеводы, полисахариды превращаются в Н 2 О,СО 2, N Н 3 и выводятся из организма). Изменение энтропии (человек +окружающая среда) в стационарном состоянии равно сумме изменения энтропии организма и среды: ∆ S общ = ∆ S чел.+ ∆ S среды Жизнь - постоянная борьба против тенденции к возрастанию энтропии. Живые организмы выбрали «наименьшее зло» - стационарное состояние, котором возрастание энтропии минимально.
Слайд 44
Принцип Пригожина В открытой системе в стационарном состоянии прирост энтропии в единицу времени ∆ S / ∆ t принимает минимальное положительное значение Пригожин Илья Романович Бельгийский химик, родился в Москве 25 января 1917 года. В 1921году семья эмигрировала из России. Нобелевская премия (1977год) «за работы по термодинамике необратимых процессов». Эта работа открыла для термодинамики «новые связи и создала теории, устраняющие разрывы между химическим, биологическим и социальным полями научных исследований». Исследования Пригожина отличает элегантность и прозрачность, поэтому ученого заслуженно называют «поэтом термодинамики»
Слайд 45
4. Реализация принципа энергетического сопряжения: эндэргонические реакции (∆ G>0) сопряжены с экзэргоническими (∆ G<0) Глюкоза + Фруктоза → Сахароза + Н 2 О ∆ G = + 20.9 кДж/моль Глюкоза + Фруктоза + АТФ → Сахароза + АДФ + Фосфаты ∆ G = - 29.2 кДж/моль Карл Брюллов «Итальянский полдень» (1827 г.)
Слайд 46
Термодинамические особенности открытых систем для живого организма ( постоянство кислотно-основного, гетерогенного, лигандообменного баланса) объясняют его устойчивость, позволяющую ему в течение многих лет сохранять работоспособность, о также относительное постоянство внутренней среды – гомеостаза!
Кислотно-основной Окислительно-восстановительный Металло-лигандный Гидрофильно-липофильный Водно-электролитный
Слайд 48
Человеческий организм, является открытой, стационарной термодинамической системой. Основным источником энергии для него является химическая энергия, заключенная в пищевых продуктах, которая расходуется на: совершение работы внутри организма, связанной с дыханием, кровообращением, перемещением метаболитов, секрецией соков ; нагревание вдыхаемого воздуха, потребляемой воды и пищи; покрытие потерь теплоты в окружающую среду при непосредственной радиации и испарении влаги с поверхности тела и с выдыхаемым воздухом и с продуктами жизнедеятельности; совершение внешней работы, связанной со всеми перемещениями человека и его трудовой деятельностью. Биоэнергетика
Слайд 50
Углеводы – C n H 2n O n (сахар, хлеб, крупы,макаронные изделия) В процессе усвоения углеводы расщепляются до моносахаридов, которые далее окисляются до СО 2 и Н 2 О. Калорийность углеводов составляет в среднем 16,5-17,2 кДж/г (4,0-4,1 ккал/г). Покрытие энергетических затрат 55–60% Норма суточного потребления - 360-500 г При правильном питании суточное потребление углеводов должно по массе в 4-5 раз превышать количество белков или жиров
Слайд 51
Белки - основной строительный материал клеток (рыба, творог, сыр, говядина, крупы) Вещества, молекулы которых состоят из остатков -аминокислот, связанных в длинные цепи пептидными связями. Конечными продуктами окисления являются СО 2 и Н 2 О, а также мочевина, аммонийные соли, мочевая кислота, аспарагин и некоторые другие, выводимые из организма с мочой и потом. калорийность 16,5-17,2 кДж/г (4 – 4.2 ккал/г) покрытие энергетических затрат -15–20 %. Норма суточного потребления 80–100 г, (при тяжелом физическом труде 130 -140 г)
Слайд 52
Жиры - сложные эфиры глицерина и жирных кислот. где R, R ' и R " — радикалы жирных кислот. наибольшее значение из которых имеют стеариновая С 17 Н 35 СООН, пальмитиновая С 15 Н 31 СООН и олеиновая С 17 Н 33 СООН. Калорийность жиров более чем в два раза превосходит таковую углеводов: 37,7-39,8 кДж/г (9,0-9,5 ккал/г). Покрытие энергетических затрат - 20–25 % Норма суточного потребления – 90-100 г (масло растительное и животное, яйцо, говядина)
Слайд 53
Запас жира позволяет представителям животного мира некоторое время обходиться без потребления воды, поскольку при окислении 100 г жира образуется около 100-150 г воды. Жир, запасаемый верблюдом в горбу, позволяет ему в течение многих дней сохранять трудоспособность, не утоляя жажды.
Слайд 55
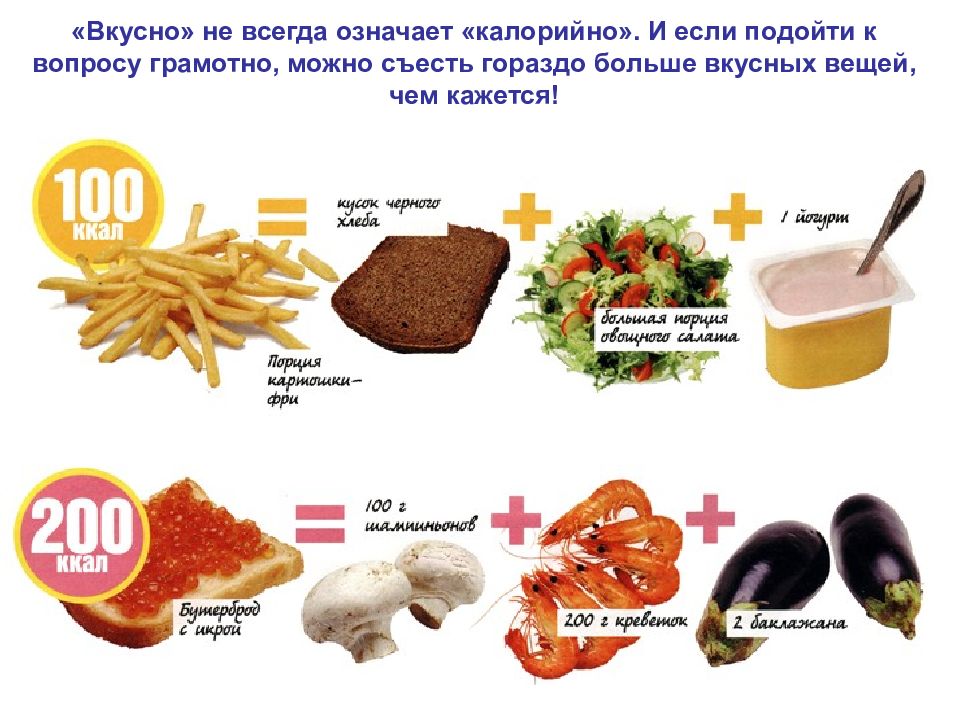
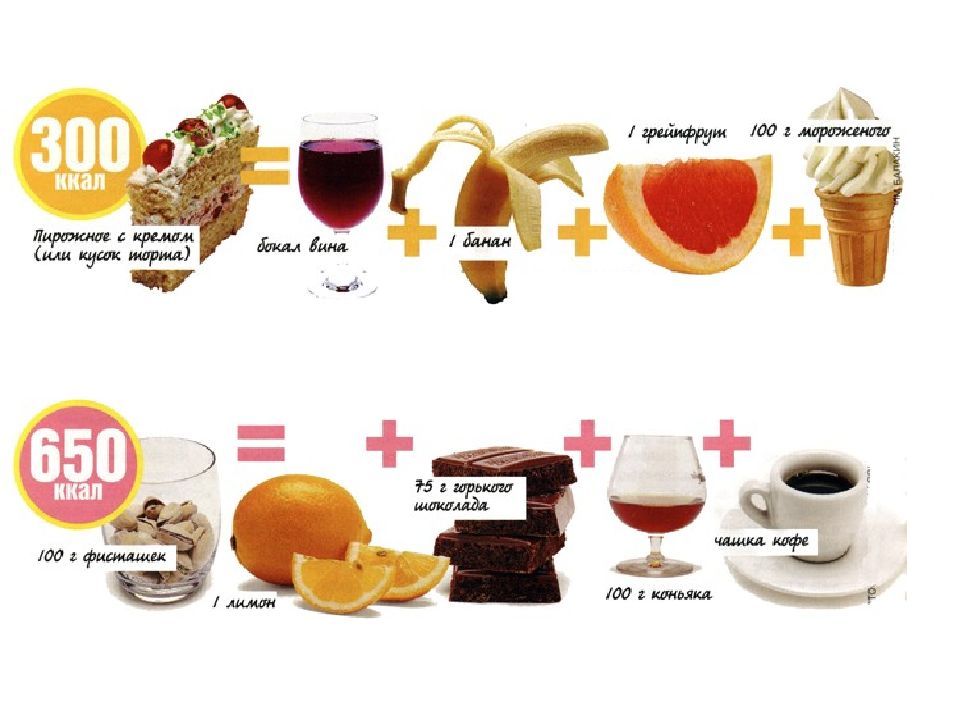
«Вкусно» не всегда означает «калорийно». И если подойти к вопросу грамотно, можно съесть гораздо больше вкусных вещей, чем кажется!
Слайд 57
Аналогичный подход относится к витаминам Без витамина Е мы страдали бы от простуд, нам бы угрожали рак и преждевременная старость. Мы даже не смогли бы прочесть эту информацию – помешала бы катаракта. Да и само наше появление на свет было бы под большим вопросом – витамин Е называют фактором размножения. Как получить суточную дозу чудо-витамина? – Выбирайте! Именно витамин Е отвечает за прозрачность хрусталика
Слайд 58
В основе научной диетологии лежит согласование режима питания (калорийности потребляемой человеком пищи) с расходом энергии, который зависит в первую очередь от характера выполняемой работы.
Слайд 59
Суточная потребность человека в энергии 1) при легкой работе в сидячем положении: канцелярские работники, секретари, портные, мастера точной механики - 2000-2800 ккал ( 8400-11700 кДж )
Слайд 60
2) при умеренной и напряженной мышечной работе: лаборанты, врачи, почтальоны, столяры, токари, трактористы, учащиеся, студенты - 3000-3600 ккал 12500-15100 кДж ) Михаил Нестеров «Портрет хирурга Сергея Юдина» 1933 г.
Слайд 61
3) при тяжелом физическом труде: литейщики, каменщики, кузнецы, плотники, пахари – 4000- 5000 ккал (16700-20900 кДж ) Аркадий Пластов «Обед трактористов» 1961
Слайд 62
4) при особо тяжелом труде - ручная косьба, спортсмены - до 7200 ккал ( 30100 кДж ) Григорий Мясоедов «Косари», 1887 г.