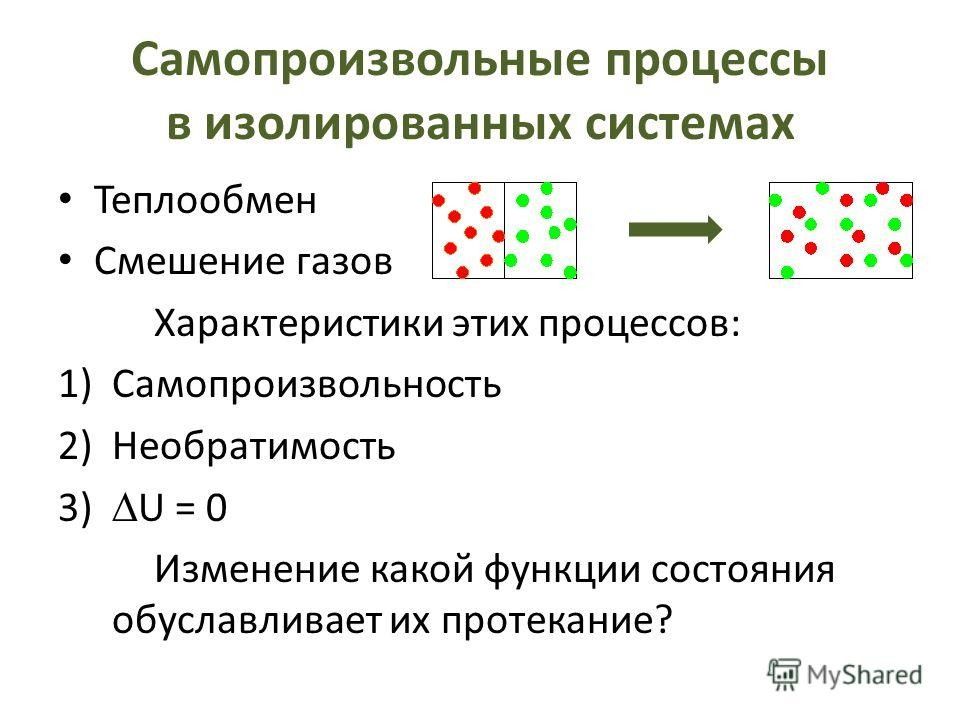
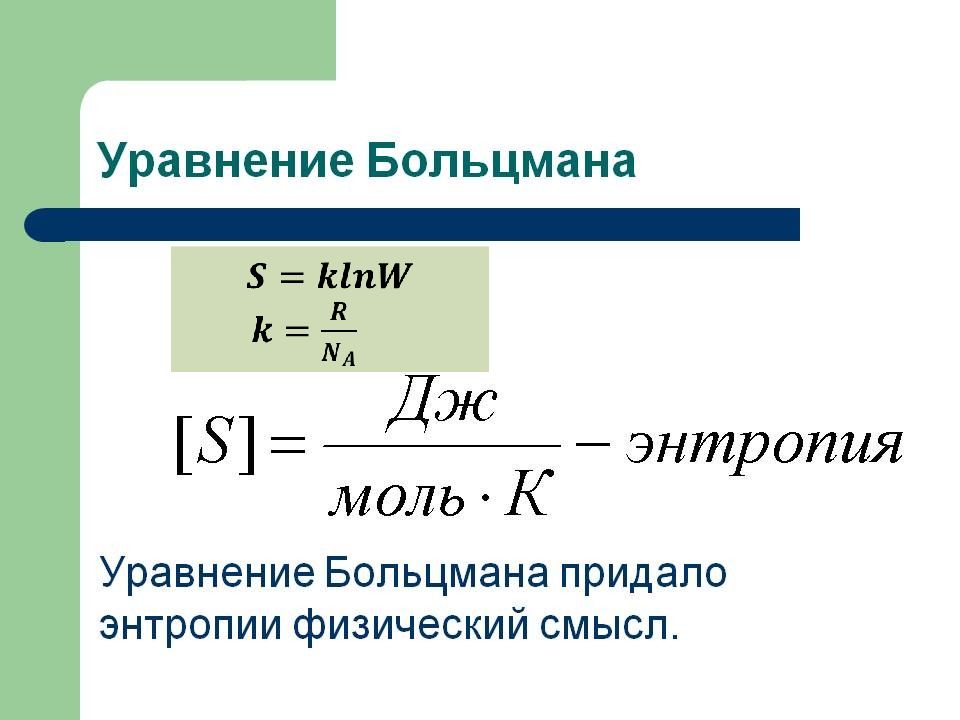
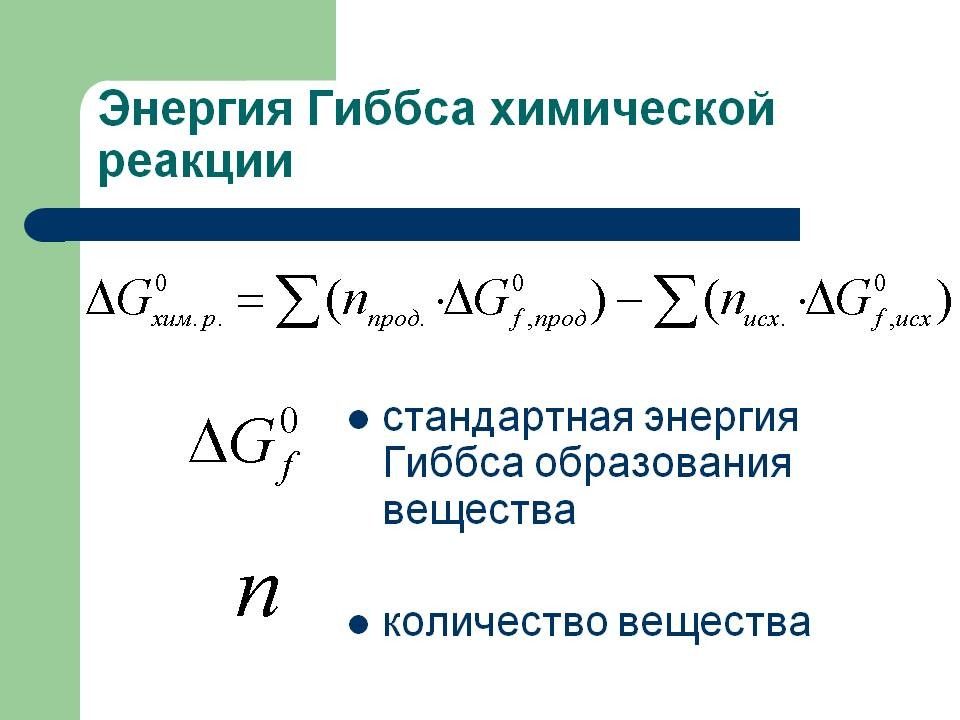
Слайд 6: Энтропия как мера неупорядоченности
Энтропию системы можно рассматривать как меру неупорядоченности ее состояния.
Слайд 8: Энтропия как Функция состояния
Энтропия, как и энтальпия, и внутренняя энергия, - функция состояния системы, поэтому изменение энтропии Δ S в ходе превращения системы определяется только начальным и конечным состоянием системы и не зависит от пути протекания процесса.
Слайд 14: Изменение энтропии
Процессы, для которых Δ S>0 : Расширение газов; Фазовые превращения, в ходе которых вещество переходит от твердого к жидкому и газообразному состоянию; Растворение кристаллических веществ. Процессы, для которых Δ S<0 : Сжатие газов; Конденсация и кристаллизация веществ. В ходе химической реакции Δ S>0, если увеличивается объем системы. Если объем системы в ходе реакции уменьшается, то Δ S<0.
Слайд 15: Значение энтропии вещества
Стандартная энтропия S o чистых веществ относится к 1 моль вещества при p = 1 бар и определенной температуре, чаще всего 298 К. Стандартная энтропия простых веществ не равна нулю. В ряду однотипных соединений абсолютная энтропия растет по мере усложнения атомов, входящих в состав молекул, а также по мере усложнения состава молекул. Чем больше твердость вещества, тем меньше его энтропия. Энтропия вещества в аморфном и стеклообразном состоянии больше, чем в кристаллическом. Энтропия возрастает с увеличением степени дисперсности частиц вещества.
Слайд 17: Энтропия образования соединения
Изменение энтропии в ходе реакции образования соединения из простых веществ называют энтропией образования соединени я. Стандартная энтропия образования соединения при 298 К равна изменению энтропии, которое сопровождает реакцию образования 1 моля этого соединения при p = 1 бар и температуре 298 К из простых веществ, находящихся в стандартном состоянии.
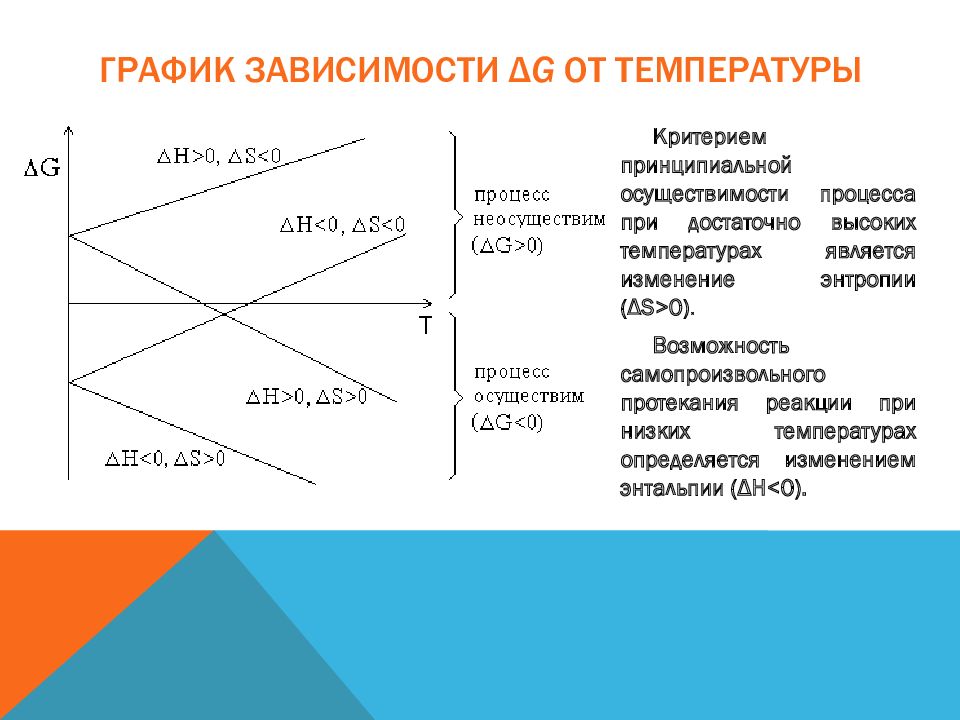
Слайд 28: График зависимости Δ G от температуры
Критерием принципиальной осуществимости процесса при достаточно высоких температурах является изменение энтропии (ΔS>0). Возможность самопроизвольного протекания реакции при низких температурах определяется изменением энтальпии ( ΔH<0 ). График зависимости Δ G от температуры
Слайд 31: выводы
Направление химической реакции определяется двумя факторами: стремлением к уменьшению внутренней энергии с выделением энергии и стремлением к максимальному беспорядку, т.е. к увеличению энтропии. Эндотермическую реакцию можно заставить идти, если она сопровождается увеличением энтропии. Энтропия увеличивается при повышении температуры и особенно сильно при фазовых переходах: твердое – жидкое, твердое – газообразное. Чем выше температура, при которой проводят реакцию, тем большее значение будет иметь энтропийный фактор по сравнению с энергетическим.