Первый слайд презентации: ОКСИДЫ
Слайд 2: Применение оксидов
оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила ). Са(ОН)2 – гашеная известь- основной строительный проду кт оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. «Зелёная хромовая» Cr 2 O 3 – пигмент оливково – зелёной краски.
Слайд 3: Углекислый газ ( CO 2 ) →
Песок (Оксид кремния (IV)SiO 2 ) Fe 2 O 3, SiO 2, Al 2 O 3 (смесь) красная охра. -
Слайд 4: Оксид алюминия
Al 2 O 3 Боксит (глина), рубин, сапфир, корунд Cr 2 О 3 как пигмент используют для типографской краски
Слайд 5: Получение оксидов
Окисление кислородом простых веществ 2Mg +O 2 =2MgO сложных веществ 2H 2 S+3O 2 =2H 2 O+2SO 2 Разложение нагреванием солей С aCO 3 =CaO+CO 2 нагреванием оснований Cu (OH) 2 =CuO+H 2 0 нагреванием кислородсодержащих кислот H 2 SO 3 =H 2 O+SO 2 нагреванием высших оксидов 4CrO 3 = 2 Cr 2 O 3 +3O 2 Окисление низших оксидов 4FeO+O 2 =2Fe 2 O 3 Вытеснение летучего оксида менее летучим Na 2 CO 3 +SiO 2 =Na 2 SiO 3 +CO 2
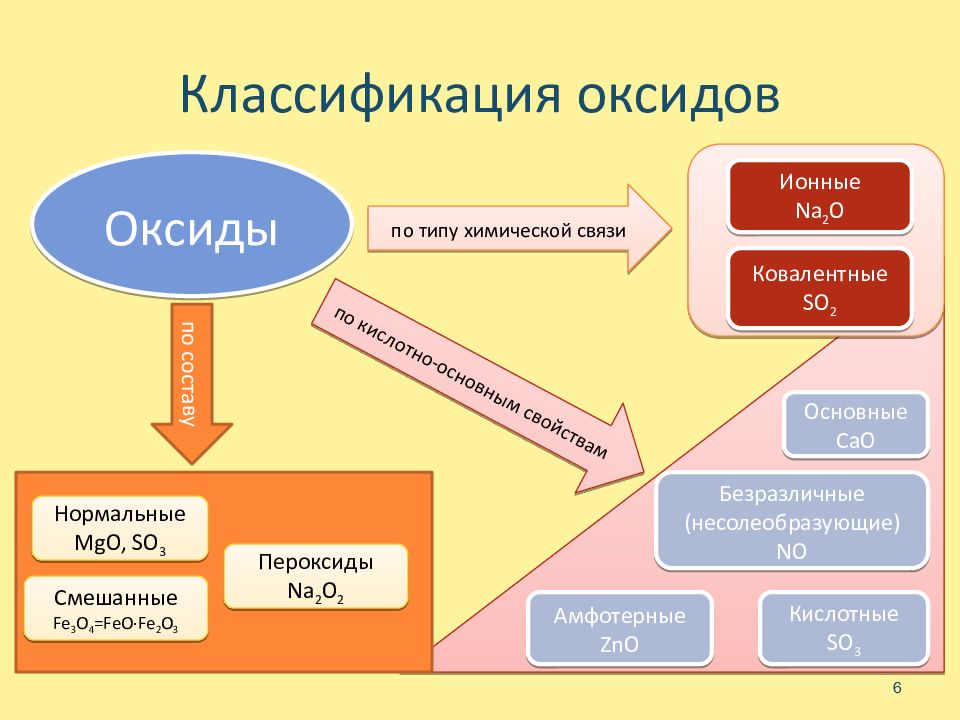
Слайд 6: Классификация оксидов
6 Оксиды Ковалентные SO 2 Ионные Na 2 O Смешанные Fe 3 O 4 =FeO·Fe 2 O 3 Пероксиды Na 2 O 2 Нормальные MgO, SO 3 Безразличные (несолеобразующие) NO Основные CaO Амфотерные ZnO Кислотные SO 3 по типу химической связи по кислотно-основным свойствам по составу
Слайд 7
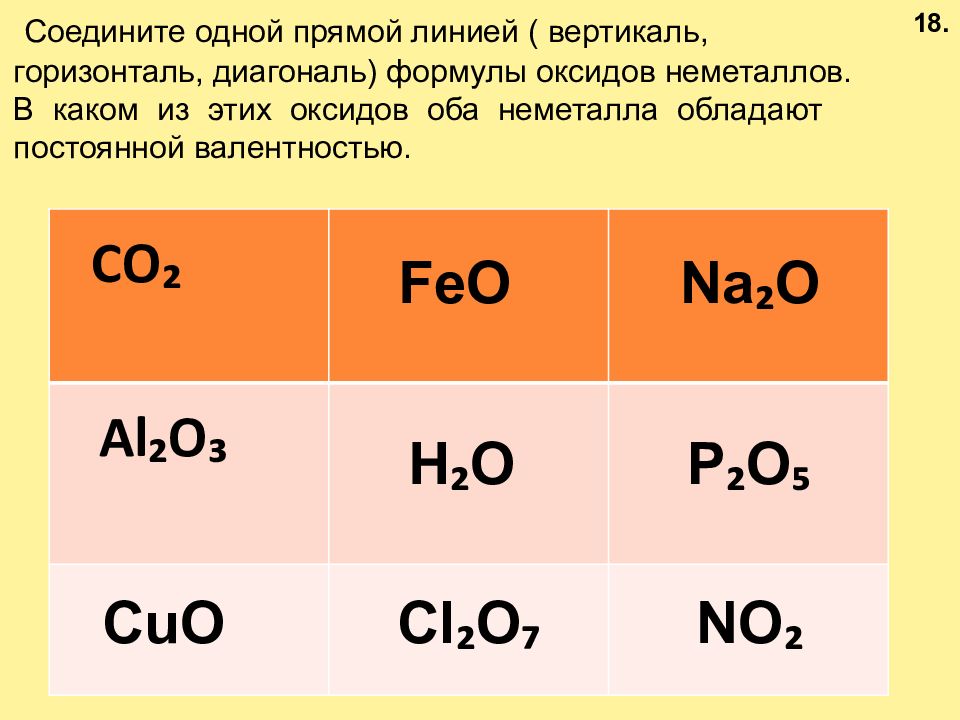
CO ₂ Al ₂ O ₃ NO ₂ FeO Na ₂ O H ₂ O P ₂ O ₅ CuO Cl ₂ O ₇ Соедините одной прямой линией ( вертикаль, горизонталь, диагональ) формулы оксидов неметаллов. В каком из этих оксидов оба неметалла обладают постоянной валентностью. 18.
Слайд 8
С повышением степени окисления атомов элемента, образующего оксиды, увеличиваются кислотные свойства его оксидов и гидроксидов. Неметаллы образуют кислотные оксиды ( исключение - несолеобразующие оксиды). Металлы Степени окисления Характер оксидов +1, +2 Основные оксиды (исключение BeO, ZnO, SnO, PbO +3, +4 Амфотерные оксиды и BeO, ZnO, SnO, PbO +5 и выше Кислотные оксиды
Слайд 9: Химические свойства оксидов
Основные 1.Взаимодействие с водой(оксиды щелочных и щелочноземельных металлов.) CaO+H 2 O= Ca (OH) 2 Кислотные 1.Большинство взаимодействуют с водой SO 3 +H 2 O=H 2 SO 4 2. Все с кислотами AI 2 O 3 +6HCl=2AlCl 3 +3H 2 O При избытке многоосновной кислоты образуется кислая соль. При избытке оксида, которому соответствует многоосновное основание, образуется основная соль. В этих случаях вода может не выделяться или даже поглощаться. 2.Со щелочами NaOH+SiO 2 =Na 2 SiO 3 +H 2 O При избытке кислотного оксида, которому соответствует многоосновная кислота, образуется кислая соль. При избытке многокислотного основания образуется основная соль.
Слайд 10
3. С кислотными и амфотерными оксидами CaO+CO 2 =CaCO 3 Li 2 O+Al 2 O 3 =2LiAlO 2 3.С основными и амфотерными оксидами SiO 2 +CaO=CaSiO 3 Al 2 O 3 +3SO3=Al 2 (SO 4 ) 3 4. Основный оксид и амфотерный гидроксид (при температуре) Li 2 O + 2 Al ( O Н) 3 =2LiAlO 2 + 3Н 2 О 4. Кислотный оксид (нелетучий) и соль, образованная кислотой, которой соответствует летучий оксид SiO 2 + Na 2 С O 3 = С O 2 + +Na 2 SiO 3
Слайд 11
5. Получение металлов из их оксидов при высокой температуре с помощью восстановителей: С, СО, Н 2, металлов (чаще AL. Mg) – пирометаллургический способ получения металлов. Cu 2 O + C = 2 Cu + CO Cr 2 O 3 + 2 AL = 2 Cr + Al 2 O 3 4. СО 2 реагирует с гидроксидом Be, Zn, Pb (II), Cu(II), c образованием основных солей.
Слайд 13: Свойства амфотерных оксидов
Амфотерность – двойственность свойств 1.Реагируют с кислотами, проявляя свойства основных оксидов : Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O При избытке многоосновной кислоты образуется к ислая соль. При избытке оксида – основная соль. 2. Реагируют со щелочами, проявляя свойства кислотных оксидов : Al 2 O 3 + 2NaOH + 3 H 2 O = 2Na[Al(OH) 4 ] (растворе) Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O ( при сплавлении ) Fe 2 O 3 и С r 2 O 3 взаимодействуют со щелочами только при сплавлении.
Слайд 14: Свойства амфотерных оксидов
3. Амфотерный оксид + кислотный оксид (основный оксид) = соль ( при нагревании)
Слайд 15
Оксидами являются оба вещества в паре 1) MgO и H 2 O 2 2)Na 2 O 2 и BaO 3) Mn 2 О 7 и N 2 O 3 4)F 2 О и P 2 O 5
Слайд 16
С водой реагируют оксиды: 1) BaO и SiO 2 2)С uO и SO 3 3) BaO и SO 3 4) FeO и СО 2
Слайд 17
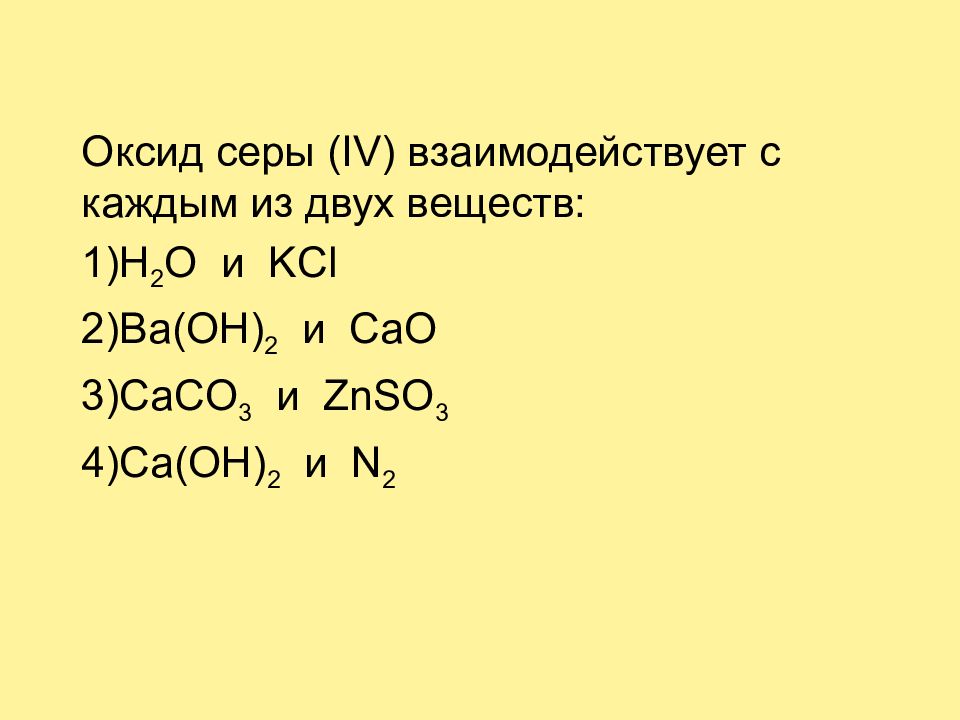
Оксид серы ( IV ) взаимодействует с каждым из двух веществ: 1) H 2 O и KCl 2)Ba(OH) 2 и CaO 3)CaCO 3 и ZnSO 3 4) Ca (OH) 2 и N 2
Слайд 18
С соляной кислотой реагируют каждый из двух оксидов 1) K 2 O и SO 3 2)Al 2 O 3 и CaO 3)CO 2 и ZnO 4)CrO 3 и Na 2 O
Слайд 19
И с раствором гидроксида натрия и с серной кислотой реагирует 1) Ва O 2) Cr 2 O 3 3) SiO 2 4) MgO
Слайд 20: Применение оксидов:
CO 2 – оксид углерода (IV), углекислый газ. Твердый оксид углерода – сухой лед. Для изготовления соды, сахара, газированных напитков, в жидком виде в огнетушителях. SiO 2 – оксид кремния (IV) – твердое, тугоплавкое вещество в природе в двух видах: 1) кристаллический кремнезем – в виде минерала кварца и его разновидностей: горный хрусталь, халцедон, агат, яшма, кремень – используют в силикатной промышленности, строительстве. 2) аморфный кремнезем SiO 2 ∙ nH 2 O – минерал опал. Применяют соединения оксида кремния в ювелирном деле, изготовлении химической посуды, кварцевых ламп. Для создания цветных стекол используют следующие оксиды: Cо 2 O 3 – синий цвет, Cr 2 O 3 – зеленый цвет, MnO 2 – розовый цвет.
Последний слайд презентации: ОКСИДЫ: Применение оксидов:
Fe 2 O 3 – оксид железа (III) – темно-красного цвета – гематит или красный железняк – для изготовления красок. Fe 3 O 4 – оксид железа (II, III) – минерал магнетит или магнитный железняк, хороший проводник электричества – для получения и изготовления электродов. CaO – оксид кальция (II) – порошок белого цвета – «негашеная» известь, используют в строительстве. Al 2 O 3 – оксид алюминия (III) – минерал твердый корунд – как полирующее средство. SO 2 – оксид серы (IV) или сернистый газ – бесцветный газ, имеющий удушливый запах, убивает микроорганизмы, плесневые грибки – окуривают подвалы, погреба, при перевозке и хранении фруктов и ягод.