Первый слайд презентации: Основные положения молекулярно- кинетической теории (МКТ)
вещества и ее опытные доказательства Основные положения молекулярно- кинетической теории (МКТ)
Слайд 2
Выделяют три основных положения МКТ, каждое из которых подтверждено опытными фактами. Первое положение: Все вещества состоят из частиц (молекул) Опытное подтверждение этого положения: Смешивание разных жидкостей, например, воды и спирта, показывает, что объём смеси меньше суммарного объёма, занимаемого двумя жидкостями до их смешивания. Это можно объяснить тем, что между молекулами жидкостей есть пустоты, и при смешивании жидкостей молекулы одной из них проникают в свободное пространство между молекулами другой жидкости. Расширение тел при нагревании и сжатие при охлаждении также можно объяснить тем, что вещества состоят из молекул, расположенных друг от друга на некотором расстоянии. При нагревании расстояния между молекулами увеличиваются, а при охлаждении уменьшаются. Проявление дискретной структуры при наблюдении веществ под электронными или ионными микроскопами. В современные электронные микроскопы можно «увидеть» очертания крупных белковых молекул.
Слайд 3
Второе положение МКТ: Частицы ( молекулы) Непрерывно и беспорядочно движутся Некоторые факты, подтверждающие это положение: Молекулы газа распространяются по всему объему сосуда. Броуновское движение. Движение частиц, взвешенных в жидкости или газе, под действием некомпенсированных ударов молекул жидкости или газа называется Броуновским движением. Если приготовить водный раствор с частицами краски, которые не видны глазом, и рассматривать приготовленную взвесь под микроскопом, то мы «увидим» следующую картину: частицы краски будут хаотически и беспорядочно двигаться. Микроскопические частицы краски хаотически движутся под ударами хаотически и беспорядочно движущихся молекул воды. Диффузия. Диффузия – взаимное проникновение одного вещества в другое без механического перемешивания веществ. Это также является косвенным доказательством хаотического и беспорядочного движения молекул, в результате которого они проникают в промежутки между другими молекулами.
Слайд 4
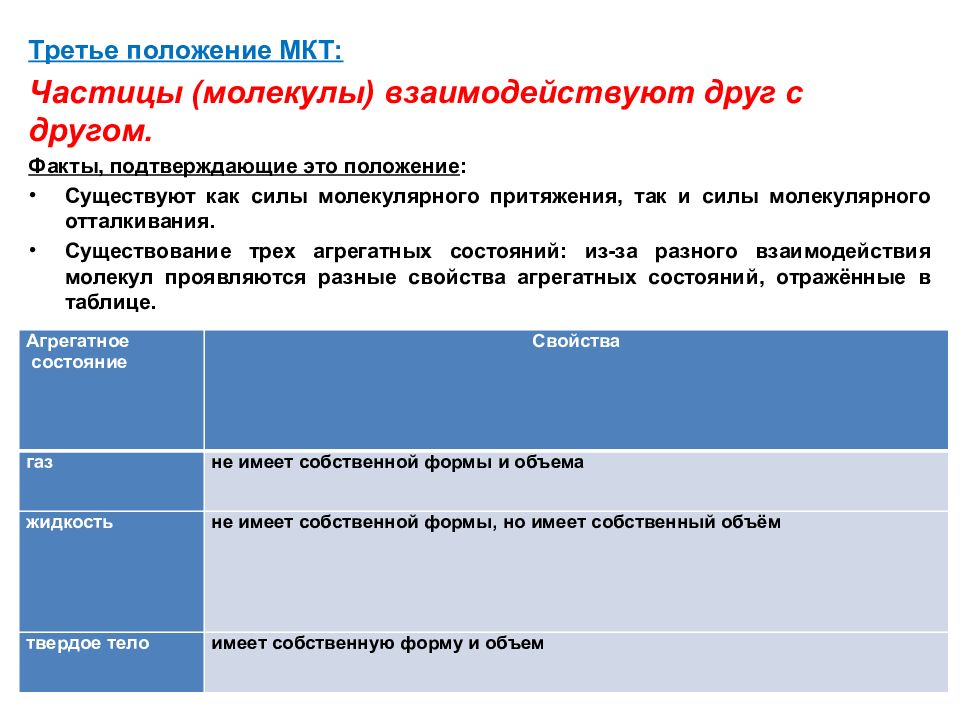
Третье положение МКТ: Частицы (молекулы) взаимодействуют друг с другом. Факты, подтверждающие это положение : Существуют как силы молекулярного притяжения, так и силы молекулярного отталкивания. Существование трех агрегатных состояний: из-за разного взаимодействия молекул проявляются разные свойства агрегатных состояний, отражённые в таблице. Агрегатное состояние Свойства газ не имеет собственной формы и объема жидкость не имеет собственной формы, но имеет собственный объём твердое тело имеет собственную форму и объем Агрегатное состояние Свойства газ не имеет собственной формы и объема жидкость не имеет собственной формы, но имеет собственный объём твердое тело имеет собственную форму и объем
На рисунке приведена зависимость сил межмолекулярного взаимодействия от расстояния между молекулами. На больших расстояниях преобладает действие сил притяжения, на малых - отталкивани я. По природе эти силы - электромагнитные. С энергетической точки зрения, чем больше кинетическая энергия атомов, тем сильнее тенденция к разъединению, отталкиванию; чем больше потенциальная энергия сцепления, тем больше тенденция к соединению. Если суммарная кинетическая энергия атомов и молекул много больше суммарной потенциальной энергии их взаимного притяжения, то вещество находится в газообразном состоянии; если много меньше, то в твердом. Жидкое состояние образуется при примерном равенстве этих энергий.
Слайд 6: Размеры и масса молекул
Молекула - это наименьшая частица вещества, сохраняющая все его химические свойства. Размеры молекул очень малы. Если представить молекулу в виде малого шарика, то его радиус имеет порядок величины 10 – 8 см = 10 – 10 м. Молекулы состоят из атомов. Массы атомов и молекул В качестве единичной атомной массы m ат принимается 1/12 массы атома ядра изотопа углерода. Абсолютные значения атомных масс по порядку величины заключаются в пределах 10 –25 ÷ 10 –27 кг.
Слайд 7: Количество вещества
Количество вещества характеризуется числом его структурных элементов. Термодинамические системы содержат большое число структурных элементов (молекул, атомов). Например, в 2 граммах газа водорода содержится порядка 10 23 молекул. Поэтому количество вещества обычно выражают в СИ в молях. Моль - количество вещества, которое содержит столько же структурных элементов, сколько атомов содержится в 0,012 кг изотопа углерода. Молярная масса – масса одного моля вещества. Таким образом, моль любого вещества содержит одинаковое число структурных элементов – атомов или молекул. Это число называется постоянной Авогадро или числом Авогадро. Количество вещества может быть определено через число молекул N в данном веществе и число молекул в одном моле вещества : = (1)
Слайд 8: Модель идеального газа
В молекулярной физике ввели модель - идеальный газ. Идеальный газ - это газ, состоящий из точечных материальных частиц с конечной массой, силами взаимодействия между которыми можно пренебречь, и которые сталкиваются между собой по законам соударения упругих шаров. Следовательно, молекулы идеального газа обладают только кинетической энергией, поскольку потенциальной энергией взаимодействия молекул можно пренебречь. Молекулы движутся непрерывно и беспорядочно, следовательно, в среднем скорости молекул газа в разных направлениях одинаковы. Тот факт, что частицы точечные, позволяет считать, что газ занимает весь предоставленный ему объём, то есть, любая молекула в любой момент времени может находиться в любом месте предоставленного объёма.
Основное уравнение молекулярно-кинетической теории идеального газа связывает макроскопический параметр - давление газа с микроскопическими характеристиками, а именно со средней кинетической энергией хаотически и беспорядочно движущихся молекул. Давление газа объясняется соударениями молекул со стенками и дном сосуда при их беспорядочном и непрерывном движении. ∙ n ∙ (2) Давление газа пропорционально средней кинетической энергии поступательного движения молекулы. где: – давление газа; n – концентрация молекул – количество молекул N, которое содержится в единице объема газа V : n = (3) - средняя кинетическая энергия движения одной молекулы : = (4) где: - масса одной молекулы; - квадрат скорости движения молекул.
Слайд 10: Единицы измерения давления
Единица давления в СИ: 1 Па =1 Н/м 2 Часто используют единицу измерения давления 1 бар=10 5 Па В технике используют: 1 ат =1 кг/см 2 = 0,98 бар - техническая атмосфера 1 атм - физическая атмосфера - равна давлению столба ртути высотой 760 мм 1 атм = 1,01 бар В области низких давлений используют: 1 тор= 1/760 атм = 1 мм.рт.ст.=133,322 Па. Измерение давления. Давление измеряют специальными приборами - манометры. Манометры делят на первичные и вторичные. Первичные - те, которые непосредственно измеряют давление, вторичные - те, которые измеряют некоторую величину, связанную с давлением. Манометры, используемые для измерения атмосферного давления, называются барометрами.
Слайд 11: Температура
Температура - величина, характеризующая степень нагретости тел. Тела могут быть нагреты неравномерно (например, одна часть тела нагрета сильнее другой). Для определения температуры тела в этом случае необходимо подождать, пока тело в результате теплообмена не перейдёт в равновесное состояние, при котором оно будет равномерно нагрето. Поэтому можно утверждать: Температура - величина, характеризующая состояние теплового равновесия тел. Два тела, имеющие одинаковые температуры, находятся в тепловом равновесии. Если два тела находятся в тепловом равновесии с третьим, то и между собой они тоже находятся в тепловом равновесии. Своеобразие температуры в том, что её нельзя измерить методом сравнения с эталоном. Для измерения температуры необходимо, чтобы тело пришло в тепловое равновесие со средой, температуру которой нужно измерить. Своеобразие температуры и в том, что она не аддитивна. Это значит, что температура всего тела не равна сумме температур его частей. Для измерения температуры пользуются тем, что при изменении температуры тела изменяются его свойства, а, следовательно, и величины, характеризующие свойства и которые линейно зависят от температуры.
Слайд 12
Температура связана с внутренней энергией тела. Внутренняя энергия тела - это сумма кинетической и потенциальной энергий его атомов и молекул. Внутренняя энергия пропорциональна температуре тела. Для идеальных газов внутренняя энергия определяется только кинетической энергией поступательного движения молекул и атомов, поэтому его также называют тепловым движением. Средняя кинетическая энергия теплового движения атомов и молекул идеального газа прямо пропорциональна температуре ~ Т. ∙ k ∙ Т (5) где : k =1,38 10 –23 Дж/К - постоянная Больцмана; Т – температура, которую стали называть – абсолютная температура. Поэтому можно утверждать, что абсолютная температура - T является количественной мерой поступательного теплового движения атомов и молекул или мерой средней кинетической энергии атомов и молекул. .
Слайд 13
Единица измерения температуры - градус. Размер градуса устанавливают так. Произвольно выбирают две температуры (их называют реперными точками ) - обычно это температура таяния льда и кипения воды при атмосферном давлении - и делят температурный интервал на некоторое число равных частей - градусов. Так получают температурную шкалу. Можно получить множество таких шкал. Их называют относительными шкалами. Примерами относительных шкал являются шкалы Цельсия, Фаренгейта. Для измерения абсолютной температуры используют Температурную шкалу, которая называется термодинамической абсолютной шкалой или шкалой Кельвина. В СИ абсолютная термодинамическая температура измеряется в кельвинах : [ T ] =1К Поскольку шкалы равномерные и величина градуса во всех шкалах одинаковая, связь между температурой в градусах Цельсия и Кельвина может быть выражена следующей формулой: T ( K )= t ( 0 C )+ 273,15 (6)
Слайд 14: Абсолютный нуль
Если: t ( 0 C ), = 0, то из формулы (6) следует, что: T ( K )=. Температура T ( K )= получила название – абсолютный нуль шкалы Кельвина. При температуре, численно равной абсолютному нулю, давление идеального газа и средняя кинетическая энергия теплового движения молекул тоже должны стать равными 0. Это означает, что движение молекул прекратится и их энергия станет равной 0, что противоречит закону сохранения энергии. На самом деле такое не может быть, в природе не бывает молекул с нулевой энергией. Дело в том, что в своих рассуждениях мы пользовались моделью – идеальный газ. Для реальных газов это невозможно, т. к. молекулы всегда взаимодействуют и имеют потенциальную энергию, отличную от нуля. Современная техника еще не позволяет достичь температуры, равной абсолютному нулю. Но удалось приблизиться к такой температуре и наблюдать очень интересное явления – сверхпроводимость, сверхтекучесть и т. д.
Слайд 15: Скорости движения молекул
Молекулы движутся хаотически, беспорядочно и непрестанно, скорости их движения могут меняться в пределах от 0 до бесконечности. Поэтому ввели понятие средней скорости молекул, наиболее вероятной скорости молекул и средней квадратичной скорости молекул, которые вычисляются по формулам: = (7) = (8) Вычисление скоростей молекул по формулам (7) и (8) дали ошеломляющие результаты. Например, при t ( 0 C ) = 0 для молекул азота ≈ 500 м/с, а для молекул водорода ≈ 1800 м/с ! Впервые скорости молекул были измерены в 1920 г. О. Штерном. Опыт Штерна полностью подтвердил теоретические расчеты и тем самым справедливость МКТ вещества, на основании которой формулы (7) и (8) были получены.