Слайд 2: Периодтық кестедегі орны
Оттек және күкірт VIA топшасындағы элементтер Бұл топтың элементтерінің жалпы аты - ХАЛЬКОГЕНдер, мағынасы « кен тудырушы » ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 3: Оттек атомының құрылысы
Электрондық конфигурациясы : Оттектің тотығу дәрежесі : -2, 0, +2 Оттектің валенттілігі екіге тең (3 және 4 болуы да мүмкін ) ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 4: Оттектің аллотропиясы
Оттек элементінің екі аллотропты түрөзгерістері бар: оттек О 2 озон О 3 ВАСИЛИЙ КАДЕВИЧ 2008г.
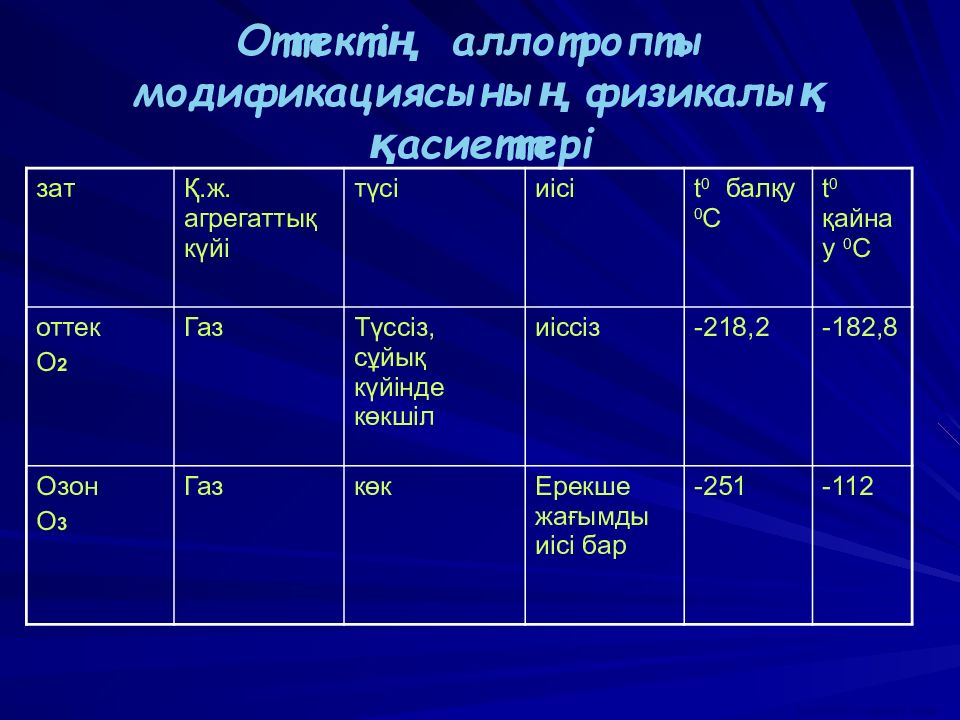
зат Қ.ж. агрегаттық күйі түсі иісі t 0 балқу 0 C t 0 қайнау 0 C оттек O 2 Газ Түссіз, сұйық күйінде көкшіл иіссіз -218,2 -182,8 Озон O 3 Газ көк Ерекше жағымды иісі бар -251 -112 ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 6
Озон оттекпен салыстырғанда химиялық белсенді : Озонның белсенділігі оның ыдырауы кезінде түзілетін атомдық оттекпен байланысты. Атомдық оттек көптеген заттармен өте белсенді реакцияға түседі. O 3 => O 2 +O Мысалы, озон күміспен өте оңай реакцияға түседі, ал оттек күміспен қыздырған жағдайда да реакцияға түспейді : бірақ озон да оттек те активті металдармен реакцияға түседі. ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 7
Озонды алу Бұл реакция жылуды сіңіру арқылы жүреді. Сондықтан озон найзағай кезінде түзіліп жатады. Ал кері реакция қалыпты жағдай кезінде орын алады, себебі озон тұрақсыз зат. Табиғаттағы озонның ыдырап кетуі атмосфераға жіберілетін түрлі газдардың әсерінен орын алады. Осындай себептерден озон қабаты бұзылып отырады. ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 8: Оттекті алу
Оттек ( O 2 ) зертханада калий перманганатын ыдырату арқылы алады KMnO 4 (марганцовка). 2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑ ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 9
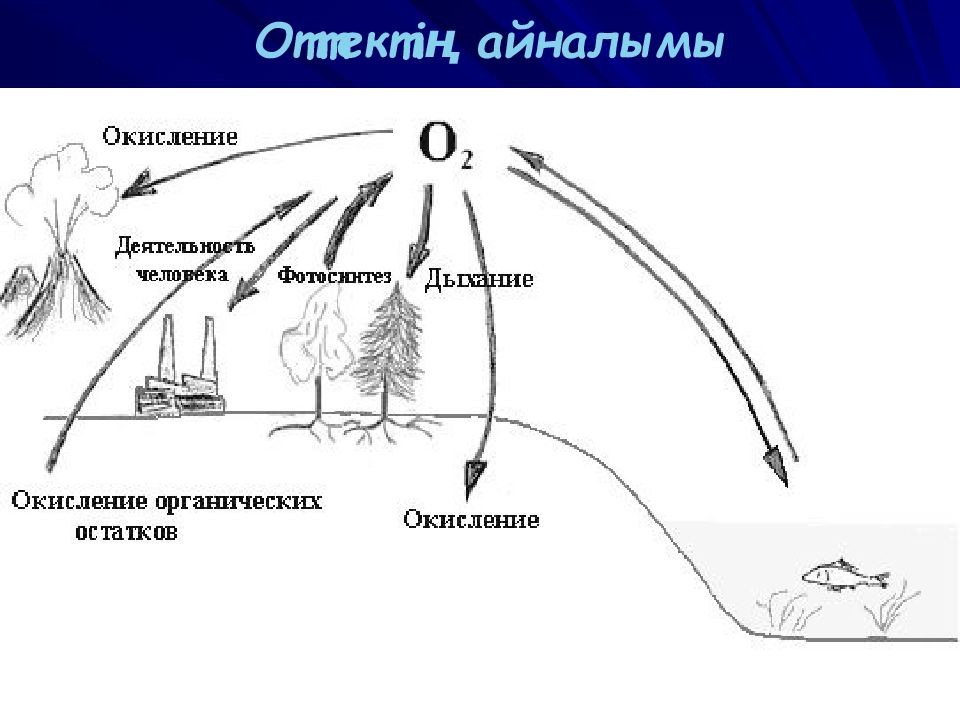
Сонымен қатар басқа да тұздарды қыздырып ыдырату арқылы 2 KNO 3 => 2KNO 2 +O 2 2 KClO 3 => 2KCl+ 3 O 2 Ал өндірісте оттекті сұйық ауадан алады ( ауаны t o -283 C o – ға дейін суыту арқылы ) немесе судың лектролизі кезінде 2 H 2 O= 2H 2 +O 2 Ал табиғатта оттек фотосинтез процесі кезінде түзіледі 6 CO 2 +6H 2 O=> C 6 H 12 O 6 +6O 2 ↑ ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 10: Химические свойства КИСЛОРОДА
Кислород непосредственно реагирует со всеми простыми веществами, кроме золота, платины и галогенов. В кислороде могут гореть даже те вещества, которые не горят на воздухе. 3Fe+2O 2 = Fe 3 O 4 ( железная окалина) ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 11: Взаимодействие с активными металлами
Горение магния 2 Mg + O 2 = 2 MgO ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 12: Взаимодействие с другими неметаллами
Горение серы в кислороде S + O 2 = SO 2 ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 13
Көміртектің оттекте жануы С+О 2 = СО 2 фосфордың оттекте жануы 4 P + 5 O 2 = 2 P 2 O 5 ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 15: Оттекті қолдану
Химия өнеркәсіптерінде Қопарылғыш қоспалар жасауда Металл дәнекерлеу және металды кесу кезінде Ғарыш саласында (ракета отыны ) Металлургия саласында Медицинада ВАСИЛИЙ КАДЕВИЧ 2008г.
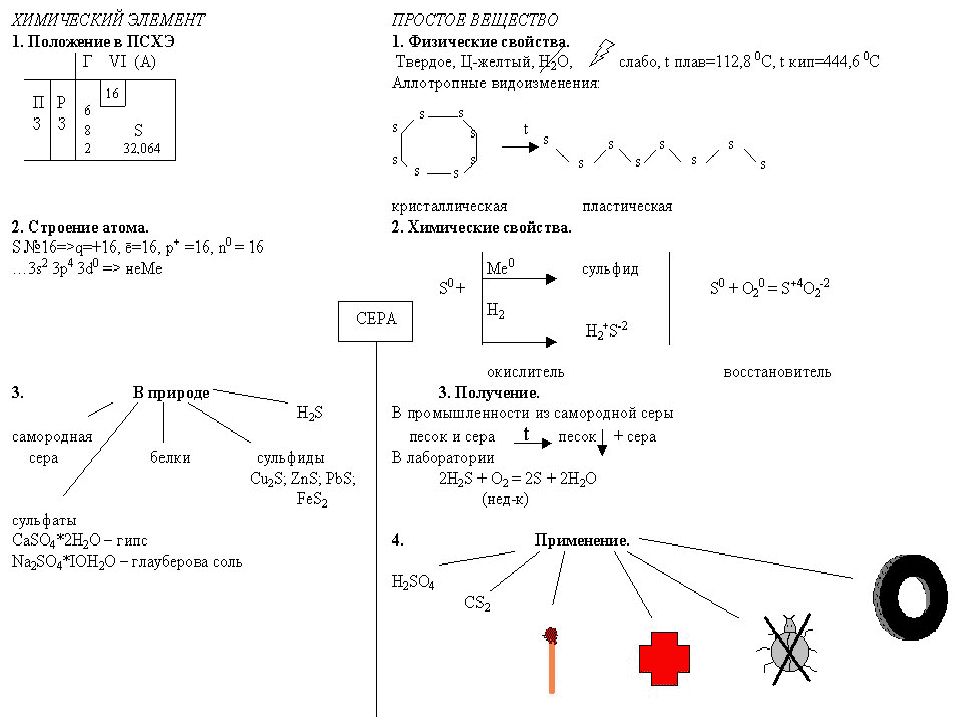
Слайд 16: Күкірттің атом құрылысы
1 s 2 2 p 2 2 p 6 3 s 2 3 p 4 Тотығу дәрежесі Валенттілік +2, - 2 II +4 IV + 6 VI ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 17: Күкірттің аллотропиясы
1) ромбалық ( a - күкірт) - S 8 t ° балқу. = 113 ° C ; r = 2,07 г/см 3 Салыстырмалы түрде тұрақты түрөзгерісі 2) моноклинді ( b – күкірт ) – қара-сары инелер t ° балқу. = 119 ° C ; r = 1,96 г/см 3 Устойчивая при температуре более 96 ° С жоғары температурада тұрақты, ал қалыпты жағдайда ромбалық түрге ауысады. 3) пластикалық – қоңыр резеңке тәріздес масса Тұрақсыз, қату кезінде ромбалық түрге ауысады ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 18: Күкіртті алу
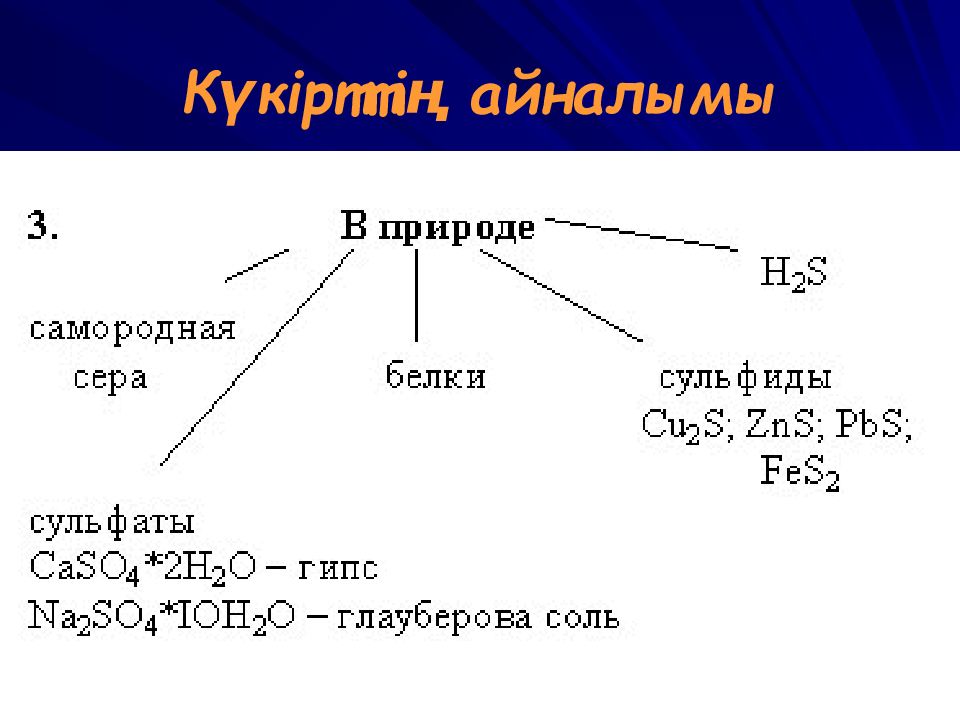
1. Өндірісте су буымен балқыту арқылы 2. күкіт сутектің толық емес тотығуы (оттек жеткіліксіз болғанда ). 2H 2 S + O 2 => 2S + 2H 2 O 3. Вакенродер реакциясы 2H 2 S + SO 2 => 3S + 2H 2 O ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 19: Күкірттің химиялық қасиеттері
( S 0 + 2ē => S -2 ) 1) Күкірт сілтілік металдармен қыздырмай ақ әрекеттеседі : 2 Na + S => Na 2 S қалған металдармен ( Au, Pt басқа ) - t° қыздырғанда : 2Al + 3S = t° => Al 2 S 3 Zn + S = t° => ZnS 2) кейбір бейметалдармен күкірт бинарлық қосылыстар түзеді : H 2 + S => H 2 S 2P + 3S => P 2 S 3 C + 2 S => CS 2 ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 20
( S 0 - 2ē => S +2 ; S 0 - 4ē => S +4 ; S 0 - 6ē => S +6 ) 3) оттекпен : S + O 2 =t°=> S +4 O 2 2S + 3O 2 = t°pt => 2S +6 O 3 4) галогендермен ( йодтан басқа ): S + Cl 2 => S +2 Cl 2 5) қышқылдармен : S + 2H 2 SO 4 ( конц ) => 3S +4 O 2 + 2H 2 O S + 6HNO 3 ( конц ) => H 2 S +6 O 4 + 6NO 2 + 2H 2 O ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 21
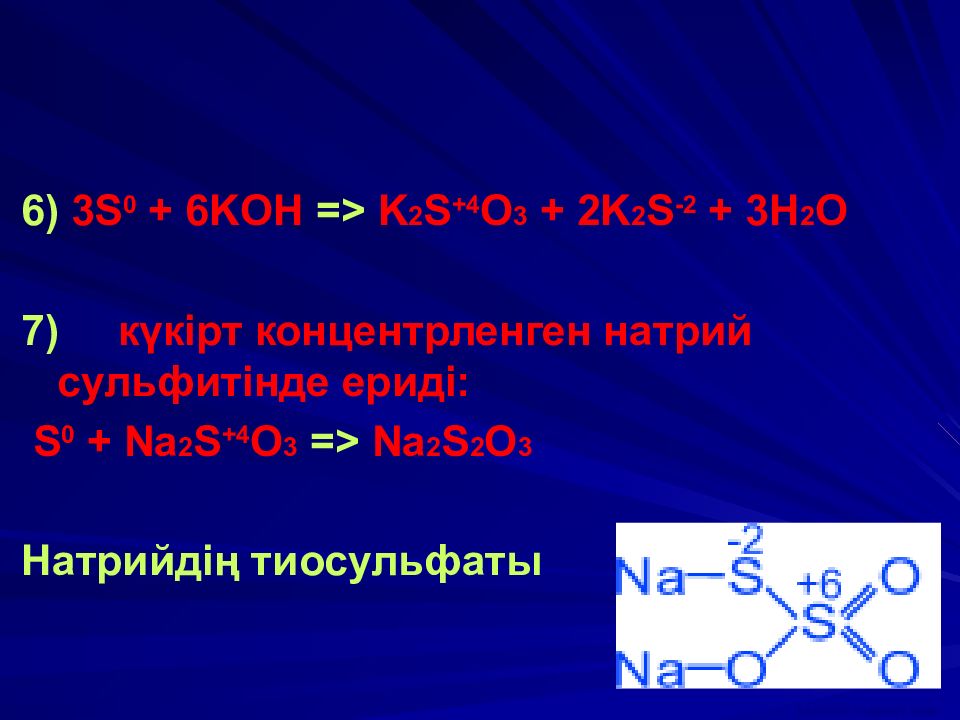
6) 3 S 0 + 6 KOH => K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O 7) күкірт концентрленген натрий сульфитінде ериді : S 0 + Na 2 S +4 O 3 => Na 2 S 2 O 3 Натрийдің т иосульфат ы ВАСИЛИЙ КАДЕВИЧ 2008г.
Слайд 23: Күкірттің қолданылуы
Каучоктың вулканизациясы Эбонитті алу Оқдәрі және оттық жасау кезінде Ауыл шаруышылығындағы зиянкестермен күресте Медициналық мақсатта ( түрлі тері аурулары кезінде қолданылатын жақпалар ) Күкірт қышқылын алу үшін ВАСИЛИЙ КАДЕВИЧ 2008г.