Первый слайд презентации: p - элементы 17 группы периодической системы: галогены
Береснева Е. В. к.п.н., профессор кафедры фундаментальной химии и методики обучения химии ВятГУ
Слайд 2: План лекции
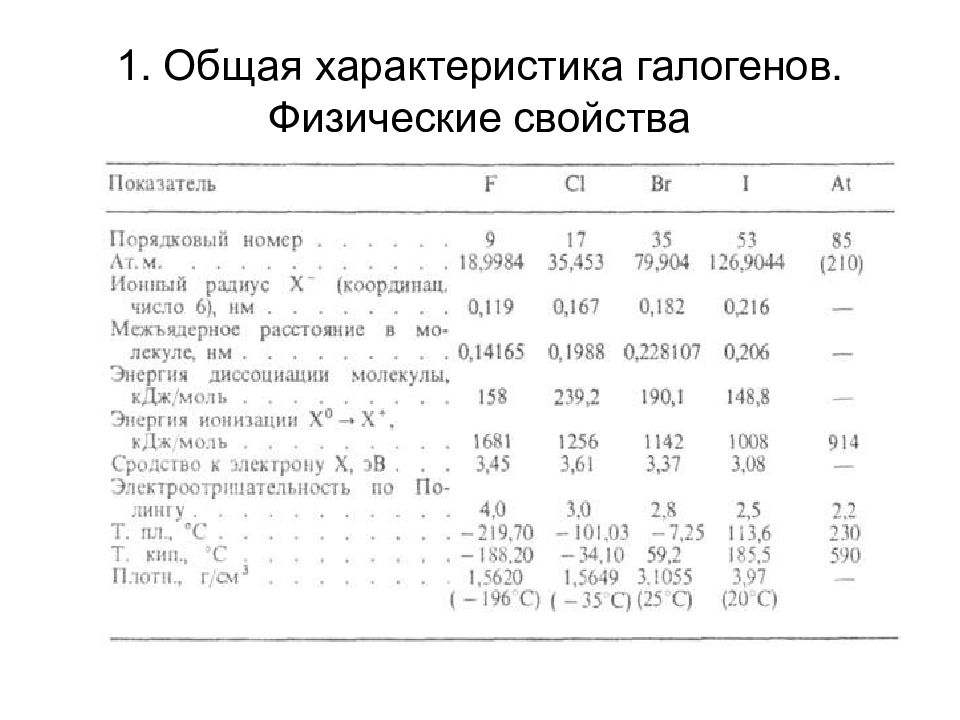
Введение 1. Общая характеристика галогенов, их физические свойства 2. Нахождение в природе 3. Получение 4. Химические свойства простых веществ 5. Соединения галогенов в отрицательной степени окисления 6. Соединения галогенов в положительной степени окисления 7. История открытия галогенов 8. Биологическая роль и применение (самостоятельная работа)
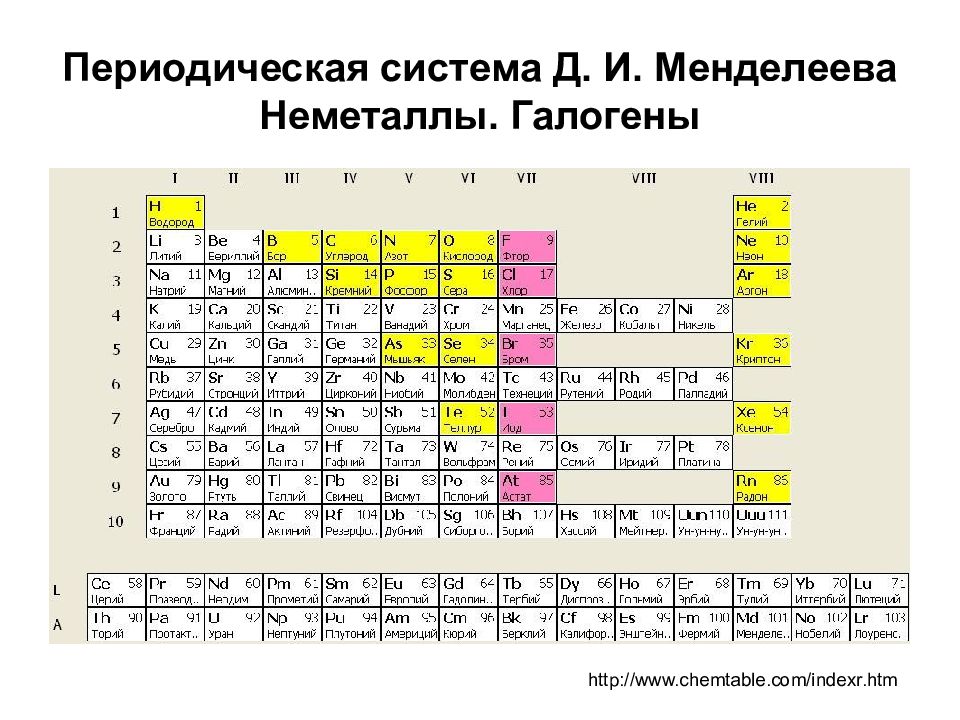
http://www.chemtable.com/indexr.htm
Слайд 4: Введение
Какие элементы относят к p -элементам? 17-я группа ( VIIA группа) периодической системы объединяет p -элементы, носящие общее название галогены (от греч. halos – соль и genes – рождающий, рождённый – рождающие соли ) (галоиды): фтор F, хлор С l, бром Вг, иод I, астат At, теннессин Ts ( элемент № 117 ). Первые четыре элемента встречаются в природе в виде различных соединений. Астат и теннессин получены искусственным путем, радиоактивны Внешняя электронная оболочка атомов имеет конфигурацию s 2 p 5
Слайд 6: Степени окисления галогенов
– 1 (наиболее характерна для всех - НГ) + 1 у Сl, Вr, I (НГО и др.) + 3 у Сl и Вr (НГО 2, ГF 3 ), у I редко + 4 у Сl, Вr, I (ГO 2 ) + 5 у Сl, Вr, I (НГO 3, XF 5 и др.) + 6 у Сl (Сl 2 О 6 ) + 7 у Сl, Вr и I (HClO 4, Cl 2 O 7, НВrO 4, IF 7 и др.)
Слайд 9: 2. Нахождение в природе Минералы, содержащие фтор
Флюорит (плавиковый шпат) CaF 2 «1С Химия для всех – XXI»
Слайд 19: 3. Получение галогенов Получение фтора
В промышленности – электролиз расплавов фторидов щелочных металлов (напишите уравнение реакции) В лаборатории – термолиз высших фторидов некоторых металлов, например: 2CeF 4 = 2CeF 3 + F 2
Слайд 20: Получение хлора
В промышленности – электролиз концентрированного раствора NaCl с диафрагмой, разделяющей катодное и анодное пространства: 2NaCl + 2H 2 O В лаборатории – реакция конц. HCl с такими окислителями, как КMnO 4, MnO 2, K 2 Cr 2 O 7 и др. 16HCl + 2KMnO 4 = 5 Cl 2 + 2 KCl +2MnCl 2 + 8H 2 O
Слайд 21: Получение брома, иода, астата
Получение брома и иода в лаборатории – взаимодействие галогенидов с окислителем (MnO 2 ) в кислой среде, например: MnO 2 + 2H 2 SO 4 + 2KI = I 2 + MnSO 4 + 2H 2 O + K 2 SO 4 Получение астата: облучение висмута или тория α -частицами радиоактивный распад франция: 223 87 Fr → 219 85 At + 4 2 He обстреливание золота ядрами углерода: 197 79 Au + 12 6 C → 209 85 At
Слайд 22: 4. Химические свойства простых веществ
Невысокие энергии диссоциации молекул галогенов (существенно меньшие, чем у О 2, Н 2 и N 2 ) Большое сродство атомов к электрону Плохие доноры электронов Хорошие акцепторы электронов Высокая реакционная способность Сильные окислители и кислотообразователи Самые активные неметаллы
Слайд 23: Химические свойства фтора
Реагирует непосредственно со всеми элементами, кроме He, Ne, Ar, N 2, C ( алмаз) В атмосфере фтора сгорают вода и стеклянная вата: 2H 2 O + 2F 2 = 4HF + O 2 SiO 2 + 2F 2 = SiF 4 + O 2 Фтор реагирует со взрывом при простом контакте с водородом (уравнение) Соединения фтора с другими элементами: SiF 4, BF 3, CF x, BrF 3, IF 7, ClF, ClF 3
Слайд 24: Химические свойства хлора
Непосредственно не реагирует с кислородом, углеродом (алмаз), азотом, благородными газами Оксиды хлора: Cl 2 O, ClO 2, Cl 2 O 6 и Cl 2 O 7. Все они неустойчивы, могут быть получены только косвенным путем и являются сильными окислителями, как и сам хлор Реагирует с некоторыми Ме и неМе (уравнения с натрием, водородом и фосфором) Со сложными веществами: Cl 2 + H 2 O ↔ НCl + НClO Cl 2 + 2NaOH = NaClO + NaCl + H 2 O 3Cl 2 + 6KOH = KClO 3 + 5KCl + 3H 2 O
Слайд 25: Химические свойства брома
Соединения брома с галогенами - BrF 3, BrF 5, BrCl и IBr С кислородом, углеродом, азотом, благородными газами непосредственно не реагирует. Косвенно получены оксиды - Вr 2 О, ВгО 2, Br 3 O 8 С S, Se, Те, Р, As и Sb - S 2 Br 2, РВr 3, РВr 5, неустойчивые SeBr 4 и Se 2 Br 2, TeBr 4, AsBr 3, SbBr 3 С бором и кремнием при t - ВВг 3 и SiBr 4 С водородом при t (уравнение)
Слайд 26: Растворы брома и иода
Иод в воде (слева) и в четыреххлористом углероде Бромная вода (уравнение)
Слайд 27: Химические свойства иода
Возгоняется при слабом нагревании Плохо растворим в воде, лучше в органических растворителях и в водных растворах иодидов С кислородом, углеродом, азотом, серой, селеном и благородными газами непосредственно не реагирует С металлами образует иодиды: Hg + I 2 = Hg I 2 В горячих растворах щелочей дает соли иодид и иодат (уравнение) H 2 S, Na 2 S 2 O 3 и другие восстановители восстанавливают его до I - : I 2 + H 2 S = S + 2НI Иод – единственный галоген, который реагирует с конц. азотной кислотой: 3I 2 + 10HNO 3 = 6HIO 3 + 10NO + 2H 2 O
Слайд 29: 5. Соединения галогенов в отрицательной степени окисления
Наиболее важные соединения галогенов в отрицательной степени окисления – галогеноводороды Это соединения с полярной ковалентной связью, в которой общая электронная пара сильно сдвинута в сторону галогена
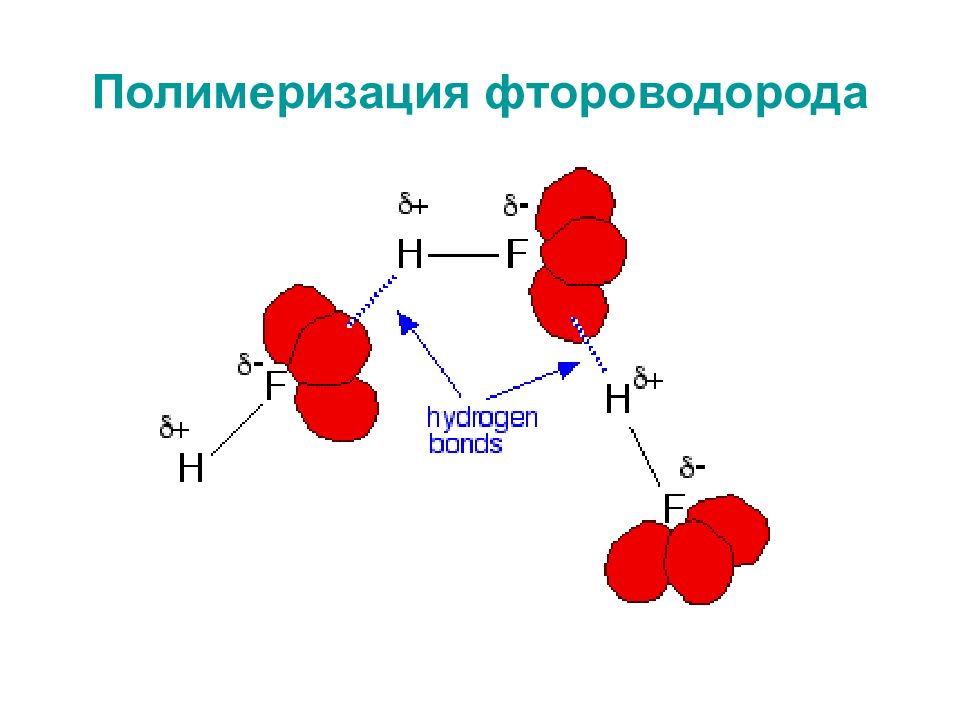
Слайд 30: Сравнение свойств галогеноводородов Почему HF проявляет аномальные свойства?
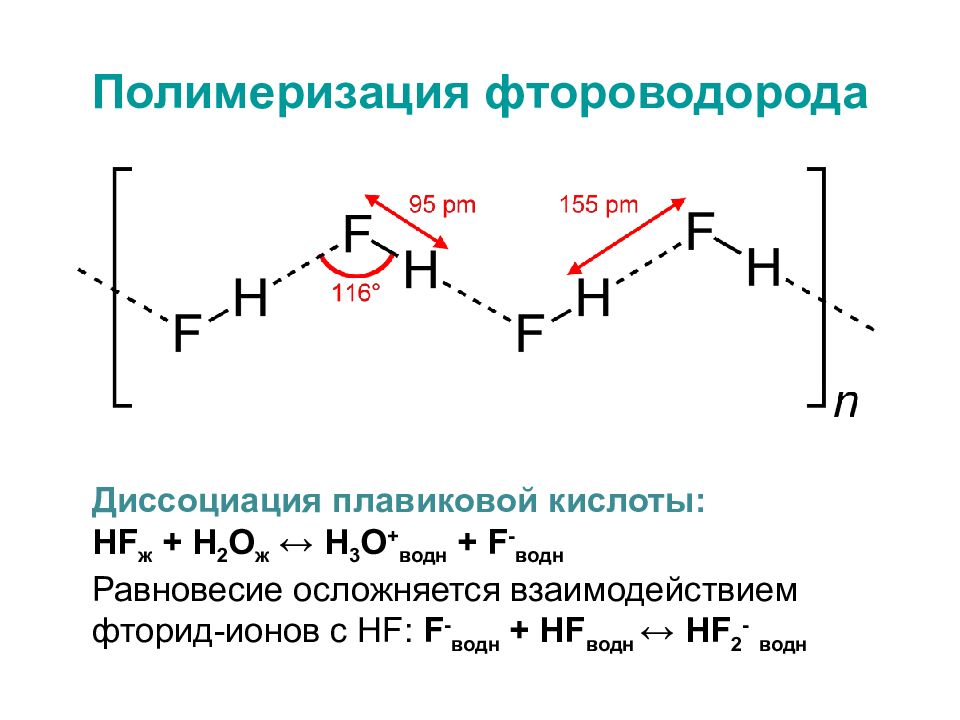
Слайд 32: Полимеризация фтороводорода
Диссоциация плавиковой кислоты: НF ж + H 2 О ж ↔ H 3 О + водн + F - водн Равновесие осложняется взаимодействием фторид-ионов с НF: F - водн + НF водн ↔ НF 2 - водн
Слайд 33: Получение галогеноводородов
1. Действие конц. серной кислоты на твердые галогениды ( HF, HCl, редко HBr ) (уравнения) 2. Синтез из простых веществ ( HF, HCl ) (уравнения) 3. Действие фосфорной кислоты на твердые галогениды ( HBr, HI ) : KX + H 3 PO 4 = KH 2 PO 4 + HX 4. Реакция галогена с водой с участием красного фосфора ( HBr, HI ) : 3Х 2 + 2Р + 6Н 2 О = 6НХ + 2Н 3 РО 3 5. Гидролиз бромида и иодида фосфора ( HBr, HI ) : PI 3 + 3 H 2 O = H 3 PO 3 + 3 HI
Слайд 34: Химические свойства галогеноводородов
1. Все галогеноводороды – восстановители за счет галогенид-иона : 4 HI + O 2 = 2 H 2 O + 2 I 2 2. Хлороводород окисляет некоторые металлы: 2 HCl газ + Mg тв →ᵗ MgCl 2 тв + Н 2 газ 3. Реагируют с более активным галогеном : 2 I - + Br 2 = 2 Br - + I 2 4. В растворах проявляют общие свойства кислот – реагируют с металлами, их оксидами, гидроксидами, солями (уравнения)
Слайд 35: Химические свойства галогеноводородов
5. Концентрированный HF ( плавиковая кислота ) реагирует с оксидом кремния. Эта реакция применяется для травления стекла: SiO 2 + 6 HF = H 2 SiF 6 + 2 H 2 O – матовое травление SiO 2 + 4 HF = SiF 4 + 2 H 2 O – прозрачное травление 6. Качественные реакции на галогенид-ионы – реакции с ионами серебра: Г - + Ag + = Ag Г↓ Фторид серебра растворим, хлорид серебра – белый, бромид серебра – желтоватый, иодид серебра – ярко-желтый
Слайд 36: Галогениды металлов
Галогениды щелочных и щелочно-земельных металлов, а также многие моно- и дигалогениды других металлов – типичные соли, в которых преобладает ионный характер связи Галогениды металлов V-VIII групп, кроме Сr и Мn, восстанавливаются Н 2 до металлов: WF 6 + 3Н 2 = W + 6HF Более легкие галогены могут вытеснять более тяжелые из галогенидов Галогениды получают непосредственно из элементов, реакцией галогеноводородов или галогеноводородных кислот с металлами, оксидами, гидроксидами или солями, а также другими обменными реакциями (уравнения)
Слайд 37: Фториды кислорода
Дифторид кислорода OF 2 ( FOF – угловая молекула ). Бесцветный газ с резким неприятным запахом. t пл. = –224°С, t кип. = –145°С. Получение: 2F 2 + 2NaOH = OF 2 + 2NaF + H 2 O (0° C) Сравнительно легко вступает в реакции с различными соединениями, что используется для синтеза фторидов благородных газов: Xe + OF 2 = XeF 2 + 1/2O 2 (400° C, 3 атм ) Не является кислотным ангидридом и при взаимодействии с водой не образует фторноватистую кислоту HOF, а разлагается Диоксидифторид O 2 F 2 ( FOOF ) ( t пл. = –154°С, t кип. = –57°С) неустойчив и быстро разлагается
Слайд 38: 6. Соединения галогенов в положительной степени окисления Оксиды галогенов
Оксиды галогенов : X 2 O ( Cl 2 O, Br 2 O ), XO 2 ( ClO 2, BrO 2 ), X 2 O 6 ( Cl 2 O 6 ), X 2 O 5 ( I 2 O 5 ), X 2 O 7 ( Cl 2 O 7 ) Оксид хлора Cl 2 O (хлорноватистый ангидрид) - темно-желтый газ с резким запахом ( t пл. = –116°С, t кип. = 2°С). Синтезируют, пропуская ток хлора через оксид ртути: 2Cl 2 + 2HgO = HgO·HgCl 2 + Cl 2 O Он хорошо растворяется в воде с образованием хлорноватистой кислоты HClO: Cl 2 O + H 2 O = 2HClO С растворами щелочей дает соли хлорноватистой кислоты – гипохлориты : Cl 2 O + 2 KOH = 2 KClO + H 2 O Ядовит и взрывоопасен. При комнатной температуре медленно диспропорционирует : 4 Cl 2 O = 2 ClO 2 + 3 Cl 2
Слайд 39: Оксиды галогенов
Диоксид хлора ClO 2 желт o -бурый газ с резким запахом ( t пл. = –59°С, t кип. = 10°С), при t ниже 10°С – бурая жидкость. Взрывоопасен при нагревании и соприкосновении с горючими веществами Получают из хлората калия: KClO 3 + H 2 SO 4 = HClO 3 + KHSO 4 3 HClO 3 = 2 ClO 2 + HClO 4 + H 2 O В лабораторных условиях: 2KClO 3 + H 2 C 2 O 4 + H 2 SO 4 = K 2 SO 4 + 2ClO 2 + 2CO 2 + 2H 2 O При взаимодействии с водой в щелочных растворах ClO 2 диспропорционирует, т.е. ангидрид двух кислот 2 ClO 2 + H 2 O = HClO 3 + HClO 2 – хорошо с холодной водой 2 ClO 2 + 2 KOH = KClO 3 + KClO 2 + H 2 O – с холодным раствором быстро
Слайд 40: Оксиды галогенов
Оксид хлора Cl 2 O 6 (димер оксида хлора VI ) – вязкая темно-красная маслянистая жидкость ( t пл. = 3,5°С, t кип. = 203°С). Образуется при окислении ClO 2 озоном: 2ClO 2 + 2O 3 = Cl 2 O 6 + 2O 2 (–10°C) Смешанный ангидрид хлорноватой и хлорной кислот, которые образуются при реакции с водой : Cl 2 O 6 + H 2 O = HClO 4 + HClO 3 Реагирует со щелочами в растворе, при этом происходит реакция диспропорционирования : 2 KOH + Cl 2 O 6 = KClO 3 + K С lO 4 + H 2 O В жидком состоянии уже при температуре плавления постепенно разлагается на ClO 2 и кислород: Cl 2 O 6 = 2ClO 2 + O 2 В газовой фазе происходит распад димера : Cl 2 O 6 ↔ 2ClO 3
Слайд 41: Оксиды галогенов
Хлорный ангидрид Cl 2 O 7 – бесцветная маслянистая жидкость ( t пл. = –90°С, t кип. = 82°С). Взрывается при нагревании до 120°C, но более стабилен, чем другие оксиды хлора: 2 Cl 2 O 7 = 2С l 2 + 7 O 2 Получают действием водоотнимающих средств (P 4 O 10, олеум) на концентрированную хлорную кислоту с последующей перегонкой при –35°С и пониженном (1 мм рт. ст.) давлении: 4HClO 4 + P 4 O 10 = 2 Cl 2 O 7 + 4 HPO 3 При попадании в воду медленно образует хлорную кислоту HClO 4, а со щелочами дает перхлораты : Cl 2 O 7 + H 2 O = 2HClO 4 Cl 2 O 7 + 2 KOH = 2 K С lO 4 + H 2 O
Слайд 42: Оксиды галогенов
Оксид брома( I ) Br 2 O – красно-коричневая жидкость, выдерживает температуру ниже -40°С. Получают аналогично Cl 2 O (уравнение) При реакции с водой дает бромноватистую кислоту: Br 2 O + H 2 O = 2H Br O Оксид брома ( IV ) BrO 2 – желтые кристаллы. Очень неустойчив, разлагается чуть выше 0°С, быстро диспропорционирует Оксид брома( VI ) BrO 3 – бесцветные игольчатые кристаллы. Разлагается уже при температуре ниже -80°С. Образуется при действии озона на бром Оксид иода (V) I 2 O 5 ( иодноватый ангидирид ) – бесцветное кристаллическое соединение. Получают I 2 O 5 дегидратацией HIO 3 (уравнение) Оксид иода (V II ) I 2 O 7 ( иодный ангидрид) – оранжевое твердое вещество. Получают обезвоживанием иодной кислоты серной кислотой (уравнение)
Слайд 43: Кислородсодержащие кислоты
Галогены образуют: - галогеноватистые кислоты HOX (все слабые), соли гипогалогениты - галогенистые кислоты HOXO (НХО 2 ) (первая средней силы, по другим данных нет), соли галогениты - галогеноватые кислоты HOXO 2 (НХО 3 ) (первые 2 сильные, последняя средней силы), соли галогенаты - галогеновые кислоты HOXO 3 (НХО 4 ) (первые 2 сильные, последняя слабая), соли пергалогенаты
Слайд 44: Галогеноватистые кислоты HOX
Слабые кислоты, не выделены в чистом виде, а встречаются только в виде водных растворов Хлорноватистая кислота HOCl существует в растворе зеленовато-желтого цвета, максимальная массовая доля 20-25%, неустойчива, уже при 5-10°С быстро разлагается Получение: 1. Хлорноватистая кислота настолько слабая, что даже угольная кислота вытесняет ее из растворов гипохлоритов: NaOCl + H 2 O + CO 2 = NaHCO 3 + HOCl
Слайд 45: Хлорноватистая кислота HOCl и гипохлориты
2. Растворение оксида хлора( I ) в воде (уравнение) 3. Растворение хлора в воде (уравнение). Гипохлориты получают аналогичной реакцией хлора с раствором щелочи (уравнение) Свойства: 1. HOCl - очень сильный окислитель, нестойкая, даже в водном растворе распадается под действием света: HOCl → HCl + [О] 2О → О 2 Аналогичная реакция протекает при разложение гипохлоритов в растворе: 2 CaOCl 2 = 2 CaCl 2 + O 2 (катализатор – Со 2+ ) 2. Гипохлориты – сильные окислители : CaOCl 2 + 2HCl = CaCl 2 + Cl 2 + H 2 O NaClO + 2KI + H 2 SO 4 = NaCl + I 2 + K 2 SO 4 + H 2 O
Слайд 46: Галогеноватистые кислоты и их соли
Бромноватистая кислота HOBr существует только в растворе желтоватого цвета, максимальная массовая доля 30%. Сильный окислитель. Получение и свойства аналогичны хлорноватистой кислоте Иодноватистая кислота HOI существует в разбавленном растворе, окрашена в зеленоватый цвет, неустойчива. Соединение амфотерное, причем основные свойства выражены сильнее, чем кислотные: HOI + HNO 3 = INO 3 + H 2 O
Слайд 47: Галогенистые кислоты HOXO и их соли
HClO 2 и HВrO 2 очень неустойчивы и в растворе быстро диспропорционируют. Иодистая кислота HIO 2 только недавно была обнаружена в водных растворах в качестве переходной частицы Получение HClO 2 и хлоритов : кислоты: Ba (ClO 2 ) 2 + H 2 SO 4 = BaSO 4 ↓ + 2HClO 2 хлоритов: 2 ClO 2 + 2 KOH = KClO 2 + KClO 3 + H 2 O Свойства: разложение в разбавленном водном растворе: 4 HClO 2 = HCl + HClO 3 + 2 ClO 2 + H 2 O Разложение солей (более устойчивы): NaClO 2 = NaCl + O 2 3 NaClO 2 = NaCl + 2 NaClO 3
Слайд 48: Хлорноватая кислота HClO 3 и хлораты
HClO 3 в свободном виде не выделена, существует в растворе с массовой долей 40%, сильная, при температуре 40-90°C разлагается Получение: кислоты: аналогично хлористой (уравнение) соли: 6Ba(OH) 2 + 6Cl 2 = 5BaCl 2 + Ba(ClO 3 ) 2 + 6H 2 O Свойства: Разложение при нагревании: 4 KClO 3 = KCl + 3 KClO 4 без катализатора, t < 370°C 2 KClO 3 = 2 KCl + 3 O 2 катализатор MnO 2, t = 370°C Реакция с кислотами: 3 KClO 3 + H 2 SO 4 = K 2 SO 4 + 2 ClO 2 ↑ + KClO 4 + H 2 O KClO 3 + 6 HCl = 3 Cl 2 + KCl + 3 H 2 O
Слайд 49: Бромноватая HBrO 3 кислота и броматы
Бромноватая кислота существует в растворе с массовой долей до 50%, сильная, сильный окислитель, нестабильна, разлагается на воду, бром и кислород Получение: 1. Аналогично хлорноватой (уравнение) 2. Окисление бромной воды хлором: 5 Cl 2 + Br 2 + 6 H 2 O = 2 HBrO 3 + 10 HCl Соли получают по реакции галогена с растворами щелочей (уравнение)
Слайд 50: Иодноватая кислота HIO 3
Иодноватая кислота HIO 3 – белые кристаллы, устойчива при комнатной температуре, при нагревании разлагается с образованием иодноватого ангидрида и воды. Кислота средней силы, окислитель Получение: 1. Реакция ангидрида с водой (уравнение) 2. Окисление иодной воды хлором (уравнение аналогично окислению бромной воды) 3. Окисление иода конц. азотной кислотой (уравнение) Соли получают по реакции галогена с растворами щелочей (уравнение)
Слайд 51: Хлорная кислота HClO 4 и перхлораты
Хлорная кислота HClO 4 известна в свободном виде, подвижная, бесцветная, дымящая на воздухе, гигроскопичная жидкость с t пл. = -101°C, t к. = +110°C Получение: KClO 4 + H 2 SO 4 конц. = HClO 4 + K Н SO 4 в вакууме Электрохимическое окисление хлоратов или хлоридов на платиновом аноде Перхлораты щелочных металлов обычно получают при диспропорционировании соответствующих хлоратов (уравнение)
Слайд 52: Хлорная и бромная HBrO 4 кислоты
Свойства: 1. Окислительная способность: 2 HClO 4 + I 2 + 4 H 2 O = 2 H 5 IO 6 + Cl 2 2. Реакция нейтрализации (уравнение) 3. Разложение при нагревании: 4 HClO 4 = 4 ClO 2 ↑ + 3 O 2 + 2 H 2 O 4. Обезвоживание оксидом фосфора: 2 HClO 4 + P 4 O 10 + 5 H 2 O = Cl 2 O 7 + 4 H 3 PO 4 Бромная кислота HBrO 4 нестойкая, стабильна только в водных растворах с концентрацией менее 55%, при более высокой концентрации разлагается. Перброматы – чрезвычайно сильные окислители
Слайд 53: Иодная кислота
Иодная кислота – гигроскопичное кристаллическое вещество с t пл. = 130°C, хорошо растворимое в воде, слабая, может образовывать средние и кислые соли В растворах существует в трех формах: HIO 4 – метаиодная кислота, H 3 IO 5 – мезоиодная кислота и H 5 IO 6 – ортоиодная кислота Средние соли этих кислот – NaIO 4, Na 3 IO 5, Na 5 IO 6
Слайд 54: Иодная кислота и периодаты
Получение: Получают по реакции диспропорционирования иодата и обработки ортопериодата кислотой: 5 Ba ( IO 3 ) 2 = Ba 5 ( IO 6 ) 2 + 4 I 2 + 9 O 2 Ba 5 ( IO 6 ) 2 + 5 H 2 SO 4 = 5 BaSO 4 ↓ + 2 H 5 IO 6 Соли получают окислением иодатов электрохимически или действием хлора Свойства: Метапериодаты чувствительны к нагреванию и даже могут при этом взрываться: 5 NaIO 4 = Na 5 IO 6 + 2 I 2 + 7 O 2 Ортопериодаты более устойчивы при нагревании
Слайд 55: 7. История открытия галогенов Карл Вильгельм Шееле ( 9.12.1742 – 21.05.1786)
Первым из семейства галогенов был открыт хлор в 1774 году шведским аптекарем Карлом Шееле. Он так описал свой опыт: «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, окрасившим его в желтый цвет. Газ имел желто-зеленый цвет, пронзительный запах». В 1812 году французский химик Гей-Люссак дал этому газу современное название – хлор, что в переводе с греческого означает желто-зеленый
Слайд 56: Бернар Куртуа 8 февраля 1777 г. - 27 сентября 1838 г
В 1811 году французский химик-технолог и фармацевт Бернар Куртуа открыл иод «Иодэс» в переводе с греч. Фиолетовый
Слайд 57: Антуан Жером Балар 30 сентября 1802 г. – 30 марта 1876 г
Бром был открыт в 1826 году лаборантом Антуаном Жеромом Баларом в возрасте 24 лет. Через несколько лет напряженной работы он выделил необходимое количество темно-бурой жидкости, названной им муридом. В Парижской Академии наук Гей-Люссак и Тенар подтвердили открытие нового простого вещества, но нашли название неудачным и предложили свое – "бром", что в переводе с греческого означало зловонный
Слайд 58: Анри Муассан 28 сентября 1852 г. - 20 февраля 1907 г
Только в 1886 г. франц. химику Анри Муассану сравнительно безболезненно удалось получить фтор. Муассан случайно обнаружил, что при электролизе смеси жидкого безводного HF и гидродифторида калия (KHF 2 ) в платиновом сосуде на аноде выделяется светло-желтый газ со специфическим резким запахом. Нобелевская премия по химии была присуждена Муассану в 1906 г. «в признание большого объема исследований – получения элемента фтора и введения в лабораторную и промышленную практику электрической печи, названной его именем». Этот элемент так и назвали « Фторос » – разрушающий
Слайд 59: Получение астата ( эко-иода )
Дэйл Раймонд Корсон Кеннет Росс МакКензи 1912 - 2002 05.04.1914 – 31.03.2012 Эмилио Джино Сегре 01.02.1905 – 22.04.1989 Один из изотопов элемента 85 (астат-211) был получен в 1940 г. Корсоном, Маккензи и Сегре в циклотроне. Элемент 85 получил свое название астат ( Astatium ) в 1947 г. в статье авторов открытия. Название произведено от греч. Астатос, означающего « неустойчивый, шаткий », так как все изотопы астата оказались короткоживущими
Слайд 60: Открытие 117-го элемента
117-й элемент был открыт последним в 7-м периоде Впервые его удалось создать в 2009 году российско-американской группе. Для синтеза 117-го мишень из 97-го элемента берклия-249 обстреливали ионами кальция-48 на ускорителе У-400 Лаборатории ядерных реакций ОИЯИ 30 декабря 2015 г. ИЮПАК официально признал открытие 117-го элемента и приоритет в этом ученых из Объединенного института ядерных исследований (ОИЯИ, г. Дубна, Россия) и Ливерморской национальной лаборатории 28 ноября 2016 года ИЮПАК утвердил название 117-го элемента теннессин ( Ts ) в честь штата Теннесси, где находится Окриджская лаборатория
Слайд 61: 8. Биологическая роль и применение Биологическая роль фтора
Минеральную основу зубных тканей – дентина составляют гидроксилапатит Ca 5 ( PO 4 ) 3 ( OH ), хлорапатит Ca 5 ( PO 4 ) 3 Cl и фторапатит Ca 5 ( PO 4 ) 3 F. Фторид-ион легко замещает гидроксид-ион в гидроксилапатите, образуя защитный эмалевый слой более твёрдого фторапатита : Ca 5 ( PO 4 ) 3 OH + F - ↔ Ca 5 ( PO 4 ) 3 F + OH - Фторид-ионы способствуют осаждению фосфата кальция, тем самым ускоряя процесс реминерализации (образования кристаллов): 10Ca 2+ + 6PO 4 3- +2F - = 3Ca 3 (PO 4 ) 2 ∙ CaF 2
Слайд 62: Биологическая роль фтора
Кариес зубов: под действием кислот, вырабатываемых бактериями, происходит растворение гидроксилапатитной компоненты эмали: Ca 5 (PO 4 ) 3 OH + 7H + = 5Ca 2+ + 3H 2 PO 4 - + H 2 O Применение NaF в медицинской практике в качестве местно действующего наружного средства основано на образовании фторапатита : NaF + Ca 5 ( PO 4 ) 3 OH ↔ NaOH + Ca 5 ( PO 4 ) 3 F паста зубная ткань
Слайд 63: Хлорсодержащие ОВ в первую мировую войну. Атака на зараженной местности
Фотоархив "Химвойска" в 1-ю мировую войну http://www.himvoiska.narod.ru/archivmain.html
Слайд 66: Применение галогенов Галогенные лампы
(3000 0 C) (400 – 1000 0 C) W + 2I 2 = WI 4