Первый слайд презентации
Тема № 6. ХИМИЯ НЕМЕТАЛЛОВ Урок № 59 Тема урока: ГАЛОГЕНЫ. ОБЩАЯ ХАРАКТЕРИСТИКА ПОДГРУППЫ. ХЛОР – ПОЛУЧЕНИЕ, ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА. Учебная дисциплина: ОДП.04. Химия. Группа: СВ-4-18. Профессия: 15.01.05 Сварщик (электросварочные и газосварочные работы) Дата проведения: 18.05.20 г. Преподаватель: Иванова Л.Н.
Задачи: Познакомиться с историей открытия галогенов Сравнить строение атомов галогенов, выявив черты сходства и отличия Изучить получение хлора Физические и химические свойства хлора Дать представление о роли галогенов в организме
Слайд 3: Открытие фтора
Фтор( F 2 ) –от греч. «фторос»- разрушающий был открыт в 1866 году французским химиком Анри Муассаном электролизом смеси жидкого безводного HF и гидродифторида калия KHF 2 в платиновом сосуде: 2HF →H 2 ↑ + F 2 ↑ катод анод В 1906 году Муассан был удостоен Нобелевской премии за открытие элемента фтора и введение в практику электрической печи, названной его именем
Слайд 4: Открытие хлора
Хлор Cl 2 от греч. «хлорос» - желто-зеленый 1774 год Шведский аптекарь Карл Вильгельм Шееле «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах». Уравнение реакции: MnO 2 + 4HCl Cl 2 + MnCl 2 + 2H 2 O
Слайд 5: Открытие брома
Бром (Br 2 ) от греч. «бромос»- зловонный Был открыт в 1826 году Французским химиком (24-летним лаборантом) Антуаном- Жеромом Баларом Действием хлором на рассолы соляных болот Франции по реакции: 2NaBr + Cl 2 → 2NaCl + Br 2
Слайд 6: Открытие йода
Йод ( I 2 ) от греч. «иодес» - фиолетовый Был открыт в 1811 году Французским химиком-технологом и фармацевтом Бернаром Куртуа в золе морских водорослей Уравнение реакции: 2 NaI + H 2 SO 4 → Na 2 SO 4 + I 2
Слайд 7: Открытие астата
Астат( At 2 ) от греч. «астатос» - неустойчивый Был получен в 1940 году Искусственным путем при облучении висмута альфа-частицами Учеными Калифорнийского университета Д.Корсоном и К.Р.Маккензи
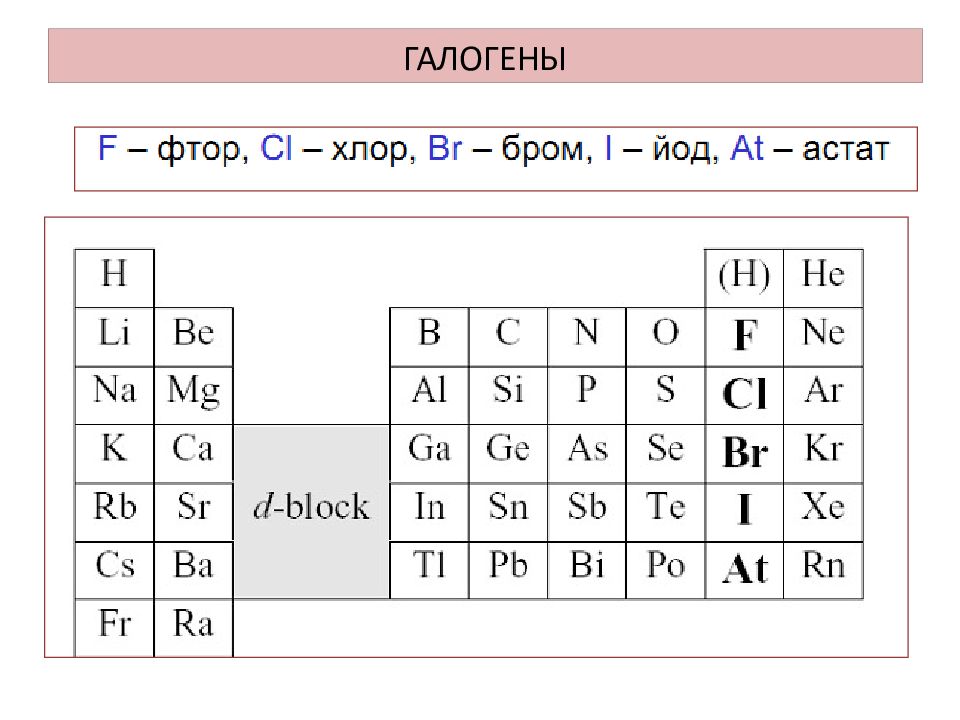
Слайд 8: Строение атомов галогенов
F + 9 ) ) 2 7 Cl +17 ) ) ) 2 8 7 Br + 35 ) ) ) ) 2 8 18 7 l + 53 ) ) ) ) ) 2 8 18 18 7 Заряд ядра увеличивается Радиус атома увеличивается Количество валентных электронов равно 7 Притяжение валентных электронов к ядру уменьшается Способность отдавать электроны увеличивается Неметаллические свойства ослабевают Окислительная способность уменьшается
Слайд 10: Сравнение физических свойств простых веществ-галогенов
F 2 светло-желтый газ Cl 2 желто-зеленый газ Br 2 красно-бурая жидкость I 2 темно-серые кристаллы с металлическим блеском At 2 черно-синие кристаллы Интенсивность цвета усиливается Плотность увеличивается Температуры плавления и кипения увеличиваются
Слайд 11: Химические свойства хлора
Взаимодействует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): Cl 2 + 2Na → 2 NaCl 3Cl 2 + 2Sb → 2SbCl 3 3Cl 2 + 2Fe → 2 FeCl 3 С неметаллами, кроме углерода, азота, кислорода и инертных газов образует соответствующие хлориды На свету или при нагреванииактивно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.: Cl 2 + H 2 → 2HCl 5Cl 2 + 2P → 2PCl 5 2S + Cl 2 → S2Cl 2
Слайд 12: Химические свойства хлора
С кислородом хлор образует оксиды в которых он проявляет степень окисления от +1 до +7: Cl 2 O, ClO 2, Cl2O6, Cl 2 O 7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду. При реакции с фтором, образуется не хлорид, а фторид: Cl 2 + 3F 2 (изб.) → 2ClF 3 Хлор вытесняет бром и иод из их соединений с водородом и металлами: Cl 2 + 2HBr → Br 2 + 2HCl Cl 2 + 2NaI → I 2 + 2NaCl
Слайд 13: Химические свойства хлора
При реакции с монооксидом углерода образуется фосген: Cl 2 + CO → COCl 2 При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли: Cl 2 + H 2 O → HCl + HClO 3Cl 2 + 6NaOH → 5NaCl + NaClO 3 + 3H 2 O Хлорированием сухого гидроксида кальция получают хлорную известь: Cl 2 + Ca (OH) 2 → CaCl ( OCl ) + H 2 O Действие хлора на аммиак можно получить трёххлористый азот: 4NH 3 + 3Cl 2 → NCl 3 + 3NH 4 Cl
Слайд 14: Химические свойства хлора
Хлор очень сильный окислитель. Cl 2 + H 2 S → 2HCl + S Реакции с органическими веществами: С насыщенными соединениями: CH 3 -CH 3 + Cl 2 → C2H6-xClx + HCl Присоединяется к ненасыщенным соединениям по кратным связям: CH 2 =CH 2 + Cl 2 → Cl-CH 2 -CH 2 -Cl Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3): C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl
Слайд 15
Химическая активность галогенов уменьшается от фтора к йоду, поэтому галоген с меньшим порядковым номером может вытеснять галоген с большим порядковым номером из его соединений с водородом и металлами: Взаимодействие хлорной воды с галогенидами 2KI + Cl 2 → 2KCl + I 2 NaCl + Cl 2 → 2NaBr + Cl 2 → 2NaCl + Br 2
Слайд 16: Качественные реакции на галогенид-ионы
Качественные реакции на хлориды, бромиды и йодиды -образование нерастворимых галогенидов серебра: NaCl + AgNO 3 → AgCl↓ + NaNO 3 белый творожистый осадок NaBr + AgNO 3 → AgBr↓ + NaNO 3 желтоватый творожистый осадок NaI + AgNO 3 → AgI↓ + NaNO 3 желтый творожистый осадок
Слайд 17: Получение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде - водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде - натрий): 2NaCl+2H 2 O → Cl 2 ↑+H 2 ↑+2NaOH 2NaCl → Cl 2 ↑+2Na В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль: 4HCl -1 +Mn +4 O 2 = Mn +2 Cl 2 +Cl 2 0 ↑+2H 2 O 2KMn +7 O 4 +16HCl -1 =2KCl+2Mn +2 Cl 2 +5Cl 2 0 ↑+8H 2 O KCl +5 O 3 +6HCl -1 = KCl+3Cl 2 0 ↑+3H 2 O
Слайд 18: П рименение хлора
отбеливание тканей и бумаги; обеззараживание воды; производство пластмасс; производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков; синтез хлороводорода в производстве соляной кислоты.
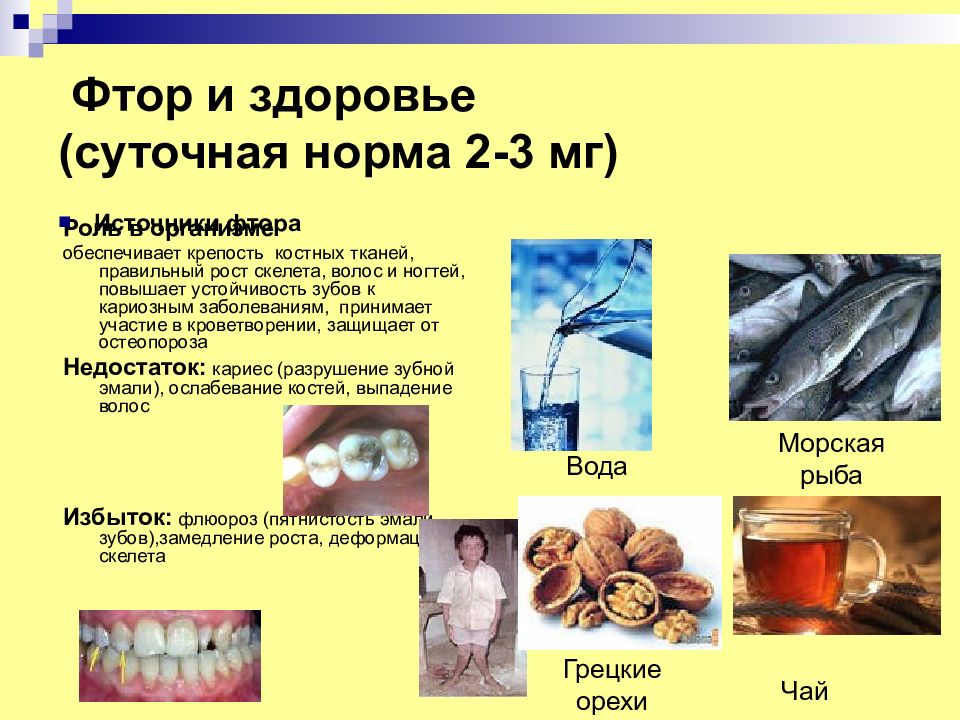
Слайд 19: Фтор и здоровье ( суточная норма 2-3 мг)
Роль в организме обеспечивает крепость костных тканей, правильный рост скелета, волос и ногтей, повышает устойчивость зубов к кариозным заболеваниям, принимает участие в кроветворении, защищает от остеопороза Недостаток: кариес (разрушение зубной эмали), ослабевание костей, выпадение волос Избыток: флюороз (пятнистость эмали зубов),замедление роста, деформация скелета Источники фтора Вода Морская рыба Грецкие орехи Чай
Слайд 20: Хлор и здоровье (суточная норма 2г)
Роль в организме: Образование соляной кислоты, поддержание водно-электролитного баланса, выведение шлаков и углекислого газа из организма, расщепление жиров Недостаток: мышечная слабость, сонливость, вялость, ослабление памяти, потеря аппетита, сухость во рту, выпадение зубов и волос Избыток: задержка воды в тканях, повышение кровяного давления, боли в голове и груди, диспепсические расстройства, сухой кашель, слезотечение, резь в глазах Источники хлора Свекла Бобовые Злаки Поваренная соль
Слайд 21: Бром и здоровье (суточная норма 0,5-2 мг)
Роль в организме: принимает участие в регуляции деятельности нервной системы, оказывает влияние на функции половых желез, влияет на процессы возбуждения и торможения в головном мозге Недостаток: бессонница, снижение уровня роста эритроцитов в крови. Избыток: кожное заболевание – бромодерма, нарушение работы нервной системы, апатия, сонливость, ослабление памяти Источники брома
Слайд 22: Йод и здоровье (суточная норма100-200 мкг)
Роль в организме: Участие в синтезе гормонов щитовидной железы, создание патрульных клеток в крови- фагоцитов. Избыток: гипертиреоз- увеличение обмена веществ учащение пульса, возбудимость Недостаток: гипотиреоз-снижение функции щитовидной железы( снижение обмена веществ, понижение температуры тела, слабость), базедова болезнь, умственная отсталость Источники йода Кальмары Хурма Томаты Морская рыба Морковь Морская капуста
Слайд 23
2 е л е з о с м ь д й о в о а т с с о в а в д и д и н я а с с о ь л е т т ы о к и с л и т л н ь л й ы л б е л е г о л г о р б е д с и р е о х ж е н е л ш е б м р а м д л т и г я т а в о д ь 1 2 3 4 8 10 12 9 13 17 16 5 11 6 7 19 18 14 н 15 2 ж 2 (по горизонтали). NaI - название вещества 4 (по горизонтали). Cl 2 + … →FeCl 3 5 (по горизонтали). F 2 +… →HF+O 2 10 (по горизонтали). Роль HCl в реакции: MnO 2 + 4HCl →MnCL 2 + Cl 2 +2H 2 O 12 (по горизонтали).Роль брома в реакции: Br 2 + 2KI →2KBr + I 2 13 (по горизонтали). Галоген, являющийся при обычных условиях жидкостью 1 5 (по горизонтали).Природное соединение состава NaCl 1 7 (по горизонтали). Ученый, открывший хлор 18 (по горизонтали). Цвет осадка AgI 19 (по горизонтали). Металл, нитрат которого используют для определения галогенов 1 (по вертикали). Высшая степень окисления галогенов (кроме фтора) 2 (по вертикали). Галоген, кристаллы которого имеют черно-фиолетовый цвет с металлическим блеском 3 (по вертикали). Количество атомов в молекулах простых веществ-галогенов 6 (по вертикали). Радиоактивный галоген 7 (по вертикали). Второе название хлороводородной кислоты 8 (по вертикали). Степень окисления простых веществ - галогенов 9 (по вертикали). Элемент VII А группы 11 (по вертикали). Цвет осадка при качественном определении ионов хлора Cl ¯ 1 4 (по вертикали). Br 2 + … →CuBr 2 1 6 (по вертикали). Название соли соляной кислоты
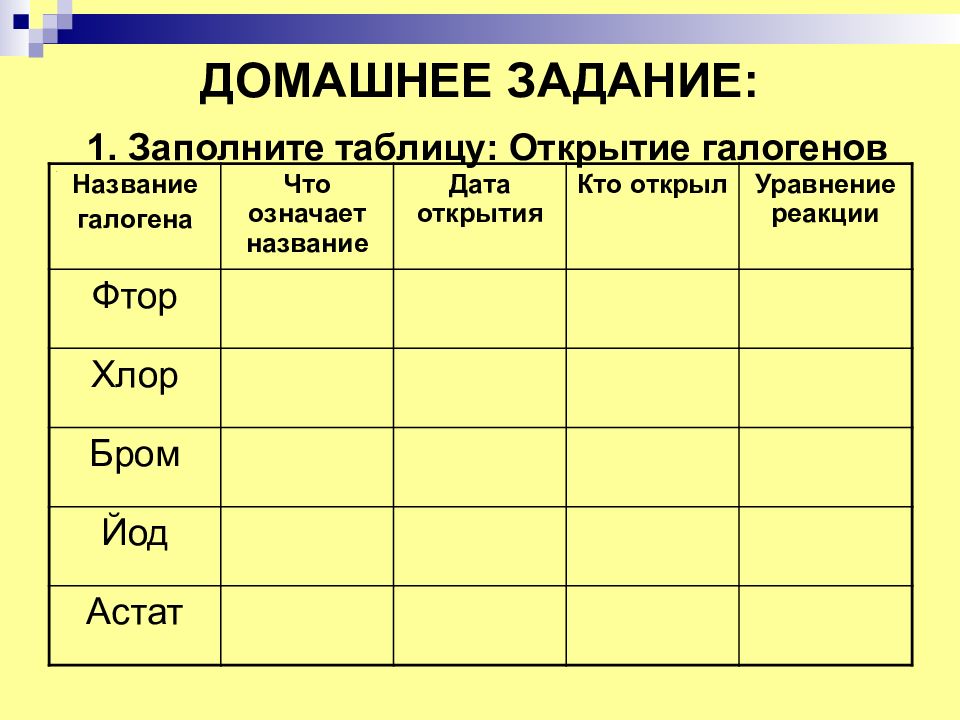
Слайд 24: ДОМАШНЕЕ ЗАДАНИЕ: 1. Заполните таблицу: Открытие галогенов
Название галогена Что означает название Дата открытия Кто открыл Уравнение реакции Фтор Хлор Бром Йод Астат
Слайд 25: ДОМАШНЕЕ ЗАДАНИЕ:
2. Заполните таблицу: Галогены и здоровье Название галогена Роль в организме Недостаток Избыток Источник
Слайд 26
Отчет о выполнении домашнего задания (в виде сканкопий, фотографий или документов Microsoft Word ) прислать на электронный адрес: larisanikolaevna.epgl@yandex.ru
Последний слайд презентации: Тема № 6. ХИМИЯ НЕМЕТАЛЛОВ Урок № 59 Тема урока: ГАЛОГЕНЫ. ОБЩАЯ ХАРАКТЕРИСТИКА: УЧЕБНАЯ ЛИТЕРАТУРА: § 37. Рудзитис Г.Е. Химия 11 класс: Учебник для общеобразовательных учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман - М.: «Просвещение», 2014. - 224 с. (§ 21). ИСПОЛЬЗОВАННЫЕ МАТЕРИАЛЫ:
http://ru.wikipedia.org – сведения о галогенах,15.10.2010, 31.10.2010 http://ru.wikipedia.org - портрет Бернара Куртуа,15.10.2010 http://ru.wikipedia.org - фото йода,17.10.2010 http://www.baby24.lv/ru/info-h/412 - сведения о роли галогенов в организме,31.10.2010, 01.11.2010