Первый слайд презентации
Общая характеристика галогенов II. Галогены – химические элементы 1. Положение в ПСХЭ 2. Строение и свойства атомов III. Галогены – простые вещества 1. Состав. Строение 2. Физические свойства 3. Химические свойства I. Исторические сведения IV. Тест
Слайд 2
Хлор. Первым из галогенов был открыт хлор. (К. Шееле, 1774 г.) Полученный желто-зеленый газ шведский ученый принял за сложное вещество и назвал « дефлогистированной соляной кислотой». Лавуазье и Бертолле считали что, этот газ является оксидом неизвестного элемента « мурия ». В 1807 г. английский химик Гемфри Деви получил тот же газ, что и Шееле. Три года пытался Деви выделить из него « мурий », но безуспешно. Он пришел к выводу, что получил новый элемент и назвал его «хлорин». Через пять лет Гей-Люссак дал газу название хлор. А за год до этого немец Иоган Швейгер предложил еще одно имя – галоген, которое распространили на всю группу элементов с аналогичными свойствами. В жидком виде хлор впервые получил в 1823 г. Фарадей. Шееле Карл Вильгельм Гемфри Деви Гей-Люссак Лавуазье Антуан Лоран Бертолле Клод Луи Майкл Фарадей
Слайд 3
Балар А Жером Либих Юстус фон Бром. Этот во многом необычный элемент был открыт последним из галогенов, существующих в природе. Впервые его получил в 1825 г. студент Гейдельберского университета К. Левел, действуя на воду минерального источника Крейцнахе хлором. В 1826 г. в Парижской Академии наук было сделано сообщение французским химиком Баларом о том, что при изучении рассолов средиземноморских соляных промыслов он выделил темно-бурую жидкость по всей вероятности являющуюся новым элементом, который он назвал – «мурид» (от латинского слова muria, означающую «рассол»). Комиссия Академии наук про- верив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от «бромос», с греческого «зловонный». Пожалуй лишь один ученый Ю. Либих, был раздражен этим известием. Нескольки-ми годами ранее одна германская фирма прислала ему бутыль с жидкостью, попросив узнать ее состав. Либих, не проводя серьезного исследования заключил, что со- держимое бутыли является соединением иода с хлором. Потом он легко обнаружил там бром (после открытия Балара). Либих сказал «Не Балар открыл бром, а бром открыл Балара.
Слайд 4
Иод. Это второй галоген, который был выделен в свободном виде. Свободный иод получил парижский селитровар Куртуа в 1811 г. Название «иод» происходит от греческого слова «иодес» - фиолетовый (по цвету паров). Куртуа подарил его фармацевтической фирме в Дижоне. Доказательство элементарной природы иода независимо друг от друга дали в 1813 г. Ж. Гей-Люссак и Гемфри Деви. Гей-Люссак Гемфри Деви
Слайд 5
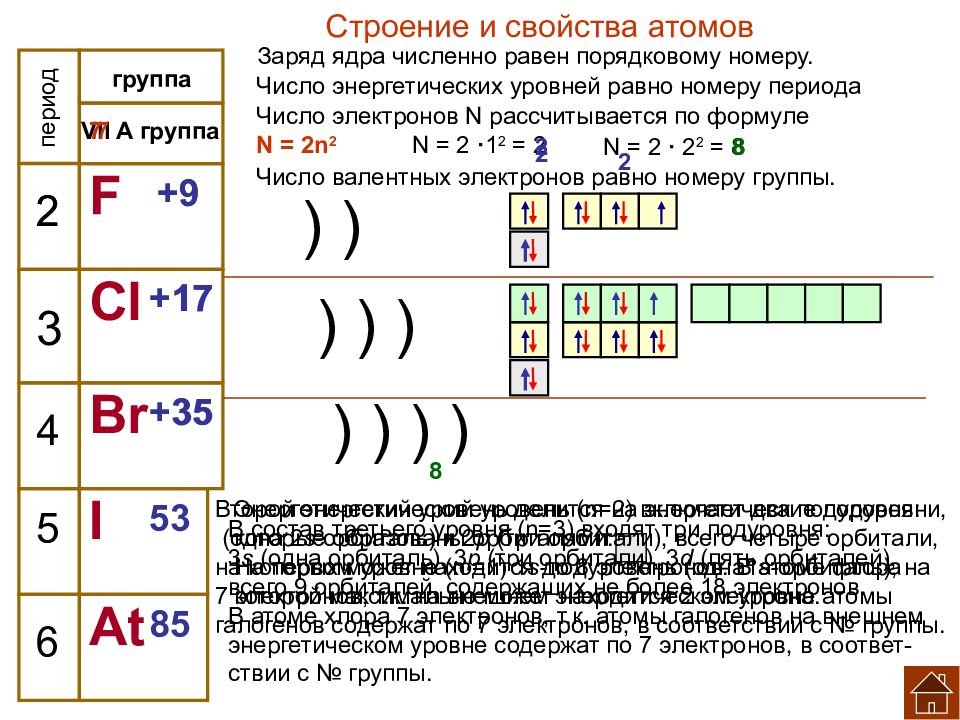
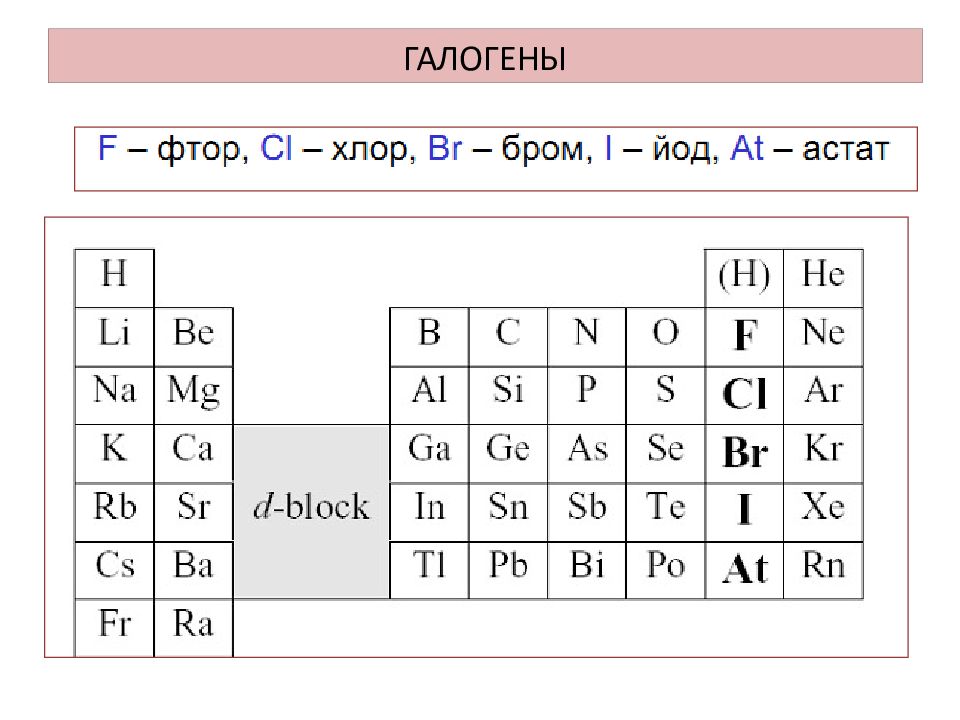
период VII A группа 2 3 4 5 F Cl Br I At 9 17 35 53 85 фтор 18,9984 6 хлор 35,453 бром 79,904 иод 126,9044 астат 210 Положение галогенов в ПСХЭ группа Определите положение галогенов в ПСХЭ. Перечислите химические элементы ─ галогены и дайте им краткую характеристику: выпишите их их символы и названия. Объясните характер изменений [ (увеличение), (усиление) ] или [ (уменьшение), (ослабление) ] в подгруппе галогенов с ростом порядкового номера: заряда ядра ( Z ); 2. количества электронов на внешнем слое; 3. радиус атома, нм; 4. прочность связи валентных электронов с ядром; 5. электроотрицательность (ЭО); 6. неметаллические свойства; 7. окислительные свойства; увеличивается не изменяется увеличивается уменьшается уменьшается ослабляются ослабляются 0,04 0,073 0,085, 0,105 F Cl Br I ЭО 3,98 3,16 2,96 2,66 2,2 F Cl Br I At
Слайд 6
группа 3 4 5 6 VII A группа F Cl Br I At 2 9 +9 2 ) ) Строение и свойства атомов Число электронов N рассчитывается по формуле N = 2n 2 N = 2 · 1 2 = 2 2 Заряд ядра численно равен порядковому номеру. Число энергетических уровней равно номеру периода период Число валентных электронов равно номеру группы. 7 17 +17 35 +35 ) ) ) ) ) ) ) 2 2 N = 2 · 2 2 = 8 8 8 8 7 7 Энергетический уровень делится на энергетические подуровни, которые образованы орбиталями. На первом уровне ( n =1) 1 s- подуровень (одна 1 s- орбиталь), на которой максимально может находится 2 электрона. Второй энергетический уровень ( n =2) включает два подуровня: (одна 2 s - орбиталь) и 2 р (три орбитали), всего четыре орбитали, на которых может находится до 8 электронов. В атоме фтора 7 электронов, т.к. на внешнем энергетическом уровне атомы галогенов содержат по 7 электронов, в соответствии с № группы. 53 85 В состав третьего уровня ( n =3) входят три подуровня: 3 s (одна орбиталь), 3 р (три орбитали), 3 d (пять орбиталей), всего 9 орбиталей, содержащих не более 18 электронов. В атоме хлора 7 электронов, т.к. атомы галогенов на внешнем энергетическом уровне содержат по 7 электронов, в соответ- ствии с № группы.
Слайд 7
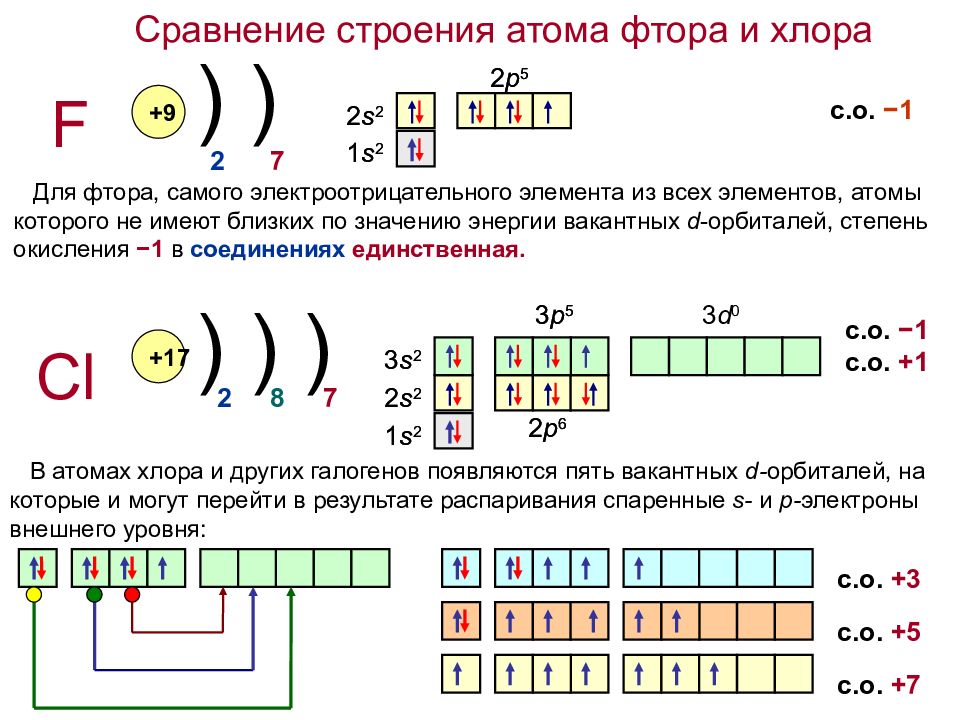
Сравнение строения атома фтора и хлора F Cl +9 +17 ) ) ) ) ) 2 2 7 8 7 Для фтора, самого электроотрицательного элемента из всех элементов, атомы которого не имеют близких по значению энергии вакантных d -орбиталей, степень окисления −1 в соединениях единственная. 1 s 2 2 s 2 1 s 2 2 s 2 2 p 5 3 p 5 2 p 6 3 s 2 3 d 0 1 s 2 1 s 2 2 s 2 2 s 2 2 p 5 2 p 6 3 s 2 3 p 5 В атомах хлора и других галогенов появляются пять вакантных d - орбиталей, на которые и могут перейти в результате распаривания спаренные s - и p - электроны внешнего уровня: с.о. +3 с.о. +5 с.о. +7 с.о. −1 с.о. +1 с.о. −1
Слайд 8
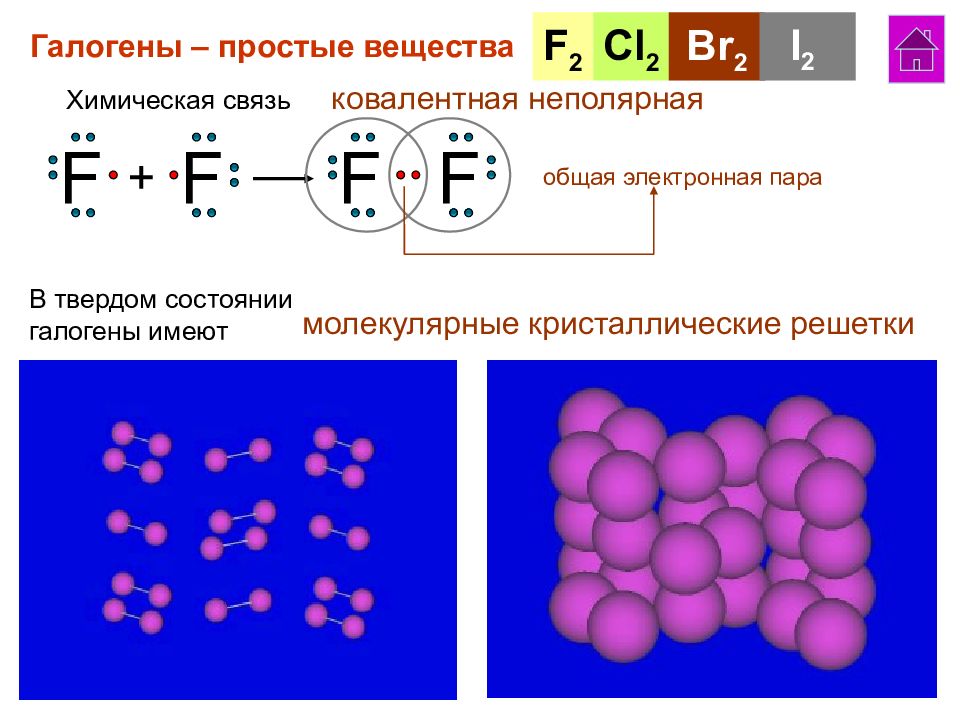
Галогены – простые вещества F 2 Cl 2 Br 2 I 2 Химическая связь ковалентная неполярная F F + F F общая электронная пара В твердом состоянии галогены имеют молекулярные кристаллические решетки
Слайд 9
Хлор – газ желто-зеленого цвета, сжижающийся при обычной температуре под давлением. В 2,5 раза тяжелее воздуха. С резким удушливым запахом. t плавления = −101 ° С t кипения = −34 ° С 1объем Н 2 О растворяет 2,3 объема С l 2 химическое взаимодействие Cl 2 + H 2 O = HCl + HClO Бром – красно-бурая жидкость. С резким Зловонным запахом. t плавления = −7,3 ° С t кипения = 59,2 ° С Плохо растворим 3,5г/л Иод – твердое вещество. Черно-фиолетовый, с металлическим блеском t плавления = 113,6 ° С t кипения = 185,5 ° С При нагревании образуют- ся фиолетовые пары Очень плохо растворим 0,3г/л Физические свойства галогенов Фтор − газ светло-желтого цвета, не сжижается при обычной температуре. С резким раздражающим запахом. t плавления = −219 ° С ; t кипения = −188,2 ° С Химически взаимодействуют 2F 2 + 2H 2 O = 4HF + O 2
Слайд 11
Химические свойства Химическая активность галогенов как неметаллов от фтора к иоду ослабевает. Каждый галоген является самым сильным окислителем в своем периоде. Окислительные свойства галогенов проявляются в первую очередь при взаимодействии с металлами. Составьте уравнения реакций взаимодействия железа с хлором, брома с алюми- нием, иода с алюминием. Рассмотрите с т.зр. ОВР. 2Fe 0 +3Cl 2 0 = 2Fe +3 Cl 3 − 2Al + 3Br 2 = 2AlBr 3 2Al + 3I 2 = 2AlI 3 Fe 0 − 3e → Fe +3 3 2 Cl 2 0 + 2e → 2Cl − 2 3 Al 0 − 3e → Al +3 3 2 Br 2 0 + 2e → 2Br − 2 3 Al 0 − 3e → Al +3 3 2 I 2 0 + 2e → 2I − 2 3 Fe − восстановитель, пр. окисления. Cl 2 − окислитель, пр. восстановления Al − восстановитель, пр. окисления. Br 2 − окислитель, пр. восстановления Al − восстановитель, пр. окисления. I 2 − о кислитель, пр. восстановления
Последний слайд презентации: Общая характеристика галогенов II. Галогены – химические элементы 1. Положение
5. В ряду F – Cl – Br – I а) увеличивается число электронов на внешнем энергетическом уровне б) увеличиваются окислительные свойства элементов в) уменьшается высшая степень окисления элементов г) увеличиваются восстановительные свойства элементов Тест 1. Название «галогены» означает: а) «рождающие кислоты»; в) «рождающие щелочи»; б) «рождающие соли»; г) «рождающие оксиды». 2. В ряду I 2 → Br 2 → Cl 2 → F 2 окислительные свойства а) возрастают; в) не изменяется б) уменьшается г) изменяется периодически a a 3. Какая степень окисления характерна для фтора: а) +1; б) – 1; в) +3; г) – 3. б 6. Реакция иода с порошком алюминия происходит: а) при нагревании в) при добавлении катализатора (воды) б) при низком давлении; г) при высоком давлении в 4. Название какого из данных элементов означает «фиолетовый»: а) фтор; б) хлор; в) бром; г) иод. г г