Первый слайд презентации: Производство иммунобиологических лекарственных препаратов
Выполнила : Салиева М. В, 224 гр Руководитель : Батурлина С. Н
Задачи: 1) Изучить специальную литературу по теме. 2) Рассмотреть особенности производства ИБЛП. 3) Познакомиться с последним этапом производства – испытанием ИБЛП
Биотехнология относится к такой области знаний, где наиболее тесно взаимодействуют достижения науки и промышленное производство. Биотехнологическая промышленность основана на нескольких принципах: брожении (ферментации) биоконверсии – превращении одного вещества в другое генетических манипуляциях и культивировании клеток различного происхождения. Для медицинской биотехнологии, а более конкретно, для получения иммунобиологических препаратов – вакцин, антител, диагностикумов, эубиотиков, бактериофагов – наибольшее значение имеют два последних из указанных выше принципов.
Слайд 4
При получении конечного продукта, будь то вакцина, профилактический бактериофаг или диагностикум, необходимо выполнение схемы производственного процесса, состоящего из нескольких основных стадий. 1) Первая стадия заключается в выборе производственного штамма клеток, который должен быть генетически стабильным и высоко продуктивным. 2) Вторая стадия – это подбор питательной среды для культивирования производственного штамма клеток. Основные требования к среде – адекватность и простота. 3) Третья стадия – культивирование клеток-продуцентов, при этом могут быть использованы традиционные консервативные методы и автоматически управляемые процессы крупномасштабного культивирования с применением биореакторов типа хемо- или турбостатов. 4) Последняя, четвёртая, стадия состоит в выделении целевого конечного продукта, его очистки и концентрации, контроле, превращении в товарную форму. Такие приёмы и методы применяются для старой, традиционной биотехнологии. Так называемая новая, генно-инженерная, биотехнология, напрямую связана с генетическими манипуляциями которые заключаются в обмене генами (рекомбинациями) между двумя разными хромосомами, в результате чего возникают клетки или организмы с двумя или несколькими наследственными генами, по которым партнёры-родители различались между собой.
Производство ИЛП отличается сложностью и многообразием технологических процессов и должно осуществляться в условиях соблюдения надлежащих требований организации производства и контроля качества лекарственных средств. При изменениях производственного процесса, введении нового регламента или способа производства, оказывающих влияние на качество ИЛП и/или стабильность и воспроизводимость процесса, представляются доказательства их пригодности для серийного производства и материалы по валидации.
Слайд 6: Производство и качество
Качество ИЛП обеспечивается следующими основными условиями: 1) в производстве используют только изученные, генетически стабильные производственные штаммы микробов 2) используют адекватные питательные среды, обладающие высокими ростовыми свойствами; 3) используют культуры клеток, в соответствии с рекомендациями ВОЗ, депонированные в официальных коллекциях и разрешенные к использованию для производства ( при культивировании клеток не допускается использование нативной сыворотки крови человека, а также антибиотиков группы пенициллина! ); 4) животные и птицы, используемые для производства ИЛП, получают только из хозяйств, благополучных в отношении бактериальных, вирусных, прионных и др.болезней, опасных для человека; 5) при производстве ИЛП из плазмы и клеток крови и органов человека должны соблюдаться требования, предъявляемые к состоянию здоровья донора;
Слайд 7: Герметизация и наличие вакуума
Герметизацию ампул и флаконов определяют физическим методом. Наличие вакуума в ампулах определяется визуально по цвету свечения газовой среды. Флаконы и ампулы с препаратом помещают в кассету и погружают в емкость, заполненную водой очищенной, подкрашенной раствором метиленовой сини. Емкость закрывают крышкой, создают избыточное давление (0,7 ± 0,05 МПа) и выдерживают 1-3 мин. Затем устанавливают атмосферное давление, емкость открывают, вынимают кассету с образцами и просматривают на наличие во флаконах воды, подкрашенной раствором метиленовой сини. Образцы, содержащие подкрашенную воду, бракуют. При контроле качества герметизации ампул под вакуумом определяющим параметром является давление воздуха в ампулах. Допустимыми величинами являются: Давление порядка 10 Па—1 кПа. Частота электрических колебаний составляет от 20 до 50 кГц Н напряжение - от 15 до 20 кВ.
Слайд 8: Получение вакцин
Получение живых вакцин: Получение убитых вакцин: культивирование вакцинного штамма в производственных условиях (бактерийные штаммы культивируют на питательных средах, вирусные — на куриных эмбрионах или в культурах клеток); очистка вакцинного штамма от балластных веществ (питательной среды, культуры клеток и т. д. ; стандартизация (определение активности, доведение до рабочей концентрации, расфасовка в ампулы); лиофилизация со стабилизатором (альбумин, сахароза с желатиной); контроль : концентрации живых бактерий или вирусов вакцинного штамма, остаточной влажности, безвредности, аллергенности, иммуногенности и др. культивирование вакцинного штамма; инактивация (чаще 0, 4 % формальдегидом при 37— 40 ОС в течение 4 нед); очистка от балластных компонентов; добавление адъюванта ; стандартизация ; лиофилизация ; контроль : остаточной вирулентности, содержание бактерий или вирусов вакцинного штамма, остаточной влажности, стерильности, безвредности, аллергенности, иммуногенности и др. n n
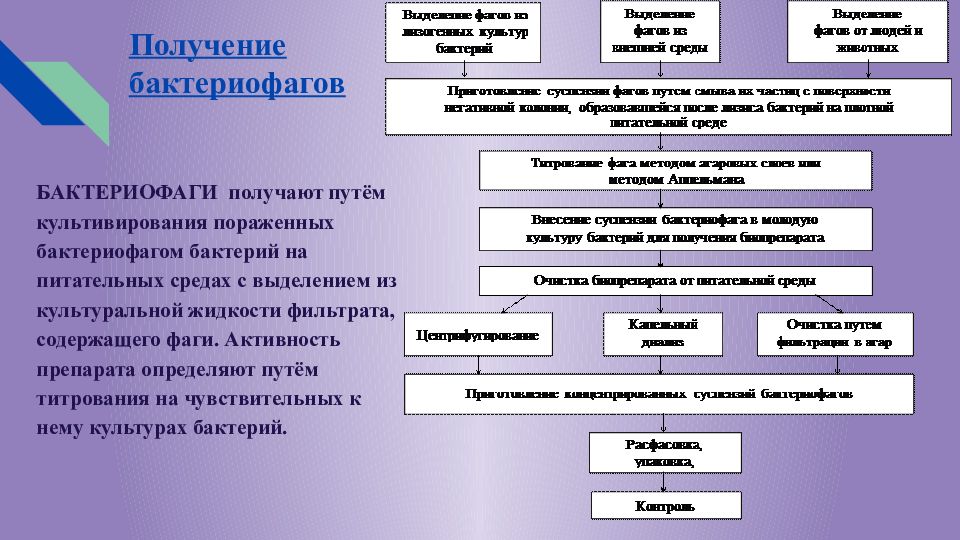
Слайд 12: Получение бактериофагов
БАКТЕРИОФАГИ получают путём культивирования пораженных бактериофагом бактерий на питательных средах с выделением из культуральной жидкости фильтрата, содержащего фаги. Активность препарата определяют путём титрования на чувствительных к нему культурах бактерий.
Слайд 13: Получение аллергенов (А)
Для диагностики и лечения аллергических заболеваний из экзогенных А. готовят препараты, которые также получили название «аллергены». Общий принцип их приготовления: Из сложных по составу продуктов готовят водно-солевые экстракты. Экстрагирующей жидкостью обычно служит раствор хлористого натрия, стабилизированный фосфатным буфером с рН = 7,0 — 7,2 с добавлением 0,4% раствора фенола. А. из простых хим. веществ готовят, разводя их в различных растворителях. Полученные экстракты освобождают от взвешенных частиц фильтрованием или центрифугированием. Далее фильтрат или надосадочную жидкость стерилизуют фильтрованием через фильтр Зейтца. Полученный таким образом фильтрат (аллерген) проверяют на стерильность, безвредность и специфичность. Для проверки на стерильность вносят по 0,5 мл экстракта на различные питательные среды и следят за посевами 8 дней. Стерильный экстракт разливают в инсулиновые флаконы и снова проверяют его на стерильность. Следующий этап — проверка на безвредность, для чего экстракт вводят белым мышам. Если мыши остаются живыми в течение 4 дней, А. считается безвредным. Специфичность проверяют на здоровых и чувствительных к данному А. людях. У здоровых лиц А. должен давать отрицательную кожную пробу, а у больных — положительную