Первый слайд презентации: Растворы
Лекция №1 для студентов 1 курса, обучающихся по специальности 060609.65-Медицинская кибернетика Лектор: ст. преподаватель кафедры биохимии Руковец Татьяна Анатольевна 1 2014 Растворы
Слайд 2: Цель лекции
Познакомиться с основными понятиями тем: «Растворы», «Равновесия в растворах слабых электролитов», «Кислоты и основания Аррениуса и Бренстеда» Рассмотреть гидролиз солей как один из видов протолитического равновесия. Научиться рассчитывать рН растворов кислот, оснований и солей.
Слайд 3: Актуальность
Растворы очень широко распространены в природе. Растворами являются все ткани живого организма. Питьевая вода, вода рек, морей и океанов – это тоже растворы. Свойства растворов определяются природой растворенных веществ, их составом и концентрацией. Актуальность
Слайд 4: Актуальность
Многие реакции (протолитические, окислительно-восстановительные, комплексообразования) протекают зачастую в водных растворах. Знание свойств водных растворов позволяет понять механизмы осмотического и протолитического гомеостаза (постоянства состава), причины нарушения осмотической и протолитической регуляции и способы их корректировки. Актуальность
Слайд 5: План
Понятие и классификация растворов. Ионизация воды, ионное произведение, водородный показатель. Реакция среды. Диссоциация кислот и оснований Аррениуса (электролитическая теория кислот и оснований ). Состав слюны. 5 План
Слайд 6: План
Расчёт рН водных растворов кислот и оснований; Индикаторы. Кислоты и основания Бренстеда (протолитическая теория), показатели рК а и рК b. Гидролиз солей, Расчёт рН их растворов. 6 План
Слайд 7: Понятие «растворы»
Растворы - это гомогенные (однородные) системы, состоящие из двух и более компонентов. 7
Слайд 8
Растворитель - вещество, которое не меняет своего агрегатного состояния при растворении. Обычно, растворитель – это просто преобладающий компонент раствора. 8
Слайд 9
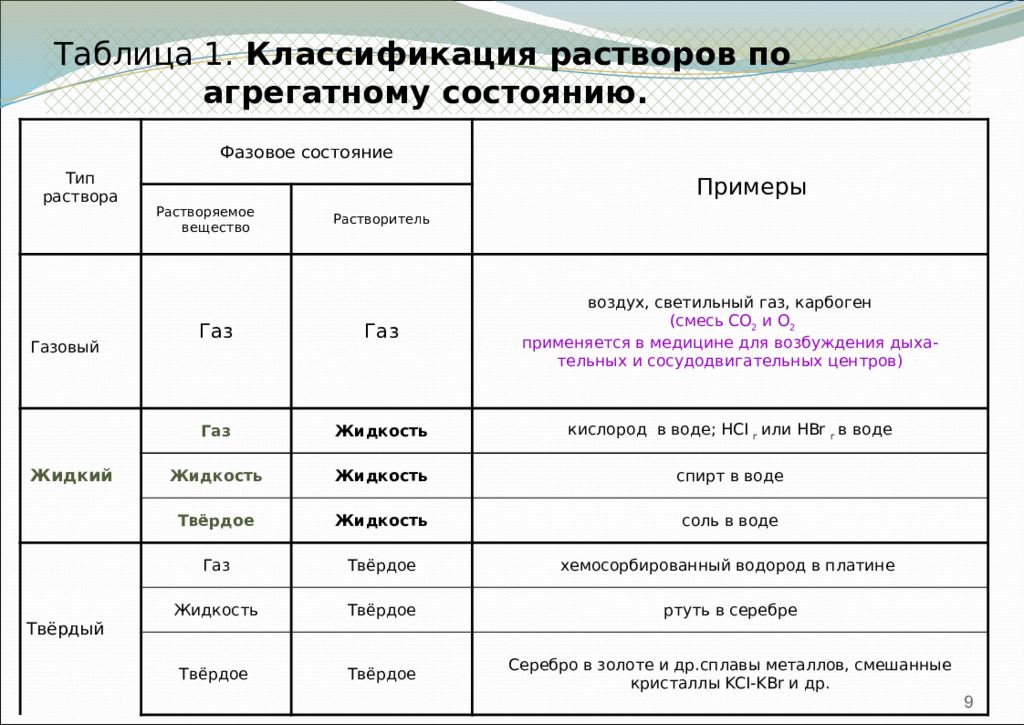
9 Таблица 1. Классификация растворов по агрегатному состоянию. Тип раствора Фазовое состояние Примеры Растворяемое вещество Растворитель Газовый Газ Газ воздух, светильный газ, карбоген (смесь СО 2 и О 2 применяется в медицине для возбуждения дыха- тельных и сосудодвигательных центров) Жидкий Газ Жидкость кислород в воде; НС I г или HBr г в воде Жидкость Жидкость спирт в воде Твёрдое Жидкость соль в воде Твёрдый Газ Твёрдое хемосорбированный водород в платине Жидкость Твёрдое ртуть в серебре Твёрдое Твёрдое Серебро в золоте и др.сплавы металлов, смешанные кристаллы KCI - KBr и др.
Слайд 10: Жидкие растворы
вода морей и океанов, и даже водопроводная вода; биологические жидкости с растворенными в них низкомолекулярными и высокомолекулярными веществами: кровь, лимфа; моча; спинномозговая жидкость; пот; желудочный и кишечный соки; слюна; желчь; цитозоль ; матрикс митохондрий. 10 Жидкие растворы
Истинные растворы (размер частиц 10 -10 – 10 -9 м) Коллоидные растворы (размер частиц 10 -9 – 10 -6 м) Растворы ВМС 11
Слайд 12
Истинные растворы - растворы, где частицы растворенного вещества находятся в воде или другом растворителе в виде молекул, атомов или ионов. Это растворы низкомолекулярных соединений (НМС). Примеры НМС: соли, кислоты, щелочи.
Слайд 13
Коллоидные растворы – это растворы, относящиеся к дисперсным системам, где частицы дисперсной фазы находятся в дисперсионной среде в виде мицелл, размеры которых превышают молекулярные. 13 Мицелла коллоидного раствора
Слайд 14
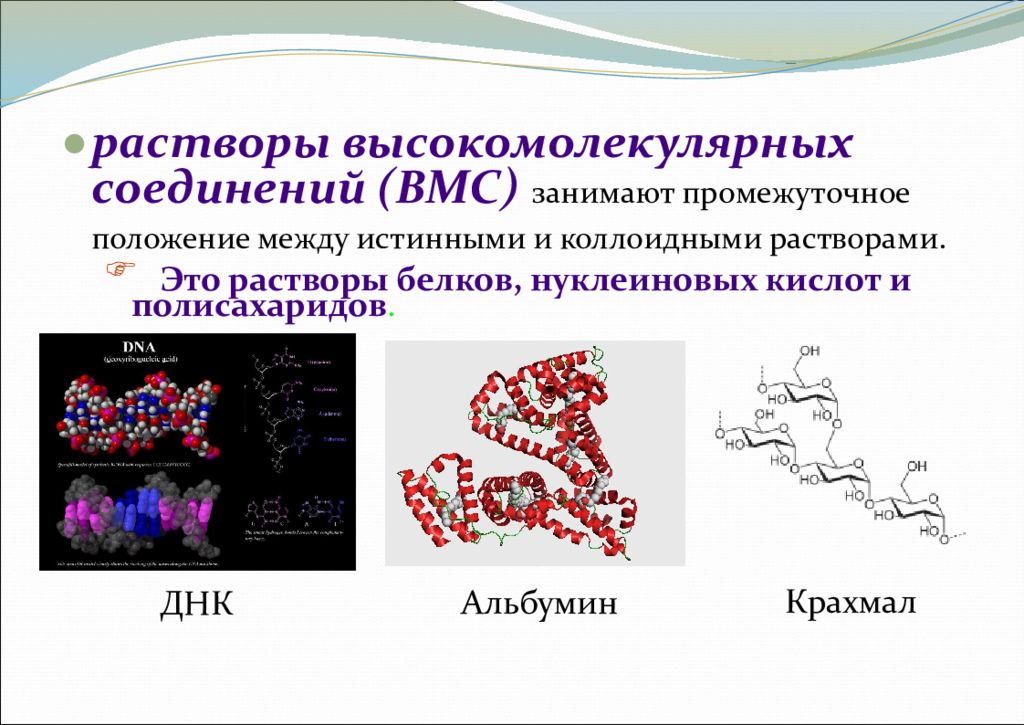
растворы высокомолекулярных соединений (ВМС) занимают промежуточное положение между истинными и коллоидными растворами. Это растворы белков, нуклеиновых кислот и полисахаридов. ДНК Альбумин Крахмал
Слайд 15: Ионизация воды. Водородный показатель рН
Вода – слабый электролит. Уравнение диссоциации воды: HOH + HOH ⇆ НО ⁻ + Н 3 О 15 + Катион гидроксония ⇨ Н Н Н О + Гидратированный протон водорода HOH ⇆ НО ⁻ + Н + (1) К р = К д (НОН) = = const при данной t 0 (2) [Н ] · [ НО⁻ ] + [ НОН ] при 25 0 С К д (НОН) = 1,8 · 10 -16 Ионизация воды. Водородный показатель рН.
Слайд 16
16 [НОН] = С М (НОН) = = = 55,6 моль/л m ( НОН) М (НОН). V л 1000 18 1 Сгруппируем постоянные величины в уравнении (2) и обозначим их произведение – К w : К w = К д (НОН) · [НОН] = [ H + ]·[ H О⁻] = =1,8·10 -16 · 55,6 ≈ 10 -14 при 25 0 С (3) ионное произведение воды И онное произведение воды К w – есть величина постоянная при данной температуре. # С увеличением температуры К w тоже увеличивается. Постоянство ионного произведения [ H + ][ H О - ] характерно не только для чистой воды, но и для любых водных растворов. Далее, молярная концентрация молекул воды – тоже const
Слайд 17
17 Роль К w : зная К w и концентрацию одного из ионов воды, можно всегда найти концентрацию другого иона : [ HO ⁻] = = ( при t 0 =25 0 С) (4) 10 -14 [H + ] К w [H + ] Для чистой воды: [ H + ] = [ HO ⁻] среда нейтральная [ H + ] = 10 -7 моль/л
Слайд 18
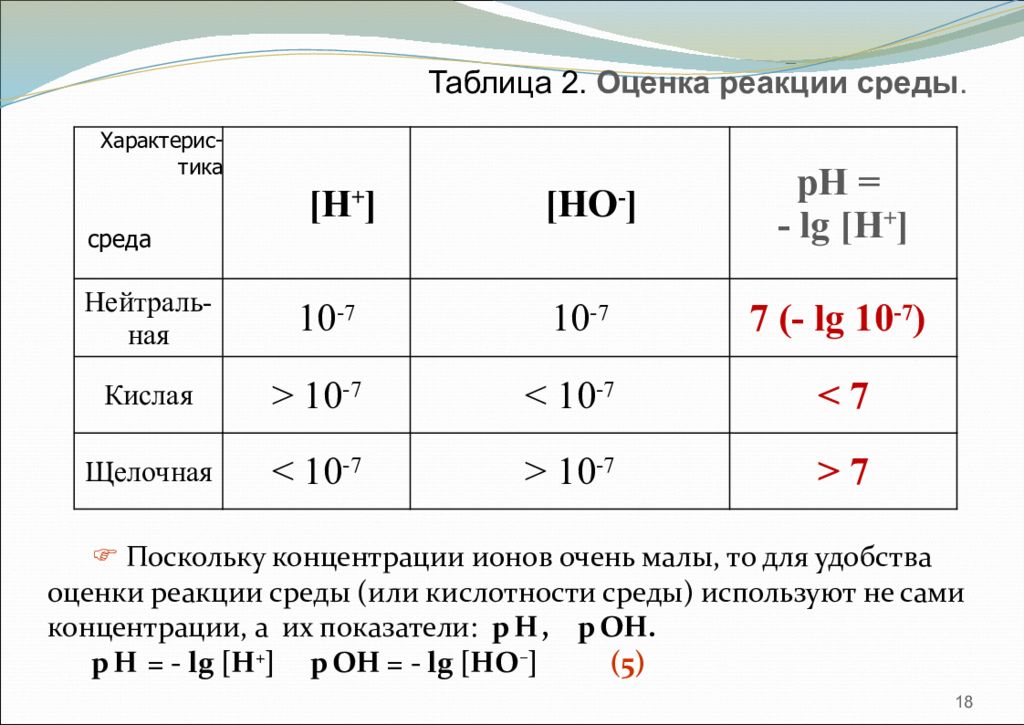
18 Таблица 2. Оценка реакции среды. [H + ] [H О - ] pH = - lg [H + ] Нейтраль-ная 10 -7 10 -7 7 (- lg 10 -7 ) Кислая > 10 -7 < 10 -7 < 7 Щелочная < 10 -7 > 10 -7 > 7 среда Характерис- тика Поскольку концентрации ионов очень малы, то для удобства оценки реакции среды (или кислотности среды) используют не сами концентрации, а их показатели: р Н, р ОН. pH = - lg [H + ] p OH = - lg [HO – ] (5)
Слайд 19
19 # На практике больше используется показатель рН, чем рОН. Чем сильнее кислотность среды (больше [ H + ]), тем меньше будет рН. И, наоборот, с ростом рН кислотность ослабевает, но растёт щелочность среды. среда слабокислая среда слабощелочная [ H + ] ___ |____|____|____|____|____|____|____|___ 10 -4 10 -5 10 -6 10 -7 10 -8 10 -9 10 -10 среда нейтральная кислотность увеличивается среда слабокислая среда слабощелочная рН ___|____|____|____|____|____|____|____|___ 4 5 6 7 8 9 10 11 нейтральная среда
Слайд 20
20 Далее, выражение для ионного произведения воды (3) переведём в логарифмическую шкалу. Для этого прологарифмируем (3) с отрицательным знаком: - lg [ H + ]·[ HO – ] = - lg 10 -14 - lg [ H + ] - lg [ HO – ] = -(-14); откуда рН рОН рН + рОН = 14 при t 0 =25 0 С (6) рН = 14 – р ОН, р ОН = 14 – рН
Слайд 21: рН биологических жидкостей
колеблется в зоне 1÷9 рН желудочного сока 1; рН кишечного сока 9 рН крови 7,36 (7,25 ÷7,44) рН мочи 4,8 ÷7,5 (из крови сбрасываются лишние кислоты или основания) рН пищевых продуктов 3÷ 6 (в большинстве случаев; только молоко щелочнее этой среды ). 21 рН биологических жидкостей
Слайд 22
рН среды, оптимальное для развития патогенных для человека бактерий практически совпадает с рН плазмы крови: рН для стрептококков и менингококков 7,4 ÷7,6 рН для стафилококков 7,4 рН для пневмококков 7,0 ÷ 7,4 22 Для измерения рН среды используются индикаторы кислотно-основного типа или рН-метры.
Слайд 23: СЛЮНА
pH от 5,6 до 7,6. На 98,5 % и более состоит из воды, Слюна содержит : соли различных кислот микроэлементы и катионы некоторых щелочных металлов муцин (формирует и склеивает пищевой комок) лизоцим (бактерицидный агент) ферменты амилазу и мальтазу, расщепляющие углеводы до олиго- и моносахаридов, а также другие ферменты, некоторые витамины.
Слайд 24: СЛЮНА
Величина рН слюны изменяется в зависимости от характера патологического процесса в полости рта. При инфекционных заболеваниях реакция слюны кислая. При ряде общих заболеваний, например, при нефрите, сопровождающемся уремией, в слюне возрастает количество остаточного азота (среда щелочная) содержание азота увеличивается также при язвенной болезни желудка и двенадцатиперстной кишки. !!! Исследование состава слюны можно предпринимать с диагностической целью.
Слайд 25: Состав слюны
Вещество Содержание Вода 994 г/л Белки 1,4—6,4 г/л Муцин 0,9—6,0 г/л Холестерин 0,02—0,50 г/л Глюкоза 0,1—0,3 г/л Аммоний 0,01—0,12 г/л Мочевая кислота 0,005—0,030 г/л Соли натрия 6—23 ммоль/л Соли калия 14—41 ммоль/л Соли кальция 1,2—2,7 ммоль/л Соли магния 0,1—0,5 ммоль/л Хлориды 5—31 ммоль/л Гидрокарбонаты 2—13 ммоль/л Мочевина 140—750 ммоль/л
Слайд 26: Ионизация кислот
По теории Аррениуса: кислоты – это молекулы или ионы, которые при растворении в воде освобождают Н + НА + НОН ⇆ А – + Н 3 О +, (7) где НА – кислота в общем виде, А – - кислотный остаток. Упрощённо (без учёта гидратации): НА ⇆ А – + Н + (8) ! Вероятность нахождения Н + в свободном виде чрезвычайно мала 26 Ионизация кислот
Слайд 27: константа кислотности К а
27 константа кислотности К а К р = К а (НА) = = const при данной t 0. (9) [А – ]·[Н + ] [НА ] где К а (НА) – константа ионизации кислоты НА, или константа кислотности НА, которая характеризует силу кислоты: с увеличением К а кислотность НА растёт. рК а = - lg К а (10) Отсюда, чем больше К а и меньше рК а, тем сильнее кислота. # Для сильных кислот рК а < 0, для слабых кислот рК а > 0
Слайд 28: Физический смысл К а и рК а
Обратимся к реакции ионизации кислоты (8). Положение равновесия этой реакции зависит от кислотности среды. В кислой среде равновесие (8) будет смещено влево, в сторону молекулярных форм, а в щелочной среде – вправо, в сторону ионных форм. Очевидно, найдётся такая среда, в которой кислота окажется ионизированной на 50%, т.е. [ HA ] = [ A – ]. При этом условии константа равновесия примет значение: 28 Физический смысл К а и рК а
Слайд 29
29 К р = К а = [ H + ] а её логарифмирование с отрицательным знаком даст: - lg K а = - lg [ H + ] рК а = рН ׀ преобладают рКа преобладают молекулярные 50/50 ионные формы формы рН Таким образом, рК а – это есть рН среды, при которой кислота ионизируется на 50%. Для каждой кислоты существует своё значение рК а в зависимости от её строения.
Слайд 30: Ионизация оснований
По теории Аррениуса: Основания – это молекулы или ионы, которые при растворении в воде освобождают ОН – Рассмотрим основания, дающие при ионизации одну ОН-группу : Э – ОН ⇆ Э + + ОН – (11) К р = К b = = const при данной t рК b = - lg К b (12) 30 [Э + ] [НО – ] [ Э – ОН ] Ионизация оснований
Слайд 31: Физический смысл рК b
# Физический смысл рК b для оснований устанавливают также как рК а для кислот: рК b – это рОН – среды, при котором основание ионизируется на 50%. Для каждого основания существует своё значение рК b, зависящее от его строения. 31 Физический смысл рК b
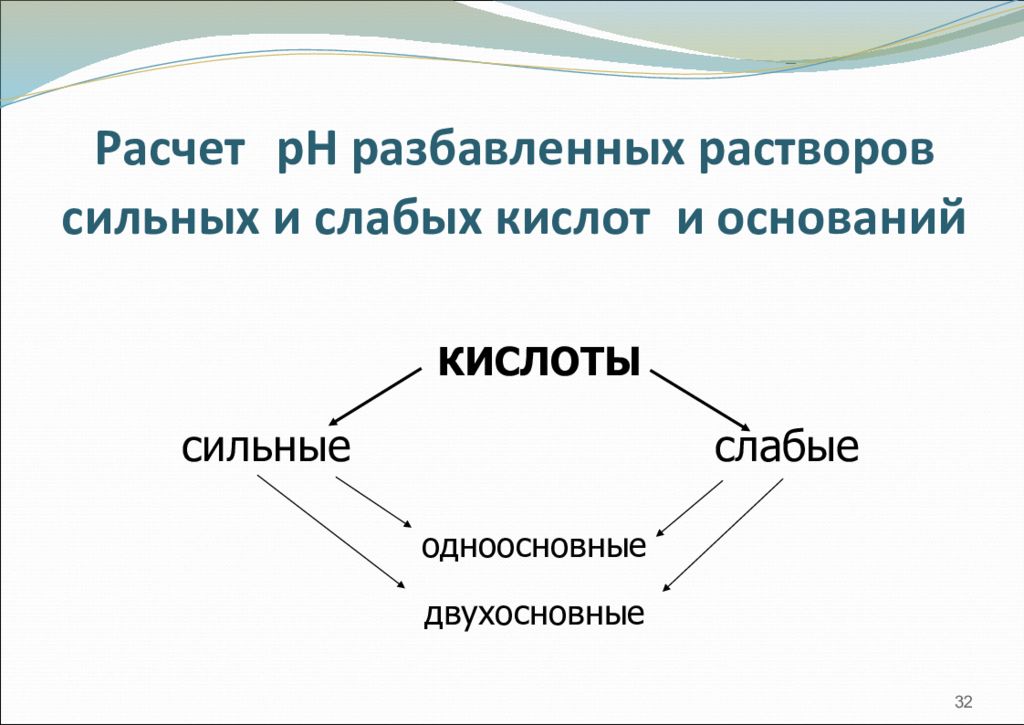
Слайд 32: Расчет рН разбавленных растворов сильных и слабых кислот и оснований
32 КИСЛОТЫ сильные слабые одноосновные двухосновные Расчет рН разбавленных растворов сильных и слабых кислот и оснований
Слайд 33
33 рН растворов сильных кислот ( HCl, HNO 3, HClO 4, H 2 SO 4 и др.) рН ( сильн.к-ты ) = - lg [ H + ] = - lgC э (НА) = рС э ( сильн.к-ты ) (НА) (1 3 ) кислотность среды для растворов сильных кислот определяется показателем их эквивалентной концентрации: рН сильн. к-ты = рС э (сильн. к-ты)
Слайд 34
34 рН растворов сильных оснований (КОН, NaOH и др.) рОН ( сильн.осн.) = - lg [О H - ] = - lgC э ( осн ) = рС э ( сильн.осн ) (1 3 ) рН сильн. осн. = 14 - рС э (сильн. осн.)
Слайд 35
35 рН растворов слабых кислот ( CH 3 COOH, HCN, HNO 2, H 2 SO 3, H 2 CO 3 и др.) 1. Слабые одноосновные кислоты диссоциируют обратимо: НА ⇆ Н + + А - (14) pH слабой кислоты = p + pC М ( HA ) - степень диссоциации (показывает долю ионизированных молекул). рН слаб. к-ты = = (15) - lgK a - lgC м 2 р K a + р C м 2
Слайд 36
36 Расчет рОН растворов слабых оснований 1) через α : рОН слаб.осн. = р α + рС м(осн.) (16) где α – степень ионизации рН = 14 – (р + рС М(основ) ) (17) 2) через К b : рН слаб. основ. = 14 – рОН = 14 – (18) рК b + рС м 2
Слайд 37: Кислотно-основные индикаторы
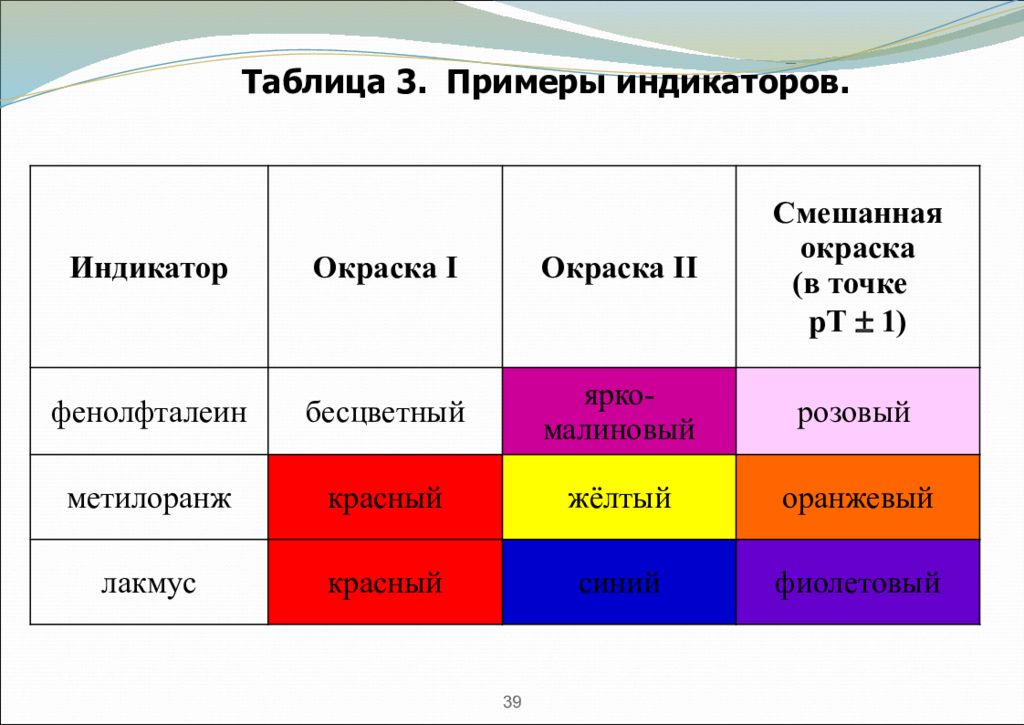
В качестве индикаторов для определения рН растворов используют слабые органические кислоты и основания, у которых молекулярная и ионная формы отличаются по цвету (см. табл. 3) 37 Кислотно-основные индикаторы
Слайд 38
рН среды, при котором индикатор ионизирован на 50% и цвет раствора смешанный, называется точкой перехода цвета индикатора рТ. рТ (инд.) = рК а (инд.) = - lg К а (инд.) - это силовая характеристика индикатора. рТ ± 1 - это зона перехода цвета индикатора. Ведь наш глаз замечает смешанный цвет не только при условии равенства концентраций молекулярных и ионных форм индикатора, но и когда концентрация одной из форм преобладает над другой в 10 раз ( lg 10 = 1). HInd ↔ Ind - + H + 38 смесь форм переходная окраска (ΔрН = pKa ± 1) нейтральная форма окраска 1 (при рН < pKa – 1) заряженная форма окраска 2 (при рН > pKa + 1)
Слайд 39
39 Таблица 3. Примеры индикаторов. Индикатор Окраска I Окраска II Смешанная окраска (в точке рТ 1) фенолфталеин бесцветный ярко-малиновый розовый метилоранж красный жёлтый оранжевый лакмус красный синий фиолетовый
Слайд 40: Протолитическая теория кислот и оснований Кислоты и основания Бренстеда
Кислоты Бренстеда – это нейтральные молекулы или ионы, способные отдавать протон водорода ( доноры Н + ). Основания Бренстеда – это нейтральные молекулы или ионы, способные принимать протон водорода ( акцепторы Н + ). 40 Протолитическая теория кислот и оснований Кислоты и основания Бренстеда
Слайд 41
41 # Существенно, что основность, с точки зрения протолитической теории, проявляется только в присутствии кислоты, а кислотность – в присутствии основания : В + АН ⇆ + ВН + А⁻ (21) .. Осн. К-та К-та Осн. 1 1 2 2 Сопряжённая кислотно-основная пара – это две формы одного и того же соединения, отличающиеся на один Н +. Записывается сопряжённая пара так: кислота / основание. В данном случае + ВН/ В и АН/А⁻ - две сопряжённые кислотно-основные пары в одной реакции ..
Слайд 42
Кислотно-основное взаимодействие — это перенос Н + с кислоты на основание, с образованием новой кислоты и нового основания, сопряжённых исходным. !!! Сильной кислоте соответствует слабое сопряжённое основание, и наоборот. 42
Слайд 43
43 Почти в любой сопряжённой кислотно-основной паре один из компонентов сильный, другой слабый: Н 3 О + / Н 2 О НОН / НО ¯ .. Сильная кислота Слабое основан. Слабая кислота Сильное основан. Кислотность по Бренстеду считается сильной, если рКа < 2 и слабой, если рКа > 11. Тогда основность, наоборот, считается слабой при рКа < 2 и сильной при рКа > 11
Слайд 44
Силовая характеристика кислотно-основных свойств рК а - показатель кислотности, характеризующий оба компонента этой пары: чем меньше рК а, тем сильнее кислотность и слабее основность в данной сопряжённой паре. Так, рК а (Н 3 О + / Н 2 О) = -1,7 В этой паре очень сильная кислотность (Н 3 О + ) и очень слабая основность (Н 2 О). 44 ..
Слайд 45: Гидролиз солей
– это реакция обменного разложения между солью и водой. Гидролиз солей – это реакция взаимодействия ионов слабого электролита, входящего в состав соли, с водой, в результате которой получается слабый электролит. Гидролиз соли – это слабое кислотно-основное взаимодействие ионов соли с водой, приводящее к разрушению не только соли, но и воды. 45 Гидролиз солей
Слайд 46: Таблица 4. Примеры солей, подвергающихся гидролизу:
KtA * сильн.- слаб. KtA слаб.- сильн. KtA слаб.- слаб. NaCH 3 COO ацетат натрия Na 2 C 2 O 4 оксалат натрия Na 2 CO 3 карбонат натрия Na 3 PO 4 фосфат натрия NaH 2 PO 4 дигидрофосфат натрия Na 2 HPO 4 гидрофосфат натрия KCN цианид калия и др. NH 4 Cl хлорид аммония Al Cl 3 хлорид алюминия Fe Cl 3 хлорид железа Zn Cl 2 хлорид цинка Zn SO 4 сульфат цинка ( NH 4 ) 2 SO 4 сульфат аммония и др. NH 4 CH 3 COO ацетат аммония ( NH 4 ) 2 CO 3 карбонат аммония ( NH 4 ) 3 PO 4 фосфат аммония Al PO 4 фосфат алюминия и др. 46 * Обозначение: Kt – катионная часть соли; A – анионная часть соли. Таблица 4. Примеры солей, подвергающихся гидролизу:
Слайд 47: Расчет рН растворов солей
Для солей, гидролизующихся по аниону (рН > 7) рН = 7 + Для солей, гидролизующихся по катиону (рН < 7) рН = 7 - Для солей, гидролизующихся по катиону и аниону (рН ≈ 7) рН = 7 +
Слайд 48
Степень гидролиза – это отношение числа гидролизованных молекул соли к общему числу растворённых молекул (выражается в долях к единице или в процентах). от природы соли (характеристики рК а и рК b ). от температуры (повышается t 0 - растёт гидролиз, так как гидролиз – это эндотермический процесс); от концентрации (чем меньше концентрация соли, тем лучше идёт гидролиз); от рН среды: кислоты и щёлочи будут усиливать определённый тип гидролиза (соответственно, по аниону или катиону, а также по обоим ионам). 48 Степень гидролиза α зависит:
Слайд 49: Литература
Основная: Слесарев В.И. – Химия: Основы химии живого: Учебник для вузов. – 3-е изд., испр. – СПб: Химиздат. – 2007. – 784с Дополнительная: Пузаков С.А. – Химия: Учебник, 2-е изд. испр. и доп. М.: ГЭОТАР-Медиа Медицина, - 2006. – 624 с Артеменко А.И. – Справочное руководство по химии. – М.: Высшая школа, 2003 49