Первый слайд презентации
Лекция 2 Теория растворов Рассматриваемые вопросы: 1.Определение рН слабой кислоты. 2.Определение рН слабого основания. 3. Произведение растворимости. 4.Определение рН сильных электролитов. 5.Гидролиз солей. Определение рН в растворе гидролизующихся солей. 6. Буферные растворы. Типы буферных систем. 7. Определение рН буферных растворов. 8. Механизм действия буферного раствора. 9. Буферная емкость. 10 Влияние разбавление на рН буферного раствора. 11. Медико-биологическое значение буферных растворов.
Слайд 2
Повтор... Водородный показатель: рН = -lg (a H+ ) или рОН = -lg [H + ] Гидроксильный показатель: рОН = -lg (a ОH- ) или рОН = -lg [ОH - ] рН + рОН = 14 для любого водного раствора
Слайд 3
HNO 2 ↔ H + + NO 2 - при tº = const т.к. [H + ] = [NO 2 - ], то [H + ] 2 ; т.к. в слабых электролитах α < 0,03, то [HNO 2 ] ≈ С М (HNO 2 ); Тогда a pH = -lg [H + ] Определение рН слабой кислоты:
Слайд 4
Например, определите рН 0,02М раствора азотистой кислоты, если Кд= 4,3 ∙10 -4. 1. Записываем ур-е процесса диссоциации: HNO 2 ↔ H + + NO 2 - при tº = const 2. Определяем средообразующие ионы: Н + 3. Находим концентрацию средообразующих ионов: [H + ] = √4,3∙10 -4 ∙2∙10 -2 = 2,93∙10 -3 М 5. От этой концентрации берем -lg: p Н = -lg[H + ] = 2,53 Определение рН слабой кислоты:
Слайд 5
NH 4 ОН ↔ NH 4 + + OH - при tº = const Определение рН слабого основания: т.к. [NH 4 + ] = [OH - ], то [OH - ] 2 и [NH 4 OH] ≈ С М (NH 4 OH); Тогда А pОН = -lg[OH - ] и pH = 14 - pOH
Слайд 6
Определение рН слабого основания: Например, определите рН 0,5М раствора гидроксида аммония, если Кд(NH 4 OH) = 1,8∙10 -5. 1. Записываем ур-е процесса диссоциации: NH 4 ОН ↔ NH 4 + + OH - 2. Определяем средообразующие ионы: ОН - 3. Находим концентрацию средообразующих ионов: [OH - ] = √1,8∙10 -5 ∙5∙10 -1 = 3∙10 -3 M 4. От этой концентрации берем -lg p ОН = -lg[OH - ] = 2,52 5. Находим р Н : pH = 14 — pOH = 11,48
Слайд 7
Произведение растворимости: Произведение растворимости (ПР) — это произведение равновесных концентраций ионов электролита в НАСЫЩЕННОМ растворе, взятых в степенях их стехиометрических коэффициентов. PbI 2 (тв) ↔ Pb 2+ (раств) + 2I - (раств) при t º = const В насыщенном растворе электролита произведение концентраций его ионов, взятых в степенях их стехиометрических коэффициентов, есть величина постоянная при данной температуре.
Слайд 8
Произведение растворимости: Как определить РАСТВОРИМОСТЬ труднорастворимого электролита, зная его ПР? PbI 2 (тв) ↔ Pb 2+ (раств) + 2I - (раств) х моль х моль 2х моль или x = [Pb 2+ (раств) ] = [PbI 2 (раств) ] = S (PbI 2 (раств) ) S — растворимость вещества при данной t º.
Слайд 9
Условия выпадения и растворения осадков: Если в некотором произвольном растворе произведение концентраций (ПК) ионов меньше, чем произведение растворимости (ПР) при данной t º, осадок не образуется. Если больше или равно — образуется. Например, образуется ли осадок при сливании равных объемов 0,002 М растворов Pb(NO 3 ) 2 и KI? Pb(NO 3 ) 2 + 2KI → PbI 2 ↓ + 2KNO 3 0,002 моль 0,002 моль После разбавления в 2 раза 0,001 моль 0,001 моль Определяем ПК: ПК = [Pb 2+ ] ∙[I - ] 2 = 10 -3 ∙(10 -3 ) 2 = 10 -9 10 -9 < 8,6·10 -9 ПК < ПР Следовательно, осадок не образуется.
Слайд 10
Определение рН сильных электролитов: Для сильных электролитов активность средообразующих ионов равна активности самого электролита. 1. Записываем диссоциацию электролита. 2. Определяем средообразующие ионы. 3. Для сильных кислот а н+ = f a ·C M (кислоты) Для сильных оснований (щелочей) а Он- = f a ·C M (основания) 4. Берем -lg от этой величины и находим соответствующий показатель: рН или рОН. 5. Для определения рН щелочи производим еще одно действие: рН = 14 - рОН
Слайд 11
Оределение рН слабого электролита через α : 1. Записываем диссоциацию электролита. 2. Определяем средообразующие ионы. 3. Через α концентрацию средообразующих ионов можно рассчитать так: Или 4. Берем -lg от этой величины и находим соответствующий показатель: рОН или рН. 5. Для определения рН основания производим еще одно действие: РН = 14 - рОН
Слайд 12
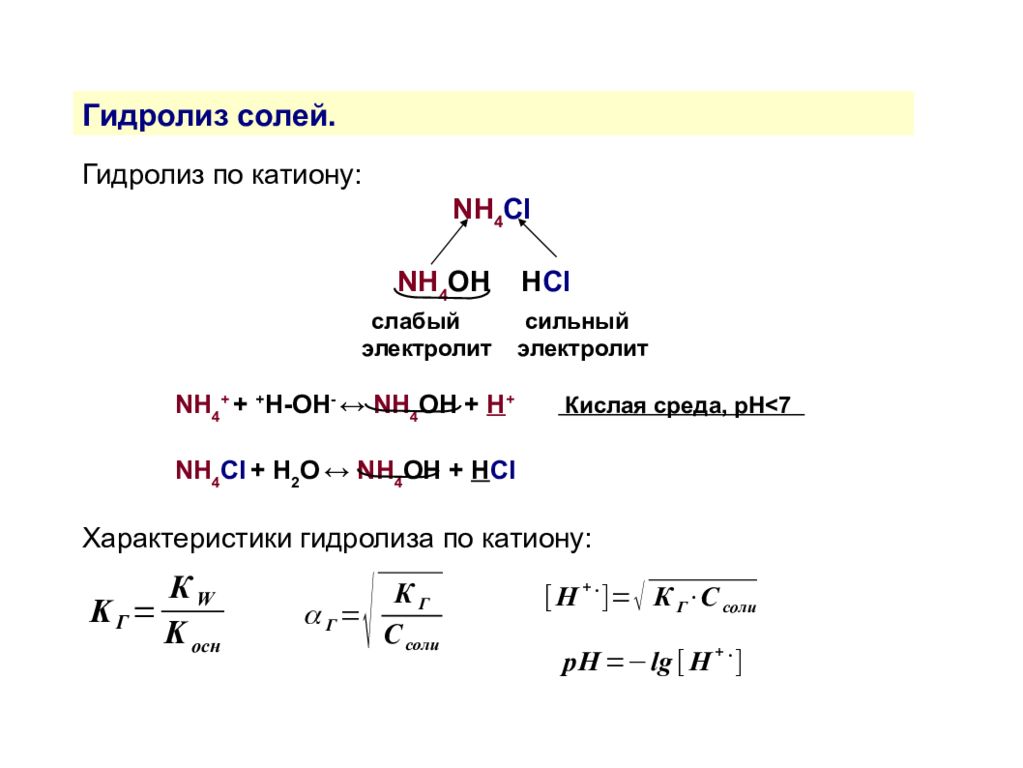
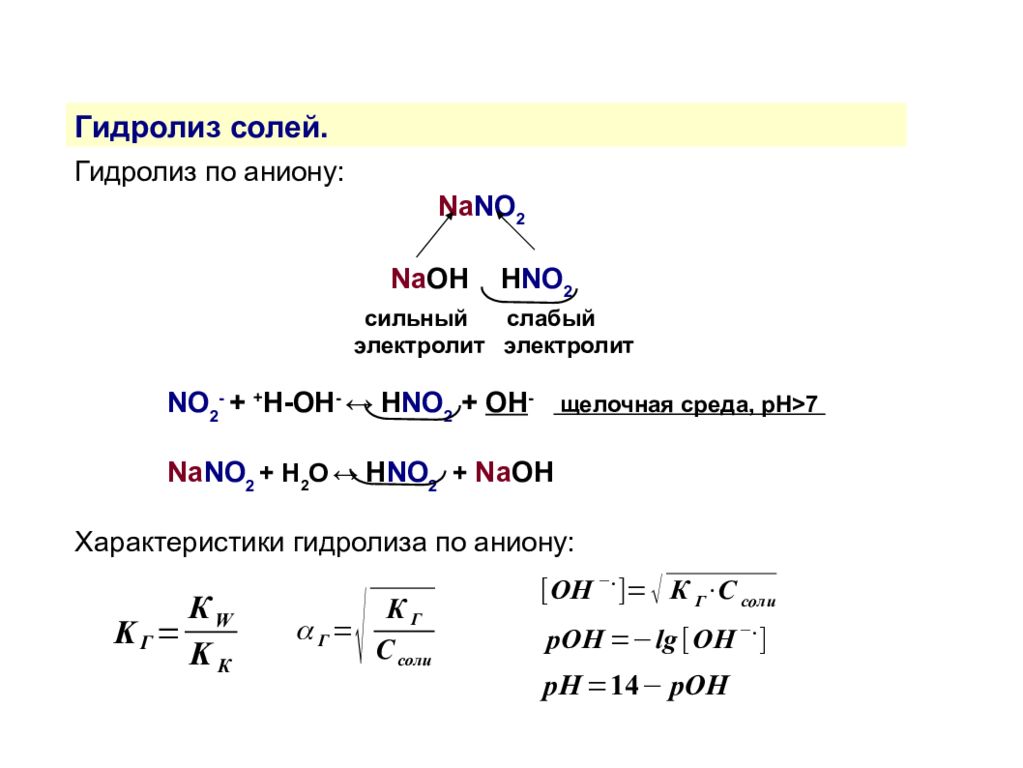
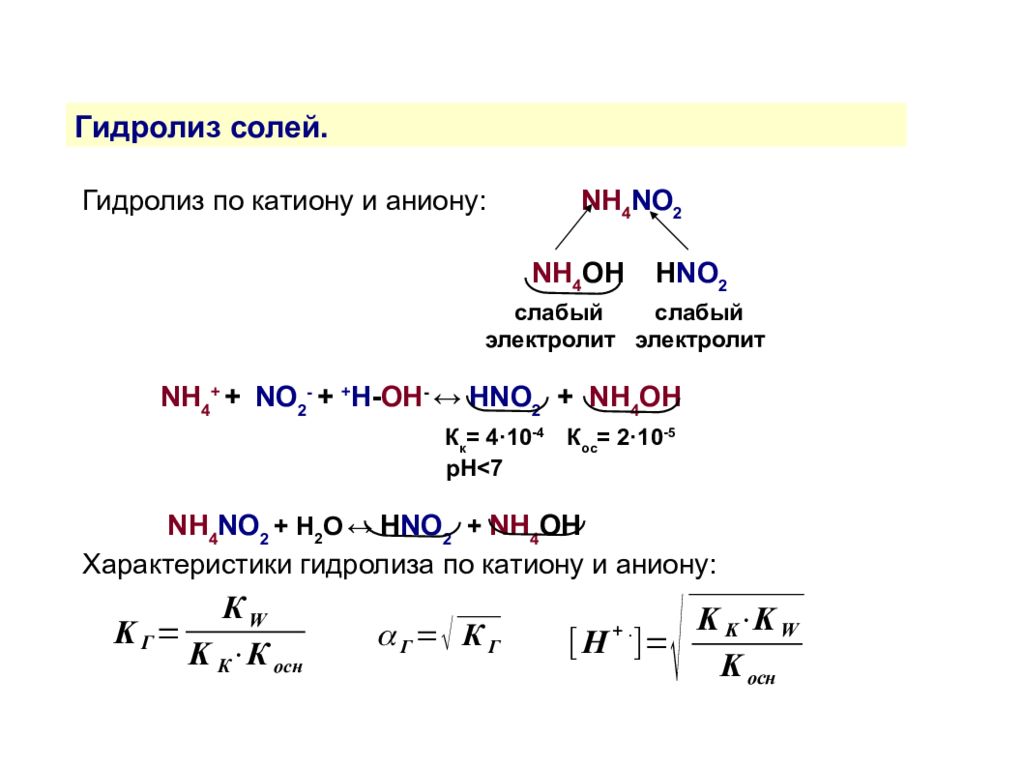
Гидролиз солей. Гидролиз — это взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Типы гидролиза По катиону По аниону По катиону и аниону Соль образована слабым основанием и сильной кислотой Соль образована сильным основанием и слабой кислотой Соль образована слабыми основанием и кислотой NH 4 Cl, Zn(NO 3 ) 2, AlBr 3 NaNO 2, (CH 3 COO) 2 Ca NH 4 NO 2, (CH 3 COO) 2 Zn
Слайд 13
Гидролиз солей. Гидролиз по катиону: NH 4 Cl NH 4 OH H Сl слабый сильный электролит электролит NH 4 + + + H-OH - ↔ NH 4 OH + H + Кислая среда, рН<7 NH 4 Сl + H 2 O ↔ NH 4 OH + H Сl Характеристики гидролиза по катиону:
Слайд 14
Гидролиз солей. Гидролиз по аниону: Na NO 2 Na OH H NO 2 сильный слабый электролит электролит NO 2 - + + H-OH - ↔ H NO 2 + OH - щелочная среда, рН>7 Na NO 2 + H 2 O ↔ H NO 2 + Na OH Характеристики гидролиза по аниону:
Слайд 15
Гидролиз солей. Гидролиз по катиону и аниону: NH 4 NO 2 NH 4 OH H NO 2 слабый слабый электролит электролит NH 4 + + NO 2 - + + H - OH - ↔ HNO 2 + NH 4 OH К к = 4·10 -4 К ос = 2·10 -5 рН<7 NH 4 NO 2 + H 2 O ↔ H NO 2 + NH 4 OH Характеристики гидролиза по катиону и аниону:
Слайд 16
Гидролиз солей. Гидролиз солей многоосновных кислот происходит ступенчато: Na 3 PO 4 Na OH H 3 PO 4 PO 4 3- + H-OH ↔ HPO 4 2- + OH - 1 ступень HPO 4 2- + H-OH ↔ H 2 PO 4 - + OH - 2 ступень H 2 PO 4 - +H-OH ↔ H 3 PO 4 + OH - 3 ступень Гидролиз — обратный процесс диссоциации. Для определения К г используем ту из констант диссоциации слабого электролита, которая соответствует гидролизующейся частице: 1) H 3 PO 4 ↔ H + + H 2 PO 4 -, К I = 7,1∙10 -3 2) H 2 PO 4 - ↔ H + + HPO 4 2-, К II = 6,2∙10 -8 3) HPO 4 2- ↔ H + + PO 4 3-, К III = 5,0∙10 -13 К III = 5,0∙10 -13 К II = 6,2∙10 -8 К I = 7,1∙10 -3
Слайд 17
Гидролиз солей. Соли, образованные сильными электролитами, гидролизу не подвергаются. рН в растворах таких солей равен 7. Na NO 3 + H - OH ↔
Слайд 18
Гидролиз солей. Соли, образованные нерастворимыми основаниями и слабыми летучими кислотами, гидролизуются необратимо: Al 2 S 3 Al(OH) 3 ↓ H 2 S ↑ слабый слабый электролит электролит 2 Al 3 + + 3 S 2 - + 6 H - OH - ↔ 2 Al(OH) 3 ↓ + 3 H 2 S↑
Слайд 19
Буферные растворы. Буферные растворы — это растворы, поддерживающие определенное значение рН при разбавлении, концентрировании или добавлении небольших количество сильных кислот или щелочей. Типы буферных растворов кислые щелочные cмеси кислых солей cлабая кислота + соль этой кислоты и сильного основания cлабое основание + соль этого основания и сильной кислоты cмеси солей слабой многоосновной кислоты и сильного основания Примеры: Ацетатный буфер Аммиачный буфер Фосфатный буфер CH 3 COOH + CH 3 COONa NH 4 OH + NH 4 Cl NaH 2 PO 4 + Na 2 HPO 4
Слайд 20
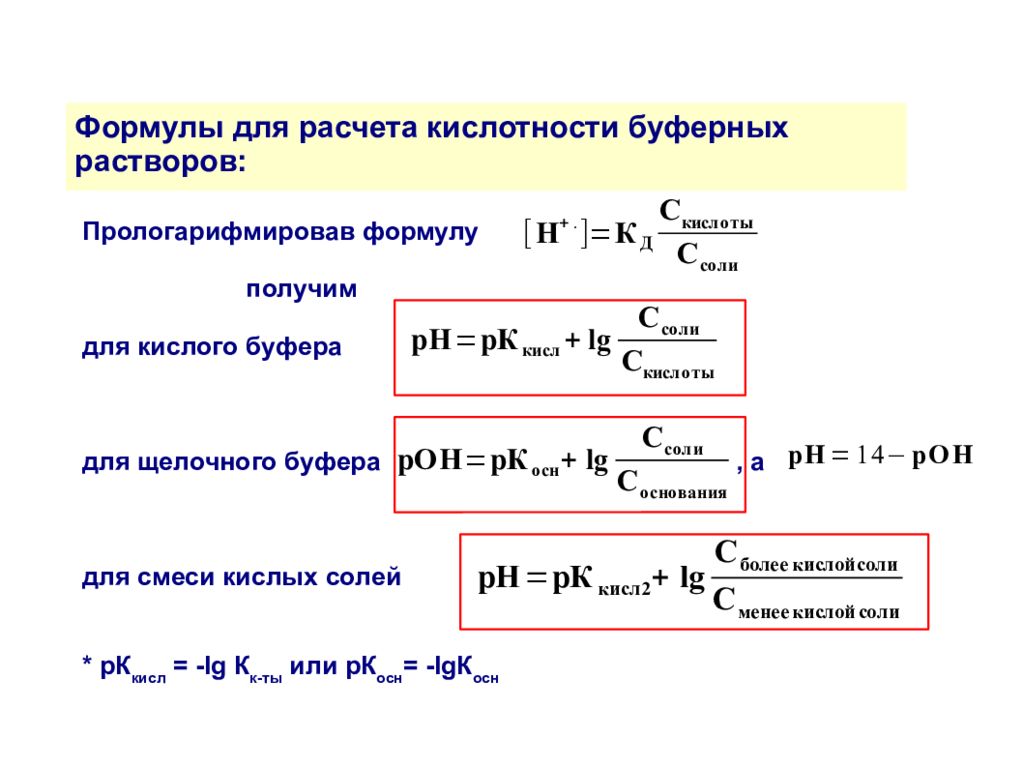
Вывод формулы для расчета кислотности буфера на примере кислого буфера: Слабая кислота: СН 3 СООН ↔ СН 3 СОО - + Н + частичная диссоциация Сильный электролит: СН 3 СООNa → СН 3 СОО - + Na + полная диссоциация Диссоциация слабой кислоты подчиняется закону действующих масс (ЗДМ) и характеризуется константой равновесия (диссоциации): Выразим, т.к. [СН 3 СООН] ≈ C M (CH 3 COOH) a [СН 3 СОО - ] ≈ C M (CH 3 COONa) Запишем Уравнение Гендерсона-Хассельбаха
Слайд 21
Формулы для расчета кислотности буферных растворов: Прологарифмировав формулу получим для кислого буфера для щелочного буфера, а для смеси кислых солей * рК кисл = -lg К к-ты или рК осн = -lgК осн
Слайд 22
Механизм действия буфера на примере кислого буфера: СН 3 СООН ↔ СН 3 СОО - + Н + СН 3 СООNa → СН 3 СОО - + Na + добавляем кислоту, то есть увеличиваем [H + ] пусть ν добавленной кислоты = 0,1 моль на каждый литр раствора Равновесие системы СН 3 СООН ↔ СН 3 СОО - + Н + сдвигается влево Концентрация [CH 3 COOH] возрастает на 0,1 моль Концентрация [СН 3 СОО - ] (то есть соли) пропорционально уменьшается на 0,1 моль
Слайд 23
Механизм действия буфера на примере кислого буфера: Например, определим рН ацетатного буфера, содержащего по 0,1 моль/л и уксусной кислоты и ацетата натрия. СН 3 СООН ↔ СН 3 СОО - + Н + СН 3 СООNa → СН 3 СОО - + Na + Определим рН этого раствора при добавлении к 1 его литру 0,01 моль/л HСl: Для сравнения: при C M (СН 3 СООН) = 0,1 М её При добавлении 0,01 моль/л HСl: Δ рН = 0,09
Слайд 24
Механизм действия буфера на примере кислого буфера: Для сравнения: при C M (СН 3 СООН) = 0,1 М её При добавлении 0,01 моль/л HСl: Δ рН = 0,92
Слайд 25
Механизм действия буфера на примере кислого буфера: Например, определим рН ацетатного буфера, содержащего по 0,1 моль/л и уксусной кислоты и ацетата натрия. СН 3 СООН ↔ СН 3 СОО - + Н + СН 3 СООNa → СН 3 СОО - + Na + При добавлении к кислому буферу избытку ОН - равновесие СН 3 СООН ↔ СН 3 СОО - + Н + Сдвигается вправо, т.к. Н + + ОН - → Н 2 О Концентрация кислоты уменьшается, а концентрация соли возрастает. При этом [H + ] изменяется незначительно, т.к. недостаток восполняется за счет диссоциации новых молекул кислоты. Определим рН этого раствора при добавлении к 1 его литру 0,01 моль/л NaOH: Δ рН = 0,06 OH -
Слайд 26
Механизм действия буфера на примере щелочного буфера: Разобрать самостоятельно!
Слайд 27
Буферная емкость Буферная емкость — количество сильной кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы сдвинуть его рН на единицу. Зависит: - от концентрации компонентов буферной системы (чем больше, тем больше); - от соотношения этих концентраций (чем больше, тем меньше).
Слайд 28
Буферная емкость Например, определить буферную емкость исходного ацетатного буфера по отношению к NaOH: рН исх = 4,74 После добавления NaOH рН должен возрасти на 1, т.е. рН получ = 5,74 х = количество эквивалентов добавленной щелочи = 0,082 моль/л. Ответ: буферная емкость исходного раствора по NaOH = 0,082 моль/л.
Слайд 29
Влияние разбавления на рН буферного на рН буферного раствора Буферные растворы не изменяют свой рН при разбавлении, т.к. концентрации компонентов системы уменьшаются пропорционально, их соотношение остается постоянным. Например, определить рН исходного буфера при разбавлении в 100 раз:
Последний слайд презентации: Лекция 2 Теория растворов Рассматриваемые вопросы: 1.Определение рН слабой
Медико-биологическое значение буферных систем В норме pH крови человека поддерживается в пределах 7,37—7,42. Изменение рН крови, выходящее за рамки интервала 6,8-7,7, несовместимо с жизнью. В сутки в организме человека вырабатывается не менее двух литров 0,1 н. HCl. Гемоглобиновая четыре мощных буферных системы Белковая поддерживают реакцию среды Бикарбонатная организма на постоянном Фосфатная уровне