Первый слайд презентации: Аналитическая химия (качественный анализ) курс лекций
Горболетова Г.Г., Березина Н.М., Базанов М.И. ФГБОУ ВПО «Ивановский государственный химико-технологический университет» Кафедра аналитической химии
Слайд 2: Список литературы:
Васильев В.П. Аналитическая химия. Кн.1.Титриметрический и гравиметрический методы анализа. - М., Дрофа, 2002. Золотов Ю.А. Основы аналитической химии. М. Высшая школа. 2004. ч.1,2. Алексеев В.Н. Курс качественного химического полумикроанализа –М.: Химия. 1973. Крешков А.П. Основы аналитической химии. М.:Химия. 1976. кн.1. Пилипенко Л.Т., Пятницкий И.В. Аналитическая химия. Кн. 1. –М.: Химия. 1990. 845 с.
Слайд 3
Аналитическая химия - наука о методах определения химического состава вещества и его структуры. Основные разделы аналитической химии: Качественный анализ; Количественный анализ; Физико-химические методы анализа. Предметом аналитической химии являются разработка методов анализа и их практическое выполнение, а также широкое исследование теоретических основ аналитических методов. 3
Слайд 4
4 Качественный анализ позволяет установить из каких элементов или ионов состоит вещество. Количественный анализ служит для определения содержания отдельных компонентов в пробе в граммах, % и т.д. Для современных физико-химических методов характерно использование оптических, электрохимических и других измерительных приборов. Многие практические аналитические приемы известны с глубокой древности. Они применялись для определения чистоты (пробы) драгоценных металлов – золота и серебра и выполнялись без растворения пробы. Основы современного качественного анализа путем проведения реакций в растворе разработал Роберт Бойль в середине XVII века.
Слайд 5
Аналитическая (или качественная) реакция — это химическая реакция, с помощью которой обнаруживают (открывают или идентифицируют) тот или иной ион в растворе. Следовательно, такая реакция должна сопровождаться каким-либо внешним, видимым эффектом: 1. Образование малорастворимых соединений ; 2. Изменение окраски раствора ; 3. Образование и выделением газов. 5
Слайд 6
6 Наименьшее содержание определяемого компонента (С х ), при котором его можно обнаружить данным методом с заданной доверительной вероятностью (Р), называют пределом обнаружения. Пусть предел обнаружения равен 10 -4 г при доверительной вероятности Р = 0,95. Это означает, что при содержании 10 -4 г определяемого компонента в анализируемой пробе в 95 опытах из 100 получают правильный результат, т.е. обнаруживают искомый компонент. Если С х > 10 -4 г, то вероятность обнаружения становится выше. Если содержание вещества в пробе меньше предела обнаружения, то его нельзя обнаружить данным методом.
Слайд 7
Аналитическая реакция тем чувствительнее, чем ниже предел обнаружения. Предел обнаружения зависит от: - концентрации реагентов ; - присутствия посторонних ионов ; - электролитов или мешающих веществ, среды ; - температуры растворов. 7
Слайд 8
Классификация аналитических реакций: 1. Специфические реакции – это реакции, которые позволяют обнаруживать данный ион в присутствии других ионов. Например, реакция обнаружения иона аммония NH 4 + действием щелочи при нагревании: NH 4 + + OH - NH 3 + H 2 O 2. Селективные или избирательные реакции дают сходный эффект с ограниченным числом ионов. Например, рубеановодородная кислота: Cu 2+ + H 2 ( SCNH ) 2 Cu ( SCN Н) 2 + 2 H + темно-зеленое или черное пятно Co 2+ + H 2 ( SCNH ) 2 Co ( SCN Н) 2 + 2 H + бурое окрашивание Ni 2+ + H 2 ( SCNH ) 2 Ni ( SCN Н) 2 + 2 H + синее или фиолетовое окрашивание 8
Слайд 9
9 3. Реакции с использованием групповых реагентов – реактивов, дающих одинаковую реакцию с большой группой ионов. Например, ионы щелочно-земельных металлов – Са 2+, Sr 2+, Ва 2+ - образуют осадки белого цвета с серной кислотой - CaSO 4, SrSO 4, BaSO 4.
Слайд 10
10 Техника выполнения аналитических реакций По технике выполнения анализа все реакции обнаружения можно разделить на три группы : пробирочные, капельные и микрокристаллоскопические. 1) Пробирочные реакции выполняются путем смешивания анализируемого раствора с реагентами в пробирке. При этом объемы растворов обычно составляют 1-3 капли. Приливать растворы в пробирку следует пипеткой (вакуумным капилляром), не касаясь стенок пробирки во избежание возможных загрязнений реактива. Растворы необходимо перемешивать стеклянной палочкой.
Слайд 11
11 2) Капельные реакции выполняются на маленьком листочке фильтровальной бумаги, имеющем треугольную форму. На кусочек бумаги наносят каплю исследуемого раствора. Затем рядом с нанесенной каплей, на расстоянии 1-1,5 мм наносят каплю реактива. В месте перекрывания двух капель наблюдают окраску образующегося соединения и делают соответствующий вывод.
Слайд 12
12 3) Микрокристаллоскопические реакции (мкс) выполняются на предметном стекле, которое должно быть тщательно вымыто, ополоснуто дистиллированной водой и насухо вытерто фильтровальной бумагой. Из капилляра-пипетки выдавливают небольшую каплю исследуемого раствора. Рядом с ней на расстоянии 2-3 мм помещают такую же каплю реагента. Затем с помощью чистой стеклянной палочки соединяют обе капли и помещают стекло на предметный столик микроскопа так, чтобы место слияния капель оказалось под объективом. Отмечают форму и цвет кристаллов, поскольку именно это служит основанием для заключения о присутствии или отсутствии иона.
Слайд 13
13 Условия выполнения аналитических реакций Четкий и однозначный результат анализа может быть получен только при соблюдении строго обозначенных условий проведения реакции. 1. Кислотность раствора. Многие реакции требуют определенной среды раствора, выражаемой значением рН. Ca 2+ + C 2 O 4 2- CaC 2 O 4 - осадок белого цвета. В кислой среде осадок не образуется: C 2 O 4 2- + H + Н C 2 O 4 - Ag + + Cl - AgCl - в кислой среде осадок белого цвета. В щелочной среде: AgOH → AgO
Слайд 14
14 Проверить среду или значение рН можно с помощью индикаторных бумаг. Лакмусовая индикаторная бумага бывает красной и синей. При нанесении капли испытуемого раствора на красную лакмусовую бумагу она окрашивается в синий цвет, если среда раствора щелочная, и остается красной в кислой среде. Синий лакмус, наоборот, краснеет в кислой среде.
Слайд 15
Более подробную информацию дает бумага, пропитанная универсальным индикатором (УИ). При смачивании ее анализируемым раствором она окрашивается в разные цвета, которые обозначены на шкале стандартов, прилагаемой к упаковке универсального индикатора. Сравнивая цвет пятна на бумаге со шкалой, можно определить не только среду раствора, но и примерное значение рН в пределах от 1 до 12. Сравнение со стандартной шкалой УИ необходимо проводить сразу, иначе цвет пятна со временем может измениться. 15
Слайд 16
16 2) Температура раствора. Многие реакции идут при нагревании, о чем обязательно говорится в руководстве. Нагревания требуют все реакции растворения осадков, часто - окислительно-восстановительные реакции, реакции с выделением газов и другие. Pb 2+ + 2 Cl - PbCl 2 осадок белого цвета, растворяется в горячей воде. Нагревание проводят в пробирках, помещаемых в водяную баню, при перемешивании.
Слайд 17
17 3) Количество добавляемого реагента. В отношении количества реактивов надо строго придерживаться прописи. Hg 2+ + 2 I - HgI 2 осадок красного цвета, растворяется в избытке KI. HgI 2 + 2 I - HgI 4 2- - бесцветный раствор. Нужно прибавлять разбавленный раствор KI по каплям.
Слайд 18
Аналитическая классификация катионов В настоящее время существуют пять методов классификации ионов. Это сероводородный, аммиачно-фосфатный, дифталатный, тиоацетамидный и кислотно-основной методы. Сероводородный метод основан на различной растворимости сульфидов, хлоридов и карбонатов. В дифталатном методе для разделения групп ионов используют дифталат калия с гидроксидом калия или натрия. Тиоацетамидный метод основан на применении в качестве группового реагента тиоацетамида, хлороводородной кислоты и карбоната аммония. В кислотно-основном методе основными реагентами являются кислоты HCl и H 2 SO 4, гидроксиды калия и натрия и водный раствор аммиака.
Слайд 20
Достоинства кислотно-основной классификации: 1) Использует основные свойства элементов – отношение к кислотам и щелочам, способность к комплексообразованию, амфотерность гидроксидов. 2) Аналитические группы в этой классификации ближе совпадают с группами периодической системы. 3) Метод более экспрессный по сравнению с сероводородным и менее токсичный. 20
Слайд 21
Основные типы реакций в растворе 1. Кислотно-основного взаимодействия ; 2. Осаждения и растворения малорастворимых соединений ; 3. Комплексообразования ; 4. Окисления-восстановления. 21
Содержание понятий «кислота» и «основание» существенно менялось в процессе развития химической науки. По теории Аррениуса кислотами назывались вещества, которые диссоциировали в воде с образованием ионов водорода Н +, а основаниями – вещества, которые диссоциировали с образованием ионов OH ˉ. Однако, классическая теория кислот и о c нований не могла объяснить ряд явлений, происходящих в водных и неводных растворителях. Например, в бензольных растворах HCl не было обнаружено ионов водорода, но металлы в этом растворе растворялись с образованием газообразного водорода, кислотно-основные индикаторы изменяли свой цвет. В водных растворах соли слабых кислот ( Na 2 CO 3, KCN, Na 3 PO 4 и т.д.) проявляли свойства оснований, а кислые соли многоосновных кислот ( Na 2 Н PO 4, KHSO 4 и т.д.) выступали как кислоты.
Слайд 23
Протолитическая теория Бренстеда-Лоури, разработанная в 1923 году, дает более общие представления о кислотах и основаниях по сравнению с классической теорией электролитической диссоциации Аррениуса. Согласно протолитической теории кислот и оснований Бренстеда-Лоури к кислотам относятся вещества, способные отдавать протон; к основаниям – вещества, способные принимать протон. По этой теории кислотами являются, например, HCl, HNO 3, NH 4 +, НСN, а основаниями – ОНˉ, СО 3 2-, РО 4 3-, SCNˉ. Реакции кислотно-основного взаимодействия – это реакции обратимого переноса протона от кислоты к основанию.
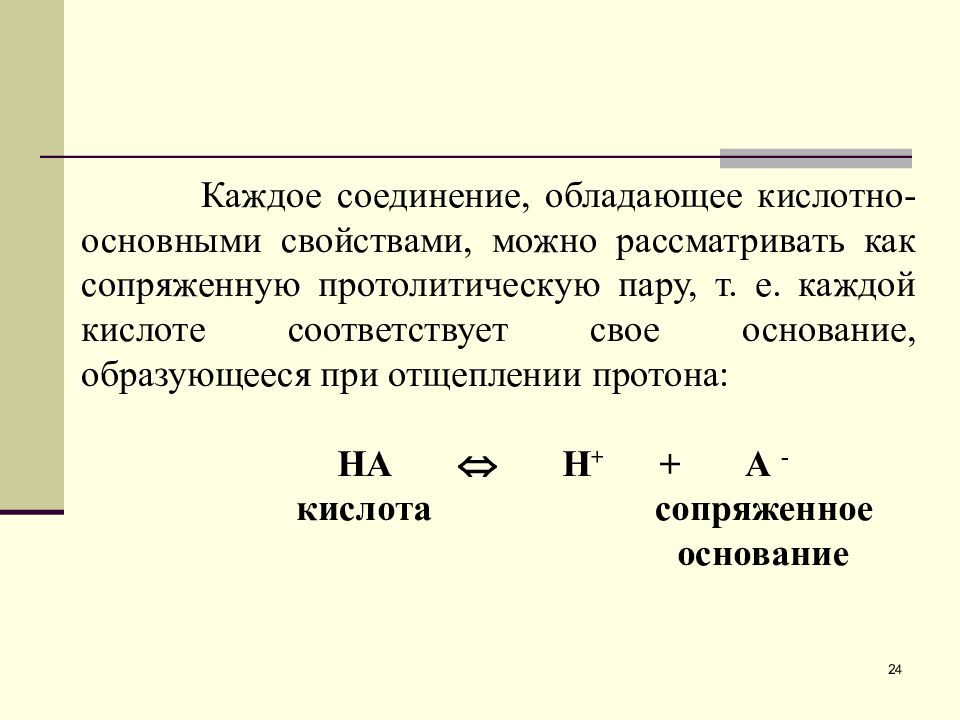
Слайд 24
Каждое соединение, обладающее кислотно-основными свойствами, можно рассматривать как сопряженную протолитическую пару, т. е. каждой кислоте соответствует свое основание, образующееся при отщеплении протона: НА Н + + А - кислота c опряженное основание 24
Слайд 25
Тогда реакцию кислотно-основного взаимодействия в общем виде можно представить так: НА + В НВ + + А - кислота основание сопряженная сопряженное кислота основание Например : НCl + OH - Н 2 O + Cl - кислота основание сопряженная сопряженное кислота основание Соединения, которые могут как присоединять, так и отдавать протон, т.е. являются одновременно и кислотами, и основаниями, называются амфолитами. Например, H 2 O, HCO 3 -, Н 2 РО 4 -, НРО 4 2- и т.п.
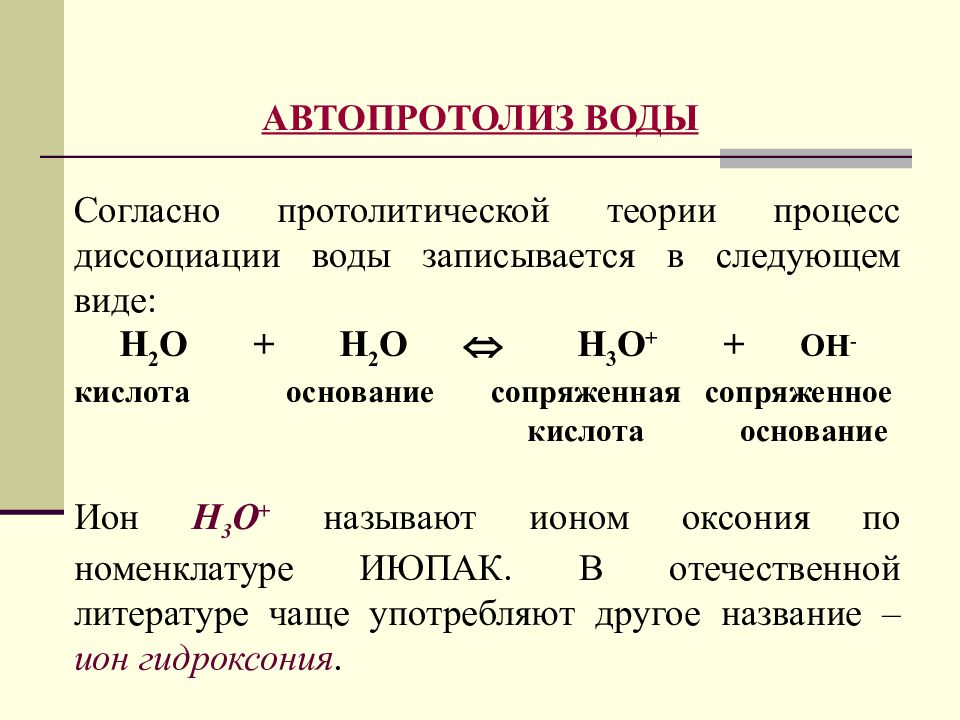
Слайд 26
АВТОПРОТОЛИЗ ВОДЫ Согласно протолитической теории процесс диссоциации воды записывается в следующем виде: Н 2 О + Н 2 О Н 3 О + + ОН - кислота основание сопряженная сопряженное кислота основание Ион Н 3 О + называют ионом оксония по номенклатуре ИЮПАК. В отечественной литературе чаще употребляют другое название – ион гидроксония.
Слайд 27
Обозначив ион гидроксония через Н +, записываем схему диссоциации воды упрощенно: Н 2 О Н + + ОН - Константа этого равновесия может быть записана как г де а - активность участников реакции. Поскольку активность воды при данной температуре постоянна, то произведение также будет постоянным. Его называют ионным произведением воды и обозначают символом К w.
Слайд 28
где - коэффициент активности. При температуре 298,15 К значение К w =1,0 10 -14 В разбавленных растворах коэффициенты активности близки к единице, следовательно, можно записать: В химически чистой воде: 28
Слайд 29
Используя понятия показателя константы автопротолиза воды ( рК=-lgK w ), водородного ( рН=-lg[H + ] ) и гидроксидного ( рН=-lg[OH - ] ) показателей, можно записать: pК w = рН + рОН = 14,0 В нейтральной среде рН = рОН = 7,0 В кислой среде рН 7 рОН 7 В щелочной среде рН 7 рОН 7 Процесс диссоциации воды эндотермичен (ΔН w = 56,070 кДж/моль), поэтому с ростом температуры К w увеличивается.
Слайд 30
СИЛЬНЫЕ КИСЛОТЫ И ОСНОВАНИЯ Сильные кислоты и основания при всех концентрациях в растворе диссоциированы практически нацело. К сильным кислотам относятся все галогеноводородные кислоты за исключением HF, хлорная (HClO 4 ), азотная (HNO 3 ) кислоты, серная кислота (H 2 SO 4 ) по первой ступени диссоциации и др. В растворах сильных кислот происходит полная ионизация кислоты по схеме: НА + H 2 O Н 3 O + + А - 30
Слайд 31
Следовательно, концентрация ионов водорода в таких растворах равна концентрации кислоты (в единицах молярности). [H + ]=C НА ; pH=-lg C НА ; pOH=14-(-lg C НА ) Например, в 0,1 М растворе HCl концентрация ионов водорода равна 0,1 моль/л и рН=1,0. 31
Слайд 32
Сильными основаниями являются водные растворы гидроксидов щелочных и щелочно-земельных металлов (КОН, NaOH, Ba ( OH ) 2 и др.). В растворах сильных оснований концентрация гидроксид-ионов вследствие полной ионизации основания в воде равна его общей концентрации. [OH - ]=C B ; pOH=-lg C B ; pH=14-(-lg C B ) Например, в 0,1 М растворе NaOH концентрация ОН - -ионов равна 0,1 моль/л и р O Н=1,0; рН=13,0. 32
Слайд 33
Пример 1. Вычислить [H + ], [OH - ] и рН 0,05 М раствора HNO 3. HNO 3 H + + NO 3 - [H + ]= C (HNO 3 ) =0,05 моль / л ; pH=-lg 0,05 = 1,30; 33
Слайд 34
Пример 2. Вычислить [H + ], [OH - ], рОН и рН 0,003 М раствора КОН. КОН О H ˉ + К + [О H ˉ]= C ( КОН)=0,003 моль/л; p О H =- lg 0,003 = 2,52; рН = - lg 3,33∙10 -12 = 11,48.
Слайд 35
СЛАБЫЕ КИСЛОТЫ И ОСНОВАНИЯ Слабые кислоты и основания диссоциированы в водном растворе неполностью. В водном растворе слабой кислоты существует равновесие: НА + Н 2 О Н 3 О + + А – или упрощенно НА Н + + А - которое характеризуется термодинамической константой диссоциации : где а – активность участников реакции; - коэффициенты активности; К НА – концентрационная константа кислотной диссоциации.
Слайд 36
В разбавленных растворах коэффициенты активности близки к единице. Для приближенных расчетов принимаем К НА К НА. 36
Правила расчета ионных равновесий
Слайд 38
Т.к. для слабой кислоты К НА 1, обозначаем за х равновесные концентрации продуктов диссоциации: [Н+] = х ; [А–] = х. Равновесная концентрация недиссоциированных молекул кислоты равна: [НА] = С НА – [Н + ] = С НА – х. Подставляем х и С НА – х в выражение для константы диссоциации: и решаем квадратное уравнение относительно х : х 2 + К НА х – К НА С НА = 0;
Слайд 39
Если К НА 10 -4 и С НА >> К НА, то С НА – х С НА и уравнение принимает вид: Отсюда 39
Слайд 40
Процесс диссоциации кислоты характеризуется степенью диссоциации, представляющей собой отношение концентрации диссоциированных молекул кислоты к исходной концентрации кислоты: 40
Слайд 41
Равновесие в растворе слабого основания B + Н 2 О BН + + OH – характеризуется константой основной диссоциации : Обозначаем равновесные концентрации частиц в уравнении: [Н B + ] = х ; [OH – ] = х ; [B] = С B – х и подставляем в выражение для константы диссоциации: Отсюда:
Слайд 42
Если К b B 10 -4 и С B >> К b B, Концентрация ионов водорода будет равна: Например, муравьиная кислота (К а НСООН =1,8 10 –4 ) сильнее, чем уксусная ( 42
Слайд 43
Пример 1. Вычислить концентрацию [Н + ], рН и степень диссоциации 0,1 М раствора уксусной кислоты. СН 3 СООН СН 3 СОО – + Н + 0,1 – х х х Так как К а НА 10 -4, х << 0,1 моль/л, можно принять, что 0,1 – х 0,1. Тогда: рН =- lg [ H + ] = - lg 1,33 10 -3 = 2,88
Слайд 44
Пример 2. Вычислить концентрацию ОН - и рН 0,1 М раствора аммиака. NH 3 + H 2 O NH 4 + + OH - 0,1 – х х х Так как К b (NH 3 ) 10 -4, х << 0,1 моль/л, то 0,1– х 0,1. рН =-lg[H + ] = -lg 7,52 10 -12 = 11,12.
Слайд 45
Пример 3. Вычислить [СH 3 COO - ] и рН 0,1 М раствора уксусной кислоты в присутствии 0,1 М раствора НCl. В растворе смеси сильной и слабой кислот существуют следующие равновесия: СН 3 СООН СН 3 СОО – + Н + 0,1 – х х х HCl Сl – + Н + 0,1 0,1 0,1 Суммарная равновесная концентрация ионов Н + в смеси двух кислот равна х + 0,1.
Слайд 46
Учитывая, что x 0,1, можно упростить уравнение. x = [СН 3 СОО – ] = 1,74 10 -5 моль/л. [H + ] = C°(НСl) = 0,1 моль/л; pH=-lg 0,1 = 1.
Слайд 47
Выводы: 1) Концентрация ацетат-ионов в присутствии сильной кислоты резко уменьшилась (в 100 раз). Следовательно, рН является мощным регулятором концентрации аниона слабой кислоты. 2) Концентрация ионов водорода в смеси сильной и слабой кислот практически полностью определяется концентрацией сильной кислоты. 47
Слайд 48: МНОГООСНОВНЫЕ СЛАБЫЕ КИСЛОТЫ
Многоосновные слабые кислоты диссоциируют в несколько ступеней, каждая из которых характеризуется константой ступенчатой диссоциации: Н 2 А Н + + HА С 0 Н 2 А – х х х НА- Н + + А 2- x - y x + y y где x, y – концентрация ионов водорода при диссоциации кислоты по I и II ступеням диссоциации соответственно.
Слайд 49
Если первая константа диссоциации значительно больше второй, то (x + y) x, (x – y) x; Концентрация ионов водорода в растворе многоосновной кислоты, ступенчатые константы диссоциации которой различаются на четыре и более порядка, определяется диссоциацией кислоты по первой ступени. [Н + ] = 49
Слайд 50
Пример 1. Вычислить концентрацию ионов Н +, Н 2 P O 4-, Н P O 4 2-, P O 4 3- в 0,1М растворе Н 3 P O 4. Диссоциация фосфорной кислоты происходит по трем ступеням: по первой ступени Н 3 P O 4 Н + + Н 2 P O 4 - X x по второй ступени Н 2 P O 4 - Н + + Н P O 4 2- 50
Слайд 51
по третьей ступени Н P O 4 2- Н + + P O 4 3- Поскольку К а 1 > 10 -4 решаем квадратное уравнение: х 2 + 7,6 10 –3 х – 7,6 10 –4 = 0
Слайд 52
Концентрация аниона, образующегося в результате диссоциации фосфорной кислоты по второй ступени, численно равна К а 2. [Н P O 4 2- ] = К а 2 = 6,2 10 –8 моль/л. Подставляя рассчитанные значения [Н + ] и [Н P O 4 2- ] в уравнение диссоциации Н 3 P O 4 по третьей ступени, находим концентрацию иона P O 4 3- :
Слайд 53: СОЛИ СЛАБЫХ КИСЛОТ И ОСНОВАНИЙ
Для сопряженного основания: А - + HOH HА + OH - Чем больше константа кислотной диссоциации кислоты, тем слабее сопряженное с ней основание. C опряженное с муравьиной кислотой основание – формиат-ион НСОО – слабее основания – ацетат-иона СН 3 СОО – 53
Слайд 54
Для сопряженной кислоты: BH + + HOH B + Н 3 O + где [Н + ]=[ H 3 O + ]. Чем больше константа основной диссоциации основания, тем слабее сопряженная с ним кислота. C опряженная с аммиаком кислота – аммоний-катион NH 4 + ( ) слабее кислоты – иона С 2 Н 5 NH 3 + 54
Слайд 55
Пример 1. Вычислить рН и степень основной диссоциации ацетат-иона в 0,1 М СН 3 СООNa. СН 3 СОО – + Н 2 О = СН 3 СООН + ОН – 0,1 – х х х Так как << 10 -4 : рОН = -lg 7,58 10 –6 = 5,12 и рН = 8,88. Степень основной диссоциации иона СН 3 СОО – :
Слайд 56
Пример 2. Вычислить рН 0,01 М раствора СH 3 CH 2 NH 3 С l. СН 3 СН 2 NH 3 + + Н 2 О = СН 3 СН 2 NH 2 + Н 3 О + 0,01-x x x рН = 6,34. 56
Слайд 57: АМФОЛИТЫ
К амфолитам относятся вещества, которые в растворе могут быть как донорами, так и акцепторами протонов. К ним относятся Н 2 О, НСО 3 –, НС 2 О 4 –, Н 2 РО 4 – и др. Например, ион НСО 3 – может как отдавать, так и принимать протоны: НСО 3 – Н + + СО 3 2- (1) 57
Слайд 58
НСО 3– + Н 2 О Н 2 СО 3 + ОН – (2) Гидроксил-ионы, выделяющиеся в процессе (2), взаимодействуют с ионами водорода, образующимися по схеме (1): Н + + ОН - Н 2 О K w = [Н + ][ O Н - ] 58
Слайд 59
По уравнению (1) [Н + ]=[СО 3 2- ], по уравнению (2) [ОНˉ]=[Н 2 СО 3 ], следовательно, равновесная концентрация ионов водорода равна: [Н + ]=[СО 3 2- ]– [Н 2 СО 3 ] (3) Выразим концентрацию ионов СО 3 2- и Н 2 СО 3 из уравнений констант равновесий процессов (1) и (2):
Слайд 61
Если К а 1 << [НСО 3 – ] (концентрация этого иона известна по условию), то величиной К а 1 в знаменателе можно пренебречь. Тогда рН раствора NaHCO 3 равен: Для Na 2 HРO 4 соответственно:
Слайд 62: БУФЕРНЫЕ РАСТВОРЫ
62 Растворы, содержащие либо слабую кислоту и ее соль, либо слабое основание и его соль, называются буферными. Сущность буферного действия заключается в том, что один из компонентов буферной системы может связывать ионы водорода, а другой - гидроксил-ионы в молекулы слабой кислоты, слабого основания и воды.
Слайд 63
63 CH 3 COO – + Н + CH 3 COOH CH 3 COOH + ОН – CH 3 COO – + Н 2 О NH 3 + H + NH 4 + NH 4 + + ОН - NH 3 + Н 2 О Буферные системы характеризуются двумя параметрами: значением создаваемого рН и буферной емкостью. Ацетатный буфер (СН 3 СООН + СН 3 СООNa) ; Аммонийный буфер (NH 4 OH + NH 4 Cl).
Слайд 64
1. Рассчитаем рН ацетатного буферного раствора: CH 3 COOH CH 3 COO – + Н + С к -x х х CH 3 COONa CH 3 COO – + Na + С c С c С c где С к – концентрация кислоты; С с – концентрация соли. Поскольку х << С к и х << C с, С с + х С с, а С к - х С к, тогда
Слайд 65
65 2. Рассчитаем рН аммонийного буферного раствора: NH 3 + HOН NH 4 + + OH С осн - x x x NH 4 Cl NH 4 + + Cl – С с С с С с
Слайд 66
66 Способность буферного раствора поддерживать постоянное значение рН определяется его буферной емкостью. Буферная емкость характеризуется количеством вещества (моль) сильной кислоты или сильного основания, которое требуется ввести в 1 л буферного раствора, чтобы изменить его рН на единицу. Математически буферная емкость равна производной: где d x – концентрация сильной кислоты или сильного основания, введенных в буферную смесь.
Слайд 67
dC x – концентрация введенной сильной кислоты или сильного основания, равная изменению концентрации соответствующего компонента буферного раствора. Учитывая равновесия, возникающие в кислотном буферном растворе при введении в него сильного основания, и проведя соответствующие математические преобразования, можно получить уравнение: + HCl : + NaOH : где K HA – константа диссоциации кислоты; С – общая концентрация буферного раствора ([ HA ]+[ A - ]).
Слайд 68
находится в пределах от 10 до 0.1, что соответствует двум единицам рН, т.е. рН = рК 1 68 Максимальная буферная емкость реализуется при одинаковой концентрации компонентов буферного раствора. Расчеты показывают, что величина рН буферных систем остается практически постоянной, если отношение концентраций компонентов или
Слайд 69
Пример 1. Вычислить рН раствора, состоящего из 0,2 М CH 3 COOH и 0,15 M CH 3 COOК. CH 3 COOH CH 3 COO – + Н + С к -x х х CH 3 COONa CH 3 COO – + Na + С c С c С c В буферном растворе х << 0,15 и 0,15 + х 0,15, а также 0,20 + х 0,20 рН = 4,63.
Слайд 70
70 Кислотно-основные индикаторы Кислотно-основные индикаторы – это органические соединения сложной структуры, которые изменяют свою окраску в зависимости от рН раствора. Согласно ионной теории кислотно-основные индикаторы – слабые кислоты или основания, недиссоциированные молекулы которых и анионы имеют различную окраску. Метиловый оранжевый: HInd H+ + Ind- кр желт