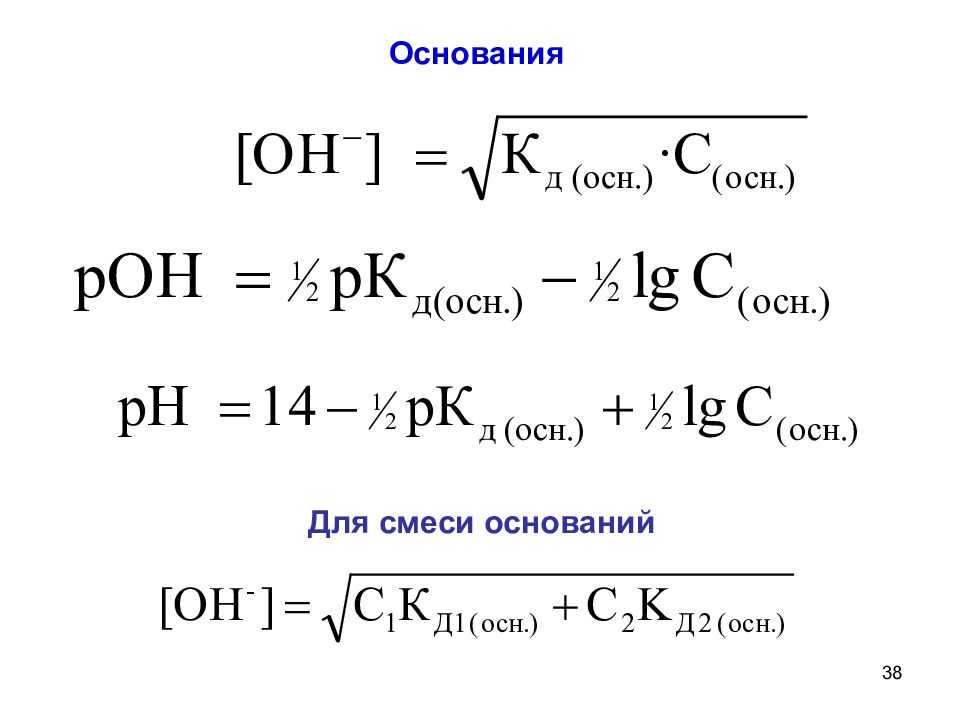Слайд 2
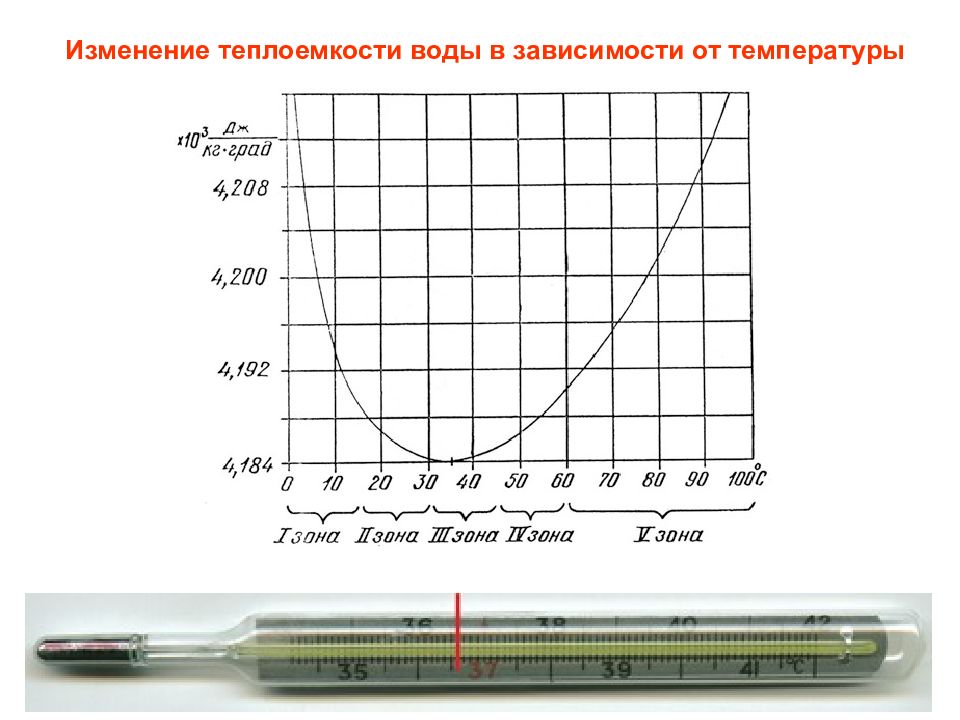
2 Основные функции воды в организме Обеспечение процессов всасывания и механического передвижения питательных веществ Поддержание оптимального осмотического давления в крови и тканях Обеспечение функционирования белков, нуклеиновых кислот, полисахаридов Участие в процессах биосинтеза, ферментативного катализа, гидролиза Поддержание температуры тела
Слайд 4
4 Значение растворов в жизнедеятельности организмов. Важнейшие биологические жидкости - кровь, лимфа моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. Биожидкости участвуют в транспорте: - кислорода, питательных веществ (жиров, аминокислот), - лекарственных препаратов к органам и тканям, - выведении из организма метаболитов: мочевины, билирубина, углекислого газа Плазма крови является средой для клеток - лимфоцитов, эритроцитов, тромбоцитов.
Слайд 5
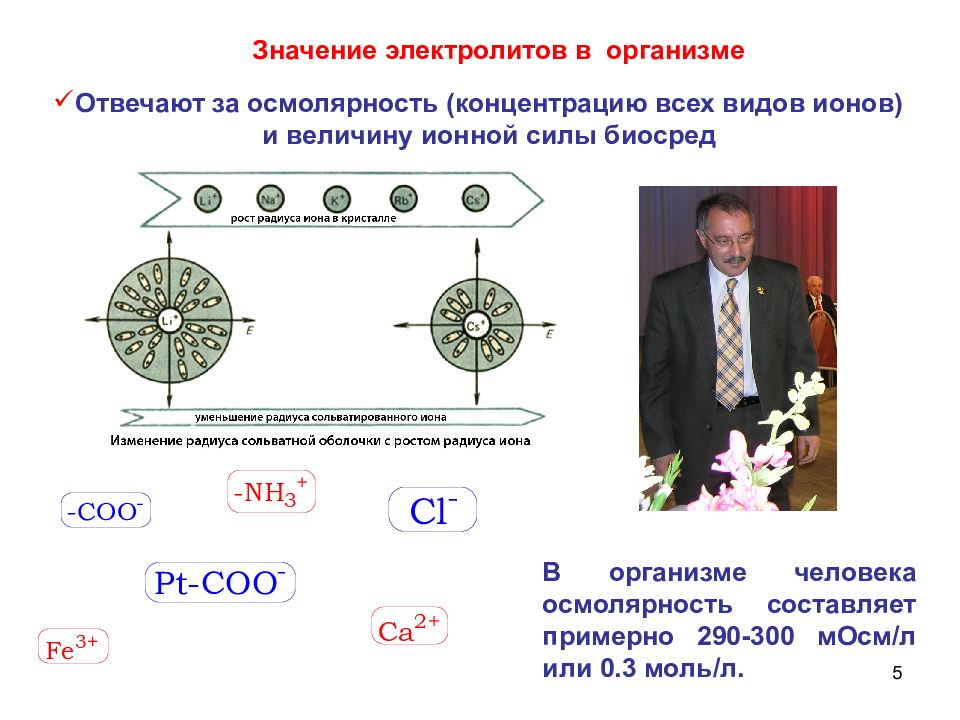
5 Отвечают за осмолярность (концентрацию всех видов ионов) и величину ионной силы биосред Значение электролитов в организме В организме человека осмолярность составляет примерно 290-300 мОсм/л или 0.3 моль/л.
Слайд 6
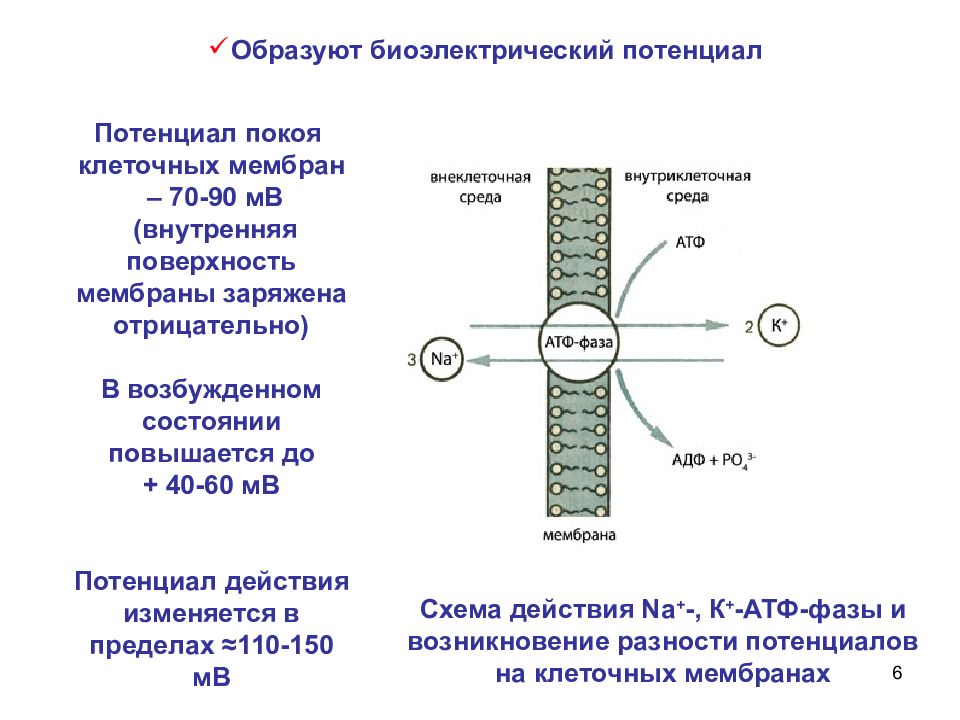
6 Схема действия Na + -, К + -АТФ-фазы и возникновение разности потенциалов на клеточных мембранах Потенциал покоя клеточных мембран – 70-90 мВ (внутренняя поверхность мембраны заряжена отрицательно) В возбужденном состоянии повышается до + 40-60 мВ Потенциал действия изменяется в пределах ≈ 110-150 мВ Образуют биоэлектрический потенциал
Слайд 7
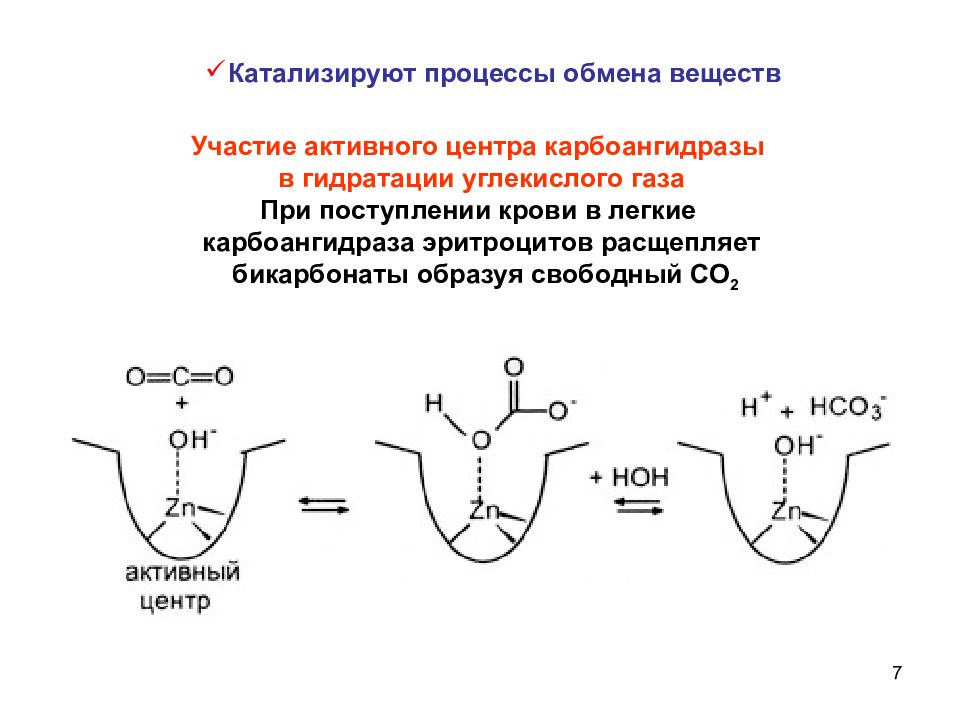
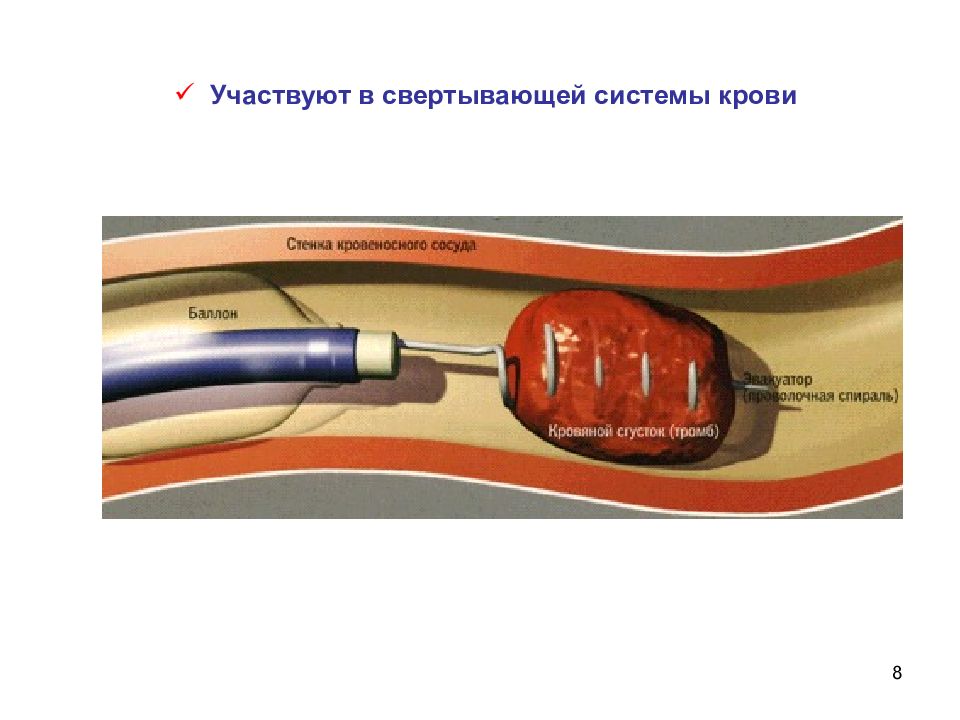
7 Участие активного центра карбоангидразы в гидратации углекислого газа При поступлении крови в легкие карбоангидраза эритроцитов расщепляет бикарбонаты образуя свободный СО 2 Катализируют процессы обмена веществ
Слайд 9
9 Образование защитного эмалевого слоя Лечение кариеса фторидами Стабилизируют костные ткани
Слайд 10
10 Какие б чувства не таились Тогда во мне - теперь их нет: Они прошли иль изменились... Мир вам, тревоги прошлых лет! В ту пору мне казались нужны Пустыни, волн края жемчужны, И моря шум, и груды скал, И гордой девы идеал, И безыменные страданья... Другие дни, другие сны; Смирились вы, моей весны Высокопарные мечтанья, И в поэтический бокал Воды я много подмешал
Слайд 11
11 КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ Имеющую огромное значение для химии чистую воду... можно рассматривать как слабую кислоту или слабое основание. С. Аррениус Ионное произведение воды Вода в малой степени ионизирована по уравнению: H 2 O H + + OH –. Константа диссоциации К дисс, в соответствии с законом действующих масс, выразится уравнением:
Слайд 12
12 При 25 °С К д =1.8·10 -16 Концентрацию молекул воды как в чистой воде, так и в разбавленных водных растворах можно считать величиной постоянной и равной: . [Н 2 О] =1000/18=55.56 моль/л [Н + ][ОН – ] = К д ·[Н 2 О] = 1.8·10 –16 ·55.56 = 10 –14. К д ·[Н 2 О] = K w Ионное произведение воды: K w =[Н + ][ОН – ] = 10 –14 ( 25° С ) В чистой воде при температуре 25 °С: Моль-экв/л.
Слайд 13
13 В соответствии с принципом Ле Шателье при добавлении кислот или оснований равновесие H 2 O H + + OH – смещается: В кислой среде: [Н + ] >10 –7, [ОН ‑ ] < 10 –7, В щелочной среде зависимость обратная
Слайд 14
14 Диссоциация воды - эндотермический процесс, следовательно, Kw растет с повышением температуры: Для наглядности удобно использовать величину – lgK Н2О = pK Н2О.
Слайд 15
15 Для удобства в расчетах пользуются величинами водородного и гидроксильного показателей - р H и рОН, pH - power Hydrogene!!! рН = 7 рН<7, рОН>7 рН>7, рОН<7 рН + рОН = 14 рН = – lg [ H + ] Шкала рН рОН = – lg [ OH – ] р – отрицательный логарифм (- lg )
Слайд 17
17 Для чистой воды рН=7 Дождевая вода за счет растворенного СО 2 имеет рН ~ 5.5 – 6.0
Слайд 18
18 Памятник Джорджу Вашингтону в Нью-Йорке в момент открытия и через 60 лет Мрамор СаСО 3 под действием слабокислой дождевой среды переходит в растворимый гидрокарбонат Са(НСО 3 ) 2
Слайд 19
19 Бронзовый памятник во влажном воздухе медленно покрывается налетом основного карбоната меди (СuOH) 2 CO 3
Слайд 20
20 Александр Федорович Тур (1894–1974) 1930-1934 -заведующий кафедрой физиологии, гигиены и диететики ребенка 1934-1939 - заведующий кафедрой пропедевтики детских болезней 1939-1974 - заведующий кафедрой госпитальной педиатрии А.Ф.Тур разрабатывал следующие научные проблемы: физиологические особенности и воспитание здоровых детей гематология и диететика здорового и больного ребенка физиология и патология здорового и больного ребенка выхаживание новорожденных и недоношенных детей дистрофия у детей в годы блокады рахит и его профилактика, детская эндокринология Лауреат Ленинской премии (1970 г.)
Слайд 21
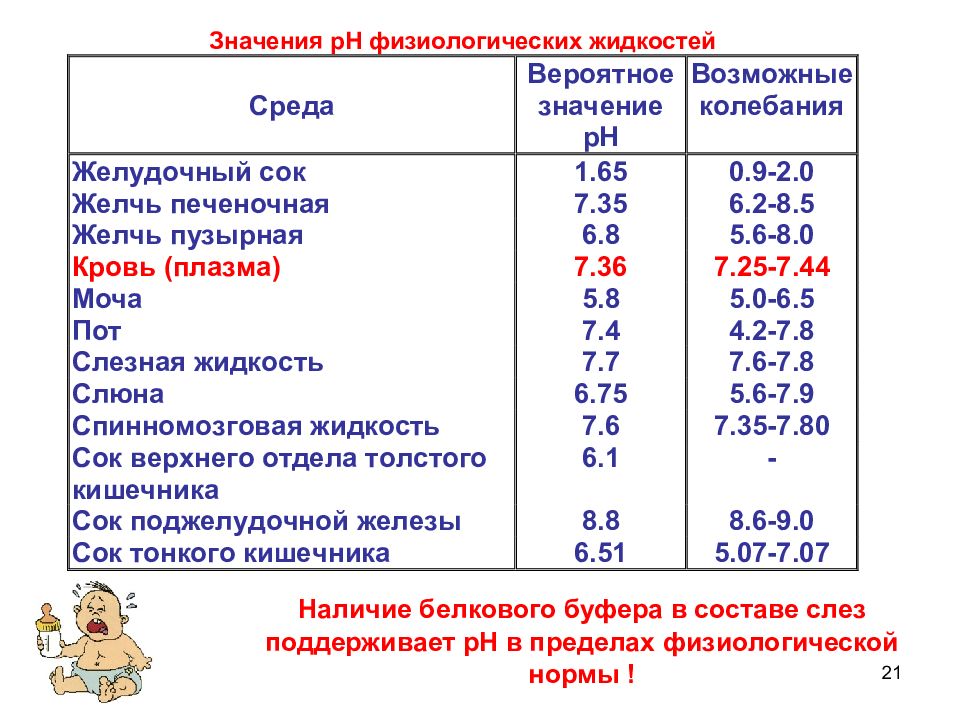
21 Наличие белкового буфера в составе слез поддерживает рН в пределах физиологической нормы !
Слайд 22
22 Электролиты – вещества, растворы и расплавы которых проводят электрический ток вследствие диссоциации на ионы. Расчет рН в растворах сильных и слабых электролитах
Слайд 23
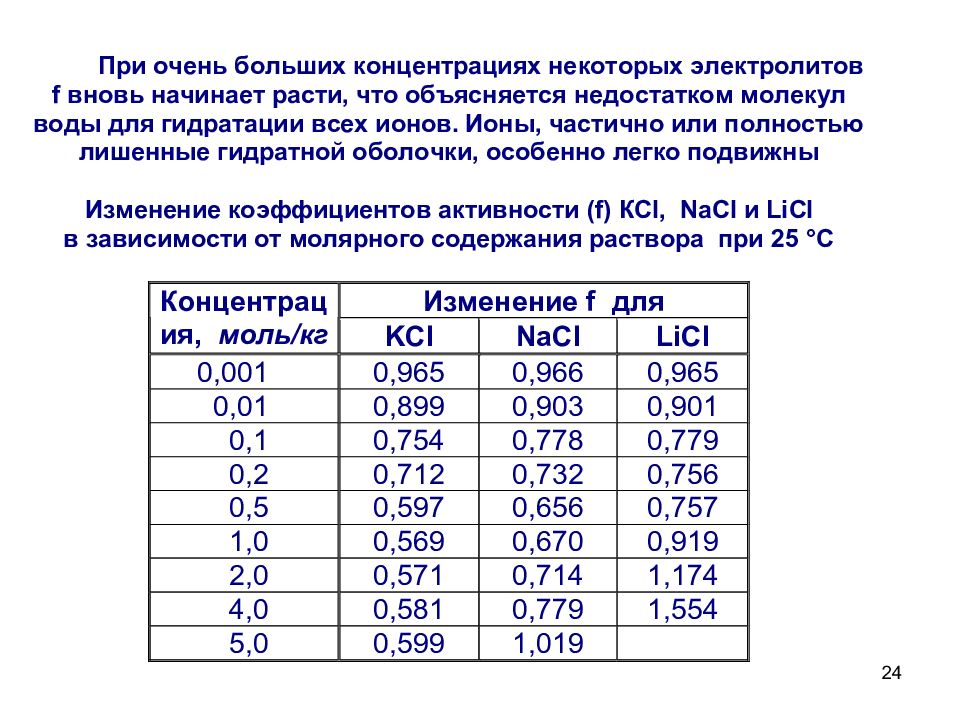
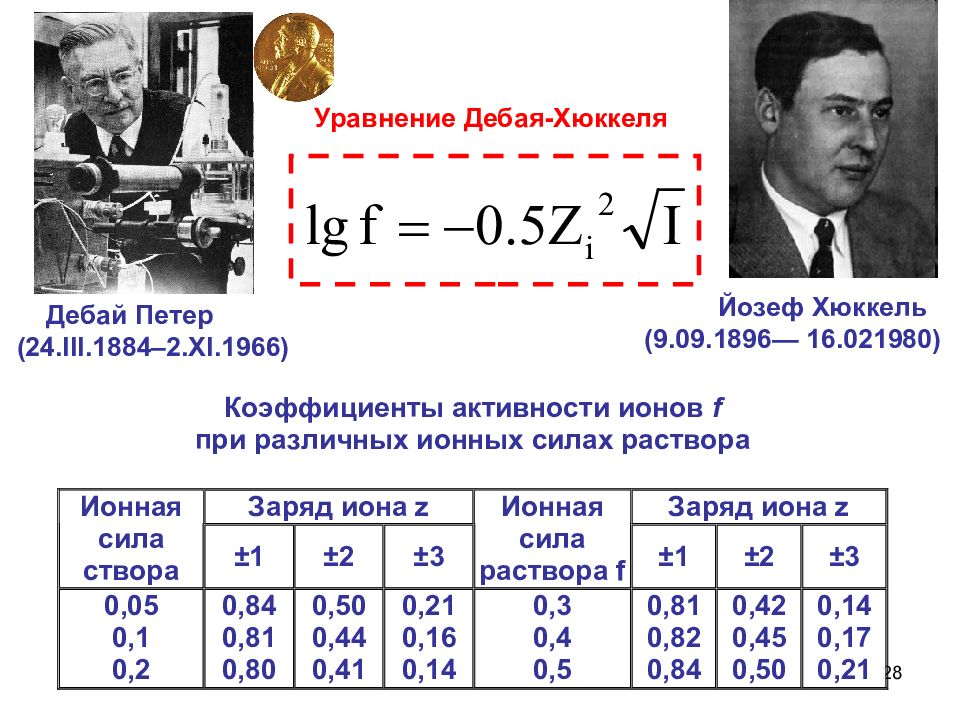
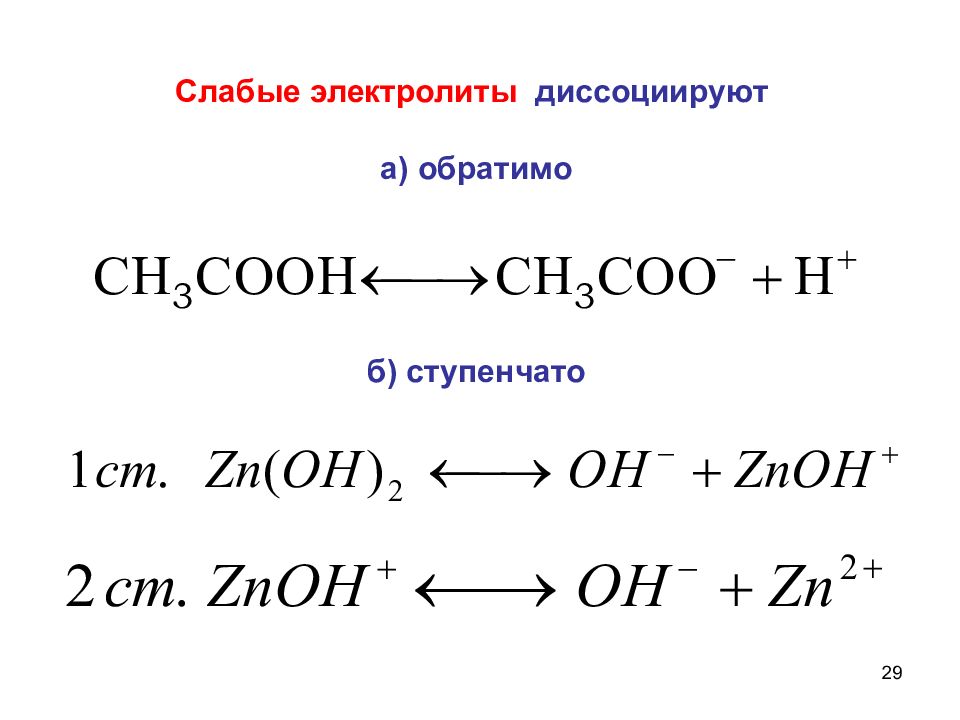
23 Сильные электролиты диссоциируют полностью, необратимо, в одну ступень. a – активность иона f – коэффициент активности, учитывающий межионное взаимодействие
Слайд 25
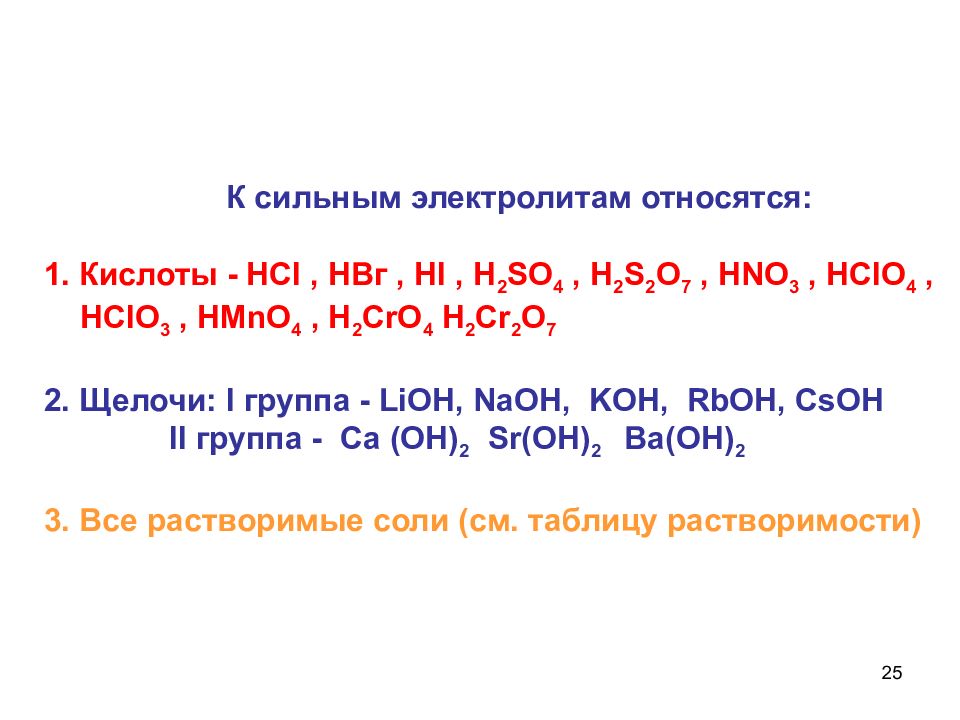
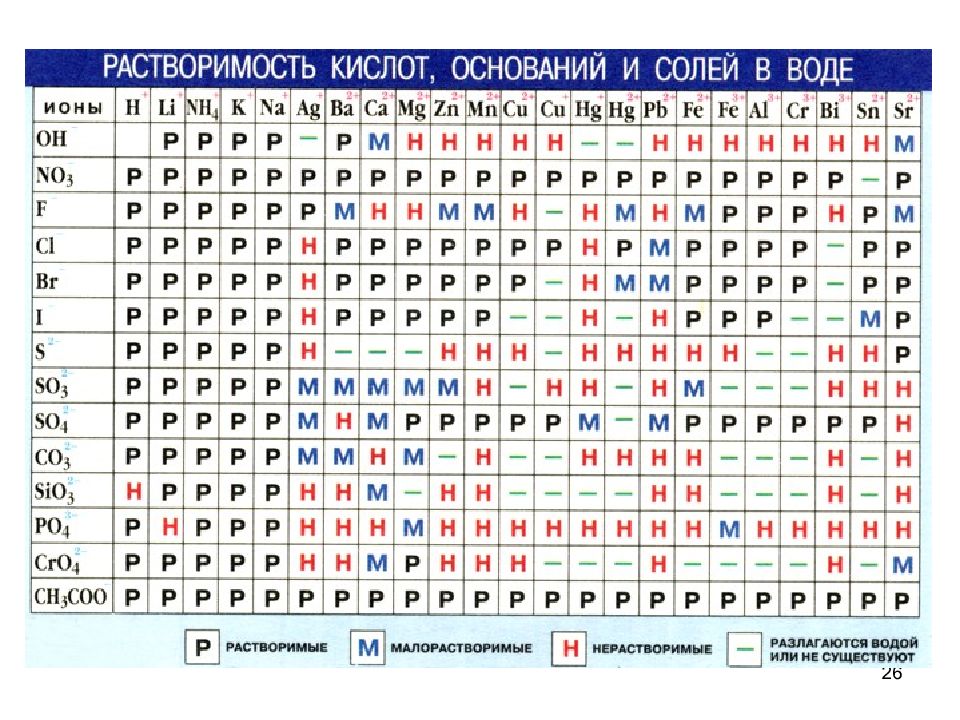
25 К сильным электролитам относятся: 1. Кислоты - НС I, НВг, HI, H 2 S О 4, H 2 S 2 O 7, HN О 3, HCI О 4, HCI О 3, H М n О 4, H 2 Cr О 4 H 2 Cr 2 О 7 2. Щелочи: I группа - LiOH, NaOH, KOH, RbOH, CsOH II группа - Ca ( OH ) 2 Sr ( OH ) 2 Ba ( OH ) 2 3. Все растворимые соли (см. таблицу растворимости)
Слайд 27
27 Ионная сила растворов Ионная сила растворов - величина, измеряемая полусуммой произведений концентраций всех находящихся в растворе ионов на квадрат их заряда (понятие введено Г. Льюисом ) Ионная сила – удобная характеристика раствора, учитывающая взаимодействие ионов, что важно для изучения биологических систем и физиологических растворов, ионная сила которых, в том числе и 0.9% (0.15м) NaCI равна, как правило, 0.15. Ионная сила характеризует общее число ионных зарядов в единице объема, независимо от их знаков. Размерность - обратна размерности объема.
Слайд 28
28 Уравнение Дебая-Хюккеля Дебай Петер (24.III.1884–2.XI.1966) Йозеф Хюккель (9.09.1896— 16.021980)
Слайд 30
30 Степень диссоциации (ионизации) - отношение числа молекул, распавшихся на ионы, к общему числу молекул в растворе. α зависит от: Природы вещества и растворителя; Концентрации; Температуры; Присутствия одноименного иона.
Слайд 31
31 Закон разведения Оствальда Нобелевская премия (1909г) « в знак признания работ по катализу, а также за исследования основных принципов управления химическим равновесием и скоростями реакций» (02.09.1853 – 4.06.1932) В 1887 г. – Лейпцигском университете создал первую в истории науки кафедру физической химии, где работали более 60 химиков многих стран: нобелевские лауреаты С. Аррениус, В. Нернст, У. Рамзай, Ф. Габер и русские ученые И. А. Каблуков, П. И. Вальден, Н. Д. Зелинский и другие. Ученики Оствальда говорили: "Стоит только поговорить с Оствальдом полчаса, и ты будешь иметь работу на полгода"
Слайд 33
33 2. Степень диссоциации кислоты HX равна 0,25. Какое суммарное число ионов H + и X - приходится в ее растворе на каждые 100 нераспавшихся молекул (ответ округлите до целого числа)? 1) 16 2) 33 3) 67 4) 85 1. На каждые 20 нераспавшихся молекул кислоты HX приходится 5 ионов H + и 5 ионов X -. Укажите степень диссоциации кислоты: 1) 0,05 2) 0,10 3) 0,15 4) 0,20
Слайд 34
34 Расчет рН в растворах сильных электролитах Рассчитать рН, рОН, [ OH - ] для 0,001 м Н NO 3 рН = 14 - рОН рОН = 14 - рН
Слайд 35
35 Задача 1. рН яблочного сока равен 4,57. Найти [Н + ] и [ OH - ] (моль/л). рОН = 14 - рН
Слайд 37
37 Расчет [ Н + ] и рН для растворов слабых электролитов Кислоты Смесь кислот
Слайд 39
39 Задача 2. Найти рН, [Н+] и [ OH -] 0,3 м раствора муравьиной кислоты (Кд=1.8 ∙10 -4 ) рН = – lg [ H + ] = – lg 7.3 ∙10 -3 = – lg 7.3 – lg 10 -3 = = 3 – lg 7.3=3-0.86 = 2.14
Слайд 40
40 Общая, активная и потенциальная кислотность Активная кислотность – концентрация свободных катионов Н +, имеющихся в растворе при данных условиях. Мерой активной кислотности является значение рН раствора: pH = -lg[H + ] Потенциальная кислотность – концентрация катионов Н+, связанных в молекулы или ионы слабых кислот, имеющихся в растворе. Сильные кислоты: [H + ] акт = [H + ] общ, [H + ] пот =0. Слабые кислоты: [H + ] общ = [H + ] пот + [H + ] акт [H + ] пот > > [H + ] акт