Первый слайд презентации: Решение задач на «долю выхода продукта реакции от теоретически возможного»
Слайд 2
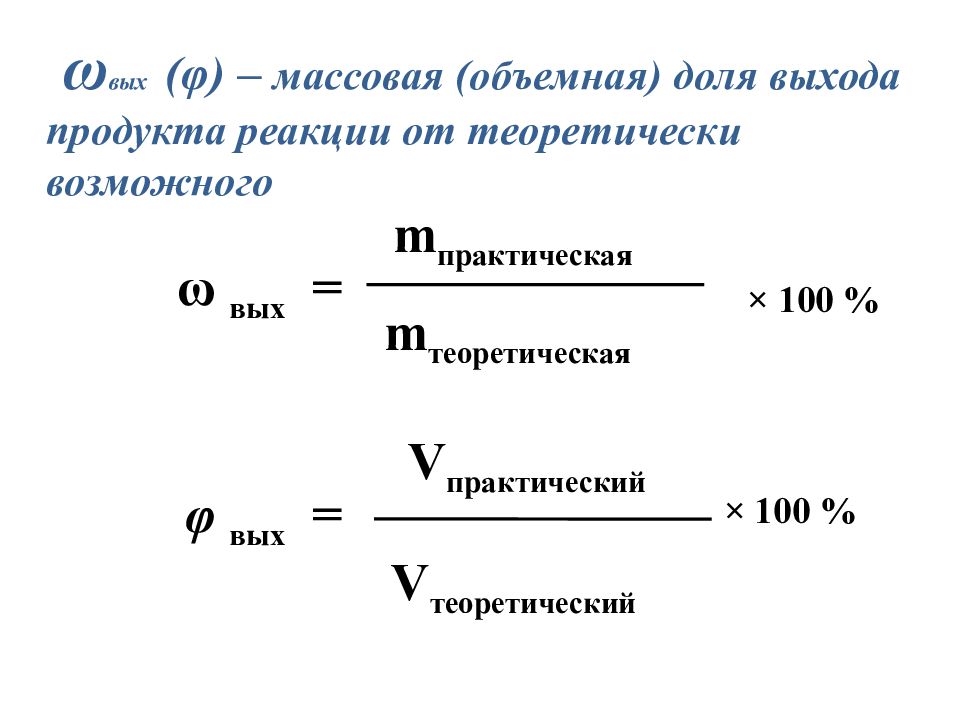
ω вых ( φ ) – массовая (объемная) доля выхода продукта реакции от теоретически возможного ω вых = m практическая m теоретическая φ вых = V практический V теоретический × 100 % × 100 %
Слайд 3
Три варианта задач: Даны массы исходного вещества и продукта реакции. Определить выход продукта реакции. Даны массы исходного вещества и выход продукта реакции. Определить массу продукта. Даны массы продукта и выход продукта. Определить массу исходного вещества.
Слайд 4
Дано: m( ZnO ) = 32,4 г m пр ( Zn) = 24 г Найти: ω вых ( Zn) - ? Решение: 3 ZnO + 2Al = 3Zn + Al 2 O 3 3 моль 3 моль Прочитаем задачу, запишем условие (дано, найти),составим уравнение реакции (поставим коэффициенты), подчеркнем, что дано в задаче, что нужно найти, под подчеркнутыми веществами запишем их количество вещества по уравнению (моль) При действии алюминия на оксид цинка массой 32,4г получили 24 г цинка. Найдите массовую долю выхода продукта реакции.
Слайд 5
Дано: m( ZnO ) = 32,4 г m пр ( Zn) = 24 г Найти: ω вых ( Zn) - ? М( ZnO )=81г/моль Решение: 0,4 моль х 3 ZnO + 2Al = 3Zn + Al 2 O 3 3 моль 3 моль Найдем количество вещества ZnO по формуле: = m /М. Подпишем его количество вещества над ним в уравнении. Над Zn подпишем х. Найдем х составив и решив пропорцию. ( Zn О)=32,4/81 = 0,4 моль 0,4/3 = х /3 х = 0,4 моль – это теоретическое количество вещества найденное по уравнению
Слайд 6
Дано: m( ZnO ) = 32,4 г m пр ( Zn) = 24 г Найти: ω вых ( Zn) - ? М( ZnO )=81г/моль М( Zn )=65 г/моль Решение: 0,4 моль х 3 ZnO + 2Al = 3Zn + Al 2 O 3 3 моль 3 моль Переведем полученное количество вещества Zn в массу по формуле: m = M m(Zn) =0,4 моль × 65 г/моль = 26 г – это теоретическая масса Zn. В задаче в условии дана практическая масса 24 г. Теперь найдем долю выхода продукта от теоретического возможного. ω вых = = = 0, 92 ( или 92%) m пр ( Zn) m теор ( Zn) 24 г 26 г Ответ: ω вых = 92 %
Слайд 7
Дано: m (Al(OH) 3 )= 23,4 г ω вых (Al 2 O 3 ) = 92% Найти: m пр ( Al 2 O 3 ) - ? М( Al(OH) 3 )= 78 г/моль Решение: 0,3 моль х 2Al(OH) 3 = Al 2 O 3 +3H 2 O 2 моль 1 моль Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции составляет 92% от теоретически возможного. М( Al 2 O 3 ) = 102 г/моль ( Al(OH) 3 )= 23,4 г/78 г/моль = 0,3 моль 0,3/2 = х /1 х = 0,15 моль m теор. ( Al 2 O 3 ) = n M = 0,15 моль 102 г/моль = 15,3 г m пр. (Al 2 O 3 ) = 15,3 г× 0,92 = 14 г Ответ: m пр. (Al 2 O 3 ) = 14 г
Слайд 8
При действии оксида углерода (II ) на оксид железа (III ) получено железо массой 11,2 г. Найдите массу использованного оксида железа ( III ), учитывая, что доля выхода продуктов реакции составляет 80% от теоретически возможного. Дано: m пр ( Fe) = 11, 2 г ω вых ( Fe) = 80% Найти: M ( Fe 2 O 3 ) - ? Решение : Fe 2 O 3 + 3CO = 2Fe + 3CO 2 1 моль 2 моль m теор = = =14 г m пр ( Fe) ω вых ( Fe) 11,2 г 0, 8
Слайд 9
Дано: m пр ( Fe) = 11, 2 г ω вых ( Fe) = 80% Найти: m ( Fe 2 O 3 ) - ? M ( Fe) = 56 г/моль М ( Fe 2 O 3 ) =160 г/моль Решение : х 0,25 моль Fe 2 O 3 + 3CO = 2Fe + 3CO 2 1 моль 2 моль Найденную теоретическую массу железа переведем в количество вещества по формуле: = m /М ( ( Fe) = 14 г /56 г/моль = 0,25 моль Напишем это количество железа над ним в уравнении, над оксидом напишем х. Решим пропорцию: х /1 = 0,25/2, х = 0,125 моль Теперь переведем в массу по формуле: m = ×М m ( Fe 2 O 3 ) = 0,125 моль × 160 г/моль = 20 г Ответ: m ( Fe 2 O 3 ) = 20 г
Последний слайд презентации: Решение задач на «долю выхода продукта реакции от теоретически возможного»
Задачи для самостоятельного решения Для получения осадка сульфата бария была взята серная кислота массой 490 г. Массовая доля выхода соли от теоретически возможного составила 60 %. Какова масса полученного сульфата бария? Вычислить выход нитрата аммония в % от теоретически возможного, если при пропускании 85 г аммиака через раствор азотной кислоты, было получено 380 г соли В результате каталитического окисления оксида серы (IV) массой 16 кг избытком кислорода образуется оксид серы (VI). Вычислите массу продукта реакции, если доля его выхода 80% от теоретически возможного. Вычислите массу азотной кислоты, которую можно получить из 17 г нитрата натрия при его взаимодействии с концентрированной серной кислотой, если массовая доля выхода кислоты составляет 0,96. На гашёную известь, взятую в необходимом количестве, подействовали 3,15 кг чистой азотной кислотой. Какую массу нитрата кальция получили, если практический выход в массовых долях составляет 0,98 или 98% по сравнению с теоретическим?